核酸-蛋白质互作
简述核酸和蛋白质代谢的相互关系

简述核酸和蛋白质代谢的相互关系全文共四篇示例,供读者参考第一篇示例:核酸是细胞内的一种重要有机物质,它由核苷酸构成,是构成核酸的基本单元。
核酸分为DNA(脱氧核糖核酸)和RNA(核糖核酸)两种。
核酸在细胞内具有非常重要的功能,它们可以携带遗传信息,参与蛋白质的合成,调控细胞的生长和分化等过程。
蛋白质则是细胞内最重要的有机物质之一,是生命体内各种生物学功能和生命活动不可或缺的组成部分。
蛋白质合成是一个复杂的生物化学过程,需要核酸的介入才能完成。
在细胞内,RNA起着传递DNA信息的作用,RNA通过转录过程将DNA上的遗传信息转换成RNA信息,然后RNA将这些信息传递给细胞内的核蛋白合成机器,进而合成蛋白质。
核酸代谢和蛋白质代谢是密切相关的,两者之间存在着相互关系。
在细胞内,核酸和蛋白质代谢之间的相互关系主要体现在以下几个方面:核酸还可以调控蛋白质的合成。
在细胞内,存在着一些特殊类型的RNA,如miRNA和siRNA等,它们能够通过靶向特定基因的mRNA,抑制或促进这些基因的表达,从而影响蛋白质的合成。
这种核酸介导的蛋白质合成调控,使得核酸和蛋白质代谢之间形成了一种复杂的调控网络。
核酸代谢和蛋白质代谢还存在着其他相互关系。
核酸可以通过调节细胞内mRNA的降解速率,影响蛋白质的合成水平;而蛋白质也可以参与核酸的合成和修复过程。
这些相互关系构成了细胞内核酸和蛋白质代谢的相互调节机制,维持了细胞内生物学功能的正常运行。
第二篇示例:核酸和蛋白质是生物体内两种重要的生物大分子,它们在生物体内的代谢过程中密不可分。
核酸是生物体内的遗传物质,负责信息的传递和储存,而蛋白质则是生物体内的最重要的功能分子,承担着多种生物过程中的功能。
核酸和蛋白质之间通过一系列生物化学反应相互转化,相互影响,共同维持着生物体内的代谢平衡和生物功能的正常进行。
核酸的合成过程称为核酸代谢,蛋白质的合成过程称为蛋白质代谢。
核酸和蛋白质的代谢密切相关,二者之间的相互关系主要体现在以下几个方面:核酸和蛋白质的合成过程相互依赖。
高一生物核酸蛋白质知识点

高一生物核酸蛋白质知识点核酸和蛋白质是生物体中非常重要的分子,承担着许多生命活动的重要功能。
在高一生物学的学习中,我们需要深入了解核酸和蛋白质的知识点,以便更好地理解生物的组成和功能。
本文将就核酸的结构和功能、蛋白质的结构和功能以及两者之间的关系进行探讨。
首先,让我们来了解核酸的结构和功能。
核酸是由核苷酸组成的大分子,包括DNA(脱氧核酸)和RNA(核糖核酸)两种类型。
DNA是生物体遗传信息的存储和传递载体,而RNA则参与遗传信息的转录和翻译过程。
DNA由两条互补的链以双螺旋结构存在,形成了双链DNA分子。
每条链由磷酸、核糖和碱基组成。
碱基包括腺嘌呤(A)、鸟嘌呤(G)、胸腺嘧啶(T)和胞嘧啶(C),它们之间通过氢键相互连接。
这种碱基的配对规则决定了DNA的遗传信息的稳定性。
除了DNA,RNA也是生物体中的重要分子。
RNA与DNA的区别在于,RNA中的胸腺嘧啶(T)被尿嘧啶(U)取代。
RNA的结构形式多样,包括信使RNA(mRNA)、转运RNA(tRNA)和核糖体RNA(rRNA)等。
mRNA通过转录过程将DNA上的遗传信息转移到蛋白质合成的位置;tRNA将氨基酸运送到核糖体,参与蛋白质合成的翻译过程;rRNA是核糖体的主要组成部分,起着结构和催化的作用。
接下来,让我们来了解蛋白质的结构和功能。
蛋白质是由氨基酸组成的聚合物,是生物体中最丰富的有机物质。
蛋白质参与了生物体的各种功能,包括结构、酶催化、免疫和运输等。
蛋白质的结构呈现出四个层次:一级结构是指由氨基酸组成的线性序列,二级结构是指蛋白质链的局部折叠,包括α-螺旋和β-折叠;三级结构是指整个蛋白质链的空间结构,由二级结构之间的相互作用所形成;四级结构是指由多个蛋白质亚基组成的复合物。
蛋白质的功能与其结构密切相关。
蛋白质的结构决定了其功能特性,例如酶的催化活性依赖于其特定的构象。
此外,蛋白质还可以通过与其他分子的结合来参与信号转导、运输物质和响应环境变化等功能。
电泳的原理的应用举例讲解

电泳的原理的应用举例讲解1. 什么是电泳?电泳是一种将带电粒子(通常是带电的蛋白质、DNA或RNA分子)在电场中移动的技术。
它基于粒子在电场中呈现电荷偏向性的原理。
2. 电泳的原理电泳的原理是基于电场对带电粒子的作用力和粒子的电荷量质量比的不同而产生的。
当电场施加在带电粒子上时,带电粒子会受到电场力的作用而在电泳溶液中运动。
带正电荷的粒子会移动到阴极,带负电荷的粒子会移动到阳极。
3. 电泳的应用举例3.1 蛋白质电泳蛋白质电泳是一种常见的蛋白质分离和分析方法。
它基于不同蛋白质在电场中移动速度的差异来分离不同的蛋白质。
蛋白质电泳广泛应用于生物医学研究、食品分析等领域。
应用举例:在食品分析中,蛋白质电泳可用于检测食品中的添加剂、致敏物质等。
通过分离和分析食品中的不同蛋白质,可以判断食品的质量和成分。
3.2 DNA电泳DNA电泳是一种常见的DNA分离和分析方法,它基于DNA分子的大小和电荷差异来进行分离和鉴定。
DNA电泳广泛应用于基因测序、DNA指纹鉴定等领域。
应用举例:在基因测序中,DNA电泳可用于检测DNA序列的长度和纯度,以确定基因序列的正确性。
3.3 RNA电泳RNA电泳是一种常见的RNA分析方法,它基于RNA分子的大小和电荷差异来进行分离和鉴定。
RNA电泳广泛应用于基因表达研究、疾病诊断等领域。
应用举例:在基因表达研究中,RNA电泳可用于分析不同组织或细胞中的RNA表达水平,以了解基因在不同组织中的表达差异。
3.4 蛋白质-核酸互作电泳蛋白质-核酸互作电泳是一种用于研究蛋白质和核酸相互作用的方法。
通过在电泳条件下观察蛋白质和核酸分子的运动,可以了解它们之间的相互作用。
应用举例:在疾病机制研究中,蛋白质-核酸互作电泳可用于检测病理过程中蛋白质和DNA/RNA之间的相互作用,从而揭示疾病的发生机制。
4. 总结电泳作为一种基于电场作用力的分离和分析技术,在生物医学研究、食品分析等领域中有着广泛的应用。
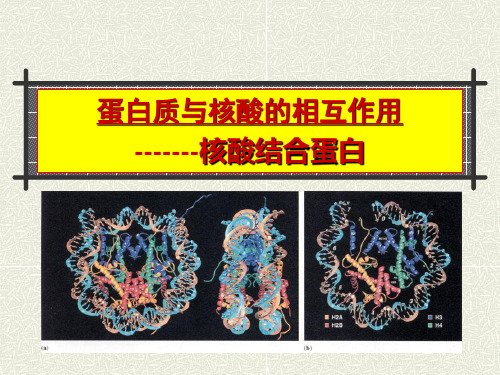
蛋白质与核酸的相互作用核酸结合蛋白模板
3.2.3 锌指结构的特点
Cys2His2锌 指蛋白与DNA 形成复合物的 X-射线晶体衍 射图谱。 三个锌指以 半环状排列于 DNA的大沟中。
3.2.3 锌指结构的特点
雌激素受体 (ER) DNA结 合结构域与 DNA识别因子 配位的同二聚 体。其中四个 圆代表二聚体 中的四个Zn 离子。
RNA结构的特点:胞内RNA一般呈单链结构,但往往 折叠成各种二级结构(突起、发夹、茎环等)。
RNA结合蛋白中的基本结构
结合结构 核糖核酸蛋白结 构域 dsRBD 结合部位 β-折叠 β-折叠 分布 真核生物 所有生物 举 例 U1A snRNP 果蝇的Staufen蛋白
K-同源蛋白
环区
真核生物
6.3 解读蛋白中的氨基酸
部分替换:用基因工程方法替换结构域中的某 些残基,研究其对与DNA结合的重要性。 结构分析:用X-射线、NMR方法研究发现,在 DNA和蛋白质结合过程中,蛋白质和DNA的构 象发生了适宜性的变化,水分子在蛋白和DNA 的相互作用中也发挥了特殊的作用。
6.4 假定的锌指蛋白DNA识别密码
目前还没有发现一套普遍的密码适用于所有的蛋白质 和氨基酸,但在锌指蛋白中发现了一个初步的规律。 锌指蛋白氨基酸残基与DNA碱基对应关系
3’
T A G
5’
与Zif268相关的锌指蛋白的部分DNA识别密码
三联体密码中碱基的位置
碱基
A C
5’
中部
3—Asn 3—Asn,Leu,Thr,Val
3’
-1—Gln+2--Ala
类固醇受体家 族 碱性结构域 带状-螺旋-螺旋 组蛋白-核心
α -螺旋
α -螺旋
真核生物
真核生物
核酸与蛋白质互作的生物化学解析

核酸与蛋白质互作的生物化学解析核酸与蛋白质互作是生物学领域中一个重要的研究课题。
核酸是DNA和RNA的总称,是生物体内保存遗传信息的重要分子。
而蛋白质则是构成细胞的主要成分,承担着多种生物学功能。
核酸与蛋白质之间的相互作用对于细胞的生长、分化、代谢等过程起着至关重要的调控作用。
本文将对核酸与蛋白质之间的互作进行生物化学解析。
一、核酸与蛋白质的结构特点核酸的结构主要由磷酸、五碳糖和碱基组成。
DNA的碱基包括腺嘌呤(A)、鸟嘌呤(G)、胸腺嘧啶(T)和胞嘧唑(C)四种。
RNA 的碱基包括腺嘌呤(A)、鸟嘌呤(G)、尿嘧啶(U)和胞嘧唑(C)四种。
蛋白质是由氨基酸通过肽键连接而成,具有复杂的三维结构。
蛋白质的功能主要取决于其特定的三维构象。
二、核酸与蛋白质的相互作用机制1. DNA与蛋白质的相互作用DNA和蛋白质之间的相互作用主要包括DNA结合蛋白、转录因子等。
DNA结合蛋白主要与DNA发生非特异性或特异性结合,参与DNA的复制、修复和重组等过程。
转录因子则在转录调控中发挥重要作用,通过与DNA特定序列结合,启动或抑制基因的转录。
2. RNA与蛋白质的相互作用RNA与蛋白质之间的相互作用主要包括RNA结合蛋白和RNA酶等。
RNA结合蛋白参与RNA的合成、修饰和稳定等过程,调控基因的表达水平。
RNA酶则参与RNA的降解过程,维持细胞内RNA的稳态。
三、核酸与蛋白质互作在生物学过程中的作用1. 转录调控核酸与蛋白质互作在转录调控中发挥重要作用。
转录因子与DNA特定序列结合,激活或抑制基因的转录,调控基因表达水平。
RNA结合蛋白则参与RNA的合成和修饰过程,影响基因的翻译和表达。
2. 蛋白质合成RNA酶参与RNA的降解过程,维持细胞内RNA的稳态。
蛋白合成依赖于RNA的翻译过程,RNA与核糖体、转运RNA等蛋白质协同作用,完成蛋白合成过程。
结语综上所述,核酸与蛋白质之间的互作在生物学过程中具有重要的生物化学意义。
核酸与蛋白质的相互作用与生命活动解析

核酸与蛋白质的相互作用与生命活动解析在生命的奥秘中,核酸与蛋白质的相互作用扮演着重要的角色。
核酸是生命的遗传物质,而蛋白质则是生命活动的执行者。
它们之间的相互作用不仅决定了生物的结构和功能,还参与了许多重要的生物过程,如DNA复制、转录和翻译等。
本文将从不同角度探讨核酸与蛋白质的相互作用对生命活动的影响。
首先,核酸与蛋白质的相互作用在生物体中起着重要的结构功能作用。
核酸分为DNA和RNA两种类型,DNA是遗传信息的存储库,而RNA则是信息的传递者和执行者。
蛋白质则是由氨基酸组成的多肽链,具有各种不同的结构和功能。
核酸与蛋白质之间的相互作用能够使蛋白质折叠成特定的结构,从而实现其特定的功能。
例如,DNA与蛋白质之间的相互作用可以形成染色体结构,使得DNA能够被紧密地包装在细胞核中,从而保护和维持遗传信息的稳定性。
其次,核酸与蛋白质的相互作用对基因表达和调控起着重要的作用。
基因表达是指遗传信息从DNA转录成RNA,再由RNA翻译成蛋白质的过程。
这一过程需要核酸与蛋白质之间的相互作用来协调和调控。
例如,转录因子是一类能够结合到DNA上的蛋白质,它们与DNA的结合能够启动或抑制基因的转录。
这种相互作用可以使细胞根据不同的环境信号和需求来调整基因的表达水平,从而适应不同的生理和生化过程。
此外,核酸与蛋白质的相互作用还参与了许多其他重要的生物过程。
例如,核酸酶是一类能够催化核酸的降解和合成反应的酶,它们与核酸的相互作用能够调控核酸的稳定性和代谢。
另外,核酸与蛋白质之间的相互作用还参与了细胞信号转导、免疫应答和细胞凋亡等重要的生物过程。
这些相互作用的失调往往会导致疾病的发生和发展,如癌症、遗传性疾病等。
最后,研究核酸与蛋白质的相互作用对于生命科学的发展具有重要意义。
通过研究核酸与蛋白质之间的相互作用,科学家们能够揭示生命活动的机制和规律,进而为疾病的治疗和预防提供理论依据。
例如,通过研究DNA与蛋白质的相互作用,科学家们可以开发出一些抗癌药物,从而有效地治疗癌症。
核酸-蛋白质互作的生物化学研究方法

核酸-蛋白质互作的生物化学研究方法
核酸-蛋白质互作是生物学中一个重要的研究领域,它涉及到核酸和蛋白质之间的相互作用,以及它们在生物体中的功能。
研究这种相互作用的生物化学方法有很多,其中最常用的是蛋白质结构分析、核酸结合实验、蛋白质-核酸相互作用实验和蛋白质-核酸相互作用的分子模拟。
蛋白质结构分析是研究核酸-蛋白质互作的重要方法,它可以帮助我们了解蛋白质的结构和功能,以及它们与核酸之间的相互作用。
通常,蛋白质结构分析可以通过X射线衍射、核磁共振成像和计算机模拟等技术来实现。
核酸结合实验是另一种研究核酸-蛋白质互作的重要方法,它可以帮助我们了解核酸与蛋白质之间的相互作用。
通常,核酸结合实验可以通过紫外光谱、荧光光谱和电泳等技术来实现。
蛋白质-核酸相互作用实验是研究核酸-蛋白质互作的重要方法,它可以帮助我们了解蛋白质与核酸之间的相互作用。
通常,蛋白质-核酸相互作用实验可以通过紫外光谱、荧光光谱、电泳和质谱等技术来实现。
最后,蛋白质-核酸相互作用的分子模拟是研究核酸-蛋白质互作的重要方法,它可以帮助我们了解蛋白质与核酸之间的相互作用。
通常,蛋白质-核酸相互作用的分子模拟可以通过分子动力学模拟、分子对接和分子模拟等技术来实现。
总之,蛋白质结构分析、核酸结合实验、蛋白质-核酸相互作用实验和蛋白质-核酸相互作用的分子模拟是研究核酸-蛋白质互作的重要生物化学方法。
这些方法可以帮助我们了解核酸和蛋白质之间的相互作用,以及它们在生物体中的功能。
生物化学中的核酸及蛋白质互作

生物化学中的核酸及蛋白质互作生物化学是研究生物体内分子结构、组成和功能的学科。
在生物化学中,核酸和蛋白质是两个重要的分子,它们在细胞内发挥着不可或缺的作用。
而核酸和蛋白质之间的互作更是生命活动的基础。
本文将探讨核酸和蛋白质在生物化学中的互作关系,以及它们在细胞内的功能和调控。
一、核酸的结构和功能核酸是生物体内的重要分子之一,包括DNA和RNA两种。
DNA是遗传信息的携带者,而RNA则参与基因表达和蛋白质合成等过程。
核酸的结构由碱基、糖和磷酸组成,其中碱基是核酸的核心部分,包括腺嘌呤、鸟嘌呤、胸腺嘧啶和尿嘧啶四种。
核酸通过碱基之间的氢键相互连接,形成双链结构(DNA)或单链结构(RNA)。
核酸在细胞内发挥着多种功能。
首先,DNA作为遗传物质,携带着细胞的遗传信息,并通过复制和遗传转录传递给后代细胞。
其次,RNA参与了蛋白质的合成过程。
在转录过程中,DNA的信息被转录成RNA,然后通过翻译过程将RNA编码的信息转化为蛋白质。
此外,RNA还参与了细胞内的多种调控过程,如RNA干扰和RNA修饰等。
二、蛋白质的结构和功能蛋白质是生物体内最为丰富的分子,它们在细胞内担任着多种功能。
蛋白质的结构由氨基酸组成,氨基酸通过肽键连接在一起,形成多肽链。
蛋白质的结构可以分为四个层次:一级结构是指氨基酸的线性排列顺序;二级结构是指氨基酸之间的氢键相互作用,形成α螺旋和β折叠等结构;三级结构是指蛋白质的立体空间结构,由各种非共价键相互作用所决定;四级结构是指由两个或多个多肽链相互作用而形成的复合物。
蛋白质在细胞内具有多种功能。
首先,蛋白质作为酶,在细胞内催化各种生化反应,如代谢、合成和降解等过程。
其次,蛋白质作为结构蛋白,参与细胞的结构组织和维持细胞的形态。
此外,蛋白质还参与了细胞信号传导、运输和免疫等重要生物过程。
三、核酸和蛋白质的互作关系核酸和蛋白质之间的互作是生物体内最为复杂和重要的分子互作之一。
在细胞内,核酸和蛋白质之间通过多种方式相互作用。
核酸和蛋白质结合形成的物质

核酸和蛋白质结合形成的物质说到核酸和蛋白质结合的东西,其实它们之间有着不为人知的默契。
这两个“明星”成分就像好基友,虽然性格截然不同,却能在生物体内巧妙地配合,共同完成一系列重要的任务。
你要是认真听听它们的“故事”,就知道它们真的是一种“天作之合”。
先别急,先给大家科普一下什么是核酸,什么是蛋白质吧。
核酸,简单来说,就是我们体内的一种“信息载体”。
想象一下,它就像是一本包含了无数篇章节的“食谱”,里面记载着我们的细胞应该怎么做、做什么、怎么做的所有信息。
而蛋白质呢,就像是厨师,负责按照这些食谱的指示,把原料做成一道道美味的“菜肴”。
但你要知道,这两个家伙可不是随便谁都能在一起的哦。
它们的结合,需要有一个特殊的“密码”。
好了,话说回来,核酸和蛋白质是怎么结合的呢?其实它们的结合形成的物质,叫做“核蛋白”。
这个“核蛋白”可以说是生命体中的一项“高级工艺”。
比如我们的DNA,它是一种长长的链条,里面有着超多的遗传信息。
而蛋白质就像是那些拿着工具的工人,负责根据DNA的指示去做一些特定的工作。
比如细胞分裂、代谢等一系列大事都离不开它们的配合。
你想啊,如果没有核酸的指挥,没有蛋白质的执行,那我们身体里面的每个细胞都不知道该做什么,简直是乱成一团。
咱们就拿细胞核里的“核蛋白”来说吧,这玩意儿对细胞的健康可重要了。
它其实是一些蛋白质和DNA结合形成的复合体,可以帮助DNA保持稳定,避免它被外界的恶劣环境给破坏了。
它还会帮助DNA在细胞分裂时顺利地进行复制。
就像是一个建筑工地上的工头,既要负责安排工作,还得保证工人们用的工具齐全。
真是不得了,居然能够做到如此精细的调配。
你说,它是不是很神奇?更有意思的是,这些“核蛋白”不仅仅是简单地“搬运工”,它们还在基因表达和调控中扮演着重要角色。
有些核蛋白在特定的时候,像是换了个人一样,能调节基因的开启与关闭。
你想象一下,假如你有个开关控制灯的“遥控器”,这玩意儿能根据你的指令让灯亮起来,也能让它熄灭,还是非常给力的对吧?这些核蛋白就是通过类似的“开关”操作,来控制哪些基因该被激活,哪些该被抑制。
蛋白质相互作用预测方法的研究

蛋白质相互作用预测方法的研究蛋白质相互作用预测是生物信息学领域的重要问题之一。
蛋白质之间的相互作用在生物体内发挥着至关重要的作用,与许多疾病的发生和发展密切相关。
因此,预测蛋白质之间的相互作用对于理解生物过程和药物研发具有重要意义。
本文将介绍常用的蛋白质相互作用预测方法及其优缺点,并讨论未来的研究方向和展望。
蛋白质是生命活动的基本单位,其相互作用在细胞信号转导、代谢调节和疾病发生等方面起着至关重要的作用。
因此,预测蛋白质之间的相互作用对于理解生物过程和疾病治疗具有重要意义。
随着生物技术的发展,蛋白质相互作用预测方法已经成为生物信息学领域的研究热点之一。
该方法主要是利用基因组学和进化学分馏技术,寻找与目标蛋白质相互作用的蛋白质。
具体实现过程包括以下几个步骤:通过基因组学方法确定目标蛋白质的基因序列;利用进化学分馏技术对该基因序列进行分馏,得到进化树;根据进化树上的信息,确定与目标蛋白质相互作用的蛋白质。
该方法的优点是可以找到与目标蛋白质相互作用的潜在蛋白质,缺点是需要大量的计算资源和时间。
该方法主要是通过分析蛋白质的相互作用口袋,预测不同蛋白质之间的相互作用。
相互作用口袋是指蛋白质在相互作用时暴露出来的疏水性氨基酸口袋,可以通过计算蛋白质表面氨基酸的亲/疏水性比值和溶剂可及性来进行预测。
该方法的优点是可以较为准确地预测蛋白质之间的相互作用,缺点是需要手动设定口袋特征和机器学习模型,且对于未知蛋白质之间的相互作用难以预测。
为了评估上述两种预测方法的准确性和可靠性,我们采用已知的蛋白质相互作用数据集进行实验。
实验结果表明,基于相互作用口袋的分析方法相比基于基因组学的方法具有更高的预测准确性和可靠性。
具体来说,基于相互作用口袋的分析方法对于已知蛋白质相互作用的预测准确率可以达到70%,而基于基因组学的预测方法准确率仅为40%。
本文介绍了常用的蛋白质相互作用预测方法及其优缺点,并对其准确性和可靠性进行了实验评估。
蛋白质与核酸相互作用的试验方法学研究

以上技术都有一定的局限性 不足以充分反映生理条件下,DNA与蛋白质相互作用的真实情 况。 因为,高等生物的基因组有染色质结构, 用以上所提到的方法分析得到的某段DNA与蛋白质,在生理状 态下, 这段DNA很可能并不与其相对应的因子相结合。 另外,染色质结构本身是动态的,DNA与非组蛋白在生理状态 下的相互作用通常是瞬时的, 以上方法难以捕捉到发生在染色质上的基因表达调控的瞬时事 件
八、染色体免疫沉淀技术
Chromatin immunoprecipitation (ChIp)
1.技术介绍 在生理状态下把细胞内的DNA与蛋白质交联在一 起,超声波将染色质打碎后,用所要研究的目的 蛋白特异性的抗体沉淀这种交联复合体。只有与 目的蛋白结合的DNA片段才能够被沉淀下来
2、主要步骤及内容
2.超声波断裂染色质 甲醛交联后的染色质对限制酶和 DnaseI高度抵抗, 因此通常使用超声波使得染色质断裂。 打断后的染色质片段的平均长度应该 在500-1000bp左右。 (可以用琼脂糖凝胶电泳来鉴定)
3.氯化铯等密度离心纯化交联的染色质 氯化铯等密度离心可以除去未交联的蛋白质、 DNA和RNA样品中加入0.5%的十二烷基肌氨酸钠, 通常在4000rpm离心72h。 4000rpm 72h 离心后,用连接到蠕动泵的0.25mm毛细管从梯度 的底部分步收集染色质组分,在4℃透析过夜。
凝胶阻滞试验不仅可以用来鉴定在特殊类 型细胞的提取物中,是否存在着能够同某 一特定DNA片段结合的蛋白质分子(比如特 异的转录因子等),而且还可以用来研究发 生此种结合作用之精确的DNA序列的特异 性
超量的非标记的竞争DNA (competitor DNA )
材料及试剂: 2X结合缓冲液: 20 mM Tris pH 7.5 、100 mM NaCl、2 mM EDTA、10% 甘油、 poly(dI-dC) (5 mg/ml in TE)、 BSA (10 mg/ml)、 P32-标记探针 缓冲液C: 20 mM HEPES pH 7.9、25% glycerol、420 mM NaCl、1.5 mM MgCl2、 0.5 mM 二硫苏糖醇、0.5 mM 苯甲基磺酰氟化物、0.2 mM EDTA 4%天然的聚丙烯酰胺凝胶(50 ml):5 ml 40% 丙烯酰胺 (30:1)、2.5 ml 5X 四溴乙烷, 41.95 ml H20、0.5 ml 10% APS(过硫酸铵)、50 ml 四甲基乙二胺、0.25X 四溴 烷电泳缓冲夜。 填充染料: 0.2% 溴酚蓝、0.2%二甲本蓝、50% 甘油 操作步骤: 1.配置反应混合液:探针DNA (1 ng/ml) 0.1ml、 dH20 6.3 ml、2x 结合缓冲液 12.5 ml、BSA (10 mg/ml) 1.0 ml 、 poly(dI-dC) (5 mg/ml) 0.1ml、 2.在细胞提取物中加入缓冲液C至5 ml。 3.加10~15 mg上述溶液(£ 5 ml)到反应混合物中,总体积应不大于25 ml。 4.在室温下培养20min。 5.加入2.5 ml的填充染料。 6.装载样品到4%的聚丙烯酰胺凝胶柱中。 7.室温下跑电泳2.5h,至溴酚蓝距底部1cm处停止。 8.80℃下干燥凝胶,进行放射自显影处理。
蛋白质与核酸的相互作用核酸结合蛋白模板

3.5 通过β链识别的蛋白
DNA识别 区域是由 1-2个β链 折叠结构 组成,它 们可以进 入DNA大 沟。
四、蛋白质中RNA结合motif
RNP(核糖核蛋白)结构域:
有两个保守motif-RNP1和RNP2,均为一
个大结构的一部分,β-α-β-β-α-β,其中motif
位于中心的一个β折叠处。通常与SnRNA结合,
3.2 半胱氨酸-组氨酸锌指
3.2.1 Cys2-His2锌指组件
锌指结构(Zinc finger) 是第一个被发现的真核细 胞中与DNA结合的蛋白质, 在真核基因组中广泛存在, 其约占基因组的0.5%, 在原核生物中虽有发现, 但相对较少。目前已发现 有六种类型,其经典结构 如右图。
3.2.2 常见的锌指结构三种类型
7.1 同蛋白质结合的核酸序列研究 7.1.1 凝胶阻滞分析:
原理:蛋白质可以与末端标记的核酸探针结合,电 泳时这种DNA/RNA蛋白质复合物比裸露的DNA或 RNA电泳迁移慢, 即表现为相对滞后。 用途: 鉴定和了解与蛋白质结合的DNA或RNA位点;
说明: 将蛋白质与标记的DNA或RNA保温或不保温, 电泳后比较迁移率。再用过量的特殊序列的寡聚核 苷酸替代试验, 以确定特殊序列与蛋白质结合位点。
研究表明:碱性结合结构域中,与DNA结合识
别的α螺旋可能是与DNA结合的结果。
如酵母bZIP蛋白的碱性结构域, 在溶液中为一
种无序的部分螺旋的结构; 当其同DNA结合时, 这种构象发生了变化,诱导了典型的α螺旋形 成。
3.4 类组蛋白结构motif
真核细胞的DNA分子,通过与组蛋白的作用, 将组蛋白包裹成核小体。每个核小体中含有两 个负超螺旋的DNA结构,与组蛋白相结合。
蛋白质与核酸的相互作用核酸结合蛋白模板

RNA结合蛋白中的基本结构
结合结构 核糖核酸蛋白结 构域 dsRBD 结合部位 β-折叠 β-折叠 分布 真核生物 所有生物 举 例 U1A snRNP 果蝇的Staufen蛋白
K-同源蛋白
环区
真核生物
3.2 半胱氨酸-组氨酸锌指
3.2.1 Cys2-His2锌指组件
锌指结构(Zinc finger) 是第一个被发现的真核细 胞中与DNA结合的蛋白质, 在真核基因组中广泛存在, 其约占基因组的0.5%, 在原核生物中虽有发现, 但相对较少。目前已发现 有六种类型,其经典结构 如右图。
3.2.2 常见的锌指结构三种类型
G
T
6—Arg;6– Ser, Thr+2--Asp
6—Ser,Thr + 2-Asp
3—His
3—Ala,Ser,Val;-1-Asn
-1—Arg+2—Asp
-1—Gln + 2--Ser
6.5 序列特异性RNA识别
由于RNA种类繁多、结构多样,目前还没有总结识别的规律。
七、蛋白质核酸相互作用的研究技术
SnRNA的一个发夹结构和蛋白的motif富含负
电荷残基结合。
四、蛋白质中RNA结合motif
双链RNA结合结构域(dsRBD):
是一个短的(约65Aa)组件,存在于果蝇 Staufen、大肠杆菌RNaseIII等蛋白质中。形成 β-α-β-α-β结构,但与双链RNA结合位点位于第
二个α螺旋和β折叠形成的裂缝中。
6.3 解读蛋白中的氨基酸
部分替换:用基因工程方法替换结构域中的某 些残基,研究其对与DNA结合的重要性。 结构分析:用X-射线、NMR方法研究发现,在 DNA和蛋白质结合过程中,蛋白质和DNA的构 象发生了适宜性的变化,水分子在蛋白和DNA 的相互作用中也发挥了特殊的作用。
蛋白质的互作和相互识别机制研究和应用

蛋白质的互作和相互识别机制研究和应用蛋白质是细胞中最基本的生物大分子之一,具有多种生物功能,包括酶作用、信号转导和结构支撑等。
在此基础上,研究蛋白质的互作和相互识别机制以及其应用已经成为当今生物学研究中的热门领域之一。
一、蛋白质互作的研究蛋白质互作是指两个或多个蛋白质分子在一个细胞环境中相互调控的过程。
在生物体内,蛋白质之间的互作可以实现信息传递、代谢调节、基因表达和细胞信号传导等生物功能的实现。
因此,研究蛋白质互作机制,可以揭示细胞内信号传导的细节过程,提高对某些疾病的理解。
目前,研究人员主要通过蛋白质-蛋白质相互作用、蛋白质-核酸相互作用、蛋白质-小分子相互作用等多种手段对蛋白质的互作与调控进行研究。
同时,新一代高通量技术如质谱、蛋白质芯片、蛋白质结构组学等技术的应用,也广泛地促进了蛋白质互作的研究。
二、蛋白质互作的相互识别机制研究蛋白质互作的相互识别机制是指蛋白质分子之间为相互作用而进行特异和高效的识别过程。
蛋白质分子相互识别的能力,是蛋白质相互作用和调控的关键。
该过程可通过理论模拟、结构构象分析、亲和力分析等多种实验方法进行研究。
其中,关键的挑战之一是如何描述和预测蛋白质-蛋白质和蛋白质-小分子之间的相互作用。
近年来,越来越多的研究发现,蛋白质混合酶、巨大的蛋白质复合体等高密度大分子的互作可以通过这种方式获得更深入的认识。
例如,分子动力学模拟可以描述长时间尺度上蛋白结构的改变,包括柔性和非平衡动力学效应。
同时,分子动力学模拟也可以揭示蛋白质的相互识别机制,且有助于发现新的酶抑制剂和药物。
三、蛋白质相互识别机制的应用蛋白质的相互识别在药物研发中具有重要意义。
虽然小分子药物仍然是现代药物领域的主流,但仍然存在它们不足之处。
通过设计和合成高特异性蛋白质相互作用的小分子药物,可以获得更大的生物活性和更强的药效,同时还可以降低药物毒副作用和解决耐药问题。
此外,蛋白质相互作用的调控也被广泛用于生产特定的蛋白质和酶的生物过程工业化生产,从而实现大规模生产高附加值产品的目的。
核酸蛋白共起源

核酸蛋白共起源
核酸和蛋白质是生物体中最重要的两种生物分子,也是最早出现的生
物分子之一。
核酸是由核苷酸组成的生物大分子,包括DNA和RNA两种。
而蛋白质则是由氨基酸组成的生物大分子,是生物体内的重要代谢产物。
核酸和蛋白质在生物体内起着非常重要的作用,两者之间存在着密切
的联系。
首先,在生物体内,DNA作为遗传信息的载体,经过转录和翻译
的过程,可以生成RNA和蛋白质,这被称为中心 dogma。
其次,在生物体内,一些蛋白质还可以作为转录因子和翻译因子,参与到DNA和RNA的合
成和翻译过程中,发挥重要作用。
同时,一些RNA也可以参与到蛋白质的
合成中,发挥着调控基因表达的作用。
因此,可以说,核酸和蛋白质是共同起源于生物体的两种生物大分子,它们之间存在着密切的联系和相互作用,共同构成了生物体内的复杂生命
机制。
核酸-蛋白质互作

核酸-蛋⽩质互作核酸-蛋⽩质互作的⽣物化学研究⽅法张⾦璧, 潘增祥, 林飞, 马雪⼭, 刘红林南京农业⼤学动物科技学院, 南京210095摘要:研究核酸-蛋⽩质的互作是揭⽰⽣命活动机理的基础, ⽂章简要综述了⽤于研究核酸-蛋⽩质互作的各种⽣物化学⽅法。
从体内、体外两个研究⾓度, 针对核酸、蛋⽩以及复合物3个研究⽔平, 概述了硝化纤维膜过滤实验、⾜迹法、EMSA、Southwestern杂交等经典分析⽅法的原理、发展和运⽤。
还着重介绍了最近在表观遗传学领域中⼴泛运⽤的nChIP、xChIP等基本染⾊质免疫沉淀(ChIP)技术及其衍⽣出的ChIP-on-chip等⽅法。
关键词: 核酸; 蛋⽩质; 互作; ⾜迹; 染⾊质免疫沉淀Biochemical methods for the analysis of DNA-protein interactionsZHANG Jin-Bi, PAN Zeng-Xiang, LIN Fei, MA Xue-Shan, LIU Hong-LinCollege of animal science and technology, Nanjing Agricultural University, Nanjing 210095, ChinaAbstract: Investigation of DNA-protein interactions is fundamental to understand the mechanism underlying a variety of life processes. In this article, various types of biochemical methods inDNA-protein interaction study in vivo and in vitro at the level of DNA, protein, and the complex, respectively were briefly reviewed. Traditional assays including Nitrocellulose filter-binding assay, Footprinting, EMSA, and Southwestern blotting were summarized. In addition, chromatin immunoprecipitation techniques including nChIP, xChIP, and ChIP-on-chip, which were widely usedin epigenetics, were particularly introduced.Keywords: nucleic acid; protein; interaction; footprinting; chromatin immunoprecipitation (ChIP) 核酸-蛋⽩的互作在⽣命活动中发挥着⼴泛⽽重要的作⽤, ⼆者的协作是各种⽣命现象的基础。
蛋白质核酸相互作用

Extract
–++
Competitor – – +
–+ + –– +
–+ + –– +
–+ + –– +
EBNA
Oct-1
AP1
图 2 . 四 种不同 D N A - 蛋白质 复合 物 的 化 学发 光 E M S A 。复合 物是 使 用 2 0 fmol生物素标记的DNA双链(每条链标记1个生物素)和2μL(6.8μg)NEPER核提取物(来自HeLa细胞)。在含有特定竞品DNA的反应中,使用超过 200倍(摩尔量)未标记特异性双链。
抑制剂成分
AEBSF·HCl 抑肽酶 乌苯美司 E-64 亮肽素 胃蛋白酶抑制剂 EDTA* 氟化钠 原钒酸钠 β-甘油磷酸盐 焦磷酸钠 * 无EDTA配方中不含EDTA
靶点(机制)
丝氨酸蛋白酶(不可逆) 丝氨酸蛋白酶(可逆) 氨肽酶(可逆) 半胱氨酸(不可逆) 丝氨酸与半胱氨酸蛋白酶 (可逆) 天冬氨酸蛋白酶 (可逆) 金属蛋白酶(可逆) 丝氨酸/苏氨酸以及酸性磷酸酶 酪氨酸以及碱性磷酸酶 丝氨酸/苏氨酸磷酸酶 丝氨酸/苏氨酸磷酸酶
Halt系列蛋白酶、磷酸酶以及蛋白酶和磷酸酶抑制剂混合物 是即用型100X浓度的溶液。这种溶液方便易用,仅需用移液 器向裂解液或样品中加入合适体积的抑制剂即可避免蛋白 降解,并且每种配方都有四种包装规格供选择,分别为:24 X100uL、1mL、5mL和10mL。
Pierce系列蛋白酶、磷酸酶以及蛋白酶和磷酸酶复合型抑制 剂片剂,采用棕色瓶装,可快速溶解为澄清溶液,能够完全 兼容所有Thermo ScientificTM Pierce蛋白质定量试剂。每片
蛋白质和核酸、蛋白质和蛋白质相互作用的方法介绍

蛋白质和核酸、蛋白质和蛋白质相互作用的方法介绍蛋白质和核酸、蛋白质和蛋白质相互作用的方法介绍蛋白质和核酸是组成生命的主要生物大分子,研究蛋白质和核酸的相互作用、蛋白质和蛋白质的相互作用是后基因组时代重要的研究领域之一。
目前,研究蛋白质和核酸、蛋白质和蛋白质相互作用的方法很多,今天,小编帮您来梳理下。
一、凝胶电泳迁移率(EMSA)凝胶迁移或电泳迁移率检测(Electrophoretic Mobility Shift Assay,EMSA)是一种检测蛋白质和DNA序列相互结合的技术,可用于定性和定量分析。
目前已用于研究RNA结合蛋白和特定的RNA 序列的相互作用,是转录因子研究的经典方法。
EMSA可检测DNA结合蛋白、RNA结合蛋白、特定的蛋白质,并可进行未知蛋白的鉴定。
二、染色质免疫沉淀(ChIP)染色质免疫沉淀技术(Chromatin immunoprecipitation assay, ChIP)是将样品中同抗体靶蛋白相互作用的DNA随免疫复合物沉淀,是研究体内蛋白质与DNA相互作用的有力工具,利用该技术不仅可以检测体内反式因子与DNA的动态作用,还可以用来研究组蛋白的各种共价修饰以及转录因子与基因表达的关系。
三、RNA Pull Down / DNA Pull Down蛋白质与RNA的相互作用是许多细胞功能的核心,如蛋白质合成、mRNA组装、病毒复制、细胞发育调控等。
RNA Pull Down使用体外转录法标记生物素RNA探针,然后与胞浆蛋白提取液孵育,形成RNA-蛋白质复合物。
该复合物可与链霉亲和素标记的磁珠结合,从而与孵育液中的其他成分分离。
复合物洗脱后,通过western blot实验检测特定的RNA结合蛋白是否与RNA相互作用。
四、RIPRIP 技术(RNA Binding Protein Immunoprecipitation Assay,RNA 结合蛋白免疫沉淀)主要是运用针对目标蛋白的抗体把相应的RNA-蛋白复合物沉淀下来,经过分离纯化就可以对结合在复合物上的RNA 进行q-PCR验证或者测序分析。
蛋白互作场所

蛋白互作场所蛋白互作场所是指蛋白质之间进行相互作用和相互影响的环境,是蛋白质结构与功能之间的重要联系。
蛋白质的互作场所可以是细胞内的特定结构或亚细胞器,也可以是蛋白质与其他分子之间的相互作用。
在这些互作场所中,蛋白质之间的相互作用可以通过多种方式进行,例如蛋白质-蛋白质相互作用、蛋白质-核酸相互作用、蛋白质-小分子相互作用等。
蛋白质-蛋白质相互作用是蛋白质互作的重要方式之一。
蛋白质之间可以通过结构域相互结合,形成稳定的复合物。
例如,信号转导通路中的蛋白质会通过相互作用形成蛋白质复合物,促进信号传递和细胞功能的调控。
另外,蛋白质之间还可以通过疏水相互作用、静电相互作用、氢键等方式进行相互作用,从而调控蛋白质的结构和功能。
蛋白质-核酸相互作用也是蛋白质互作的常见方式之一。
在细胞内,蛋白质与DNA或RNA之间可以通过直接结合或间接相互作用来调控基因表达和转录过程。
例如,转录因子能够与DNA结合,识别特定的核酸序列并激活或抑制基因的转录。
此外,其他一些蛋白质也可以与RNA相互作用,参与RNA的修饰、加工和运输等过程。
蛋白质-小分子相互作用是蛋白质互作的另一重要方式。
细胞内存在大量的小分子,可以与蛋白质进行非特异性或特异性的相互作用。
例如,药物与蛋白质之间的相互作用可以调节药物的活性和药物代谢过程。
此外,某些小分子还可以调控蛋白质的折叠和稳定性,影响蛋白质的功能发挥。
除了以上的蛋白质互作方式,蛋白质互作还可以与其他生物分子进行相互作用。
例如,细胞内的糖类与蛋白质之间可以通过糖蛋白相互作用来调节细胞信号传递和细胞表面的识别。
此外,蛋白质还可以通过与细胞膜脂质相互作用,参与细胞的黏附、迁移和信号传导等过程。
蛋白互作场所的研究对于揭示蛋白质的结构和功能具有重要意义。
通过了解蛋白质之间的相互作用,可以深入理解蛋白质的结构与功能的关系,并为疾病的发生和治疗提供重要的依据。
近年来,借助高通量技术和系统生物学方法,已经取得了大量有关蛋白质互作场所的研究成果,为进一步揭示蛋白质功能和相关疾病的机制提供了新的思路和方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
核酸-蛋白质互作的生物化学研究方法张金璧, 潘增祥, 林飞, 马雪山, 刘红林南京农业大学动物科技学院, 南京210095摘要:研究核酸-蛋白质的互作是揭示生命活动机理的基础, 文章简要综述了用于研究核酸-蛋白质互作的各种生物化学方法。
从体内、体外两个研究角度, 针对核酸、蛋白以及复合物3个研究水平, 概述了硝化纤维膜过滤实验、足迹法、EMSA、Southwestern杂交等经典分析方法的原理、发展和运用。
还着重介绍了最近在表观遗传学领域中广泛运用的nChIP、xChIP等基本染色质免疫沉淀(ChIP)技术及其衍生出的ChIP-on-chip等方法。
关键词: 核酸; 蛋白质; 互作; 足迹; 染色质免疫沉淀Biochemical methods for the analysis of DNA-protein interactionsZHANG Jin-Bi, PAN Zeng-Xiang, LIN Fei, MA Xue-Shan, LIU Hong-LinCollege of animal science and technology, Nanjing Agricultural University, Nanjing 210095, ChinaAbstract: Investigation of DNA-protein interactions is fundamental to understand the mechanism underlying a variety of life processes. In this article, various types of biochemical methods inDNA-protein interaction study in vivo and in vitro at the level of DNA, protein, and the complex, respectively were briefly reviewed. Traditional assays including Nitrocellulose filter-binding assay, Footprinting, EMSA, and Southwestern blotting were summarized. In addition, chromatin immunoprecipitation techniques including nChIP, xChIP, and ChIP-on-chip, which were widely usedin epigenetics, were particularly introduced.Keywords: nucleic acid; protein; interaction; footprinting; chromatin immunoprecipitation (ChIP) 核酸-蛋白的互作在生命活动中发挥着广泛而重要的作用, 二者的协作是各种生命现象的基础。
将细胞或细胞器中的蛋白质、核酸等生物大分子的相互作用联系起来, 是综合研究一个完整的生物学途径的核心内容[1]。
近半个世纪以来, 研究者们在核酸-蛋白质复合物的构成和分解过程中进行了大量探索, 发展了一系列研究其互作关系的方法技术, 其中, 生物化学相关方法一直是重点与主流。
生物化学法主要利用酶或其他化学制剂, 通过切割、修饰等作用来分析或分辨存在相互作用的核酸和蛋白复合物, 研究其间潜在或实际的结合能力和结合方式。
其中DNaseⅠ、ExoⅢ足迹法以及更加精练的足迹技术, 如羟基自由基足迹分析、保护/干扰实验等, 在鉴别潜在的DNA靶点的基础上可进一步用于研究DNA-蛋白复合物中的DNA构成; 消化纤维膜过滤法、凝胶阻滞分析以及Southwestern印迹等能用作结合位点确定后相关蛋白的分离分析; 随着表观遗传学的兴起, 建立在DNA-蛋白交联基础上的染色质免疫沉淀(Chromatin immunoprecipitation, ChIP)技术迅速发展起来, 成为探索复杂的DNA-蛋白复合物结合情况的重要手段, 被广泛运用于转录复合体和组蛋白修饰的研究。
本文就相关方法的原理、应用及发展情况, 从体内、体外两个方面进行综述。
1体外的生化研究方法在对于蛋白质-核酸互作的多数研究, 尤其是早期研究中, 目的蛋白和目的核酸被分别提取出来, 在人工条件下进行孵育结合, 进行相关研究。
虽然实际上在生物体中, 二者有可能因为空间、电荷等各种关系无法接近而产生作用, 但体外方法有效地体现了核酸和蛋白质能够发生互作的潜力, 为核酸-蛋白质研究所广泛运用。
1.1 硝化纤维膜过滤实验膜过滤方法在核酸-蛋白质复合物研究中渊源已久, 最初用于RNA-蛋白质的互作研究[2], 后由Jones和Berg[3]于1966年首次将其用于DNA-蛋白质的研究中。
其原理是蛋白与硝化纤维膜(Nitrocellulose filter, NCF)结合, 但DNA不与其结合。
将标记过的DNA与蛋白质共同孵育, 用NCF过滤混合物, 则DNA能够通过NCF, 而DNA- protein 复合物留在NCF上。
随后干燥NCF, 通过标记物定量分析留在滤膜上的复合物, 即可判断二者的结合程度。
NC膜过滤的方法虽然在当前的研究中逐渐减少, 但其操作快速、简单, 能够定量地研究蛋白质与DNA相互作用, 仍在分析较多个核酸-蛋白质的互作关系中有一定用途。
Tran等[4]在蛋白互作研究中, 用膜过滤法确定促旋酶的DNA结合特性, Haque等[5]在研究线粒体翻译起始因子与核糖体的互作关系时, 用此方法分析起始复合物中RNA与核糖体蛋白的结合量变化情况; Posner等[6]结合芯片作用原理, 用滤膜板一次性检验384个G 蛋白联合受体的可能结合部位。
1.2足迹法足迹法最大的特点在于能确定蛋白结合DNA的片段长度, 其基本原理与DNA化学测序法相似, 首先将待测双链DNA片段进行标记, 然后加入适当浓度的探针对DNA进行消化剪切, 由于剪切具有随机性, 在反应完全时可将DNA切成单核苷酸。
若控制探针浓度, 将DNA部分消化, 就可以形成一个单核苷酸、二核苷酸、三核苷酸……n核苷酸的混合物[7]。
经变性后电泳分离, 放射自显影, 即可形成以相差一个核苷酸为梯度的DNA条带。
但当结合上蛋白时, 相应的DNA序列不会受探针的攻击, 因而在放射自显影图谱上DNA梯度条带在相应DNA结合蛋白的结合区域中断, 形成一空白区域, 恰似蛋白质在DNA上留下的足迹, 因而被形象地称作足迹法。
具体原理见图1。
随着可选用的探针逐渐丰富, 足迹法的具体研究方法和功能也丰富起来, 针对不同用途选取不同的探针, 在解决多种实际问题中起到了很大作用。
用于互作分析的探针主要有两种: 生物酶探针和化学探针, 以下分别进行介绍。
1.2.1 酶足迹法生物酶探针特异性好, 一般不会与要研究的结合蛋白作用, 不会扰乱DNA与蛋白质的互作。
因此在脆弱的DNA-蛋白质复合体中, 酶探针更受欢迎[8]。
DNaseⅠ和exonucleaseⅢ是两种最主要的生物酶探针, 在定位与蛋白质结合的DNA序列上有较大优势。
1.2.1.1 DNaseI足迹DNaseⅠ是直径约40Å的蛋白, 结合在DNA小沟, 独立地切割两条链的磷酸骨架[9]。
由于其体积较大, 切割作用更容易受空间位阻作用的影响, 不能切割到有蛋白覆盖的区域及周边的DNA, 因此是足迹法中确定DNA-蛋白结合与否的理想方法之一, 可以确定结合在蛋白上的DNA的片段长度, 但不能给出具体核酸序列。
DNaseⅠ足迹法由Galas和Schmitz[7]于1978年首次运用于DNA序列特异性结合蛋白的研究中。
通常是将DNA单链末端标记, 然后与结合蛋白反应, 复合物用DNaseⅠ部分消化。
结合蛋白的区域受到蛋白保护, 免受DNaseⅠ攻击, 而产物由于分子量的差异, 经电泳和放射自显影即可得到一系列条带, 与对照消化产物的连续条带相比, 其中空缺部分即为蛋白的结合区域。
图1 足迹法原理通过同一DNA片段与多个蛋白的足迹分析, 可推断这些蛋白的结合域是否有交叠或相互分开, 从而推测这些蛋白之间的协作对基因的调节, 如Makarewicz等[10]用单体PhoP进行DNaseⅠ足纹法分析得出, PhoP_P二聚体在phy C启动子上有两个结合区域, 在启动子-35位的结合促进启动子活性, 而在-10的结合抑制其活性; Matta等[11]在拮抗酶Ato C和细菌调控元件的互作研究中, 用DNaseⅠ足迹法检测Ato C的结合位点, 得出其在两个20 bp的位置结合, 序列分析得出这两个位置正好构成与转录起始位点相关的回文序列。
DNaseⅠ足迹法在确定单一转录因子结合区的研究中应用也很广泛。
近期应用此法的一个典型例子是Connaghan-Jones等[12]在研究孕酮受体与小鼠乳腺肿瘤病毒启动子的互作时, 采用DNaseⅠ足迹法检测出PR-a在启动子上的5个特异结合区域。
当然, DNaseⅠ法亦有其缺点。
由于一些结合蛋白也会与其发生作用, 导致一些DNaseⅠ超敏感位点的存在。
另外DNaseⅠ对DNA的切割有位点偏好性, 因此得出的电泳梯度条带是不均匀的, 而且实验中底物需要量大, 不能自动区别开DNA-蛋白质复合体上的多个组分。
这些不足使DNaseⅠ技术具有一定局限性。
1.2.1.2 外切酶Ⅲ足迹法外切酶Ⅲ(ExonucleaseⅢ, ExoⅢ)加工过程独特, 使其在研究序列特异性结合蛋白的工作中成为一种常用的探针, 适用于蛋白结合位置DNA序列的分析。
ExoⅢ是单体酶, 分子量小(28 000 kDa), 具有3'→5'外切酶活性、RNaseH 活性、3′磷酸酶活性和AP核酸内切酶活性[13]。
ExoⅢ足迹法运用了其3'→5'外切酶活性[14], 当ExoⅢ切割双链DNA时, 有蛋白结合的位置被保留下来, 产生的两条单链DNA片段经过变性凝胶电泳分析, 放射自显影检测即可得到结合片段大小。
一般来说, ExoⅢ足迹的切割片段要比DNaseⅠ略小一些, 所有的未被结合的DNA都被完全消化, 这是ExoⅢ的优势所在, 不存在自由DNA产生的背景问题。
不过使用ExoⅢ探针的先决条件是, 蛋白和DNA互作的半衰期不能少于Exo III作用所需要的时间[8]。
ExoⅢ足迹法最早由Shalloway等[14]采用, 通过此方法, 他们用SV40 T抗体找出了SV40 DNA复制起始位点结合区域。
