托伐普坦对肝性水肿的改善作用: 一项3期,多中心,随机双盲安慰剂对照试验
托伐普坦在心力衰竭治疗中的临床研究进展

托伐普坦在心力衰竭治疗中的临床研究进展摘要】通过回顾托伐普坦在医治心力衰竭过程中的大量临床试验资料,我们得知,低钠血症和肾功能不全是心力衰竭患者在药物治疗过程中最常见的并发症。
低钠血症和肾功能不全又分别是心力衰竭预后评估的独立危险因素。
然而常规利尿剂在利尿改善心功能的同时,经常导致低钠血症的发生和肾功能不全的进一步损害。
托伐普坦作为一种新型的治疗心力衰竭的利尿药物,通过其独特的作用机制,在利尿改善心功能的同时,能够防止低钠血症的发生,能够防止肾功能不全进一步加重。
总之,许多的临床实验研究数据提示,托伐普坦作为治疗心力衰竭的一种新型利尿药物,将为广大心力衰竭患者,特别是合并有低钠血症或肾功能不全的病人,在临床症状以及远期预后的改善上提供一种更优化的治疗。
【关键词】托伐普坦; 心力衰竭; 临床研究进展;【中图分类号】R541.6 【文献标识码】A 【文章编号】2095-1752(2016)29-0071-02目前治疗心力衰竭的药物主要有利尿药、血管扩张剂、血管紧张素I转化酶抑制药、血管紧张素II受体拮抗剂、抗醛固酮药、β受体阻滞剂、强心苷类正性肌力药、非苷类正性肌力药等。
利尿剂是心衰系统治疗的基本药物,然而利尿药经常伴有部分副作用,大剂量应用时副作用更加显著,包含电解质紊乱、神经激素激活、肾功能不全的加重,并可能引起病死率升高,且存在利尿药抵抗现象。
托伐普坦(Tolvaptan) 是一种选择性非肽类精氨酸升压素(AVP)受体拮抗剂,能够增加血浆中钠离子的浓度,减少水潴留,目前已有大量临床实验验证了其在医治心力衰竭合并低钠血症的有效性,美国正在进行两个三期临床试验[1]。
本文主要回顾和探究精氨酸升压素在心力衰竭中的作用以及其受体拮抗剂—托伐普坦在心力衰竭治疗中的临床进展。
1. AVP在心衰中的作用AVP也称抗利尿激素,其主要的生理功能为调控血浆渗透压和血容量。
血管升压素的作用主要体现于与其受体的结合,其受体可分为V1a、V1b、V2三种亚群。
托伐普坦治疗心衰合并低钠血症患者临床效果观察

托伐普坦治疗心衰合并低钠血症患者临床效果观察【摘要】托伐普坦是一种新型的心衰治疗药物,其在治疗心衰合并低钠血症患者中的临床效果备受关注。
本研究旨在观察托伐普坦在此类患者中的治疗效果,并探讨其临床意义及局限性。
研究采用回顾性观察法,结果显示托伐普坦在改善心衰症状、提高生活质量等方面具有明显效果。
研究也发现了一些局限性,如部分患者出现了药物不耐受等情况。
结论表明托伐普坦在治疗心衰合并低钠血症患者中具有一定的疗效,但仍需进一步研究完善其治疗策略。
展望未来,随着研究的不断深入,托伐普坦有望成为心衰治疗的重要药物,给患者带来更多的希望和好处。
【关键词】托伐普坦、心衰、低钠血症、临床效果观察、研究方法、结果分析、讨论、临床意义、研究局限性、结论总结、展望、启示。
1. 引言1.1 背景心衰是一种常见的心血管疾病,其主要特征是心脏功能减退导致全身组织器官灌注不足,临床表现为呼吸困难、乏力、水肿等症状。
心衰是一种进展性疾病,严重影响患者的生活质量,并且有较高的死亡率。
低钠血症是心衰患者常见的并发症之一,往往伴随水肿、腹胀等症状,严重时可导致神经系统症状,甚至危及生命。
托伐普坦是一种利尿剂,通过抑制肾脏中的钠钾氯共转运体,促使尿液中排钠,达到利尿的治疗效果。
近年来有研究表明,托伐普坦对心衰患者合并低钠血症具有一定的疗效,但相关的临床观察研究还比较有限。
本研究旨在通过对托伐普坦治疗心衰合并低钠血症患者的临床观察,评估其疗效和安全性,为临床治疗提供更多的依据和参考。
希望通过本研究的开展,可以为临床实践提供更好的指导,并促进心衰合并低钠血症患者的治疗效果和预后。
1.2 研究目的研究目的是评估托伐普坦治疗心衰合并低钠血症患者的临床疗效及安全性。
通过观察研究对象在接受托伐普坦治疗后的心衰症状、心功能、血钠水平等指标的变化情况,进一步了解托伐普坦在治疗心衰合并低钠血症方面的效果。
借助本研究结果,探讨托伐普坦在临床实践中的应用前景,为临床医生提供更为可靠的治疗方案。
托伐普坦治疗肝硬化腹水伴低钠血症的疗效及安全性分析

托伐普坦治疗肝硬化腹水伴低钠血症的疗效及安全性分析【摘要】在本研究中,我们对托伐普坦治疗肝硬化腹水伴低钠血症的疗效及安全性进行了分析。
我们首先介绍了背景情况,阐述了研究目的和意义。
随后详细解析了托伐普坦的药理作用,临床研究方法,疗效分析和安全性分析,并对不良反应进行了监测。
结果显示托伐普坦在治疗肝硬化腹水伴低钠血症中表现出显著的疗效,并且具有较好的安全性。
未来的研究可以进一步探讨托伐普坦在该疾病中的应用,以及可能的副作用和长期疗效。
托伐普坦在治疗肝硬化腹水伴低钠血症中具有良好的效果和安全性,为临床治疗提供了一个有前景的选择。
【关键词】肝硬化腹水、低钠血症、托伐普坦、疗效、安全性、药理作用、临床研究、不良反应监测、有效性、未来研究、肝功能、腹水减轻1. 引言1.1 背景介绍肝硬化是一种严重的肝脏疾病,常见于长期酗酒、慢性病毒性肝炎或脂肪肝患者。
肝硬化会导致肝脏功能受损,造成腹水、低蛋白血症、低钠血症等各种严重并发症。
肝硬化腹水伴低钠血症是一种常见且严重的并发症,临床治疗挑战较大。
托伐普坦是一种新型的抗肾素抗凝集子药物,通过抑制肾素-血管紧张素系统的活性,可以减轻血管紧张素引起的钠潴留和水潴留,从而改善肝硬化腹水伴低钠血症的症状。
目前关于托伐普坦治疗肝硬化腹水伴低钠血症的临床研究较少,其疗效和安全性仍然有待进一步探讨。
本研究旨在通过对托伐普坦治疗肝硬化腹水伴低钠血症的疗效及安全性进行分析,为临床医生提供更多治疗选择,并推动相关研究的发展。
通过本研究,我们希望可以更深入地了解托伐普坦在治疗肝硬化腹水伴低钠血症中的作用机制,为临床实践提供更加科学依据。
1.2 研究目的研究目的旨在评估托伐普坦治疗肝硬化腹水伴低钠血症的疗效及安全性,为临床提供更具科学依据的治疗方案。
具体目的包括:1. 探讨托伐普坦在治疗肝硬化腹水伴低钠血症中的药理作用,深入了解其对患者病情的影响机制;2. 分析临床研究方法,比较不同研究设计对于评估托伐普坦疗效的影响;3. 评价托伐普坦治疗肝硬化腹水伴低钠血症的疗效,包括对患者症状、生活质量和预后的影响;4. 分析托伐普坦治疗的安全性,包括对不良反应的监测和管理,确保患者在接受治疗过程中的安全性;5. 展望未来研究,提出进一步完善和深入研究的方向,为托伐普坦在治疗肝硬化腹水伴低钠血症中的应用提供更多依据。
心力衰竭药物治疗的新秀—托伐普坦

心力衰竭药物治疗的新秀—托伐普坦http:// 心力衰竭药物治疗的新秀—托伐普坦急性失代偿性心力衰竭(ADHF)在全球均是导致住院的主要原因之一。
尽管近几年慢性心力衰竭的预后改善方面有很大进展,但是在急性心力衰竭治疗方面却进展甚微。
ADHF治疗的首要目标是减容,2012年更新的欧洲心力衰竭指南治疗路径即是这样推荐。
然而目前的减容手段非常有限,利尿剂,特别是袢利尿剂是其主要选择。
尽管利尿剂在急性状况时有效,但常会出现不良反应,包括电解质紊乱(低钠血症、低钾血症)、神经激素激活、肾功能损伤或称为肾功能恶化(WRF,Worsening of Renal Function)。
最新的一些研究显示,患者的肾功能与心力衰竭预后密切相关。
ADHF合并肾功能恶化非常常见,这使得心力衰竭治疗变得更加复杂。
肾功能恶化会导致利尿剂抵抗、住院时间延长、死亡率增加以及出院后再住院比例增加。
虽然目前已确认了一些肾功能恶化的危险因素,但尚无针对ADHF伴肾功能恶化患者的有效治疗策略。
托伐普坦是一种口服的选择性V2受体抑制剂,其作用在肾脏远端集合管,可导致不含电解质的自由水排出增多。
作用机制方面,托伐普担与现有的利尿剂作用机制完全不同,但却能与它们有很好的互补效果。
研究显示,对于心力衰竭患者,托伐普坦在保护肾功能方面具有良好的特性。
2013年61期Journal of Cardiology刊登了Y Matsue 的最新研究文章。
该项研究为前瞻性观察研究,选择的是有肾功能恶化高危因素的ADHF患者,危险因素评分采用Forman的评分系统,分数大于或等于2的患者入选。
心力衰竭诊断依据Framingham标准。
研究共有114例患者入选,其中44例纳入托伐普坦组,70例纳入常规治疗组。
结果显示,托伐普坦组肾损伤的发生率为22.7%,远低于传统治疗组的41.4%(P <0.05);托伐普坦能够导致更多的利水,而不导致肾功能恶化(图1)。
托伐普坦治疗肝硬化腹水伴低钠血症的疗效及安全性分析

托伐普坦治疗肝硬化腹水伴低钠血症的疗效及安全性分析肝硬化是一种常见的肝脏疾病,其主要特征是肝脏组织发生不可逆性纤维化和结缔组织增生,导致肝脏功能受损。
肝硬化患者常常伴有并发症,其中腹水是最严重的并发症之一。
腹水是由于肝硬化导致的门脉高压引起肝腹壁静脉曲张,导致腹腔内压力增加,从而促进腹水的产生和腹水的潴留。
托妥普坦是一种有效的利尿剂,被广泛应用于治疗肝硬化所致腹水伴低钠血症。
本文将对托妥普坦治疗肝硬化腹水伴低钠血症的疗效及安全性进行分析。
托妥普坦是一种非氨基糖苷类利尿剂,通过阻断血管紧张素Ⅱ对肾脏的作用和收缩外周血管,从而减少静脉回流,降低肝内静脉和门脉的压力,减轻肝脏、肾脏和心脏的负担,从而减少肾脏的远端管路的钠重吸收。
托妥普坦还可增加尿酸的排泄,减少血管紧张素Ⅱ对肾小管的作用,减少远端肾小管的钠重吸收,从而产生利尿效应。
通过上述机制,托妥普坦能够减少腹水的产生和潴留,缓解肝硬化腹水伴低钠血症的症状。
在临床研究中,托妥普坦已被证实在治疗肝硬化腹水伴低钠血症方面具有显著的疗效。
一项研究显示,托妥普坦治疗肝硬化腹水伴低钠血症的患者,在6个月内有效率达到75%,在12个月内有效率达到83%,并且患者的血压、肾功能等指标也有明显改善。
另一项研究显示,托妥普坦联合醛固酮受体拮抗剂治疗肝硬化腹水伴低钠血症的患者,比单独使用醛固酮受体拮抗剂组有更好的腹水控制效果。
托妥普坦治疗肝硬化腹水伴低钠血症的安全性良好。
托妥普坦是一种非常温和的利尿剂,与其他利尿剂相比,其不会引起低钾血症、低镁血症等电解质紊乱。
在临床应用中,托妥普坦主要的不良反应是头痛、疲劳、头晕等轻微的中枢神经系统不良反应,且发生率较低。
由于托妥普坦不会影响尿酸的排泄,因此不会引起高尿酸血症和痛风。
托妥普坦治疗肝硬化腹水伴低钠血症的安全性较高,对患者的心、肝、肾功能没有明显不良影响。
需要注意的是,使用托妥普坦治疗肝硬化腹水伴低钠血症的患者在治疗过程中需要定期监测血钠、肾功能等指标,及时调整用药剂量,以保证患者的治疗效果和安全性。
托伐普坦治疗快速进展型常染色体显性多囊肾病的临床实践指南解读(最全版)

托伐普坦治疗快速进展型常染色体显性多囊肾病的临床实践指南解读(最全版)常染色体显性多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)是最常见的单基因遗传性肾病,患病率约为1/1000~1/400,约10%~15%为非遗传性自发突变致病[1,2]。
多数患者40岁后出现一系列临床症状,可累及全身多个系统,其中以肾脏病变为主且最为严重[3,4,5]。
我国约50% ADPKD患者到60岁时不可逆转地进展至终末期肾病(end-stage renal disease,ESRD)[2],只能依靠透析或肾移植维持生命,给社会和家庭带来了沉重负担。
国内现有的ADPKD药物治疗主要以对症处理并发症为主,如控制蛋白尿[6]、处理囊肿出血[7,8]、治疗囊肿感染[9,10]等。
近年来,国际上几项大型临床随机对照试验表明,托伐普坦(tolvaptan)能有效抑制ADPKD 患者肾囊肿生长,延缓肾功能恶化,包括美国在内的多个国家已批准该药用于治疗快速进展型成年ADPKD患者[11,12,13,14,15,16]。
尽管有了新药,但在应用托伐普坦治疗ADPKD患者的过程中,临床医生还面临许多具体问题。
鉴于此,2018年10月,美国梅奥(Mayo)临床医学中心Vicente E.Torres教授领衔制定了托伐普坦治疗快速进展型ADPKD的临床实践指南[16],详尽介绍了应用托伐普坦治疗ADPKD的适宜人群、药物剂量选择以及不良反应评估与处理等内容。
为使我国肾脏病医师今后能合理使用托伐普坦治疗ADPKD,我们对该指南做一解读。
1.明确ADPKD诊断:患者在使用托伐普坦治疗前,必须明确ADPKD诊断。
对于有明确ADPKD家族史的患者,主要依靠肾脏影像学方法进行诊断。
ADPKD超声和磁共振成像(MRI)影像学诊断和排除标准分别见表1和表2[17,18]。
以上两个诊断和排除标准只适合因PKD1和PKD2基因突变导致的ADPKD,不适用于非PKD基因突变导致的其他类型多囊肾病。
肝腹水及相关文献

▪ 方法 :两项多中心、随机化、双盲、安慰剂对照试验,评价托伐普坦在正常容 量性或高容量性低钠血症患者中的有效性。
▪ Vaptans在肝内由CYP3A酶代谢,因此,CYP3A的强抑制剂如酮康唑、柚子汁、尤其是 克拉霉素,增加血vaptans浓度,可能与血清钠浓度大幅增加有关,相反,诱导 CYP3A 系统的药物,如利福平、巴比妥类和苯妥英钠,可能会降低vaptans的疗效
▪ 2013 年 1 月,美国 FDA 发布了托伐普坦有潜在肝损伤风险的 警告,警告源于托伐普坦治疗常染色体显性多囊肾病 (autosomal dominant polycystic kidney disease,ADPKD)
肝肾综合征治疗
▪ 扩容治疗+血管收缩剂
▪ TIPS
▪ 人工肝( MARS)
▪ 肝移植
▪ 血液透析、CRT
▪ 2、其他血管收缩药:
▪ (1)去甲肾上腺素+白蛋白,剂量(0.5-3 mg/h)静脉 持续使用,增加剂量以达到动脉压升高
▪ (2)米多君(α1肾上腺素受体激动剂)+奥曲肽+白蛋 白。米多君口服起始剂量2.5mg-7.5 mg/8h和奥曲肽 100μg/8h 皮下注射,如肾功能无改善,剂量分别增加 至12.5mg/8h和 200μg/8h
▪ 低血容量性低钠血症较为少见,以血清钠水平低而无腹水和 水肿为特征,最常见于过度利尿剂治疗之后
▪ 在肝硬化中,血清钠浓度是预后的一个重要指标,出现低钠血 症与生存率受损有关
托伐普坦治疗心衰合并低钠血症患者临床效果观察

托伐普坦治疗心衰合并低钠血症患者临床效果观察
心衰是指心脏无法提供足够的血液和氧气,以满足身体的需要。
低钠血症则是指血液中钠离子的浓度低于正常范围。
心衰患者常常合并低钠血症,这会对患者的治疗和预后产生负面影响。
托伐普坦是一种利尿剂,可以减少体内的水分和钠离子,从而治疗心衰患者的水肿,并可能改善低钠血症。
本文旨在观察托伐普坦治疗心衰合并低钠血症患者的临床效果。
研究方法:选取2019年1月至2020年12月,我院收治的60例心衰合并低钠血症患者,随机分为托伐普坦组和对照组,每组30例。
托伐普坦组患者口服托伐普坦,对照组患者口服螺内酯,治疗持续2周。
对两组患者的治疗前后进行观察和比较。
研究结果:治疗后两组患者的心功能等级均有所提高,但托伐普坦组的心功能等级提高显著高于对照组,差异具有统计学意义(P<0.05)。
托伐普坦组的钠离子浓度明显上升(P<0.05),而对照组的钠离子浓度没有明显变化。
两组患者的水肿情况均有所改善,但托伐普坦组的水肿程度减轻显著,差异具有统计学意义(P<0.05)。
两组患者的血糖、血压、血尿酸、尿素等指标变化无明显差异。
结论:托伐普坦治疗心衰合并低钠血症患者可以显著改善心功能并提高血液中钠离子的浓度,同时可以减轻水肿程度,在临床上有一定的应用价值。
但需要注意的是,托伐普坦有一定的副作用,如低血钾、疲劳等,需严密监测。
柳暗花明又一村:托伐普坦,利尿药物的新选择
柳暗花明⼜⼀村:托伐普坦,利尿药物的新选择在上⼀篇⽂章中《利尿剂抵抗?Say No More 利尿剂》中,我们通过结合具体病例阐述了新药托伐普坦与传统利尿剂,在顽固性⼼源性⽔肿以及利尿剂抵抗时机制的差别,总结出托伐普坦在某些⽅⾯具有相关优势,但是托伐普坦作为最近新上市的新药,究竟怎么⽤呢?本期我们通过结合指南以及相关研究,循证阐述托伐普坦在各种情况下的应⽤。
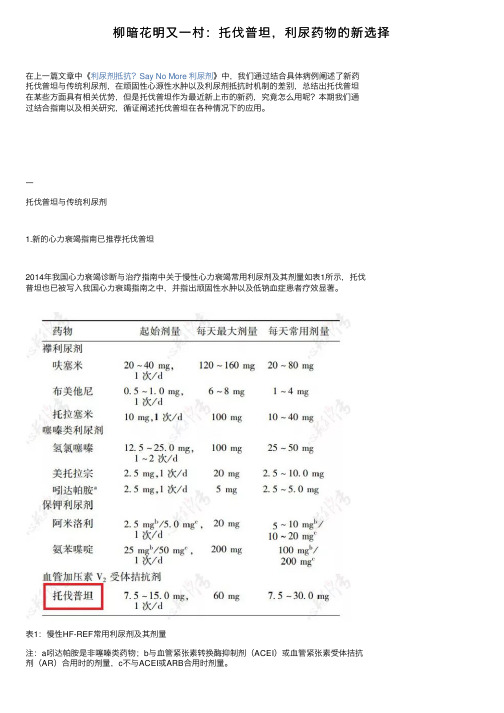
⼀托伐普坦与传统利尿剂1.新的⼼⼒衰竭指南已推荐托伐普坦2014年我国⼼⼒衰竭诊断与治疗指南中关于慢性⼼⼒衰竭常⽤利尿剂及其剂量如表1所⽰,托伐普坦也已被写⼊我国⼼⼒衰竭指南之中,并指出顽固性⽔肿以及低钠⾎症患者疗效显著。
表1:慢性HF-REF常⽤利尿剂及其剂量注:a吲达帕胺是⾮噻嗪类药物;b与⾎管紧张素转换酶抑制剂(ACEI)或⾎管紧张素受体拮抗剂(AR)合⽤时的剂量,c不与ACEI或ARB合⽤时剂量。
2.托伐普坦的适应症及⽤法⽤量适应症:①低钠⾎症托伐普坦适⽤于临床上明显的⾼容量性和正常容量性低钠⾎症(⾎清钠浓度<125mEq/L,或低钠⾎症不明显但有症状并且限液治疗不佳),包括伴有⼼⼒衰竭、肝硬化以及抗利尿激素分泌异常综合征(SIADH)的患者。
②⼼⼒衰竭引起的体液储留⽤于袢利尿剂等其他利尿剂治疗效果不理想的⼼⼒衰竭引起的液体潴留。
⽤法⽤量:起始剂量为15mg,每⽇1次,建议清晨服⽤。
3.托伐普坦与袢利尿剂对⽐托伐普坦与传统利尿剂相⽐较除尿量增加相同外,也有许多不同(表2),⾸先成分不同,托伐普坦排出的尿液中⾃由⽔含量更多,平衡减少细胞外液和细胞内液。
托伐普坦能维持⾎管内容量,故对⾎压、⼼率等没有影响。
⽽呋塞⽶会导致⾎压下降、⼼率增快、⼼律失常发⽣率增⾼。
托伐普坦对低钠患者⾎钠升⾼,⽽对⾎钠正常患者影响不⼤。
对⾎钾影响也不⼤。
⽽呋塞⽶以排电解质为主,故会导致低钠和低钾。
托伐普坦改善肾功能,⽽呋塞⽶使肾功能恶化。
托伐普坦不激活神经激素,⽽呋塞⽶会激活神经体液系统。
Vaptans:有望治疗进展期肝硬化

预测 因子 ,而且 低 钠 血 症 与短 期 高 死亡 率 相 关 。所有 这 些提 示 低 钠血 症 的发 生是 肝 硬 化 自然 病程 的相 关事 件 。
基于此背景 ,A P作用于位于肾小管的相关受体 ( 2 v V 受体 )引起水储 留,从理论上讲 , 选择性对抗该受体的抑制剂类药物可能是一个有效的治疗肝硬化和低钠血症的办法。这些药 物在 V 2受体分子克隆成功后得到发展, 并引起的清除显著上升 , 这基于肾集合管对于无溶质
维普资讯
V pa s a tn :有望治疗进展期 肝原载 : Ju lo p tlg 6 (0 7: 1 — 2 o me fHeaoo y 4 20 ) 0 1 ) 1 5 1 5
T l pa ,一个选择性的 口服抗利尿激素 V 受体拮抗剂 ,可用于治疗低 钠血症 。 o at v n 2
上升 ,尽管如此 ,由于 显著的动脉循 环系统的血管扩张造成有效血容量下 降。这种异常被定
义为 “ 高血 容量 性 低 钠血 症 或 稀释 性低 钠 血症 ” 与 “ 血 容量 性低 钠血 症 ” 相鉴 别 ( 被称 低 也
为 “ 真性低钠” ,体内总钠水平降低 ) ,这也可发生于肝硬化 ,尤其是 过量利尿后 ,特征性表
方法:两个多中心 、随机双盲 、安慰剂对照试验 ,评估了 tla t n 治疗稀释性或高血 o pa v i 容量性低钠血症的效果;病人被随机分为口服安慰剂组 (2 2 3人 )和 口服 tla tn组 (2 o pa v 25 人 ) 剂量 1mg 日。必要时 , o a tn的剂量根据血清钠的浓度增加 至每 日3mg , 5 / tl pa v 0 ,然后增 加 至每 日 6mg 0 。对于 所 有患 者 两个 初 始 治疗 终 点是 治 疗 4天和 3 0天血 清 钠浓 度 曲线 下 平均
托伐普坦片治疗低钠血症的效果及安全性观察

托伐普坦片治疗低钠血症的效果及安全性观察高倩【摘要】目的观察托伐普坦片对抗利尿激素分泌不高(SIADH)及其它原因引起的非低容量性、非急性低钠血症患者的疗效及安全性.方法 38例因充血性心力衰竭、肝功能衰竭伴腹水形成、慢性肾功能不全或抗利尿激素分泌不当等疾病引起体液潴留和低钠血症的患者,予口服托伐普坦片治疗.结果口服托伐普坦片者都有血钠浓度和血渗透压的显著升高.结论托伐普坦片能够显示良好的提高血清钠浓度作用,对低钠血症患者有明显疗效.没有严重并发症和不良反应,临床应用中简便且安全.【期刊名称】《实用医药杂志》【年(卷),期】2011(028)005【总页数】3页(P387-389)【关键词】托伐普坦片;低钠血症;疗效【作者】高倩【作者单位】250031 山东济南,济南重型汽车厂职工医院内科【正文语种】中文【中图分类】R591.1血钠对于血管内外液体容量以及渗透压的维持很重要,并受到严格调节以保证中枢和外周神经系统的正常功能。
血钠浓度受压力感受器和渗透压感受器相互作用以及中枢神经系统和神经激素系统的复合调节。
其中渴感和血管加压素的调节最重要。
血钠平衡的紊乱可导致一系列症状,包括从轻度的认知运动障碍,直至痉挛、昏迷和病死。
低钠血症指血清Na+<135 mmol/L,可分为低容量性、正常容量性和高容量性低钠血症,是住院患者中最常见的电解质异常。
有报道血钠浓度低于135 mmol/L的发生率为6%~15%,严重低钠血症(血钠浓度低于135 mmol/L)估计的发生率大约1%~4%。
通常对于轻度无症状低钠血症的治疗是纠正潜在病因并限水(一般1 L/d)。
但从临床治疗实践上来看,长期限水对多数患者会造成不适,特别是门诊患者很难执行长期限水治疗。
本研究观察口服托伐普坦片对低钠血症患者的疗效及安全性。
1 资料和方法1.1 病例资料入选的对象为2008-06~2010-06在笔者所在医院住院患者38例。
病因为充血性心力衰竭、肝功能衰竭伴腹水形成、慢性肾功能不全或抗利尿激素分泌不当(SIADH)等疾病引起血管加压素过度分泌,从而导致体液潴留和低钠血症,并且符合以下条件:①签署知情同意;②年龄18~80岁,男女不限;③随机分组之前血钠<135 mmol/L。
急性肝卟啉病的治疗进展

急性肝卟啉病的治疗进展雷佳佳1,李霜1,董白雪1,杨静2,任毅21 山西医科大学第一临床医学院,太原 0300012 山西医科大学第一医院内分泌科,太原 030001通信作者:任毅,*****************(ORCID:0000-0002-1163-3642)摘要:急性肝卟啉病(AHP)是一种血红素代谢异常的罕见病,近年来对该病的治疗有了突破。
除常规治疗外,本文重点综述了AHP的新疗法,这些治疗正处于初步应用于临床,或仍在研究阶段,包括RNAi疗法、酶替代疗法、DNA或mRNA的基因增补、药物分子伴侣和降低血红素合成的甘氨酸转运体抑制剂等。
另外,本文对AHP相关的低钠血症、可逆性后部脑病综合征等合并症、并发症的治疗也进行了综述。
我国对于AHP的治疗主要以高糖输注为主,我国诊断水平的提升及对罕见病的关注度增加,促进了AHP的诊治发展,有望今后能够探索更多适宜于我国人群的AHP的治疗方法。
关键词:卟啉病,肝;血红素;治疗学基金项目:山西省重点研发计划项目(201903D321127)Advances in the treatment of acute hepatic porphyriaLEI Jiajia1,LI Shuang1,DONG Baixue1,YANG Jing2,REN Yi2.(1. The First Clinical Medical College of Shanxi Medical University, Taiyuan 030001, China; 2. Department of Endocrinology, The First Hospital of Shanxi Medical University, Taiyuan 030001, China)Corresponding author: REN Yi,*****************(ORCID: 0000-0002-1163-3642)Abstract:Acute hepatic porphyria (AHP) is a rare disease with abnormal heme metabolism, and breakthroughs have been made in the treatment of this disease in recent years. In addition to conventional treatment methods, this article reviews new therapies for AHP that are in the stage of initial clinical application or are still in the research stage,including RNAi therapy,enzyme replacement therapy, genetic supplementation of DNA or mRNA, drug molecular chaperones, and glycine transporter inhibitors for reducing heme synthesis. Moreover,this article also reviews the treatment of AHP-related comorbidities and complications,such as hyponatremia and posterior reversible encephalopathy syndrome. High glucose infusion is the main treatment method for AHP in China,and the improvement in diagnosis and increased attention to rare diseases in China has promoted the development of the diagnosis and treatment of AHP, and it is expected to explore more suitable treatment methods for AHP in the Chinese population in the future. Key words:Porphyrias, Hepatic; Heme; TherapeuticsResearch funding:Key Research and Development Project of Shanxi Province (201903D321127)卟啉病是由血红素合成途径中酶活性缺乏导致的一种罕见病[1]。
托伐普坦片的功能主治

托伐普坦片的功能主治1. 功能介绍托伐普坦片是一种常用的口服药物,属于血管紧张素转换酶抑制剂(ACEI)类药物。
它主要通过抑制血管紧张素转换酶的活性,从而降低血管紧张素II的生成,促进血管舒张,降低血压,达到治疗高血压和心力衰竭的效果。
2. 主治疾病2.1 高血压高血压是一种常见的慢性疾病,如果不及时治疗,会增加心脑血管疾病的发生风险。
托伐普坦片通过降低血管紧张素II的生成,能够有效降低血压。
其作用机制有以下几个方面:•降低周围血管的阻力:托伐普坦片通过促进血管舒张,降低周围血管的阻力,使血液流动更加畅通,从而降低血压。
•减少体液潴留:血管紧张素II对肾脏具有收集尿液的作用,而托伐普坦片能够抑制血管紧张素II的生成,减少体液潴留,进而减轻血压。
2.2 心力衰竭心力衰竭是一种心脏功能减退的疾病,常常伴随呼吸困难、乏力等症状。
托伐普坦片对心力衰竭的治疗主要通过以下方式发挥作用:•改善心肌收缩力:托伐普坦片能够通过降低血管紧张素II的生成,减少心肌的负荷,从而改善心肌的收缩力。
•减轻心肌重构:血管紧张素II会引起心肌细胞增生和胶原沉积,导致心肌重构。
托伐普坦片能够抑制血管紧张素II的生成,减轻心肌重构。
3. 使用注意事项在使用托伐普坦片之前,需要注意以下事项:•孕妇和哺乳期妇女禁用:托伐普坦片可能对胎儿或婴儿产生不良影响,孕妇和哺乳期妇女禁用。
•患有肾功能不全的患者慎用:托伐普坦片主要经肾脏排泄,肾功能不全的患者需要调整剂量。
•与钾盐置换药物的联用注意监测血钾水平:托伐普坦片可能导致血钾升高,与钾盐置换药物联用时需要注意监测血钾水平。
4. 常见不良反应托伐普坦片在使用过程中可能出现以下不良反应:•咳嗽:因托伐普坦片对血管紧张素II的抑制,可能导致咳嗽,如果出现持续咳嗽需要咨询医生。
•头晕:托伐普坦片可能引起头晕,尤其是在刚开始使用药物时,需要避免过快的起床或者做出其他需要注意安全的动作。
•低血压:托伐普坦片可能导致血压降低,如果出现低血压症状,如头晕、晕厥等,需要咨询医生。
托伐普坦片Tolvaptan-详细说明书与重点

托伐普坦片Tolvaptan英文名称: T olvaptan T ablets【成分】本品主要成份是托伐普坦。
化学名称:(±)-4'-[(7-氯-2,3,4,5-四氢-5-羟基-1H-1-苯并杂氮卓-1-基)羰基]-N-邻-甲苯酰基-间-苯甲胺。
【性状】本品为蓝色片【适应症】1.低钠血症用于治疗临床上明显的高容量性和正常容量性低钠血症(血清钠浓度<125mEq/L,或低钠血症不明显但有症状并且限液治疗效果不佳),包括伴有心力衰竭、肝硬化以及抗利尿激素分泌异常综合征(SIADH)的患者。
重要限制事项-需要紧急升高血钠以预防或治疗严重神经系统症状的患者不应使用本品进行治疗。
尚未确定使用本品使血清钠浓度升高后对症状改善的益处。
2.心力衰竭引起的体液潴留用于袢利尿剂等其他利尿剂治疗效果不理想的心力衰竭引起的体液潴留。
本品可与其他利尿剂(袢利尿剂、噻嗪类利尿剂、抗醛固酮制剂)合并应用。
但没有与人心房利钠肽(hANP)合并应用的经验。
【规格】(1)15mg (2)30mg【用法用量】1.成人常用剂量由于过快纠正低钠血症可引起渗透性脱髓鞘作用,导致构音障碍、缄默症、吞咽困难、昏睡、情感变化、痉挛性四肢瘫痪、癫痫发作、昏迷和死亡,因此患者的开始给药和再次开始给药治疗应在医院进行,服药当日应多次监测血清钠浓度,以评估其对治疗的反应。
(1)治疗低钠血症本品通常的起始剂量是15mg、每日1次,餐前餐后服药均可。
根据需要,服药至少24小时以后,可将服用剂量增加至30mg,每日1次,最大可增加至60mg,每日1次,以升高血清钠浓度。
为降低肝损害的风险,服用本品不得超过30天。
在初次服药和增加剂量期间,要经常监测血清电解质和血容量的变化情况。
避免在治疗最初的24小时内限制液体摄入。
指导服用本品的患者,口渴时应及时摄入液体。
患者停止服用本品后,应指导患者重新限制液体摄入,并对患者的血清钠浓度以及血容量的变化进行监测。
托伐普坦治疗肝硬化难治性腹水的临床效果及不良反应

托伐普坦治疗肝硬化难治性腹水的临床效果及不良反应盛旭【期刊名称】《临床合理用药杂志》【年(卷),期】2021(14)29【摘要】目的观察在对症治疗基础上加用托伐普坦治疗肝硬化难治性腹水患者的临床效果及不良反应。
方法选取2019年4月-2020年4月湖北科技学院附属浠水医院收治的肝硬化难治性腹水患者92例,根据随机数字表法分为观察组和对照组,每组46例。
对照组采取基础对症治疗,观察组在对照组基础上加用托伐普坦治疗。
比较2组患者治疗总有效率,治疗前后血钠水平、尿量、腹水深度,并于治疗前后采用生活质量量表(SF-36)评估生活质量变化情况。
结果治疗7 d,观察组总有效率为95.65%,高于对照组的82.61%(χ^(2)=4.039,P=0.044);治疗7 d后,2组血钠水平较治疗前升高,尿量增加,腹水深度下降,且观察组变化幅度大于对照组(P均<0.01);2组心理角度、生理角度、社会角度评分均较治疗前升高,且观察组高于对照组(P均<0.01)。
结论肝硬化顽固性腹水患者在对症治疗基础上加用托伐普坦可获得满意效果,能在避免患者出现低血钠症同时有效提高排尿量并降低患者腹水深度,并可明显提高患者生活质量,值得临床推广应用。
【总页数】3页(P82-84)【作者】盛旭【作者单位】湖北科技学院附属浠水医院【正文语种】中文【中图分类】R47【相关文献】1.托伐普坦治疗肝硬化顽固性腹水的临床效果观察2.托伐普坦治疗肝硬化顽固性腹水并低钠血症的临床效果分析3.托伐普坦片治疗老年肝硬化难治性腹水伴低钠血症患者疗效观察4.托伐普坦治疗肝硬化顽固性腹水患者的临床疗效及安全性5.托伐普坦片治疗老年肝硬化难治性腹水伴低钠血症患者的疗效观察因版权原因,仅展示原文概要,查看原文内容请购买。
不同剂量托伐普坦治疗肾病综合征伴利尿剂抵抗患者的有效性与安全性

不同剂量托伐普坦治疗肾病综合征伴利尿剂抵抗患者的有效性与安全性曾芳;徐旺;许仁聪;刘德慧【期刊名称】《药品评价》【年(卷),期】2022(19)18【摘要】目的:探究不同剂量托伐普坦治疗肾病综合征(NS)伴利尿剂抵抗患者的有效性与安全性。
方法:选择2020年1月至2020年12月于赣州市人民医院就诊的74例NS伴利尿剂抵抗患者,按随机数字表法分为两组,各37例。
对照组采用中大剂量(30 mg/d)托伐普坦治疗,观察组采用低剂量(15 mg/d)托伐普坦治疗。
比较两组疗效、用药后的相关指标及不良反应发生率。
结果:两组治疗有效率比较,差异无统计学意义(P>0.05)。
两组用药后尿量、体重、尿钠、血钾、尿钾排泄量、血纤维蛋白原降解产物(FDP)、血D-二聚体(D-D)、血肌酐、尿素氮水平比较,差异无统计学意义(P>0.05);观察组血钠排泄量高于对照组(P<0.05)。
两组低血压、转氨酶水平升高、胆红素水平升高发生率比较,差异无统计学意义(P>0.05);观察组高钠血症发生率低于对照组(P<0.05)。
结论:不同剂量的托伐普坦治疗NS伴利尿剂抵抗患者的利尿效果相当,但低剂量托伐普坦能减少高钠血症不良反应,安全性较高。
【总页数】3页(P1147-1149)【作者】曾芳;徐旺;许仁聪;刘德慧【作者单位】赣州市人民医院【正文语种】中文【中图分类】R54【相关文献】1.托伐普坦治疗I型心肾综合症病人利尿剂抵抗的疗效及安全性2.不同剂量托伐普坦治疗老年慢性心力衰竭伴利尿剂抵抗患者的疗效与安全性观察3.托伐普坦治疗I 型心肾综合症病人利尿剂抵抗的疗效及安全性4.托伐普坦与常规利尿剂治疗肝硬化腹水伴低钠血症的疗效及安全性对比分析5.小剂量托伐普坦联合呋塞米治疗急性心力衰竭合并利尿剂抵抗超高龄老年患者临床评价因版权原因,仅展示原文概要,查看原文内容请购买。
托伐普坦对肝硬化腹水并发低钠血症患者Na+调控作用的影响

托伐普坦对肝硬化腹水并发低钠血症患者Na+调控作用的影响郑东阳;邱敏玲;黄宏黎;潘金水【期刊名称】《中国生化药物杂志》【年(卷),期】2016(000)007【摘要】目的观察托伐普坦对肝硬化腹水并发低钠血症患者Na+的调控作用.方法选取2013年1月~2016年1月厦门大学附属第一医院收治的肝硬化腹水并发低钠血症患者110例.随机分成2组,A组55例使用托伐普坦治疗,不限液体入量,限制体内钠盐摄入;B组55例使用常规治疗,控制其每天液体摄入量在1 ~1.5L,并视每位患者的具体情况而定适时补充钠盐和白蛋白以及利用利尿剂.治疗周期为8d,比较2患者治疗前后体内的血钠值、血钾浓度和尿量,记录2组患者在治疗过程中的不良反应.结果治疗后第8天,A、B组患者血钠值均显著高于治疗前(P<0.05);A、B组患者尿量分别为(3 124.2±689.2)ml和(1 722.3±625.7)ml,与治疗前(1 253.6±504.4)ml和(1277.5±647.3)ml相比,差异有统计学(P<0.05).且A组患者治疗过程中伴有口干、渴感等不良反应,B组患者不良反应不明显.结论托伐普坦对肝硬化腹水并发低钠血症患者的Na+有明显调控作用,和常规治疗方式相比作用显著.【总页数】3页(P41-43)【作者】郑东阳;邱敏玲;黄宏黎;潘金水【作者单位】厦门大学附属第一医院消化内科,福建厦门361003;厦门大学附属第一医院内科,福建厦门361003;厦门大学附属第一医院检验科,福建厦门361003;厦门大学附属中山医院消化内科,福建厦门361022【正文语种】中文【中图分类】R575【相关文献】1.肝硬化腹水患者并发低钠血症84例的临床分析及防治体会 [J], 周翠;陈向荣2.托伐普坦治疗伴低钠血症肝硬化腹水患者的疗效 [J], 徐力力;苏良;王晨;李新立3.肝硬化腹水并发HRS和低钠血症患者综合护理干预效果分析 [J], 阙静4.托伐普坦对肝硬化腹水并发低钠血症的疗效观察 [J], 魏建雄5.托伐普坦片治疗肝硬化腹水低钠血症患者的临床效果分析 [J], 何国开;沓世念;植中敬因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
托伐普坦对肝性水肿的改善作用:一项3期,多中心,随机双盲安慰剂对照试验作者:来自腹水双盲研究小组的Isao Sakaida,,Seiji Kawazoe,,Kozo Kajimura,,Takafumi Saito,,Chiaki Okuse,Koichi Takaguchi, Mitsuru Okada,及Kiwamu Okita目的:肝性水肿表现为腹水,下肢水肿及难以忍受的症状。
传统利尿剂对有些患者效果不佳。
所以便需要一种新的治疗选择。
我们进行了一项三期临床试验来确证托伐普坦对肝硬化合并肝性水肿的治疗效果。
方法:在我们的多中心随机双盲安慰剂对照试验中,在使用利尿剂的基础上,一组加用托伐普坦,另一组加用安慰剂,两组剂量均为7.5mg/天,连用7天,对传统利尿剂反应差的肝硬化患者会被随机分配到两组中的任一组中。
从基线图上看到最主要的结果是体重的变化。
结果:164名符合条件的患者,其中84名被分到托伐普坦组,另外80名被分配到安慰剂组。
从基准线上看到,在终末计量日安慰剂组的体重变化是-0.44kg(标准差[SD],1.93),而托伐普坦组的体重变化是-1.95kg (SD,1.77)(P<0.001)。
对下肢水肿及腹水相关临床症状的改善率来说,使用托伐普坦比使用安慰剂要高。
甚至在血清白蛋白偏低(<2.5g/dl)的患者中,使用托伐普坦降低体重的效果也比使用安慰剂要好(P=0.0163)。
另外,对比基准值可以看出托伐普坦极大地提高了血清钠浓度。
结论:加用托伐普坦对于肝性水肿及腹水相关临床症状的治疗是有效的。
而且,托伐普坦可以用于低钠血症以提高血清钠浓度并能在不受血清白蛋白水平影响下发挥作用。
因此加用托伐普坦被认为是针对肝性水肿的一种治疗新选择。
关键词:添加治疗,腹水相关临床症状,传统利尿剂,肝性水肿,肝硬化,托伐普坦引言在大多数肝硬化患者中,肝性水肿表现为腹水(由门脉高压及白蛋白合成功能受损引起)。
持续的肝性水肿可能导致各种主观和客观的症状出现,最终使生活质量下降。
针对肝性水肿的传统药物疗法是醛固酮拮抗剂(螺内酯)与袢利尿剂(如速尿)的联合应用。
然而这种联合用药对有些患者而言作用甚微。
因为这类患者的血清白蛋白和血钠水平往往偏低,故仅用速尿进行强效利尿治疗并不被看好。
而且,呋塞米存在相关药物不良反应,会出现例如低钠血症和肾脏损害等风险,所以不能轻易加大其剂量。
结果就使得单用传统利尿剂难以处理肝性水肿。
托伐普坦是一种非肽类物质,有效拮抗精氨酸加压素对V2受体的作用。
这种药物在美国已经被批准用于低钠血症的治疗,在欧盟被批准用在继发于抗利尿激素异常分泌综合征的低钠血症,在日本则被批准用于心衰引起的容量超负荷。
除了上述适应症外,在传统利尿剂的基础上加用托伐普坦的治疗方法用于治疗肝性水肿效果卓越,因其导致利尿的同时不会排钠。
为了使托伐普坦能有其他适应症,于是进行了一系列的临床试验以求得到认可,作为试验的一部分,二期试验的药物研究结果提示托伐普坦在用于肝硬化合并腹水的患者时,其剂量有所规定:低剂量7.5mg/天,中剂量15mg/天(在日本此为心衰引起容量超负荷患者的推荐剂量)及高剂量30mg/天。
基于之前研究的结果,最好选择7.5mg/天的剂量来治疗肝硬化患者,并且再进行三期试验来检验在使用利尿剂时加用上述剂量的托伐普坦对治疗肝硬化合并肝性水肿是否有效。
方法这项多中心,随机双盲安慰剂对照试验于2010年2月至2011年8月间在日本的80个试验点进行的。
此项试验包含了3天的治疗前观察阶段,7天的治疗阶段与14天的治疗后观察阶段。
参与该项试验的肝硬化合并腹水的患者至少在1周前已经签过知情同意书,并且在取得同意后一直使用袢利尿剂与醛固酮拮抗剂联合治疗。
联用的利尿剂日标准剂量在日本作如下规定:袢利尿剂(速尿)至少40mg/天以及螺内酯至少25mg/天,或者袢利尿剂(速尿)至少20mg/天以及螺内酯至少50mg/天。
20至80岁的患者在试验期间需住院治疗。
主要的排除标准如下:(i)肝性脑病患者(昏迷分期,≥II);(ii)肝细胞癌控制不佳的患者;(iii)食管胃底静脉曲张需新治疗方法的患者;(iv)继发于直肠静脉曲张的痔性出血患者;以及(v)接受了包括备用白蛋白在内的血液制品输注的患者。
在符合源自赫尔辛基宣言的相关伦理准则下进行这项试验,并且与优质临床规范指南保持一致。
每个试验点的机构审查委员会均通过了这项草案。
所有患者需提供书面同意书。
这项试验登记在,编号NCT01050530。
研究者认为用CT估算腹水量达1000ml以上的患者,在治疗前观察阶段未用早餐其体重能保持稳定(+1.0kg),就有资格进入下一阶段(药物治疗阶段)进行试验。
如果患者被确认符合以上标准,研究者需将治疗任务报告发送到登记中心。
登记中心重新审查患者的资格。
患者被随机分配到托伐普坦组或安慰剂组(人数1:1),用过早餐后托伐普坦组使用利尿剂加7.5mg/天的托伐普坦,安慰剂组使用利尿剂加7.5mg/天的安慰剂,两组均用药7天。
从试验药物用药开始至结束的7天内,传统利尿剂的量要保持固定。
登记中心用腹水量作为随机分配因子进行动态分配,通过这种分配每名患者分到一个试验药代码。
试验药事先已随机标上号码,并且每名患者分配到一个治疗号,治疗号与试验药号码相一致,以上操作是通过来自登录中心合同研究组织的药物分配管理者来进行的。
所有的患者,评判者,研究者及试验发起者在整个试验过程的治疗分配中均被标上记号。
试验药分配管理者在分配结束后封存分配名单,直到指定的揭露时间才将其解封。
对所有变量来说,在开始试验用药前立即获得的数据可作为基准值。
每名患者均完成或者停止试验用药的日期被称为终末计量日。
安慰剂被用作参照药物是因为托伐普坦有着不同于传统利尿剂的新作用机制,而且缺乏有效的正面比较物。
治疗时间设定为7天是因为在以前的试验中,开始试验用药后7天内可以评估托伐普坦组和安慰剂组的体重变化差异,还因为要对分配到安慰剂组的患者作伦理方面的考虑。
从基准线上看到的体重变化是主要的疗效指标,它能反映在终末计量日肝性水肿的改善情况。
次要的疗效指标包括腹围及腹水量(CT测得)的变化,下肢水肿与腹水相关临床症状(患者在3天治疗前观察阶段出现肿胀感,胃纳差,心神不宁,卧位压迫感及呼吸困难症状)的改善率。
而腹围及腹水量的变化,下肢水肿与腹水相关临床症状的改善率是各组在终末计算日同基准值作比较得出的。
研究者以“无”,“轻度”,“中度”和“严重”来评估下肢水肿的严重性。
下肢水肿的变化以“明显改善”(完全消退或改善度>2级),“改善”(除去消退外,改善度>1级),“未变”和“恶化”(恶化度>1级)为评估标准。
被评估为明显改善或改善的患者被视为有效病例。
研究者也会询问患者是否在治疗前观察阶段(标准时间段)出现典型的腹水相关临床症状并且这些症状是否在7天内发生变化。
以“消退”,“改善”,“未变”或“恶化”来评估腹水相关临床症状的变化。
评估符合“消退”或“改善”标准的患者视为有效病例。
下肢水肿及腹水相关临床症状的改善率的计算方式如下:有效病例数÷在治疗前观察阶段出现典型症状的患者数。
第1天指第1次用药至第2次开始试验用药之间的时间,第2至第7天的计算方式同上。
体重在1至7天的早餐前排尿后参照标准值测得,腹围在2至4天的任何一天与第7天的早餐前按基准值测得。
腹水量在第7天参考基准值测量。
下肢水肿参照典型表现在2至4天的任何一天及第7天的早餐前评估。
腹水相关临床症状参照典型表现在第7天评估。
为了确定日间尿液累积量,在标准时间段及1至7天内收集尿液标本。
为了确定血清钠浓度,在标准时间段,第1天的4-8小时、第24小时,2-4天中的任一天与第7天采集血液标本。
在试验进行期间需要安全评估,包括观察不良反应,临床实验室检查,生命体征测量及12导联心电图检测。
假设在终末计量日从基线图上得出的体重变化差异有统计学意义,在0.025水平(有统计学意义)及90%的检验效能上使用片面配对t检验可估测出所需的样本量。
在以往的试验中,安慰剂组的体重变化是-0.36kg(标准差[SD],2.06),7.5mg组为-2.31kg(SD,2.35),15mg 组体重变化-1.88kg(SD,2.45)以及在30mg组则为-1.67kg(SD,1.46)。
基于以往试验所有治疗组的最小差值与最大SD值,可以推测出此项试验两组间的体重变化差值是-1.31kg (SD,2.45)。
所以,需要的样本量估测每组患者75名,而我们决定让不少于80名患者参与这项试验,因为要考虑到部分患者退出的可能。
在全分析群(FAS)上进行样本分析。
全分析群(FAS)包括所有随机分配并至少使用过一次试验药的患者。
终末计量日缺失的数据由治疗开始后就获得的最终数据填补(此为最后观察结转法)。
假如第7天的腹水量难以测量,则其值可由治疗前所得的数据替代。
接受过至少1次试验药治疗的患者也应对其进行安全评估。
后续的数据用学生t检验或配对t检验来分析。
分类数据用Fischer’s精确概率法或Kruskal-Wallis检验法分析。
P<0.05被认为有统计学意义(双边的)。
95%的置信区间(CI)也可被估算出。
所有的统计分析都是使用9.2版本的SAS软件(SAS机构,Cary,NC,美国),在东京的EPS数据平台上操作。
结果164名参加试验的患者,84名被分配到托伐普坦组,80名被分配到安慰剂组(图1)。
然而,托伐普坦组在治疗开始前因为医生的有关决定有2名患者退出试验,并撤回了同意书。
其后,又有10名患者从安慰剂组中退出,8名患者从托伐普坦组退出。
安慰剂组患者早期退出的原因是:1名撤回了同意书,3名发生不良反应(食管静脉曲张破裂出血合并肝性脑病,陈旧性心肌梗死合并肝性脑病与肝病相关性水肿),6名是由医生决定其退出;托伐普坦组患者退出的原因:1名违反协议,6名发生不良反应(肝性脑病,脐疝,脱水,慢性肾衰,出疹及低钠血症),1名由医生决定让其退出。
两组间患者在统计学特征和临床特征上无显著差异(表1)评估后合格的患者(n=219)排除不合标准的患者(n=32)包含治疗前观察阶段的患者(n=187)排除患者(n=23)不符合条件(n=19)不良反应(n=2)医生决定(n=1)撤回同意书(n=1)图1 患者分配流程图表1 统计和临床基本特征特征安慰剂组(n=80) 托伐普坦组(n=82) P 值 年龄(年)69(46-78) 68(31-80) 0.91† 性别 (男)49 (61.3%) 52 (63.4%) 0.87‡ 体重(kg )59.2 (13.2) 59.4 (12.7) 0.92† 腹围(cm )89.7 (10.8) 89.6 (11.1) 0.93† CT 测得的腹水量(ml)2841 (1424) 2846 (1398) 0.98† 下肢水肿的严重程度0.25§ 无34 (42.5%) 43 (52.4%) 轻度23 (28.8%) 19 (23.2%) 中度13 (16.3%) 12 (14.6%) 严重10 (12.5%) 8 (9.8%) 胸腔积液20 (25.0%) 25 (30.5%) 0.49‡ 肝硬化病因乙型肝炎7 (8.8%) 5 (6.1%) 丙型肝炎42 (52.5%) 48 (58.5%) 酒精性肝硬化20 (25.0%) 27 (32.9%) 其他及未知16 (20.0%) 10 (12.2%) Child-Pugh 分级0.07§ A0 (0%) 0 (0%) B54 (67.5%) 44 (53.7%) C26 (32.5%) 38 (46.3%) 并发症肝癌16 (20.0%) 23 (28.0%) 0.27‡ 静脉曲张65 (81.3%) 68 (82.9%) 0.84‡ 血清白蛋白浓度(g/dl)2.88 (0.50) 2.81 (0.46) 0.39† 血清肌酐浓度(mg/dl)1.05 (0.44) 0.99 (0.35) 0.27† 限制纳摄入29 (36.3%) 32 (39.0%) 0.75‡ 联用利尿剂螺内酯(mg/天)54.1 (24.3) 55.2 (26.3) 0.78† 呋塞米(mg/天)61.5 (28.8) 64.5 (40.4) 0.59† 数据以中位数(一定范围)、人数(%)或平均值(标准差)表示† 学生t 分布检验‡ Fischer ’s 精准概率法§ Kruskal –Wallis 检验 随机分配的患者(n=164)随机分配到安慰剂组的患者(n=80) 随机分配托伐普坦组 的患者(n=82) 排除患者(n=2) 医生决定(n=1) 撤回同意(n=1)从基线图上看,在终末计量日的体重变化安慰剂组为-0.44kg(SD,1.93),托伐普坦组为-1.95kg (SD,1.77)。
