初中化学元素化合价
初三化学化合价详细讲解

初三化学化合价详细讲解一、常见元素及原子团的化合价:钾K 钠Na 氢H 银Ag +1价,氟F 氯Cl 溴Br 碘I -1价钙Ca 镁Mg 钡Ba 锌Zn +2价,+1、+2铜Cu,+2、+3铁Fe铝Al+3 硅Si+4 氧O-2常见带电离子团:硫酸根SO42+,硝酸根NO3-,氢氧根OH-,氯酸根ClO3-,碳酸根CO32-铵根NH4+,高锰酸根MnO4- 锰酸根MnO42-,磷酸根PO43-注意:标原子团的化合价时,应标在原子团的上方,如:书写离子符号时,应在原子团右上角标明带电荷数,如硫酸根离子:SO42-一个亚铁离子Fe2+,一个铁离子Fe3+。
二、初中化学物质的检验(一)、气体的检验1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.(二)、离子的检验.6、氢离子:滴加紫色石蕊试液/加入锌粒7、氢氧根离子:酚酞试液/硫酸铜溶液8、碳酸根离子:稀盐酸和澄清的石灰水9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子(三)、相关例题14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。
元素化合价口诀初中

元素化合价口诀初中好的,以下是为您生成的文章:初中化学里,元素化合价这玩意儿可是个重要的“小怪兽”,想要打败它,咱们得有秘密口诀!话说我当年教过一个叫小明的学生,这孩子聪明是聪明,就是对化合价老是搞混。
有一次化学课上,我刚讲到化合价,他那迷茫的小眼神就告诉我,他又迷糊啦!咱先来说说常见元素的化合价口诀:“钾钠氢银正一价,钙镁钡锌正二价,氟氯溴碘负一价,通常氧是负二价,铜汞一二铝正三,铁有正二和正三。
”就拿钾来说吧,在各种化合物里,钾元素常常就是正一价。
比如氯化钾(KCl),钾就是正一价,氯是负一价。
钠也是一样,氯化钠(NaCl)里钠就是正一价。
氢和银也不例外,像氯化氢(HCl)里氢就是正一价,而银在硝酸银(AgNO₃)中就是正一价。
钙、镁、钡、锌这些家伙,多数时候都是正二价。
比如氧化钙(CaO),这里面钙就是正二价,氧是负二价,正负化合价代数和为零,这样化学式才能平衡嘛。
氟、氯、溴、碘,它们通常是负一价。
像氢氟酸(HF)里氟就是负一价,盐酸(HCl)里氯是负一价。
氧呢,一般是负二价,像水(H₂O),双氧水(H₂O₂),氧都是负二价。
铜和汞有正一价和正二价的时候。
像氧化亚铜(Cu₂O)里铜就是正一价,氧化铜(CuO)里铜就是正二价。
铝通常是正三价,比如氧化铝(Al₂O₃)。
铁就有点调皮啦,有正二价和正三价。
像氯化亚铁(FeCl₂)里铁是正二价,氯化铁(FeCl₃)里铁就是正三价。
小明一开始总是记不住,我就给他举例子,让他多写多练。
后来有一次测验,他居然把化合价相关的题目都做对了,那高兴劲儿,就像发现了新大陆似的。
总之,化合价这东西,多记多练,结合具体的化合物去理解,慢慢就能掌握啦。
可别像刚开始的小明那样,被它给难住哟!相信大家都能把化合价这个“小怪兽”打得落花流水,在化学的世界里畅游无阻!。
化学常见元素化合价

化学常见元素化合价
化学中,元素的化合价是指一个元素在化合物中的电价。
对于常见元素,其化合价是可以预测的,因为它们都遵循着特定的规律。
以下是常见元素的化合价:
1. 氢 (H):+1
2. 氧 (O):-2
3. 氮 (N):-3
4. 碳 (C):-4
5. 硫 (S):-2, +4, +6
6. 氯 (Cl):-1, +1, +3, +5, +7
7. 硼 (B):+3
8. 钠 (Na):+1
9. 铝 (Al):+3
10. 锌 (Zn):+2
11. 铁 (Fe):+2, +3
12. 铜 (Cu):+1, +2
13. 氟 (F):-1
14. 硒 (Se):-2, +4, +6
15. 硅 (Si):+4
需要注意的是,元素的化合价可以有多个值。
比如,硫可以具有 -2、+4、+6 的化合价。
这是因为不同的化合物中,元素的价电
子数不同,因而化合价也会发生变化。
此外,还需要注意的是,在某些情况下,元素的化合价可能会发生变化。
比如,氧化铁中的铁的化合价为 +3,但是在酸性条件下,铁的化合价可以升高到 +6。
这些变化会受到化合物的环境和条件的影响。
总的来说,了解常见元素的化合价对于理解化学反应和化合物的性质非常重要。
初中常见化合价化学式化学方程式
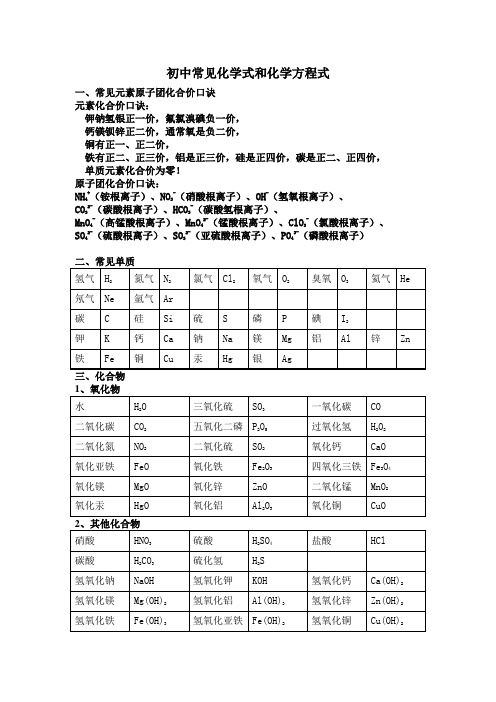
初中常见化学式和化学方程式一、常见元素原子团化合价口诀元素化合价口诀:钾钠氢银正一价,氟氯溴碘负一价,钙镁钡锌正二价,通常氧是负二价,铜有正一、正二价,铁有正二、正三价,铝是正三价,硅是正四价,碳是正二、正四价,单质元素化合价为零!原子团化合价口诀:NH4+(铵根离子)、NO3-(硝酸根离子)、OH-(氢氧根离子)、CO32-(碳酸根离子)、HCO3-(碳酸氢根离子)、MnO4-(高锰酸根离子)、MnO42-(锰酸根离子)、ClO3-(氯酸根离子)、SO42-(硫酸根离子)、SO32-(亚硫酸根离子)、PO43-(磷酸根离子)初中常见的化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P+5O2 2P2O52、氢气在空气中燃烧生成水:2H2+O22H2O3、硫磺在空气(或氧气)中燃烧:S+O2SO24、镁条在空气(或氧气)中燃烧:2Mg+O22MgO5、铁丝在氧气中燃烧:3Fe+2O2Fe3O46、木炭在空气(或氧气)中完全燃烧:C+O2 CO27、木炭不充分燃烧:2C+O22CO8、一氧化碳燃烧:2CO+O2 2CO29、二氧化碳和水反应生成碳酸:CO2+H2O ==H2CO310、二氧化碳通过灼热的炭层:CO2+C 2CO点燃点燃点燃点燃点燃点燃点燃高温点燃11、生石灰作为干燥剂:CaO +H2O == Ca(OH)2二、分解反应11、高锰酸钾制氧气:2KMnO4K2MnO4+MnO2+O2↑12、氯酸钾制氧气:2KClO32KCl+3O2↑13、双氧水制氧气:2H2O22H2O + O2↑14、电解水:2H2O 2H2↑+ O2↑15、碳酸分解:H2CO3H2O+CO2↑16、高温煅烧石灰石(工业制取二氧化碳):CaCO3 CaO +CO2↑三、置换反应17、铜和硝酸银溶液反应:Cu + 2AgNO3 == 2Ag +Cu(NO3)218、铁和硫酸铜溶液反应:Fe + CuSO4 == Cu + FeSO419、锌和硫酸反应制取氢气:Zn + H2SO4== ZnSO4+ H2↑20、铝和稀硫酸反应:2Al + 3H2SO4== Al2(SO4)3+ 3H2↑21、木炭还原氧化铁:3C+2Fe2O34Fe + 3CO2↑木炭还原氧化铜:C+2CuO 2Cu +CO2↑木炭还原四氧化三铁:2C+Fe3O43Fe +2CO2↑氢气还原氧化铜:H2+ CuO Cu + H2O四、复分解反应(一)酸 + 碱→盐 + 水22、氢氧化钠与盐酸反应:NaOH + HCl == NaCl + H2O23、氢氧化钠与硫酸反应:2NaOH + H2SO4== Na2SO4+ 2H2O24、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl3+ 3H2O25、氢氧化镁与硫酸反应:Mg(OH)2 + H2SO4== MgSO4+ 2H2O(二)酸 + 盐→新酸 + 新盐26、盐酸与硝酸银溶液反应:HCl+AgNO3== AgCl↓+HNO3△MnO2△MnO2通电高温高温高温高温高温27、氯化钡溶液与硫酸溶液反应:BaCl2 +H2SO4== BaSO4↓+ 2HCl28、碳酸钠与稀盐酸:Na2CO3+2HCl == 2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸:NaHCO3+HCl == NaCl+H2O+CO2↑29、石灰石与稀盐酸反应(实验室)制取二氧化碳:CaCO3+2HCl =CaCl2+H2O+CO2↑(三)碱 + 盐→另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓31、氯化铁溶液和氢氧化钠溶液反应:FeCl3+3NaOH==Fe(OH)3↓+3NaCl(四)盐 + 盐→两种新盐32、硝酸银溶液与氯化钠溶液反应:AgNO3 + NaCl == AgCl↓+ NaNO333、氯化钡溶液与碳酸钠溶液反应:BaCl2+ Na2CO3= BaCO3↓+ 2NaCl(五)金属氧化物 + 酸→盐 + 水34、稀盐酸清洗铁锈:6HCl+Fe2O3== 2FeCl3+3H2O35、氧化铜与稀硫酸反应:CuO+H2SO4== CuSO4+H2O五、非金属氧化物 + 碱→盐 + 水36、二氧化碳通入澄清石灰水中:CO2+Ca(OH)2== CaCO3↓+H2O37、氢氧化钠在空气中变质:CO2+2NaOH=Na2CO3+H2O38、氢氧化钠溶液吸收二氧化硫:SO2+2NaOH==Na2SO3+H2O39、氢氧化钠溶液吸收三氧化硫:SO3 +2NaOH==Na2SO4+H2O六、其他反应类型40、一氧化碳还原氧化铜:CO + CuO Cu + CO241、一氧化碳还原氧化铁:3CO+ Fe2O32Fe + 3CO2↑42、一氧化碳还原四氧化三铁:4CO+ Fe3O43Fe + 4CO2↑43、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O44、甲烷燃烧:CH4 + 2O2CO2+ 2H2O△点燃点燃高温高温。
初中化学化合价概念详细图文解析

初中化学化合价概念详细图文解析【导言】化学是一门研究物质变化性质及其应用的学科,而化合价则是化学中一个基本概念。
本文将详细解析初中化学中化合价的概念,并通过图文结合的方式进行解析,帮助读者更好地理解和掌握化合价的知识。
【概念解析】化合价,又称原子价、价值、电价等,是指元素在化合物中正负电荷的表现形式。
化合价的概念来源于化学反应中的化学键。
在化学式中,原子通过原子上的电子迁移或共用来构成化学键。
化合价的数值表示原子在化合物中所带的电荷数。
【基本规则】化合价的计算遵循以下基本规则:1. 单负离子的化合价等于离子的所带电荷数。
2. 单正离子的化合价等于离子所带电荷数的相反数。
3. 自由原子的化合价为0。
4. 非金属元素的化合价通常是正的,而金属元素的化合价通常是负的。
5. 氧元素通常化合价为-2,氢元素通常化合价为+1。
6. 非氧族元素的化合价通常不超过其周期数减去8。
7. 阳离子和阴离子的化合价绝对值之和相等。
【图文解析】图一:化合价的计算规则(插入一张图表,图表中包含了化合价的计算规则,可以通过示例原子和离子的化合价计算来帮助读者理解)图二:常见离子的化合价(插入一张图表,图中列出了常见元素的离子以及离子的化合价,例如Na+、Cl-、Mg2+等,以帮助读者记忆常见离子的化合价)图三:氧族元素的化合价(插入一张图表,图中给出了氧族元素的周期表,标注了氧族元素的化合价,例如O、S、Se、Te等,以帮助读者理解氧族元素的化合价规律)图片说明:1. 图一中的计算规则示例:以氢氧化钠(NaOH)为例,Na的化合价为+1,O的化合价为-2,根据化合价绝对值之和相等的规则,可推算出Na的化合价为+1。
2. 图二中的常见离子示例:Na+的化合价为+1,Cl-的化合价为-1,Mg2+的化合价为+2,通过图表可以直接查找常见离子的化合价。
3. 图三中的氧族元素示例:O的化合价为-2,S的化合价为-2或+6,Se的化合价为-2或+6,Te的化合价为-2或+6,通过图表可以了解氧族元素的化合价规律。
元素化合价口诀初中顺口溜

元素化合价口诀初中顺口溜
初中化学中,元素化合价的记忆可以通过以下顺口溜来帮助:
1.一价钾钠银氢正一价,钡锌钙镁正二价,一二铜,二三铁,亚铜
亚铁是低价,铝是正三氧负二,氯是负一最常见,硫有负二正四六,正二正三铁可变,二三铁,二四碳,单质零价永不变。
2.负一硝酸氢氧根,负二硫酸碳酸根,负三记住磷酸根,正一价的
是铵根。
3.氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙
钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;
一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
初中化学化合价口诀

初中化学化合价口诀[初中化学化合价口诀]初中化学口诀1、常见元素的化合价:一价钾钠氯氢银,二价钙钡镁锌,三铝四硅五价磷;二三铁,二四碳;二四六硫都齐全,铜汞二价最常见。
2、实验室制取氧气的步骤:“茶(查)、庄(装)、定、点、收、利(离)、息(熄)”“查”检查装置的气密性“装”盛装药品,连好装置“定”试管固定在铁架台“点”点燃酒精灯进行加热“收”收集气体“离”导管移离水面“熄”熄灭酒精灯,停止加热。
3、用CO还原氧化铜的实验步骤:“一通、二点、三灭、四停、五处理”“一通”先通氢气,“二点”后点燃酒精灯进行加热;“三灭”实验完毕后,先熄灭酒精灯,“四停”等到室温时再停止通氢气;“五处理”处理尾气,防止CO污染环境。
4、电解水的实验现象:“氧正氢负,氧一氢二”:正极放出氧气,负极放出氢气;氧气与氢气的体积比为1:2。
6、组成地壳的元素:养闺女(氧、硅、铝)7、原子最外层与离子及化合价形成的关系:“失阳正,得阴负,值不变”:原子最外层失电子后形成阳离子,元素的化合价为正价;原子最外层得电子后形成阴离子,元素的化合价为负价;得或失电子数=电荷数=化合价数值。
8.化学实验基本操作口诀:固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖液体应盛细口瓶,手贴标签再倾倒;读数要与切面平,仰视偏低俯视高滴管滴加捏胶头,垂直悬空不玷污;不平不倒不乱放,用完清洗莫忘记托盘天平须放平,游码旋螺针对中;左放物来右放码,镊子夹大后夹小试纸测液先剪小,玻棒沾液测最好;试纸测气先湿润,粘在棒上向气靠酒灯加热用外焰,三分之二为界限;硫酸入水搅不停,慢慢注入防沸溅实验先查气密性,隔网加热杯和瓶;排水集气完毕后,先撤导管后移灯9、金属活动性顺序:金属活动性顺序由强至弱:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au (按顺序背诵)钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金10、“十字交叉法”写化学式的口诀:“正价左负价右,十字交叉约简定个数,写右下验对错”11、过滤操作口诀:斗架烧杯玻璃棒,滤纸漏斗角一样;过滤之前要静置,三靠二低莫忘记。
初中化学元素化合价完整版

一、常见元素化合价
元素名称
元素符号
常见化合价
元素名称
元素符号
常见化合价
钾
K
+1
氢
H
+1
钠
Na
+1
氯
Cl
-1+5+7
银
Ag
+1
溴
Br
-1
钙
Ca
+2
碘
I
-1
镁
Mg
+2
氧
O
-2
硫
S
-2+4+6
钡
Ba
+2
碳
C
+2+4
锌
Zn
+2
硅
Si
+4
铜
Cu
+2-1
氮
N
-3+2+4+5
铝
Al
+3
磷
P
+5
铁
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
—
Cu2+
不
溶
溶
溶
不
Ag+
—
溶
不
微
不
Fe
+2+3
二、常见原子团化合价原子团
名称原子团
名称
原子团
符号
原子团
化合价
原子团
名称原子团Fra bibliotek符号原子团
化合价
氢氧根
常见化学元素化合价

常见化学元素化合价化学元素的化合价是指元素与其他元素结合时所表现出的电荷数。
化学元素的化合价不仅是化学中的重要概念,也是化学反应和化学式计算的基础。
在化学元素的命名和化合物的构建过程中,了解常见化学元素的化合价是非常重要的。
本文将介绍一些常见化学元素的化合价及相关知识。
1. 氢(H):氢的化合价通常为+1,但在金属化合物中,其化合价可以为-1。
2. 氧(O):氧的化合价通常为-2,但在过氧化物中,其化合价可以为-1。
同时,氧还可以表现出不同的氧化态,如+1、+2和+3等。
3. 氮(N):氮的化合价通常为-3,但在某些化合物中,其化合价可以为+3或+5。
4. 碳(C):碳的化合价通常为+4,在某些有机化合物中,其化合价可以为+2或-4。
5. 硫(S):硫的化合价通常为-2,但在硫化物中,其化合价可以为-1、+2、+4或+6。
6. 氯(Cl):氯的化合价通常为-1,但在氯化物中,其化合价可以为-1、+1、+3、+5或+7。
7. 铁(Fe):铁的化合价通常为+2或+3,但在一些特殊的化合物中,其化合价可以为+0或+6。
8. 锌(Zn):锌的化合价通常为+2。
除了以上所列举的常见化学元素,其他元素的化合价也存在多样性和变化性。
由于篇幅关系,本文无法一一列举。
在实际应用中,化学家们通过实验和观察总结出了大量元素的化合价规律和特点。
掌握了常见化学元素的化合价,我们可以更好地理解元素间的化学反应和化合物的构建过程。
化合价的概念帮助我们预测元素的离子价,从而推断出不同元素结合形成的化合物的化学式。
同时,对于化学方程式的平衡和离子反应的计算,了解化合价也能起到重要的指导作用。
总之,化合价是化学中不可或缺的概念,它能帮助我们理解元素的性质和化合物的构成。
通过掌握常见化学元素的化合价,我们可以更好地应用化学知识于实际应用中,为科学研究和工程技术提供有力支持。
(字数:408)。
初中常见物质化学式与元素化合价

初中常见物质化学式与元素化合价物质的化学式是用元素符号表示化学元素的种类和原子数目的式子。
而元素的化合价是指元素与其他元素形成化合物时所呈现的既成规律,反映了元素在化合物中与其他元素结合的能力。
下面将介绍一些初中常见物质的化学式以及元素的化合价。
1.二氧化碳:化学式为CO2,由1个碳原子和2个氧原子组成。
其中,碳的化合价为+4,氧的化合价为-2、碳与氧原子的化合价之和为0。
2.水:化学式为H2O,由2个氢原子和1个氧原子组成。
其中,氢的化合价为+1,氧的化合价为-2、氢原子与氧原子的化合价之和为0。
3.氯化钠:化学式为NaCl,由1个钠原子和1个氯原子组成。
其中,钠的化合价为+1,氯的化合价为-1、钠原子与氯原子的化合价之和为0。
4.硝酸:化学式为HNO3,由1个氢原子、1个氮原子和3个氧原子组成。
其中,氢的化合价为+1,氮的化合价为+5,氧的化合价为-2、氢的化合价与氮、氧原子的化合价之和都为0。
5.二氧化硫:化学式为SO2,由1个硫原子和2个氧原子组成。
其中,硫的化合价为+4,氧的化合价为-2、硫原子与氧原子的化合价之和为0。
6.氨气:化学式为NH3,由1个氮原子和3个氢原子组成。
其中,氮的化合价为-3,氢的化合价为+1、氮原子与氢原子的化合价之和为0。
7.二氧化硅:化学式为SiO2,由1个硅原子和2个氧原子组成。
其中,硅的化合价为+4,氧的化合价为-2、硅原子与氧原子的化合价之和为0。
8.硫酸:化学式为H2SO4,由2个氢原子、1个硫原子和4个氧原子组成。
其中,氢的化合价为+1,硫的化合价为+6,氧的化合价为-2、氢的化合价与硫、氧原子的化合价之和都为0。
9.乙烯:化学式为C2H4,由2个碳原子和4个氢原子组成。
其中,碳的化合价为-3,氢的化合价为+1、碳原子与氢原子的化合价之和为0。
10.氯气:化学式为Cl2,由2个氯原子组成。
氯的化合价为0,因为不需要与其他元素结合。
以上是一些初中常见物质的化学式和元素的化合价。
初中化学元素及化合价

初中化学元素及化合价1、氢化合物:
(1)氢:质子1,化合价+1
(2)氧化物:质子2,化合价-2
(3)氯化物:质子1,化合价-1
(4)硫酸盐:质子2,化合价-2
2、碱金属:
(1)钠:质子1,化合价+1
(2)钙:质子2,化合价+2
(3)铝:质子3,化合价+3
(4)锂:质子1,化合价+1
3、非金属:
(1)氟:质子1,化合价-1
(2)氖:质子0,化合价0
(3)氮:质子3,化合价-3
(4)磷:质子3,化合价-3
(5)硫:质子2,化合价-2
4、有机元素:
(1)甲烷:质子4,化合价-4
(2)乙烷:质子2,化合价-2
(3)丙烷:质子6,化合价-6
(4)烯烃:质子2,化合价-2
(5)芳香烃:质子4,化合价-4
二、常见元素的定义
1、氢:氢是一种无色、无臭、无味的无机元素,其在自然界中最多,但是在地壳中只占质量的0.14%,其原子量为1,处于无机元素周期表的
最左边。
2、氧:氧是一种常见的元素,它是地球上最常见的元素,其原子量
为16,是一种有机物,它可以与其他元素如氢、碳等进行化学反应,形
成氧化物。
3、氯:氯是一种常见的元素,原子量为35.5。
初中元素化合价记忆口诀

初中元素化合价记忆口诀1.用口诀法记忆化学元素化合价(1)常规价的:一价氢氯钾钠银,二价氧钙钡镁锌,三铝四硅五氮磷。
(2)变价的:铜一二,铁二三,二(负二)四六硫二四碳,二四六七锰全占。
(3)负价的:负一氟氯和溴碘,负二氧硫负三氮。
2.化合价口诀:钾钠氢银正一价,钙镁锌钡正二价,氟氯溴碘负一价,通常氧是负二价,铜正一二铝正三,铁有正二和正三,碳有正二和正四,硫有负二正四六。
3.常见元素化合价口诀,及原子团化合价K Na Ag H +1价Ca Zn Ba Mg Hg +2价Cu有+1,+2价 Fe有+2,+3价记住Al是+3价F和Cl -1价 O和S是-2价OH根,根-1价根,根-2价根+1价一价氢氯钾钠银,二价氧镁钙钡锌,亚铁正二,铝,铁三铜汞二价最常见前正价,后负价,化合物中无余价单质书写为零价硝酸根,氢氧根负一价碳酸根,硫酸根负二价铵根则为正一价K Na Ag H +1价F Cl Br I —1价Ca Mg Ba Zn +2价通常O S —2价二、三Fe 二、四C三Al、四Si、五价P单质通通显零价氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
常见根价口诀:一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
金属活动性顺序表:(初中)钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
(高中)钾钙钠镁铝锰锌、铬铁镍、锡铅氢;铜汞银铂金。
化合价口诀二:一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫都齐;全铜以二价最常见简单的:一价钾钠氯氢银二价氧钙钡镁锌三铝四硅五氮磷二三铁二四碳二四六硫锰七全氢氧铵根负正一氟氯溴碘负一价,正一银氢钾和钠,二镁钙钡铜锌汞,硫有二四六变价。
初中化学元素化合价口诀

初中化学元素化合价口诀化学元素的化合价口诀主要用于记忆元素的化合价规律。
以下是一个常见的初中化学元素化合价口诀:
1. 氢氧氮氟磷硫氯溴碘,都是一价氢氧氮。
2. 氧是二价硫是二四,氮氟磷碘五六七。
3. 硝酸盐氧氟磷硫氯溴碘,氧是一价氟硫是二。
4. 金刚石氮氟磷硫氯,氮是四价硫二三五。
5. 亚硝酸盐硝酸醋酸,亚硝盐一二硝酸五。
6. 氯酸氢氟酸溴酸磷酸,氯二氧酸二一氟磷。
7. 锁亚硫酸锁硫酸,硫二是方锁五硫酸。
这些口诀可以帮助你在化学学习中记忆元素的化合价规律,但仍然建议理解化学原理和反应规律,而不仅仅依赖口诀记忆。
初中知识总结之常见元素化合价、化学式及化学方程式

初中常见化学式一、常见元素原子团化合价口诀元素化合价: 原子团化合价:一价氢氯钾钠银二价氧钙钡镁锌负一硝酸氢氧根三铝四硅五价磷二三铁,二四碳负二硫酸碳酸根二四六硫都齐全铜汞二价最常见负三记住磷酸根条件不同价不同单质为零永不变! 正一价的是铵根常见离子符号:H+ (氢离子)、Na+ (钠离子)、K+ (钾离子) 、Ag+ (银离子)Ca2+ (钙离子)、Mg2+ (镁离子)、Ba2+ (钡离子)、Zn2+ (锌离子)、Cu2+ (铜离子) Fe2+ (亚铁离子)、Fe3+ (铁离子)、Al3+ (铝离子)、NH4+(铵根离子)、NO3-(硝酸根离子)、OH-(氢氧根离子)CO32-(碳酸根离子)、HCO3-(碳酸氢根离子)、MnO4-(高锰酸根离子)、MnO42-(锰酸根离子)、ClO3-(氯酸根离子)、SO42-(硫酸根离子)、SO32-(亚硫酸根离子)、PO43-(磷酸根离子)二、常见单质三、化合物1、氧化物2、其他化合物3、常见有机化合物初中常见的化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O 2 2P 2O 52、氢气在空气中燃烧生成水:2H 2 + O 2 2H 2O3、硫磺在空气(或氧气)中燃烧:S + O 2 SO 24、镁条在空气(或氧气)中燃烧:2Mg + O 2 2MgO5、铁丝在氧气中燃烧:3Fe + 2O 2 Fe 3O 46、木炭在空气(或氧气)中完全燃烧:C + O 2 CO 27、木炭不充分燃烧:2C + O 2 2CO8、一氧化碳燃烧:2CO + O 2 2CO 29、二氧化碳和水反应生成碳酸:CO 2 + H 2O == H 2CO 3 10、二氧化碳通过灼热的炭层:CO 2 + C 2CO 11、生石灰作为干燥剂:CaO + H 2O == Ca(OH)2二、分解反应11、高锰酸钾制氧气:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 12、氯酸钾制氧气:2KClO 3 2KCl + 3O 2↑ 13、双氧水制氧气:2H 2O 2 2H 2O + O 2↑ 14、电解水:2H 2O 2H 2↑+ O 2↑15、碳酸分解:H 2CO 3 H 2O + CO 2↑16、高温煅烧石灰石(工业制取二氧化碳):CaCO 3 CaO +CO 2↑点燃点燃点燃 点燃 点燃 点燃高温 △MnO 2 △MnO 2 通电高温 点燃 点燃三、置换反应17、铜和硝酸银溶液反应:Cu + 2AgNO 3 == 2Ag + Cu(NO 3)2 18、铁和硫酸铜溶液反应:Fe + CuSO 4 == Cu + FeSO 4 19、锌和硫酸反应制取氢气:Zn + H 2SO 4 == ZnSO 4 + H 2↑ 20、铝和稀硫酸反应:2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑ 21、木炭还原氧化铁:3C + 2Fe 2O 3 4Fe + 3CO 2↑木炭还原氧化铜:C + 2CuO2Cu + CO 2↑ 木炭还原四氧化三铁:2C + Fe 3O 4 3Fe +2CO 2↑ 氢气还原氧化铜:H 2 + CuO Cu + H 2O四、复分解反应(一)酸 + 碱 → 盐 + 水22、氢氧化钠与盐酸反应:NaOH + HCl == NaCl + H 2O 23、氢氧化钠与硫酸反应:2NaOH + H 2SO 4 == Na 2SO 4 + 2H 2O 24、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl 3 + 3H 2O 25、氢氧化镁与硫酸反应:Mg(OH)2 + H 2SO 4 == MgSO 4 + 2H 2O(二)酸 + 盐 → 新酸 + 新盐26、盐酸与硝酸银溶液反应:HCl + AgNO 3 == AgCl ↓+ HNO 327、氯化钡溶液与硫酸溶液反应:BaCl 2 + H 2SO 4 == BaSO 4↓+ 2HCl 28、碳酸钠与稀盐酸:Na 2CO 3 + 2HCl == 2NaCl+ H 2O + CO 2↑ 碳酸氢钠与稀盐酸:NaHCO 3 + HCl == NaCl+ H 2O + CO 2↑ 29、石灰石与稀盐酸反应(实验室)制取二氧化碳:CaCO 3+2HCl = CaCl 2+H 2O+CO 2↑(三)碱 + 盐 → 另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应:CuSO 4+2NaOH = Na 2SO 4+Cu(OH)2↓ 31、氯化铁溶液和氢氧化钠溶液反应:FeCl 3+3NaOH==Fe(OH)3↓+3NaCl高温 高温 高温(四)盐 + 盐 → 两种新盐32、硝酸银溶液与氯化钠溶液反应:AgNO 3 + NaCl == AgCl↓+ NaNO 3 33、氯化钡溶液与碳酸钠溶液反应:BaCl 2+ Na 2CO 3 = BaCO 3↓+ 2NaCl(五)金属氧化物 + 酸 → 盐 + 水34、稀盐酸清洗铁锈:6HCl + Fe 2O 3 == 2FeCl 3 + 3H 2O 35、氧化铜与稀硫酸反应:CuO + H 2SO 4== CuSO 4+ H 2O 五、非金属氧化物 + 碱 → 盐 + 水36、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O 37、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O 38、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O 39、氢氧化钠溶液吸收三氧化硫:SO 3 + 2NaOH ==Na 2SO 4+ H 2O六、其他反应类型40、一氧化碳还原氧化铜:CO + CuO Cu + CO 2 41、一氧化碳还原氧化铁:3CO + Fe 2O 3 2Fe + 3CO 2 42、一氧化碳还原四氧化三铁:4CO + Fe 3O 4 3Fe + 4CO 2 43、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O 44、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△点燃点燃 高温 高温附表1 一些常见元素的名称、符号和相对原子质量附表2 一些常见元素、根的化合价和离子符号。
化学元素的化合价

化学元素的化合价
正一价:氢,钾,纳,银,铵根离子。
正二价:钙,镁,钡,锌,铜,亚铁。
正三价:铝,铁。
负一价:氯,氢氧根离子,硝酸根离子。
负二价:氧,硫酸根离子,碳酸根离子。
负三价:磷酸根离子。
常见元素的主要化合价氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
扩展资料:
常见元素化合价顺口溜(一)
钾钠氢银正一价,钙镁锌钡正二价;
氟氯溴碘负一价,通常氧是负二价;
铜正一正二铝正三,铁有正二和正三;
碳有正二和正四,硫有负二正四和正六。
常见元素化合价顺口溜(二)
一价氢锂钾钠银,二价氧镁钙钡锌,铜汞一二铁二三,碳锡铅在二四寻,硫为负二正四六,负三到五氮和磷,卤素负一、一、三、五、七,
三价记住硼、铝、金。
九年级上册化学化合价

九年级上册化学化合价
九年级上册化学化合价主要涉及以下内容:
1. 化合价的定义:化合价是一个元素在化合物中得失电子的数目。
得失电子数目决定了元素的化合价。
2. 常见元素的化合价:
- 一价元素:钾(K)、钠(Na)、氯(Cl)等。
- 二价元素:钙(Ca)、镁(Mg)、铁(Fe)等。
- 三价元素:铝(Al)等。
3. 化合价的表示方法:在化学式中,元素的化合价可以用正负号和数字表示。
例如,NaCl中,钠的化合价为+1,氯的化合价为-1。
4. 化合价与电子配置的关系:元素在形成化合物时,通常会寻求达到稳定的电子配置。
例如,氧(O)的最外层电子数为6,它需要得到2个电子形成稳定的电子配置。
因此,在H2O中,氧的化合价为-2。
5. 化合价与化合物性质的关系:化合价影响了化合物的性质,如稳定性、酸碱性等。
一般来说,金属元素的化合价越高,化合物越稳定;非金属元素的化合价越低,化合物越稳定。
6. 部分化合物的化学式:
- 二氧化碳(CO2)
- 钾(K)
- 氮气(N2)
- 钙氧化物(CaO)
- 氯化钾(KCl)
- 氯化铁(FeCl2)
- 氯化铝(AlCl3)
综上所述,九年级上册化学化合价主要涉及化合价的定义、常见元素的化合价、化合价的表示方法、化合价与电子配置、化合价与化合物性质的关系以及部分化合物的化学式。
初中化学常见元素化合价

初中化学常见元素化合价
哎呀,亲爱的同学们,你们知道吗?初中化学里那些常见元素的化合价可太有意思啦!
就像我们在学校里有不同的班级和座位一样,元素们也都有自己特定的化合价。
比如说,氢元素,它呀,大多数时候的化合价是+1 价。
这就好像氢是个乖巧的小朋友,总是乖乖地站在自己的位置上,化合价+1 就是它的“专属座位”。
再看看氧元素,它通常是-2 价。
这氧元素呀,就像一个稳重的大姐姐,总是坚守着-2 价的位置。
那氯元素呢?它可调皮啦,有时候是-1 价,有时候又是+1、+5、+7 价,这难道不像一个性格多变的小伙伴吗?一会儿这样,一会儿那样。
还有铁元素,哇,它更有趣了!它有+2 价和+3 价。
这就好比铁有两副不同的面孔,有时候是温柔的+2 价,有时候又变成严肃的+3 价。
我们在学习的时候,可不能把这些元素的化合价搞混了哟!不然,就像在一场游戏中找错了伙伴,会全盘皆输的!比如说,写化学方程式的时候,如果搞错了元素的化合价,那整个式子可就全错啦!这难道不可怕吗?
我还记得有一次,老师在课堂上提问关于化合价的问题,我答错了,当时我那个尴尬呀,脸都红得像个熟透的苹果!从那以后,我就下定决心,一定要把这些化合价记得牢牢的。
同学们,你们是不是也有过类似的经历呢?我们可不能被这些小小的化合价给难住了,对吧?
总之,初中化学常见元素的化合价虽然有点复杂,但只要我们用心去记,多做练习,就一定能把它们掌握得妥妥的!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素名称
元素符号
常见化合价
元素名称
元素符号
常见化合价
钾
K
+1
氢
H
+1
钠
Na
+1
氯
Cl
-1 +5 +7
银
Ag
+1
溴
Br
-1
钙
Ca
+2
碘
I
-1
镁
Mg
+2
氧
O
-2
硫
S
-2 +4 +6
钡
Ba
+2
碳
C
+2 +4
锌
Zn
+2
硅
Si
+4
铜
Cu
+2 -1
氮
N
-3 +2 +4 +5
铝
Al
+3
磷
P
+5
铁
MnO4
-1
磷酸根
PO4
-3
磷酸氢根
HPO4
-2
磷酸二氢根
H2PO4
-1
溶解度表
OH-
NO3-
Cl-
SO42-
CO32-?
H+
溶,挥
溶,挥
溶
溶,挥
NH4+
溶,挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+??
不
溶
溶
溶
—
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
—
Cu2+
不
溶
溶
溶
不
Ag+
—
溶
不
微
不
Fe
+2 +3
二、常见原子团化合价原子团
名称原子团
名称
原子团
符号
原子团
化合价
原子团
名称
原子团
符号
原子团
化合价
氢氧根
OH
-1
碳酸氢根
HCO3
-1
硫酸根
SO4
-2磷Βιβλιοθήκη 根PO4-3碳酸根
CO3
-2
亚硫酸根
SO3
-2
硝酸根
NO3
-1
铵根
NH4
+1
醋酸根
CH3COO
-1
氯酸根
ClO3
-1
锰酸根
MnO4
-2
高锰酸根
