初中化学用语(全)
化学用语宝典

化学用语宝典1. 嘿,宝子们!化学用语就像魔法咒语一样,能让你在化学世界里畅通无阻。
比如说化学式,就像人的名字一样,是物质的独特标识。
H₂O,这不就是水嘛,简单又好记。
要是不懂化学用语,就像到了外国却不懂当地语言,只能干瞪眼。
2. 化学用语可是打开化学大门的金钥匙呀!你看化学方程式,那简直就是一场化学物质的“舞蹈编排”。
像2H₂+ O₂= 2H₂O,氢气和氧气就像两个小伙伴,在特定条件下欢快地结合成了水这个新伙伴。
如果不掌握化学用语,就好比厨师不知道菜谱上的菜名,咋做菜呢?3. 哇塞,化学用语是化学世界的密码本呢!离子符号就很神奇。
比如Na⁺,这小小的符号代表着钠离子,它在溶液里就像一个个小战士,带着正电荷,到处游走。
要是不明白这些化学用语,就如同在迷宫里乱撞,根本找不到方向。
4. 哟呵,化学用语里的元素符号是基石中的基石。
像C代表碳,碳可是个超级明星元素。
从钻石到石墨,都是它的变身。
要是不知道元素符号,就像你认识一堆明星,却不知道他们的名字,多尴尬啊。
5. 天哪,化学用语中的化合价就像商品的价格标签。
例如在氧化铁Fe₂O₃里,铁是 +3价,氧是 -2价,这就像规定好了每个元素在这个化合物里的“价值”。
要是搞不懂化合价,就像在市场上乱花钱,根本不知道东西值不值。
6. 嘿,你知道吗?化学用语的结构就像建筑蓝图。
像有机化学里的结构简式,以乙醇CH₃CH₂OH为例,它清楚地告诉我们原子是怎么排列组合的。
要是不懂化学用语,就像建筑工人没有蓝图就盖房子,肯定盖得乱七八糟。
7. 哎呀,化学用语中的化学计量数也很有趣呢。
在反应式3Fe + 2O₂= Fe₃O₄里,3、2、1这些数字就像指挥棒,指挥着反应物和生成物的量。
要是不理解这个,就像乐队里的乐手不看指挥,肯定乱成一锅粥。
8. 哟,化学用语中的官能团就像人的特殊技能。
以-OH(羟基)为例,它让醇类物质有了独特的性质。
要是不知道官能团,就像不知道一个人的特长,无法真正了解这个物质的个性。
化学常见用语

(一)化学用语1.元素符号:氢H 氦He锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne钠Na 镁Mg 铝Al 硅Si 磷P硫S 氯Cl 氩Ar钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 锡Sn 铅Pb (氢H)铜Cu 汞Hg 银Ag 铂Pt 金Au2.化学式:气体:氧气O2氢气H2氮气N2氯气Cl2二氧化碳CO2二氧化硫SO2一氧化碳CO 二氧化氮NO2甲烷CH4氨气NH3氯化氢HCl固体:白色:五氧化二磷P2O 5氧化镁MgO 氯酸钾KClO3碳酸钙CaCO3硫酸钡BaSO4氯化银AgCl 生石灰CaO 熟石灰Ca(OH) 2黑色:木炭C 氧化铜CuO 四氧化三铁Fe3O4二氧化锰MnO2蓝色:胆矾CuSO4 . 5H2O 氢氧化铜Cu(OH) 2绿色:碱式碳酸铜Cu2 (OH) 2CO3红褐色:氧化铁(铁锈)Fe2O3氢氧化铁Fe(OH) 3常见的酸:硫酸H2SO4盐酸HCl 硝酸HNO3碳酸H2CO3常见的碱:氢氧化钠(烧碱,火碱,苛性钠)NaOH 熟石灰Ca(OH) 2常见的盐:氯化钠NaCl 氯化钡BaCl2硝酸银AgNO3碳酸钠(纯碱)Na2CO3氯化铁FeCl33.离子符号:氢离子H+钠离子Na+镁离子Mg2+氯离子Cl--离子Ag+钙离子Ca2+钡离子Ba2+硫离子S2--硝酸根离子NO3--氢氧根离子OH-- 硫酸根离子SO42--碳酸根离子CO32--4.化学方程式:化合反应:木炭充分燃烧:木炭不完全燃烧:硫的燃烧:磷的燃烧:铁丝燃烧:镁条燃烧:氢气燃烧:一氧化碳燃烧:碳还原二氧化碳:二氧化碳与水反应分解反应:加热氯酸钾:加热高锰酸钾:加热碱式碳酸铜:电解水:煅烧石灰石:氢氧化铁受热分解:碳酸分解:氧化汞受热分解:置换反应:锌和稀硫酸反应,镁和稀硫酸反应:铁和稀盐酸反应:木炭还原氧化铜:氢气还原氧化铜:锌和硫酸铜溶液反应:复分解反应:二氧化碳通入澄清石灰水:实验室制取二氧化碳:碳酸钠与盐酸反应:其他反应类型:甲烷燃烧:一氧化碳还原氧化铜:炼铁的原理:(一)化学用语1.元素符号:氢_______ 氦_______锂Li 铍Be 硼B 碳______ 氮______ 氧_____ 氟F 氖_______钠____镁____铝___ 硅_______ 磷_______ 硫_______ 氯______ 氩_______钾______ 钙______ 钠______ 镁______ 铝______ 锌_______ 铁_______锡Sn 铅Pb (氢_______)铜_______ 汞_______ 银_______ 铂Pt 金Au2.化学式:A.气体:氧气_______ 氢气_______ 氮气_______ 氯气_______ 二氧化碳_______ 二氧化硫_______ 一氧化碳_______ 二氧化氮_______甲烷_______ 氨气_______ 氯化氢_______B.常见物质颜色:____色:五氧化二磷_______ 氧化镁_______ 氯酸钾_______ 碳酸钙_______ 硫酸钡_______ 氯化银_______ 生石灰_______ 熟石灰_______镁_______、铝_______、纯铁_______、水银_______、白磷_______、碳酸钙_______、碳酸钡___________色:木炭_______ 氧化铜_______ 四氧化三铁_______ 二氧化锰_______无色:水、金刚石、许多无色溶液、大多数气体。
100个化学用语

100个化学用语1. 元素 (element)2. 化合物 (compound)3. 分子 (molecule)4. 原子 (atom)5. 反应 (reaction)6. 酸 (acid)7. 碱 (base)8. 盐 (salt)9. 溶液 (solution)10. 晶体 (crystal)11. 气体 (gas)12. 液体 (liquid)13. 固体 (solid)14. 离子 (ion)15. 化学键 (chemical bond)16. 反应速率 (reaction rate)17. 摩尔质量 (molar mass)18. 摩尔浓度 (molar concentration)19. 反应平衡 (chemical equilibrium)20. 离子化 (ionization)21. 电离度 (ionization degree)22. 化学式 (chemical formula)23. 反应机制 (reaction mechanism)24. 化学平衡 (chemical balance)25. 比较分析 (comparative analysis)26. 氧化还原反应 (redox reaction)27. 酸碱中和反应 (acid-base neutralization reaction)28. 氧化剂 (oxidizing agent)29. 还原剂 (reducing agent)30. 晶体结构 (crystal structure)31. 电子亲和力 (electron affinity)32. 电离能 (ionization energy)33. 共价键 (covalent bond)34. 极性 (polarity)35. 热力学 (thermodynamics)36. 核化学 (nuclear chemistry)37. 催化剂 (catalyst)38. 光催化 (photocatalysis)39. 量子力学 (quantum mechanics)40. 电子结构 (electronic structure)41. 有机化合物 (organic compound)42. 无机化合物 (inorganic compound)43. 生物化学 (biochemistry)44. 放射性 (radioactive)45. 电解质 (electrolyte)46. 晶体缺陷 (crystal defect)47. 热分析 (thermal analysis)48. 光谱学 (spectroscopy)49. 核磁共振 (nuclear magnetic resonance)50. 红外光谱 (infrared spectroscopy)51. 质谱 (mass spectrometry)52. 光电子能谱 (photoelectron spectroscopy)53. 光谱分析 (spectral analysis)54. 电化学 (electrochemistry)55. 电导率 (conductivity)56. 比色法 (colorimetry)57. 密度 (density)58. 粘度 (viscosity)59. 热容 (heat capacity)60. 摩尔吸光度 (molar absorptivity)61. 晶体学 (crystallography)62. 热力学循环 (thermodynamic cycle)63. 化学动力学 (chemical kinetics)64. 反应速度常数 (rate constant)65. 反应活化能 (activation energy)66. 催化作用 (catalysis)67. 氧化态 (oxidation state)68. 还原态 (reduction state)69. 链式反应 (chain reaction)70. 增溶剂 (cosolvent)71. 电解 (electrolysis)72. 电解槽 (electrolytic cell)73. 化学计量 (stoichiometry)74. 氧化数 (oxidation number)75. 比例法 (proportional method)76. 酸碱指示剂 (acid-base indicator)77. 沉淀 (precipitate)78. 污染物 (pollutant)79. 溶解度 (solubility)80. 毒性 (toxicity)81. 晶体生长 (crystal growth)82. 光催化剂 (photocatalyst)83. 酸碱滴定 (acid-base titration)84. 沸点 (boiling point)85. 熔点 (melting point)86. 比热容 (specific heat capacity)87. 催化剂活性 (catalyst activity)88. 化学反应平衡常数 (chemical equilibrium constant)89. 氧化物 (oxide)90. 电子云 (electron cloud)91. 分子轨道 (molecular orbital)92. 电子转移 (electron transfer)93. 能带 (band)94. 离子晶体 (ionic crystal)95. 配位化合物 (coordination compound)96. 可燃性 (flammability)97. 气液平衡 (gas-liquid equilibrium)98. 表面张力 (surface tension)99. 热解 (pyrolysis)100. 溶剂 (solvent)。
初中化学用语汇总

初中化学用语汇总1. 原子:构成分子的最小粒子。
2. 元素:由同种原子组成的物质。
4. 分子:由两个及以上原子组成的不带电荷的粒子。
6. 原子量:一个原子质量单位。
8. 周期表:元素根据其原子核结构的排列方式排列的表格。
9. 金属:具有良好的导电性和热传导性质的物质。
11. 金属元素:处于周期表左侧的元素。
16. 原子核:由质子和中子组成的原子中心部分。
17. 共价键:由电子对共享形成的键。
18. 离子键:带正电荷和负电荷之间的相互作用。
21. 化学键:元素通过共享或转移电子形成的化学物质的力。
22. 化学式:用元素符号表示化合物的组成。
23. 反应物:在化学反应中参与反应的物质。
25. 化学反应:物质之间的化学相互作用。
26. 酸:会释放出氢离子的物质。
28. 盐:由阳离子和阴离子组成的离子化合物。
30. 溶解:由固体或气体转变为液体。
31. 溶质:溶解在溶剂中的物质。
34. 沉淀:在溶液中形成的固体颗粒。
36. 电离:在溶液中将电解质分解为离子。
39. 化学平衡:反应物和生成物在化学反应中达到平衡状态。
40. 配位化合物:由中心金属离子和其它分子和离子中的原子和分子共价结合而成的化合物。
41. 化学式计算:根据化学式计算元素的质量。
42. 摩尔质量:化学式中一个摩尔的质量。
43. 密度:单位体积内的物质质量。
44. 燃烧:化合物与氧气彻底反应的化学反应。
46. 温度:温度代表了物体内部分子的平均运动速度。
47. 热力学系统:研究热和压力与化学反应之间的关系。
48. 热能:热能是物体或系统储存的能量。
49. 热动力学:热的能量学,研究物质内部热运动的规律。
50. 热量:由于温度差异而流动的能量。
51. 热容:物质单位质量的温度变化时吸收或释放的热量。
52. 热传导:热能通过物质的传递。
53. 热平衡:两个物体之间热能的交换达到相同的温度。
54. 热力学第一性原理:能量守恒。
55. 内能:热力学系统内分子内部相互作用引起的能量总和。
(完整版)初三化学全册必背知识点(精华)

初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根铵根OH- NO3- CO32- SO4 2- NH4+2、(1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2) 常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑(4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl= ZnCl2 +H2↑(6)电解水制取氢气: 2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (Fe与盐、酸反应都生成的是+2价亚铁离子)(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2 (Fe2O3与酸反应生成的是+3价铁离子)(9)熟灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱: K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au 。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O42、红色固体:Cu、Fe2O3、红磷▲硫磺:淡黄色▲绿色:碱式碳酸铜(铜锈,俗称铜绿)3、溶液的颜色:含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈棕黄色(如FeCl3溶液),其余溶液一般为无色。
九年级常见化学用语和化学方程式

九年级常见化学用语和化学方程式五、课本中的化学方程式:第二单元:1、红磷在氧气中燃烧4 P + 5 O2 2 P2O52、碳在氧气中燃烧 C + O2CO23、硫在氧气中燃烧S + O2 SO24、铁在氧气中燃烧 3 Fe + 2 O2Fe3O45、铝在氧气中燃烧 4 Al + 3 O2 2 Al2O36、用过氧化氢制氧气 2 H2O2 2 H2O + O2↑7、用高锰酸钾制氧气2KMnO4K2MnO4+ MnO2+ O2↑8、用氯酸钾和二氧化锰的混合物制氧气 2 KClO3 2 KCl + 3 O2↑第三单元:9、水通电分解(电解水) 2 H2O 2 H2↑+ O2↑10、汞受热2Hg+O22HgO11、氧化汞受热分解2HgO2Hg+O2↑12、氢气在空气中燃烧 2 H2 + O2 2 H2O13、氢气还原氧化铜H2 + CuO Cu + H2O第四单元:第五单元:14、铁和硫酸铜溶液反应Fe + CuSO 4FeSO4 + Cu15、碳酸钠和盐酸反应Na 2CO3+2HCl2NaCl+H2O+CO2↑16、镁条在空气中燃烧 2 Mg + O2 2 MgO17、高温煅烧石灰石(二氧化碳的工业制法)CaCO3CaO + CO2↑第六单元:2 CO18、碳在氧气中不充分燃烧 2 C + O2 (不足)19、碳跟氧化铜反应 C + 2 CuO 2 Cu + CO2↑20、碳跟氧化铁反应 3 C + 2 Fe2O3 4 Fe + 3 CO2 ↑21、碳跟二氧化碳反应C+CO22CO+ 2HCl CaCl2 + CO2↑+ H2O22、实验室制取二氧化碳CaCO23、二氧化碳与水反应CO 2 + H2O H2CO324、碳酸分解H 2CO3CO2 ↑+ H2O25、二氧化碳与氢氧化钙溶液反应(二氧化碳的检验方法)CO 2 + Ca(OH)2CaCO3↓+ H2O26、一氧化碳燃烧 2 CO + O2 2 CO227、一氧化碳还原氧化铜CO +CuO Cu + CO228、一氧化碳还原氧化铁 3 CO +Fe2O3 2 Fe + 3 CO2第七单元:29、甲烷燃烧CH4 + 2 O2CO2 + 2 H2O30、酒精燃烧C2H5OH + 3 O2 2 CO2 + 3 H2O第八单元:31、镁和稀盐酸反应镁和稀硫酸反应Mg + 2 HCl MgCl+ H2↑Mg + H2SO4MgSO4 + H2↑32、锌和稀盐酸反应锌和稀硫酸反应(实验室制取氢气)Zn + 2 HCl ZnCl+ H2↑Zn + H2SO4ZnSO4 + H2↑33、铁和稀盐酸反应铁和稀硫酸反应+ H2↑Fe + H2SO4FeSO4 + H2↑Fe + 2 HCl FeCl34、铝和稀盐酸反应铝和稀硫酸反应+3H2↑2Al+ 3H2SO4Al2(SO4)3 +3 H2↑2Al+6HCl2AlCl35、铝和硫酸铜溶液反应 2 A l + 3 CuSO 4Al2(SO4)3 + 3CuCu(NO3)2 + 2 Ag36、铜和硝酸银溶液反应Cu + 2 AgNO第十单元:37、铁锈与稀盐酸反应铁锈与稀硫酸反应FeO3+6HCl2FeCl3+3H2O Fe2O3+3H2SO4Fe2(SO4)3+3H2O38、氧化铜与稀硫酸反应H2SO4+ CuO Cu SO4+ H2O39、氧化钙与水的反应CaO+HO Ca(OH)240、氢氧化钠溶液与二氧化碳反应2NaOH+CO 2Na2CO3+H2O41、二氧化硫与氢氧化钠溶液反应2NaOH+SO 2Na2SO3+H2O42、三氧化硫与氢氧化钠溶液反应2NaOH+SO 3Na2SO4+H2O43、氢氧化钠与盐酸反应氢氧化钠与硫酸反应NaOH+HCl NaCl+H 2O 2NaOH+H2SO4Na2SO4+H2O44、氢氧化钙与盐酸反应氢氧化钙与硫酸反应+2HCl CaCl2+2H2O Ca(OH)2+H2SO4CaSO4+2H2OCa(OH)第十一单元:45、碳酸氢钠与盐酸反应NaHCO 3+HCl NaCl+H2O+CO2↑CO3+Ca(OH)2CaCO3↓+2NaOH46、碳酸钠溶液与氢氧化钙溶液反应Na初中化学常见物质的颜色(后面是物质化学式或物质名称,前面是颜色)1. 常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
化学用语汇总

一、物质的化学名称、俗名和化学式汞(水银)Hg 硫(硫磺)S 氧化钙(生石灰)CaO 固体二氧化碳(干冰)CO2氧化铁(铁锈的主要成分)Fe2 O 3 碳酸钙(大理石、石灰石的主要成分)CaCO3碱式碳酸铜(铜绿)Cu2 (OH)2 CO3氯化钠(食盐)NaCl 甲烷(沼气)CH4乙醇(酒精)C2 H5 OH 乙酸(醋酸)CH3 COOH碳酸钠(纯碱)Na2 CO3 硫酸铜晶体(蓝矾、胆矾)CuSO4·5H2O氢氧化钠(烧碱、火碱、苛性钠)NaOH 氢氧化钙(熟石灰、消石灰)Ca(OH)2水煤气:氢气和一氧化碳的混合物爆鸣气:氢气和氧气的混合物二、物质的化学式A 单质:由同种(或一种)元素组成的纯净物。
1、金属单质钡钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金Ba K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au2、非金属单质氢气H2 氧气O2氮气N2氯气Cl2氟气(F2)溴(Br2 ) 碘(I2)碳C 硅Si 磷P 硫S 臭氧(O3)3、稀有气体氦气He 氖气Ne 氩气ArB 化合物:由不同种元素组成的纯净物。
(一)有机物:含碳元素的化合物(除CO、CO2和CO32-的化合物)甲烷 CH4 乙醇C2H5OH 甲醇 CH3OH 乙酸 CH3 COOH 乙炔 C2 H2尿素CO(NH2)2(二)氧化物:由两种元素组成,其中一种是氧元素的化合物。
1、非金属氧化物(大部分非金属氧化物通常是酸性氧化物,跟水化合成同价的含氧酸)水一氧化碳二氧化碳二氧化硅五氧化二磷二氧化硫三氧化硫H2 O CO CO2 SiO2 P2 O5 SO2 SO32、金属氧化物氧化钡氧化钾氧化钙氧化钠氧化镁氧化铝氧化锌BaO K2 O CaO Na2 O MgO Al2 O3 ZnO 氧化铁氧化亚铁四氧化三铁氧化铜氧化亚铜氧化汞氧化银二氧化锰Fe2 O3 FeO Fe3 O4 CuO Cu2 O HgO Ag2 O MnO2(三)酸:名称中最后一个字是“酸”,通常化学式的第一种元素是“H ”硫酸盐酸硝酸磷酸氢硫酸碳酸亚硫酸H2 SO4 HCl HNO3 H3 PO4 H2 S H2 CO3 H2 SO3(四)碱:由金属离子和氢氧根离子构成,碱的名称通常有“氢氧化某”化学式的最后面是“OH”(五)盐:由金属离子和酸根离子构成碱 1、碳酸盐 2、硫酸盐 3、硝酸盐 4.氯化物 5.亚硫酸盐氢氧化钾碳酸钾硫酸钾硝酸钾氯化钾亚硫酸钾KOH K2 CO3 K2SO4 KNO3 KCl K2SO3氢氧化钠碳酸钠硫酸钠硝酸钠氯化钠亚硫酸钠NaOH Na2 CO3 Na2SO4 NaNO3 NaCl Na2SO3碳酸银硫酸银硝酸银氯化银Ag2 CO3 Ag2 SO4 AgNO3 AgCl氨水碳酸铵硫酸铵硝酸铵氯化铵NH3 ·H2 O NH4)2 CO3(NH4)2SO4 NH4 NO3 NH4 Cl氢氧化钙碳酸钙硫酸钙硝酸钙氯化钙亚硫酸钙Ca(OH)2 CaCO3 CaSO4 Ca(NO3)2 CaCl2 CaSO3氢氧化钡碳酸钡硫酸钡硝酸钡氯化钡Ba(OH)2 BaCO3 BaSO4 Ba(NO3 )2 BaCl2氢氧化镁碳酸镁硫酸镁硝酸镁氯化镁Mg(OH)2 MgCO3 MgSO4 Mg(NO3 )2 MgCl2氢氧化铜碳酸铜硫酸铜硝酸铜氯化铜Cu(OH)2 CuCO3 CuSO4 Cu(NO3 )2 CuCl2氢氧化锌碳酸锌硫酸锌硝酸锌氯化锌Zn(OH)2 ZnCO3 ZnSO4 Zn(NO3 )2 ZnCl2硝酸汞氯化亚铜Hg(NO3)2 CuCl氢氧化亚铁碳酸亚铁硫酸亚铁硝酸亚铁氯化亚铁Fe(OH)2 FeCO3 FeSO4 Fe(NO3 )2 FeCl2氢氧化铁硫酸铁硝酸铁氯化铁Fe(OH)3 Fe2(SO4)3 Fe(NO3 )3 FeCl3氢氧化铝硫酸铝硝酸铝氯化铝Al(OH)3 Al2(SO4)3 Al(NO3 )3 AlCl36、酸式盐(多元酸里的氢部分被金属取代,H夹在中间)碳酸氢钠NaHCO3,碳酸氢钙Ca(HCO3 )2磷酸二氢钠NaH2 PO4磷酸二氢钾KH2 PO4硫酸氢钠NaHSO4,硫酸氢钾KHSO47、碱式盐(化学式的中间有“OH”):碱式碳酸铜Cu2(OH)2 CO38、其他盐高锰酸钾KMnO4 锰酸钾K2MnO4 氯酸钾KClO3硫化钠Na2 S碘酸钾 KIO3亚硝酸钠NaNO2硫化钾K2S初中化学方程式一、化合反应1、木炭在氧气中燃烧(氧气充足):C+O2CO22、木炭在氧气中燃烧(氧气不充足):2C+ O2 2CO3、铁丝在氧气中燃烧:3Fe+2O2Fe3O44、氢气在空气中燃烧:2H2+O22H2O5、硫在空气中燃烧: S+O2SO26、磷在空气中燃烧:4P+5O22P2O57、镁带在空气中燃烧:2 Mg+O22MgO 8、铜在空气中加热: 2Cu+O2 2CuO9、一氧化碳在空气中燃烧:2CO+ O2 2CO2 10、铝与氧气反应形成保护膜:4Al+3O2===2Al2O311、二氧化碳与水的反应:CO2+H2O=== H2CO3 12、二氧化硫与水的化合:SO2+H2O=== H2SO3 (亚硫酸)13、生石灰与水化合:CaO+H2O===C a(O H)2(放热)二、分解反应14、加热氯酸钾和二氧化锰的混合物:2KClO32KCl+3O2↑15、加热高锰酸钾制氧气:2KMnO4K2MnO4+MnO2+O2↑实验室制取氧气MnO216、用过氧化氢制氧气:2H2O2 2H2O+O2↑17、高温煅烧石灰石:CaCO3 CaO+CO2↑18、碳酸不稳定分解:H2CO3 === H2O+CO2↑ 19、电解水:2H2O 2H2↑+O2↑三、置换反应20、锌和稀硫酸反应(实验室制取氢气):Zn+H2SO4===ZnSO4+H2↑21、铁和稀硫酸:Fe+H2SO4===FeSO4+H2↑22、镁和稀硫酸:Mg+H2SO4===MgSO4+H2↑23、铝和稀硫酸:2Al+3H2SO4===Al2(SO4)3+3H2↑24、锌和稀盐酸反应:Zn+2HCl===ZnCl2+H2↑25、铁和稀盐酸:Fe+2HCl===FeCl2+H2↑26、镁和稀盐酸:Mg+2HCl===MgCl2+H2↑27、铝和稀盐酸:2Al+6HCl===2AlCl3+3H2↑28、氢气还原氧化铜:H2+CuO Cu+H2O29、木炭还原氧化铜:C+2CuO2Cu+CO2↑30、铁和蓝色硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu31、铜与硝酸银溶液反应:Cu+2AgNO3===2Ag+Cu(NO3)2四、复分解反应32、用石灰石与稀盐酸制取二氧化碳:CaCO3+2HCl===CaCl2+H2O+CO2↑(实验室制取二氧化碳)33、稀盐酸和碳酸钠反应:2HCl+Na2CO3===2NaCl+H2O+CO2↑34、稀盐酸和碳酸氢钠反应:HCl+NaHCO3===NaCl+H2O+CO2↑35、稀盐酸和碳酸钾(草木灰的成分):2HCl+K2CO3===2KCl+H2O+CO2↑36、稀盐酸和氢氧化钠:HCl+NaOH===NaCl+H2O37、稀盐酸和氢氧化钙:2HCl+Ca(OH)2===CaCl2+2H2O38、氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3===AlCl3+3H2O39、稀硫酸和氢氧化钠:H2SO4+2NaOH===Na2SO4+2H2O40、硫酸和氢氧化钙:H2SO4+Ca(OH)2===CaSO4+2H2O41、稀盐酸除铁锈:6HCl+Fe2O3===2FeCl3+3H2O42、氧化铜与稀盐酸反应:2HCl+CuO===CuCl2+H2O43、稀硫酸除铁锈:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O44、硫酸和硝酸钡:H2SO4+Ba(NO3)2===BaSO4↓+2HNO345、硫酸和碳酸钾:H2SO4+K2CO3===K2SO4+H2O+CO2↑↓+2KNO346、硝酸钡和碳酸钾:Ba(NO3)2+K2CO3=== BaCO347、氢氧化钠与硫酸铜溶液:CuSO4+2NaOH===Cu(OH)2↓(蓝色)+Na2SO448、氢氧化钠与氯化铁溶液:3NaOH+FeCl3===Fe(OH)3↓(红褐色)+3NaCl49、碳酸钠与石灰水:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH50.硝酸银溶液与盐酸: AgNO3 + HCl ===AgNO3↓+HNO351、硝酸铵与氢氧化钠:NH4NO3 + NaOH = NaNO3 + NH3 ↑ + H2O五、其他类型反应52、二氧化碳与澄清石灰水的反应:CO2+Ca(OH)2===CaCO3↓+H2O53、苛性钠在空气中变质:2NaOH+CO2===H2O+Na2CO354、苛性钠吸收二氧化硫气体:2NaOH+SO2===H2O+Na2SO3 (亚硫酸钠)55、烧碱溶液和三氧化硫反应:2NaOH+SO3===H2O+Na2SO456、一氧化碳还原氧化铜:CO+CuO Cu+CO257、一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO258、一氧化碳还原四氧化三铁:4CO+Fe3O4 3Fe+4CO259、甲烷在空气中燃烧:CH4+2O2CO2+2H2O60、酒精在空气中燃烧:C2H5OH+3O22CO2+3H2O一、化合反应1、木炭在氧气中燃烧(氧气充足):2、木炭在氧气中燃烧(氧气不充足):3、铁丝在氧气中燃烧:4、氢气在空气中燃烧:5、硫在空气中燃烧:6、磷在空气中燃烧:7、镁带在空气中燃烧:8、铜在空气中加热:9、一氧化碳在空气中燃烧:10、铝与氧气反应形成保护膜:11、二氧化碳与水的反应:12、二氧化硫与水的化合:13、生石灰与水化合:二、分解反应141516、用过氧化氢制氧气:氧气17、高温煅烧石灰石:18、碳酸不稳定分解:19、电解水:三、置换反应20、锌和稀硫酸反应(实验室制取氢气):21、铁和稀硫酸:22、镁和稀硫酸:23、铝和稀硫酸:24、锌和稀盐酸反应:25、铁和稀盐酸:26、镁和稀盐酸27、铝和稀盐酸:28、氢气还原氧化铜:29、木炭还原氧化铜:30、铁和蓝色硫酸铜溶液反应:31、铜与硝酸银溶液反应:四、复分解反应32、用石灰石与稀盐酸制取二氧化碳:(实验室制取二氧化碳)33、稀盐酸和碳酸钠反应:34、稀盐酸和碳酸氢钠反应:35、稀盐酸和碳酸钾(草木灰的成分):36、稀盐酸和氢氧化钠:37、稀盐酸和氢氧化钙:38、氢氧化铝药物治疗胃酸过多:39、稀硫酸和氢氧化钠:40、硫酸和氢氧化钙:41、稀盐酸除铁锈:42、氧化铜与稀盐酸反应:43、稀硫酸除铁锈:44、硫酸和硝酸钡:45、硫酸和碳酸钾:46、硝酸钡和碳酸钾47、氢氧化钠与硫酸铜溶液:48、氢氧化钠与氯化铁溶液:49、碳酸钠与石灰水:50.硝酸银溶液与盐酸:51.硝酸铵与氢氧化钠:五、其他类型反应52、二氧化碳与澄清石灰水的反应:53、苛性钠在空气中变质54、苛性钠吸收二氧化硫气体:55、烧碱溶液和三氧化硫反应:56、一氧化碳还原氧化铜57一氧化碳还原氧化铁:58、一氧化碳还原四氧化三铁:59、甲烷在空气中燃烧60、酒精在空气中燃烧:。
化学用语集锦
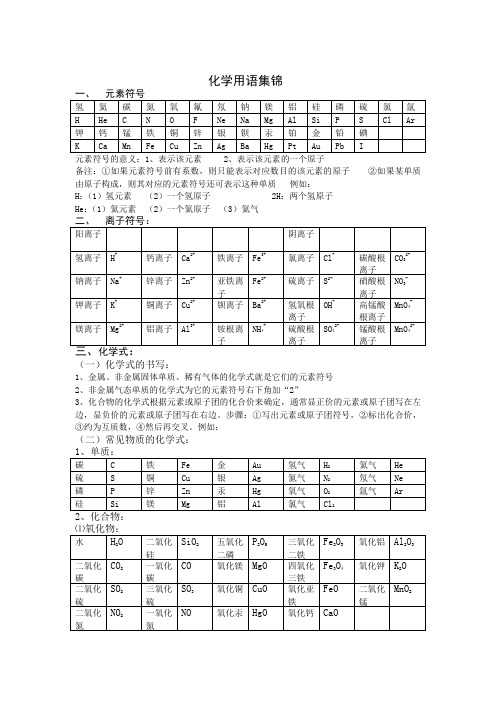
化学用语集锦
元素符号的意义:1、表示该元素 2、表示该元素的一个原子
备注:①如果元素符号前有系数,则只能表示对应数目的该元素的原子②如果某单质由原子构成,则其对应的元素符号还可表示这种单质例如:
H:(1)氢元素(2)一个氢原子 2H:两个氢原子
He:(1)氦元素(2)一个氦原子(3)氦气
(一)化学式的书写:
1、金属、非金属固体单质、稀有气体的化学式就是它们的元素符号
2、非金属气态单质的化学式为它的元素符号右下角加“2”
3、化合物的化学式根据元素或原子团的化合价来确定,通常显正价的元素或原子团写在左边,显负价的元素或原子团写在右边。
步骤:①写出元素或原子团符号,②标出化合价,③约为互质数,④然后再交叉。
例如:
(二)常见物质的化学式:
其他:过氧化氢 H2O2甲烷 CH4乙醇 C2H5OH 醋酸CH3COOH 葡萄糖C6H12O6尿素 CO(NH2)2
常见物质的俗名、名称、化学式
学名俗名化学式学名俗名化学式
汞水银Hg 硫硫磺S
氧化钙生石灰CaO 二氧化碳固干冰CO2
氢氧化钙熟石灰、消石灰Ca(OH)2氢氧化钠烧碱、火碱、苛性钠NaOH
氯化钠食盐NaCl 碳酸钠纯碱Na2CO3
甲烷沼气CH4乙醇酒精C2H5OH
乙酸醋酸CH3COOH 碱式碳酸铜铜绿Cu2(OH)2CO3。
初三化学常化学用语必背

初三化学常化学用语必背“化学是一门记忆加实验的科学”,这也许不太符合一些同学的思维习惯。
下面是小偏整理的初三化学常化学用语必背,感谢您的每一次阅读。
初三化学常化学用语必背一、熟记下列元素名称及符号: 1、H氢O氧 N氮 Cl氯 C碳 P 磷 S硫 2、K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag 银 Mn锰 Ba钡二、熟记下列物质的化学式: 1、单质: H2氢气 O2氧气 N2氮气 C碳 P磷 S硫 Fe铁 Cu铜 Hg汞 2、化合物 (1)氧化物:H2O水CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫P2O5五氧化二磷 Fe2O3氧化铁Fe3O4四氧化三铁 CaO氧化钙 MgO氧化镁 CuO氧化铜 ZnO氧化锌 FeO氧化亚铁MnO2二氧化锰-Na2O氧化钠(2)酸:HCl盐酸H2SO4硫酸HNO3硝酸 H2CO3碳酸 -H2SO3亚硫酸(3)碱:NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡 Cu(OH)2氢氧化铜Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁(4)盐:NaCl氯化钠Na2CO3碳酸钠NaHCO3碳酸氢钠 CaCO3碳酸钙 CaCl2氯化钙 KCl氯化钾ZnCl2氯化锌AgCl氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝 BaCl2氯化钡 Na2SO4硫酸钠CuSO4硫酸铜FeSO4硫酸亚铁Fe2(SO4)3硫酸铁ZnSO4硫酸锌BaSO4硫酸钡KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾KNO3硝酸钾 Ag NO3硝酸银 Cu(NO3)2硝酸铜-NH4Cl氯化铵-NH4NO3硝酸铵-(NH4)2SO4硫酸铵- NH4HCO3碳酸氢铵(5)有机物:CH4甲烷C2H5OH乙醇(酒精) C6H12O6葡萄糖(C6H10O5)n淀粉 -CO(NH2)2尿素三、熟记下列元素在化合物中的化合价:(1) 正价(多为金属)+1 +1 +1 +1 +2 +2 +2 +2 +2 +3 +2 +3 H K Na Ag Ca Mg Zn Ba Cu Al Fe(FeO) Fe(Fe2O3) (2) 负价(非金属)-2 -1 -2 O Cl S (3) 原子团+1 -1 -1 -1 -1 -2 -2 -2 -3 -1 NH4 OH NO3 ClO3 MnO4(KMnO4) CO3 SO4 SO3 PO4 HCO3四、熟记下列常用离子(比较与相应化合价的联系)(1)阳离子H+ K+ Na+ Ca2+ Fe2+ Mg2+ Cu2+ Fe3+(2)阴离子Cl- OH - NO3- CO32- SO4 2-五、熟记下列化学方程式:(一)化合反应(A+B→C):1、木炭在氧气中燃烧:C+O2 点燃CO2 2、硫在氧气中燃烧:S+O2 点燃SO2 3、镁在空气中燃烧:2Mg+O2 点燃 2MgO 4、铁在氧气中燃烧: 3Fe+2O2 点燃 Fe3O4 5、磷在氧气中燃烧:4P+5O2 点燃2P2O5 6、铜在空气中加热:2Cu+O2 △ 2CuO 7、氢气在氧气中燃烧:2H2+O2 点燃 2H2O8、一氧化碳在空气中燃烧:2CO+O2 点燃2CO2 9、碳不充分燃烧:2C+O2(不充分)点燃2CO 10、二氧化碳通过灼热的碳层:CO2 + C 高温2CO 11、二氧化碳与水反应:CO2+H2O === H2CO3-12、三氧化硫溶于水:SO3+H2O === H2SO4 (酸雨的成因)13、生石灰和水化合:CaO+H2O === Ca(OH)2(二)分解反应(C→A+B):14 过氧化氢用二氧化锰作催化剂分解(实验室制O2):2H2O2 2 H2O + O2↑15、氯酸钾与二氧化锰共热(实验室制O2):2KClO3 2KCl+3O2↑ 16、加热高锰酸钾:2KMn O4 △ K2MnO4 + MnO2 + O2↑ 17、电解水:2H2O通电2H2↑ + O2↑18、碳酸不稳定分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石:CaCO3 高温 CaO + CO2↑-20、氢氧化铜受热分解:Cu(OH)2 △ CuO + H2O(三)置换反应(A+BC→B+AC):21、锌和稀硫酸反应(实验室制H2):Zn+H2SO4 === ZnSO4 + H2↑ 22、锌和盐酸的反应:Zn+2HCl === ZnCl2 + H2↑ 23、铁和盐酸: Fe+2HCl === FeCl2 + H2↑ 24、铁和稀硫酸:Fe+H2SO4 === FeSO4 + H2↑ 25、氢气还原氧化铜:H2+CuO △ Cu + H2O26、氢气还原氧化铁:3H2 + Fe2O3 △ 2Fe + 2H2O27、木炭还原氧化铜:C+2CuO高温2Cu + CO2↑ 28、焦碳还原氧化铁:3C+2Fe2O3 高温4Fe+3CO2↑ 29、铁和硫酸铜溶液:Fe + CuSO4 === Cu + FeSO4 30、铜和硝酸银溶液:Cu + 2AgNO3 === 2Ag + Cu(NO3)231、铝和稀硫酸:2Al+3H2SO4 === Al2(SO4)3 + 3H2↑32、铝和硫酸铜溶液:2Al + 3CuSO4 === 3Cu + Al2(SO4)3-33、钠和水反应:2Na+2H2O === 2NaOH+H2↑(四)复分解反应(AB+CD→AD+CB):34、大理石和稀盐酸(实验室制CO2):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 35、碳酸钠和盐酸(灭火器原理):Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑36、碳酸氢钠和盐酸:NaHCO3 + HCl === NaCl + H2O + CO2↑37、碳酸钾(草木灰)和盐酸:K2CO3 + 2HCl === 2KCl + H2O + CO2↑38、盐酸和氢氧化钠(中和反应):HCl + NaOH === NaCl + H2O 39、硫酸和氢氧化钠溶液:H2SO4 + 2NaOH === Na2SO4 + 2H2O 40、硫酸与氯化钡溶液:H2SO4 + BaCl2 === BaSO4↓(白)+ 2HCl 41、盐酸与硝酸银溶液:HCl + AgN O3 === AgCl↓(白)+ HNO342、氢氧化钠和硫酸铜:2NaOH+CuSO4 === Cu(OH)2↓(蓝色) + Na2SO443、氢氧化钠和氯化铁溶液:3NaOH+FeCl3 === Fe(OH)3↓(红褐色)+ 3NaCl44、碳酸钠和石灰水:Na2CO3 + Ca(OH)2 === CaCO3↓ + 2NaOH45、硫酸钠和氯化钡:Na2SO4 + BaCl2 === BaSO4↓ + 2NaCl 46、氯化钠和硝酸银:NaCl + AgNO3 === AgCl↓ + NaNO347、氢氧化铝和盐酸(中和胃酸):Al(OH)3 + 3HCl === AlCl3 + 3H2O 48、氢氧化镁和盐酸(去除水垢):Mg(OH)2 + 2HCl === MgCl2 + 2 H2O 49、盐酸除铁锈:Fe2O3 + 6HCl === 2FeCl3 + 3H2O 50、氧化铜和硫酸:CuO + H2SO4 === CuSO4 + H2O -51、硝酸铵和氢氧化钠:NH4NO3 + NaOH △ NaNO3 + H2O + NH3↑(五)其他:52、二氧化碳使澄清石灰水变浑浊(实验室用于鉴定CO2):CO2 + Ca(OH)2 === CaCO3↓ + H2O 53、二氧化碳通入氢氧化钠溶液(实验室用于吸收CO2): CO2 + 2NaOH === Na2CO3 + H2O 54、用氢氧化钠溶液吸收三氧化硫:SO3 + 2NaOH === Na2SO4 + H2O 55、一氧化碳还原氧化铜:CO + CuO △ Cu + CO256、一氧化碳还原氧化铁(炼铁):3CO + Fe2O3 高温 2Fe + 3CO257、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 58、乙醇在空气中燃烧:C2H5OH+3O2 点燃 2CO2+3H2O-59、葡萄糖在人体组织中氧化:C6H12O6 + 6O2 =酶6CO2+6H2O化学学习经典方法技巧一:形成网络,优化忆技巧二:突出关键,浓缩记忆技巧三:分析对比,理解记忆技巧四:形象比喻,增强记忆技巧五:口诀韵语,灵活记忆技巧六:前后联想,巩固记忆“化学是一门记忆加实验的科学”,这也许不太符合一些同学的思维习惯。
初中化学用语(全)

初中化学方程式总结一、化合反应:“多变一”2、红磷燃烧:522O P 2O 5P 4点燃+3、硫的燃烧:22SO O S 点燃+4、铁在氧气中燃烧:432O e F O 2e F 3点燃+5、镁的燃烧:O Mg 2O 2Mg 2点燃+6、铝的燃烧:322O Al 2O 34Al 点燃+7、铜在空气中加热:O Cu 2O Cu 22△+8、氢气的燃烧:O H 2O 2H 222点燃+9、木炭燃烧:22CO O C 点燃+10、碳在不足量氧气中燃烧:CO 2O C 22点燃+11、一氧化碳的燃烧:22CO 2O CO 2点燃+12、二氧化碳溶于水:13、生石灰遇水反应:二、分解反应:“一变多”1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2Og H 2△ 2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 23、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热++−−→− 4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→− ↑+↑222O H 2O2H 通电6、碳酸分解: 二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:水二氧化碳氧化铜碱式碳酸铜加热++−−→−8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温 10、碳酸氢钠分解:氧气铝氧化铝通电+−−→− ↑++22323CO Na 2Na CO O H HCO V11、碳酸氢铵分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+2O Hg 2Og H 2△(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”1、 氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+3、 氢气还原氧化铁:铜二氧化碳氧化铜碳高温+−−→−+4、 碳还原氧化铁:铜二氧化碳氧化铜碳高温+−−→−+金属活动顺序:5、 镁与稀盐酸反应:氢气氯化镁盐酸镁+→+6、 铝与稀盐酸反应:氢气氯化铝盐酸铝+→+7、 锌与稀盐酸反应:氢气氯化锌盐酸锌+→+8、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+9、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+10、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+11、 铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+(四)、复分解反应:1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁+→+6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸+→+7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸+→+8、硝酸与氢氧化铜反应:水硝酸铜氢氧化铜硝酸+→+9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡+→+9、氯化钡与碳酸钠反应:氯化钠碳酸钡碳酸钠氯化钡+→+10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+(五)、其他反应:1、汽车尾气催化转换:氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯 22d P t P N CO 2NO2CO 2++,2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):水碳酸钙氢氧化钙二氧化碳+→+3、大理石与盐酸反应:二氧化碳水氯化钙盐酸碳酸钙++→+4、甲烷(天然气的主要成分)燃烧:水二氧化碳氧气甲烷点燃+−→−+O H 2CO O 2CH 2224++点燃5、一氧化碳还原氧化铁: 二氧化碳铁一氧化碳氧化铁高温+−−→−+ 232CO 32Fe COO e F ++高温 6、一氧化碳还原氧化铜:二氧化碳铜一氧化碳氧化铜加热+−−→−+ 2CO u C CO CuO ++加热10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△++−→−+(NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O + NH 3·H 2O7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶+−→−+。
初中化学用语(全)

初中化学用语总结
一、单质
1、由原子直接构成的单质:
2、由分子构成的物质
(1)金属单质,如:Na 钠Cu 铜Mg 镁Zn 锌Al 铝Ag 银
K 钾Ba 钡Ca 钙Pt 铂Mn 锰Hg 汞Fe 铁Au 金(2)非金属固体:
C 碳
S 硫
P 磷
(3)稀有气体:
He 氦气
Ne 氖气
Ar 氩气
H2氢气
N2氮气
O2 氧气
O3臭氧
Cl2氯气
(一)、化合反应:“多变一”
1磷燃烧: 五氧化二磷氧气磷点燃
−−→−+ 522O P 2O 5P 4点燃+ 2硫的燃烧: 二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+
3铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+ 4镁的燃烧: 氧化镁氧气镁点燃
−−→−+ O Mg 2O 2Mg 2点燃+ 5铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+
6铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+ 7氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 8木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+
(二)、分解反应:“一变多”
1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2O
g H 2△ 2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 2
3、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热
++−−→−
4、氯酸钾与二氧化锰混合加热:。
初中化学用语

-1 O PO4
+1 NH4
七、1-20 号元素的原子结构示意图:
八、化学式: 单质:氢气 H2 化合物: 氧化物: 一氧化碳 二氧化锰 氧化镁 酸:盐酸 HCl NaOH CO MnO2 二氧化碳 三氧化二铁 CaO H2SO4 CO2 Fe2O3 五氧化二磷 四氧化三铁 Al2O3 碳酸 P2O5 Fe3O4 二氧化硫 SO2 氧气 O2 氮气 N2 氯气 Cl2 氖气 Ne 碳 C 铜 Cu 铁 Fe
钠离子 氟离子
Na+ F—
锌离子 Zn2+ 氮离子 N3—
硫酸根离子 硝酸根离子
CO32— OH—
【高锰酸根离子 MnO4—】 【碳酸氢根离子 HCO3—】
三、写出下列符号的意义: O O2
-
氧元素;一个氧原子
2O
2 个氧原子
2O2
2 个氧分子
氧气这种物质;氧气由氧元素组成;一个氧分子,一个氧分子由 2 个氧原子构成
氢氧化铜(蓝色) Cu(OH)2 氯化铝 氯化亚铁 氯化银 碳酸钾 AlCl3 FeCl2 AgCl K2CO3 Na2SO4 ZnSO4 Zn(NO3)2 Cu(NO3)2 氯化锌 ZnCl2
氯化镁 氯化铁 氯化铜 碳酸钠 硫酸铁
MgCl2 FeCl3 CuCl2 Na2CO3
(盐酸盐) 碳酸钡 硫酸镁 硫酸钡 硝酸钡 硝酸钙 BaCO3 MgSO4 BaSO4 Ba(NO3)2 Ca(NO3)2
周四化学测验答案
初中化学用语
一、常见的元素符号: 氢 H 锰 Mn 氦 He 钡 Ba 锂 Li 碘 I 铍 Be 铁 Fe 硼,碳 B C 铜 银 Cu Ag 氮 氧 氟 氖。 N O F Ne 汞 锌 铂 金 Hg Zn Pt Au 钠 镁 铝 硅 磷,硫 氯 氩 钾 钙 。 Na Mg Al Si P S Cl Ar K Ca
初中化学常用词组大全

初中化学常用词组大全
1. 溶解:固体在液体中消失,称为溶解,如糖溶于水中。
2. 水溶性:物质在水中溶解的能力,称为水溶性。
3. 不溶性:物质不能在水中完全溶解,称为不溶性。
4. 沸点:液态物质在给定的压力下从液体变为气体的温度,称为沸点。
5. 密度:物体单位体积的质量。
6. 酸性:具有酸性的物质的水溶液有酸味、能腐蚀金属并使植物染色。
7. 碱性:具有碱性的物质的水溶液有苦味、具有腐蚀性并容易吸收水分。
8. 中性:不呈酸性或碱性的状态。
9. 化学反应:物质经过变化生成新物质的过程。
10. 氧化:物质失去电子或氢原子的过程。
11. 还原:物质获得电子或氢原子的过程。
12. 合成反应:多个物质反应生成新物质的过程。
13. 分解反应:化合物分解成两个或更多的物质的反应。
14. 烷烃:由碳和氢组成的一类物质,包括甲烷、乙烷等。
15. 烯烃:由碳和氢组成的一类物质,分子中有一个或多个碳
双键,包括乙烯、丙烯等。
16. 炔烃:由碳和氢组成的一类物质,分子中有三条及以上的碳—碳三键,包括乙炔、丙炔等。
17. 离子:原子或单原子离子失去或获得电子形成的带电粒子。
18. 离子键:由正负离子间的静电相互作用形成的化学键。
19. 共价键:两个原子通过共用它们的价电子对形成的化学键。
20. 化合价:化学元素与其他化学元素化合时所能借出的电子
数或能接受的电子数的最大值。
21. 分子式:化合物分子中各元素原子的种类、数目与相对位
置表达式。
初中化学用语(全)65256

初中化学用语总结一、单质1、由原子直接构成的单质:2、由分子构成的物质(1)金属单质,如:Na 钠Cu 铜Mg 镁Zn 锌Al 铝Ag 银K 钾Ba 钡Ca 钙Pt 铂Mn 锰Hg 汞Fe 铁Au 金……(2)非金属固体:C 碳S 硫P 磷(3)稀有气体:He 氦气Ne 氖气Ar 氩气H2氢气N2氮气O2 氧气O3臭氧Cl2氯气二、化合物Ag +此物质不存在AgNO 3硝酸银AgCl氯化银Ag 2SO 4硫酸银Ag 2CO 3碳酸银Ag 2O氧化银三、化学反应(一)、化合反应:“多变一”1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−+ Cl NH NH HCl 43===+ 2、红磷燃烧: 五氧化二磷氧气磷点燃−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧: 二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+5、镁的燃烧: 氧化镁氧气镁点燃−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+7、铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+8、氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃−−→−+ 22CO 2O CO 2点燃+ 12、二氧化碳溶于水:碳酸水二氧化碳→+ 13、生石灰遇水反应:氢氧化钙水氧化钙→+(二)、分解反应:“一变多”1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2Og H 2△2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 2 3、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热++−−→−4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→− ↑+↑222O H 2O 2H 通电6、碳酸分解: 二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:水二氧化碳氧化铜碱式碳酸铜加热++−−→−8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电 9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温 (三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ” 1、 氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+ 2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+ 金属活动顺序:3、 镁与稀盐酸反应:氢气氯化镁盐酸镁+→+4、 铝与稀盐酸反应:氢气氯化铝盐酸铝+→+5、 锌与稀盐酸反应:氢气氯化锌盐酸锌+→+6、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+7、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+8、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+9、 铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+ 10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+ 11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+ 12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+(四)、复分解反应:1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁+→+6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸+→+7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸+→+8、硝酸与氢氧化铜反应:水硝酸铜氢氧化铜硝酸+→+9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡+→+ 9、氯化钡与碳酸钠反应:氯化钠碳酸钡碳酸钠氯化钡+→+10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+(五)、其他反应: 1、汽车尾气催化转换:氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯22dP t P N CO 2NO2CO 2++,2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):水碳酸钙氢氧化钙二氧化碳+→+ 3、大理石与盐酸反应:二氧化碳水氯化钙盐酸碳酸钙++→+4、甲烷(天然气的主要成分)燃烧:水二氧化碳氧气甲烷点燃+−→−+O H 2CO O 2CH 2224++点燃5、一氧化碳还原氧化铁:二氧化碳铁一氧化碳氧化铁高温+−−→−+ 232CO 32Fe COO e F ++高温6、一氧化碳还原氧化铜:二氧化碳铜一氧化碳氧化铜加热+−−→−+ 2CO u C COCuO ++加热10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△++−→−+(NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O + NH 3·H 2O7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶+−→−+。
初中化学用语

初中化学用语一、元素符号元素符号就像是化学世界里每个元素的小名片。
比如说氧元素,它的符号是“O”,这小小的字母可代表着咱们呼吸离不开的氧气哦。
还有氢元素“H”,这可是组成水的重要元素呢。
记忆元素符号的时候呀,就像认识新朋友,多和它们打打交道就熟悉啦。
咱们可以编一些小口诀来记,像“氧是O,氮是N,镁的符号Mg真迷人”,这样俏皮的口诀,是不是让元素符号的记忆变得轻松又好玩啦?而且元素符号可是写化学方程式的基础呢,就像盖房子的小砖块,缺了它们可不行。
二、化学式化学式呢,就像是元素们组合在一起的小家庭的名字。
像水的化学式是H₂O,这表示一个水分子是由两个氢原子和一个氧原子组成的。
你看,这就像一个小家庭里有两个氢宝宝和一个氧妈妈。
二氧化碳的化学式是CO₂,这就告诉我们一个二氧化碳分子里有一个碳原子和两个氧原子。
在写化学式的时候呀,我们要遵循一定的规则,化合价就是这个规则里很重要的一部分呢。
就像在这个化学小家庭里,每个元素都有自己的地位和价值,这个价值就体现在化合价上啦。
如果化合价搞错了,那这个化学式可就写错啦,就像给人家小家庭乱起名字一样,可不行哦。
三、化学方程式化学方程式可算是化学用语里的大明星啦。
它就像一个故事,讲述了化学反应是怎么发生的。
比如说氢气和氧气反应生成水的化学方程式2H₂+O₂=2H₂O。
这个方程式就像在说,两个氢气小家庭和一个氧气小家庭在一起发生了奇妙的变化,最后变成了两个水小家庭。
在化学方程式里,等号左边的是反应物,就像故事的开头;等号右边的是生成物,那就是故事的结尾啦。
而且化学方程式要遵循质量守恒定律呢,就像在这个故事里,原子的种类和数目可不能变,就像参加派对的人数不能突然变多或者变少一样。
我们在写化学方程式的时候,要先把反应物和生成物的化学式写对,然后再根据质量守恒定律去配平。
这就像搭积木一样,要一块一块地搭好,让两边的原子数目相等,这样化学方程式才是正确的呢。
四、离子符号离子符号也很有意思哦。
初中化学用语(全)

初中化学用语总结一、单质1 、由原子直接构成的单质:2、由分子构成的物质( 1)金属单质,如:( 2)非金属固体:H2 氢气Na 钠Cu 铜 C 碳N 2 氮气Mg 镁Zn 锌S 硫O2 氧气Al 铝Ag 银P 磷O3 臭氧K 钾Ba 钡( 3)稀有气体:Cl2 氯气Ca 钙Pt 铂He 氦气Mn 锰Hg 汞Ne 氖气Fe 铁Au 金Ar 氩气二、化合物阴离子———2— 2 —OH NO 3 Cl SO4 CO3 2阳离子(氢氧根离子 )(硝酸根离子 ) (氯离子 )(硫酸根离子 )(碳酸根离子 ) OH+H 2O HNO 3HCl H2SO4 H 2CO3 H2O 水硝酸盐酸硫酸碳酸水+NH3 ·H2O NH 4NO3 NH 4Cl( NH4)2SO4( NH4 )2CO3NH 4氨水硝酸铵氯化铵硫酸铵碳酸铵K+KOH KNO 3 KCl K 2SO4K 2CO3 K2O 氢氧化钾硝酸钾氯化钾硫酸钾碳酸钾氧化钾Na +NaOH NaNO 3NaCl Na2SO4 Na2CO3 Na2O 氢氧化钠硝酸钠氯化钠硫酸钠碳酸钠氧化钠Ba2+Ba(OH) 2Ba(NO 3) 2BaCl 2BaSO4 BaCO 3BaO 氢氧化钡硝酸钡氯化钡硫酸钡碳酸钡氧化钡2+Ca(OH) 2Ca(NO 3) 2CaCl 2CaSO4 CaCO3 CaO Ca氢氧化钙硝酸钙氯化钙硫酸钙碳酸钙氧化钙Mg 2+Mg(OH) 2 Mg(NO 3)2 MgCl 2 MgSO 4MgCO 3MgO 氢氧化镁硝酸镁氯化镁硫酸镁碳酸镁氧化镁3+Al(OH) 3 Al(NO 3)3 AlCl 3 Al 2(SO4)3 此物质不存在Al 2O3Al氢氧化铝硝酸铝氯化铝硫酸铝氧化铝Zn 2+Zn(OH) 2 Zn(NO 3) 2 ZnCl2、ZnSO 4 ZnCO 3 ZnO氢氧化锌 硝酸锌 氯化锌 硫酸锌 碳酸锌 氧化锌Fe 2+ Fe(OH) 2 Fe(NO 3)2 FeCl2 FeSO4FeCO3FeO 氢氧化亚铁 硝酸亚铁 氯化亚铁 硫酸亚铁 碳酸亚铁 氧化亚铁Fe 3+ Fe(OH) 3Fe(NO 3)3 FeCl3 Fe2 (SO4) 3 此物质不存在Fe2O3氢氧化铁硝酸铁 氯化铁 硫酸铁 氧化铁Cu 2+ Cu(OH) 2 Cu(NO 3)2 CuCl 2 CuSO4 CuCO 3 CuO氢氧化铜 硝酸铜 氯化铜 硫酸铜 碳酸铜 氧化铜 Ag +此物质不存在 AgNO 3 AgCl Ag 2 SO4 Ag 2CO3 Ag2O硝酸银 氯化银 硫酸银 碳酸银 氧化银三、化学反应一、( 1) 3 个碳原子;( 2) 2 个硫酸根离子;( 3)臭氧分子( 4)人体中含量最多的物质;( 5)氧化铝中铝元素的化合价;( 6)空气中含量最多的元素;(7)氯离子;( 8)氧化镁2 个氮原子;(10)碳酸根离子。
初中化学教师课堂教学用语100句

初中化学教师课堂教学用语100句1. 请大家进入课堂。
2. 安静下来,准备上课。
3. 请大家翻开课本到第一页。
4. 今天我们要研究的是有关化学的知识。
5. 谁能告诉我化学是什么?6. 请大家打开笔记本。
7. 让我们先看一下上节课的复题。
8. 这个问题如何解答呢?9. 请举手回答这个问题。
10. 你们有什么问题需要问吗?11. 请大家分组进行讨论。
12. 请把你们的讨论结果告诉我。
13. 让我们来看一下实验的步骤。
14. 现在请你们动手进行实验。
15. 实验的结果是什么?16. 这个实验有什么意义?17. 请大家把实验报告交上来。
18. 让我们来研究一下这个化学公式。
19. 请大家背诵这个化学公式。
20. 这个公式怎么应用到实际生活中呢?21. 下面我们来做一个小测验。
22. 请把答案写在答题卡上。
23. 时间快到了,请大家抓紧时间完成。
24. 请你举例说明这个概念。
25. 这个问题你是否明白了?26. 请你把这个问题重新解释一下。
27. 让我们来看一下这个化学方程式。
28. 请你解释一下这个化学方程式的含义。
29. 这个方程式的反应条件是什么?30. 请你描述一下这个实验装置。
31. 这个实验装置的作用是什么?32. 请你描述一下这个化学元素的特性。
33. 这个化学元素的原子序数是多少?34. 这个元素的电子排布是什么?35. 另外,我们还有其他什么问题需要讲解吗?36. 请大家把课本合上。
37. 今天的课程就到这里,谢谢大家。
38. 下节课我们将继续研究化学。
39. 请你把这个化合物的结构式画出来。
40. 下次带好实验用具来上课。
41. 这个实验涉及到一些危险,要小心操作。
42. 请你给这个实验设置一下控制变量。
43.请你使用正确的实验方法。
44. 这个实验需要多长时间才能完成?45. 请你描绘一下这个实验的步骤。
46. 请你把实验的原理解释一下。
47. 这个实验中你的角色是什么?48. 请你把这个实验的结果写在报告里。
九年级化学化学用语-知识总结

九年级化学必须掌握的化学用语一、元素符号氢钠锌钡氦镁铁锰锂----铝锡碘铍----硅铅硼----磷氢----碳硫铜氮氯汞氧氩银氟钾铂氖钙金二、离子符号氢离子氧离子氟离子钠离子镁离子铝离子硫离子氯离子钾离子钙离子锌离子铜离子硝酸根离子氢氧根离子铁离子亚铁离子银离子钡离子汞离子硫酸根离子碳酸根离子铵根离子氯酸根离子高锰酸根离子锰酸根离子三、化合价+1+2K 、Na 、H 、AgCa 、Mg 、Ba 、Zn+1、+2+2、+3+3+4-1-2Cu Fe Al Si F O 口诀:钾钠氢银+1价;钙镁钡锌+2价。
铜1、2,铁2、3;还有铝3硅4为正价。
氟-1,氧-2;碳氮磷硫氯锰等,化合价在化合物里寻。
寻的方法:用“正负化合价的代数和=O ”列方程,用固定化合价找未知化合价原子团的化合价与对应的离子带电数值相同,正负一致。
※写出下列原子团的化合价:SO4:,CO3:,OH:NO3:,NH4:,MnO4(高锰酸根),MnO4(锰酸根),ClO3四、化学式特殊:氧气O2、氢气H2、氮气N2、臭氧O3单质碳-60C60氯气Cl2碘I2等其它:全部用元素符号表示。
如铁Fe、氩气Ar等氧化物:氧化钠氧化钾氧化镁氧化钙氧化铝氧化锌氧化铜氧化铁氧化亚铁四氧化三铁氧化汞氧化钡二氧化锰水二氧化碳一氧化碳二氧化氮二氧化硅五氧化二磷二氧化硫过氧化氢酸:盐酸硫酸硝酸碳酸化碱:氢氧化钠氢氧化钾氢氧化钙合氢氧化镁氢氧化钡氢氧化铜物盐:硫酸钠硫酸钾硫酸钙硫酸镁硫酸铜硫酸铁硫酸亚铁硫酸锌硫酸钡氯化亚铁氯化银氯化钡氯化钠氯化钾氯化钙氯化镁氯化铝氯化锌氯化铜氯化铁硝酸钠硝酸钾硝酸钙硝酸镁硝酸铜硝酸锌硝酸钡硝酸银氯酸钾高锰酸钾锰酸钾碳酸氢铵硝酸铵硫酸铵氯化铵温馨提示:以上物质的化学式要用化合价的知识“推”哟!!※特殊的化合物:(要记牢哈!!)双氧水H2O2甲烷CH4酒精C2H5OH醋酸CH3COOH尿素CO(NH2)2五、化学方程式(一)化合反应1、木炭的燃烧完全燃烧不完全燃烧2、硫的燃烧3、磷的燃烧4、铁丝在氧气中燃烧5、氢气的燃烧6、镁条的燃烧7、一氧化碳的燃烧8、氧化钙和水的反应9、铜和氧气加热10、铝和氧气反应11、二氧化碳和水的反应(二)分解反应1、过氧化氢和二氧化锰反应2、氯酸钾和二氧化锰加热3、高锰酸钾加热4、水通电5、碳酸钙高温6、碳酸分解(三)置换反应1、氢气和氧化铜加热2、木炭和氧化铜高温3、木炭和氧化铁高温4、锌和稀盐酸反应5、锌和稀硫酸反应6、铁和稀盐酸反应7、铁和稀硫酸反应8、镁和稀盐酸反应9、镁和稀硫酸反应10、铁和硫酸铜反应11、铝和硫酸铜反应12、铜和硝酸银反应(四)复分解反应1、盐酸和氢氧化钠反应2、盐酸和氢氧化钙反应3、盐酸和碳酸钙反应4、盐酸和碳酸钠反应5、盐酸和碳酸氢钠反应6、盐酸和硝酸银反应7、盐酸和铁锈反应7、硫酸和氢氧化钠反应8、硫酸和氢氧化钙反应9、硫酸和氯化钡反应10、硫酸和铁锈反应11、碳酸钠和氢氧化钙反应12、硫酸铜和氢氧化钠反应(五)特殊反应1、甲烷燃烧2、酒精燃烧3、一氧化碳和氧化铜高温4、一氧化碳和氧化铁高温5、二氧化碳和石灰水(氢氧化钙)6、二氧化碳和氢氧化钠〔六〕两个顺序1、1-20号元素(每五种一组);;2、金属活动顺序K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au 注意金属活动顺序的应用哟!你知道吗?。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学用语总结
一、单质
1、由原子直接构成的
单质:
2、由分子构成的物质
(1)金属单质,如: Na 钠Cu 铜
Mg 镁Zn 锌
Al 铝Ag 银
K 钾Ba 钡
Ca 钙Pt 铂 Mn 锰Hg
汞
Fe 铁Au
金……
(2)非金属固体:
C 碳
S 硫
P 磷
(3)稀有气体:
He 氦气
Ne 氖气
Ar 氩气
H2氢气
N2氮气
O2 氧气
O3臭氧
Cl2氯气
二、化合物
三、化学反应
(一)、化合反应:“多变一”
1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−
+ Cl NH NH HCl 43===+ 2、红磷燃烧: 五氧化二磷氧气磷点燃
−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧: 二氧化硫氧气硫点燃
−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+
5、镁的燃烧: 氧化镁氧气镁点燃
−−→−+ O Mg 2O 2Mg 2点燃+
6、铝的燃烧: 氧化铝氧气铝点燃
−−→−+ 322O Al 2O 34Al 点燃+ 7、铜在空气中加热:氧化铜氧气铜加热
−−→−+ O Cu 2O Cu 22△+ 8、氢气的燃烧: 水氧气氢气点燃
−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃
−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃
−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃
−−→−+ 22CO 2O CO 2点燃+ 12、二氧化碳溶于水:碳酸水二氧化碳→+ 13、生石灰遇水反应:氢氧化钙水氧化钙→+
(二)、分解反应:“一变多”
1、氧化汞加热分解: 氧气汞氧化汞加热
+−−→− ↑+2O Hg 2O g H 2△
2、过氧化氢催化分解:氧气水过氧化氢二氧化锰
+−−−−→− ↑+22O Mn 22O O H 2O 2H 2 3、高锰酸钾加热分解:
氧气二氧化锰锰酸钾高锰酸钾加热
++−−→−
4、氯酸钾与二氧化锰混合加热:
5、电解水: 氢气氧气水通电
+−−→− ↑+↑222O H 2O 2H 通电
6、碳酸分解: 二氧化碳水碳酸+→
7、碱式碳酸铜(孔雀石)热分解:
水二氧化碳氧化铜碱式碳酸铜加热
++−−→−
8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电
9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温 (三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”
1、 氢气还原氧化铜:铜水氧化铜氢气加热
+−−→−+
2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温
+−−→−+
金属活动顺序:
3、镁与稀盐酸反应:氢气
→
+
盐酸
氯化镁
镁+
4、铝与稀盐酸反应:氢气
+
氯化铝
→
盐酸
铝+
5、锌与稀盐酸反应:氢气
+
→
锌+
盐酸
氯化锌
6、铁与稀盐酸反应:氢气
+
→
氯化亚铁
盐酸
铁+
7、镁与稀硫酸反应:氢气
+
硫酸镁
→
稀硫酸
镁+
8、锌与稀硫酸反应:氢气
→
+
稀硫酸
硫酸锌
锌+
9、铝与稀硫酸反应:氢气
+
→
硫酸铝
稀硫酸
铝+
10、铁与稀硫酸反应:氢气
+
硫酸亚铁
→
稀硫酸
铁+
11、铝与硫酸铜反应:铜
+
→
硫酸铝
硫酸铜
铝+
12、铁与硫酸铜反应:铜
铁+
+
→
硫酸亚铁
硫酸铜
13、铁与氯化铜反应:铜
+
→
氯化亚铁
氯化铜
铁+
(四)、复分解反应:
1、氯化钾与硝酸银反应:氯化银
→
+
硝酸银
硝酸钾
氯化钾+
2、盐酸与硝酸银反应:氯化银
+
硝酸
→
硝酸银
盐酸+
3、氧化铜与硫酸反应:水
→
+
硫酸
硫酸铜
氧化铜+
4、氧化镁与硫酸反应:水
氧化镁+
+
→
硫酸镁
硫酸
5、氧化铁与盐酸反应:水
+
→
氯化铁
盐酸
氧化铁+
6、盐酸与氢氧化钠反应:水
氯化钠
+
→
盐酸+
氢氧化钠
7、硫酸与氢氧化钠反应:水
+
→
硫酸钠
氢氧化钠
硫酸+
8、硝酸与氢氧化铜反应:
→
+
硝酸+
水
硝酸铜
氢氧化铜
9、氯化钡与硫酸反应:水
氯化钡+
+
→
硫酸钡
硫酸
9、氯化钡与碳酸钠反应:
→
氯化钡+
+
碳酸钡
氯化钠
碳酸钠
10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+
11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+
(五)、其他反应: 1、汽车尾气催化转换:
氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯
22d
P t P N CO 2NO
2CO 2++,
2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):
水碳酸钙氢氧化钙二氧化碳+→+
3、大理石与盐酸反应:
二氧化碳水氯化钙盐酸碳酸钙++→+
4、甲烷(天然气的主要成分)燃烧:
水二氧化碳氧气甲烷点燃
+−→−+
O H 2CO O 2CH 2224++点燃
5、一氧化碳还原氧化铁:
二氧化碳铁一氧化碳氧化铁高温+−−→−+ 232CO 32Fe CO O e F ++高温
6、一氧化碳还原氧化铜:
二氧化碳铜一氧化碳氧化铜加热+−−→−+ 2CO u C CO CuO ++加热
10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+
11、硫酸铵与氢氧化钠溶液混合加热:
氨气水硫酸钠氢氧化钠硫酸铵△++−→−+ (NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O+ NH 3·H 2O
7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶+−→−+。
