《水盐体系相图》(第二章)作业及答案
第二章 二元体系相图

共晶反应: l(E)
冷却 加热
E
sA(G) + sB(H)
A 水
xB→
盐 B
相图应用
1.盐的精制 ① 理解利用相图原理进 行盐类精制过程; ② 量的关系:
m(B 硫铵) SG m(l 母液) SZ
G
Z
2. 水-盐冷冻液
在化工生产和科学研究中常要用到低温浴,配制合 适的水-盐体系,可以得到不同的低温冷冻液。另外, 冬天里汽车水箱等防冰冻也用这种方法。饱和盐水系统 低共熔温度如下:
编号 1 2 符号 A 温度 0 -5 液相组成 0 7.9 平衡固相 ice ice
3
4 5 6 7 8 9 10 11 Q E
-10
-15 -21.1 -15 -10 -5 0.15 10 20
14.0
18.9 23.3 24.2 24.0 25.6 26.3 26.3 26.4
ice
ice Ice+ NaCl.2H2O NaCl.2H2O NaCl.2H2O NaCl.2H2O NaCl.2H2O+NaCl NaCl NaCl
33.0
40.5 42.3 50.5 54.6 62.3 64.6
ice
Ice+ Mn(NO3)2.6H2O Mn(NO3)2.6H2O Mn(NO3)2.6H2O Mn(NO3)2.6H2O Mn(NO3)2.6H2O Mn(NO3)2.6H2O+ Mn(NO3)2.3H2O Mn(NO3)2.3H2O Mn(NO3)2.3H2O
说明: 水盐体系是凝聚体系,可以不考虑压力的变化,水盐体 系的固液平衡可以在没有水蒸气的情况下实现,所以气 相没有计入相数P中,水盐体系也不研究气相的组成
水盐体系相图及其应用参考文档

改变W角
将AB拉向∞
A'
E
B'
A' E B'
A'
E
A' E
A
B
A
B
W
B'
B
W
B' B
图3-4 各种坐标的关系
三、空间立体图
B'
1.三棱柱坐标系立体图
在平面组成坐标 (t;')H M' 的基础上,再把温
E2
度坐标加上去,就 (te')K
E3 W'
E1
组成了三棱柱空间
E
坐标系,如图3-5所
B
H(t")
a%+b%+c%=100% 在三元水盐体系中,仅有两个组分的浓 度是独立变数,另一组分浓度为非独立变数。
二、三元水盐体系组成表示法
1.正三角形(以溶液为基准)
图中M点,通过M点作DE、
FG、HL线分别平行于三角形
C
的三条边。从图中可看出以
H
下的关系: HC=EM=GM=GE=LB= a% GC=DM=HM=HD=AF= b%
b% D
G a%
M E
AD=FM=LM=BE=FL= c% A
这样,可在△ABC任一边上 同时读出系统M(M点)的组成。
B
F
L
C%
图3-1 正三角形坐标
二、三元水盐体系组成表示法
2.直角等腰三角形(以溶液为基准)
这种坐标的读数方 法和正三角形法相同。 由于直角等腰三角形有 斜边,其刻度和直角边 上不同,因此,读数时 可只读直角边上的刻度。 这种坐标可以直接在直 角坐标纸上标绘,十分 方便,而且对于近水点 处的图形适当地放大。 系统M(M点)含B30%, 含A为50%,水则自然为 20%。
2-1水盐体系相图及其应用

BM盐的饱和溶解度曲线,即与
液相呈平衡的固相为BM盐。
a点代表AM-H2O二元体 系中AM盐的溶解度,b点代 表BM-H2O二元体系中BM的
溶解度,c点是ac和bc的交点,
代表AM和BM两种盐共同饱 和时的点(共饱和点),即 与液相呈平衡的固相为AM和 BM两种盐。
面积Aca代表AM盐与其饱 和溶液共存的两相区,面积 Bcb代表BM盐与其饱和溶液共
F =C-P=3-1=2
表示该不饱和区为双变量区。
——END Thank you
(2)独立组分
系统中每一个可以单独分离出来并能在体系外长
期存在的物质,称之为组分。组分是构成整个体系的化学物质, 物质间如果没有化学反应,则组分数与独立组分数相等,如物质 间有化学反应,则组分数减去独立化学反应数,即得独立组分数, (3)自由度 在体系中不致引起相的数目发生变化的条件下,可
以随意独立变动的可变因素(如温度、压力、浓度等)的数目。
存的两相区,面积AcB代表AM
盐和BM盐都与饱和溶液c共存 的三相区,面积Dacb代表单一 液相的不饱和区。
下面用相律分析相图中各点、线、面的意义。 对于相图中点a和点b:组分数为2,相数为2,由相律 公式知
F-C-P=2-2=0
自由度F为0,表示在一定温度条件下,这样的点为无 变量点,不论改变那个强度变量都会使体系发生相的变化。 对于c点,组分数为3,相数为3,则 F =C-P=3-3=0 也是无变量点。 对于ac和bc线上的任何点,组分数为3,相数为2,则
ac m bc n
2.三元体系直角等腰三角形 表示法 直角等腰三角形表示法如图2-4
所示。这种示法的优点是可
用普通方格纸作图。体系以l00g (或l00mol)为基准。横坐标表 示A盐的质量分数,纵坐标表示B 盐的质量分数,坐标原点为纯 水点。水的含量不能从图上直接读 出来,但显然是已知的了。如图
《水盐体系相图》(第一章)作业及答案

《水盐体系相图》(第一章)作业及答案-标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII1-1 计算下列物料的组成,分别用重量%、摩尔%、克/100克水、克/100克盐表示。
(1) 由20克Na 2SO 4、30克K 2SO 4和150H 2O 克组成的物料; (2) 某溶液,含MgCl 2 、NaCl 、 KCl 46.1g/L ,比重为。
其中:Na 2SO 4摩尔质量为,K 2SO 4摩尔质量为,H 2O 摩尔质量为,MgCl 2摩尔质量为,NaCl 摩尔质量为,KCl 摩尔质量为。
(1) 由20克Na 2SO 4、30克K 2SO 4和150克H 2O 组成的物料。
解:a.用重量%表示物料的组成:b.用摩尔%表示物料组成:物料总摩尔数:++=(mol )c.用克/100克水表示物料组成:d.用克/100克盐表示物料组成:(2)某溶液,含MgCl 2 g/L 、NaCl g/L 、 KCl 46.1g/L ,比重为L 。
解:由题意,1L 溶液中H 2O 的重量为:用重量%表示物料的组成:%00.75%1001503020150:%00.15%100150302030:%00.10%100150302020:24242=⨯++=⨯++=⨯++O H SO K SO Na )(324.802.18150:)(172.03.17430:)(141.00.14220:24242mol O H mol SO K mol SO Na ===%38.96%100637.8324.8:%99.1%100637.8172.0:%63.1%100637.8141.0:24242=⨯=⨯=⨯O H SO K SO Na )100/(00.100100150150:)100/(00.2010015030:)100/(33.1310015020:22242242O gH g O H O gH g SO K O gH g SO Na =⨯=⨯=⨯)100/(00.30010050150:)100/(00.601005030:)100/(00.401005020:24242gS g O H gS g SO K gS g SO Na =⨯=⨯=⨯%21.61%10012878.787:%58.3%10012871.46:%42.1%10012873.18:%78.33%10012878.434:22=⨯=⨯=⨯=⨯O H KCl NaCl MgCl )(618.055.741.46:)(313.044.583.18:)(567.421.958.434:2mol KCl mol NaCl mol MgCl ===b.用摩尔%表示物料组成:溶液总摩尔数:+++=(mol )c.用克/100克水表示物料组成:d.用克/100克盐表示物料组成:1-2根据数据绘制50℃时,溶液中有CaCl 2存在的KCl 的溶解度曲线。
第二章 二元水盐体系相图

步骤进行量的计算: • 确定有关物料的系统点、液相点、固相点在相图上的位置; • 通过读取坐标上刻度或量取长度的方法,确定杠杆臂所代表
的物料量的长度; • 根据杠杆规则列出比例式,求出未知量。 • 说明:在杠杆法中,如果系统分为固液两相,则两段杠杆的长
x 12.40 ,解得x 1780(kg) 3210 x 10
未析出组分法解题步骤
故 l MS 根据合比定理有l s MS LM 即 m LS
s LM
s
LM
s LM
综上所述,l : s : m MS : LM : LS
关于低共熔物:具有低共熔点组成的融合体
• 由几个组分构成的具有一定特征结构的混合物,而且在熔点时 生成了对它所含有在某组成中所有组分都饱和的溶液。
• 低共熔物的熔点在体系的所有融合体中最低。 • 两种物质的混合降低了水的冰点和纯盐的熔点。
横轴为一固定长度,等分成100份 左端点W表示纯水,右端点S表示纯盐
左右端点是体系组成的固定界线,同时反映出 盐和水的组成关系:盐的百分数+水的百分数=100%
1.3 简单二元水盐相图的标绘
依据:相平衡数据
相图的标绘完全符合连续原理和相应原理。步骤如下: ⑴分析相平衡数据:平衡固相与平衡液相一一对应。 ⑵建立坐标系:横轴表组成
杠杆法: 溶液密度为1070kg / m3,故原始溶液为3210kg, 其中含盐321k g,水2889k g。由图中查得低共熔点时 液相含NaCl 22.42%。因此,溶液的浓度增加的倍数为 22.42 /10 1 1.242。 系统原始组成点在冷却至低共熔温度时,是从M点降到 M1点,此时相应液相点移至E点,析出固相点在B点。 按杠杆规则,析出的固相量GB与母液GE量之比为 GB 22.4 10 12.40 GE 10 0 10 设析出的固相量为x,余下的液相量为3210 x,得
第二章水盐体系

溶解度法是绘制水-盐体系相图的一种常用方法
下面对H2O(A)-(NH4)2SO4体系的液、固平衡相图的得来先进行定性解释。
160
(定量方面具体实验数据见上页表)
t/℃
120
N
读图要点:
80
l(A+B)
① 点、线、区的含义
40
l (A+B)+s (B)
② 水平线 CED—三相平衡线
0L l(A+B)+s(A) wE=0.384
T-p图 — 根据实验数据绘制
1. 点、线、面的意义
面:单相区,P=1;f =2 双变量区,
AOB:水蒸气稳定区 AOC:水稳定区 BOC:冰稳定区
pC
冰 F
A 水 R
O 水蒸气
B T1 T2 T
线:两相平衡,为单变量系 — P =2 f =1 OA:液(水)-气(水蒸气)平衡线,水蒸气压曲线
OF :过冷水-水蒸气平衡 p
M
六、溶解度法绘制水-盐体系相图
不同温度下(NH 4)2SO4在水中的溶解度
温度 t / ℃ 0
-1.99 -5.28 -10.15 -13.99 -18.50
0 10 20 30 40 50 60 70 80 90 100 108.50( 沸点 )
液相组成
[w ( NH 4 ) 2 SO 4 ] 0 0.0652 0.1710 0.2897 0.3447 0.3975 0.4122 0.4211 0.4300 0.4387 0.4480 0.4575 0.4664 0.4754 0.4847 0.4944 0.5042 0.5153
冰点温度比三相点温度低0.01 K是 由两种因素造成的: (1)因外压增加,使凝固点下降
水盐体系相图及应用下载

水盐体系相图及应用下载
水盐体系相图是描述水和盐溶液在不同条件下相互间的相变和混合行为的图表。
在水盐体系中,由于水可作为溶剂,可以溶解各种盐类物质。
而不同种类和浓度的盐溶液在温度和压力变化时会发生溶解度、相变、晶体生长等现象,这些现象可以通过相图来展示和解释。
水盐体系相图的主要应用包括以下几个方面:
1. 溶解度研究:水盐体系相图可以直观地显示不同温度和浓度下溶解度的变化规律。
通过相图可以确定在不同条件下某种盐类在水中的溶解度,为溶液的配制提供依据。
2. 结晶过程控制:相图可以分析水盐体系中的结晶行为,并确定结晶温度和浓度的范围。
通过控制温度和浓度,可以实现溶液中盐类的结晶过程,制备纯度较高的盐类晶体产品。
3. 蒸发结晶工艺优化:对于蒸发结晶过程,通过相图可以确定盐溶液的饱和度条件和晶体生长的温度范围,从而优化结晶工艺,提高晶体的产量和质量。
4. 盐类分离与提纯:相图不仅可以分析盐的溶解和结晶行为,还可以指导盐类的分离和提纯过程。
通过调整温度和浓度,可以选择性地溶解或结晶某种盐类,实现盐类的纯化。
5. 结晶过程动力学研究:相图可以提供结晶过程的动力学信息,如结晶速率、晶体生长形态等。
这些动力学参数对于优化结晶工艺、控制产品质量具有重要意义。
综上所述,水盐体系相图是研究水和盐溶液相互间相变和混合行为的重要工具,不仅可以解释水盐体系中的现象和规律,还可以指导实际工艺中的操作和优化。
在水处理、化工、食品加工等领域都有广泛的应用。
NaCa2ClSO42H2O四元水盐体系的相图研究

f。
’、。
”。
鼍i药剂与材料;;;’'’.^-^-^^-^-^-^.^-^-^-^-^-^,^。
pNa+,Ca2+//C1。
,8042-_H20四元水盐体系的相图研究杨文忠,王晓云,刘瑛,尹晓爽(南京工业大学理学院,南京210009)CwTC.14.010[摘要] 采用等温溶解平衡法研究了四元体系Na+,Ca2+//Cl。
,s042。
一-H20在25"(3的介稳相平衡关系,测定了该温度下四元体系中液相的溶解度及其主要物化性质。
根据实验数据,绘制了四元体系干盐图和水图,同时绘制了该体系的物化性质一组成图。
四元体系Na+,Ca2+//C1一,S042-一H20 在25"(2时的介稳相图属于简单型,该体系在25℃下有2个共饱和点,6条溶解度曲线和4个结晶相区,其平衡相区分别为NaCl、Na2S04、CaS04·2H20和each·6820结晶区,介稳平衡溶液的密度和电导率呈现规律性变化,均随着S042。
的含量呈现一致的变化,并且和该体系该温度的水图的变化相吻合。
[关键词】硫酸钙;四元体系;溶解度;相平衡T h e p h a s e equilibrium diagrams in the quaternary system Na十,Ca2+//CI",S042。
-H20Abstra ct:The metastable pha s e exluilibfium in the qu atern ary system Na十,Ca2+//CI-,S042一-H20at 298K Was studied by using isothermal sol u ti o n exluilibfium method in the paper.Thesolubi liti esand p hy‘s i co c he mi c al properties(density and conductivity)of the metastable system were determined at the same temperature.The phase diagrams of the ter n ar y system and the dry-salt system were d r a w n accordi ng to the experimental data.T he physicochemical composition diagram Was plotted,respectively.T h e experimental results s h o w that the quaternary system Na十,Ca2+//CI-,S042-_H20at 298K Was of simple eutectic type system.In the matestable ph a s e diagram of the te rn ar y system,there ex is te d t wo invariant points,six solubility c u r v e s and fou r crystallization zones corresponding to NaCl,Na2S04,CaS04·2H20and CaCl2·6H20.From the diagrams of physicochemical pro pe r ti es ve r su s compositions in the metastable system,the density and conductivity presented the reg ula r change with the S042’Janecke index,and the change Was identical witll the tren d o f dry-salt diagram in the system at 298K.Keyword:Calcium sulfate;Quaternary system;Solubili哆;Phase equilibrium1引言·67·在化工生产中,.人们广泛地遇到相变问题,特别是多数无机化工产品都是从水溶液中结晶或转换出来的。
《水盐体系相图》(第二章)作业及答案
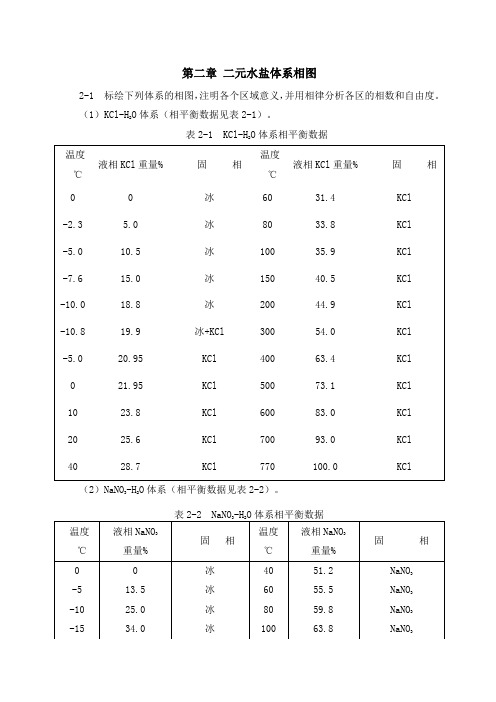
第二章 二元水盐体系相图2-1 标绘下列体系的相图,注明各个区域意义,并用相律分析各区的相数和自由度。
(1)KCl-H 2O 体系(相平衡数据见表2-1)。
表2-1 KCl-H 2O 体系相平衡数据(2)NaNO 3-H 2O 体系(相平衡数据见表2-2)。
图2-1(1) KCl-H 2O体系相图图2-1(2) 体系相图在图2-1(1)KCl-H 2O 体系相图中:①未饱和溶液区域中:P=1,F=C-P+1=2-1+1=2;②冰的结晶(冰+L )区域中:P=2,F=C-P+1=2-2+1=1; ③KCl 的结晶(KCl+L )区域中:P=2,F=C-P+1=2-2+1=1; ④三相线CED(不包括C 、E 两点)中:P=3,F=C-P+1=2-3+1=0; ⑤冰与KCl (冰+KCl )两固相共存区中:P=2,F=C-P+1=2-2+1=1。
在图2-1(2)NaNO 3-H 2O 体系相图中:①未饱和溶液区域中:P=1,F=C-P+1=2-1+1=2; ②冰的结晶(冰+L )区域中:P=2,F=C-P+1=2-2+1=1;③NaNO 3的结晶(NaNO 3+L )区域中:P=2,F=C-P+1=2-2+1=1;④三相线CED(不包括C 、E 两点)中:P=3,F=C-P+1=2-3+1=0;⑤冰与NaNO 3(冰+ NaNO 3)两固相共存区中:P=2,F=C-P+1=2-2+1=1。
2-2 1000公斤含KCl5%的溶液,在95℃下蒸发掉900公斤水,计算:(1)蒸发后析出的固相量及母液的量。
(2)把蒸发后的母液冷却到15℃,在冷却过程析出的固相量及最后的液相量。
解法一:用杠杆规则法求解 如图2-2,由题意知:原始物料系统点为M 。
(1)系统M 蒸发后,首先应确定蒸发后的新系统点M 1。
∵M=H+M 1, 因此由杠杆规则有:HMMM 1100900=即:51009001MM = 解之:451=MM ,据此可确定出新系统点M 1,又∵M 1处在KCl 的结晶区,∴L 1+S 1= M 1,故蒸发后:)(60.2210060.6460.1410011111kg S L M L W S =⨯=⨯=)(40.7760.22100111kg W W W S M L =-=-= (2)母液L 1冷却后,得到的系统点为M 2,∵M 2亦处在KCl 的结晶区,∴L 2+S 2= M 2,故冷却后:)(02.1140.7732.7572.1040.7722222kg S L M L W S =⨯=⨯=)(38.6602.1140.77222kg W W W S M L =-=-=图2-2 -体系相图重量%解法二:用母液的浓度求解如图2-2,由题意知:原始物料系统点为M 。
水盐体系相图总复习

杠杆规则
A、B、C三点所代表的物料量各与其它两点间的线段的长度 成比例,这就是杠杆规则。直线规则和杠杆规则,我们统称直 线杠杆规则或称直线反比法则。 如果用MA、MB、MC分别代表A、B、C三点的数量,则可列 出如下的比例式
A MA C MC B MB
MA∶MB∶MC=BC∶AC∶AB • 所谓反比,就是指每点所代表的数量和其它两点间线段的长度 成比例,而不包括本身的那个点。MA和直线BC的长度成比例, MB与直线AC的长度成比例,MC和直线AB的长度成比例。
子分开。
例如Na+、K+//Cl-、SO42--H2O体系等。
此外还有写成例如Na'、K'//Cl'、SO4"-H2O体系等形式
的。只要前后一致就好,没有十分严格的规定。
第二章 二元水盐体系相图
第一节 简单二元水盐体系图形表示法
第二节 复杂二元水盐体系相图
第三节 二元水盐相图的化工过程 第四节 二元水盐相图的计算方法
可以是0、1、2、3等。
通常,自由度用F表示。
相律
F=C-P+2 式中F——独立参变量数目,即自由度;. C——独立组分数; P——平衡共存的相的数目; 2——指温度和压力两个变量。
水盐体系属于凝聚体系,一般是处在大气之中,因为 压力对水盐体系平衡影响甚微,所以可以不考虑压力 这一外界变量对平衡的影响。 因而对水盐体系,我们用“减相律”,即凝聚体系相 律。其表达形式为 F=C-P+1 式中的1指温度这一变量,式中的P不包括气相在 内, 也不考虑空气的存在。读者在应用时要特别注意。
250
15
200
14
150 未饱和溶液L 100 12 11 10 50 1 2 3 7 6 E 20 40 60 8 9 45
大学物理化学相图课后习题及答案

相图一、是非题下述各题中的说法是否正确?正确的在题后括号内画“√”,错的画“⨯”。
1.相是指系统处于平衡时,系统中物理性质及化学性质都均匀的部分。
( )2.依据相律,纯液体在一定温度下,蒸气压应该是定值。
( )3.依据相律,恒沸温合物的沸点不随外压的改变而改变。
( )二、选择题选择正确答案的编号,填在各题题后的括号内。
1NH4HS(s)和任意量的NH3(g)及H2 S(g)达平衡时有:( )。
(A)C=2,φ=2,f =2;(B) C=1,φ=2,f =1;(C) C=1,φ=3,f =2;(D) C=1,φ=2,f =3。
2已知硫可以有单斜硫,正交硫,液态硫和气态硫四种存在状态。
硫的这四种状态____稳定共存。
(A) 能够;(B) 不能够;(C) 不一定。
3硫酸与水可形成H2SO4⋅H2O(s),H2SO4⋅2H2O(s),H2SO4⋅4H2O(s)三种水合物,问在101 325Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?( )(A) 3种;(B) 2种;(C) 1种;(D) 不可能有硫酸水合物与之平衡共存。
4将固体NH4HCO3(s) 放入真空容器中,恒温到400 K,NH4HCO3按下式分解并达到平衡:NH4HCO3(s) === NH3(g) + H2O(g) + CO2(g) 系统的组分数C和自由度数f为:( )(A) C=2,f =2;(B) C=2,f =2;(C) C=2,f =0;(D) C=3,f =2。
5某系统存在C(s)、H2O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡:H 2O(g)+C(s) H2(g) + CO(g)CO 2(g)+H2(g) H2O + CO(g)CO 2(g) + C(s) 2CO(g)则该系统的独立组分数C为:( )。
(A) 3;(B) 2;(C) 1;(D) 4。
三、计算题习题1A,B二组分在液态完全互溶,已知液体B在80︒C下蒸气压力为101.325 kPa,汽化焓为30.76 kJ·mol-1。
硕士研究生水盐体系相图及其应用考试试题

2009-2010学年第二学期硕士研究生
水盐体系相图及其应用考试试题
(答题要求:该课程为开卷考试,要求学生仔细解答,可以是
打印也可以手写,不得抄袭,如果完全类同,将严格扣分,卷
面总分为100分,最后总评分数:卷面占80%,平时成绩20%)
1什么是相图?水盐体系相图和其他类型的相图有什么区别和联系?(5分)
2什么是湿渣法和合成复体法,这两种方法有什么区别和联系?(5分)
3稳定相图和介稳相图的区别和联系?介稳相图有什么特点(5分)4简要叙述水盐体系盐类溶解度理论计算的方法原理及其应用。
(10分)
5什么是相律,结合如图所示,给出四元体系相律公式。
并应用相律对图中Q点进行分析讨论,该点是由那几相组成,分别是什么?(10分)
6如图所示五元体系,请结合五元体系相律公式对该五元体系相图中的点线面进行分析讨论。
(15分)
7什么是杠杆规则?杠杆规则在水盐体系相图中有何应用?试举例说明。
(10分)
8如图所示KCl-NaCl-H2O三元体系相图,根据相图,试以100Kg钾石盐为基准,给出钾石盐分离的操作流程,画出工艺操作流程图,对操作流程进行物料衡算,请计算加水量,100℃时分离出的NaCl产量和NaCl的产率,高温时母液E100的量,25℃时分离出的KCl的结晶量和产率,最后的母液量为多少?(20分)
9根据(水盐体系相图及其应用,牛自得主编)书中P265附录页Na, K//Cl, NO3-H2O四元体系25℃和100℃实验数据,绘制出该四元体系
及该四元体系的相图制取钾肥硝酸钾,试的相图,拟利用KCl和NaNO
3
根据所绘的相图,分析讨论,给出制备硝酸钾的操作流程。
(20分)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 二元水盐体系相图
2-1 标绘下列体系的相图,注明各个区域意义,并用相律分析各区的相数和自由度。
(1)KCl-H 2O 体系(相平衡数据见表2-1)。
表2-1 KCl-H 2O 体系相平衡数据
(2)NaNO 3-H 2O 体系(相平衡数据见表2-2)。
图2-1(1) KCl-H 2O体系相图
图2-1(2) 体系相图
在图2-1(1)KCl-H 2O 体系相图中:
①未饱和溶液区域中:P=1,F=C-P+1=2-1+1=2;
②冰的结晶(冰+L )区域中:P=2,F=C-P+1=2-2+1=1; ③KCl 的结晶(KCl+L )区域中:P=2,F=C-P+1=2-2+1=1; ④三相线CED(不包括C 、E 两点)中:P=3,F=C-P+1=2-3+1=0; ⑤冰与KCl (冰+KCl )两固相共存区中:P=2,F=C-P+1=2-2+1=1。
在图2-1(2)NaNO 3-H 2O 体系相图中:
①未饱和溶液区域中:P=1,F=C-P+1=2-1+1=2; ②冰的结晶(冰+L )区域中:P=2,F=C-P+1=2-2+1=1;
③NaNO 3的结晶(NaNO 3+L )区域中:P=2,F=C-P+1=2-2+1=1;
④三相线CED(不包括C 、E 两点)中:P=3,F=C-P+1=2-3+1=0;
⑤冰与NaNO 3(冰+ NaNO 3)两固相共存区中:P=2,F=C-P+1=2-2+1=1。
2-2 1000公斤含KCl5%的溶液,在95℃下蒸发掉900公斤水,计算:
(1)蒸发后析出的固相量及母液的量。
(2)把蒸发后的母液冷却到15℃,在冷却过程析出的固相量及最后的液相量。
解法一:用杠杆规则法求解 如图2-2,由题意知:原始物料系统点为M 。
(1)系统M 蒸发后,首先应确定蒸发后的新系统点M 1。
∵M=H+M 1, 因此由杠杆规则有:
HM
MM 1100900=
即:51009001
MM = 解之:451=MM ,据此可确定出新系统点M 1,又∵M 1处在KCl 的结晶区,∴L 1+S 1= M 1,故蒸发后:
)(60.2210060
.6460
.141001
1111kg S L M L W S =⨯=
⨯=
)(40.7760.22100111kg W W W S M L =-=-= (2)母液L 1冷却后,得到的系统点为M 2,∵M 2亦处在KCl 的结晶区,∴L 2+S 2= M 2,故冷却后:
)(02.1140.7732
.7572
.1040.772
2222kg S L M L W S =⨯=
⨯=
)(38.6602.1140.77222kg W W W S M L =-=-=
图2-2 -体系相图
重量%
解法二:用母液的浓度求解
如图2-2,由题意知:原始物料系统点为M 。
(1)系统M 蒸发后,首先应确定蒸发后的新系统点M 1。
∵M=H+M 1, 因此由杠杆规则有:
HM
MM 1100900=
即:51009001
MM = 解之:451=MM ,据此可确定出新系统点M 1。
又∵M 1处在KCl 的结晶区,∴L 1+S 1= M 1,而原始物料中总水量为950kg,蒸发掉900kg 水
后,M 1当中的水量为50kg,亦即 L 1当中的水量为50kg,由图2-2中可读得L 1的KCl 含量为35.40%,设L 1当中的KCl 量为1KCl W kg,则:50
60.6440.351
KCl W =,解之, )
(kg W KCl 40.271=,)(40.7740.27501kg W L =+=, ∴)(60.2240.77100111kg W W W L M S =-=-=
(2)母液L 1冷却后,得到的系统点为M 2,则)(40.7712kg W W L M ==,∵M 2亦处在KCl 的结晶区,∴L 2+S 2= M 2,由题意,M 2当中的水量为50kg ,亦即 L 2当中的水量为50kg, 由
图2-2中可读得L 2的KCl 含量为24.68%,设L 2当中的KCl 量为2KCl W kg,则:50
32.7568.242
KCl W =,解之, )
(kg W KCl 38.162=,)(38.6638.16502kg W L =+=, ∴)02.1138.6640.77222kg W W W L M S =-=-=。
