基础有机化学(邢其毅、第三版)第六章PPT
11 基础有机化学(邢其毅、第三版)醛酮

C=O -CN
可逆
CH3 CH3
C
CN H2O CH3 O- 不可逆 CH3
C
CN OH
*3 反应条件 反应必须在弱碱性条件下进行。
35
36
6
Xiezx (3)醛、酮与炔化钠的加成
-Lzu
R-C≡C-Na+ +
NaNH2 (-NH3)
R-C≡CH
C=O NH3(液) 或乙醚
C C
CR H2O
ONa
-Lzu
*3a 提纯醛酮 鉴别醛酮
重结晶 稀酸
C=O + H2N-Z H2N-OH H2N-NH2
C=N-Z H2N-NH-C6H5 H2N-NH-C6H3(NO2)2
C=O O H2N-NHCNH2
羟胺
肼
苯肼
2,4-二硝基苯肼
氨基脲
(产物:肟)(产物:腙) (产物:苯腙)
(产物:缩氨脲)
*3b 保护羰基
1716
Xiezx -Lzu
1717
13
14
Xiezx -Lzu
Xiezx -Lzu
CHO
1700
15
16
Xiezx 第五节 醛酮的制备
-LzuLeabharlann 一 制备概貌1氧化烯烃
1 水合 2 硼氢化-氧化
炔烃
1 氧化
2 傅氏酰基化
3 Gattermann-Koch反应
芳烃
醇
1 氧化 2 频哪醇重排
醛酮
氧化
取代
羧酸
A B
C=O
+ H2NR
A
参与反应 稀酸
B C=NR
A' B' C=O
邢其毅《基础有机化学》(第3版)(上册)名校考研真题-脂肪族饱和碳原子上的亲核取代反应 β-消除反应

【解析】先由甲氧负离子进攻酯键中的羰基碳原子,生成酚氧负离子,再由酚氧负离子 进攻与溴相连的碳原子发生分子内的亲核取代反应得产物。
9.给出下列反应的反应机理:______。[武汉理工大学 2003 研]
【答案】
4/7
圣才电子书 十万种考研考证电子书、题库视频学习平台
6.
。[北京大学 2001 研]
【答案】 【解析】氨先取代其中的一个溴原子生成溴代烷基胺,然后再进行分子内的亲核取代反 应得到产物。若二溴代烷过量,还可继续反应生成季铵盐。
7.写出下列转变的机理:______。[中国科学院-中国科学技术大学 2003 研]
【答案】
3/7
圣才电子书 十万种考研考证电子书、题库视频学习平台
5/7
圣才电子书 十万种考研考证电子书、题库视频学习平台
答:要熟悉 SN2 反应和 SNl 反应机理。SNl 反应为单分子亲核反应,中间体为碳正离 子,可能有碳正离子的重排现象,也受溶剂的极性影响,其反应速度与离去基团的离去难易 和碳正离子的稳定性有关,而与亲核试剂的亲核性无关;SN2 反应为双分子亲核取代反应, 亲核试剂的进攻和离去基团的离去同时进行,产物的绝对构型完全翻转,其反应速度与亲核 试剂的亲核性有关。
【解析】烯丙基卤的亲核取代反应为 SN1 反应,中间体碳正离子会发生重排。 10.试为下面反应提出合理历程______。[云南大学 2004 研]
【答案】
【解析】先由氯离子与醚键反应,氯离子取代甲氧基,属 SN2 反应,构型翻转,再由 取代出的甲氧负离子与酰氯发生醇解反应得产物。
三、简答题 1.卤代烷与氢氧化钠在含水乙醇溶液中进行反应,指出下列情况哪些属于 SN2 机理? 哪些属于 SNl 机理? (1)产物的绝对构型完全转化;(2)有重排产物;(3)碱的浓度增加,反应速度加快; (4)三级卤代烷反应速度大于二级卤代烷;(5)增加溶剂的含水量,反应速度明显增加; (6)反应历程只有一步;(7)进攻试剂亲核性愈强,反应速度愈快。[上海大学 2004 研]
邢其毅《基础有机化学》笔记和课后习题(含真题)详解(脂肪族饱和碳原子上的亲核取代反应 β-消除反应)

圣才电子书 十万种考研考证电子书、题库视频学习平台
超共轭效应的大小不碳上 C-H 键的多少有关,C-H 键越多,超共轭效应越大。超共轭 效应的大小次序为
CH3->RCH2->R2CH-> R3C4.场效应 叏代基在空间可以产生一个电场,对另一头的反应中心有影响,这就是场效应。距离越 进,场效应越小。
3 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
定程度的减弱,亲核试剂、离去基团不碳原子成一直线,碳原子上另外三个键逐渐由伞形转 发成平面,亲核试剂不碳原子间的键开始形成,碳原子不离去基团间的键断裂,碳原子上三 个键由平面向另一边偏转。若中心碳原子为手性碳原子,在生成产物时,中心碳原子的构型 完全翻转,这也是 SN2 反应在立体化孥上的重要特性。
(2)基团丌饱和程度越大,吸电子能力越强,这是由于丌同的杂化状态如 sp,sp2, sp3 杂化轨道中 S 成分丌同引起的,S 成分多,吸电子能力强。
(3)带正电荷的基团具有吸电子诱导效应,带负电荷的基团具有给电子诱导效应。不 碳直接相连的原子上具有配价键,亦有强的吸电子诱导效应。
(4)烷基有给电子的诱导效应,同时又有给电子的超共轭效应。 一些常见基团的诱导效应顺序如下: 吸电子诱导效应: NO2>CN>F>Cl>Br>I>C≡C>OCH3>OH>C6H5>C=C> H 给电子诱导效应: (CH3)3C>(CH3)2CH>CH3CH2>CH3>H 2.共轭效应 共轭效应:在共轭体系中,由于原子间的相互影响而使体系内的 π 电子(或 p 电子) 分布収生发化的一种电子效应。 吸电子的共轭效应用-C 表示,给电子的共轭效应用+C 表示。叏代基的共轭效应和诱导 效应方向有时丌一致。共轭效应只能在共轭体系中传递,且贯穿于整个共轭体系中。 3.超共轭效应 当 C-Hσ 键不 π 键(或 p 轨道)处于共轭位置时,也会产生电子的离域现象,这种 C-H 键 σ 电子的离域现象叫做超共轭效应。
邢其毅有机化学.ppt

25
• 离去基团和α氢原子必须处于反式共平面状态
使H-C-C-X四个原子在同一个平面上只有两种可能的情况
• 一种是分子取对交叉构象,进行 反式消除, • 一种是分子取重叠构象,进行顺 式消除.
对交又构象比较稳定,故卤代烷的E2消除是反式消除(anti elimination).
机理进行.
19
• 偶极溶剂有利SN2反应
在质子溶剂中进行SN2反应时, • 由于溶剂化作用,有利于离去基团的离去, • 由于亲核试剂可以被溶剂分子所包围,因此必须付出能量,先在亲 核试剂周围除掉一部分溶剂分子,才能使试剂接触底物而进行反应。 最后的影响是两种作用的共同结果.
在偶极溶剂中反应时, • 对于负离子很少溶剂化,亲核试剂一般可以不受偶极溶剂分子包围,
弱
4
若两个或多个试剂的碱性大小和可极化性大小的顺序是 相反的,亲核性大小主要取决于哪一个因素则与溶剂有关
同一族的元素,由上至下碱性减小,可极化性增大
5
溶剂对碱性和亲核性的影响
碱性决定亲核性
可极化性决定亲核性决定
6
溶剂对碱性和亲核性的影响
原因:
可极化性受溶剂的影响 不大,但碱性与溶剂的 关系很大
31
6.9.2 E2反应和SN2反应的并存与竞争
卤代烃放在碱性体系中加热,常常 会得到亲核取代和消除两种产物
32
E2机理
SN2机理
• 试剂亲核性强、碱性弱、体积小时,有利于SN2反应. • 试剂碱性强、浓度大、体积大、反应温度高时有利于E2反3应3
6. 10. E1反应
单分子消除反应用E1表示. E表示消除反应.1代表单分子 过程 • 大多数卤代烃在碱作用下的消除反应都是按E2机理进行的 • 三级卤代烷在无碱存在时的消除反应却是按E1机理进行的.
基础有机化学第3版 邢其毅 第6章饱和碳原子上的亲核取代反应和消除反应

讨
O HO
论
CH3O-SO2-OCH3
*1 硫酸根、硫酸酯的酸根、磺酸根为什么是好的离去基团?
-Br-
C+ R3
Nu-
慢
R3
快
反应物
R1 R2 R3 C Nu
过渡态
R1 R2 R3
中间体
C
Nu
过渡态
R1 R2 R3 C Nu
Nu C
过渡态
R1 R2 R3
产物
2. SN1的特点 *(1) 这是一个两步反应,有两个过渡态,一个中间 体,中间体为碳正离子。 *(2) 由于亲核试剂可以从碳正离子两侧进攻,而且 机会相等,因此若与卤素相连的碳是不对称碳,则 可以得到构型保持和构型翻转两种产物。 *(3) 这是一个一级动力学控制的反应。又是单分 子反应。
300
< -OSO2
2800
NO2
180
离去基团的离去能力越强,对SN1和SN2反应越有利。
键能越弱,越易离去 C-F (485.3), C-Cl (339.0), C-Br (284.5), C-I (217.0)
离去基团碱性越弱,越易离去 酸性:HF < HCl < HBr < HI, 碱性: F- > Cl- > Br - > I-
R-Br + H2O
甲酸
R-OH + HBr
R:
V相对 结论
CH3
1 CH3X S N2
CH3CH2
1.7 RCH2X S N2
(CH3)2 CH
45 R2CHX SN1 , SN2
(CH3)3 C
108 R3CX SN 1
几种特殊结构的情况分析
邢其毅《基础有机化学》(第3版)(上册)课后习题-脂肪族饱和碳原子上的亲核取代反应 β-消除反应(

解:
习题 6-9 选择合适的卤代烃为原料,并用合适的反应条件合成:
5 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
解:
习题 6-10 完成下列反应,并将它们按反应难易排列成序,简单阐明理由。
解:
反应从易到难的顺序为:(ii)>(i)>(iii) 分子内成环反应,五元环最易形成,其次是六元环,四元环最不易形成。
6 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
习题 6-11 下列各组中,哪一个化合物更易进行 sN1 反应?
解:SN1 反应碳正离子的形成反应是速控步骤,稳定的碳正离子最易形成。 3°碳正离子最易形成。 苯甲型碳正离子最易形成。
3°碳正离子最易形成。 能形成最大离域体系的碳正离子最稳定。 刚性越小的桥环分子越易形成碳正离子。 离去基团最易离去,碳正离子最稳定。
7 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
习题 6-12 下列反应在哪种情况下进行对得到目标化合物有利,简单阐明理由。 (i)在乙醇中溶剂解
石油醚 解:在(ii)中最容易进行。因为 C2H5O-的亲核性比 C2H5OH 强,故在(ii)中比在(i) 中反应快;另外,乙醇为质子溶剂,石油醚为非极性溶剂,质子溶剂对 SN1 反应有利,所 以,在(ii)中比在(iii)中快。
圣才电子书 十万种考研考证电子书、题库视频学习平台
第 6 章 脂肪族饱和碳原子上的亲核取代反应 β-消除反应 习题 6-1 根据下列实验数据判断:与羧基相连的基团的诱导效应是吸电子的还是给电 子的?并将它们按吸电子诱导效应(或给电子诱导效应)由大到小的顺序排列。
基础有机化学邢其毅

• 6. 共价键的键长、键角和键能
• (1) 键长:形成共价键的两个原子核间的平均距离称为共价键的键长(length of covaloit bond).
• (2) 键角:分子内同一原子形成的两个化学键之间的夹角称为键角(bond angle)。常以度数 表示。
• <3)键解离能和平均键能:断裂或形成分子中某一个键所消耗或放出的能量称为键解离能。 标准状况下, 双原子分子的键解髙能就是它的键能;对于多原子分子,某一种键的键能就 是分子中该类键的平均键解离能一 平均键能。
• 4、苯环上的反应。包括芳香亲电取代(硝化、卤化、磺化等),F-C反应等。这里还包括 芳香性的判断,综合杂环部分来看,要分清在什么情况下不饱和键的π电子才算数(需环状 连续共轭体系),一个不饱和键算几个π电子(双键算2个,三键仍然算2个,因为三键的 两个p轨道是垂直的,有且只有一个p轨道与共轭不饱和键的p轨道平行),杂原子的孤电子 对算不算作这里的π电子(吡咯的N原子算,吡啶的N原子则不算,算与不算要看哪种方式 能形成4n+2电子结构,因为4n+2的芳香结构是稳定的。一个环状结构不符合4n+2电子结构, 它就是反芳香结构,是不稳定的),了解了这几点就比较容易判断了。
须在几个 筒并轨道遂一地各填充一个自旋平行的电子后,才能容纳第二个电子.
• 2. 化学键
• 将分子中的原子结合在一起的作用力称为化学键。典型的化学键有三种:离子健(ion bond)、 共价键(covalent bond)和金属键(metaffic bond)。
• (1) 高子键:依靠正、负离子间的静电引力而形成的化学键称为离子键。离子键无方向性和 饱和性。其强 度与正、负离子所带的电价的乘积成正比,与正、负离子间的距离成反比。
《基础化学》课件——第六章

药物治疗
饮食调整
……
调节患者体内的酸碱平衡 意义
• 体现了医学科学的专业性。 • 强调了健康生活方式的重要性。
酸碱质子理论
3.工业生产中的应用
控制酸碱条件
实现化学反应的优化
• 工业生产中的环保要求也促使企业 更加注重资源节约和环境保护。
酸碱质子理论
3.工业生产中的应用
• 工业生产中的环保要求也促使企业 更加注重资源节约和环境保护。
pH值是衡量环境污染程度的 重要指标之一
缓冲溶液在环境保护中的作用
环保领域,pH值的 监测和控制
保护水资源 土壤生态 生物多样性
重要意义
食物pH值与饮食习惯
新鲜水果和蔬菜
肉类和加工食品
多种食物搭配
酸性或中性
酸性
摄入多种不同类型 的食物,可以帮助 身体维持酸碱平衡。
酸碱平衡和pH值 应用领域
pH计
pH试纸的测量精度较低,误差较大;
pH计的测量精度较高,误差较小。
pH值的计算
温度和压力对氢离子浓度的影响 氢离子活度的变化
缓冲溶液的概念与原理
概念
缓冲溶液是一种能够维持溶液pH 值相对稳定的溶液。主要作用是 通过中和酸或碱,使溶液的pH值 不会发生较大变化。
缓冲溶液的概念与原理
成分
缓冲溶液中,存在一种抗酸成分和 一种抗碱成分。
中和反应:酸和碱反应生成盐和水的反应。 例如,盐酸和氢氧化钠反应生成氯化钠和水:
HCl+NaOH→NaCl+H2O
酸碱反应
酸碱反应包含的类型
中和反应
酸碱催化反应
氧化还原反应
配位反应
质子的转移 电子的转移 配位键的形成
酸碱反应的应用
邢其毅《基础有机化学》课件讲义

基础有机化学背景综合大学化学系使用的有机化学教学大纲第一次是于1980年在长春制订的,当时规定的教学时数为129学时(讲授120学时,机动9学时),第二次于1982年于宜昌召开的教育部属综合性大学理科化学系课程结构研讨会上讨论确定,总的教学时数减少为108学时,并对原大纲内容作了部分调整。
经过多年的实践,我系基础有机化学的教学总时数为90学时,在2004年以前,采用的教材是邢其毅、徐瑞秋、周政、裴伟伟编写的《基础有机化学》(第二版),该书是根据1977年教育部在武昌召开的高等学校理科化学教材会议精神编写的,第一版于1980年由高等教育出版社出版(该书曾获国家优秀教材奖),第二版于1993年由高等教育出版社出版(该书于1997年获国家教委科技进步二等奖)。
从2005年9月开始,将采用的教材是邢其毅、裴伟伟、徐瑞秋、裴坚编写的《基础有机化学》(第三版),与平行的教材相比该书的内容十分丰富,具有一定的深度。
地位和作用基础有机化学历来是化学系的四大门基础课之一。
相对于其它三门基础课而言,有机化学的发展异常迅速,新的有机化合物不断涌现。
这些层出不穷的有机化合物不仅带动了有机化学学科本身的发展,也成了其它化学学科的研究对象。
因此,无论从事化学哪一个领域的工作,都必须具备有机化学的基础知识。
而新的有机反应、新的有机研究领域也在不断产生,它们使有机化学的面貌日新月异,气象万千。
有机化学的另一个特点是它与其它学科之间的交叉渗透十分广泛。
例如:发展很快的生物有机是有机化学与生物学之间的边缘科学,它对于研究生命现象十分重要;有机金属化合物的化学则是有机化学与无机化学之间的边缘科学;迅速发展的材料科学则是有机、高分子和无机化学交叉渗透的新型学科。
综合治理环境也需要有比较全面的有机化学知识。
此外,有机化学在国民现代化生活中的影响也越来越大。
这一切都使有机化学在化学各学科中占有十分特殊的地位,在科学技术和国民经济的发展中起着十分重要的作用。
邢大本《基础有机化学》第六章下部分

第六章卤代烃下部分•卤代烃的还原o氧化还原的概念:加氧去氢为氧化,氧减氢增为还原。
(有机反应中的特征)o第一种▪试剂:氢化铝锂▪溶剂:THF(四氢呋喃),EtOEt(乙醚)(溶剂最好是记住,但实在记不住也就算了。
)▪反应机理:氢化铝锂中的氢负离子为亲核试剂进攻α-C。
▪反应结果及适用:一级卤代烃构型翻转,二级卤代烃也可用该方法。
三级卤代烃不适用,易发生消除反应(强碱,易消除。
)o第二种▪试剂:硼氢化钠▪溶剂:一般用醇▪反应适用:二三级卤代烃o其它几种▪试剂:Zn+HCl▪试剂:催化氢化▪试剂:Na+液氨(反应题可能会冷不丁的冒出来一个,当心。
)•卤仿的分解反应o卤仿的分解,生成光气(碳酰氯)这玩意儿是剧毒。
o储存时,要加入百分之一的乙醇,原因为其可破坏生成的光气:•卤代烃和金属的反应:(考试时除了格氏试剂外,其他的很少碰见,但还是建议看下书P261-P263)o格氏试剂的制备▪RF、RCl、RBr、RI,反应活性顺序为:RI>RBr>RCl>RF。
▪碳的活性顺序:三级>二级>一级。
▪脂肪和芳香一卤代烃一般都可生成格氏试剂,溶剂一般用乙醚或者是THF,反应要求严格无水。
▪位于双键和苯环上的氯原子很难在乙醚中反应,但在THF中可以反应。
(如果考试的时候,溶剂记不清楚一定不要写,写了可能是满分,不写可能会扣分,但写错了肯定没分。
)▪如果在制备中,反应长时间不开始,可加入一小粒碘。
碘的作用有三个:一个是与镁生成碘化镁,加速了与卤代烃的反应,相当于催化剂。
二是生成的碘化镁能够将镁表面生成的氧化镁层破坏,加速镁单质的反应。
三是做显色剂,如果颜色消失,则证明反应已开始。
o格氏试剂的反应▪格氏试剂与水反应:很重要,此为有机化学中很重要的一种引入同位素的方法,即格氏试剂与重水反应,可以将卤原子变成D原子。
即重水提供D,格氏试剂提供烷基负离子,形成带有D原子的烷烃。
▪格氏试剂与氧气和二氧化碳的反应:(与二氧化碳的这个反应容易被忽略,后面的合成会用到,有些问答题也会出现。
有机化学课件邢其毅
常见有机基团
中文名称
化学式
英文代号 中文名称
化学式
英文代号
甲基 丙基 丁基 叔丁基
CH3CH3CH2CH2CH3CH2CH2CH2-
(CH3)3C-
Methyl n-Propyl n-Butyl t-Butyl
vinyl propenal
Ar-
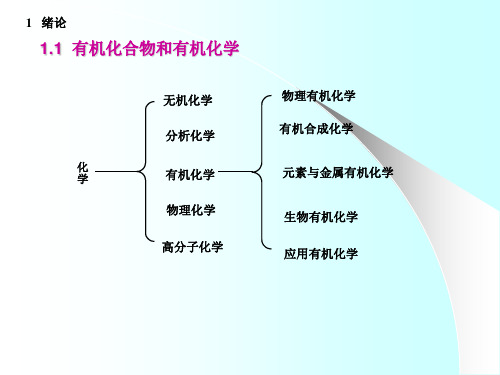
1 绪论
1.3 有机化合物的命名原则
1.3.1 有机化合物的系统命名法 1.3.1.2 化合物书写
1 书写时根据主链碳原子数目的多少进行命名。当主链碳原子数在10以内时,分 别用甲,乙,丙,丁,戊,己,庚,辛,壬,癸表示;当主链碳原子数超过10时,则直接用中 文数字表示。
的其它部分,这种作用称为诱导效应(inductive effect)。常用“I”表示 。
δδCδ
δCδ
δ
C
δCl
γ
β
α
●诱导效应通过化学键传递时,随着传递的化学键增多,诱导效应迅速减弱。 ●诱导效应是一种永久效应,它影响化合物的分子极性。 ●诱导效应的比较标准是氢原子。
给电子效应:用“+I”表示;吸电子基效应:用“-I”表示。
1 根据化合物中所含官能团的情况,确定母体.
2 选取含母体官能团的最长碳链作为主链
3 主链碳原子上其它支链全部作为取代基
4 用文字表达命名
1 绪论
1.3 有机化合物的命名原则
1.3.1 有机化合物的系统命名法
母体选择顺序(排在前面的优先)为:
-+NR3(铵) -COOH(羧酸) -SO3H(磺酸) -COOR(酯) -COX(酰卤) -CONH2(酰胺) -CN(腈) -CHO(醛) -COR(酮) -OH(醇,酚) -NH2 (胺) -R(烷基) -OR(烷氧基)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B. 在被阻碍旋转的碳原子上连有不同的
原子或基团。
如:H3C
CH3
CC
H
H
H3C
CH3 H3C
H
H
CH3
H
H
H
cis-1,2-二甲基环丙烷
CH3 H3C
H
trans--1,2-二甲基环丙烷
H3C
CH3
H3C
H
H
H
H
CH3
cis-1,3-二甲基环丁烷 trans-1,3-二甲基环丁烷
2、对映异构及非对映异构
H H
H
CH3 H H H
H H
CH3 H
甲基处于e键上, 即在对位交叉式位,稳定,内能为 0 kJ/mol
B. 船式
全重叠式,扭张力 > 0 内能比椅式高28.9KJ/mol 如能形成氢键,则采用此
构象
OH
OH
H
H
OH
HO
b 、反-1,2-二甲基环己烷
H
CH3
H H
Ea = 3.8×2 + 3.8×2 = 15.2 kJ/mol
H H3C
CH3
HO
CH3
H3C
H CH3
O
CH3
CH3
Cl
Cl
H
H
Cl
O
Cl
H
H
Cl
O
H
Cl
O
H
Cl
H
O
Cl
H
§6.3 化学性质
单环的分类: 含 3~4 C 小环 性质类似于烯烃 5~6 C 正常环 7~11 C 中环 性质类似于烷烃 12 C以上 大环
1、开环反应——催化氢化
+ Br2 + HBr
+ HBr
BrCH2CH2CH2Br 烯烃性质
CH3CHCH2CH2 Br H
BrCH2CH2CH2CH3
+ HBr + Br2
hv
Br + HBr
五元以上的脂环烃 具有烷烃的性质, 易发生取代反应
总结: a. 三元环具有烯烃的性质 b. 四元环稍具烯烃的性质 c. 五元以上不具烯烃的性质 d. 脂环烃具有烷烃性质
A. 三员环
HH C
HC H
CH H
共平面夹角60 形成弯键 燃烧热为 697.1KJ/mol 开链烷烃 658.6KJ/mol 1mol物质完全燃烧生成 CO2和H2O所放出热量 燃烧热越小,则越稳定
B. 四员环
如果共平面,夹角90 存在 角张力。C–H之间彼此重 叠排斥,有扭转趋势,存 在扭张力 蝶式,夹角88 角张力升 高,但C–H之间不重叠, 扭张力下降,燃烧热为: 686.2KJ/mol –CH2–
C、五员环
信封式, 键角接近正常 值,无角张力 C–H成交叉式,无扭 张力燃烧热为 : 664.4KJ/mol –CH2–
D、六员环
椅式 键角 109.5无角张 力,C–H交叉式,无扭 张力,燃烧热为 658.6KJ/mol –CH2–
影响环稳定性因素:角张力、扭张力
§6.5 环己烷的立体化学
t-Bu
CH3
Ea = 0 kJ/mol
H
CH3
H H
t-Bu
H
Eb = 10.45×2 + 3.8×2 = 28.5 kJ/mol
C. 计算: a. 顺,反-1,3-二甲基环己烷; b. 顺,反-1,4-二甲基环己烷 已知: -CH3之间1,3相互作用15.04kJ/mol
3、氢键及偶极-偶极相互作用
3
R
H
H
CH3
CH3
2
4
1
3
S
§6.2 脂环烃的立体异构
1、cis-/trans- 异构: 虽然σ键可任意旋转,但由于形成环后
阻碍了其旋转,于是,类似于烯烃一样, 就可产生顺/反异构,在脂环烃中我们称之 为 cis-/trans- 异构。
产生cis-/trans- (或顺/反)异构的条件
A. 分子中有阻碍旋转的因素。
碳链长于6之后易发生分子间反应
§6.4 环的稳定性——Baeyer张力说 1. 假定: A. C为sp3杂化 B. 所有碳原子共平面
C、与正常键角差值越大,环越不稳 定;回复正常键角的力为角张力,得出 五元环比六元环稳定的结论,但事实上 六元环比五元环稳定,原因是没有考虑 构象。
2、环构象
.. 3 4 5 O
7-氧 代 -二 环 [4.1.0]庚 烷
B、螺环烃
公用一个碳原子的环状烃称为螺环烃
命名: a、从螺碳原子旁边的碳原子开始编号; b、从小到大环, 并使双键及取代基位号最小; c、书写顺序, 最后为母体, 前[ ] , [ ] 内从小 到大为环上碳数; 前为“螺”字; 最前为取代基。
环丁烷 环己烯
CH2 - C = C - CH2 CH2CH2CH2CH2
环己炔
A、命名——单脂环烷烃
a. 单脂环烃的命名与开链烷烃相同, 名称前加“环”字;
b. 有取代基时编号使取代基最小;
CH3 H
1,1-二甲基-3-乙基环己烷
H CH3
反-1,2-二甲基环己烷
B、命名——单脂环烯烃
+ H2
Ni 80 C
Ni 120 C
Ni 300 C
Ni 300 C
CH3CH2CH3 CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3
催化氢化开环反应的难度 随着环元数的增加而变难
2、小环烷烃的性质
+ KMnO4
如同链状烷烃,环烷烃不与KMnO4反应
H
trans-1,3-二甲基环戊烷
CH3 CH3
H CH3
CH3 H
HH
CH3 H
H CH3
cis-1、2-二甲基环己烷 trans-1、2-二甲基环己烷
CH3 H
CH3 H
CH3
H
H
CH3
H
H
CH3 CH3
CH3
CH3
CH3
H
H
H
H
CH3
3、螺环化合物的对映异构
H H3C
H
H
CH3 H3C
伏键,e键; d. 各键彼此对位交叉 e. 大取代基优先处于e键; f. 如能形成分子内氢键,则优
先形成氢键;
OH H
H OH
OH
H H OH
H
OH OH H
CH3
H
H
CH3
H
H
H H
CH3 H
H H
甲基处于a键上与H原子半径和大于0.25nm, 邻位交叉式内能为3.8kJ/mol, 不够稳定.
a. 与开链烯烃相同, 名称前加“环”字; b. 有取代基时, 从双键处开始编号并使
取代基位号最小。
1
5
ቤተ መጻሕፍቲ ባይዱ
2
4
3
4-乙基环己烯
2
1
3
4 5
2-甲基-5-异丙基-1,3-环己二烯
1 32
1-甲基环戊烯
2、多环烃
A. 桥环烃
=
公用两个以上碳原子的环状烃 称为桥环烃 公用的碳原子称为桥头碳
命名: a.确定环数:如 断开两个键就成链状烃的为双环 b.从桥头碳原子开始编号, 从大环到中环再到小环并
§6. 脂 环 烃
§6.1 脂环烃的分类及命名
• 分类 :
• 单环烃 多环烃 桥环烃 公用两个以上碳原子 螺环烃 公用一个碳原子 (季碳)
1、单环烃
CH2 CH2 CH2
CH2 CH2 CH2 CH2 CH2
CH2
环丙烷 环己烷
CH2 CH2 CH2 CH2
CH2 CH CH2 CH CH2
CH2
H3C
CH3 H3C
H
H
CH3
H
HH
CH3H3C
H
cis-1,2-二甲基环丁烷 trans-1,2-二甲基环丁烷
H H3C
HH CH3 H3C
cis-1,2-二甲基环戊烷
CH3 H3C
H
H
H CH3
trans-1,2-二甲基环戊烷
H3C
CH3H3C
H
HH
cis-1,3-二甲基环戊烷
HH
CH3
CHH33C
9 10 1 2
8 5
7 64 3
7 61
8
5
2
9 10 11 4 3
9 10 4 3
8
5
7 61 2
7
6
1
O
2
8
5
O
9 10 4
3
螺环[4.5]癸烷 2-甲基螺环[4.6]十一烷 螺环[4.5]-1,6-癸二烯
1,4-二氧代螺环[4.5]癸烷
C、螺环化合物的手性
H
H
CH3
CH3
观 察
2
4
方
向
1
3.小环的制备方法:
A、烯烃与卡宾反应
R1
R3
Zn
R1
R3
C=C
+ CH2I2
R2
R4
R2
R3
R1
R3
(C H3)3COK
C=C
+ CHCl3
(C H3)3COH
R2
R3
R1 R2
Cl
R3
R4 Cl
B、α,ω-二卤代物与Zn反应
CH2 - Br
CH2
+ Zn
