物质的量及其有关计算
高中化学基础知识复习1物质的量计算

高中化学基础知识复习(一)物质的量及计算一、此部分对应的公式(弄清各字母在题目中对应的含义)1、主要公式N m V气n = = = = c V溶液N A M Vmn———物质的量的符号,单位为。
代表一定数量的微粒的集合。
N A———代表1mol任何微粒的个数,其数值为。
M———摩尔质量,单位为。
代表1摩尔物质的质量,在数值上等于该物质的。
Vm———气体摩尔体积,单位为。
代表1摩尔气体的体积。
在标况下Vm 的数值为。
N———为个数m ———为物质的,单位为。
V气———为的体积,单位为。
c ———为溶液的物质的量浓度,单位为。
V溶液———为的体积,单位为。
2、常用公式物质密度的计算公式:ρ= m/V = M/Vm物质的量浓度和溶质质量分数之间的关系: c =(1000ρ•w%)/M稀释定律:c浓·V浓= c稀·V稀二、阿伏加德罗定律及其推论阿伏加德罗定律——同温同压下,相同体积的任何气体的物质的量相同。
即:等温等压条件下:V1 N1 n1= =V2 N2 n2三、练习题1、6.02×1023个SO2分子,64g O2, 2mol H2,它们所含原子个数比为,质量比为。
2、相同质量的NO和NO2,它们的物质的量比为,所含原子个数比为,所含氧原子质量比为,在同温同压下,它们的体积比为。
3、0.2mol金属钠与足量水反应,转移电子总数为:。
4、已知某气体在标准状况下的体积为0.2L,气体质量为0.25g , 计算该气体的相对分子质量。
5、下列各组中两种气体的分子数一定相等的是( ) A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4C.体积相同、密度相等的CO和C2H4 D.压强相同、体积相同的O2和H26、下列条件下,两瓶气体所含原子数一定相等的是( ) A.同质量、同体积的C2 H4和C3 H6B.同温度、同体积的N2和H2C.同体积、同密度N2和NO D.同体积、同压强的N2O和CO27、下列叙述正确的是()A.同温同压下,相同体积的物质,它们的物质的量必相等B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等C.1L一氧化碳气体一定比1L氧气的质量小D. 等体积、等物质的量浓度的强酸中所含的H+ 数一定相等8、下列说法不正确的是()A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等B.6.02×1023个氮分子和6.02×l023个氢分子的质量比等于14:1C.32g氧气所含的原子数目为2×6.02×1023D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L9、用N A表示阿伏加德罗常数,下列叙述中正确的是()A.0.1mol·L-1稀硫酸100mL中含有硫酸根个数为0.1N AB.1mol CH3+(碳正离子)中含有电子数为10N AC.2.4g金属镁与足量的盐酸反应,转移电子数为2N AD. 12.4g白磷中含有磷原子数为0.4N A10、N A代表阿伏加德罗常数值,下列说法正确的是()A.9g重水所含有的电子数为5N AB.1molMgCl2中含有离子数为N AC.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2N AD.1molC10H22分子中共价键总数为31N A11.设N A代表阿伏加德罗常数的数值,下列说法正确的是()A.22.4 L Cl2中含有N A个C12分子B.1 mol浓硫酸做氧化剂时,通常得到的电子数为2N AC.4.6克金属钠投入到足量的重水(2D216O)中,则产生的气体中含有0.1N A个中子D.1 L 0.1 mol·L-1 Na2SO4溶液中有0.1 N A个Na+12.下列叙述中,正确的是()A.1 mol 过氧化钠中阴离子所带的负电荷数为6.02×1023B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为6.02×1023C.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×102313.下列说法正确的是()A.2.24 L CO2中含有的原子数为0.3×6.02×1023B.1.8 g NH4+ 含有的质子数为6.02×1023C.30 g乙酸和甲酸甲酯的混合物中含有的共价键数为4×6.02×1023D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×102314.下列有关叙述正确的是()A.标准状况下,2.24 L C6H14中含有的共用电子对数为1.9×6.02×1023B.同温同压下,原子数均为6.02×1023的氢气和氦气具有相同的体积C.0.50 mol的亚硫酸钠中含有的钠离子数为6.02×1023D.常温下,7.1gCl2与足量NaOH溶液作用,转移电子的数目为0.2×6.02×102315.下列说法正确的是()A.7.1 g C12与足量NaOH溶液反应转移0.2×6.02×1023个电子B.28 g乙烯和丙烯的混合气体中含有2×6.02×1023个碳原子C.标准状况下,2.24 L H2O含有的分子数等于0.1 N AD.2.9 g乙基(一C2H5)含有的电子数为1.8 N A个16.下列叙述中正确的是()A.0.1 mol Cu和足量的稀硝酸反应时,转移的电子数为0.1×6.02×1023B.4.4g CO2中所含有的原子总数为0.3×6.02×1023C.标准状况下,2.24L溴乙烷中含有的溴离子数目为0.1×6.02×1023D.在1L 0.1mol/L的硫酸铁溶液中含有的三价铁离子数为0.2×6.02×102317.下列说法正确的是()A.2.8g C2H4和C3H6的混合物中含碳原子数为0.2×6.02×1023B.在O2参与的反应中,1 mol O2做氧化剂时,得到电子数一定是4×6.02×1023C.1 L 0.1 mol/L 的Na2S溶液中硫离子数为0.1×6.02×1023D.标准状况下,11.2 L乙醇中氧原子数为0.5×6.02×102318.(朝阳08第11题)N A表示阿伏加德罗常数,下列说法正确的是( ) A.在1 L 1mol / L 的AlCl3溶液中,Al3+和Cl-离子总数为4N AB. 标准状况下,1 L辛烷完全燃烧后,所生成气态产物的分子数为8/22.4N AC. 活泼金属从盐酸中置换出1 mol H2,发生转移的电子数为2N AD. 常温常压下,1 mol氦气含有的电子数为4N A19.(崇文08第5题)下列说法正确的是( ) A.6.2g氧化钠和7.8g过氧化钠混合物中所含有的离子数目为0.7×6.02×1023B.1L 0.1mol•L-1Na2CO3溶液中,CO32-的数目小于0.1×6.02×1023C.6.4 gSO2在一定条件下与足量氧气充分反应后失去的电子数目为0.2×6.02×1023 D.标准状况下,22.4L CH4和CHCl3的混合物所含有的分子数目为6.02×102320.(东城08第13题)阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( ) A.2.4g 镁作还原剂时失去电子数是0.1×6.02×1023B.标准状况下,22.4L 氮气中含有的共价键数是6.02×1023C.标准状况下,5.6 L的甲醛所含的电子数是4×6.02×1023D.100mL 1mol/L氨水溶液中,铵根离子的个数0.1×6.02×102321.(丰台08第12题)常用N A表示阿伏加德罗常数,下列有关叙述正确的是( ) A.标准状况下,11.2L CHCl3中所含的分子数为0.5N AB.7.1g C12与足量NaOH溶液反应转移的电子数为0.2N AC.常温常压下,0.1 mol氖气所含的电子数为N AD.18gH2O的体积一定是18mL,所含的分子数为N A22.(石景山08第7题)阿伏加德罗常数约为6.02×1023 mol-1,下列说法正确的是( ) A.1 mol H2O2完全分解时转移电子数为2×6.02×1023B.30 g乙烷中所含极性共价键数目为7×6.02×1023C.20g H218O中含有的中子数为8×6.02×1023D.常温下,42 g乙烯和丁烯的混合气体中含有的碳原子数为3×6.02×102323.(西城08第14题)阿伏加德罗常数的近似值为6.02×1023,下列说法正确的是( ) A.5.6 g铁与足量盐酸反应转移的电子数为0.3×6.02×1023B.48 gO3气体含有的O3分子数为6.02×1023C.0.5 mol/LCuCl2溶液中含有的Cu2+离子数为0.5×6.02×1023D.标准状况下,33.6 LH2O含有的H2O分子数为1.5×6.02×102324.(宣武08第13题)下列叙述正确的是( ) A.18g D2O中含有的质子数为10×6.02×1023个B.1mol碳正离子(CH5+)中含电子数为10×6.02×1023个C.44g C3H8分子中含共价键数为11×6.02×1023个D.1L 1mol·L-1醋酸溶液中离子总数为2×6.02×1023个25.(延庆08第5题)下列说法正确的是( ) A.100 mL 2.0 mol/L 的氯化铜溶液中铜离子个数为0.2×6.02×1023B.1mol烷烃(C n H2n+2)含有的共价键数目为(3n+1)×6.02×1023C.标准状况下,11.2 L四氯化碳所含分子数为0.5×6.02×1023D.24g镁在足量CO2中燃烧转移的电子数目为4×6.02×102326.(东城09第11题)下列说法正确的是( ) A.标准状况下,11.2 L H2中所含中子数为6.02×1023B.14 g C2H4和C3H6的混合物中,H原子数为2×6.02×1023C.1 L pH=1的HCl溶液中,HCl分子数为6.02×1022D.常温常压下,8 g CH4中所含的共用电子对的数目为6.02×102327.(丰台09第10题)设N A为阿伏加德罗常数,下列说法不正确的是( ) A.标准状况下C2H4气体22.4L,所含电子数为16N AB.0.1mol铁在纯氧中充分燃烧,失电子数为0.3N AC.1L 0.2mol/L的氯化铁溶液中,氯离子数为0.6N AD.室温下,16g甲烷含有共价键数为4N A28.(西城09第8题)阿伏加德罗常数的近似值为6.02×1023,下列说法中正确的是( ) A.12 g金刚石中所含共价键数目为6.02×1023B.22.4 L的HCl溶于水,溶液中H+离子数为6.02×1023C.1 mol CO2与含1 mol NaOH的溶液反应后,溶液中HCO3—离子数为6.02×1023D .Na 2O 2与H 2O 反应,常温常压下生成16 gO 2,反应中转移电子数为6.02×102329.(崇文09第4题)下列叙述中正确的是 ( )A .Cu 和足量的稀硝酸反应产生4.48L 气体时,转移的电子数为0.6×6.02×1023B .常温常压下,8.8g CO 2和N 2O 混合物中所含有的原子总数为0.6×6.02×1023C .标准状况下,3.36L 溴乙烷中含有的溴离子数目为0.15×6.02×1023D .在1L 0.2mol/L 的硫酸铁溶液中含有的三价铁离子数为0.4×6.02×102330.(宣武09第6题)下列说法正确的是 ( )A .7.1g C12与足量NaOH 溶液反应转移0.2×6.02×1023个电子B .1mol 乙酸分子与1mol 甲酸甲酯分子中都含有7×6.02×1023个共用电子对C .28g 乙烯和丙烯的混合气体中含有2×6.02×1023个碳原子D .2 mol/L 的 MgCl 2溶液中含有2×6.02×1023个Mg 2+31.(海淀08第14题)下列说法中正确的是 ( ) ①标准状况下,22.4 L 己烯所含有的分子数约为6.02×1023②标准状况下,a L 的氧气和氮气的混合物含有的分子数约为4.22a ×6.02×1023 ③7.1 g 氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2×6.02×1023④10 g 重水中含有中子数约为4×6.02×1023⑤1 mol 乙醇中含有的共价键数约为7×6.02×1023⑥500 mL 1 mol/L的硫酸铝溶液中含有的硫酸根离子数约为9.03×1023A.①④B.②⑤C.③⑤D.②⑥32.下列说法正确的是( ) A.1molFe与足量盐酸反应,转移的电子总数为1.806×1024个B.常温常压下,1 mol羟基(-OH)所含电子数为6.02×1024个C.常温常压下,34g H2O2中含有共用电子对数为1.806×1024个D.58.5gNaCl晶体中离子总数为6.02×1023个33.为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol•L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol•L-1NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。
物质的量浓度及其相关计算

22 .4ac
C.
L
bN A
22 .4bc
D.
L
aN A
中小学 1 对 1 课外辅导专家
例 2:按体积比为 4:2:3 所组成的 N2、O2、CO2,混合气体 100g 在标准状况下体积为__
_
解析:根据阿伏加德罗定律,三种气体的体积比为 4:2:3,物质的量之比也为 4:2:3,可当作 4mol,2mol,3mol.
例 3:在同温同压下,某瓶充满 O2 的质量为 116g,充满 CO2 的质量为 122g,充满气体 X 质量为 114g,则 X 的相对分
子量为( )
A、28
B、60
C、32
D、44
例 4:下列说法正确的是(
)
A.标准状况下,1mol 任何物质的体积都约为 22.4L
B.1mol 任何气体所含分子数都相同,体积也都约为 22.4L
1.关于 m g H2 和 n g He 的下列说法中,正确的是 A.同温同压下,H2 与 He 的体积比为 m∶2n B.同温同压下,若 m=n,则 H2 与 He 的分子数之比为 2∶1
C.同温同压下,同体积时,H2 与 He 的质量比 m >1 n
D.同温同压下,H2 与 He 的密度比为 1∶2 2.标准状况下有①0.112 L 水 ②3.01×1023 个氯化氢分子 ③13.6 g H2S 气体 关系由小到大排列正确的是
①粒子数多少。 ②粒子本身大小。 ③粒子间距离大小 影响固体、液体体积的因素:①② 影响气体体积的因素:①③
影响气体分子间距离的条件:
温度:T↑,分子距离↑
压强:P↑,分子距离↓
2、气体摩尔体积的概念 单位物质的量的气体所占的体积叫做气体摩尔体积。
高中化学物质的量及其相关计算练习苏教版必修1

物质的量相对原子质量:H:1 C:12 N:14 O:16 F:19 Na:23 Mg:24 Al:27 P:31 S :32 Cl :35.5K:39 Ca:40 Fe:56 Cu:64 Zn:65物质的量概念1. 下列说法正确的是( )A.物质的量可理解为物质的质量B.物质的量就是物质的粒子数目C.物质的量是量度物质所含粒子多少的一个物理量D.物质的量的单位——摩尔只适用于分子、原子和离子2.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。
如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg。
那么一个铅笔字含有的碳原子数约为()A.2.5×1019个 B.2.5×1022个 C.5×1019个 D. 5×1022个3. 对于物质的量相同的硫酸和磷酸(H3PO4),下列说法不正确的是( )A.分子个数相等B.含有的氧原子数相等C.含有的氢原子数相等D.质量相等4. 某元素1个原子的质量为a g,一个碳原子(126 C)的质量为b kg,则该元素的相对原子质量为( )A.b a12B.a b12C.12abD.N A a5.设N A表示阿伏加德罗常数的值。
下列说法不正确的是()A.1mol硫酸的质量与NA个硫酸分子质量相等B. NA 个氧分子和NA个氢分子的质量比等于16:1C. 28g氮气所含的原子数目为NAD. 1.7g氨气所含电子数目为NA6. 下列关于物质的量的叙述,错误的是( )A.1mol任何物质都含有6.02×1023个分子B.0.012 kg 12C中含有约6.02×1023个碳原子C.1 mol水中含有2 mol氢原子和1mol氧原子D.1 mol Ne中含有6.02×1024个电子7.设N A表示阿伏加德罗常数,下列说法正确的是 ( )(A)常温常压下,11.2 L氯气所含有的原子数目为N A(B)9 g水所含有的电子数目为0.5N A(C)在同温同压时, 相同物质的量的任何气体的体积相同且为11.2L(D)0.1 mol甲烷分子含有的质子数目为N A8.下列说法中正确的是(N A为阿伏加德罗常数)A.1mol任何物质都含有阿伏加德罗常数个分子B.7.8g Na2O2含有0.4N A个离子C.阿伏加德罗常数个粒子的集体就是1molD.1mol离子化合物中阴、阳离子的总数等于N A9.设N A表示阿伏加德罗常数,下列叙述正确的是()A.常温常压下,N A个CO2分子的质量总和为44 gB.常温常压下,1mol氦气含有的核外电子数为4 N AC.12.4 g 白磷(P4)中含有的磷原子数为0.4 N AD.0.1 mol·L-1稀硫酸100 mL中硫酸根个数为0.1 N A10. 4 ℃时,若20滴水恰好为1 mL,那么1滴水中所含的水分子数约为(NA表示阿伏加德罗常数的值)( )A.20NA B.NA/360 C.9 N A/10 D.360/NA11.欲使每10个水分子中溶有1个Na+,则90g水中应投入金属钠的质量为[]A.10.5g B.11.5g C.21g D.23g12.2.16gX2O5中含有0.1mol氧原子,则X的相对原子质量为()(A)21.6 (B)28 (C)14 (D)3113.已知铁的相对原子质量是56,则1个铁原子的质量是g。
高二化学学业水平测试复习专题专题一物质的量及其计算

专题一、物质的量及其计算一、有关概念(n 、NA 、M 、Vm 、c )及其内涵1、物质的量、物质的量 (1)概念:用)概念:用 中所含的原子数目作为标准来衡量其他微粒集体所含微粒数目多少的目多少的 ,符号为,符号为 。
(2)单位:)单位: ,简称,简称 ,符号,符号 。
[注意事项] (1)“物质的量”是专用名词,是七个“物质的量”是专用名词,是七个 之一,在表达中四个字不可拆分。
之一,在表达中四个字不可拆分。
(2)物质的量及其单位摩尔计量的对象不是宏观物体,它只适于表示如:如: 等微粒及这些微粒的特定组合。
等微粒及这些微粒的特定组合。
(3)使用摩尔时必须用化学式指明微粒的种类,严禁指代不明。
例如: 1mol H 2表示的意义是表示的意义是 还应明确微粒的内在联系,如:1mol Al 2(SO 4)3中含___ mol _Al 3+,_____ mol SO 42-,1 mol Na+中含中含 mo l 质子质子 ;电子;电子 mol 。
2、阿伏加德罗常数、阿伏加德罗常数(1)概念:)概念: 摩任何微粒所含的微粒数或摩任何微粒所含的微粒数或 所含的碳原子数,符号为所含的碳原子数,符号为 ,近似值为近似值为(2)微粒个数N 与物质的量的关系:n = 或 N = [注意事项] (1)阿伏加德罗常数是一个)阿伏加德罗常数是一个 值。
6.02×1023是一个是一个 值,它是通过实验测定的,值,它是通过实验测定的,常用于计算,不能用于有关概念中。
常用于计算,不能用于有关概念中。
(2)阿伏加德罗常数不是一个数,而是有单位的,单位是而是有单位的,单位是【练习】①0.25 mol H 2SO 4中约含中约含个氧原子;个氧原子; ②3.01×3.01×101024个NH 4+的物质的量为的物质的量为 mol ③含2 N A 个氢原子的磷酸分子的物质的量为个氢原子的磷酸分子的物质的量为④0.5mol Fe 2(SO 4)3中所含的Fe 3+离子数为离子数为3、摩尔质量、摩尔质量(1)概念:单位物质的量的物质所具有的)概念:单位物质的量的物质所具有的 单位单位 符号符号(2)与相对原子质量的关系:当微粒(原子、离子、单质、化合物等)的摩尔质量以克为单位时,在数值上等于以克为单位时,在数值上等于例: M (O 2)= M (CO 32-)= M (H 2SO 4)= M (NH 4+)= (3)有关计算:)有关计算: n = n = n = ((m 与M 关系)关系) m= m= m=[思考1]下列正确的是下列正确的是 (( ))A .摩尔可以把物质的宏观数量(质量、气体体积等)与微观粒子的数量联系起来B .水的摩尔质量和1mol 水的质量均可计为18g 18g··mol -1C .水的摩尔质量和1mol 水的质量均可计为18g 18gD .硫酸和磷酸的摩尔质量在数值上相等.硫酸和磷酸的摩尔质量在数值上相等 [思考2]设N A 代表阿伏加德罗常数,下列说法是否正确?①1mol 任何物质中都含有6.02×1023个粒子;个粒子;= g ,含有,含有 个 = ;含有;含有 NA = ,含有,含有 个电子。
物质的量浓度及其计算

n
c
Байду номын сангаас
V
n (溶液)
c
注意:当气体溶于一定体积的水后,溶液的体积不再是
原来水的体积。
② 若已知溶液的密度
在标准状况下,V L气体(摩尔质量为 M g/mol)完全溶
于 1L水中,所得溶液的密度为 ρ g/cm3,求其物质的量
浓度 c 。
n
V
mol
22.4
v M 1
V 22.4
mL103 L·mL-1
在同一溶液中,不同粒子(分子、离子等)的物质 的量浓度之比等于其粒子数目之比。
③电荷守恒规律:任何溶液都呈电中性,则
溶液中阳离子所带的正电荷总数等于阴离子所 带的负电荷总数。(高考重点)
如:1. 在Na2SO4溶液中
电荷守恒 c(Na+) ×1= c(SO42-) ×2
2. 在K2SO4、MgSO4的混合溶液中
(4)某些物质溶于水后与水发生反应生成了另 一种物质,此时溶质为反应后的生成物。
例:CaO 溶于水后溶质是Ca(OH)2。 Na2O 溶于水后溶质是NaOH。
(5)带有结晶水的物质作为溶质时,其“物
质的量”的计算,用带有结晶水的物质的
质量除以带有结晶水的物质的摩尔质量即
可。 例如:a克 CuSO4·5H2O 作为溶质,则溶质 “物质的量”的求法为:
① MnO2 + 4HCl(浓) 87g 4 mol
xg
y mol
② MnO2 + 4HCl(浓) 4 mol y mol
MnCl2 + 2H2O + Cl2 ↑
MnCl2 + 2H2O + Cl2 ↑ 22.4 L xL
高中化学练习-物质的量浓度及其有关计算_word版含解析

(4)该同学实际配制得到的浓度为4.5 mol/L,可能的原因是________. A.量取浓H2SO4时俯视刻度B.容量瓶洗净后未经干燥处理C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作D.定容时仰视刻度线练高考——找规律1.(2013·新课标全国卷Ⅱ)N A为阿伏加德罗常数的值.下列叙述正确的是()A.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2N AB.12 g石墨烯(单层石墨)中含有六元环的个数为0.5N AC.25 ℃时pH=13的NaOH溶液中含有OH-的数目为0.1N AD.1 mol的羟基与1 mol的氢氧根离子所含电子数均为9N A2.(2013·四川卷)1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀.下列说法不正确的是()A.该合金中铜与镁的物质的量之比是2:1B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/LC.NO2和N2O4的混合气体中,NO2的体积分数是80%D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL练模拟——明趋势3.(正定中学月考)下列操作能达到目的的是()A.将58.5 g NaCl溶于1 L水中可得1 mol·L-1的NaCl溶液B.将标准状况下22.4 L HCl溶于1 L水中可得1 mol·L-1盐酸C.将25.0 g胆矾溶于水后配成100 mL溶液,所得溶液的浓度为1 mol·L-1 D.将78 g Na2O2溶于水,配成1 L溶液,其浓度为1 mol·L-14.(黑龙江模考)下列说法正确的是()A.现需480 mL 0.1 mol·L-1硫酸铜溶液,则使用容量瓶配制溶液需要7.68 g 硫酸铜固体B.配制1 mol·L-1 NaOH溶液100 mL,用托盘天平称量4 g NaOH固体放入100 mL容量瓶中溶解C.制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并继续煮沸至红褐色D.使用量筒量取一定体积的浓硫酸配制一定物质的量浓度的稀硫酸,将浓硫酸转移至烧杯后需用蒸馏水洗涤量筒,并将洗涤液一并转移至烧杯5.(廊坊期中)下列情况会使所配溶液浓度偏低或其他测量值偏低的是()①用稀醋酸和稀氢氧化钠溶液反应测定中和热;②用滴定管量取液体时,开始时平视读数,结束时俯视读数所得溶液的体积;③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;④在用标准液(已知浓度)滴定未知溶液时,盛标准液的滴定管水洗后未润洗;⑤定容时,仰视容量瓶的刻度线A.①③⑤B.①②⑤C.②③④D.③④⑤6.(安徽模拟)某乙醇水溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为d g·mL-1,1 kg这种溶液中含有的乙醇是()A.46c g B.c/d mol【…、¥.】【…、¥.】。
高一化学物质的量笔记

高一化学物质的量笔记一、物质的量1.定义:物质的量是一个物理量,表示含有一定数目粒子的集合体。
符号为n,单位为摩尔(mol)。
2.意义:物质的量是联系宏观物质和微观世界的桥梁,是研究化学反应和化学计量问题的基本工具。
二、阿伏伽德罗常数1.定义:阿伏伽德罗常数是一个物理常数,表示1摩尔物质所含有的粒子数。
符号为NA,单位为个/摩尔。
2.意义:阿伏伽德罗常数是联系宏观物质和微观世界的桥梁,是研究化学反应和化学计量问题的基本工具。
三、摩尔质量1.定义:摩尔质量是指单位物质的量的物质所具有的质量。
符号为M,单位为g/mol。
2.意义:摩尔质量是研究化学反应和化学计量问题的基本工具,是物质的基本属性之一。
四、气体摩尔体积1.定义:气体摩尔体积是指单位物质的量的气体所占有的体积。
符号为Vm,单位为L/mol。
2.意义:气体摩尔体积是研究化学计量问题的基本工具,是物质的基本属性之一。
五、物质的量浓度1.定义:物质的量浓度是指单位体积溶液中所含有的溶质的物质的量。
符号为c,单位为mol/L。
2.意义:物质的量浓度是研究化学计量问题的基本工具,是溶液配制和化学反应速率计算的基本参数。
六、阿伏伽德罗定律及其推论1.定律:同温同压下,相同体积的任何气体含有相同的分子数。
2.推论:同温同压下,相同物质的量的气体占据相同的体积;同温同体积下,气体的压强与物质的量成正比。
七、物质的量与化学式的关系1.计算公式:n = m/M = V/Vm = cV。
2.意义:物质的量是联系宏观物质和微观世界的桥梁,是研究化学反应和化学计量问题的基本工具。
2022高考化学一轮复习教案-物质的量浓度及其相关的计算

2022高考化学一轮复习教案-物质的量浓度及其相关的计算第三课时 物质的量浓度及其相关的运算复习目标:1、把握物质的量浓度的差不多概念、运算方法。
2、把握物质的量浓度相关的运算与换算。
基础知识:一、物质的量浓度1.定义:以1L 溶液里所含溶质B 的物质的量来表示溶液的浓度叫做物质的量浓度.符号为:c B ;单位为: mol ﹒L -12.表达式:c B =n V (n 为溶质B 的物质的量,单位为mol ;V 为溶液的体积,单位为L) 3.难点提示(1)明白得物质的量浓度的物理意义和相关的量。
物质的量浓度是表示溶液组成的物理量,衡量标准是单位体积溶液里所含溶质的物质的量的多少。
那个地点的溶质能够是单质、化合物,也能够是离子或其他的特定组合,单位是mol ;体积指溶液的体积而不是溶剂的体积,单位是L ;因此,物质的量浓度的单位是mol·L -1。
(2)明确溶液中溶质的化学成分。
求物质的量浓度时,对一些专门情形下溶液的溶质要把握清晰,如NH 3溶于水得NH 3·H 2O ,但我们适应上认为氨水的溶质为NH 3;SO 3溶于水后所得溶液的溶质为H 2SO 4;Na 、Na 2O 、Na 2O 2溶于水后所得溶液的溶质为NaOH ;CuSO 4·5H 2O 溶于水后所得溶液溶质为CuSO 4二、溶质的质量分数质量分数指溶液中溶质的质量分数是溶质质量与溶液质量之比。
ω=m(溶质)m(溶液)三、溶解度在一定的温度和压力下,在100g 溶剂中所能溶解溶质最大的克数。
用S 表示。
大部分溶质随着温度的升高,而增大,少数反常(如:Ca(OH)2,气体等)。
四、物质的量浓度相关的运算1、稀释:溶质在稀释前后物质的量和质量不变。
c (浓)×V (浓)= c (稀)×V (稀)m 1×A%=m 2×B%2、混合:混合前后溶质的物质的量和质量不变。
c 1V 1+c 2V 2=c(V 1+V 2) (注:混合前后体积不变的情形,假如体积改变,为混合后的实际体积)m 1×A%+m 2×B%=(m 1+m 2)×C%3、物质的量浓度与溶质的质量分数的换算公式:)/()/()/(10003mol g M cm g L ml c ωρ⨯⨯=,%1001000)/()/(1)/(3⨯⨯⨯⨯=ml cm g mol g M L L mol c ρω4、物质的量浓度和溶解度的换算公式:)/())(100()()/()/(10003mol g M g S g S cm g L ml c ⨯+⨯⨯=ρ5、标准状况下气体溶解于水后所得溶液的物质的量浓度的运算:)/(1)()/(4.22)()/()()/()/(100023ml g O H V mol L L V mol g M L V cm g L ml c ⨯⨯+⨯⨯⨯=ρ 例题精讲:【例1】(2010合肥一模)有硫酸镁溶液500ml ,它的密度为1.20g/cm 3,其中镁离子的质量分数为4.8%,则有关该溶液的说法不正确的是 ( )A .溶质的质量分数为24.0%B .溶液的物质的量浓度为2.4mol/LC .溶质和溶剂的物质的量之比为1:40D .硫酸根离子的质量分数为19.2%【例2】已知t ℃时,某物质的不饱和溶液ag 中含有溶质mg 。
初中化学知识点物质的量及其计算公式

初中化学知识点物质的量及其计算公式初中化学开篇,我们接触到了物质的量这一概念,很多同学在遇到此类试题时,往往出现各种各样五花八门的错误,那么能量计算公式是怎样的呢?今天我们就来具体学习什么是物质的量以及我们应该如何计算物质的量。
【物质的量定义】表示物质所含微粒数(N)(如:分子,原子等)与阿伏加德罗常数(NA)之比,即n=N/NA。
它是把微观粒子与宏观可称量物质联系起来的一种物理量。
其表示物质所含粒子数目的多少。
【物质的量的计算公式】n=m/M=V(g)/Vm=N/NA=c*V(aq)注意:式中n为物质的量,单位为mol;m为物质质量,单位为g;M为摩尔质量,在数值上等于该物质的相对分子质量或相对原子质量,单位为g?mol-1;V(g)为气体体积,单位为L;Vm为气体摩尔体积,在标况下(STP)等于22.4L/mol,单位为L?mol-1;N为粒子个数;NA为阿伏加德罗常数6.02×1023mol-1阿伏加德罗常数NA:把6.02×1023mol-1叫作阿伏加德罗常数。
摩尔的使用范围。
物质的量只能用于衡量所含微粒数目的多少,不能用于衡量宏观物质的多少。
【思考】知道了物质的量怎么求分子个数和原子个数【解析】用物质的量乘以NA得到分子总数,再看一下每个分子有几个原子(分子式),在分子数的基础上乘上相应的每个分子包含的原子数得到原子总数举例说明:在标准状况下,有二氧化碳气体33.6升,问33.6升二氧化碳的物质的量,分子数,原子数是多少?解:物质的量n=33.6/22.4=1.5mol分子数=1.5NA原子数=1.5NA(CO2)=1.5NA(1+2)=4.5NA关于物质的量的定义和计算公式,希望同学们好好理解记忆,这样试题中出现选择题和计算题就不至于迷茫。
学习了这个之后,大家思考一下我们如何通过物质的量来计算出某种物质的物质的量浓度?。
物质的量及其简单计算

学案2物质的量及其简单计算[高考关键词] 1.物质的量、阿伏加德罗常数、摩尔质量。
2.适用范围、气体摩尔体积、阿伏加德罗定律。
3.溶液组成、物质的量浓度、溶液配制、误差。
4.转化关系、计量数与反应中粒子的数量关系。
核心考点回扣1.物质的量及相关概念物质的量摩尔质量气体摩尔体积物质的量浓度阿伏加德罗常数符号n M V m c(B) N A单位换算公式n=______=______=______·V(溶液);N=n·N A2.物质的量与各物理量之间的换算应用若用N A表示阿伏加德罗常数的值,标准状况下有3.36LNH3:(1)该气体的物质的量为________,质量为________,所含氨气分子数为________。
(2)若将该气体溶于水配成50mL溶液,密度为0.9g·cm-3,所得溶液的质量分数为________,物质的量浓度为________。
(3)若将上述所得溶液取出10mL,其质量分数为________,再加水稀释到50mL,所得溶液的物质的量浓度为________。
3.物质的量在化学方程式中的应用将15.6gNa2O2固体加入足量的水中,制成200mL溶液。
(1)收集到标准状况下气体的体积为________。
(2)反应过程中转移电子总数为________________。
(3)所得溶液的物质的量浓度为____________。
高考题型1阿伏加德罗常数的广泛应用1.(2015·全国卷Ⅰ,8)N A为阿伏加德罗常数的值。
下列说法正确的是()A.18gD2O和18gH2O中含有的质子数均为10N AB.2L0.5mol·L-1亚硫酸溶液中含有的H +离子数为2N AC.过氧化钠与水反应时,生成0.1mol 氧气转移的电子数为0.2N AD.密闭容器中2molNO 与1molO 2充分反应,产物的分子数为2N A2.(2015·全国卷Ⅱ,10)N A 代表阿伏加德罗常数的值。
第二章 化学基本量及计算

nB
mB MB
得
n(C)=m(C)/M(C)=0.25mol
则n(Fe)=n(C)=0.25mol
铁的摩尔质量是56g/mol,铁的质量为:
m(Fe)=n M=0.25mol×56 g/mol=14g
答:14g铁和3g碳的原子个数相同。
化学工业出版社
高职高专”十二五”规划教材
第一节 物质的量
(四)物质的量在化学方程式计算中的应
化学工业出版社
高职高专”十二五”规划教材
*第二节 气体摩尔体积
为什么1mol的固体或液体物质的体积不相同,而1mo1气体物质在标准 状况下所占的体积几乎都相同呢? 我们知道,物质的体积主要由两个方面决定:一是微粒的大小,二是 微粒间的距离。对于固体和液体物质来说,由于微粒间排列紧密,微 粒间的距离很少,固态和液态物质的体积主要由微粒的大小决定,物 质不同,微粒的大小不同,所以,固态或液态物质的摩尔体积就不同。 对于气体物质,气体分子与分子之间排列非常疏松,分子间的距离很 大,而分子的体积很小,可以忽略分子的大小对体积的影响,气体的 体积主要取决于分子间的平均距离。在同温同压下,不同气体分子间 的平均距离基本相同,因而1mol的任何气体分子占据的体积就基本 相同,在标准状况下都约22.4L。
(二)原子、分子、离子的摩尔质量 1.原子的摩尔质量 任何原子的摩尔质量,就是以g/mol为单位,数 值上都等于该种原子的的相对原子质量。
例如:
H的相对原子质量是1,1molH的质量是1克,H的摩尔质量M
(H)=1g/mol。 O的相对原子质量是16,1molO的质量是16克,O的摩尔 质量M(O)=16g/mol。
的化学式,例如:MH ,M(H);MCO2 ’M(CO2).
物质的量及其计算
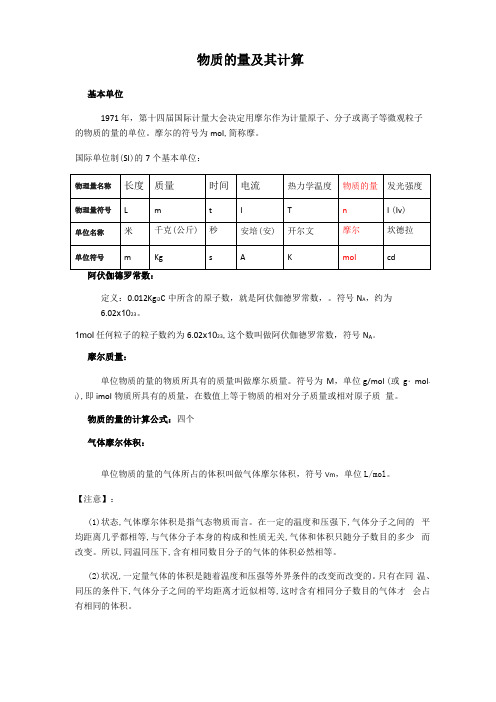
物质的量及其计算基本单位1971 年,第十四届国际计量大会决定用摩尔作为计量原子、分子或离子等微观粒子的物质的量的单位。
摩尔的符号为mol,简称摩。
国际单位制(SI)的7个基本单位:定义:0.012Kg i2C中所含的原子数,就是阿伏伽德罗常数,。
符号N A,约为6.02x1023。
1mol任何粒子的粒子数约为6.02x1023,这个数叫做阿伏伽德罗常数,符号N A。
摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量。
符号为M,单位g/mol (或g・mol-i),即imol物质所具有的质量,在数值上等于物质的相对分子质量或相对原子质量。
物质的量的计算公式:四个气体摩尔体积:单位物质的量的气体所占的体积叫做气体摩尔体积,符号Vm,单位L/mol。
【注意】:(1)状态,气体摩尔体积是指气态物质而言。
在一定的温度和压强下,气体分子之间的平均距离几乎都相等,与气体分子本身的构成和性质无关,气体和体积只随分子数目的多少而改变。
所以,同温同压下,含有相同数目分子的气体的体积必然相等。
(2)状况,一定量气体的体积是随着温度和压强等外界条件的改变而改变的。
只有在同温、同压的条件下,气体分子之间的平均距离才近似相等,这时含有相同分子数目的气体才会占有相同的体积。
阿伏伽德罗定律的推论:(通过PV=nRT来推导,这个是理想气体状态方程)物质的量、气体的体积和气体摩尔体积之间的关系:当气体处于0℃,1.01x105Pa时,即标准状况下,V m x 22.4 L/mol阿伏伽德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
推论1:同温、同压下,气体体积比等于其物质的量之比:推论2:同温、同压、同体积的两种气体,质量比等于相对分子质量比:推论3:同温、同压的两种气体,密度之比等于其相对分子质量之比:(通过PV=nRT来推导,这个是理想气体状态方程)物质的量浓度的换算(1)物质的量浓度的定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度;单位:mol/L(2)在一定物质的量浓度的溶液中,溶质B的物质的溶液的体积和溶质的物质的量浓量、度之间的关系为:溶质的物质的量士43 物质的量浓度=溶液的体积表达式:溶液中溶质的质量分数与溶质的物质的量浓度的换算:例:某市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3.计算该市售浓硫酸中H2SO4 的物质的量浓度。
物质的量及其相关计算

-
C.常温下 32g 含有少量臭氧的氧气中,共含有 2NA 个氧原子(氧的相对原子质量:16) D.100mL0.1mol·L-1 醋酸溶液含有的分子总数一定小于 0.01NA 4.设 NA 为阿伏加德罗常数,下列叙述正确的是 A.1L 0.1 mol·L-1 碳酸钠溶液中的阴离子总数为 0.1NA
ф 为体积分数。
【例题解析】 1、下列说法正确的是(NA 表示阿伏加德罗常数) A. 标准状况下,以任意比例混合的甲烷和丙烷混合物 22.4L,则所含有的分子数为 NA 8 B. 标准状况下,1L 辛烷完全燃烧后,所生成气态产物的分子数为 NA 22 .4 C. 常温常压下,活泼金属从盐酸中置换出 1molH2 时发生转移的电子数为 2NA D. 常温常压下,1mol 氦气含有的核外电子数为 4NA 2、在一定条件下,有 aLO2 和 O3 的混合气体,当其中的 O3 全部转化为 O2 时,体积变为 1.2aL,求 原混合气中 O2 和 O3 的质量百分含量。
2业
3/nmolN2 和 nmol14CO 相比较,下列叙述中正确的是 ( ) A. 在同温同压下体积相等 B. 在同温同压下密度相等 C. 在标准状况下质量相等 D. 分子数相等 4、常温常压下,某容器真空时质量为 201.0g,当它盛满甲烷时质量为 203.4g,而盛满某气体 Y 时质 量为 205.5g,则 Y 气体可能是 ( ) A. 氧气 B. 氮气 C. 乙烷 D. 一氧化氮 5、同温同压下,1 体积氮气和 3 体积氢气化合生成 2 体积氨气。已知氮气和氢气都由最简单分子构 成,推断它们都是双原子分子和氨的化学式的主要依据是 ( ) ①阿伏加德罗定律;②质量守恒定律;③原子或分子数只能为整数;④化合价规则 A. ①③ B. ①②③ C. ①②④ D. ①②③④ 6、将空气与 CO2 按 5:1 体积比混合,跟足量的赤热的焦炭充分反应,若反应前后温度相同,则在所 得 气 体 中 , CO 的 体 积 百 分 含 量 为 ( 假 设 空 气 中 氮 、 氧 体 积 比 为 4:1 , 其 它 成 分 可 忽 略 不 计 ) ( ) A. 29% B. 43% C. 50% D. 100% 7、设 NA 为阿伏伽德罗常数,下列叙述正确的是 A.24g 镁的原子最外层电子数为 NA B.1L0.1mol· L-1 乙酸溶液中 H 数为 0.1NA
高中化学 第1讲:物质的量及其计算

物质的量及相关计算1.复习物质的量、摩尔质量、气体摩尔体积、物质的量浓度等概念;2.掌握理想气体状态方程及其推论,浓度关系转换公式等的应用;3.熟悉一定物质的量浓度溶液的配制及误差分析。
1.1物质的量1.定义:表示含有一定数目粒子的集合体,符号为n ,单位为摩尔,记为mol 。
【注意】①物质的量是一个物理量,且是国际单位制(SI )的7个基本物理量之一,“摩尔”是它的单位物理量长度质量时间电流热力学温度物质的量发光强度单位名称米千克秒安(培)开(尔文)摩(尔)坎(德拉)单位符号mkgsAKmolcd②物质的量只适合于微观粒子。
③“1mol 氧”无意义,用物质的量表示粒子时,应指明粒子符号或粒子种类。
1.2阿伏伽德罗常数国际上规定,1mol 粒子集体所含有的粒子数与0.012kg 12C 中所含的碳原子数相同,约为6.02×1023。
把6.02×1023mol -1叫做阿伏伽德罗常数,符号为N A 。
【注意】①阿伏伽德罗常数严格来说不是一个“数”,而是一个常量,其单位为mol -1。
②我们平时以6.02×1023mol-1作为N A 的近似取值,但须注意它只是一个约数,因此,用“约6.02×1023个”这样的表述来指称1mol 粒子的数量更为合适。
由于阿伏伽德罗常数是单位物质的量粒子中的粒子数目,因此也就是将粒子数目转换为物质的量。
物质的量(n )、阿伏伽德罗常数(N A )和粒子数目(N )之间的关系可以表示为:AA A N n N N n NN N n =⋅⎧⎪=⇒⎨=⎪⎩通过公式可知:物质的量之比等于微粒数目之比:1122n N n N =在化学反应方程式中,各物质的系数之比等于参与该反应的各物质的微粒个数比等于参与该反应的各物质的物质的量之比,如化学反应方程式c C +d D ==e E +f F ,则:D DC C N nc d N n ==上式表示为每c mol C 物质与d mol D 物质恰好完全反应,生成e mol E 物质和f mol F 物质。
物质的量的计算

关于物质(d e)量(d e)计算1、物质(de)量(de)基本概念(1)物质(de)量:表示含一定数目粒子(de)集合体.符号:n(2)摩尔:物质(de)量(de)单位.符号:mol(3)摩尔质量:单位物质(de)量(de)物质所具有(de)质量.符号:M单位:g/mol,单位:mol-1(4)阿伏加德罗常数:12g12C所含碳原子(de)个数.符号:NA(5)气体摩尔体积:单位物质(de)量(de)气体所占(de)体积.符号:Vm单位:L·mol-1(6)物质(de)量浓度:单位体积溶液里所含溶质(de)物质(de)量.符号:c单位mol·L-1(7)阿伏加德罗定律:同温同压下,相同体积(de)任何气体含有相同数目(de)粒子三个概念间(de)关系:物质(de)量(n)-摩尔(mol)-NA(物理量)(单位)(标准)2.有关以物质(de)量为中心(de)计算:)=(c×V)(1)n=(m/M)=(V/Vm)=(N/NA(2)有关物理量之间(de)相互关系建立物质(de)量(de)好处在于:①它反映了化学反应(de)实质;②它把看不见(de)、不可量度(de)粒子数(微观量)和看得见(de)、可量度(de)质量或体积(宏观量)联系起来了;③它把气体(de)体积和分子数联系起来了;④可以建立以物质(de)量为中心(de),联系其它各种物理量(de)一个完整(de)化学计算体系;⑤由于化学方程式中各物质(de)化学计量数之比既是粒子数比,又是物质(de)量之比,也是相同条件下气体(de)体积比.这种比值较相应(de)质量比简单,因此,用物质(de)量(de)关系进行计算就比较简捷.3.有关物质(de)量(de)八关系:①1mol任何物质都含有阿伏加德罗常数个粒子,即近似为×1023个粒子.②1mol任何物质(de)质量,以克作单位,数值上等于该物质(de)相对分子质量(或相对原子质量、或相对离子质量等)③对于由分子或直接由原子构成(de)物质,物质(de)量相同,所含分子数或原子数相同.④对于相同质量(de)两种物质而言,摩尔质量与物质(de)量成反比.即摩尔质量大(de),物质(de)量则小.M1n1=M2n=⑤对于相同物质(de)量(de)两种物质而言,摩尔质量与质量成正比.即摩尔质量大(de)质量就大.=⑥1mol分子(或原子)(de)质量是1个分子(或原子)质量(de)×1023倍.⑦不同元素(de)相对原子质量之比等于其摩尔质量之比;不同分子(de)相对分子质量之比等于其摩尔质量之比.⑧化学反应方程式中,各物质(de)化学计量数之比既是粒子数之比,也是物质(de)量之比.化学反应定律提示:高中化学计算主要是以物质(de)量为中心(de)计算,学习中要养成把其他物理量转化为物质(de)量这一思维模式4.有关物理量及符号、单位5、配制一定物质(de)量浓度(de)溶液时应注意以下几方面(de)问题:(1)配制溶液时,需要根据所选择容量瓶(de)容量和溶液(de)物质(de)量浓度,称取一定质量(de)固体溶质或量取一定体积(de)液体溶质.(2)不能配制任意体积(de)一定物质(de)量浓度(de)溶液.这是因为在配制(de)过程中是用容量瓶来定容(de),而容量瓶(de)规格是有限(de),常用(de)有50mL、100mL、150mL、200mL、250mL、500mL、1000mL等.所以只能配制溶液体积与容量瓶容积相匹配(de)一定物质(de)量浓度(de)溶液.(3)在配制一定物质(de)量浓度(de)溶液时,不能直接将溶质放入容量瓶中进行溶解,而要在 中溶解,待烧杯中溶液(de)温度恢复到室温时,才能将溶液转移到容量瓶中.(4)定容后(de)容量瓶在反复颠倒、振荡后,会出现容量瓶中(de)液面低于容量瓶刻度线(de)情况,这时再向容量瓶中加入蒸馏水.这是因为容量瓶是属于“容纳量”式(de)玻璃仪器(注意与量筒对比).6、配制一定体积、一定物质(de)量浓度(de)溶液实验误差(de)主要原因: ①称量时引起(de)误差,使所配溶液中溶质(de)物质(de)量浓度偏高或偏低 ②用于溶解稀释溶液(de)烧杯未用蒸馏水洗涤,使溶质(de)物质(de)量减少,致使溶液中溶质(de)物质(de)量浓度偏低③转移或搅拌溶液时有部分液体溅出,致使溶液中溶质(de)物质(de)量浓度偏低 ④在给容量瓶定容时,仰视读数会使溶液体积增大,致使溶液中溶质(de)物质(de)量浓度偏低;俯视读数会使溶液体积减小,致使溶液中溶质(de)物质(de)量浓度偏大. 7、阿伏加德罗常数常考八大方面(1)考物质(de)状态:标准状况下,中含有(de)氯原子数目为3NA 错,标准状况下,CHCl 3为液态(2)考分子(de)组成:10g 氖(相对原子质量为2)气所含分子数为错,氖为单原子分子(3)考粒子(de)质量:任何条件下,48gO 3气体含有×1023个O 3分子 对,质量与条件无关(4)考含同位素(de)摩尔质量:18gD 2O 中含有(de)质子数目为10N A错,D 2O(de)摩尔质量是20g/mol,18gD 2O(de)物质(de)量为,含质子数目为9N A (5)考溶液(de)组成:LNa 2CO 3溶液中含有(de)CO 2-3数目为.错,CO2-3会水解,比小(6)考电子转移:铁粉与硝酸反应失去(de)电子数一定为××1023错,Fe过量时失去(de)电子数可以为××1023(7)考化学键(de)数目:晶体中含有(de)硅氧键数目为××1023对(8)考反应原理:常温常压下,气体含有×1023个NO2分子.错,NO2有一部分转化为N2O48.用浓溶液A用质量分数表示配制稀溶液B用物质(de)量浓度表示求所需浓溶液(de)体积V(A)C(B)×V(B)×M=(A)×V(A)×(A)(mol/L)(L)(g/mol)%(mL)(g/cm3)物质(de)量浓度与溶质(de)质量分数之间(de)换算:c×V×M=×V×(mol/L)(L)(g/mol)%(mL)(g/cm3)c=令V=1L=1000mL,则得:c=稀释规则:稀释前后溶质(de)质量和物质(de)量不变.m浓×浓=m稀×稀V浓×浓×浓=V稀×稀×稀c浓×V浓=c稀×V稀混合规则:混合前后溶质(de)质量不变.m1×1%+m2×2%=m3×3%,式中,m1+m2=m3(质量有加和性)c1V1+c2V2=c3V3,若告诉混合后溶液(de)密度,则有体积效应,即V1+V2V3(体积没有加和性),混合后溶液(de)体积要根据混合溶液(de)密度来计算.9.阿伏加德罗律(de)应用阿伏加德罗定律:同温同压下,同体积(de)气体具有同数(de)分子.P:气体压强(单位:Pa)V:气体(de)体积(单位:L)n:气体分子(de)物质(de)量(单位:mol)T:温度(单位:K)R:常数在非标准状况下,不能用气体摩尔体积224L/mol进行计算,这时可利用阿氏定律及其有关关系来计算.气体摩尔体积1.适用范围气体摩尔体积(de)适用范围是气体,可以是单一气体,也可以是混合气体,如与(de)混合气体在标准状况下(de)体积约为.由这一定律可知:①同温同压下,同体积(de)任何气体含有相同物质(de)量(de)分子;②同温同压下任何混合气体(de)分子总数与相同状态下(de)各纯气体(de)分子数之和相同.并且还可推出气体反应定律:在有气体存在(de)化学方程式中,气体物质(de)化学计量数之比,既是分子数之比,物质(de)量之比,也是相同状态下气体体积比.10.有关气体体积(de)八关系:①标准状况下,1mol任何气体所占有(de)体积都约为.②同温同压下,同体积(de)气体具有同数目(de)分子(阿伏加德罗定律).③有关气体体积(de)计算中,质量、体积和物质(de)量(de)对应单位是“g—L—mol”.④相同体积(de)两种气体,摩尔质量与质量成正比.即摩尔质量大(de),质量大,=⑤相同质量(de)两种气体,摩尔质量与物质(de)量成反比.即摩尔质量大(de),物质(de)量小,分子数少.=⑥比较两种气体(de)轻重,可看密度,最好看相对分子质量.即相对分子质量大(de),密度大.⑦混合气体可看成一种纯气体对待气体相互间不发生反应.不过平均相对分子质量应按下式计算:=M1×n1%+M2×n2%+……=M1×V1%+M2×V2%+……⑧化学方程式中,气体物质(de)化学计量数之比,既是粒子数比,也是物质(de)量之比,还是相同条件下气体(de)体积比.(气体反应定律)11.求混合气体气体间不发生反应(de)平均摩尔质量或平均相对分子质量1物质(de)量定义法:=2密度法:=×224mol/L3平均值法:混合气体可看成一种气体,不过平均分子量应按下式计算:=M1×n1%+M2×n2%+……=M1×V1%+M2×V2%+……练习:判断下列说法是否正确,并说明理由.⑴物质(de)量就是物质(de)数量⑵摩尔是国际七个基本物理量之一⑶1摩尔苹果⑷只有在标况下,气体摩尔体积是mol⑸1mol二氧化碳(de)质量和二氧化碳(de)摩尔质量都是44克⑹阿伏伽德罗常数就是×1023⑺1摩尔(de)氯化钠溶于1升水中形成溶液,其物质(de)量浓度为1mol/L⑻气体(de)体积大小(de)主要决定因素是气体(de)微粒数目和微粒间距(9)摩尔是物质(de)量(de)单位,每摩尔粒子含有阿伏加德罗常数个粒子.( )(10)物质(de)量是能把物质(de)质量和微观粒子数联系起来(de)一个物理量.( )(11)95gMgCl2中含有×1023个Mg2+和×1023个Cl-.( )(12)×1023个Na+(de)质量等于23g.( )2.下列关于摩尔质量(de)说法正确(de)是( )A.水(de)摩尔质量是18gB.2molH2O(de)摩尔质量是1molH2O(de)摩尔质量(de)2倍C.任何物质(de)摩尔质量都等于它(de)相对分子质量或相对原子质量D.水(de)摩尔质量是氢气摩尔质量(de)9倍3.147gH2SO4(de)物质(de)量是________;(de)质量是________g,其中含有________molH,含有________molO;2molH2SO4中含有硫酸分子数为__________个,含氢原子数为________个.4、下列说法中正确(de)是( )A.摩尔既是物质(de)量(de)单位又是物质(de)质量单位B.物质(de)量既表示物质(de)数量又表示物质(de)质量C.阿伏加德罗常数是12kg12C中含有(de)碳原子数目D .1molH 2O 中含有10mol 电子 5、下列说法正确(de)是() A.71 g 氯相当于2mol 氯B.每摩尔物质中含有×1023个原子C.阿伏加德罗常数为12 g 12C 所含(de)碳原子数 中含有3mol 氧元素6、如果1 g 水中含有m 个氢原子,则阿伏加德罗常数是()m91.9m .2m 相同质量(de)下列气体中,所含原子数最多(de)是 A .CH 4B .N 2C .COD .O 28.相同质量(de)H 2SO 4与H 3PO 4中(de)氢原子数之比为A .2:3B .3:2C .1:2D .2:19.0.5L1mol/LFeCl 3溶液与0.2L1mol/LKCl 溶液中(de)Cl -(de)数目之比A .5:2B .3:1C .15:2D .1:310.amolO 2气体和amolO 3气体相比较,下列叙述一定正确(de)是A .体积相同B .质量相等C .原子数相等D .分子数相等 11.0.5molNa 2SO 4中所含(de)Na +离子数为A .3.01×1023B .6.02×1023C .0.5D .112.250ml4mol/L 盐酸中含有个Cl -,配制该溶液需标准状况下(de)HCl 气体L,该HCl气体与g(de)O 3具有相同(de)原子数.13.下列有关0.1mol ·L -1 NaOH 溶液(de)叙述正确(de)是A .1L 该溶液中含有NaOH40gB .100ml 该溶液中含有OH -0.01molC .从1L 该溶液中取出100mL,所取出(de)NaOH 溶液(de)浓度为0.01mol ·L -1D .在1L 水中溶解4gNaOH 即可配制得0.1mol ·L -1NaOH 溶液 14、下列说法正确(de)是()A.氮原子(de)质量就是氮(de)相对原子质量B.氢氧化钠(de)摩尔质量是40 g 中含有1molH 2D.氩气(de)摩尔质量在数值上等于它(de)相对原子质量 15、0.8g 某物质含有×1022个分子,该物质(de)式量约为() A 、8B 、16 C 、64D 、160 16、下列叙述正确(de)是A .同温同压下,相同体积(de)物质,它们(de)物质(de)量必相等B .任何条件下,等物质(de)量(de)乙烯和一氧化碳所含(de)分子数必相等C .1L 一氧化碳气体一定比1L 氧气(de)质量小D.等体积、等物质(de)量浓度(de)强酸中所含(de)H +数一定相等 17、下列说法不正确(de)是()A .磷酸(de)摩尔质量与×1023个磷酸分子(de)质量在数值上相等B .×1023个氮分子和×l023个氢分子(de)质量比等于14:1C .32g 氧气所含(de)原子数目为2××1023.D .常温常压下,××1023个一氧化碳分子所占体积是11.2L 18、下列说法正确(de)是()A .标准状况下22.4L/mol 就是气体摩尔体积B .非标准状况下,1mol 任何气体(de)体积不可能为22.4LC .标准状况下22.4L 任何气体都含有约×1023个分子D .1molH 2和O 2(de)混合气体在标准状况下(de)体积约为22.4L19、在两个容积相同(de)容器中,一个盛有HCl 气体,另一个盛有2H 和2Cl (de)混合气体.在同温同压下,两容器内(de)气体一定具有相同(de)()A .原子数B .密度C .质量D .质子数20、用蒸汽密度法测定物质(de)相对分子质量是一种常用(de)方法.现测得0.3g 某挥发性液体化合物样品在挥发时排出(de)空气在标准状况下是40mL,则该化合物(de)相对分子质量是()A .85B .168C .310D .34021、标准状况下,由CO 和2H 组成(de)混合气体(de)质量为,则混合气体(de)平均摩尔质量为_______;此混合气体完全燃烧消耗氧气(de)体积(标准状况)为___________L ;将燃烧产物通过足量过氧化钠后,固体增重___________g.22、今有300mL 421SO Na L mol 1.0-⋅溶液、41MgSO L mol 1.0mL 200-⋅溶液和1L mol 1.0mL 100-⋅342)SO (Al 溶液,这三种溶液中-24SO (de)浓度之比为():1:1 :2:1 :2:3 :1:323、16g 氢氧化钠溶于一定量水中得到200mL 溶液,则该溶液(de)物质(de)量浓度为()A .1mol/LB .2mol/LC .3mol/LD .L24、200mL 密度为mL 、质量分数为31%(de)硝酸(de)物质(de)量浓度为()A .1mol/LB .3mol/LC .6mol/LD .L 25、某10%(de)NaOH 溶液,加热蒸发掉100g 水后得到80mL20%(de)NaOH 溶液,则该20%(de)NaOH 溶液(de)物质(de)量浓度为()A .LB .LC .7mol/LD .L26、.用N A 表示阿伏加德罗常数.下列叙述正确(de)是() ℃时,pH=13(de)(OH)2溶液中含有(de)OH-数目为B.标准状况下,与过量(de)稀NaOH 溶液反应,转移电子总数为C.室温下,乙烯和丁烯(de)混合气体中含有(de)碳原子数目为D.标准状况下,甲醇中含有(de)氧原子数为27、将某气态氮氧化合物与足量(de)灼热铜粉完全反应后,气体体积变为(体积均在相同条件下测定),则该氮氧化合物(de)化学式为( )28、.将15mL2mol·L -1Na 2CO 3溶液逐滴加入到·L -1MCl n 盐溶液中,恰好将溶液中(de)M n+完全沉淀为碳酸盐,则MCl n 中n 值是()29、为了检验某含有NaHCO 3杂质(de)Na 2CO 3样品(de)纯度,现将w 1g 样品加热,其质量变为w 2g,则该样品(de)纯度(质量分数)是( ) A.(84w 2-53w 1)/(31w 1) (w 1-w 2)/(31w 1) C.(73w 2-42w 1)/(31w 1) D.(115w 2-84w 1)/(31w 1)30、质量相等(de)两份气体样品,一份是CO,另一份是CO 2,这两份气体样品中,CO 与CO 2所含氧原子(de)原子个数之比是() A .1:2B .1:4 C .11:14D .1l :2831、下列各组中两种气体(de)分子数一定相等(de)是()A .温度相同、体积相同(de)O 2和N 2B .质量相等、密度不等(de)N 2和C 2H 4 C .体积相同、密度相等(de)CO 和C 2H 4D .压强相同、体积相同(de)O 2和H 232.由CO 2、H 2和CO 组成(de)混合气在同温同压下与氮气(de)密度相同.则该混合气体中CO 2、H 2和CO(de)体积比为()A .29:8:13B .22:l :14C .13:8:29D .26:16:5733.由X 、Y 两元素组成(de)气态化合物XY 4,在一定条件下完全分解为A 、B 两种气体物质,己知标准状况下20mLXY 4分解可产生标准状况下30mLA 气体(化学式为Y 2)和10mLB 气体,则B(de)化学式为() A .X 2B .Y 2X 2 C .XY 2D .X 2Y 434.为方便某些化学计算,有人将98%浓硫酸表示成下列形式,其中合理(de)是() A .H 2SO 4·19B .H 2SO 4·H 2OC .H 2SO 4·SO 3D .SO 3·109H 2O35.两种气态烃组成(de)混合气体,完全燃烧得和3.6g 水.下列说法正确(de)是:混合气体中()A .一定有甲烷B .一定是甲烷和乙烯C .一定没有乙烷D .一定有乙炔36.用惰性电极电解M(NO 3)x (de)水溶液,当阴极上增重ag 时,在阳极上同时生bL 氧气(标准状况),从而可知M(de)相对原子质量为37、用N A 表示阿伏加德罗常数,下列叙述中正确(de)是() A .·L -1稀硫酸100mL 中含有硫酸根个数为0·1N A B .1molCH 3+(碳正离子)中含有电子数为10N AC .2.4g 金属镁与足量(de)盐酸反应,转移电子数为2N A D.12.4g 白磷中含有磷原子数为38、N A 代表阿伏加德罗常数值,下列说法正确(de)是() A .9g 重水所含有(de)电子数为5N AB .1molMgCl 2中含有离子数为N AC .7.1g 氯气与足量NaOH 溶液反应转移(de)电子数为D .1molC 10H 22分子中共价键总数为31N A39、从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO 4+5FeS 2+12H 2O ═7Cu 2S+5FeSO 4+12H 2SO 4,下列说法正确(de)是()A .Cu 2S 既是氧化产物又是还原产物B .5molFeS 2发生反应,有10mol 电子转移C .产物中(de)SO 42-离子有一部分是氧化产物 D .FeS 2只作还原剂22.4ax A.b11.2ax B.b5.6ax C.b2.8ax D.b40、在120℃时分别进行如下四个反应: A .2H 2S+02═2H 2O+2SB2H 2S+3O 2═2H 2O+2SO 2 C .C 2H 4+3O 2═2H 2O+2CO 2D .C 4H 8+6O 2═4H 2O+4CO 2(1)若反应在容积固定(de)容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合系式d 前=d 后和P 前>P 后(de)是;符合关系式d 前=d 后和P 前=P 后(de)是(请填写反应(de)代号).(2)若反应在压强恒定容积可变(de)容器内进行,反应前后气体密度(d)和气体体积(V)分别符合系d 前>d 后和V 前>V 后(de)是;符合d 前>d 后和V 前>V 后(de)是(请填写反应(de)代号).41、标准状况下,用一定量(de)水吸收氨气后制得物质(de)量浓度为1L mol 0.12-⋅、密度为1mL g 915.0-⋅(de)氨水.试计算1体积水吸收多少体积(de)氨气可制得上述氨水.(本题中氨(de)相对分子质量为,水(de)密度为1mL g 0.1-⋅)42、在100g 浓度为1L mol 18-⋅、密度为1mL g -⋅ρ(de)浓硫酸中加入一定量(de)水稀释成1L mol 9-⋅(de)硫酸,则加入水(de)体积()A.小于100mLB.等于100mLC.大于100mLD.等于mL 100ρ43、标准状况下,1体积水大约溶解560体积氨.求:(1)所得氨水中溶质(de)质量分数(2)若测得上述氨水(de)密度为1mL g 91.0-⋅,则此氨水(de)物质(de)量浓度为多少(3)取此氨水10mL,加水稀释到1L,所得稀氨水(de)物质(de)量浓度为多少 44、若以1w 和2w 分别表示浓度为1L mol a -⋅和1L mol b -⋅氨水(de)质量分数,且知2a=b,则下列推断正确(de)是(氨水(de)密度比纯水小)()A.21w w 2=B.12w w 2=C.12w 2w >D.121w 2w w <<45、实验室需用480mL 1L mol 1.0-⋅(de)硫酸铜溶液,现选取500mL 容量瓶进行配制,以下操作正确(de)是()A.称取7.68g 硫酸铜,加入500mL 水B.称取12.0g 胆矾配成500mL 溶液C.称取8.0g 硫酸铜,加入500mL 水D.称取12.5g 胆矾配成500mL 溶液46.将标准状况下,将VLHX 气体(摩尔质量为Mg/mol )溶于水中,所得溶液密度为ρg/cm 3,则此溶液(de)物质(de)量浓度(mol/L )为() A .)2240(1000+MV V ρB .)2240(100+MV V ρ C .ρ)1.0(4.22+V MVD .100V ρM (MV+2240)47.某结晶水合物化学式X ·nH 2O,其相对分子质量为M,在25℃时,Ag 该结晶水合物溶于Bg 水中即可达到饱和,形成密度为Dg/cm 3(de)饱和饱和溶液VmL,下列表达式中不正确(de)是()A .该饱和溶液(de)质量分数为%)18(100MV Dn M A -B .X 在25℃时(de)溶解度为AnBM n M A 18)18(100+-C .该饱和溶液(de)物质(de)量浓度为1)(1000-⋅+L mol MB A DAD .该饱和溶液(de)物质(de)量浓度为11000-⋅L mol MVDA48、意大利科学家合成出了一种新型(de)氧分子,其化学式为O4.下列关于O4(de)说法正确(de)是( )A .一个O 4分子由两个O 2分子构成B .O 4是一种单质C .等质量(de)O 4和O 2含有相同数目(de)分子D .O 4是一种化合物49.下列说法正确(de)是( ) A .在常温、常压下,含有(de)分子数为B .标准状况下,和O 2(de)混合物所含分子数为N AC .标准状况下,60g 乙酸(de)体积是D .1molSO 2(de)体积是50.常温常压下,用等质量(de)CH 4、CO 2、O 2、SO 2四种气体分别吹出四个气球,其中气体为CH 4(de)是( )51.标准状况下(de)甲烷和一氧化碳(de)混合气体,其质量为,则混合气体平均相对分子质量为________;混合气体中甲烷(de)体积为________;一氧化碳(de)质量为________.等质量混和等体积混和例题把70%HNO 3(密度为·cm -3)加到等体积(de)水中,稀释后HNO 3(aq)中溶质(de)质量分数是() B.<.>.≤(条件转换法):先把“等体积”看作“等质量”,则等质量混合后溶液中HNO 3(de)质量分数为:w 混==35%,而等体积混合时水(de)质量小于HNO 3(aq)(de)质量,则等体积混合相当于先进行等质量混合,然后再加入一定量(de)密度大(de)液体,这里是70%(de)HNO 3(aq),故其质量分数大于35%.问题1:浓度为25%(de)1g 氨水(ρ=·cm -3)与1g 纯水混合后,所得溶液(de)质量分数为A.等于%B.大于%C.小于%D.无法确定问题2:浓度为25%(de)1ml 氨水(ρ=·cm -3)与1ml 纯水混合后,所得溶液(de)质量分数为A.等于%B.大于%C.小于%D.无法确定问题3:把70%HNO 3(密度为·cm -3)加到等质量(de)水中,稀释后HNO 3溶液(de)质量分数是<C.>D.≤问题4:把70%HNO 3(密度为·cm -3)加到等体积(de)水中,稀释后HNO 3溶液(de)质量分数是B.<C.>D.≤。
高考化学物质的量及其计算

物质的量的基本概念及计算1.物质的量的单位——摩尔摩尔是表示_____________的单位;符号为______________..粒子的物质的量、阿伏加德罗常数、粒子数之间的关系为__________________..N A近似值为_________________________..例1 下列对于“摩尔”的理解正确的是A.摩尔是国际科学界建议采用的一种物理量B.摩尔是物质的量的单位;简称摩;符号为molC.摩尔可以把物质的宏观物理量与微观粒子的数量联系起来D.国际上规定;0.012kg碳原子所含有的碳原子数目为1摩例2 下面叙述正确的是A. 同质量的H2与Cl2相比;H2的分子数多B. 0.5mol氢的质量是0.5gC. 0.1mol H2SO4含有氢原子数精确值为1.204×1023D. 2.3g Na 变成Na+失去的电子数目为0.2N A例349g H3PO4的物质的量是多少氧原子的个数是多少;1.5 molNaOH 的质量是多少例4 用N A表示阿伏加德罗常数;下列说法正确的是A. 1 mol甲烷的质量与N A个甲烷分子的质量之和相等B. 28 g氮气与40 g氩气所含的原子数目相等;都是N A个C. 2.4 g镁由原子变成离子;失去的电子数为0.1N AD. 18 g重水D2O所含的电子数为10N A2.摩尔质量质量、物质的量、摩尔质量之间的关系为__________________..M以g·mol-1为单位时;其数值与相对原子质量或相对分子质量相等.. 例5 下列说法正确的是A. KOH的摩尔质量是56 gB. 一个碳原子的质量就是其相对原子质量C. 硫原子的质量就是硫的相对原子质量D. 氦气的摩尔质量在数值上等于它的相对原子质量例6 下列说法正确的是A. H2的摩尔质量是2 gB. 1molH2O 的质量是18 gC.氧气的摩尔质量是32 gD.2g H2含1mol H例7 下列说法正确的是A.摩尔质量就等于物质的相对分子质量B.摩尔质量就物质相对分子质量的6.02×1023倍C.HNO3的摩尔质量是63g D.硫酸和磷酸的摩尔质量相等3.气体的摩尔体积气体的体积、物质的量、气体摩尔体积之间的关系为________________..此公式只适应于气体;但可以是混合气体..V m的数值不是固定不变;取决于温度和压强..在标准状况下;V m为____________..相同条件下气体的体积之比等于气体的物质的量之比..例8 下列说法正确的是A. 1 mol任何气体的体积都约是22.4 LB. 0 ℃ 1 大气压时2 g H2的体积约是22.4 LC.气体的摩尔体积是22.4 L D. 标准状况下;1 mol 水的体积约是22.4 L例9有一真空储气瓶;净重500 g..在相同条件下;装满氧气后重508 g;装满另一种气体X时重511 g;则X的相对分子质量为A. 44B. 48C. 64D. 714.物质的量在化学方程式计算中的应用计量依据:各反应物、生成物的物质的量之比等于化学计量数之比.. 例10 把6.5 g Zn 放入足量盐酸中;锌完全反应..计算生成标况下H2的体积..知识总结1. 我们把含有一定数目粒子的集合称为;它是一个 ;符号为;单位是 ;用符号表示是 ..2. 使用物质的量应注意:⑴⑵⑶3. 叫做阿伏加德罗常数;符号为 ;单位为 ;是计量摩尔的标准;1摩尔任何物质所含粒子数目为个;约为个..4. 物质的量、微粒数、阿伏加德罗常数之间的关系..5. 摩尔质量的定义:符号:单位:6. 物质的量、摩尔质量、物质的质量之间的关系..7. 物质的量、气体..体积之间的关系....摩尔体积、气体注意:标准状况0℃、101kPa时气体摩尔体积为_________________________;但其不一定是标准状况时的气体摩尔体积..在每一种状况下都有对应的气体摩尔体积..小练习1. 下列说法正确的是A. 摩尔是七个基本物理量之一B. 物质的量就是物质的质量C.12 g12C中含有阿伏加德罗常数N A个碳原子D. 阿伏加德罗常数就是6.02×1023 mol-12. 下列关于物质的量的叙述;正确的是A. 1 mol任何物质都含有6.02×1023个分子B. 0.012 kg14C中约含有6.02×1023个碳原子C. 1 mol水中含有2 mol氢和1 mol氧D. 1 mol氢气分子中含有2 mol氢原子3. 用N A表示阿伏加德罗常数的值;下列说法错误的是A. 在标准状况下;22.4 L H2中含有氢分子的个数为2N AB. 24 g Mg变为Mg2+时失去的电子数为2N AC. 32 g O2中含有氧原子的个数为2N AD. 1 L 1 mol·L-1 NaCl溶液中含有钠离子的个数为N A4. 下列说法正确的是① 2 mol铁原子② 1 mol Fe3+③ 0.5 mol氧④ 0.5 mol 氮气分子⑤ 1 mo1氯的质量为35.5 g;1 mol Cl-质量也为35.5 g⑥氨的摩尔质量是17 gA. ①②④⑥B. ①②④⑤⑥C. ①②④D. ①②③④⑤⑥5. 同温同压下;同体积的气体单质X2和气体单质Y2化合生成气体Z;反应前后气体的体积保持不变;则Z的化学式为A. X2Y3B. X2YC. XY2D. XY6. 关于质量相同的N2和CO;下列叙述正确的是A. 其摩尔质量均为28 gB. 其物质的量均为1 molC. 各取11.2 L两种气体所含的原子数均为N AD. 分子数目均为其所含原子数目的一半7. 相同条件下;下列各组中分子数一定相同的是A. 14 g N2与32 g NO2B. 34 gNH3与4 gH2C. 2LCO2与2LH2OD. 11.2 LCO与0.5 molO28. 下列说法正确的是A. 1 mol 任何气体的体积都是22.4 L·mol-1B. 1 molH 2的质量是1 g;它所占的体积是22.4 L·mol-1C. 在标准状况下;1 mol任何气体所占的体积都约为22.4 L·mol-1D. 在标准状况下;1 mol任何气体所占的体积都约为22.4 L9. 用N A表示阿伏加德罗常数的值;下列说法正确的是A. 2 g H2中含有的分子数为N AB. 常温常压下;22.4 L Cl2中含有的分子数为N AC. 1L 1 mol·L-1 K2SO4溶液中含有钾离子数为N AD. 1 mol钠原子中含有的电子数为N A10. 足量的浓盐酸与 4.35 g MnO2混合加热;向反应后的溶液中加入53 g 10%的Na2CO3溶液;恰好不再产生气体;再向溶液中加入过量的AgNO3溶液..试计算:1 标准状况下产生Cl2的体积;2 生成AgCl沉淀的质量..11. 某气态氧化物化学式为RO2;在标准状况下;1.28 g该氧化物的体积为448 mL;则该氧化物的摩尔质量为________;R的相对原子质量为________..12. 将6.1gNH4Cl和NH42SO4的混合物完全溶于水; 加入过量的烧碱溶液并加热; 将产生的气体用100 mL 0.6 mol·L-1的硫酸完全吸收; 为中和过量的酸;用去40 mL 0.5 mol·L-1KOH溶液; 则原混合物中NH4Cl 和NH42SO4的物质的量之比为多少。
