环氧化合物专题
[理学]第八章 醚和环氧化合物讲解学习
![[理学]第八章 醚和环氧化合物讲解学习](https://img.taocdn.com/s3/m/78163a936aec0975f46527d3240c844769eaa00a.png)
CH3- CH C2H Nu O
Nu CH3 CH C2H (似SN 2)
O-
空间障碍C1: < C2 , Nu更容易从背面进 1 攻C
例如:
H H 3 3 C CCO C HC H 3C H 3 O N C aH , 3 C O H -3 O HH 3 CO C C H 3O C H C H C H 33C H 3 O HH 3 CO C C H H 3O C H C H C H 33
OC H3+ H I
O H+ C H3 I
返回
8.3 醚的化学性质
(3)过氧化物的生成
醚对氧化剂较稳定,但长期与空气接触可被空气中 的氧氧化为有机过氧化物。氧化过程比较复杂,可能 是先生成α-氢过氧化物,然后再转变为更复杂的过 氧化物。
+ H3 CC HOC HC H2 O2
C H3 C H3
OO H H3 C COC HC H3
C H3 C H3
过氧化物
返回
过氧化物的检验:酸性碘化钾淀粉试纸
除去过氧化物的方法: 5%FeSO4、5%NaHSO3、5%NaI均可洗去过氧化物。
防止过氧化物的生成: ① 将乙醚贮存于棕色瓶中; ② 在乙醚中加入铁丝(还原剂)。
8.3 醚的化学性质
(4) 环氧乙烷的化学性质
环氧乙烷又叫氧化乙烯,是重要的环醚。它是无
例如chchchch4甲氧基2己烯chchchchohoc醚的命名返回环氧乙烷环氧某烷或从杂环化合物名称衍生12环氧丙烷3氯12环氧丙烷环氧氯丙烷14环氧丁烷四氢呋喃thf多元醚多元醇的烃衍生物命名时首先写出多元醇的名称再写出烃基的数目和名称最后写上醚字
[理学]第八章 醚和环氧化 合物
8.1 醚(Ethers)
第八章醚和环氧化合物(etherandepoxides)

第一节醚(ether)一、醚的结构、分类与命名二、醚的物理性质三、醚的化学性质四、冠醚五、硫醚混醚对于 Ar—O—R 型芳香醚,芳香烃基名称在前,脂肪烃基名称在后。
苯甲醚多元醚首先写出多元醇的名称,再写出另一部分烃基的数目和名称,最后写 “醚”字。
CH3OCH2CH2O CH3乙二醇二甲醚CH3OCH2CH2O CH2CH3乙二醇甲乙醚较复杂的醚以较大的烷基、不饱和烃基或芳香烃基所对应的烃作为母体,另一烃基与氧组成的烃氧基作为取代基。
HOCH2CH2OCH2CH3 2-甲氧基戊烷2-乙氧基乙醇环醚多用俗名;或按杂环化合物命名的方法命名。
(1)命名或写结构式(2)(3)CH 3CHCHCH 2CH 2CH 3OC 2H 5CH 32-甲基-3-乙氧基己烷CH 3CH 2OCH(CH 3)2O 乙基异丙基醚苯基环丙基醚一些常见醚的物理性质0.994158.3-37.3苯甲醚35CH 2═CHOCH ═CH 2二乙烯基醚0.769141-97.9(CH 3CH 2CH 2CH 2)2O 正丁醚0.72568-86(CH 3)2CHOCH(CH 3)2异丙醚0.73690.5-122(CH 3CH 2CH 2)2O 正丙醚0.71434.6-116CH 3CH 2OCH 2CH 3乙醚0.69710.8CH 3OCH 2CH 3甲乙醚0.661-24.9-138CH 3OCH 3甲醚密度/(g·cm -3)沸点/℃熔点/℃结构式化合物(续表)0.86383-68CH 3OCH 2CH 2OCH 3乙二醇二甲醚1.033101111,4-二氧六环0.88865.4-108四氢呋喃0.88211环氧乙烷 1.07425927二苯醚密度/(g·cm -3)沸点/℃熔点/℃结构式化合物三、醚的化学性质RCH 2 -O-CH 2R●●1、 盐的生成2、醚键的断裂3、过氧化物的生成H +(一) 盐的生成醚分子中氧原子上的孤对电子能接受质子而生成 盐。
醚和环氧化合物
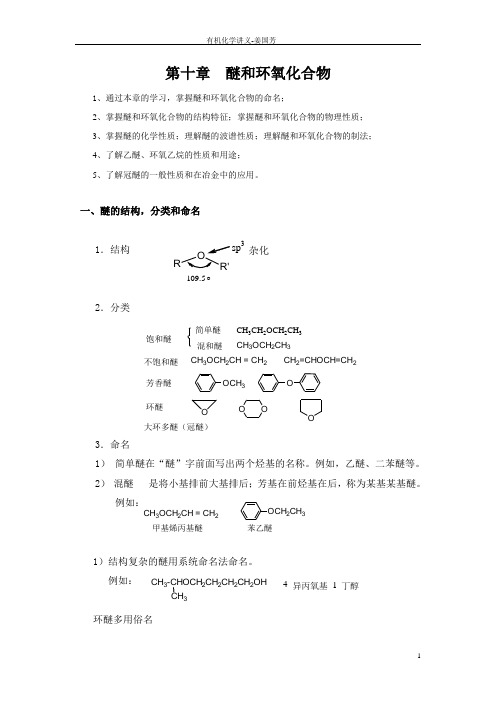
第十章 醚和环氧化合物1、通过本章的学习,掌握醚和环氧化合物的命名;2、掌握醚和环氧化合物的结构特征;掌握醚和环氧化合物的物理性质;3、掌握醚的化学性质;理解醚的波谱性质;理解醚和环氧化合物的制法;4、了解乙醚、环氧乙烷的性质和用途;5、了解冠醚的一般性质和在冶金中的应用。
一、醚的结构,分类和命名1.结构 2.分类3.命名1) 简单醚在“醚”字前面写出两个烃基的名称。
例如,乙醚、二苯醚等。
2) 混醚 是将小基排前大基排后;芳基在前烃基在后,称为某基某基醚。
例如:1)结构复杂的醚用系统命名法命名。
例如:环醚多用俗名饱和醚简单醚混和醚不饱和醚芳香醚环醚大环多醚(冠醚)CH 3CH 2OCH 2CH 3CH 3OCH 2CH 3CH 3OCH 2CH = CH 2CH 2=CHOCH=CH 2OCH 3O O OOOCH 3OCH 2CH = CH 2OCH 2CH 3甲基烯丙基醚苯乙醚CH 3-CHOCH 2CH 2CH 2CH 2OHCH 3异丙氧基丁醇4 --1-ROR'°109.5sp 3杂化二、醚的物理性质常温下,大多数醚为易挥发、易燃烧、有香味的液体。
醚分子中因无羟基而不能在分子间生成氢键,因此醚的沸点比相应的醇低得多,与分子量相近的烷烃相当。
常温下,甲醚、甲乙醚、环氧乙烷等为气体,大多数醚为液体。
醚分子中的碳氧键是极性键,氧原子采用sp 3杂化,其上有两对未共用电子对,两个碳氧键之间形成一定角度,故醚的偶极矩不为零,易于与水形成氢键,所以醚在水中的溶解度与相应的醇相当。
甲醚、1,4-二氧六环、四氢呋喃等都可与水互溶,乙醚在水中的溶解度为每100g 水溶解约7克,其它低分子量的醚微溶于水,大多数醚不溶于水。
二、乙醚能溶于许多有机溶剂,本身也是一种良好的溶剂。
乙醚有麻醉作用,极易着火,与空气混合到一定比例能爆炸,所以使用乙醚时要十分小心。
三、醚的化学性质醚是一类不活泼的化合物,对碱、氧化剂、还原剂都十分稳定。
醚和环氧化合物

第7章 醚和环氧化合物本章重点介绍醚和环氧化合物的结构和化学性质;醚键断裂的机制;环氧乙烷开环反应的机制;取代环氧化合物在酸和碱催化下的开环取向;以及醚在医药学上的应用。
醚(ether)是含氧的有机物,可以看成是醇或酚分子中羟基的氢原子被烃基取代而成的化合物,醚的化学性质不活泼,是常用的有机溶剂。
环氧化合物(epoxide )是指含有三元环的醚及其衍生物。
它属于环醚,但性质与一般的醚不同,高度活泼,是合成反应重要的中间体。
学完本章后,你应该能够回答以下问题: 1. 醚的结构如何?它怎样分类和命名? 2. 醚键断裂有何规律?反应机制是什么? 3. 环氧化合物特指哪一类环醚?它如何命名? 4. 环氧乙烷开环反应的机制是什么?5. 取代环氧化合物在酸性和碱性条件下的开环取向是否一样?为什么? 6. 冠醚是什么样的化合物?有哪些重要用途?7.1 醚的结构、分类和命名温习提示:醇的结构,醇分子间脱水反应。
醚的结构通式为R-O-R 、Ar-O-R 或Ar-O-Ar ,分子中的C-O-C 键称为醚键,是醚的官能团。
甲醚分子中C-O-C 键角为111.7°,氧原子为sp 3不等性杂化,两对孤对电子位于sp 3杂化轨道。
H 3C3图7-1 甲醚的结构按醚键所连接的烃基不同,醚可以是饱和醚、不饱和醚和芳香醚等: 饱和醚: CH 3OCH 3 CH 3CH 2OCH 2CH 3 CH 3OCH 2CH 3 不饱和醚: CH 3CH 2OCH=CH 2 芳醚:两个烃基相同的为单醚,两个烃基不同的为混醚。
如果氧原子与烃基连成环则为环醚。
分子中含有多个氧原子的大环醚,因为结构象皇冠而被称为冠醚。
单醚命名时,如果是两个饱和烃基,在烃基名称后面加上醚字,通常“二”字可省略;CH 33如果是不饱和烃基或芳烃基,“二”字不可省略。
英文名称醚为ether ,例如:CH 3CH 2-O-CH 2CH 3 CH 2=CH-O-CH=CH 2(二)乙醚 二乙烯基醚 二苯醚diethyl ether diethenyl ether diphenyl ether混醚命名时,分别写出两个烃基的名称,加上醚字,如果是两个脂肪烃基,较优基因放在后面;如果有芳烃基,则芳烃基放在前面,英文命名醚中烃基按第一个字母顺序排列。
有机化学10---醚和环氧化合物

C O
C
利用分子内的Williamson合成法
OH (CH2)n CH2X OH H2 O CH2—X O (CH2)n (CH2)n+1 O
X
10.4 醚的物理性质
沸点低于同碳原子数的醇,因为醚分子之间不能形成氢键。 醚与水能形成氢键,乙醚与丁醇溶解度相同.
R
:O:
R
O H H
四氢呋喃能与水混溶,因其氧原子突出在外,更容易与 水形成氢键。 醚不活泼,是良好的有机溶剂。常用的有机溶剂有:乙醚、 四氢呋喃、1,4-二氧六环等。
(A) CH3OCH2CH(CH3)2
(C) CH3CH2OCH(CH3)2
(B) CH3CH2OCH2CH2CH3
(D) CH3OC(CH3)3
1) 1H-NMR谱图中,仅具有单峰; 2) 1H-NMR谱图中,只有一个双峰; 3) 1H-NMR谱图中,除含有其它质子峰外,在较低场中具有 两个吸收峰,其中一个为单峰,另一个为双峰; 4)1H-NMR谱图中,除含有其它质子峰外,在较低场中具有 两个吸收峰,其中一个为三重峰,另一个为四重峰; 答案: 1)D; 2)C; 3)A; 4)B.
◇ 检验:用KI-淀粉试纸,若试纸变蓝色,说明存在过氧化物。 ◇ 除去过氧化物可用还原剂Na2SO3、FeSO4等。 ◇ 储存时醚中加入少许金属钠或铁屑,以免过氧化物形成。 ◇ 蒸馏乙醚时,不要蒸干,以免过氧化物过度受热而爆炸。蒸 馏前必须检验有无过氧化物存在,以防意外。
*10.7
冠 醚(自学)
O O O O O
10.6 醚和环醚的化学性质
*10.6.5 Claisen重排 (周环反应)
OCH2CH CH2 200℃ OH CH2CH CH2
第十章-醚和环氧化合物

检查过氧化物的方法:使湿的淀粉/KI试纸变蓝或使FeSO4 /KSCN显红色。 除去过氧化物的方法:用FeSO4洗涤(还原破坏)
四、克莱森(Claisen)重排
烯丙基芳基醚在高温下可以重排为邻烯丙基酚或对烯丙基酚, 称为克莱森重排。
OC* H2CH=CH2 200oC
OH CH2CH=C* H2
若邻位已被占领,烯丙基经两次连续重排迁移到对位。
CH3
OCH2CH=C* H2 CH3
CH3
OH CH3
CH2CH=C* H2
αβγ
O CH2CH=CHCH3
CH3
CH3
重排机理:经历环状过渡态
CH3
OH CH3
CH2CH=CHCH3
α βγ
* O
* O
O
OH
H CH2CH=C*H2 互变异构
CH2CH=C* H2
如何制备?
OH
CHCH2CH3 C6H5 CH3
KOH 160 ~180oC
CH2=CH O C2H5
汞盐催化下醇对炔烃的亲电加成反应
CH3C CH + HOR Hg2+
CH2C=CH2 OR
第四节 醚的化学性质
醚是一类不活泼的化合物,对稀酸、碱、金属钠、催化氢 化、氧化剂、还原剂等都很稳定,与强酸可以发生反应。
一 烊盐的形成 二 醚键的断裂 三 生成过氧化物 四 克莱森重排
OR C
OR
H3O+
C O + ROH
ROH
H3O+
H+
O
O OR
四氢吡喃醚
+ ROH
O OH
常用于保护羟基
4* 含芳基的混合醚,醚键总是优先在脂肪烃基一边断裂。
第7章 醚和环氧化合物

第7章醚和环氧化合物7.1基本要求●掌握醚和环氧化合物的分类和命名方法。
●熟悉醚和环氧化合物结构特点●掌握醚和环氧化合物的主要化学性质。
7.2基本知识点●醚分子中的醚键C—O—C,是醚的官能团。
●根据醚键连接的烃基不同,醚可分为饱和醚、不饱和醚和芳醚。
如果两个烃基相同,为单醚;两个烃基不同为混醚。
●单醚命名时,如果是两个饱和烃基,直接在烃基名称后面加“醚”字,通常“二”字可省略;如果是不饱和烃基或芳烃基,“二”字不可省略。
混醚命名时,分别写出两个烃基的名称,加上“醚”字,如果是两个脂肪烃基,较优基团放在后面,即“先小后大”,称“某某醚”;如果有芳烃基,则芳烃基放在前面,即“先芳香后脂肪”。
结构复杂的醚,常用系统命名法,以较长的烃基为母体,简单的烃基看作含氧取代基。
如果氧原子与烃基连成环则为环醚。
环醚可以称为环氧某烷,也可按杂环化合物名称命名。
●分子结构中含有多个—OCH2CH2—环醚,称为冠醚。
冠醚命名时要分别表明分子中原子总数(X)和氧原子数(Y),称为X-冠-Y。
●醚分子间不能形成氢键,因而沸点低于同分异构的醇,而接近相对分子质量相近的烷烃。
醚与水分子可形成氢键,所以低级醚在水中的溶解度与相对分子质量相近的醇接近。
醚是常用的有机溶剂。
●醚的化学性质稳定,稳定性仅次于烷烃。
醚能以钅羊盐的形式溶于浓酸中,借此可与不溶于浓酸的烷烃或卤代烃相区别。
在浓酸(如氢卤酸)作用下,醚键断裂,生成醇和卤代烃。
含有两个不同烃基的混醚,通常是较小的烃基生成卤代烃,较大的烃基生成醇。
如果氢卤酸过量并加热,生成的醇可进一步反应生成卤代烃。
含有苯基的混醚,总是生成酚和卤代烃,二苯基的混醚则不发生醚键断裂.。
醚键断裂的机理为亲核取代。
●环氧化合物是特指含有三元环的醚及其衍生物。
环氧化合物的普通命名法称为氧化某烯,环氧化合物的衍生物有两种命名法: (1) 将环氧化合物的母体命名为环氧乙烷,三元环中的氧原子编号为1,两个碳原子依次编号; (2) 环氧化合物命名为环氧某烷,并标明与氧原子成环后的碳原子的位置。
8有机化学醚环氧化合物

(ethers and epoxides) 醚:醇(酚)羟基上的氢被烃基取代的化合物。
也可看做是水分子中的氢原子被两个烃基 取代的化合物。 环氧化合物:含三元环的醚及其衍生物。
醚的用途:有机溶剂、冷冻剂、香精等。 环氧乙烷临床用于医疗器械消毒。
一、醚
结构、命名和分类 物理性质 化学性质
环氧乙烷化学性质活泼,在酸或碱催化下能 与多种亲核试剂反应,形成一系列重要工业 原料
1.对称环氧化合物的开环反应
在稀酸、强碱的作用下,环被打开,生成
相应的加成产物。
例如:
O
+ H2O H+
O H+
+ HCl
OH OH CH2 CH2 OH Cl CH2 CH2
O
+ H2O OH
-
OH OH CH2 CH2
二、环氧化合物
结构和命名 开环反应
第一节 醚
一、醚的结构、分类和命名 1.结构 (非直线型)
醚的通式 R-O-R Ar-O-Ar
Ar-O-R
sp3
O
H 3C CH3
110 0
2. 分类: 饱和醚
简单醚 混和醚
CH3CH2OCH2CH3 CH3OCH2CH3
不饱和醚 CH3OCH2CH = CH2 CH2=CHOCH=CH2
H
H
2.命名
a. “氧化某烯”
氧化乙烯
O
O CH3
氧化丙烯
b.将环氧化合物的母体命名为“环氧乙烷”,三元
环中的氧原子编号为“1”
O
O
CH2CH3
H3C
CH3
2-乙基环氧乙烷
2,3-二甲基环氧乙烷
醚和环氧化合物(3)

整理课件
9
(1)铁羊盐的形成
醚链中氧原子上的孤电子对可作为一种路易斯 碱,接受强酸中的质子形成铁羊 盐而溶于强酸。
C 2 H 5 O 2 H 5 C 浓 H H 2 2 O S4O [C 2 H 5O H C 2 H 5] + H4 -SO
由于氧对孤电子对的吸引较强,因此醚的氧只 能与强酸的质子形成 铁羊盐,用水稀释,铁羊盐
O C 2H 5
HI △
OH + C 2H 5I
二苯基醚的醚键很稳定,通常不易与HX发 生醚键的断裂反应。
整理课件
13
(三) 醚的过氧化物的形成
醚对氧化剂是稳定的,但在空气中久置,会
慢慢发生自动氧化,α碳上的氢可被氧化生
成过氧化物。
CH3CH2OCH2CH3
O2 CH3CH-OCH2CH3 O OH
整理课件
19
第二节 环氧化物
一个氧原子与相邻的两个碳原子相连构成 的三元环醚,不稳定,性质特殊,在有机 化学中特称为环氧化物(epoxides)。
整理课件
20
一 环氧化合物的结构和命名
C
C
O
整理课件
21
普通命名法:根据相应的烯烃称为氧化 某烯。
O
O
O
C2HC2H C2HCH 3 CC H 2HC(3 )2 CH
(ethyl methyl ether)
O
(二)苯(基)醚 (phenyl ether)
O CH2CH3
苯乙醚 (ethyl phenyl ether)
整理课件
6
烃基结构比较复杂的醚,以烃为母体,烃氧基 为取代基来命名。
CH3CH2 CH CH3
CH3 CCH3 OCH3
大学有机化学醚和环氧化合物PPT课件

• 有机化学醚的介绍 • 环氧化合物的介绍 • 醚和环氧化合物的比较 • 有机化学醚和环氧化合物的实际应用 • 有机化学醚和环氧化合物的未来发展
01
有机化学醚的介绍
醚的定义和结构
醚的定义
醚是一类由醇或酚与卤素或硫酸反 应生成的化合物,其结构通式为RO-R',其中R和R'为烃基。
醚和环氧化合物的应用比较
醚的应用
醚在工业上主要用于溶剂、麻醉剂、农药等。
环氧化合物的应用
环氧化合物主要用于合成树脂、聚合物、涂料等高分子材料。
应用比较
醚和环氧化合物的应用领域不同,醚主要用于化学试剂、农药等; 而环氧化合物主要用于高分子材料合成。
04
有机化学醚和环氧化合物的实际应用
醚在医药领域的应用
THANKS
感谢观看
一些醚类化合物具有杀虫、杀 菌或除草活性,可以直接用作 农药,如杀螨醚、苯氧威等。
醚类化合物还可以作为农药的 增效剂,与其他农药混合使用, 以提高防治效果并减少农药的 使用量。
环氧化合物在材料科学领域的应用
环氧化合物可以通过聚合反应制备高 分子材料,如环氧树脂、环氧橡胶等, 这些材料具有优异的力学性能、电绝 缘性能和耐腐蚀性能。
醚和环氧化合物的性质比较
醚的性质
醚是较为稳定的化合物,对酸、 碱都有较好的稳定性。醚的沸点 较低,容易挥发。
环氧化合物的性质
环氧化合物对酸、碱都敏感,容 易发生开环反应。环氧化合物的 沸点较高,不易挥发。
性质比较
醚和环氧化合物的性质差异较大, 醚较为稳定,沸点低;而环氧化 合物对酸、碱敏感,沸点较高。
详细描述
环氧化合物具有多种化学性质,包括亲核性、亲电性、开环反应等。在一定条件下,环氧化合物可以 与多种试剂发生反应,如醇、酚、胺等。其中,开环反应是环氧化合物最重要的反应类型之一,可以 通过与氢离子、金属离子等反应打开环氧环。
新颖的生物基环氧化合物

新颖的生物基环氧化合物:使环氧化的脂肪酸蔗糖酯摘要:新颖的高功能性生物基环氧树脂由来自植物油脂肪酸的蔗糖酯环氧化反应(SEFA)合成。
很多脂肪酸的蔗糖酯被过氧化氢和醋酸在离子交换树脂催化剂中提取的过乙酸环氧化制成的环氧化的脂肪酸的蔗糖酯。
双键向环氧化合物的转化多于99%。
产品特性已用基体协助激光解吸和电离分析时间,质谱分析法,霍氏转换红外光谱仪(FTIR)和核磁共振测定。
物性用体积粘度,特性粘度和密度进行表征。
热学性能有DSC和TDA表征。
由于蔗糖酯包含蔗糖的核心完全由8个植物油脂肪酸替代,SEFAs和ESEFAs 都有定义明确的紧凑的大分子结构。
作为新颖的生物基环氧树脂复合物,ESEFAs 有很高的环氧官能团(每个分子8-15个),高密度和紧凑的分子结构。
而且,ESEFAs从通过交联环氧树脂官能团在生物基热固性材料的组成到环氧树脂官能团反应的衍生都很有前途。
1简介可再利用的原材料的利用被看做是有利于可持续发展的绿色化学。
植物油,是脂肪酸中自然产生的三酸甘油酯,占制备的生物基聚合物所需可再生原材料很大比例。
碳水化合物是另一种典型的做绿色材料的原材料,将低分子量的碳水化合物做产品以取代石油基产品很有吸引力。
蔗糖是一个有8羟基官能团的二糖。
将蔗糖与植物油脂肪酸结合以出产脂肪酸蔗糖酯以做涂层的车辆的第一次探索是在1960年。
然而最近探索发现得到的8羟基官能团最大饱和度是7。
当时的树脂无法商业化。
在21世纪早期,Proctor& Gamble (P&G) Chemicals 发展了一种不同的将SEFA商业化的进程,饱和度至少7.7,并将其介绍到润滑油和油漆市场。
SEFOSE (上述产品商标)蔗糖酯可用作粘合剂和活性填充剂。
Fig. 1 有全取代的大分子结构。
环氧化合物是环醚类,也叫环氧乙烷,氧原子存在于三元环中。
用脂肪化合物不饱和双键进行环氧化是最有用的修正方法之一,因为环氧化合物是稳定生成新官能团,通过加入亲核对环氧化合物开环可生成很多产品,如二醇,醚醇,酯醇,氨基醇。
有机化学-第十章醚和环氧化合物

H H3CH2C O C O O n H
CH3
+ (n-1) CH3CH2OH
有机化学 第十章 醚和环氧化合物
31
本章的重点和难点
醚和环氧化合物的结构; 醚和环氧化合物的制备方法; 环氧化合物在酸、碱催化下醚键的断裂反应;
有机化学 第十章 醚和环氧化合物
32
作业
P375 习题(一); P376 习题(二)(1-4);习题(四)单
R O Na + R' L R O R' + Na L L: Br, I, OSO2R'' 或 OSO2OR''等
反应特点: SN2; 反应原料最好使用RCH2X
有机化学 第十章 醚和环氧化合物
11
(2) 芳香醚的合成
O ONa + CH3OSOCH3
O
O
OCH3 + NaOSOCH3
(75%)
O
6
(5) 冠醚
m-冠-n m: 碳、氧原子总数 n: 氧原子数
O
O
OO
12-冠-4
O O
O O
O
苯并-15-冠-5
有机化学 第十章 醚和环氧化合物
7
2. 结构
1) 醚
O
0.142 nm
CH3 112° CH3
O: sp3 杂化
2) 环氧化合物
0.147 nm
CH2
CH2
59.2°
0.144 nm
剧毒
OH
O
+ H3CO C OCH3
OCH3 + CH3OH + H2O
无毒无害,
绿色化学。 有机化学 第十章 醚和环氧化合物
醚、环氧化合物

3. Claisen重排的应用 Claisen重排的应用 用于制备烃基酚及γ 用于制备烃基酚及γ,δ-不饱和醛或酮。 不饱和醛或酮。
乙烯 基 O 烯 丙基
O
C6H5CH
CHOCH2CH CHCH3 C6H5CH CH O H3C CH CH CH2
C6H5CH CH O H3C CH CH CH2
3
氧杂( 氧杂(噁)oxa; 氮杂(吖)Azo; 硫杂(噻)thia ; 氮杂( ; 硫杂(
10.2 醚的物理性质
O H 沸点: 沸点:
104.5
o
O H R
110
o
R
因醚分子中无氢键,沸点比分子量相近的醇低,但比烷烃高。 因醚分子中无氢键,沸点比分子量相近的醇低,但比烷烃高。 溶解度:醚能与水形成氢键,溶解度与分子量相近的醇相近。 溶解度:醚能与水形成氢键,溶解度与分子量相近的醇相近。 环醚有较大的溶解度。 环醚有较大的溶解度。 O O O
O H
OH 互变 异构
γ β α
H
H
烯 丙基苯基 醚
1α
环 状过渡 态
邻烯丙基苯苯 酚
O H
2β 3γ 3
O
1 2
H
1γ 2 β 3α
O
H
1γ 2 β 3α
O
H
OH
γ
H α
γ β
对烯丙基苯苯酚
H
H
β α
环状过渡态
当芳基的两个邻位未被占满,重排主要得邻位产物;两邻位被 当芳基的两个邻位未被占满,重排主要得邻位产物; 占满,重排到对位, 对位均被占,则不发生重排。 占满,重排到对位,邻、对位均被占,则不发生重排。
4
10.3 醚的制法
有机化学:第10章 醚和环氧化合物

CH3 112° CH3
O: sp3 杂化
图10.1 乙醚分子的球棍模型
2、环氧化合物的结构
0.147 nm
CH2
CH2
59.2°
O
0.144 nm 61.5°
三元环具有较大的环张力
三、醚和环氧化合物的制法
1、醚和环氧化合物的工业合成
乙醚:
2 CH3CH2OH
浓
H2SO4
△
CH3CH2OCH2CH3
结构特点分析
a碳有亲电性, 但难亲核取代
醚在中性、碱性和弱酸性 条件下稳定,常用作溶剂
a碳有亲电性,可 亲核取代
H+
R' C O R
H
C上连有氧, H易被氧化
氧有碱性, 可与酸结合
H R' C O R
H
较好的 离去基
1、 盐的生成
R O R' 一种Lewis碱 pKb≈ 17.5
与强酸作用生成 盐:
CH3
CH3 HBr
CH3 H CH3 C O
CH3 CH3
CH3 Br CH3 C Br
CH3
CH3
CH3 C CH3OH CH3
不对称醚醚键的开裂取向 : 3o>甲基>1o>20
醚键开裂机理
SN2机理
位阻影 响为主
SN1机理
中间体稳 定性为主
28
两类较易水解的醚类化合物
• 叔丁基醚
•烯基醚
醇在硫酸的作用下脱水生成醚——单醚的制备
醇脱水法适用于制备低级单纯醚,不能制高级醚和混合醚。
环氧乙烷:
CH2
CH2
+
1 2
O2
Ag 280~300℃,1~2MPa
10.6环氧化合物的反应

H
Ph
CH
C
H
HO H
H
Ph
CH
C
H
酸酸性性开开环环反反应应
H2C CH2 O
+
••
O
••
••
••
Br
••
H
•• – •• B••r••
H2C CH2 + O ••
H
••
••
Br
••
••
CH2CH2
O
••
H
酸性开环机理的总结
-- --
- -
- -
-C C- O
H+
-
Nu
-C C-
+
O H
酸性开环机理通式
Nu -C C-
OH
9的的9动在动在力这力这主种主种要亲要亲来核来核自取自取于代于代酸反酸反对应对应环中环中氧,氧,化由化由合于合于物H物H2的2O的O是质是质弱子弱子的化的化亲,亲,核以核以试使试使剂C剂C-,-,O所O所键键以以消消反反应应 弱弱,,容容易易断断裂裂((三三元元环环的的高高度度张张力力可可以以看看成成是是反反应应的的潜潜在在动动 开力力开中))中心。。心碳或或碳原者者原子说说子。,,。质质子子化化后后--CCHH22OOHH作作为为较较好好的的离离去去基基团团容容易易离离
+ H2C CHCH3
O 1. 乙醚 2. H3O+
CH2CHCH3
OH (60%)
碱性开环方向
H2C CH(CH2)7CH3
O 亲核试剂优先进攻含
烷基较少的环氧碳原子
1. LiAlH4, 乙醚 2. H2O
H3C CH(CH2)7CH3
OH
(90%)
环氧化合物

一.4,二.1,2,四.1 二.4,5,6 一.7
3. 芳香烃基——不易断裂。
H3C
H
C O+
H H
生成酚
10.6.3 环氧乙烷的开环反应
环氧乙烷由于存在较大角张力,容易与亲核试 剂(如H2O、HX、ROH、NH3、RMgX等)发生亲 核取代反应而开环。
不对称的环氧化合物在酸催化下,有先
形成C+碳正离子的趋势,反应具有SN1的性质, Nu:优先进攻取代较多的C原子:
➢但可以和水分子形成氢键,小分子醚有一定水溶性。
易燃易爆 使用小分子醚时,应避免明火。
乙醚,它遇到火星就有发生燃烧爆炸的危险。其蒸气能 从远处将明火引来起火。
➢醚长期放置受热或碰撞可发生爆炸。 ➢醚有麻醉作用,1850年被用作外科手术上的全身麻 醉剂。(有副作用,现用如七氟醚、卤代烃等)
10.6 醚和环氧化合物的化学性质
{稳定,不和除酸之外的试剂反应。
在空气中会慢慢氧化成过氧化物。
形成过氧化物
溶解于浓酸
R
醚键的断裂
• 对氧化剂、还原剂稳定,对碱稳定 • 对活泼金属稳定 • 有碱性,与强酸反应
10.6.1 盐的生成
醚中氧原子上未共用电子对,可作为路易斯碱, 与强质子酸(如HCl和H2SO4等)和路易斯酸(如 BF3和AlCl3)作用生成 盐; 用冷水稀释又得到醚, 可用于醚的分离、纯化。
称醚以较小基团生成RX为主。
蔡塞尔(Zeisel)甲氧基(-OCH3)定量测定法
R-O-CH3 HI ROH + CH3I AgNO3
AgI 沉淀
根据生成碘化银的量,计算出甲氧基含量。此反 应用于天然的复杂有机化合物分子中甲氧基的测定。
有机化学-第九章-醚和环氧化合物

CH2Cl
+
KCN
18-冠-6 CH3CN 25oC 0.4 h
使无机盐溶于有机相
RX
有机相
RCN +
CH2CN (100 % )
KX+-
K+CN- 冠醚
水相
K+ CN-
O
O
O
K+
CN-
O
O
O
第十九页,共30页。
第三节 环氧化合物(epoxide)
一、结构
1,2-环氧乙烷是一个张力很大的环, 因此比一般的环醚或开链醚的性质 要活泼。
HCl
Cl
Cl
+
O
OH
OH
dl体
CH3
O
CH3OH
OCH3 H3C OH
第二十五页,共30页。
总结:反应即可以是酸催化的,也可以是碱催化的。反应是按照 SN2机理进行的,立体化学特征是发生构型翻转。 酸催化:在取代较多的碳与氧之间的键断裂
碱催化:强亲核试剂进攻取代较少的碳。在取代较少的碳与氧之间 的键断裂。
• 选择性地络合不同金属离子,用于分离金属离子。
命名:m-冠-n
OO Li +
OO
O
O
O
K+
O
O
O
• 作相转移催化剂
12-冠-4 18冠-6
KMnO4 18-冠-6
HOOC(CH2)4COOH
100%
第十八页,共30页。
卤代烃氰解
CH2Cl + KCN
CH3CN 25oC 72h
CH2CN (20 % )
与水互溶 CH2 CH2
O
O
[课件]大学有机化学 醚和环氧化合物PPT
![[课件]大学有机化学 醚和环氧化合物PPT](https://img.taocdn.com/s3/m/18db71dd04a1b0717fd5dd5e.png)
第八章 醚和环氧化合物
第一节 醚 (三、醚的化学性质)
醚键断裂反应属于亲核取代反应, 通常伯烷基醚易按SN2机制进行, 叔 烷基醚易按SN1机制进行。
C H 3 O C H (H C )2 H C 3 H
H-I
SN2 C H 3 C H C H - O H + I - C H C H 3 2 3
H C H 3 + O C H (H C )2 H C 3 H
9 0 %
1 0 %
2-甲基环氧乙烷
2-氯-1-丙醇
1-氯-2-丙醇
上页
下页
首页
第八章 醚和环氧化合物
第二节 环氧化合物 (二、开环反应)
(二) 碱催化开环反应
环氧化合物在强碱作用下, 环 被打开,生成相应的加成产物。
O H, H O 2 N H 3 O C H O H 3 C H O N a 3 H C C H 2 2 O HO H H C C H 2 2 O HN H 2 乙 二 醇 2 -氨 基 乙 醇
1-甲氧基-2-丙醇
OC H C H M g B r 3 2
5 ℃ C H - C H 2 2 2
H O 2 C H C H C H C H O C H C H C H C H O H 3 2 2 2 3 2 2 2 1 丁 醇 ( 8 2 % )
烃 氧 负 离 子 中 间 体
上页
下页
首页
第八章 醚和环氧化合物
I
-
上页
下页
首页
第八章 醚和环氧化合物
第一节 醚 (三、醚的化学性质)
(三) 过氧化物的生成
烷基醚在空气中久置,α-碳上的氢可 被氧化, 生成醚的过氧化物。
+ O C H C H O C H C H C H C H O C H C H 2 3 2 2 3 3 2 3 O O H
