仪器分析习题及答案
仪器分析考试题及答案

仪器分析考试题及答案分析仪器考试题及答案1. 选择题1) 什么是质谱仪器?a. 用于测定物体的质量b. 用于测定物体的质子数c. 用于测定物体的电荷d. 用于测定物体中化学元素的质量及其相对丰度答案:d. 用于测定物体中化学元素的质量及其相对丰度2) 下列哪种仪器可以用于测定溶液的PH值?a. 紫外可见分光光度计b. 原子吸收光谱仪c. 离子色谱仪d. pH计答案:d. pH计2. 填空题1) 大分子量的物质通常使用 _______ 进行分离和检测。
答案:凝胶电泳2) 红外光谱仪适用于检测 _______。
答案:有机化合物的分子结构和化学键3. 简答题1) 请简要介绍质谱仪器的工作原理。
答案:质谱仪器的工作原理是通过将物质中的分子或原子经过电离后加速到高速,然后将其进行分析和检测。
具体过程包括样品的进样,样品中分子或原子的离子化,通过质谱仪器的质量分析装置进行质量分析,最后得到质谱图谱。
2) 离子色谱仪的应用范围是什么?答案:离子色谱仪广泛应用于环境监测、食品安全检测、药物分析等领域。
它可以用于分析离子物质的浓度和组分,对无机及有机离子进行分离和定量分析。
4. 计算题请计算以下离子在10 mL溶液中的浓度:Na+ 为0.2 mol/LCl- 为0.15 mol/L答案:Na+ 的摩尔数 = 浓度 ×体积 = 0.2 mol/L × 0.01 L = 0.002 molCl- 的摩尔数 = 浓度 ×体积 = 0.15 mol/L × 0.01 L = 0.0015 mol因此,Na+ 的浓度为0.002 mol/L,Cl- 的浓度为0.0015 mol/L。
总结:本文介绍了仪器分析考试题及答案,从选择题、填空题、简答题和计算题四个方面进行了讨论。
通过这些题目的解答,可以加深对仪器分析原理和应用的理解,提高仪器操作和实验技能。
仪器分析是化学、生物、环境等科学领域中重要的分析手段,在科学研究和工业生产中起着重要作用。
仪器分析练习题及答案

仪器分析练习题及答案1. 对下列的物理量单位进⾏换算:(1) 150pm X射线的波数(cm-1);(2) 670.7nm Li线的频率(Hz);(3) 3300cm-1波数的波长(µm)。
2. 计算下列电磁辐射的频率(Hz)、波数(cm-1)及光量⼦的能量(⽤电⼦伏eV、尔格erg及千卡/摩尔表⽰):(1) 波长为589.0nm的钠D线;(2) 在12.6µm的红外吸收峰。
3. 将波长为443nm的光通过折射率为1.329的甲醇溶液时,试计算:(1) 在甲醇溶液中的传播速度;(2) 频率;(3) 能量(J);(4) 周期(s)。
4. 辐射通过空⽓(n=1.00027)与某玻璃(n=1.7000)界⾯时,其反射损失的能量⼤约有多少?5. 何谓光的⼆象性?何谓电磁波谱?6. 请按照能量递增和波长递增的顺序,分别排列下列电磁辐射区:红外线,⽆线电波,可见光,紫外光,X射线,微波。
7. 光谱法的仪器通常由哪⼏部分组成?它们的作⽤是什么?1. 原⼦发射光谱是怎样产⽣的?为什么各种元素的原⼦都有其特征的谱线?2. 光谱仪的意义是什么?为何写出Mg285.2nm共振线的光谱线跃迁表达式?3. 试⽐较原⼦发射光谱中⼏种常⽤激发光源的⼯作原理、特性及适⽤范围。
4. 简述ICP光源的⼯作原理及其优点?5. 光谱仪的主要部件可分为⼏个部分?各部件的作⽤如何?6. 棱镜摄谱仪和光栅摄谱仪的性能各⽤那些指标表⽰?各性能指标的意义是什么?7. ⽐较摄谱仪及光电直读光谱仪的异同点?8. 分析下列试样时应选⽤何种激发光源?⑴矿⽯的定性、半定量分析;⑵合⾦中铜的定量分析(0.x~x%);⑶钢中锰的定量分析(0.0x~0.x%);⑷头发中各元素的定量分析;⑸⽔质调查中Cr、Mn、Cu、Fe、Zn、Pb的定量分析。
9. 影响原⼦发射光谱的谱线强度的因素是什么?产⽣谱线⾃吸及⾃蚀的原因是什么?10. 解释下列名词:17. 有⼀块光栅的宽度为5.00mm,每mm的刻痕数为720条,那么该光栅第⼀级光谱分辨率是多少?对波数为1000cm-1的红外线,光栅能分辨的最靠近的两条谱线的波长差为多少?18. ⽤(折射率对波长的变化率)的60o熔融⽯英棱镜和刻有1200条/mm的光栅来⾊散Li的400.20nm及400.30nm两条谱线。
仪器分析练习题及答案

1. 简述仪器分析法的特点。
答:1.仪器分析法灵敏度高。
2.仪器分析法多数选择性较好。
3.仪器分析法分析速度较快,利于批量样品分析。
4.易于使分析工作自动化。
5.相对误差较大。
6.设备复杂、价格昂贵,对仪器工作环境要求较高。
第二章电分析导论1.计算[Cu2+] = 0.0001 mol/L时,铜电极的电极电位(EθCu2+ /Cu=0.337V)2.已知电极反应Ag++ e-=Ag的EθAg+,Ag为0.799V,电极反应Ag2C2O4+ 2e-=Ag + C2O42-的标准电极电位EθAg2C2O4,Ag为0.490V,求Ag2C2O4的溶度积常数。
3. 已知电极反应Zn2++ 2e-=Zn的EθZn2+,Zn=-0.763V,Zn(CN)42-的稳定常数为5×1016。
求电极反应Zn(CN)42-+ 2e-=Zn + 4 CN-的标准电极电位EθZn(CN)42-,Zn。
答案:1.计算[Cu2+] = 0.0001 mol/L时,铜电极的电极电位(EθCu2+ /Cu=0.337V)解:电极反应为:Cu2++ 2e-=Cu按照能斯特方程,铜电极的电位为:E Cu2+ /Cu = EθCu2+ /Cu+RT/nF ln[αCu2+ /αCu]金属的活度为常数,作为1,在非精度的情况下,可以认为αCu2+=[Cu2+]。
则求得(25℃时)E Cu2+ /Cu = EθCu2+ /Cu +RT/nF ln[Cu2+]=0.344+(0.059/2)•lg0.0001=0.226V2.已知电极反应Ag++ e-=Ag的EθAg+,Ag为0.799V,电极反应Ag2C2O4+ 2e-=Ag + C2O42-的标准电极电位EθAg2C2O4,Ag为0.490V,求Ag2C2O4的溶度积常数。
解:根据能斯特方程:EθAg2C2O4,Ag= E Ag+,Ag=EθAg+,Ag + 0.059lg[Ag+]已知EθAg2C2O4,Ag为0.490V,EθAg+,Ag为0.799V,令[ C2O42-]=1得到0.490=0.799+0.059lg(Ksp/1)1/2lgKsp=-{(0.309×2)/0.059}=-10.475Ksp=3.4×10-113. 已知电极反应Zn2++ 2e-=Zn的EθZn2+,Zn=-0.763V,Zn(CN)42-的稳定常数为5×1016。
(完整版)仪器分析试题及答案

(完整版)仪器分析试题及答案-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN复习题库绪论1、仪器分析法:采用专门的仪器,通过测量能表征物质某些物理、化学特性的物理量,来对物质进行分析的方法。
( A )2、以下哪些方法不属于电化学分析法。
A、荧光光谱法B、电位法C、库仑分析法D、电解分析法( B )3、以下哪些方法不属于光学分析法。
A、荧光光谱法B、电位法C、紫外-可见吸收光谱法D、原子吸收法( A )4、以下哪些方法不属于色谱分析法。
A、荧光广谱法B、气相色谱法C、液相色谱法D、纸色谱法5、简述玻璃器皿的洗涤方法和洗涤干净的标志。
答:(1)最方便的方法是用肥皂、洗涤剂等以毛刷进行清洗,然后依次用自来水、蒸馏水淋洗。
(3分)(2)玻璃器皿被污染的程度不同,所选用的洗涤液也有所不同:如:①工业盐酸——碱性物质及大多数无机物残渣(1分)②热碱溶液——油污及某些有机物(1分)③碱性高锰酸钾溶液——油污及某些有机物(1分)(3)洗涤干净的标志是:清洗干净后的玻璃器皿表面,倒置时应布上一层薄薄的水膜,而不挂水珠。
(3分)6、简述分析天平的使用方法和注意事项。
答:(1)水平调节。
观察水平仪,如水平仪水泡偏移,需调整水平调节脚,使水泡位于水平仪中心。
(2分)(2)预热。
接通电源,预热至规定时间后。
(1分)(3)开启显示器,轻按ON键,显示器全亮,约2 s后,显示天平的型号,然后是称量模式0.0000 g。
(2分)(4)称量。
按TAR键清零,置容器于称盘上,天平显示容器质量,再按TAR 键,显示零,即去除皮重。
再置称量物于容器中,或将称量物(粉末状物或液体)逐步加入容器中直至达到所需质量,待显示器左下角“0”消失,这时显示的是称量物的净质量。
读数时应关上天平门。
(2分)(5)称量结束后,若较短时间内还使用天平(或其他人还使用天平),可不必切断电源,再用时可省去预热时间。
一般不用关闭显示器。
(完整word版)仪器分析习题及课后答案..

色谱法习题一、选择题1.在色谱分析中, 用于定性分析的参数是 ( )A.保留值B.峰面积C.分离度D.半峰宽2.在色谱分析中, 用于定量分析的参数是 ( )A.保留时间B.保留体积C.半峰宽D.峰面积3. 良好的气-液色谱固定液为 ( )A.蒸气压低、稳定性好B.化学性质稳定C.溶解度大, 对相邻两组分有一定的分离能力D. (1)、(2)和(3)4. 在气-液色谱分析中, 良好的载体为 ( )A.粒度适宜、均匀, 表面积大 (2)表面没有吸附中心和催化中心C.化学惰性、热稳定性好, 有一定的机械强度D. (1)、(2)和(3)5. 试指出下列说法中, 哪一个不正确? 气相色谱法常用的载气是 ( )A.氢气B.氮气C.氧气D.氦气6.在液相色谱中,范第姆特方程中的哪一项对柱效的影响可以忽略()A.涡流扩散项B.分子扩散项C.流动区域的流动相传质阻力D.停滞区域的流动相传质阻力7. 使用热导池检测器时, 应选用下列哪种气体作载气, 其效果最好? ( )A.H2B.HeC. ArD.N28.热导池检测器是一种 ( )A.浓度型检测器B.质量型检测器C.只对含碳、氢的有机化合物有响应的检测器D.只对含硫、磷化合物有响应的检测器9. 使用氢火焰离子化检测器, 选用下列哪种气体作载气最合适? ( )A.H2B.HeC.ArD.N210.含氯农药的检测使用哪种色谱检测器为最佳?( )A. 火焰离子化检测器B. 热导检测器C. 电子捕获检测器D. 火焰光度检测器11. 某色谱柱长1m时,其分离度为1.0,问要实现完全分离(R=1.5),色谱柱至少应为多长:A. 1.5mB. 2.25mC. 3mD. 4.5m12. 气相色谱检测器中,通用型检测器是:A. 热导池检测器B. 氢火焰离子化检测器C. 火焰光度检测器D. 差示折光检测器13. 使用热导池检测器时,下列操作哪种是正确的:A.先开载气,后开桥电流, 先关载气,后关桥电流B. 先开桥电流,后开载气, 先关载气,后关桥电流C. 先开载气,后开桥电流, 先关桥电流,后关载气D. 先开桥电流,后开载气, 先关桥电流,后关载气14. 下列哪种方法不适用于分析试样中铅、镉等金属离子的含量A. 气相色谱法B. 原子吸收分光光度法C. 可见分光光度法D. 伏安法15. 分析农药残留,可以选用下列哪种方法:A. 电位分析法B. 原子吸收光谱法C. 原子发射光谱法D. 气相色谱法16.载体填充的均匀程度主要影响()A.涡流扩散B分子扩散 C.气象传质阻力 D.液相传质阻力17.在色谱分析中,柱长从 1m 增加到 4m ,其它条件不变,则分离度增加( )A. 4 倍B. 1 倍C. 2 倍D. 10 倍18.试指出下述说法中, 哪一种是错误的? ( )A.根据色谱峰的保留时间可以进行定性分析B. 根据色谱峰的面积可以进行定量分析C. 色谱图上峰的个数一定等于试样中的组分数D.色谱峰的区域宽度体现了组分在柱中的运动情况19. 色谱体系的最小检测量是指恰能产生与噪声相鉴别的信号时 ( )A 进入单独一个检测器的最小物质量B 进入色谱柱的最小物质量C 组分在气相中的最小物质量D 组分在液相中的最小物质量20.柱效率用理论塔板数n或理论塔板高度h表示,柱效率越高,则:A.n越大,h越小;B.n越小,h越大;C.n越大,h越大;D.n越小,h越小;21..如果试样中组分的沸点范围很宽,分离不理想,可采取的措施为:A.选择合适的固定相;B.采用最佳载气线速;C.程序升温;D.降低柱温22.要使相对保留值增加,可以采取的措施是:A.采用最佳线速;B.采用高选择性固定相;C.采用细颗粒载体;D.减少柱外效应二、填空题1.色谱分析中,根据进行定性分析,根据进行定量分析。
仪器分析考试题及答案

仪器分析考试题及答案一、选择题(每题2分,共20分)1. 原子吸收光谱法中,用于测量元素浓度的参数是()。
A. 波长B. 吸光度C. 光程D. 光源强度答案:B2. 质谱仪中,用于将样品分子离子化的方法不包括()。
A. 电子轰击B. 化学电离C. 热解吸D. 电喷雾答案:C3. 色谱法中,用于分离混合物中不同组分的基本原理是()。
A. 样品的物理状态B. 样品的化学性质C. 样品的生物活性D. 样品的热稳定性答案:B4. 在红外光谱分析中,用于识别官能团的特征吸收峰是()。
A. 指纹区B. 特征区C. 组合区D. 吸收区答案:B5. 核磁共振波谱法中,用于区分不同化学环境的氢原子的是()。
A. 化学位移B. 耦合常数C. 信号强度D. 弛豫时间答案:A6. 紫外-可见光谱法中,用于测量样品对光的吸收的参数是()。
A. 波长B. 吸光度C. 光程D. 光源强度答案:B7. 电化学分析法中,用于测量电极电位的方法是()。
A. 电位滴定B. 循环伏安法C. 电导分析D. 极谱分析答案:B8. 气相色谱法中,用于分离挥发性组分的参数是()。
A. 沸点B. 分子量C. 极性D. 溶解度答案:A9. 液相色谱法中,用于分离非挥发性或热不稳定组分的参数是()。
A. 沸点B. 分子量C. 极性D. 溶解度答案:C10. 质谱仪中,用于确定分子质量的参数是()。
A. 离子化能量B. 碎片离子C. 分子离子峰D. 同位素峰答案:C二、填空题(每题2分,共20分)1. 在原子吸收光谱法中,_________是测量元素浓度的关键参数。
答案:吸光度2. 质谱仪中的_________可以提供样品分子的质量信息。
答案:分子离子峰3. 色谱法中的_________是分离混合物中不同组分的基本原理。
答案:分配系数4. 红外光谱分析中,_________区的特征吸收峰用于识别官能团。
答案:特征区5. 核磁共振波谱法中,_________用于区分不同化学环境的氢原子。
仪器分析习题及答案

仪器分析习题及答案C.分子振动能级的跃迁伴随着转动能级的跃迁D.分子中电子能级的跃迁伴随着振动、转动能级的跃迁2.在紫外-可见分光光度分析中,极性溶剂会使被测物的吸收峰()A.消失 B.精细结构更明显 C.位移D.分裂3.在紫外-可见分光光度法中,某有色物质在某浓度下测得其透光率为T;若浓度增大1倍,则透光率为()A.T/2 B.T2 C.T1/2 D.2T 4.用分光光度计测量有色化合物的浓度,相对标准偏差最小时的吸光度为()A.0.334 B.0.343 C.0.434 D.0.4435.下列表达正确的是()A.吸收光谱曲线表明吸光物质的吸光度随波长的变化而变化B.吸收光谱曲线以波长为纵坐标、吸光度为横坐标C.吸收光谱曲线中,最大吸收处的波长不一定为最大吸收波长D.吸收光谱曲线不能表明吸光物质的光吸收特性6.在紫外分光光度法中,参比溶液的选择原则是()A.通常选用蒸馏水B.根据加入试剂和被测试液的颜色、性质来选择C.通常选用试剂溶液D.通常选用褪色溶液7.下列四种化合物中,在紫外区出现两个吸收带的是()A.乙醛 B.乙烯C.1, 5-己二烯 D.2-丁烯醛8.助色团能使谱带()A.波长变短 B.波长变长C.波长不变 D.蓝移9.不能用作紫外-可见分光光度法的定性参数是()A.吸光度 B.最大吸收波长C.吸收光谱的形状 D.吸收峰的数目10.以下四种化合物,能同时产生B吸收带、K 吸收带和R吸收带的是()A. B.C. D.11.紫外可见分光光度法测定中,使用参比溶液的作用是()A. 消除试剂等非测定物质的影响B. 吸收入射光中测定所需要的光波C. 调节入射光的光强度D. 调节仪器透光率的零点12. 扫描K2Cr2O7硫酸溶液的紫外-可见吸收光谱时,一般选作参比溶液的是()A. 蒸馏水B. H2SO4溶液C. K2Cr2O7的水溶液D. K2Cr2O7的硫酸溶液13.在比色法中,显色反应的显色剂选择原则错误的是()A. 显色反应产物的e值愈大愈好B. 显色剂的e值愈大愈好C. 显色剂的e值愈小愈好D. 显色反应产物和显色剂,在同一光波下的e 值相差愈大愈好14.某分析工作者,在光度法测定前用参比溶液调节仪器时,只调至透光率为95.0%,测得某有色溶液的透光率为35.2%,此时溶液的真正透光率为()A. 40.2%B. 37.1%C. 35.1%D. 30.2%15. 下列化合物中,不适合作为紫外分光光度法测定用的溶剂是()A.水 B.苯 C.乙腈 D.甲醇二、简答题1.电子跃迁的类型有哪几种?2.具有何种结构的化合物能产生紫外吸收光谱?3.为什么邻二氮杂菲分光光度法测定微量铁时要加入盐酸羟胺溶液?4.在没有干扰的条件下,紫外分光光度法为什么总是选择在λmax处进行吸光度的测量?5.举例说明紫外分光光度法如何检查物质纯度。
仪器分析试题及答案(完整版)
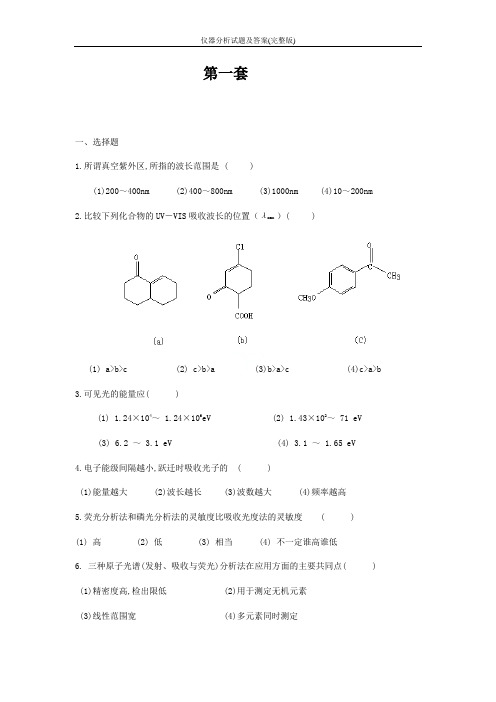
第一套一、选择题1.所谓真空紫外区,所指的波长范围是 ( )(1)200~400nm (2)400~800nm (3)1000nm (4)10~200nm2.比较下列化合物的UV-VIS吸收波长的位置(λmax )( )(1) a>b>c (2) c>b>a (3)b>a>c (4)c>a>b 3.可见光的能量应( )(1) 1.24×104~ 1.24×106eV (2) 1.43×102~ 71 eV(3) 6.2 ~ 3.1 eV (4) 3.1 ~ 1.65 eV4.电子能级间隔越小,跃迁时吸收光子的 ( )(1)能量越大 (2)波长越长 (3)波数越大 (4)频率越高5.荧光分析法和磷光分析法的灵敏度比吸收光度法的灵敏度 ( )(1) 高 (2) 低 (3) 相当 (4) 不一定谁高谁低6. 三种原子光谱(发射、吸收与荧光)分析法在应用方面的主要共同点( ) (1)精密度高,检出限低 (2)用于测定无机元素(3)线性范围宽 (4)多元素同时测定7.当弹簧的力常数增加一倍时,其振动频率 ( )(1) 增加倍 (2) 减少倍 (3) 增加0.41倍 (4) 增加1倍8. 请回答下列化合物中哪个吸收峰的频率最高? ( )9.下列化合物的1HNMR谱, 各组峰全是单峰的是 ( )(1) CH3-OOC-CH2CH3 (2) (CH3)2CH-O-CH(CH3)2(3) CH3-OOC-CH2-COO-CH3 (4) CH3CH2-OOC-CH2CH2-COO-CH2CH310. 某化合物的相对分子质量M r=72,红外光谱指出,该化合物含羰基,则该化合物可能的分子式为 ( )(1) C4H8O (2) C3H4O2 (3) C3H6NO (4) (1)或(2)11.物质的紫外-可见吸收光谱的产生是由于 ( )(1) 分子的振动 (2) 分子的转动(3) 原子核外层电子的跃迁 (4) 原子核内层电子的跃迁12. 磁各向异性效应是通过下列哪一个因素起作用的( )(1) 空间感应磁场 (2) 成键电子的传递 (3) 自旋偶合 (4) 氢键13.外磁场强度增大时,质子从低能级跃迁至高能级所需的能量 ( )(1) 变大 (2) 变小 (3) 逐渐变小 (4) 不变化14. 某化合物在一个具有固定狭峰位置和恒定磁场强度B的质谱仪中分析, 当加速电压V慢慢地增加时, 则首先通过狭峰的是: ( )(1) 质量最小的正离子 (2) 质量最大的负离子(3) 质荷比最低的正离子(4) 质荷比最高的正离子15.某化合物Cl-CH2-CH2-CH2-Cl的1HNMR谱图上为 ( )(1) 1个单峰 (2) 3个单峰(3) 2组峰: 1个为单峰, 1个为二重峰 (4) 2组峰: 1个为三重峰, 1个为五重峰二、填空题1. 核磁共振的化学位移是由于 _______________________________________ 而造成的,化学位移值是以 _________________________________为相对标准制定出来的。
(完整版)仪器分析习题及答案

光谱概论习题一、单项选择题1.下列表达式表述关系正确的是()。
A.B.C.D.2.下述哪种性质可以说明电磁辐射的微粒性()。
A.波长B.频率C.波数D.能量3.光量子的能量正比于辐射的()A.频率和波长B.波长和波数C.频率和波数D.频率、波长和波数4.下面四个电磁波谱区中波长最短的是()A.X射线B.红外光区C.紫外和可见光区D.无线电波5.下列四种电磁辐射中能量最小的是()。
A.微波B.X射线C.无线电波D.g 射线二、简答题1.简述下列术语的含义:(1)电磁波谱(2)发射光谱(3)吸收光谱(4)荧光光谱2.请按照波长和能量递减的顺序排列下列常见的电磁辐射区:紫外光、红外光、可见光、X 射线、无线电波。
3.常见的光学分析法有哪些类型?光谱概论习题答案A 2.D 3.C 4.A 5.C紫外-可见分光光度法习题一、单项选择题1.分子的紫外-可见吸收光谱呈带状光谱,其原因是()A.分子中价电子运动的离域性质B.分子中价电子能级的相互作用C.分子振动能级的跃迁伴随着转动能级的跃迁D.分子中电子能级的跃迁伴随着振动、转动能级的跃迁2.在紫外-可见分光光度分析中,极性溶剂会使被测物的吸收峰()A.消失B.精细结构更明显C.位移D.分裂3.在紫外-可见分光光度法中,某有色物质在某浓度下测得其透光率为T;若浓度增大1倍,则透光率为()A.T/2 B.T2 C.T1/2 D.2T4.用分光光度计测量有色化合物的浓度,相对标准偏差最小时的吸光度为()A.0.334 B.0.343 C.0.434 D.0.4435.下列表达正确的是()A.吸收光谱曲线表明吸光物质的吸光度随波长的变化而变化B.吸收光谱曲线以波长为纵坐标、吸光度为横坐标C.吸收光谱曲线中,最大吸收处的波长不一定为最大吸收波长D.吸收光谱曲线不能表明吸光物质的光吸收特性6.在紫外分光光度法中,参比溶液的选择原则是()A.通常选用蒸馏水B.根据加入试剂和被测试液的颜色、性质来选择C.通常选用试剂溶液D.通常选用褪色溶液7.下列四种化合物中,在紫外区出现两个吸收带的是()A.乙醛B.乙烯C.1, 5-己二烯D.2-丁烯醛8.助色团能使谱带()A.波长变短B.波长变长C.波长不变D.蓝移9.不能用作紫外-可见分光光度法的定性参数是()A.吸光度B.最大吸收波长C.吸收光谱的形状D.吸收峰的数目10.以下四种化合物,能同时产生B吸收带、K吸收带和R吸收带的是()A.B.C.D.11.紫外可见分光光度法测定中,使用参比溶液的作用是()A. 消除试剂等非测定物质的影响B. 吸收入射光中测定所需要的光波C. 调节入射光的光强度D. 调节仪器透光率的零点12. 扫描K2Cr2O7硫酸溶液的紫外-可见吸收光谱时,一般选作参比溶液的是()A. 蒸馏水B. H2SO4溶液C. K2Cr2O7的水溶液D. K2Cr2O7的硫酸溶液13.在比色法中,显色反应的显色剂选择原则错误的是()A. 显色反应产物的e值愈大愈好B. 显色剂的e值愈大愈好C. 显色剂的e值愈小愈好D. 显色反应产物和显色剂,在同一光波下的e值相差愈大愈好14.某分析工作者,在光度法测定前用参比溶液调节仪器时,只调至透光率为95.0%,测得某有色溶液的透光率为35.2%,此时溶液的真正透光率为()A. 40.2%B. 37.1%C. 35.1%D. 30.2%15. 下列化合物中,不适合作为紫外分光光度法测定用的溶剂是()A.水B.苯C.乙腈D.甲醇二、简答题1.电子跃迁的类型有哪几种?2.具有何种结构的化合物能产生紫外吸收光谱?3.为什么邻二氮杂菲分光光度法测定微量铁时要加入盐酸羟胺溶液?4.在没有干扰的条件下,紫外分光光度法为什么总是选择在λmax处进行吸光度的测量?5.举例说明紫外分光光度法如何检查物质纯度。
仪器分析考试题及答案

仪器分析考试题及答案一、选择题(每题2分,共20分)1. 原子吸收光谱法中,用于测定元素的基态原子的发射线是()。
A. 共振线B. 非共振线C. 吸收线D. 散射线答案:A2. 质谱仪中,用于将样品分子离子化的方法不包括()。
A. 电子轰击B. 化学电离C. 热解吸D. 电喷雾答案:C3. 高效液相色谱法中,流动相的组成对分离效果的影响主要体现在()。
A. 溶剂强度B. 溶剂极性C. 溶剂粘度D. 溶剂的pH值答案:B4. 红外光谱法中,用于测定分子中特定化学键振动频率的仪器是()。
A. 紫外-可见光谱仪B. 核磁共振仪C. 红外光谱仪D. 质谱仪答案:C5. 核磁共振波谱法中,化学位移的单位是()。
A. HzB. ppmC. TD. G答案:B6. 气相色谱法中,用于固定相的物质不包括()。
A. 硅胶B. 活性炭C. 聚四氟乙烯D. 石英答案:D7. 电化学分析法中,用于测量溶液中离子活度的电极是()。
A. 参比电极B. 指示电极C. 工作电极D. 辅助电极答案:B8. 紫外-可见光谱法中,用于测定溶液中物质浓度的方法是()。
A. 吸光度法B. 荧光法C. 磷光法D. 散射法答案:A9. 原子荧光光谱法中,用于激发原子荧光的光源是()。
A. 氘灯B. 空心阴极灯C. 氩离子激光器D. 氙灯答案:B10. 毛细管电泳法中,用于分离样品的机制不包括()。
A. 电泳B. 色谱C. 扩散D. 电渗答案:B二、填空题(每题2分,共20分)11. 在原子吸收光谱法中,火焰原子化器的温度通常在______℃左右。
答案:230012. 质谱仪中,用于分析生物大分子的质谱技术是______。
答案:MALDI-TOF13. 高效液相色谱法中,反相色谱的固定相通常是______。
答案:非极性14. 红外光谱法中,用于测定分子中特定化学键振动频率的区域是______。
答案:中红外区15. 核磁共振波谱法中,氢核的自旋量子数为______。
仪器分析考试题及答案

仪器分析考试题及答案一、选择题1. 在高效液相色谱法(HPLC)中,用于分离化合物的主要是哪种机制?A. 吸附B. 分子筛选C. 离子交换D. 亲和力答案:B. 分子筛选2. 原子吸收光谱法(AAS)中,光源的作用是什么?A. 激发样品中的原子B. 测量样品的重量C. 测量样品的体积D. 测量样品的温度答案:A. 激发样品中的原子3. 核磁共振波谱法(NMR)中,化学位移的单位是什么?A. 赫兹(Hz)B. 波数(cm^-1)C. 特斯拉(T)D. 皮特斯拉(pT)答案:B. 波数(cm^-1)4. 红外光谱法(IR)主要用于分析样品中的哪种信息?A. 原子的能级跃迁B. 分子的振动模式C. 化合物的紫外吸收D. 放射性同位素的衰变答案:B. 分子的振动模式5. 质谱分析中,MS/MS指的是什么?A. 质谱与质谱的串联B. 质谱与色谱的联用C. 质谱仪器的操作模式D. 质谱分析的数据处理方法答案:A. 质谱与质谱的串联二、填空题1. 在气相色谱法(GC)中,固定相通常是涂覆在__________上的液体或固体,用于分离不同的化合物。
答案:载气管道2. 紫外-可见光谱法(UV-Vis)中,比尔-朗伯定律描述了溶液的吸光度与溶液中__________的浓度成正比。
答案:吸收剂3. 电感耦合等离子体质谱法(ICP-MS)中,样品被转化为等离子体状态,这种等离子体具有极高的温度,可达__________。
答案:7000K至10000K4. X射线衍射(XRD)分析可以用来确定晶体的__________,进而了解材料的结构。
答案:晶格参数5. 拉曼光谱是一种非破坏性的分析技术,它可以用来检测样品中的__________振动。
答案:分子指纹三、简答题1. 请简述高效液相色谱法(HPLC)的工作原理及其在分析化学中的应用。
答:高效液相色谱法(HPLC)是一种用于分离、鉴定和定量混合物中各组分的色谱技术。
它通过将样品溶液注入色谱柱,并利用高压泵推动流动相(溶剂)通过柱子。
仪器分析试题及答案

仪器分析试题及答案一、选择题(每题2分,共20分)1. 以下哪种分析方法属于光谱分析?A. 质谱分析B. 色谱分析C. 核磁共振分析D. 红外光谱分析答案:D2. 质谱仪中,用于将样品分子离子化的部分是:A. 离子源B. 质量分析器C. 检测器D. 真空系统答案:A3. 在气相色谱中,分离混合物的固定相是:A. 流动相B. 柱子C. 检测器D. 样品答案:B4. 原子吸收光谱分析中,样品原子化的方法不包括:A. 火焰原子化B. 石墨炉原子化C. 化学发光D. 氢化物发生答案:C5. 紫外-可见光谱分析中,用于测定物质的:A. 质量B. 浓度C. 熔点D. 沸点答案:B6. 以下哪种分析方法可以测定样品的分子量?A. 红外光谱B. 核磁共振C. 质谱D. 紫外-可见光谱答案:C7. 液相色谱中,常用的检测器不包括:A. 紫外检测器B. 荧光检测器C. 质谱检测器D. 热重分析检测器答案:D8. 核磁共振氢谱中,化学位移的单位是:A. 波数B. 赫兹C. 皮米D. 兆赫答案:D9. 质谱分析中,用于确定分子离子峰的是:A. 同位素峰B. 碎片离子峰C. 分子离子峰D. 亚稳态离子峰答案:C10. 以下哪种仪器分析方法可以提供样品的三维结构信息?A. 红外光谱B. 质谱C. 核磁共振D. 紫外-可见光谱答案:C二、填空题(每题2分,共20分)1. 在气相色谱中,样品的气化温度应该高于样品的______温度。
答案:沸点2. 液相色谱中,流动相的组成和______对分离效果有重要影响。
答案:流速3. 原子吸收光谱仪中,火焰的类型包括空气-乙炔火焰、______火焰等。
答案:氧化亚氮-乙炔4. 在紫外-可见光谱分析中,______是影响光谱吸收的主要因素。
答案:电子跃迁5. 质谱仪中,电子轰击离子源的电子能量通常为______电子伏特。
答案:706. 核磁共振氢谱中,化学位移的参考物质通常为______。
答案:四甲基硅烷7. 液相色谱中,柱效的高低主要取决于______的粒径。
仪器分析习题及答案

仪器分析习题及答案一、单选题(共40题,每题1分,共40分)1、紫外光谱分析中所用比色皿是OA、玻璃材料的B、陶瓷材料的C、萤石材料的D、石英材料的正确答案:D2、可见-紫外分光度法的适合检测波长范围是()。
A、 200-760nmB、 400~760nmC^ 200-IOOOnmD、 200-400nm正确答案:A3、在原子吸收分析中,当溶液的提升速度较低时•,一般在溶液中混入表面张力小、密度小的有机溶剂,其目的是OA、增加溶液粘度B、提高雾化效率C、使火焰容易燃烧D、增加溶液提升量正确答案:B4、气相色谱仪除了载气系统、柱分离系统、进样系统外,其另外一个主要系统是()。
A、记录系统B、恒温系统C、样品制备系统D、检测系统正确答案:D5、原子吸收分光光度计调节燃烧器高度目的是为了得到()。
A、入射光强最大B、透光度最小C、吸光度最小D、火焰温度最高正确答案:B6、在液相色谱法中,提高柱效最有效的途径是()。
A、降低流动相流速B、降低板高C、提高柱温D、减小填料粒度正确答案:D7、严禁将O同氧气瓶同车运送。
A、氢气瓶、乙快瓶B、氮气瓶、氢气瓶C、氮气瓶、乙焕瓶D、二氧化碳、乙烘瓶正确答案:A8、在相同条件下测定甲、乙两份同一有色物质溶液吸光度。
若甲液用ICin 吸收池,乙液用2cm吸收池进行测定,结果吸光度相同,甲、乙两溶液浓度的关系是()。
A、C甲二C乙B、C乙二2C甲C、C乙二4C甲D、C甲二2C乙正确答案:D9、原子吸收光谱法是基于从光源辐射出O的特征谱线,通过样品蒸气时,被蒸气中待测元素的基态原子所吸收,由辐射特征谱线减弱的程度, 求出样品中待测元素含量。
A、待测元素的基态原子B、待测元素的分子C、待测元素的电子D、待测元素的离子正确答案:A10、对大多数元素,日常分析的工作电流建议采用额定电流的()。
A、 50〜60%B、30—40%C、40-50%D、 40〜60%正确答案:D11、pH=2.0,其有效数字为OoA、2位B、3位C、1位D、4位正确答案:C12、高效液相色谱流动相脱气稍差造成()。
仪器分析习题(附答案)

1.仪器分析法的主要特点是(D )A.分析速度快但重现性低,样品用量少但选择性不高B.灵敏度高但重现性低,选择性高但样品用量大C.分析速度快,灵敏度高,重现性好,样品用量少,准确度高D.分析速度快,灵敏度高,重现性好,样品用量少,选择性高2.仪器分析法的主要不足是(B )A.样品用量大B.相对误差大C.选择性差D.重现性低3.下列方法不属于光分析法的是(D )A.原子吸收分析法B.原子发射分析法C.核磁共振分析法D.质谱分析法4.不属于电分析法的是( D)A.伏安分析法B.电位分析法C.永停滴定法D.毛细管电泳分析法5.Ag-AgCl参比电极的电极电位取决于电极内部溶液中的(B )。
A. Ag+活度B. C1-活度C. AgCl活度D.Ag+和C1-活度之和6.玻璃电极使用前,需要(C )。
A.在酸性溶液中浸泡1 hB.在碱性溶液中浸泡1 hC.在水溶液中浸泡24 hD.测量的pH不同,浸泡溶液不同7.根据氟离子选择电极的膜电位和内参比电极来分析,其电极的内充液中一定含有(A )。
A.一定浓度的F-和Cl-B.一定浓度的H+C.一定浓度的F-和H+D.一定浓度的Cl-和H+8.测量pH时,需要用标准pH溶液定位,这是为了(D )。
A.避免产生酸差B.避免产生碱差C.消除温度的影响D.消除不对称电位和液接电位的影响9.玻璃电极不包括(C )。
A. Ag-AgCl内参比电极B.一定浓度的HCl溶液C.饱和KCl溶液D.玻璃膜10.测量溶液pH通常所使用的两支电极为(A )。
A.玻璃电极和饱和甘汞电极B.玻璃电极和Ag-AgCl电极C.玻璃电极和标准甘汞电极D.饱和甘汞电极和Ag-AgCl电极11.液接电位的产生是由于(B )。
A.两种溶液接触前带有电荷B.两种溶液中离子扩散速度不同所产生的C.电极电位对溶液作用的结果D.溶液表面张力不同所致12.离子选择性电极多用于测定低价离子,这是由于(A )。
A.高价离子测定带来的测定误差较大B.低价离子选择性电极容易制造C.目前不能生产高价离子选择性电极D.低价离子选择性电极的选择性好13.电位滴定中,通常采用(C )方法来确定滴定终点体积。
(完整版)仪器分析习题参考答案

仪器分析习题作业第一章绪论需要特殊的仪器设备;仪器分精心整理析需要特殊的仪器设备;(3)化学分析只(4)化学分析灵精心整理敏度低、选择性差,但测量准确度高,适合于常量组分分析;超痕量组精心整理分的分析。
2、共同点:都是进行组分测量分析是利用仪器设备进行组分分精心整理析的一种技术手段。
分析仪器与仪器分析的联系:质的各种物理信号而不是其浓精心整理度或质量数,而信号与浓度或质信号与浓度或质量数之间的关精心整理系,即进行定量分析校正。
括激发到高能态;单色器:精心整理将复合光分解为单色光并采集特定波长的光入射样品或检测精心整理精心整理精心整理精心整理精心整理精心整理精心整理透镜、单色元件、聚焦透镜、精心整理出射狭缝。
各部件的主要作用为:入射狭的具有相同波长的光在单色器精心整理的出口曲面上成像;出射狭缝:采集色散后具有特定波长的光入射样品或检测器2-7光栅宽度5.0mm,每毫米刻线数720条,该光栅第一级光谱分辨率多少?因为对于一级光谱(n=1)而言,光栅的分辨率为:R = nN = N=光栅宽度×光栅的刻痕密度= 720×5 = 3600 又因为:R =精心整理所以,中心波长(即平均波长)在1000cm-1 的两条谱线要被该光栅分开,它们相隔的最大距离为:dλ===0.28cm-1第3 章原子发射光谱法3-2缓冲剂与挥发剂在矿石定量分析中的作用?缓冲剂的作用是抵偿样品组成变化的影响,即消除第三元素精心整理的影响,控制和稳定弧温;挥发剂的作用是增加样品中难号与内标物的信号比与待测物精心整理的浓度或质量之间的关系来进行定量分析的方法称为内标3-8简述三种用于ICP炬的式样引入方式?精心整理因为试样只能被载气带入ICP 光源中,而不能直接引入花熔融进样,对于特定元素还精心整理可以采用氢化物发生法进样。
其中,以气动雾化方式最为常不同轨道的状态。
精心整理(3)系间跨越:不同多重态能级之间的非辐射跃迁过程。
仪器分析各章习题与答案

仪器分析各章习题与答案Document serial number【UU89WT-UU98YT-UU8CB-UUUT-UUT108】第一章绪论问答题1. 简述仪器分析法的特点。
第二章色谱分析法1.塔板理论的要点与不足是什么2.速率理论的要点是什么3.利用保留值定性的依据是什么4.利用相对保留值定性有什么优点5.色谱图上的色谱流出曲线可说明什么问题6.什么叫死时间用什么样的样品测定.7.在色谱流出曲线上,两峰间距离决定于相应两组分在两相间的分配系数还是扩散速率为什么8.某一色谱柱从理论上计算得到的理论塔板数n很大,塔板高度H很小,但实际上柱效并不高,试分析原因。
9.某人制备了一根填充柱,用组分A和B为测试样品,测得该柱理论塔板数为4500,因而推断A和B在该柱上一定能得到很好的分离,该人推断正确吗简要说明理由。
10.色谱分析中常用的定量分析方法有哪几种当样品中各组分不能全部出峰或在组分中只需要定量其中几个组分时可选用哪种方法11.气相色谱仪一般由哪几部分组成各部件的主要作用是什么12.气相色谱仪的气路结构分为几种双柱双气路有何作用13.为什么载气需要净化如何净化14.简述热导检测器的基本原理。
15.简述氢火焰离子化检测器的基本结构和工作原理。
16.影响热导检测器灵敏度的主要因素有哪些分别是如何影响的17.为什么常用气固色谱分离永久性气体18.对气相色谱的载体有哪些要求19.试比较红色载体和白色载体的特点。
20.对气相色谱的固定液有哪些要求21.固定液按极性大小如何分类22.如何选择固定液23.什么叫聚合物固定相有何优点24.柱温对分离有何影响柱温的选择原则是什么25.根据样品的沸点如何选择柱温、固定液用量和载体的种类26.毛细管色谱柱与填充柱相比有何特点27.为什么毛细管色谱系统要采用分流进样和尾吹装置28.在下列情况下色谱峰形将会怎样变化(1)进样速度慢;(2)由于汽化室温度低,样品不能瞬间汽化;(3)增加柱温;(4)增大载气流速;(5)增加柱长;(6)固定相颗粒变粗。
仪器分析习题(附答案)

仪器分析习题(附答案)1. 仪器分析法的主要特点是(D )A. 分析速度快但重现性低,样品用量少但选择性不高B. 灵敏度高但重现性低,选择性高但样品用量大C. 分析速度快,灵敏度高,重现性好,样品用量少,准确度高D. 分析速度快,灵敏度高,重现性好,样品用量少,选择性高2. 仪器分析法的主要不足是(B )A. 样品用量大B. 相对误差大C. 选择性差D.重现性低3. 下列方法不属于光分析法的是( D )A. 原子吸收分析法B. 原子发射分析法C. 核磁共振分析法D. 质谱分析法4. 不属于电分析法的是( D )A. 伏安分析法B. 电位分析法C. 永停滴定法D. 毛细管电泳分析法5. Ag-AgCl参比电极的电极电位取决于电极内部溶液中的( B )。
A. Ag+活度B. C1-活度C. AgCl活度D.Ag+和C1-活度之和6. 玻璃电极使用前,需要( C )。
A. 在酸性溶液中浸泡1 hB. 在碱性溶液中浸泡1 hC. 在水溶液中浸泡24 hD. 测量的pH不同,浸泡溶液不同7. 根据氟离子选择电极的膜电位和内参比电极来分析,其电极的内充液中一定含有( A )。
A. 一定浓度的F-和Cl-B. 一定浓度的H+C. 一定浓度的F-和H+D. 一定浓度的Cl-和H+8. 测量pH时,需要用标准pH溶液定位,这是为了( D )。
A. 避免产生酸差B. 避免产生碱差C. 消除温度的影响D. 消除不对称电位和液接电位的影响9. 玻璃电极不包括( C )。
A. Ag-AgCl内参比电极B. 一定浓度的HCl溶液C. 饱和KCl溶液D. 玻璃膜10. 测量溶液pH通常所使用的两支电极为( A )。
A. 玻璃电极和饱和甘汞电极B. 玻璃电极和Ag-AgCl电极C. 玻璃电极和标准甘汞电极D. 饱和甘汞电极和Ag-AgCl电极11. 液接电位的产生是由于( B )。
A. 两种溶液接触前带有电荷B. 两种溶液中离子扩散速度不同所产生的C. 电极电位对溶液作用的结果D. 溶液表面张力不同所致12. 离子选择性电极多用于测定低价离子,这是由于( A )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.就是否能用普通电位计或伏特计测量参比电极与pH玻璃电极所组成电池的电动势?简述原因。
答:不能。
因为玻璃电极的内阻(50MΩ~500MΩ)很高,若采用普通电位计或伏特计测量其电位,会引起较大的测量误差。
用普通电位计或伏特计测量玻璃电极所组成电池的电动势时,若检流计的灵敏度为10-9A(测量中有10-9A电流通过),玻璃电极的内阻108Ω,当这微小电流流经电极时,由于电压降所引起的电动势测量误差可达:△E=IV=10-9×108=0、1V,它相当于1、7个pH单位的误差。
因此不能用普通电位计或伏特计测量参比电极与pH玻璃电极所组成电池的电动势。
2.已知=0、10,若试样溶液中F-浓度为1、0×10-2mol/L时,允许测定误差为5%,问溶液允许的最大pH(以浓度代替活度计算)为多少?解:离子电极选择性误差用下式表示与计算:即:-离子选择电极插入50、00ml某高氯酸盐待测溶液,与饱与甘汞电极(为3.将一支ClO4负极)组成电池。
25℃时测得电动势为358、7mV,加入1、00ml NaClO标准溶液(0、4-浓度。
0500mol/L)后,电动势变成346、1mV。
求待测溶液中ClO4解:-为阴离子,但该离子选择电极为电池的正极,因此S为负值。
注意:此题中虽然ClO44、用离子选择电极校正曲线法进行定量分析有什么优点?需注意什么问题?使用TISAB有何作用?答:离子选择电极校正曲线法进行定量分析的优点就是适用于大批量的样品分析。
定量分析中应注意实验条件的一致,特别就是待测液与标准溶液系列的离子强度须保持一致。
使用TISAB的作用为: ①保持待测液与标准溶液系列的总离子强度及活度系数恒定;② 维持溶液在适宜的pH范围内,满足离子电极的要求;③掩蔽干扰离子。
5、某pH值的标度每改变一个pH单位,相当于电位的改变为60mV,用响应斜率为53mV/pH的玻璃电极来测定pH为5、00的溶液,分别用pH2、00及pH4、00的标准缓冲溶液来标定,测定结果的绝对误差各为多少?由此,可得出什么结论?解:用pH2、00标准缓冲溶液标定时:ΔE =53×(5、00-2、00)=159(mV)实际测到的pH为: 2、00+2、65=4、65pH第8章 电位法与永停滴定法 绝对误差=4、65-5、00=-0、35pH用pH=4、00的标准缓冲溶液标定时:ΔE =53×(5、00-4、00)=53(mV)实际测到的pH 为:4、00+0、88=4、88, 绝对误=4、88-5、00=-0、12结论:①绝对误差的大小与选用标定溶液的pH 有关; ②应选用与待测试液pH 相近的标准缓冲溶液标定,以减小测量误差。
最佳分辨率:1024*768第10章紫外1.钯(Pd)与硫代米蚩酮反应生成1:4的有色配位化合物,用1、00cm 吸收池在520nm 处测得浓度为0、200×10-6g/ml 的Pd 溶液的吸光度值为0、390,试求钯-硫代米蚩酮配合物的及ε值。
(钯-硫代米蚩酮配合物的分子量为106、4)解:2.取咖啡酸,在105°C干燥至恒重,精密称取10、00mg,加少量乙醇溶解,转移至200ml量瓶中,加水至刻度,取出5、00ml,置于50ml量瓶中,加6mol/L HCl 4ml,加水至刻度。
取此溶液于1cm石英吸收池中,在323nm 处测得吸光度为0、463,已知咖啡酸=927、9 ,求咖啡酸的百分质量分数。
解:3.分别用0、5mol/L HCl 、0、5mol/L NaOH与pH4、00的邻苯二甲酸氢钾缓冲液配制某弱酸溶液,浓度均为含该弱酸0、001g/100ml。
在lmax=590nm处分别测出三者吸光度如下表。
求该弱酸的pKa值。
解一:在pH=4的缓冲溶液中,[HIn]与[In-]共存,则该弱酸在各溶液的分析浓度为C HIn+C In-,即0、001g/100ml。
因此在缓冲溶液中就是两种型体混合物的吸收: A混=0、430=E HIn C HIn+E In-C In- (1)在碱性溶液中就是In-的吸收:A In-=1、024=E In-(C HIn+C In-) (2)在酸性溶液中就是HIn的吸收:A HIn=0、002=E HIn(C HIn+C In-) (3)(2),(3)式代入(1)得:C HIn/C In-=1、3879pKa=4+lg1、3879=4、14解二:由(2)、(3)式代入(1)式还可写成: (4)将代入(4),整理,取对数,得:式中A混为该弱酸在缓冲液中的吸光度;A HIn为该弱酸在酸性溶液中的吸光度;A In-为该弱酸在碱性溶液中的吸光度;pH为缓冲溶液的pH 值。
把数据代入上式得:此外,还可用酸、碱溶液中的A值分别求出HIn与In-的E值,再求在pH=4的缓冲溶液中两型体的浓度,即可求出pKa。
4.配合物MR2的吸收峰在480nm处。
当配位剂五倍以上过量时,吸光度只与金属离子的总浓度有关且遵循比尔定律。
金属离子与配位剂在480nm处无吸收。
今有一含M2+0、000230mol/L,含R 0、00860mol/L的溶液,在480nm处用1cm比色皿测得它的吸光度为0、690。
另有一含M2+0、000230mol/L,含R 0、000500mol/L的溶液,在同样条件下测得吸光度为0、540。
试计算配合物的稳定常数。
解:在配位剂过量5倍以上时,金属离子几乎全部以MR2存在,因此: 在R为0、000500mol/L的溶液中:最佳分辨率:1024*768第13章原子吸收分光光度法7.用原子吸收分光光度法测定自来水中镁的含量。
取一系列镁对照品溶液(1μg/ml)及自来水样于50ml量瓶中,分别加入5%锶盐溶液2ml后,用蒸馏水稀释至刻度。
然后与蒸馏水交替喷雾测定其吸光度。
其数据如下所示,计算自来水中镁的含量(mg/L)。
解:由测量数据计算得回归方程:A=0、045+0、0473c,当A=0、135时,20ml自来水中Mg的含量代入上式计算得:1、903μg,故每升自来水含Mg量为:第16章色谱分析法例16-1 在1m长的填充柱上,某化合物A及其异构体B的保留时间分别为5、80min与6、60min;峰宽分别为0、78min与0、82min,死时间为1、10min。
计算:(1)调整保留时间t R(A)'及t R(B)';(2) 保留因子k A及k B;(3)用组分A计算色谱柱的有效理论塔板数n ef及有效塔板高度H ef。
解:(1)t R(A)'=t R(A)-t0=5、80-1、10=4、70(min)t R(B)'=t R(B)-t0=6、60-1、10=5、50(min)(2)k A=t R(A)'/t0=4、70/1、10=4、27k B=t R(B)'/t0=5、50/1、10=5(3)n ef(A)=16(t R(A)'/W)2=16×(4、70/0、78)2=581H ef(A)=L/n ef(A)=1000/581=1、72(mm)例16-2 在一根3m长的色谱柱上,分离某样品的结果如下:组分1的保留时间为14min,半峰宽为0、41min;组分2的保留时间为17min,半峰宽为0、5min,死时间为1min。
(1)求分配系数比α;(2)求组分1与组分2的相对保留值r2,1与分离度;(3)若柱长变为2m,两组分的分离度变为多少?解:(1)k2=t R2'/t0=17-1/1=16,k1=t R1'/t0=14-1/1=13,;(2)r2,1=t R2'/t R1'=16/13=1、2;(3)从式中可知R与成正比,在塔板高度不变的条件下n又与柱长L成正比,所以,R与成正比,。
例16-3 柱相比(β=V m/V s)为20,理论塔板高度为0、6mm,已知两组分在柱温下的分配系数分别为45、2,50、5。
若使R=1、0,所需的柱长就是多少?解:根据,其中R已知,α与k2可通过已知条件求出,,从而求出L。
①;②;③,代入数据,,L=2、35(m)例16-4 在GC非极性柱上测得一系列化合物的调整保留时间如下。
计算甲苯与环已烷的保留指数,说明选择哪两个正构烷烃作为参比物质,为什么?解:甲苯的保留时间在正庚烷与正辛烷之间,选这两者作为参比物质,可以减小计算误差:;同理,选正己烷与正庚烷作为参比物质计算环己烷的保留指数:。
最佳分辨率:1024*76817章气相色谱法1.化合物A在某色谱柱上的保留时间为350s,半峰宽0、25cm,记录仪纸速2cm/min,计算该柱的理论塔板数。
解:该题就是测验对塔板理论的理解与应用,计算时要注意保留时间与色谱峰区域宽度的单位应一致。
2.在GC中,改变下列一个色谱条件,其余色谱条件均不变,问:色谱峰形会发生怎样变化?并说明理由柱长增加一倍;(2)载气流速增加;(3)载气摩尔质量减少,并在低流速区工作;(4)采用粘度较小的固定液。
解:该题就是考察对塔板理论与速率理论的理解与灵活运用能力。
(1)柱长增加一倍,H不变。
L为2L,则n变为2n,t R为2t R,且由n=16(t R/W)2知W为W(2)载气流速增加,在柱中展宽时间少,t R变小,W变窄。
u增加,一般会增加H,而n变小,W变宽,此因素较其次。
(3)在低流速区,以B/u为主,B =2γDm,载气摩尔质量减小,Dm↑,B↑,H↑,n↓,W↑,所以在低流速区,载气摩尔质量减小,色谱峰变宽。
(4)范氏方程中,,固定液h↓,Dl↑,C↓,H↓,n↑,W↓,采用粘度较小的固定液可使峰宽变窄。
3.用一根色谱柱将分离组分A、B,A峰与B峰保留时间分别为320s与350s,死时间为25s,若两峰峰宽相等,要使两峰完全分离则色谱柱至少为多少?(假设理论塔板高度0、11mm)解:该题的目的就是通过计算,达到掌握塔板理论、分离度的目的。
在两峰宽相等的情况下,已经导出,完全分离时R=1、5,α虽未直接给出,但可通过两组分的调整保留时间计算:。
(cm)4.用一色谱柱分离A、B两组分,此柱的理论塔板数为4200,测得A、B的保留时间分别为15、05min及14、82min,(1)求分离度;(2)若分离度为1、0时,理论塔板数为多少?解:(1)由n=16(t R/W)2得:W A2=16×15、052/4200,W A=0、9289(min)W B2=16×14、822/4200,W B=0、9147(min)(2)由分离方程式得:,,n2=672005.某色谱柱的速率理论方程中,A、B、C三个参数分别为0、013cm,0、40cm2/s,0、0053s,试求最佳载气线速度与最小塔板高度。
