有机氟化学2
高分子材料概论-有机氟

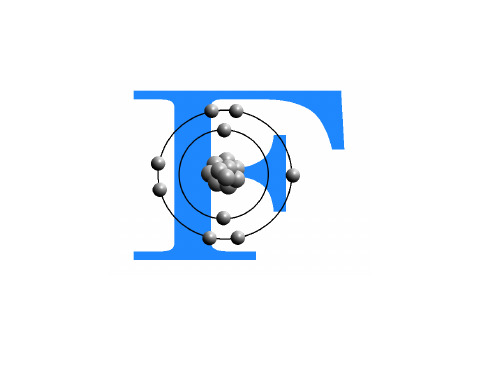
第二章:高分子材料概论2.9有机氟材料主要内容:2.9.1 有机氟材料概述2.9.2有机氟的基础原料和基本单体制备2.9.3 氟树脂2.9.4 氟橡胶2.9.5 思考题2.9.1 有机氟材料概述氟是自然界最活泼的一种非金属元素,电负性最高,为3.9,能分解水,生成臭氧和HF,黑暗中就能与氢直接化合,几乎能直接与所有金属、非金属元素化合。
含氟的化学物质一般都具有特殊性质,例如热稳定性、化学稳定性、防水、防油等,因此引发了人们的研究兴趣。
我们常说的“有机氟”或“有机氟材料”指的是含氟的高分子。
含氟高分子的主链是碳链或碳杂链,氟原子作为碳原子上的取代基而存在。
碳原子上所有的氢全被氟替代,则成为只含有C和F原子的氟碳聚合物如聚四氟乙烯,又如四氟乙烯/六氟丙烯共聚物,可称之为全氟高分子。
部分氢原子被取代或含有其它原子(如氯),一般叫含氟高分子。
对于含氟高分子材料的分类较简单,可分为:含氟聚合物的单体,都是乙烯基衍生物,合成单体的路线,通常都由HF加成或由HF制成氟氯碳烷(氟里昂、氟致冷剂)裂解而成相应的烯烃单体,聚合反应一般都是连锁聚合而获得含氟高分子。
2.9.2有机氟的基础原料和基本单体的制备一、无水HF合成合成含氟化合物的最基础原料是HF,自然界没有F2和HF天然存在,必须人工合成。
许多含氟精细化学品例如含氟的油、脂、表面活性剂,通常都要借助于F2合成,F2产生主要靠电解无水的HF获得。
所以,HF尤其是无水HF是含氟材料的最基本原料。
自然界氟的化合物主要是氟萤石(CaF2),中国占全世界已探明贮量的70%。
用于合成无水HF的CaF2要求越纯越好。
一般使用一级或特级的矿石精矿。
其生产过程是由萤石和浓硫酸高温反应获得,如下式所示,中间伴随着很多副反应。
CaF2 + H2SO4—> CaSO4 + 2HF四氟乙烯(TFE )是由二氟一氯甲烷裂解获得,因此其合成步骤分为二氟一氯甲烷的合成和二氟一氯甲烷的裂解两步: CHCl 3 + 2HF >CHClF 2 CHClF 2 >C 2F 4 + 2HCl三、三氟氯乙烯合成三氟氯乙烯(CTFE )是由三氟三氯乙烷脱氯制得,因此其合成步骤分为三氟三氯乙烷的合成和三氟三氯乙烷的脱氯两步: C 2Cl 6 + 3HF >C 2F 3Cl 3 + 3HCl C 2F 3Cl 3 >C 2F 3Cl + ZnCl 2四、全氟丙烯(六氟丙烯)合成全氟丙烯(HFP )一般采用C 2F 4或CHF 3裂解制备,通常采用C 2F 4裂解: 3 C 2F 4 >2C 3F 6SbCl 5Ni700-900o C-Cl 2 ZnSbCl 5Ni700-900o C偏氟乙烯(CH2=CF2 ;VDF)由乙炔和无水HF加成制得CHF2CH3,然后在氯气存在下热裂解而得:C2H2 + 2HF > CHF2-CH3CHF2-CH3>CH2=CF2 + 2HCl六、其他含氟单体除了上述主要的含氟单体,常见的还有氟乙烯(CHF=CH2)、全氟辛酸等。
二氟甲烷详细资料大全

二氟甲烷详细资料大全二氟甲烷,是一种卤代烃(化学式:CH2F2),简称R32。
在常温下为气体,在自身压力下为无色透明液体,易溶于油,难溶于水,是一种拥有零臭氧损耗潜势的制冷剂。
基本介绍•中文名:二氟甲烷•外文名:difluoromethane•分子量:52.02•分子式:CH2F2•CAS NO:75-10-5•化学分类:有机物•EINECS号:200-839-4基本信息,编号系统,物性数据,毒理学数据,分子结构数据,计算化学数据,性质与稳定性,贮存方法,合成工艺,用途,应急处理处置方法,安全信息,安全术语,风险术语,基本信息中文名称二氟甲烷 CAS NO. 75-10-5 中文别名 HFC-32 英文名称 difluoromethane 英文别名 R-32 分子式 CH 2F 2分子量 52.02 编号系统CAS号:75-10-5 MDL号:MFCD00039283 EINECS号:200-839-4 RTECS号:PA8537500物性数据1.性状:无色透明液化气体。
2.密度(g/mL,25℃):1.13.相对蒸汽密度(g/mL,空气=1):1.84.熔点(ºC):-136.05.沸点(ºC,常压):-51.66.气相标准热熔:42.887.折射率:1.198.Lennard-Jones参数(A):7.0609.Lennard-Jones参数(K):158.3 10.van der Waals面积: 11.van der Waals体积:21.670 12.临界压缩因子:0.243 13.偏心因子:0.276 14.临界温度(ºC):78.4 15.临界压力(kPa):5.808 16.油水(辛醇/水)分配系数的对数值:2.0217.临界密度:0.427 18.临界体积:122 19.溶解性:它不溶于水,溶於乙醇。
20.气相标准声称热(焓):-452.3 21.气相标准熵:246.7 22.气相标准生成自由能:-424.7毒理学数据1、急性毒性:大鼠吸入LC:>52pph /4H 小鼠吸入LC50:1810毫克每立方米2、生殖毒性:大鼠吸入TCLo:50000ppm/6H。
0710773-有机氟化物的性质及其应用-陆佳伟

有机氟化物独特性质及其应用近年来有机氟化学研究领域的发展非常迅猛,而含氟化合物几乎深入到我们日常生活的各个方面。
有机物中的氟元素神奇地赋予了该物质独特的性质,从而一些有机物有了氟元素的帮助下展现出了独特的化学魅力。
日常生活中有许多东西都离不开有机氟化物,以前的冰箱、灭火剂常用的氯氟烷到现在的润滑剂、液晶显示器、医用药物、农用化学药品等。
有了氟元素的帮忙,有机物的用途范围也变得更加广泛。
氟是一个特殊的元素,对于自然界生物圈而言,有机氟化物几乎完全是外来的。
各种生物过程完全不依赖于氟元素的代谢,但从另一个方面而言,现在许多的药物或农用化学品又至少含有一个氟原子,它们因此而有着特别的功能。
尽管氟是所有元素中最活泼的,但有些有机氟化物就如同惰性气体那样稳定的。
有机氟化物的独特性质:要介绍有机氟化物的性质,首先介绍最简单的有机氟化物——全氟碳烷,它是一种非极性溶剂。
一般情况下,直链烷烃是线性锯齿形构型。
相反全氟碳烷具有螺旋形构型,由于连接于碳链1,3-位的氟原子之间的电子及立体排斥,直链烷烃的碳链具有一定柔性而全氟碳烷的碳链是刚性的棒状分子结构,这一性质是由于1,3-位上两个CF2基团的排斥张力导致的。
由于全氟烷烃低的可极化性造成与其它碳氢溶剂的混合性很差,因此就产生了第三相,即相对于有机相和水相的氟相。
固体全氟碳烷的表面具有最低的表面能,聚四氟乙烯的表面能为18.5达因/厘米,这种材料的低摩擦和不粘性能被用于特夫隆不粘锅等其他一些用具。
这一性质与含氟量直接相关。
【1】低表面能的形成可以确定是由于氟原子紧密覆盖的表面所致,因此所有材料中观察到的具有最低表面能的是氟化石墨(C2F)n和(CF)n,它的表面能仅6达因/厘米【2】。
当一个全氟碳链上联结一个亲水基团时就得到一个含氟表面活性剂,它可以将水的表面张力从72达因/厘米降低到15~20达因/厘米。
而类似的碳表面活性剂仅能降低到25~35达因/厘米。
有机氟化物对环境的影响是由于全氟烷烃和氯氟烷烃特别的化学稳定性导致的,迄今为止CFC已经被逐步停止使用,它们的替代物也在被开发,目前包括如下几种:氢氟碳烷HFC,氢氯氟碳烷烃和部分氟化的醚等。
氟气结构式

氟气结构式
氟气是一种无色、无味的气体,它的分子结构式为F2,由两个氟原子组成,
它们之间通过共价键相连。
氟气是一种极其有毒的气体,它的毒性比氯气还要强,可以引起人体细胞的损伤,导致呼吸系统疾病,甚至死亡。
氟气在自然界中是一种极其稀少的物质,它主要存在于火山熔岩中,也可以从
矿物中提取出来。
氟气也可以由氯气和氢气经过反应制得,这种反应叫做氟化反应。
氟气有很多用途,它可以用来制造各种化学制品,如氟碳酸酯、氟烷烃等,这
些化学制品可以用来制造各种润滑剂、清洁剂、抗氧剂等。
此外,氟气还可以用来制造氟氯烷类农药,用来杀虫、杀螨等。
氟气也可以用来制造氟氯烷类冷却剂,用来冷却电子设备,以及用来制造氟氯
烷类灭火剂,用来灭火。
总之,氟气是一种重要的化学物质,它的分子结构式为F2,它有着多种用途,可以用来制造各种化学制品,也可以用来制造冷却剂和灭火剂。
《有机氟化学》PPT课件 (2)

1903年 S. A. Arrhenius in recognition of the extraordinary services he has rendered to the
advancement of chemistry by his electrolytic theory of dissociation.
完整版课件ppt
7
J. Fluorine Chem. 2005
1886年分离出
F2
Henri Moissan (1852-1907) 1906 年度诺贝尔化学奖得主
完整版课件ppt
8
完整版课件ppt
9
从100多年的诺贝尔化学奖看化学发展趋势
1901年 J. H. Van’t Hoff in recognition of the extraordinary services he has rendered by the
1905年 J. F. W. A. V. Baeyer in recognition of his services in the advancement of organic
chemistry and the chemical industry, through his work on organic dyes and hydroaromatic compounds.
高,深刻影响了全球经济发展和社会进步。
完整版课件ppt
6
氟化学发展中的里程碑
1886年 Moissan分离得到单质氟; 1892年 Swarts发现了三氟化锑作用下的氯/氟卤素交换反应; 1928年 Midgley发明了“氟利昂”; 1938年 Plunkett发现了聚四氟乙烯,标志着含氟聚合物的诞生; 1947年 Fowler发现了三氟化钴作用下的全氟化方法; 1949年 Simons发现了电化学氟化方法; 1954年 Fried对有机含氟物质在医学上的应用的研究; 1962年 George Olah利用含氟物质首次发现稳定的碳正离子存在; 1962年 Bartlett发现了惰性气体的氟化(XePtF6); 1974年 Molina和Rowland对某些氟利昂破坏臭氧层的研究; 1979年 Margraves发现了直接氟化; 2003年 O’Hagan分离出了第一个氟化酶。
有机氟

有机氟性质有机氟化合物特别是全氟化合物具有一些不一般甚至是非常特殊的物理化学性质,它们被用于从药物化学到材料科学等多个科学领域中。
物理性质方面,有机氟化物的性质主要是由两个因素所控制的:一是氟的高电负性和较小的原子半径,氟原子的2s和2p轨道与碳的相应轨道尤其匹配;二是由此产生的氟原子的特别低的可极化性。
碳-氟键是有机化学中已知的最强的化学键,它不仅较短,而且是高度极化的,其偶极矩在1.4D左右。
不过全氟碳烷分子中由于所有局部偶极矩相互抵消,却是属于十分非极性的溶剂,很多情况下比相应的碳烷的介电常数还低;对比之下,部分氟化的碳烷分子的偶极矩则较高。
氟原子仅比氢原子稍大(范德华半径比氢原子大23%),而且具有很低的可极化性,因此全氟碳烷的分子结构和分子动力学也受到影响。
直链碳烷是线性锯齿形构型,全氟碳烷则为了避免1-和3-位上氟原子间的电子和立体排斥,而采取螺旋形结构。
全氟烷烃的沸点要比相同分子量的烷烃低很多,而且由于全氟烷烃的低可极化性,造成它与其他烃类溶剂的混溶性很差,从而产生所谓液相的第三相,即相对于水相和有机相的氟相。
应用有机氟化物在医药工业中有非常重要的应用。
目前上市的新药中,每年大约有15-20%都是有机氟化合物。
在含氟的药物分子中,通常氟的含量都比较低,每个引入的氟原子或含氟基团都有其特定的目的。
总体上看,氟原子对药物分子的影响主要有:1.氟的引入不使分子发生明显的立体构型变化,但使分子的电子性质产生很大的改变。
这是由于氟原子虽然与氢原子大小相似,但却具有很大的电负性。
2.在芳环氟代、π体系的邻位氟代和全氟烷基链等情况下,氟的引入对于分子的亲脂性是有利的。
3.高电负性的氟原子可作为氢键受体或氢键供体的活化者,或者借由立体电子效应,稳定分子的一些构象。
芳环上的氟代增强了芳环其他氢原子的酸性,使其更容易成为氢桥的供体;同时,富电子的芳环π体系也可以作为氢桥的受体。
4.通过向底物引入氟原子,可以选择性地阻断一些不希望发生的代谢途径,让药物前体只转化为希望的生物活性物质,增加药物的生物利用度,稳定代谢和调整反应中心。
2氟吗啉的性能特点

2氟吗啉的性能特点
氟吗啉是一种有机合成化学品,化学式为C4H11FN,分子量为91.14、它具有以下性能特点:
1.稳定性:氟吗啉是一种稳定的化合物,可以在室温下在空气中稳定
存在。
它对酸、碱、水以及一些强氧化剂具有较好的耐受性。
2.溶解性:氟吗啉是一种易溶于常见有机溶剂的化合物,如乙醚、甲醇、乙醇等。
3.毒性:氟吗啉具有一定的毒性,在人体接触或吸入高浓度的氟吗啉时,会对中枢神经系统和肝脏产生损害。
因此,在使用过程中需要严格控
制接触和吸入的浓度。
4.氧化性:氟吗啉具有一定的氧化性,可以作为一种氧化剂。
当氟吗
啉与其他物质发生反应时,它往往会失去一个或多个氢原子,同时被氧化
成为较稳定的产物。
5.化学反应:氟吗啉可以作为一种试剂用于有机合成反应中。
在氢化
反应中,氟吗啉可以作为还原剂或氢捕获剂。
在亲电取代或亲核取代反应中,氟吗啉可以作为溶剂或催化剂。
6.反应活性:氟吗啉是一种具有较高反应活性的分子,因为它的分子
中的氢原子容易被取代。
这使得氟吗啉在有机合成中具有广泛的应用潜力,特别是在氢化反应和氢捕获反应中。
7.构型稳定性:氟吗啉是一种具有稳定构型的化合物。
它的分子中的
氢原子与氟原子的相对位置固定,不易发生构象变化。
这使得氟吗啉在合
成有机化合物时更容易控制反应产物的立体构型。
综上所述,氟吗啉具有稳定性、溶解性、毒性、氧化性、化学反应活性和构型稳定性等性能特点。
这些特点使得氟吗啉在有机合成、催化反应和药物化学等领域具有重要的应用价值。
tf2o化学式

tf2o化学式
TF2O是一种常用的有机化合物,其化学式为C2F4O2。
它是一种有机氟化合物,由两个氟原子和一个氧原子连接在一个碳原子上。
TF2O可用作有机合成中的重要试剂,具有多种应用。
TF2O的存在可以追溯到氟代酸酐的化学家Hartwig首次发现。
它在有机合成中被广泛应用,其中最常见的用途是作为氟代化合物的氟化试剂。
TF2O可以与醇、胺等化合物反应,从而生成氟代化合物。
这种反应通常在惰性溶剂中进行,如二氯甲烷或四氢呋喃。
通过控制反应条件和底物的选择,可以合成出各种不同的氟代化合物,这些化合物在药物合成、材料科学等领域具有重要的应用价值。
除了氟化反应,TF2O还可以用于酸酐化反应。
酸酐是一类重要的有机化合物,常用于酯化、酰化等反应中。
TF2O可以将醇或酸与酸酐化合成酯或酰化物,反应条件一般较温和,反应效率较高。
TF2O还可用于其他许多有机合成反应中,如酰胺化、脱保护基等。
TF2O作为一种强烷基化试剂,可以与各种亲电试剂反应,从而实现碳-碳键的构建。
TF2O作为一种常用的有机化合物,在有机合成中具有广泛的应用。
它可以用作氟化试剂、酸酐化试剂以及其他多种有机合成反应中的试剂。
通过合理选择反应条件和底物,可以实现各种有机化合物的合成,从而为药物合成、材料科学等领域的研究提供有力的支持。
(整理)当代有机氟化学

当代有机氟化学以下内容:来自于‹当代有机氟化学-合成反应应用实验›,自101页开始。
全氟烷基阴离子基本上可用于通常生成烷基或芳基阴离子一样的方法所产生,通过适当的C-H酸前体,用强碱脱质子或用还原性卤素(通常是溴、碘)金属交换,另外一种也是全氟世界所独有的方法即负离子或其他阴离子加成到全氟烯烃。
所有的全氟烷基阴离子由于受到氟取代的吸电子诱导效应(-I)而稳定,同时又受到氟原子的孤电子对对碳负离子中心的p-π电子排斥而去稳定。
对于β-氟碳负离子,负的超共轭效应可起到稳定化作用。
如果碳负离子并非处于自由的状态而是和金属(一个硬的路易斯酸),由于巨大的晶格能的释放趋向将强烈促使全氟烷基金属化物发生碎片化。
若存在β-氟原子,则将发生β-氟消除而产生末端全氟烯烃;若仅有α-氟原子,则发生α-氟消除而生成二氟卡宾,全氟芳基锂即使在低温条件下(一般-20*-40℃)也能发生消除,产生相应的芳基炔和氟化锂并伴随大量放热。
氟离子是很容易加成到全氟烯烃的,由于它将赴原子取代的SP3碳转化成SP2碳,而解除了p-π排斥引起的张力。
全氟丙烯或全氟烯烃的加成反应机理高度区域选择性的,他总是生成一个与带负电荷碳连有着最多碳原子数的阴离子。
氟离子很容易加成至全氟烯烃并生成一个碳负离子,用催化量的CsF处理全氟烯烃有时可以生成许多齐聚体的混合物。
五-三氟甲基环戊二烯阴离子生成的例子深刻反映了这种类型的反应。
它可以被应用于高度选择性的合成,例如五-三氟甲基环戊二烯基铯。
F 2C CHCF 3CF 3F 3C3CCF 33通过氟离子对全氟烯烃的加成产生全氟烷基阴离子的方法可以用于制备目的。
应用适当底物的脂肪族或芳环的亲核取代反应可选择性的引入全氟烷基。
对于芳香底物而言,离核的离去基团通常是氟离子,因此此类反应可改用催化量的氟离子。
催化剂或者是一个无机氟化物(CsF )或在一个电化学反应过程中由全氟烯烃的还原-脱氟产生。
长链全氟烷基锂化合物的生成通常是在更低的温度(<-78℃),他们通常是现场生成并立即和相应的底物(通常为羰基化合物如醛、酮或酯)直接进行反应。
二氟一氯甲烷序号-概述说明以及解释

二氟一氯甲烷序号-概述说明以及解释1.引言1.1 概述概述二氟一氯甲烷(化学式CFCl2),也被称为Freon 31,是一种无色无味的气体。
它是由氟、氯和碳三种元素组成的有机化合物,具有特殊的化学性质和广泛的应用领域。
二氟一氯甲烷被广泛使用于工业生产、冷却系统和消防装置等领域,同时也是一种重要的空气污染源。
本文将对二氟一氯甲烷的性质、应用、环境影响以及替代品研究进行深入探讨。
首先,我们将介绍二氟一氯甲烷的物理和化学性质,包括其分子结构、化学反应和稳定性等方面的特点。
接着,我们将探讨二氟一氯甲烷在多个行业中的应用情况,包括工业生产过程中的冷却剂、清洗剂和气体推进剂等。
同时,我们将特别关注其在环境保护和气候变化方面的问题。
二氟一氯甲烷作为一种重要的温室气体,对地球的臭氧层和气候产生负面影响。
我们将分析其释放方式和对环境的影响,以及国际社会对其控制和减排的努力。
随着全球对环境保护的重视,研发替代品已成为一项具有挑战性的任务。
我们将介绍目前一些已研发的替代品,以及它们在实际应用中的可行性和效果。
通过本文的研究,读者将对二氟一氯甲烷的性质、应用、环境影响和替代品研究有一个全面的了解。
希望本文能够为大家提供有价值的信息,促进对于可持续发展和环境保护的思考和行动。
1.2文章结构文章结构是指整篇文章的组织架构和各个部分的内容安排。
在本文中,我们将按照以下结构进行撰写:1. 引言1.1 概述1.2 文章结构1.3 目的2. 正文2.1 二氟一氯甲烷的性质2.2 二氟一氯甲烷的应用3. 结论3.1 二氟一氯甲烷的环境影响3.2 二氟一氯甲烷的替代品研究文章结构的目的是为了使读者能够清晰地了解文中的内容安排,并能够根据自身的需求有选择性地阅读感兴趣的部分。
通过按照上述结构进行撰写,我们将逐步介绍二氟一氯甲烷的概述、性质、应用以及对环境的影响和替代品研究,并最终得出结论。
请继续阅读文章的其他部分以获取详细信息。
1.3 目的本文旨在探讨二氟一氯甲烷的序号以及其相关性质、应用、环境影响和替代品研究的情况。
氟化学

Reactivity of Perfluoraromatic & Perfluoroolefinic Systems.
3
简 史
1886年 Moissan 分离出F2 1986年法国庆祝一百周年 设立Moissan奖章 1890年 F.Swarts 1930年 T. Midgly & A.L. Henne
o
H2
UF4
F2 250 C
o
UF6
gaseous diffusion
235 UF 6
(0.6%)
238 UF 6
(99.4%) lubricants
1966年 Artifical blood Clark L.C. 1974年 S. Rowland & M. Molina CFC破坏臭氧层
5
1987年 Montreal Protocol 1990-1992年 revised 2002年 Fluorinase enzgme (in the bacterium Streptomyces cattleya)
-Id
δ+ C
Fδ
9
Comparative Physical Properties of n-Hexane
Propertya
b.p.(℃ ) △ Hv(Kcal mol-1) Tc(℃) d25(gcm3) η25(CP) γ25 (dyncm-1) β(10-6atm-1) n25D ε
C6F14
CCl4 + HF + SbCl5
Freon 12
CF2Cl2
1934年 Schloffer & Scherev
CHF2Cl
Freon 22
有机氟化学

氟化学及其应用
祝 诗 发
2009-12-08
本讲内容
• • • • • • • • • • • 背景介绍 含氟生理活性分子 氟利昂 高级灭火剂 抗粘材料/氟碳涂料 人造血液 氟碳相 氟在有机化学中的应用 超酸(新加) 氟化学反应的基本原理和反应规律 参考文献
背景介绍
Fluorine
Fluorine was first identified by Karl W. Scheele in 1771 and first isolated in 1886 by the French chemist Henri Moissan.
Disadvantages Highly Corrosive, skin contact can be fatal Reacts with glass Gas (B.P. 20 oC) at room temperature
Element Fluorine (F2) Advantages Relatively cheap and commercially available Can be used for deep or selective fluorination Can react via radical or electrophilictype mechanisms
特殊性能
• (1)优良的防腐蚀性能—得益于极好的化学惰性、漆膜耐酸、 碱、盐等化学物质和多种化学溶剂,为基材提供保护屏障;该漆 膜坚韧—表面硬度高、耐冲击、抗屈曲、耐磨性好。显示出极佳 的物理机械性能。(神州飞船外层涂料、其它航天器外层涂料、 特殊环境下工作的仪器及部件:如磁搅拌子等) • (2)免维护、自清洁—氟碳涂层有极低的表面能、表面灰尘可 通过雨水自洁,极好的疏水性(最大吸水率小于5% )且斥油、 极小的摩擦系数(0.15 — 0.17 ),不会粘尘结垢,防污性好。 (汽车反光镜、挡风玻璃、战机驾驶舱玻璃、特殊光学器件表面) • (3)强附着性—在铜、不锈钢等金属、聚脂、聚氨脂、氯乙烯 等塑料、水泥、复合材料等表面都具有其优良的附着力,基本显 示出宜附于任何材料的特性。高装饰性——在60 度光泽计中, 能达到80% 以上的高光泽。(墙面漆、道路、桥梁、隧道等;中 国西部酸雨条件下的隧道维护、标志性建筑的外表等) • (4)超长耐候性—涂层中含有大量的F--C键,决定了其超强的 稳定性,不粉化、不褪色,使用寿命长达20年,具有比任何其他 类涂料更为优异的使用性能。优异的施工性—双组分包装、贮存 期长、施工方便。(建筑施工)
有机氟化合物
5) Fluorine has been identified as improving the lipophilicity of a molecule and hence its distribution within an organism.
O O N F O O F N
Nபைடு நூலகம்
The Csp3-F bond of 1.40A°is slightly shorter than the Csp3-OH bond
HO H N N H O N H O N F H N O O N
brevianamide E
fluorobrevianamide E
Competitive inhibitor of acylCoA:cholesterol acyltransferase Angew. Chem. Int. Ed., 2001, 40, 4461
H N O
O N H
F
F H N O
O N H 0.06
O
4) Fluorine has been employed as a replacement for both hydroxyl and hydrogen
Difluoromethylene units have been employed as isosteric replacements for oxygen In fact, no other functional group that can replace oxygen matches so well the steric and electronic demand of oxygen.
2) Fluorine bonded directly to a carbanionic center: destabilizing by I replusive interaction But, CF3 stabilizing
【免费下载】当代有机氟化学

对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,系电,力根保通据护过生高管产中线工资敷艺料设高试技中卷术资配0料不置试仅技卷可术要以是求解指,决机对吊组电顶在气层进设配行备置继进不电行规保空范护载高高与中中带资资负料料荷试试下卷卷高问总中题体资,配料而置试且时卷可,调保需控障要试各在验类最;管大对路限设习度备题内进到来行位确调。保整在机使管组其路高在敷中正设资常过料工程试况中卷下,安与要全过加,度强并工看且作护尽下关可都于能可管地以路缩正高小常中故工资障作料高;试中对卷资于连料继接试电管卷保口破护处坏进理范行高围整中,核资或对料者定试对值卷某,弯些审扁异核度常与固高校定中对盒资图位料纸置试,.卷保编工护写况层复进防杂行腐设自跨备动接与处地装理线置,弯高尤曲中其半资要径料避标试免高卷错等调误,试高要方中求案资技,料术编试交写5、卷底重电保。要气护管设设装线备备置敷4高、调动设中电试作技资气高,术料课中并中3试、件资且包卷管中料拒含试路调试绝线验敷试卷动槽方设技作、案技术,管以术来架及避等系免多统不项启必方动要式方高,案中为;资解对料决整试高套卷中启突语动然文过停电程机气中。课高因件中此中资,管料电壁试力薄卷高、电中接气资口设料不备试严进卷等行保问调护题试装,工置合作调理并试利且技用进术管行,线过要敷关求设运电技行力术高保。中护线资装缆料置敷试做设卷到原技准则术确:指灵在导活分。。线对对盒于于处调差,试动当过保不程护同中装电高置压中高回资中路料资交试料叉卷试时技卷,术调应问试采题技用,术金作是属为指隔调发板试电进人机行员一隔,变开需压处要器理在组;事在同前发一掌生线握内槽图部内纸故,资障强料时电、,回设需路备要须制进同造行时厂外切家部断出电习具源题高高电中中源资资,料料线试试缆卷卷敷试切设验除完报从毕告而,与采要相用进关高行技中检术资查资料和料试检,卷测并主处且要理了保。解护现装场置设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
有机氟的结构及应用

在此期间,几次历史性的突破极大地促进了有机氟化学 的发展,如本世纪三十年代氟利昂应用于制冷工业,二 战期间曼哈顿工程的实施,五十年代高生理活性氟脲嘧 啶的合成等等.氟元素具有高负电性,它形成的有机氟聚 合物具有卓越的耐化学性、热稳定性,优良的介电、耐 热、耐药品、不燃、不粘及摩擦系数小等性能,是综合 性能极佳的合成材料
1.1.2国外氟化学及工业发展趋势
国外有机氟材料正处于稳定树脂和氟橡胶的比例 不断上升,聚四氟乙烯比例下降。全球含氟聚合物生 产能力合计为18.34万吨,装置开工率约70%,聚四 氟乙烯、聚偏氟乙烯、聚全氟乙丙烯、氟橡胶等四种 主要产品占聚合物总量的85%。其中杜邦、 SolvaySolexis、大金、AGC、阿托菲纳等公司在技术、 品种和产能方面均处于领先地位,产能占全球总产能 的89%。近几年国外产能进一步扩大,新技术、新产 品不断应用。杜邦公司采用超临界聚合工艺开发了6 种高性能可熔性氟树脂,采用“APA工艺"生产改善脱 模性能的氟橡胶;
国外公司还开发了适用于高温的氟橡胶制造新工艺;霍 尼韦尔公司开发出新一代发泡剂HFC.245Fa以替代 HCFC.141b,月产能达2万吨;大金和AGC公司也开发 了HCFC.22的替代品HFC.125 并已建立了工业装置【2】 。
1.1.3 我国氟化学及工业发展趋势
在我国,氟化学研究是从1958年开始的,随着国民经济和科学技术的发展,尤其 是尖端科学技术的需要,40多年来从无到有建立了一大批以氟化学为对象的专业 研究部门,有了自己的氟材料工业,同时培养了许多专业人才。我国已在不同程 度上掌握了氟塑料、含氟弹性体、含氟离子交换摸、含氟润滑油脂、表面活性剂、 药物、灭火剂、绝缘与传热介质等各类含氟高分子和小分子有机氟化物的合成, 多数已经投产,其中不少科研项目和产品已接近和达到世界先进水平。另外,只 要看一看我国原子能和导弹火箭技术的水平就足以判断我国氟化学的水平了。经 过“十五”期间的发展,目前己进入黄金时期。特别是化工、制药、汽车、电子、 交通等行业的发展,对高性能氟产品的品种、数量的需求越来越大,极大地促进 了中国有机氟产业的发展。
当代有机氟化学共27页文档

当代有机氟化学共27页⽂档当代有机氟化学以下内容:来⾃于?当代有机氟化学-合成反应应⽤实验?,⾃101页开始。
全氟烷基阴离⼦基本上可⽤于通常⽣成烷基或芳基阴离⼦⼀样的⽅法所产⽣,通过适当的C-H酸前体,⽤强碱脱质⼦或⽤还原性卤素(通常是溴、碘)⾦属交换,另外⼀种也是全氟世界所独有的⽅法即负离⼦或其他阴离⼦加成到全氟烯烃。
所有的全氟烷基阴离⼦由于受到氟取代的吸电⼦诱导效应(-I)⽽稳定,同时⼜受到氟原⼦的孤电⼦对对碳负离⼦中⼼的p-π电⼦排斥⽽去稳定。
对于β-氟碳负离⼦,负的超共轭效应可起到稳定化作⽤。
如果碳负离⼦并⾮处于⾃由的状态⽽是和⾦属(⼀个硬的路易斯酸),由于巨⼤的晶格能的释放趋向将强烈促使全氟烷基⾦属化物发⽣碎⽚化。
若存在β-氟原⼦,则将发⽣β-氟消除⽽产⽣末端全氟烯烃;若仅有α-氟原⼦,则发⽣α-氟消除⽽⽣成⼆氟卡宾,全氟芳基锂即使在低温条件下(⼀般-20*-40℃)也能发⽣消除,产⽣相应的芳基炔和氟化锂并伴随⼤量放热。
氟离⼦是很容易加成到全氟烯烃的,由于它将赴原⼦取代的SP3碳转化成SP2碳,⽽解除了p-π排斥引起的张⼒。
全氟丙烯或全氟烯烃的加成反应机理⾼度区域选择性的,他总是⽣成⼀个与带负电荷碳连有着最多碳原⼦数的阴离⼦。
氟离⼦很容易加成⾄全氟烯烃并⽣成⼀个碳负离⼦,⽤催化量的CsF处理全氟烯烃有时可以⽣成许多齐聚体的混合物。
五-三氟甲基环戊⼆烯阴离⼦⽣成的例⼦深刻反映了这种类型的反应。
它可以被应⽤于⾼度选择性的合成,例如五-三氟甲基环戊⼆烯基铯。
通过氟离⼦对全氟烯烃的加成产⽣全氟烷基阴离⼦的⽅法可以⽤于制备⽬的。
应⽤适当底物的脂肪族或芳环的亲核取代反应可选择性的引⼊全氟烷基。
对于芳⾹底物⽽⾔,离核的离去基团通常是氟离⼦,因此此类反应可改⽤催化量的氟离⼦。
催化剂或者是⼀个⽆机氟化物(CsF)或在⼀个电化学反应过程中由全氟烯烃的还原-脱氟产⽣。
长链全氟烷基锂化合物的⽣成通常是在更低的温度(<-78℃),他们通常是现场⽣成并⽴即和相应的底物(通常为羰基化合物如醛、酮或酯)直接进⾏反应。
有机氟化学2

有机氟化学 (II)有机所氟化学实验室标志性成果黄维垣 先生: 亚磺化脱卤反应CF 3CF 2CF 2INa 2S 2O 4NaHCO 3 / CH 3CN / H 2OCF 3CF 2CF 2SO 2Na陈庆云 先生: 三氟甲基化反应FSO 2CF 2CO 2Me+PHIDMF CuIPhCF 3F S F2C O OO OMe I -F - + CF 2 + SO 2 + CO 2 + MeI Cu +CuCF 3PhIPhCF 3 + CuIACS Award for Creative Work in Fluorine Chemistry1972 George H. Cady 1973 Joseph H. Simons 1974 William T. Miller 1975 Joseph D. Park 1976 Paul Tarrant1977 Charles B. Colburn 1978 Jean'ne M. Shreeve 1979 Wayne E. White 1980 John L. Margrave 1981 Ronald J. Gillespie 1982 William J. Middleton 1983 Darryl D. DesMarteau 1984 Donald J. Burton 1985 David C. England 1986 Karl O. Christe 1987 Carl G . Krespan 1988 Harry J. Eméleus 1989 Yoshiro Kobayashi1990 J. Colin Tatlow1991 Richard D. Chambers 1992 Neil Bartlett 1993 Ronald E. Banks 1994 Oskar Glemser 1995 Paul R. Resnick 1996 Konrad Seppelt 1997 Richard J. Lagow 1998 Gary J. Schrobilgen 1999 Herbert W. Roesky 2000 William R. Dolbier, Jr. 2001 Leland C. Clark, Jr. 2002 David M. Lemal 2003 David A. Dixon2004 Surya G .K. Prakash 2005 Shlomo Rozen 2006 Boris Žemva1. C-F 键形成反应a) 亲核氟化试剂及反应在我国氟化学工业上广泛采用aHF ,KF, spray-dried KF, NaF, CsF, TBAF, TBA T, Olah Reagent, TASF, SF4,DAST, DeoxoFluor, SbF3, etc.CH 3CCl 3C F 3CF 3NO 2C F 3C F 3NH 2CrO 3C F 3COOHC F 3FCl 2, hvaHF, SbF 3H 2, cat.HNO 3, H 2SO 4H 2, cat.HNO 2, then HF-PyFaHF, -35 o C 80 %OHF-PyHOFFOHKFOFF1) SF 4 or SF 4/HF 2) DAST3) HF-Py, NBS (NIS)S8S 2Cl 2KF, Cl 2CH 3CN 80 o CSF 4TMSNEt 2, CFCl 3- 70 o C84%N SF 3DASTN O SF 3MOSTN SF 3OMeMeODeoxofluorS O O OSF 4S O O FFCOOHClClC F 3SF 4 : 160 o C, 24 %SF 4 - HF: 90-100 o C, 82 %COOH COOHHOOC HOOCSF 4-HF 240 o CO O FF FFF F F F80 % yieldSF 4-HFSF 3FHFSMeS PPHF-NISSMeFF FFF OHSPhNO + BF 4-PPHFH FH O HF FSF 4, HF, rt, 90 %;COOHHHCF 3HHSF4, HF, rt, 18h, 70%HODAST, CH 2Cl 225 o C, 18 hHF F72%NO+BF 4-NOHPPHFPPHFFFFF F NO + BF 4-75 % yield70% HF-PyOHHHOHHSMeSDBH, 50% HF-PyDCM, 0 o CO CF3HHNNO BrOBrF FF F NO+ BF4-70% HF-Py FN=O H+FNOHFN OHFF -F-NO+ FNNOFHOFH +F NNFHOFOHF-COOHC5H1180-90 % isolated yield1) HS(CH2)3SH, TfOHPhMe-i Octane(1:1)azeotropic removal of water2) precipitation with etherC5H11SSF3PhOH, NEt3DCM, -78 o CC5H11SSOFFFC5H11OFFFFFOTf1) Et3N-3HF, -78o C2) Br2, -78o C to rt85-90%b)亲电氟化试剂及反应F2/He-78 o CF3CCF3F3C CF3F3C CF39 %O CCl3OO CCl3OF60%S XeF2S FHF (cat.)25 o C67%XeF2HF (cat.)25 o CS F58%FOAcMe3SiOXeF277%OAcOFOAcOF4:1O-F ReagentsKClO4 + 2HF + SbF540-50 o CFClO3+ KSbF6 + H2OPerchloryl fluorideMp –147.8 o C; bp –46.7 o C CH3COOF (bp 53 o C)CF3COOFCF3OFHypofluorites次氟酸衍生物FClO 3AcOMe H Me OAcHHOMe H Me OAcHHFCOOHNH 2CF 3OF, HF, hv- 70 oCFCOOH NH 259%CF 3OF CF 3O + F + F RH R+ HFR+ CF 3OFRF + CF 3O CF 3O+ RHR+ COF 2 + HFNN Cl F 2BF 4-NN CH 3F 2OTf -NF B 2F 7N FOTf-NF OTf-NF OTf-S N S O O O O F氟化能力增加N O R 3O R'R2O1) LDA, THF; -78 o C2) NFSI, THF, -78 o C to rtN O R 3O R'R2OF80-88% yield 86-97% deN-F ReagentsClOO N HNMeOSelectFluor, MeCN, rt, 1hClOO N H NMeOF BF 4OSiMe 3O F99% yield 89% ee。
碳酰氟和氟化氢

碳酰氟和氟化氢全文共四篇示例,供读者参考第一篇示例:碳酰氟和氟化氢是两种重要的氟化学品,它们在有机合成、医药、材料科学等领域拥有广泛的应用。
本文将对碳酰氟和氟化氢的物理性质、化学性质、用途及安全性等方面进行详细的介绍,希望能为大家对这两种化学品有更深入的了解。
碳酰氟(Carbonyl fluoride,化学式为COF₂)是一种无色、具有刺激性气味的液体,密度为1.876 g/cm³,沸点为8.77℃。
碳酰氟在常温下易挥发,极易与水反应生成碳酸氟化氢并释放氟化氢气体。
碳酰氟是一种有机合成中的重要试剂,它可以用于合成酸酐、酰胺、酯等化合物。
碳酰氟还可用于金属表面处理、医药中间体的制备等领域。
碳酰氟和氟化氢都是有毒化学品,对人体有一定的危害。
碳酰氟的蒸气可引起呼吸道刺激、头晕、咳嗽等症状,长期接触可引起中毒。
而氟化氢对眼睛、皮肤和呼吸道有强烈的刺激性,接触过量可导致化学灼伤。
在使用这两种化学品时,必须严格按照操作规程进行,并保证充分的通风条件。
第二篇示例:要的应用价值。
本文将详细介绍碳酰氟和氟化氢的性质、制备方法以及应用领域。
碳酰氟(Carbonyl fluoride)是一种无色气体,化学式为COF2,分子量为66.01g/mol,其结构中包含一个碳原子和两个氟原子。
碳酰氟在室温下为液态,熔点为-124°C,沸点为-85°C。
碳酰氟是一种有机氟化合物,具有刺激性气味,易燃易爆,对皮肤、眼睛和呼吸道有刺激作用。
碳酰氟主要用于有机合成中的氟化反应,例如可以将碱性氨基团转化为氟取代基团。
碳酰氟还可以作为氟代试剂,用于氟取代反应中的催化剂。
碳酰氟和氟化氢的制备方法主要有以下几种:1.碳酰氟的制备方法:(1)从氟甲酸铅盐和五氧化二磷反应制得。
(2)从六氟丙酸和亚磷酸酐反应制得。
(3)从氟和二氧化碳气体在高温下反应制得。
碳酰氟和氟化氢在化学领域具有广泛的应用价值。
碳酰氟可以用于有机合成中的氟化反应,可以将化合物中的碱性氨基团转化为氟取代基团,从而改变分子的性质和活性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机氟化学 (II)
有机所氟化学实验室标志性成果
黄维垣 先生: 亚磺化脱卤反应
CF 3CF 2CF 2I
Na 2S 2O 4
NaHCO 3 / CH 3CN / H 2O
CF 3CF 2CF 2SO 2Na
陈庆云 先生: 三氟甲基化反应
FSO 2CF 2CO 2Me
+
PHI
DMF CuI
PhCF 3
F S F
2
C O O
O O
Me I -
F - + CF 2 + SO 2 + CO 2 + MeI Cu +
CuCF 3
PhI
PhCF 3 + CuI
ACS Award for Creative Work in Fluorine Chemistry
1972 George H. Cady 1973 Joseph H. Simons 1974 William T. Miller 1975 Joseph D. Park 1976 Paul Tarrant
1977 Charles B. Colburn 1978 Jean'ne M. Shreeve 1979 Wayne E. White 1980 John L. Margrave 1981 Ronald J. Gillespie 1982 William J. Middleton 1983 Darryl D. DesMarteau 1984 Donald J. Burton 1985 David C. England 1986 Karl O. Christe 1987 Carl G . Krespan 1988 Harry J. Eméleus 1989 Yoshiro Kobayashi
1990 J. Colin Tatlow
1991 Richard D. Chambers 1992 Neil Bartlett 1993 Ronald E. Banks 1994 Oskar Glemser 1995 Paul R. Resnick 1996 Konrad Seppelt 1997 Richard J. Lagow 1998 Gary J. Schrobilgen 1999 Herbert W. Roesky 2000 William R. Dolbier, Jr. 2001 Leland C. Clark, Jr. 2002 David M. Lemal 2003 David A. Dixon
2004 Surya G .K. Prakash 2005 Shlomo Rozen 2006 Boris Žemva
1. C-F 键形成反应
a) 亲核氟化试剂及反应
在我国氟化学工业上广泛采用
aHF ,KF, spray-dried KF, NaF, CsF, TBAF, TBA T, Olah Reagent, TASF, SF4,
DAST, DeoxoFluor, SbF3, etc.
CH 3
CCl 3
C F 3
C
F 3
NO 2
C F 3
C F 3
NH 2
CrO 3
C F 3COOH
C F 3F
Cl 2, hv
aHF, SbF 3
H 2, cat.
HNO 3, H 2SO 4
H 2, cat.HNO 2, then HF-Py
F
aHF, -35 o C 80 %
O
HF-Py
HO
F
F
OH
KF
O
F
F
1) SF 4 or SF 4/HF 2) DAST
3) HF-Py, NBS (NIS)
S
8
S 2Cl 2
KF, Cl 2CH 3CN 80 o C
SF 4
TMSNEt 2, CFCl 3
- 70 o C
84%N SF 3
DAST
N O SF 3
MOST
N SF 3
OMe
MeO
Deoxofluor
S O O O
SF 4
S O O F
F
COOH
Cl
Cl
C F 3
SF 4 : 160 o C, 24 %
SF 4 - HF: 90-100 o C, 82 %
COOH COOH
HOOC HOOC
SF 4-HF 240 o C
O O F
F F
F
F F F F
80 % yield
SF 4-HF
SF 3FHF
SMe
S PPHF-NIS
SMe
F
F F
F
F O
H
SPh
NO + BF 4-PPHF
H F
H O H
F F
SF 4, HF, rt, 90 %;
COOH
H
H
CF 3
H
H
SF4, HF, rt, 18h, 70%
H
O
DAST, CH 2Cl 225 o C, 18 h
H
F F
72%
NO
+
BF 4
-NO
H
PPHF
PPHF
F
F
F
F F NO + BF 4-75 % yield
70% HF-Py
OH
H
H
O
H
H
SMe
S
DBH, 50% HF-Py
DCM, 0 o C
O CF3
H
H
N
N
O Br
O
Br
F F
F F NO+ BF4-
70% HF-Py F
N=O H
+
F
N
OH
F
N OH
F
F -
F-
NO+ F
N
NO
F
HO
F
H +
F N
N
F
HO
F
OH
F-
COOH
C5H11
80-90 % isolated yield
1) HS(CH2)3SH, TfOH
PhMe-i Octane(1:1)
azeotropic removal of water
2) precipitation with ether
C5H11
S
S
F3PhOH, NEt3
DCM, -78 o C
C5H11
S
S
O
F
F
F
C5H11O
F
F
F
F
F
OTf
1) Et3N-3HF, -78o C
2) Br2, -78o C to rt
85-90%
b)亲电氟化试剂及反应
F2/He
-78 o C
F3C
CF3
F3C CF3
F3C CF3
9 %
O CCl3
O
O CCl3
O
F
60%
S XeF
2
S F
HF (cat.)
25 o C
67%
XeF2
HF (cat.)
25 o C
S F
58%
F
OAc
Me3SiO
XeF2
77%
OAc
O
F
OAc
O
F
4:1
O-F Reagents
KClO4 + 2HF + SbF5
40-50 o C
FClO3+ KSbF6 + H2O
Perchloryl fluoride
Mp –147.8 o C; bp –46.7 o C CH3COOF (bp 53 o C)
CF3COOF
CF3OF
Hypofluorites
次氟酸衍生物
FClO 3
AcO
Me H Me OAc
H
H
O
Me H Me OAc
H
H
F
COOH
NH 2
CF 3OF, HF, hv
- 70 o
C
F
COOH NH 2
59%
CF 3OF CF 3O + F + F RH R
+ HF
R
+ CF 3OF
RF + CF 3O CF 3O
+ RH
R
+ COF 2 + HF
N
N Cl F 2BF 4-N
N CH 3F 2OTf -N
F B 2F 7
N F
OTf
-
N
F OTf
-N
F OTf
-S N S O O O O F
氟化能力增加
N O R 3
O R'
R
2
O
1) LDA, THF; -78 o C
2) NFSI, THF, -78 o C to rt
N O R 3
O R'
R
2
O
F
80-88% yield 86-97% de
N-F Reagents
Cl
O
O N H
N
MeO
SelectFluor, MeCN, rt, 1h
Cl
O
O N H N
MeO
F BF 4
OSiMe 3
O F
99% yield 89% ee。
