元素周期表中各元素名称及性质
元素周期表中各元素名称及性质

—/[ *、…氢(H)[主要性质和用途熔点为℃,沸点为℃,密度为0. 089 88 g/L(10 ℃)。
无色无臭气体,不溶于水,能在空气中燃烧,与空气形成爆炸混合物。
工业上用于制造氨、环已烷、甲醇等。
发现1766年由卡文迪许()在英国判明。
氦(He);主要性质和用途熔点为℃(加压),沸点为-℃,密度为 5 g/L(0 ℃)。
无色无臭气体。
化学性质不活泼。
用于深海潜水、气象气球和低温研究仪器。
发现1895年由拉姆塞(Sir )在英国、克利夫等(和在瑞典各自独立分离出。
锂(Li)。
主要性质和用途熔点为℃,沸点为1 347 ℃,密度为g/cm3(20 ℃)。
软的银白色金属,跟氧气和水缓慢反应。
用于合金、润滑油、电池、玻璃、医药和核弹。
发现1817年由阿尔费德森(. Arfvedson)在瑞典发现。
铍(Be)主要性质和用途~熔点为1 278±5 ℃,沸点为2 970 ℃(加压下),密度为g/cm3(20 ℃)。
较软的银白色金属,在空气和水中稳定,即使在红热时也不反应。
用于与铜和镍制合金,其导电性和导热性极好。
发现1798年由沃克兰()发现硼(B)主要性质和用途*熔点为2 300 ℃,沸点为3 658 ℃,密度为g/cm3(β-菱形)(20 ℃)。
具有几种同素异形体,无定形的硼为暗色粉末,跟氧气、水、酸和碱都不起反应,跟大多数金属形成金属硼化物。
用于制硼硅酸盐玻璃、漂白和防火。
发现1808年由戴维(Sir Humphrey Davy)在英国、盖-吕萨克()和泰纳)在法国发现。
碳(C)主要性质和用途熔点约为3 550 ℃(金刚石),沸点约为4 827 ℃(升华),密度为g/cm3(金刚石)、g/cm3(石墨)(20 ℃)。
用于首饰(金刚石)、炼钢(焦炭)、印刷(炭黑)和精制糖(活性炭)等。
;发现在自然界中以石墨(和金刚石)存在。
古代已知有木炭和烟炱。
氮(N)主要性质和用途熔点为℃,沸点为℃,密度为g/L(0 ℃)。
化学元素周期表(完整版)

化学元素周期表(完整版)
介绍
化学元素周期表是由化学元素按照其原子序数、电子排布和化学性质等规律进行排列的表格。
它是化学研究中的基础工具,用于传达元素的基本信息和特性。
本文档将提供一个完整的化学元素周期表,其内容包括元素的名称、原子序数、原子量、元素符号以及简要的特性说明。
元素列表
(注:上表只列出部分元素,完整版元素周期表可参考其他资源)
结论
元素周期表的完整版包含了大量的元素信息,通过学习元素周期表,可以更好地理解元素的特性和相互关系。
对于化学研究、材料开发和生命科学等领域的学习和实践,元素周期表都起到了重要的指导作用。
元素周期表中的主族元素

元素周期表中的主族元素元素周期表是化学中的重要工具,它将元素按照一定规律排列。
其中,主族元素是指周期表中第1A到第8A族元素,也就是代表性元素。
这些元素具有共性,其化学性质也有规律可循。
本文将介绍元素周期表中的主族元素,以及它们在日常生活中的应用。
一、第1A族元素 - 碱金属碱金属是元素周期表中的第1A族元素。
它们包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素具有低密度、低熔点和非常活泼的化学性质。
碱金属在自然界中以化合物的形式存在,比如氯化钠(NaCl),它是我们常见的食盐。
此外,钾和铷还用于冶金工业中的合金制备。
二、第2A族元素 - 碱土金属碱土金属是元素周期表中的第2A族元素。
它们包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
与碱金属相比,碱土金属的化学性质更为稳定。
它们在自然界中以氧化物和硫化物的形式广泛存在。
钙是人体骨骼、牙齿的重要组成元素,被广泛应用于医药和建筑材料制造。
镁用于制备轻便合金,广泛应用于航空航天领域。
三、第3A族元素 - 硼族元素硼族元素是元素周期表中的第3A族元素。
它们包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl)和镓(Uut)。
这些元素的数量较少,化学性质各异。
铝是最常见的硼族元素,具有良好的导电性和导热性,广泛应用于建筑、汽车和航空领域。
四、第4A族元素 - 碳族元素碳族元素是元素周期表中的第4A族元素。
它们包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)和镤(Fl)。
碳是生命的基础,几乎所有有机物都含有碳元素。
硅在电子工业中应用广泛,是半导体材料的重要组成部分。
锡和铅常用于合金制备,具有良好的焊接性能。
五、第5A族元素 - 氮族元素氮族元素是元素周期表中的第5A族元素。
它们包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和镤(Mc)。
氮是地球大气中的主要成分,也是生物体内常见的元素。
元素周期表中主族元素的性质与应用

元素周期表中主族元素的性质与应用元素周期表是化学家们用来组织元素的一种表格,包含了所有已知元素,并按照一定的规律进行排列。
其中的主族元素是指周期表中1A (IA)到8A(VIII A,除去希腊字母B)族的元素。
这些元素在化学中起着重要的作用,具有独特的性质和广泛的应用。
本文将探讨主族元素的一些性质及其在不同领域中的应用。
一、第一主族元素第一主族元素包括氢(H)和锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、和钫(Fr)等元素。
这些元素在自然界中常以离子的形式存在,具有单价阳离子特性。
它们的化合物具有良好的溶解性,是一些重要的化学试剂。
1.1 氢(H)氢是宇宙中最常见的元素之一,也是第一主族元素中唯一一个非金属元素。
它的原子核仅由一个质子组成,主要以分子氢(H2)的形式存在。
氢气是一种无色、无味、无毒的气体,在工业上被广泛用于氢气燃料电池。
此外,氢也是许多化学反应的重要参与者,包括水的电解、还原反应等。
1.2 锂(Li)、钠(Na)和钾(K)锂、钠和钾都是第一主族的典型金属元素,它们在自然界中以氧化物或氯化物的形式存在。
这些元素具有低密度、较低的熔点和活泼的化学性质。
它们在电池技术、合金制备、有机合成等方面有着广泛的应用。
例如,锂被广泛用于锂离子电池,钠和钾被用于合成冶金和有机合成中的还原剂。
二、第二主族元素第二主族元素包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)等元素。
这些元素通常以阳离子的形式出现,并具有活泼的金属性质。
它们的化合物广泛存在于地壳和生物体内,具有广泛的应用领域。
2.1 镁(Mg)和钙(Ca)镁和钙是第二主族元素中应用最广泛的两个元素。
镁是一种轻质金属,具有强度高、耐腐蚀性好等优异的性能。
它广泛用于航空航天、汽车制造和生物医学等领域。
钙是人体骨骼和牙齿的重要组成成分,也是神经传导和肌肉收缩的必需元素。
它被广泛应用于医药和食品添加剂。
2.2 钡(Ba)和锶(Sr)钡和锶是两个重要的第二主族元素,它们的化合物具有较好的化学稳定性和良好的光学性能。
化学之元素周期表的性质
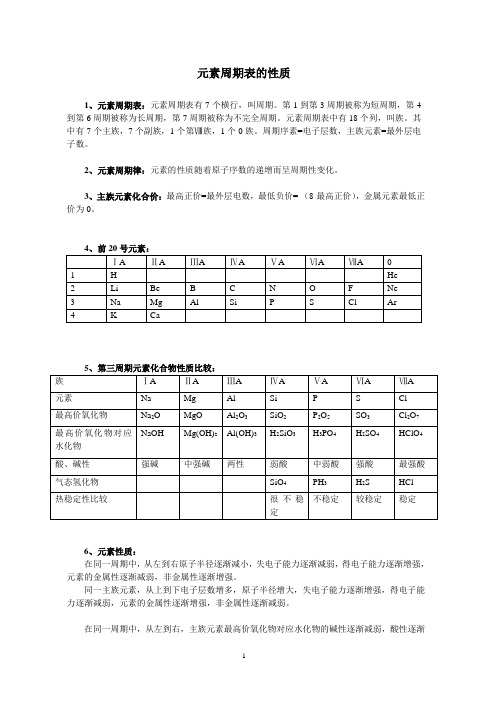
元素周期表的性质1、元素周期表:元素周期表有7个横行,叫周期。
第1到第3周期被称为短周期,第4到第6周期被称为长周期,第7周期被称为不完全周期。
元素周期表中有18个列,叫族。
其中有7个主族,7个副族,1个第Ⅷ族,1个0族。
周期序素=电子层数,主族元素=最外层电子数。
2、元素周期律:元素的性质随着原子序数的递增而呈周期性变化。
3、主族元素化合价:最高正价=最外层电数,最低负价=-(8-最高正价),金属元素最低正价为0。
4、前20号元素:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 01 H He2 Li Be B C N O F Ne3 Na Mg Al Si P S Cl Ar4 K Ca5、第三周期元素化合物性质比较:族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA元素Na Mg Al Si P S Cl最高价氧化物Na2O MgO Al2O3SiO2P2O5SO3Cl2O7NaOH Mg(OH)2Al(OH)3H2SiO3H3PO4H2SO4HClO4最高价氧化物对应水化物酸、碱性强碱中强碱两性弱酸中弱酸强酸最强酸气态氢化物SiO4PH3H2S HCl不稳定较稳定稳定热稳定性比较很不稳定6、元素性质:在同一周期中,从左到右原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,元素的金属性逐渐减弱,非金属性逐渐增强。
同一主族元素,从上到下电子层数增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。
在同一周期中,从左到右,主族元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐增强;它们气态氢化物的热稳定性逐渐增强。
在同一主族中,从上到下,元素最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;它们的气态氢化物的热稳定性逐渐减弱。
原子半径金属性非金属性最高价氧化物对应水化物气态氢化物的稳定性酸性碱性同一横行减小减小增大减小增大增大同一列增大增大减小增大减小减小2011.11.12。
化学元素周期表重要元素及其特性的解读

化学元素周期表重要元素及其特性的解读化学元素周期表是化学家们用来组织和分类所有已知元素的工具。
它由一系列水平排列的横行和垂直排列的竖列组成。
每个元素都有自己独特的原子序数、原子质量和化学性质。
在本文中,将重点介绍一些重要的元素及其特性。
1. 氢 (H):氢是周期表中最简单的元素,其原子序数为1。
它是宇宙中最常见的元素之一,也是构成水的主要成分。
氢气可以燃烧,是强力的燃料。
此外,氢还具有广泛的应用,如在合成氨、制造氢气燃料电池等。
2. 氧 (O):氧是生命中必不可少的元素之一,原子序数为8。
它是空气中最常见的元素,占空气体积的约1/5。
氧是火焰燃烧和许多生物呼吸过程中的关键成分。
此外,氧还可以与其他元素形成氧化物,如水和二氧化碳。
3. 碳 (C):碳是生命的基础,原子序数为6。
它是有机物的主要组成部分,包括蛋白质、脂肪、碳水化合物和核酸。
碳还可以形成多种形态,如钻石和石墨。
碳的特殊性质使得它成为材料科学和纳米技术的研究重点。
4. 氮 (N):氮是空气中的重要元素之一,原子序数为7。
它占空气体积的约78%。
氮在植物生长和动物组织中起着重要作用。
此外,氮还可以与其他元素形成许多有用的化合物,如氨、硝酸和氰化物。
5. 铁 (Fe):铁是人类文明发展史上至关重要的元素之一,原子序数为26。
它是地壳中最常见的金属之一。
铁具有良好的导电性和热传导性,因此广泛应用于制造工业。
铁还是血红蛋白的主要组成部分,负责输送氧气到人体各个器官。
6. 钾 (K):钾是人体内的重要矿物质之一,原子序数为19。
它在维持酸碱平衡和正常肌肉功能方面起着关键作用。
钾还参与神经信号传递和细胞功能调节。
蔬菜、水果和坚果是富含钾的食物。
7. 锌 (Zn):锌是人体所需的微量元素之一,原子序数为30。
它对细胞分裂、免疫功能和蛋白质合成至关重要。
锌还在许多酶反应中充当催化剂。
肉类、海鲜和豆类是富含锌的食物。
8. 黄金 (Au):黄金是一种珍贵金属,原子序数为79。
化学元素周期表及其特性

化学元素周期表及其特性化学元素周期表是一个有序排列的化学元素列表,其中元素按照其原子编号逐渐增加。
通过周期表,我们可以获得关于各种元素的重要信息,包括元素符号、原子序数、原子量以及元素的一些特性。
以下是一些常见的元素特性:1. 元素符号和原子编号元素符号是化学元素的缩写形式,由一个或两个字母组成。
常见的元素符号有H(氢)、O(氧)和Fe(铁)等。
原子编号是元素在周期表中的位置,也称为原子序数。
例如,氧的原子编号是8,铁的原子编号是26。
2. 原子量原子量是一个元素所含有的质子和中子的总数。
它通常以摩尔(mol)为单位表示。
原子量与元素的质量有关,可以用于计算元素的摩尔质量。
例如,氧的原子量为16 g/mol。
3. 化学性质化学性质是描述元素在化学反应中表现出的特性。
不同元素具有不同的化学性质,这些性质决定了元素在反应中的行为。
例如,金属元素具有良好的导电性和延展性,非金属元素则通常呈现不良导电性和脆性。
4. 物理性质物理性质是描述元素在物理过程中的特性。
它包括元素的密度、熔点、沸点等。
这些性质可以帮助我们了解元素的状态变化和物质性质。
例如,水的熔点是0摄氏度,沸点是100摄氏度。
5. 元素分类化学元素可以根据周期表中的位置进行分类。
元素主要分为金属、非金属和半金属三大类。
金属元素位于周期表的左侧和中间部分,具有良好的导电性和热传导性。
非金属元素位于周期表的右侧,通常为脆性、不良导电和导热的。
半金属元素则处于金属和非金属之间。
通过学习周期表及其特性,我们可以更好地了解化学元素的组成和特性,为化学研究和应用提供基础知识。
初中化学元素周期表中的元素分类与性质

初中化学元素周期表中的元素分类与性质序言:化学元素周期表是化学研究中的重要工具,它将化学元素按照一定的规律排列,并按照不同的特性进行分类。
通过研究元素周期表,我们能够更好地理解元素的分类与性质,为化学学习打下坚实的基础。
本节课将重点介绍化学元素的分类以及它们的主要性质。
一、基本概念的介绍1. 元素的概念和特征元素是物质的最基本单位,由具有相同原子序数的原子组成。
每个元素有一些独特的物理和化学性质,这些性质可以用于对元素进行分类。
2. 元素周期表的结构和组成元素周期表是由经典周期表和长式周期表两种形式组成,它将元素按照原子序数的增加顺序排列,并将具有相似性质的元素放在同一列上。
二、元素的分类1. 金属、非金属和类金属元素的划分金属元素具有良好的导电、导热性和延展性,常见的金属元素包括铁、铜、铝等;非金属元素则不具备这些性质,如氧、氮、碳等;而类金属元素则处于金属和非金属之间,如硅、磷等。
2. 主族元素和过渡元素的分类元素周期表中的第1、2组和13-18组元素被称为主族元素。
它们通常具有相似的化学性质和外电子排布。
而在元素周期表中位于3-12组之间的元素被称为过渡元素,它们具有复杂的电子排布和特殊的化学性质。
3. 同位素的分类同位素是指原子序数相同、质量数不同的元素。
它们具有相同的化学性质,但质量不同。
同位素在核化学和放射性物质的研究中发挥着重要作用。
三、元素的主要性质1. 原子半径和离子半径原子半径是指原子的大小,而离子半径则是指由原子失去或获得电子后形成的正离子或负离子的大小。
元素周期表中的原子和离子半径呈现一定的趋势,如随着原子序数的增加,原子半径逐渐变大。
2. 电负性和电子亲和能电负性是描述原子对电子的亲和程度,电子亲和能则是指原子吸引外部电子的能力。
元素的电负性和电子亲和能对其在化学反应中的行为和性质有重要影响。
3. 化合价和氧化态化合价是指元素形成化合物时的电荷状态,氧化态则是指元素在化合物中离子化的程度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
—/[ *、…氢(H)[主要性质和用途熔点为℃,沸点为℃,密度为0. 089 88 g/L(10 ℃)。
无色无臭气体,不溶于水,能在空气中燃烧,与空气形成爆炸混合物。
工业上用于制造氨、环已烷、甲醇等。
发现1766年由卡文迪许()在英国判明。
氦(He);主要性质和用途熔点为℃(加压),沸点为-℃,密度为 5 g/L(0 ℃)。
无色无臭气体。
化学性质不活泼。
用于深海潜水、气象气球和低温研究仪器。
发现1895年由拉姆塞(Sir )在英国、克利夫等(和在瑞典各自独立分离出。
锂(Li)。
主要性质和用途熔点为℃,沸点为1 347 ℃,密度为g/cm3(20 ℃)。
软的银白色金属,跟氧气和水缓慢反应。
用于合金、润滑油、电池、玻璃、医药和核弹。
发现1817年由阿尔费德森(. Arfvedson)在瑞典发现。
铍(Be)主要性质和用途~熔点为1 278±5 ℃,沸点为2 970 ℃(加压下),密度为g/cm3(20 ℃)。
较软的银白色金属,在空气和水中稳定,即使在红热时也不反应。
用于与铜和镍制合金,其导电性和导热性极好。
发现1798年由沃克兰()发现硼(B)主要性质和用途*熔点为2 300 ℃,沸点为3 658 ℃,密度为g/cm3(β-菱形)(20 ℃)。
具有几种同素异形体,无定形的硼为暗色粉末,跟氧气、水、酸和碱都不起反应,跟大多数金属形成金属硼化物。
用于制硼硅酸盐玻璃、漂白和防火。
发现1808年由戴维(Sir Humphrey Davy)在英国、盖-吕萨克()和泰纳)在法国发现。
碳(C)主要性质和用途熔点约为3 550 ℃(金刚石),沸点约为4 827 ℃(升华),密度为g/cm3(金刚石)、g/cm3(石墨)(20 ℃)。
用于首饰(金刚石)、炼钢(焦炭)、印刷(炭黑)和精制糖(活性炭)等。
;发现在自然界中以石墨(和金刚石)存在。
古代已知有木炭和烟炱。
氮(N)主要性质和用途熔点为℃,沸点为℃,密度为g/L(0 ℃)。
无色无臭气体。
在室温下一般不活泼。
用于制硝酸、化肥、炸药、塑料和染料等。
发现!1772年由卢瑟福()在苏格兰发现。
氧(O)主要性质和用途熔点为℃,沸点为℃,密度为g/L(0 ℃)。
无色无臭气体。
非常活泼,与除稀有气体以外的所有元素形成氧化物,在水中有一定的溶解性。
用于炼钢、金属切割和化学工业。
发现1773年由舍勒()在瑞典、1774年由普利斯特里()在英国,拉瓦锡)在法国各自独立发现。
【氟(F)主要性质和用途熔点为℃,沸点为℃,密度为g/L(0 ℃)。
淡黄色气体,是最活泼的非金属元素。
用于制氟化试剂以及金属冶炼中的助熔剂等。
发现1886年由莫瓦桑()在法国制得。
*钠(Na)主要性质和用途熔点为℃,沸点为℃,密度为9 g/L(0 ℃)。
无色无臭气体。
化学性质不活泼。
用于装饰灯(霓红灯广告牌)。
发现1898年由拉姆塞(Sir William Ramsay)和特拉弗斯()在英国发现。
|钠(Na)主要性质和用途熔点为℃,沸点为℃,密度为g/cm3(20 ℃)。
软的银白色金属,切割时迅速被氧化,跟水剧烈反应。
用于原子反应堆的热交换器中。
发现1807年由戴维(Sir Hamphry Davy)在英国分离出。
{镁(Mg)主要性质和用途熔点为℃,沸点为1 090 ℃,密度为g/cm3(20 ℃)。
较软的银白色金属,在空气中燃烧,跟热水反应。
用于制合金以及保护其他金属的牺牲阴极。
发现1808年由戴维(Sir Hamphry Davy)在英国制得。
铝(Al)#主要性质和用途熔点为℃,沸点为2 467 ℃,密度为g/cm3(20 ℃)。
银白色金属,由于表面形成氧化层而保护其不与空气和水起反应。
溶于热的浓盐酸和氢氧化钠溶液。
作为金属和合金在飞机、建筑业、容器、铝箔等方面有许多用途。
发现1825年由厄斯泰德(Hans Christian Dersted)在丹麦发现。
硅(Si)(主要性质和用途熔点为1410 ℃,沸点为2 355 ℃,密度为g/cm3(20 ℃)。
超纯半导体晶体是蓝灰色,用碳还原砂子得到的无定形硅为黑色。
不跟氧气、水、酸(HF 除外)反应,但溶于热碱。
用于制半导体、合金和聚合物。
发现1823年由贝采里乌斯()在瑞典制得。
磷(P)主要性质和用途熔点为℃(白磷),410 ℃(红磷,加压),沸点为280 ℃,密度为g/cm3,g/cm3(红磷)。
白磷软而易燃,红磷呈粉末状,通常不易燃。
都不跟水或稀酸反应,但跟碱反应生成磷化氢气体。
用于制化肥、杀虫剂、清洁剂以及金属处理等。
&发现1669年由布兰特(Hennig Brandt)在德国制得白磷。
硫(S)主要性质和用途熔点为℃(α),沸点为℃,密度为g/cm3(α) (20 ℃)。
有几种同素异形体,其中正交晶型的S8是最稳定的。
对空气和水稳定,但加热时会燃烧;跟氧化性的酸反应。
是重要的工业化学品。
发现古代已发现天然硫。
|氯(Cl)主要性质和用途熔点为℃,沸点为℃,密度为g/cm3(0 ℃)。
黄绿色具有强烈刺激性气味的气体。
用于制漂白剂、有机氯溶剂和聚合物(PVC)。
发现1774年由舍勒()在瑞典制得,1810年由戴维(Sir Hamphry Davy)在英国确认。
氩(Ar)-主要性质和用途熔点为℃,沸点为℃,密度为g/cm3(0 ℃)。
无色无臭气体。
在灯泡和高温冶金中用作惰性气氛。
发现1894年由雷利(Lord Rayleigh)和拉姆塞(Sir William Ramsay)在英国发现。
钾(K)《主要性质和用途熔点为℃,沸点为774 ℃,密度为g/cm3(20 ℃)。
软的白色金属,切割时有银白色光泽,但同时迅速被氧化,跟水剧烈反应。
用于制化肥、化学品和玻璃等。
发现1807年由戴维(Sir Hamphry Davy)在英国发现。
钙(Ca)主要性质和用途熔点为839 ℃,沸点为1 484 ℃,密度为g/cm3(20 ℃)。
较软的银白色金属,跟氧和水反应。
用于制合金、生产锆、钍、铀和稀土金属。
生石灰用于冶金、水处理、化学工业和建筑等。
'发现1808年由戴维(Sir Hamphry Davy)在英国分离出。
钪(Sc)主要性质和用途熔点为1 541 ℃,沸点为2 831 ℃,密度为g/cm3(0 ℃)。
软的银白色金属,在空气中失去光泽并且容易燃烧,跟水反应生成氢气,跟酸反应形成盐。
很少应用。
发现1879年由尼尔森()在瑞典发现。
-钛(Ti)主要性质和用途熔点为1 660 ℃,沸点为3 287 ℃,密度为g/cm3(20 ℃)。
硬而有光泽的银白色金属。
因氧化物膜而抗腐蚀,但金属粉末在空气中燃烧,不跟酸和碱反应。
主要用制轻合金、用于化工厂,钛白粉用于涂料。
发现1791年由格雷戈尔()在英国发现。
钒(V)!主要性质和用途熔点为1 887 ℃,沸点为3 377 ℃,密度为g/cm3(20 ℃)。
闪亮的银白色金属,纯净时软。
因氧化物膜而抗腐蚀,能与浓酸作用,但不跟熔融的碱反应。
主要用于制造合金和制钢。
发现1830年由塞夫斯特伦()在瑞典发现。
铬(Cr),主要性质和用途熔点为1 857±20 ℃,沸点为2 672 ℃,密度为g/cm3(20 ℃)。
硬的蓝白色金属。
溶于盐酸和硫酸,但因形成保护层而不溶于硝酸、磷酸或高氯酸,在空气中抗氧化。
主要用于合金、镀铬和金属陶瓷。
发现1797年由沃克兰在法国发现。
锰(Mn)主要性质和用途熔点为1 244 ℃,沸点为1 962 ℃,密度为(α)g/cm3(20 ℃)。
硬而脆的银白色金属。
含杂质时活泼,在氧气中燃烧,在空气中发生表面氧化,跟水反应,溶于稀酸中。
用于钢铁生产、陶瓷、肥料添加剂、动物饲料补充剂等。
》发现1774年由甘恩()在瑞典分离出。
铁(Fe)主要性质和用途熔点为1 535 ℃,沸点为2 750 ℃,密度为g/cm3(20 ℃)。
银白色有光泽的金属,纯时较软。
在潮湿空气中生锈,溶于酸中,在冷的浓硫酸、硝酸中钝化。
主要用于钢铁。
发现古代文明已知。
:钴(Co)主要性质和用途熔点为1 495 ℃,沸点为2 870 ℃,密度为g/cm3(20 ℃)。
坚硬的银色发蓝、有光泽的金属,具有铁磁性。
在空气中稳定,跟稀酸缓慢反应。
60Co 是有用的放射性同位素。
用于磁性合金、陶瓷、催化剂和涂料中。
发现1735年由布兰特()在瑞典发现。
镍(Ni)。
主要性质和用途熔点为1 453 ℃,沸点为2 732 ℃,密度为g/cm3(25 ℃)。
银白色、有光泽、有延展性和韧性的金属。
抗腐蚀,溶于酸中(浓硝酸除外),不跟碱反应。
发现1751年由克郎斯塔特()在瑞典发现。
铜(Cu)—主要性质和用途熔点为1 084 ℃,沸点为2 567 ℃,密度为g/cm3(20 ℃)。
红色、有光泽、有延展性和韧性的金属,具有高的导电性和导热性。
难跟空气和水反应,但会缓慢地被侵蚀而生成铜绿。
用于制造合金、电线、电器、钱币等。
发现古代文明已知。
锌(Zn)主要性质和用途熔点为℃,沸点为907 ℃,密度为g/cm3(20 ℃)。
略带浅蓝色的白色金属,铸锌较脆。
在空气中失去光泽,跟酸和碱反应。
用于镀锌铁皮、合金、电池等,氧化锌用在橡胶中,可以用作聚合物稳定剂。
、发现1500年前在中国和印度已知。
镓(Ga)主要性质和用途熔点为℃,沸点为2 403 ℃,密度为g/cm3(20 ℃)。
软的银白色金属。
在空气和水中稳定,溶于酸和碱中。
在所有元素中具有最长的液态范围。
用磷、砷和锑掺杂具有半导体性质。
用于发光二极管和微波装置。
发现1875年由布瓦博德朗Boisbaudran)在法国发现。
*锗(Ge)主要性质和用途熔点为℃,沸点为2 830 ℃,密度为g/cm3(20 ℃)。
超纯锗是银白色、脆的类金属元素。
在空气和水中稳定,不跟酸(硝酸除外)和碱反应。
用于半导体、合金和红外装置用的特种玻璃。
发现1886年由文克勒()在德国发现。
砷(As)#主要性质和用途熔点为817 ℃(加压下),沸点为616 ℃(升华),密度为g/cm3(α),g/cm3(β)(20 ℃)。
准金属元素,有几种同素异形体。
其中灰α-砷软而脆,无光泽,具有金属性,在氧气中燃烧,在水、酸和碱中不活泼,但能跟热酸和熔融的氢氧化钠反应。
用于合金、半导体、杀虫剂、木材防腐剂和玻璃等。
发现1250年由马格耐斯()发现。
硒(Se)}主要性质和用途熔点为217 ℃(加压下),沸点为℃,密度为g/cm3(灰)(20 ℃)。
从银白色金属同素异形体或红色无定形粉末获得,不太稳定。
在空气中燃烧,不跟水反应,溶于浓硝酸和碱中。
用于光电池、复印和半导体中。
发现1817年由贝采里乌斯()在瑞典发现。
溴(Br)主要性质和用途熔点为℃,沸点为℃,密度为g/cm3(20 ℃)。
深红色、稠密的、具有强刺激性气味的液体。
