2015-2016学年高二化学人教版选修四课件3.1弱电解质的电离 .ppt
合集下载
人教版高二化学选修四:弱电解质的电离PPT(24页)

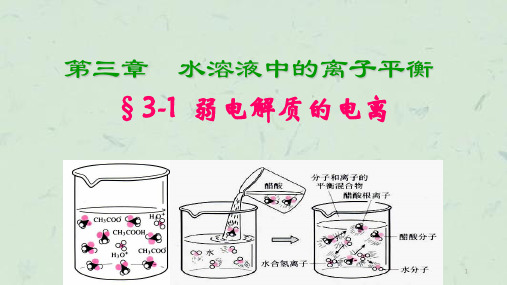
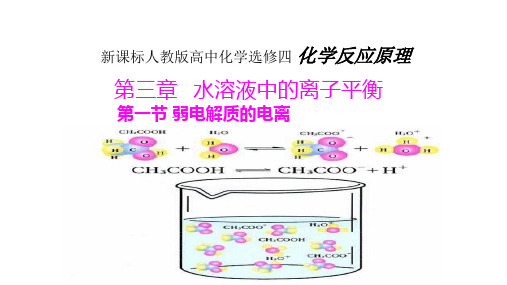
第三章 水溶液中的离子平衡
第一节 弱电解质的电离
知识回顾:
1、(1)什么叫电解质? 举例说明.
(2)什么叫非电解质? 举例说明.
一、强电解质和弱电解质
1、电解质和非电解质
电解质:
②③⑤⑥⑨
在水溶液中或熔融状态时能够 导电的化合物。
非电解质: 在水溶液中和熔融状态时都不 ⑦⑧ 能导电的化合物。
人教版高二化学选修四:弱电解质的 电离PPT (24页)
人教版高二化学选修四:弱电解质的 电离PPT (24页)
2.外界条件对电离平衡的影响:
讨论完成表格:CH3COOH
CH3COO--+ H+
改变条件
加
热
平衡移动 C(H+) C(CH3COO--) C(CH3COOH) 方向
正向移动 增大
增大
减少
三、
一元强酸(HA)与一元弱酸(HB)的比较:
1)相同物质的量浓度、相同体积时
比较 项目 C(H+) pH
HA 大 小
中和碱 的能力
相同
与活泼金 属反应产 生H2的量
相同
与金属反 应的开始
速率
稀释相同 倍数后pH
大
小
HB 小 大 相同 相同
小
大
一元强酸(HA)与一元弱酸(HB)的比较: 2)相同PH、相同体积时
V(结合)
t
1、电离平衡:一定条件下(温度、浓度一定),当弱电 解质分子电离成离子的速率等于离子重新结合成分子的 速率时,电离过程就达到了平衡状态,即电离平衡。
❖特征—— 逆、等、动、定、变
人教版高二化学选修四:弱电解质的 电离PPT (24页)
人教版高二化学选修四:弱电解质的 电离PPT (24页)
第一节 弱电解质的电离
知识回顾:
1、(1)什么叫电解质? 举例说明.
(2)什么叫非电解质? 举例说明.
一、强电解质和弱电解质
1、电解质和非电解质
电解质:
②③⑤⑥⑨
在水溶液中或熔融状态时能够 导电的化合物。
非电解质: 在水溶液中和熔融状态时都不 ⑦⑧ 能导电的化合物。
人教版高二化学选修四:弱电解质的 电离PPT (24页)
人教版高二化学选修四:弱电解质的 电离PPT (24页)
2.外界条件对电离平衡的影响:
讨论完成表格:CH3COOH
CH3COO--+ H+
改变条件
加
热
平衡移动 C(H+) C(CH3COO--) C(CH3COOH) 方向
正向移动 增大
增大
减少
三、
一元强酸(HA)与一元弱酸(HB)的比较:
1)相同物质的量浓度、相同体积时
比较 项目 C(H+) pH
HA 大 小
中和碱 的能力
相同
与活泼金 属反应产 生H2的量
相同
与金属反 应的开始
速率
稀释相同 倍数后pH
大
小
HB 小 大 相同 相同
小
大
一元强酸(HA)与一元弱酸(HB)的比较: 2)相同PH、相同体积时
V(结合)
t
1、电离平衡:一定条件下(温度、浓度一定),当弱电 解质分子电离成离子的速率等于离子重新结合成分子的 速率时,电离过程就达到了平衡状态,即电离平衡。
❖特征—— 逆、等、动、定、变
人教版高二化学选修四:弱电解质的 电离PPT (24页)
人教版高二化学选修四:弱电解质的 电离PPT (24页)
人教版选修4 化学:3.1 弱电解质的电离 课件(共15张PPT)

3.电离平衡常数的意义[对弱酸(碱)而言]: K值越大 → 越易电离 → 酸(碱)性越强
4.外因对电离平衡常数的影响: 电离平衡常数只与_温度_有关,升_温_时K值增大。
(P150)问题辨析3.以0.1 mol/L的醋酸溶液为例填写下表:
CH3COOH CH3COO-+H+
加水稀释 加冰醋酸
升温 加CH3COONa(s)
上述物质中属于强电解质的有__①__⑤__⑧____, 属于弱电解质的有___②__④_____。
注意:单质和混合物既不是电解质,也不是非电解质。
2.弱电解质的电离平衡
(1)电离平衡的定义:
在一定条件(如温度、浓度)下,当电离的速率 和离子结合为分子的速率相等时,电离过程就达到了 平衡状态。
(2)电离平衡的特征:逆、等、动、定、变。
知识点一:弱电解质的电离平衡
1.弱电解质
(1)概念:
◆◆判断:强电解质溶液中不存在溶质分子,
弱电解质溶液中存在溶质分子( √ )
(2)与物质类别的关系 ①强电解质主要包括_强_酸_、_强_碱_和_大_多_数_盐_。 ②弱电解质主要包括_弱_酸_、_弱_碱_、_少_数_盐_和_水_。
练习:现有下列物质:①硝酸②冰醋酸③氨水 ④Fe(OH)3⑤NaHCO3(s)⑥Al⑦氯水⑧CaCO3
加NaOH(s)
平衡移
动方向
正向 正向 正向 逆向 正向
平衡常
导电
n(H+) c(H+)
数Ka
性
不变 增大 减小 减弱
不变 增大 增大 增强
增大 增大 增大 增强
不变 减小 减小 增强
不变 减小 减小 增强
1.(1)填写下表:
弱电解质
2015-2016学年高二化学人教版选修四课件3.1弱电解质的电离-.ppt

H++HCO- 3 ,K=c(HcC(OH- 3 2)CO·c(3)H+)
服/务/教/师 免/费/馈/赠
第15页,共70页。
返回菜单
化学·选修4
6.查阅资料发现,醋酸、碳酸和硼酸在 25 ℃的电离平衡常 数分别是 1.75×10-5、4.4×10-7(第一步电离)和 5.8×10-10。它们 的酸性强弱顺序是怎样的?有何规律?
4.H2SO3 在水溶液中的电离方程式:H2SO3 这样书写正确吗?为什么?
2H++SO23-,
【提示】 H2SO3 为二元中强酸,为弱电解质,电离过程分步 进行,电离方程式为:H2SO3 H++HSO- 3 ,HSO3- H++SO23-。
服/务/教/师 免/费/馈/赠
第12页,共70页。
返回菜单
自 主 学 习
·
基 础 知 识
解 疑 合 探
·
重 难 释 疑
服/务/教/师 免/费/馈/赠
第1页,共70页。
化学·选修4
学 科 素 养
·
实 验 探 究
课
时 作
业
返回菜单
化学·选修4
第一节 弱电解质的电离
服/务/教/师 免/费/馈/赠
第2页,共70页。
返回菜单
化学·选修4
[学习目标] 1.理解强电解质、弱电解质的概念。(重点) 2. 能描述弱电解质在水溶液中的电离平衡,正确书写电离方程式。 3.理解一定条件下弱电解质的电离平衡移动。(难点)4.了解电离常 数的概念、表达式和意义。 (难点)
H2SO4、HClO4 等;
等;弱碱:NH3·H2O、
强碱:KOH、NaOH、 Cu(OH)2、Fe(OH)3
Ba(OH)2、Ca(OH)2 等 等,水也是弱电解质
人教版高二化学选修四弱电解质的电离1PPT(35页)

C(HA) 最大 变小 不变
C(BOH)
最小
变大 不变
1.定义:在一定条件(如温度、浓度)下,当 弱电解质分子电离成离子的速率和离子重新结
合成分子的速率相等时,电离过程就达到了平
衡状态—电离平衡 弱 弱电解质的溶液里
2. 逆 弱电解质的电离是可逆的
特 等 V电离=V结合≠0 点: 动 电离平衡是一种动态平衡
全部电离的电解质(其离子无 分子化倾向) 。
弱电解质:在水溶液里只有部分电离的
电解质(其离子有分子化倾向) 。
问题探讨
CaCO3、Fe(OH)3的溶解度都很小,CH3COOH、 HNO3的溶解度都很大,它们是强电解质还是弱
电解质? 本质区别:是否完全电离!
CaCO3、HNO3属于强电解质 CH3COOH 、 Fe(OH)3属于弱电解质
H2PO4-
H+ + HPO42-
HPO42-
H+ + PO43-
你推测每一步的电离程度如何变化,为 什么?
•多元弱酸是分步电离的,K1>K2>K3 •多元弱酸的酸性由第一步电离决定。
➢试根据课本中“一些弱酸和弱碱的电离 平衡常数”比较它们的相对强弱。
草酸>磷酸>柠檬酸>碳酸
➢意义:K值越大,电离程度越大, 相应酸 (或碱)的酸(或碱)性越强。
不变
不变
不变
人教版高二化学选修四弱电解质的电 离1PPT( 35页)
人教版高二化学选修四弱电解质的电 离1PPT( 35页)
开始时V离子化 和 V分子化怎样变化? 当V离子化 = V分子化时,可逆过程达 到一种什么样的状态? 你能画出这个过程的V~t图吗?
人教版高二化学选修四弱电解质的电 离1PPT( 35页)
人教版高中化学选修4第三章第一节弱电解质的电离市公开课教学课件共36张PPT[可修改版ppt]
![人教版高中化学选修4第三章第一节弱电解质的电离市公开课教学课件共36张PPT[可修改版ppt]](https://img.taocdn.com/s3/m/2354ca9faef8941ea76e05bd.png)
如:弱酸 HF、H2SO3、HClO、CH3COOH等
弱碱 NH3·H2O Fe(OH)3等
H2O
思考与交流
难溶:BaSO4 Fe(OH)3
强电解质 弱电解质
易溶:HCl CH3COOH
电解质的强弱与其溶解性有何关系? 无关
怎样区分强弱电解质?
溶于水的部分是否完全电离
实验再探
实验3-1:体积相同,浓度相同的盐酸和醋酸 分别与等量镁条反应,并测量溶液的pH值
(2)二元及多元弱酸的电离分步完成,并以第
一步电离为主。
H2CO3
H+ + HCO3-
HCO3-
2.过程与方法: 从化学平衡移动的角度理解电离平衡和移动的结果,
体会重要的学习方法(类比迁移)。 3.情感、态度价值观:
通过本节课的学习,意识到整个自然界实际就是各类物 种相互依存、各种变化相互制约的复杂的平衡体系
知识回顾
①NaCl溶液 ②NaOH
③蔗糖
④Cu
⑤CH3COOH ⑥乙醇
电解质:在水溶液中或熔融状态下能导电的化合物
②⑤
(如:酸、碱、盐、水)
非电解质:在水溶液和熔融状态下都不导电的化合物
③⑥
(如:多数有机物、某些非金属氧化物)
混合物
物质
纯净物
既不是电解质也 不是非电解质
单质
化合物 非电解质 电解质
实验探究
实验3-1:体积相同,浓度相同的盐酸和醋酸分别 与等量镁条反应,并测量溶液的pH值比较其大小
注意 :1.测过的pH试纸要留存在点滴板上
2.观察反应快慢,尤其反应一段时间后速率的变化
项目
与足量镁条反应速率比较 比较溶液的pH大小
1mol/L 1mol/L HCl CH3COOH
弱碱 NH3·H2O Fe(OH)3等
H2O
思考与交流
难溶:BaSO4 Fe(OH)3
强电解质 弱电解质
易溶:HCl CH3COOH
电解质的强弱与其溶解性有何关系? 无关
怎样区分强弱电解质?
溶于水的部分是否完全电离
实验再探
实验3-1:体积相同,浓度相同的盐酸和醋酸 分别与等量镁条反应,并测量溶液的pH值
(2)二元及多元弱酸的电离分步完成,并以第
一步电离为主。
H2CO3
H+ + HCO3-
HCO3-
2.过程与方法: 从化学平衡移动的角度理解电离平衡和移动的结果,
体会重要的学习方法(类比迁移)。 3.情感、态度价值观:
通过本节课的学习,意识到整个自然界实际就是各类物 种相互依存、各种变化相互制约的复杂的平衡体系
知识回顾
①NaCl溶液 ②NaOH
③蔗糖
④Cu
⑤CH3COOH ⑥乙醇
电解质:在水溶液中或熔融状态下能导电的化合物
②⑤
(如:酸、碱、盐、水)
非电解质:在水溶液和熔融状态下都不导电的化合物
③⑥
(如:多数有机物、某些非金属氧化物)
混合物
物质
纯净物
既不是电解质也 不是非电解质
单质
化合物 非电解质 电解质
实验探究
实验3-1:体积相同,浓度相同的盐酸和醋酸分别 与等量镁条反应,并测量溶液的pH值比较其大小
注意 :1.测过的pH试纸要留存在点滴板上
2.观察反应快慢,尤其反应一段时间后速率的变化
项目
与足量镁条反应速率比较 比较溶液的pH大小
1mol/L 1mol/L HCl CH3COOH
人教版化学选修四弱电解质的电离

人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
弱电解质的电离平衡
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
H++A-,平衡时
c ( H+) .c( A-)
Ka=
c(HA)
对于一元弱碱:MOH
M++OH-,平衡时
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
c ( M+).c( OH- )
Kb=
c(MOH)
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
减少 增大 增大 减少
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
二、弱电解质电离程度的表示:
1、电离平衡常数K:
(1)、K表达式: 对于一元弱酸:HA
( BC )
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
【练习】利用右图装做下面的实验:在烧杯里盛半杯乙溶
液,然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
弱电解质的电离平衡
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
H++A-,平衡时
c ( H+) .c( A-)
Ka=
c(HA)
对于一元弱碱:MOH
M++OH-,平衡时
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
c ( M+).c( OH- )
Kb=
c(MOH)
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
减少 增大 增大 减少
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
二、弱电解质电离程度的表示:
1、电离平衡常数K:
(1)、K表达式: 对于一元弱酸:HA
( BC )
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
人教版化学选修四3.1弱电解质的电离 (共14 张PPT) 统编版 课件优 秀课件p pt课件 部编版 课件
【练习】利用右图装做下面的实验:在烧杯里盛半杯乙溶
液,然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
《弱电解质的电离》人教版高二化学选修4PPT课件(第1课时)

分析讨论:
CH3COOH、NH3·H2O是由什么键构成的什么化合物?在水溶液里电解质以 什么形式存在? 某些具有极性键的共价化合物(如弱酸、弱碱和水)
CH3COOH
弱电解质
CH3COO - + H+
写出HF、 NH3·H2O、Fe(OH)3、H2CO3在水溶液中的电离方程式.
小结
离子化合物 共价化合物
例2下列说法正确的是( D )
A、氯水能导电,所以氯气是电解质 B、碳酸钙不溶于水,所以它是非电解质 C、固体磷酸是电解质,所以磷酸在熔化状态下和溶于水时都能导电
课堂练习:
例3 下列电离方程式正确的是( B )
A.NaHCO3=Na++H++CO32-
B.HCO3- H++CO32-
C.KClO3=K Cl-+3O2-
D.NaOH
Na++OH-
例4 在氨水中,NH3·H2O的电离达到平衡的标志是( C)
A.溶液显电中性
B.溶液中无NH3·H2O分子 C.氢氧根离子浓度恒定不变
D.溶液中NH3·H2O与NH4+和OH-共存
人教版高中化学选修4(高二)
第三章 水溶液中的离子平衡
感谢各位的仔细聆听
MENTAL HEALTH COUNSELING PPT
①强酸(6种):HCl、HBr、HI、H2SO4、HNO3、HClO4等。 ②强碱(4种) :NaOH、KOH、Ba(OH)2、Ca(OH)2等。 ③绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等。
常见的弱电解质: ①弱酸:HF、HClO、H2SO3、H3PO4、H2CO3 、 CH3COOH等。 ②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等。 ③水是极弱的电解质。
高中化学选修4人教版3.1弱电解质电离(新课标3)课件品质课件PPT

HC2- < H2C- < HA < HB- < H3C < H2B 对应的酸 (1) H2B (2) C3- HB-(3)B C (4)H3C+3OH- =C3- +3H2O
2HA(过量)+C3- = H2C- + 2A-
长风破浪会有时,直挂云帆济沧海。努力,终会有所收获,功夫不负有心人。以铜为镜,可以正衣冠;以古为镜,可以知兴替;以人为镜,可以明得失。前进的路上 照自己的不足,学习更多东西,更进一步。穷则独善其身,达则兼济天下。现代社会,有很多人,钻进钱眼,不惜违法乱纪;做人,穷,也要穷的有骨气!古之立大 之才,亦必有坚忍不拔之志。想干成大事,除了勤于修炼才华和能力,更重要的是要能坚持下来。士不可以不弘毅,任重而道远。仁以为己任,不亦重乎?死而后已, 理想,脚下的路再远,也不会迷失方向。太上有立德,其次有立功,其次有立言,虽久不废,此谓不朽。任何事业,学业的基础,都要以自身品德的修炼为根基。饭 而枕之,乐亦在其中矣。不义而富且贵,于我如浮云。财富如浮云,生不带来,死不带去,真正留下的,是我们对这个世界的贡献。英雄者,胸怀大志,腹有良策, 吞吐天地之志者也英雄气概,威压八万里,体恤弱小,善德加身。老当益壮,宁移白首之心;穷且益坚,不坠青云之志老去的只是身体,心灵可以永远保持丰盛。乐 其乐;忧民之忧者,民亦忧其忧。做领导,要能体恤下属,一味打压,尽失民心。勿以恶小而为之,勿以善小而不为。越是微小的事情,越见品质。学而不知道,与 行,与不知同。知行合一,方可成就事业。以家为家,以乡为乡,以国为国,以天下为天下。若是天下人都能互相体谅,纷扰世事可以停歇。志不强者智不达,言不 越高,所需要的能力越强,相应的,逼迫自己所学的,也就越多。臣心一片磁针石,不指南方不肯休。忠心,也是很多现代人缺乏的精神。吾日三省乎吾身。为人谋 交而不信乎?传不习乎?若人人皆每日反省自身,世间又会多出多少君子。人人好公,则天下太平;人人营私,则天下大乱。给世界和身边人,多一点宽容,多一份担 为生民立命,为往圣继绝学,为万世开太平。立千古大志,乃是圣人也。丹青不知老将至,贫贱于我如浮云。淡看世间事,心情如浮云天行健,君子以自强不息。地 载物。君子,生在世间,当靠自己拼搏奋斗。博学之,审问之,慎思之,明辨之,笃行之。进学之道,一步步逼近真相,逼近更高。百学须先立志。天下大事,不立 川,有容乃大;壁立千仞,无欲则刚做人,心胸要宽广。其身正,不令而行;其身不正,虽令不从。身心端正,方可知行合一。子曰:“知者不惑,仁者不忧,勇者不惧 进者,不会把时间耗费在负性情绪上。好学近乎知,力行近乎仁,知耻近乎勇。力行善事,有羞耻之心,方可成君子。操千曲尔后晓声,观千剑尔后识器做学问和学 次的练习。第一个青春是上帝给的;第二个的青春是靠自己努力当眼泪流尽的时候,留下的应该是坚强。人总是珍惜未得到的,而遗忘了所拥有的。谁伤害过你,谁 要。重要的是谁让你重现笑容。幸运并非没有恐惧和烦恼;厄运并非没有安慰与希望。你不要一直不满人家,你应该一直检讨自己才对。不满人家,是苦了你自己。 久的一个人,而是心里没有了任何期望。要铭记在心;每一天都是一年中最完美的日子。只因幸福只是一个过往,沉溺在幸福中的人;一直不知道幸福却很短暂。一 看他贡献什么,而不应当看他取得什么。做个明媚的女子。不倾国,不倾城,只倾其所有过的生活。生活就是生下来,活下去。人生最美的是过程,最难的是相知, 幸福的是真爱,最后悔的是错过。两个人在一起能过就好好过!不能过就麻利点分开。当一个人真正觉悟的一刻,他放下追寻外在世界的财富,而开始追寻他内心世 若软弱就是自己最大的敌人。日出东海落西山,愁也一天,喜也一天。遇事不转牛角尖,人也舒坦,心也舒坦。乌云总会被驱散的,即使它笼罩了整个地球。心态便 明灯,可以照亮整个世界。生活不是单行线,一条路走不通,你可以转弯。给我一场车祸。要么失忆。要么死。有些人说:我爱你、又不是说我只爱你一个。生命太 了明天不一定能得到。删掉了关于你的一切,唯独删不掉关于你的回忆。任何事都是有可能的。所以别放弃,相信自己,你可以做到的。、相信自己,坚信自己的目 受不了的磨难与挫折,不断去努力、去奋斗,成功最终就会是你的!既然爱,为什么不说出口,有些东西失去了,就在也回不来了!对于人来说,问心无愧是最舒服 ,表明他人的成功,被人嫉妒,表明自己成功。在人之上,要把人当人;在人之下,要把自己当人。人不怕卑微,就怕失去希望,期待明天,期待阳光,人就会从卑 封存梦想去拥抱蓝天。成功需要成本,时间也是一种成本,对时间的珍惜就是对成本的节约。人只要不失去方向,就不会失去自己。过去的习惯,决定今天的你,所 决定你今天的一败涂地。让我记起容易,但让我忘记我怕我是做不到。不要跟一个人和他议论同�
2HA(过量)+C3- = H2C- + 2A-
长风破浪会有时,直挂云帆济沧海。努力,终会有所收获,功夫不负有心人。以铜为镜,可以正衣冠;以古为镜,可以知兴替;以人为镜,可以明得失。前进的路上 照自己的不足,学习更多东西,更进一步。穷则独善其身,达则兼济天下。现代社会,有很多人,钻进钱眼,不惜违法乱纪;做人,穷,也要穷的有骨气!古之立大 之才,亦必有坚忍不拔之志。想干成大事,除了勤于修炼才华和能力,更重要的是要能坚持下来。士不可以不弘毅,任重而道远。仁以为己任,不亦重乎?死而后已, 理想,脚下的路再远,也不会迷失方向。太上有立德,其次有立功,其次有立言,虽久不废,此谓不朽。任何事业,学业的基础,都要以自身品德的修炼为根基。饭 而枕之,乐亦在其中矣。不义而富且贵,于我如浮云。财富如浮云,生不带来,死不带去,真正留下的,是我们对这个世界的贡献。英雄者,胸怀大志,腹有良策, 吞吐天地之志者也英雄气概,威压八万里,体恤弱小,善德加身。老当益壮,宁移白首之心;穷且益坚,不坠青云之志老去的只是身体,心灵可以永远保持丰盛。乐 其乐;忧民之忧者,民亦忧其忧。做领导,要能体恤下属,一味打压,尽失民心。勿以恶小而为之,勿以善小而不为。越是微小的事情,越见品质。学而不知道,与 行,与不知同。知行合一,方可成就事业。以家为家,以乡为乡,以国为国,以天下为天下。若是天下人都能互相体谅,纷扰世事可以停歇。志不强者智不达,言不 越高,所需要的能力越强,相应的,逼迫自己所学的,也就越多。臣心一片磁针石,不指南方不肯休。忠心,也是很多现代人缺乏的精神。吾日三省乎吾身。为人谋 交而不信乎?传不习乎?若人人皆每日反省自身,世间又会多出多少君子。人人好公,则天下太平;人人营私,则天下大乱。给世界和身边人,多一点宽容,多一份担 为生民立命,为往圣继绝学,为万世开太平。立千古大志,乃是圣人也。丹青不知老将至,贫贱于我如浮云。淡看世间事,心情如浮云天行健,君子以自强不息。地 载物。君子,生在世间,当靠自己拼搏奋斗。博学之,审问之,慎思之,明辨之,笃行之。进学之道,一步步逼近真相,逼近更高。百学须先立志。天下大事,不立 川,有容乃大;壁立千仞,无欲则刚做人,心胸要宽广。其身正,不令而行;其身不正,虽令不从。身心端正,方可知行合一。子曰:“知者不惑,仁者不忧,勇者不惧 进者,不会把时间耗费在负性情绪上。好学近乎知,力行近乎仁,知耻近乎勇。力行善事,有羞耻之心,方可成君子。操千曲尔后晓声,观千剑尔后识器做学问和学 次的练习。第一个青春是上帝给的;第二个的青春是靠自己努力当眼泪流尽的时候,留下的应该是坚强。人总是珍惜未得到的,而遗忘了所拥有的。谁伤害过你,谁 要。重要的是谁让你重现笑容。幸运并非没有恐惧和烦恼;厄运并非没有安慰与希望。你不要一直不满人家,你应该一直检讨自己才对。不满人家,是苦了你自己。 久的一个人,而是心里没有了任何期望。要铭记在心;每一天都是一年中最完美的日子。只因幸福只是一个过往,沉溺在幸福中的人;一直不知道幸福却很短暂。一 看他贡献什么,而不应当看他取得什么。做个明媚的女子。不倾国,不倾城,只倾其所有过的生活。生活就是生下来,活下去。人生最美的是过程,最难的是相知, 幸福的是真爱,最后悔的是错过。两个人在一起能过就好好过!不能过就麻利点分开。当一个人真正觉悟的一刻,他放下追寻外在世界的财富,而开始追寻他内心世 若软弱就是自己最大的敌人。日出东海落西山,愁也一天,喜也一天。遇事不转牛角尖,人也舒坦,心也舒坦。乌云总会被驱散的,即使它笼罩了整个地球。心态便 明灯,可以照亮整个世界。生活不是单行线,一条路走不通,你可以转弯。给我一场车祸。要么失忆。要么死。有些人说:我爱你、又不是说我只爱你一个。生命太 了明天不一定能得到。删掉了关于你的一切,唯独删不掉关于你的回忆。任何事都是有可能的。所以别放弃,相信自己,你可以做到的。、相信自己,坚信自己的目 受不了的磨难与挫折,不断去努力、去奋斗,成功最终就会是你的!既然爱,为什么不说出口,有些东西失去了,就在也回不来了!对于人来说,问心无愧是最舒服 ,表明他人的成功,被人嫉妒,表明自己成功。在人之上,要把人当人;在人之下,要把自己当人。人不怕卑微,就怕失去希望,期待明天,期待阳光,人就会从卑 封存梦想去拥抱蓝天。成功需要成本,时间也是一种成本,对时间的珍惜就是对成本的节约。人只要不失去方向,就不会失去自己。过去的习惯,决定今天的你,所 决定你今天的一败涂地。让我记起容易,但让我忘记我怕我是做不到。不要跟一个人和他议论同�
高中化学选修4人教版3.1弱电解质电离(新课标3)课件优品课件ppt

C3- 大于 HC2- 大于 A-大于H2C- ----------- ①
H2B(少量)+2A- = B2- + 2HA 得质子能力: A- 大于 B2-
H2B: B2- 大于 HBA- 大于 B2- 大于 HB- ---------------②
H2B(少量)+ H2C- ==HB- + H3C
第一节弱电解质的电离平衡 (3课时) 一、电离常数
1、概念:一定条件下达到电离平衡时,弱电解 质电离形成的各种离子的 浓度 乘积与溶液中
未电离的分子的 浓度 之比是一个常数,这
个常数成为电离常数,弱酸和弱碱的电离常数分
别用Ka和Kb表示 2、表示方法 AB
A+ + B -
K c(A)c(B) c(AB)
(4)比较离子结合质子的能力大小 一般弱酸的电离常数越小,电离程度越弱,弱 酸的酸性越弱,此时弱酸根离子结合氢离子的 能力就越 强 。
已知醋酸的酸性比碳酸强,比较CO32- > HCO3-
> CH3COO-结合H+的能力强弱比较
解释2CH3COOH+Na2CO3== 2CH3COONa +H2O+CO2(强酸制弱酸)的原因
H2S + CO32-
== HS-+ HCO3-
5、总结电离常数与电离程度的联系和区别
(1)公式不同:
% c(H ) 1% 0 0 c(C3 C HO ) 1 O % 00
c(C3 C HO ) OH c(C3 C HO ) OH
Ka
c(H)c(CH 3COO ) c(CH 3COO ) H
(2)影响因素不同
HC2- < H2C- < HA < HB- < H3C < H2B 对应的酸 (1) H2B (2) C3- HB-(3)B C (4)H3C+3OH- =C3- +3H2O
H2B(少量)+2A- = B2- + 2HA 得质子能力: A- 大于 B2-
H2B: B2- 大于 HBA- 大于 B2- 大于 HB- ---------------②
H2B(少量)+ H2C- ==HB- + H3C
第一节弱电解质的电离平衡 (3课时) 一、电离常数
1、概念:一定条件下达到电离平衡时,弱电解 质电离形成的各种离子的 浓度 乘积与溶液中
未电离的分子的 浓度 之比是一个常数,这
个常数成为电离常数,弱酸和弱碱的电离常数分
别用Ka和Kb表示 2、表示方法 AB
A+ + B -
K c(A)c(B) c(AB)
(4)比较离子结合质子的能力大小 一般弱酸的电离常数越小,电离程度越弱,弱 酸的酸性越弱,此时弱酸根离子结合氢离子的 能力就越 强 。
已知醋酸的酸性比碳酸强,比较CO32- > HCO3-
> CH3COO-结合H+的能力强弱比较
解释2CH3COOH+Na2CO3== 2CH3COONa +H2O+CO2(强酸制弱酸)的原因
H2S + CO32-
== HS-+ HCO3-
5、总结电离常数与电离程度的联系和区别
(1)公式不同:
% c(H ) 1% 0 0 c(C3 C HO ) 1 O % 00
c(C3 C HO ) OH c(C3 C HO ) OH
Ka
c(H)c(CH 3COO ) c(CH 3COO ) H
(2)影响因素不同
HC2- < H2C- < HA < HB- < H3C < H2B 对应的酸 (1) H2B (2) C3- HB-(3)B C (4)H3C+3OH- =C3- +3H2O
人教版选修四弱电解质的电离课件
A、电离程度增大
CD
B、溶液中离子总数增多
C、溶液导电性增加
D、溶液中醋酸分子增多
人教版选修四弱电解质的电离
34
4:体积和pH都相等的盐酸和醋酸 溶液的导电能力___相__同______,升高相
同温度后导电能力 _____醋__酸__大__于__盐__酸_______。
人教版选修四弱电解质的电离
35
不同电解质电离程度不同
人教版选修四弱电解质的电离
4
思考:如何用实验证明在溶液中HCl是完全电离 的而CH3COOH是不完全电离的? 实验3-1:体积相同,浓度相同的盐酸和醋酸溶液
的pH值及与等量镁条反应。
溶液pH
1mol/L HCl
小 (0)
1 mol/L CH3COOH
大(2.4)
与镁反应 现象
当外界条件改变时符合
“勒夏特列原理” 人教版选修四弱电解质的电离
20
4、影响电离平衡的因素 ①温度 电离过程是吸热过程,升高温度,
平衡向电离方向移动
人教版选修四弱电解质的电离
21
4、影响电离平衡的因素
②浓度
当电离达到平衡时, 加水稀释向电离的方向移动,电离程 度增大, 增加弱电解质浓度,向电离的方向移 动,但电离程度减小.
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
人教版选修四弱电解质的电离
36
29
1)等体积,等浓度的盐酸和醋酸
1mol/L HCl 1mol/L CH3COOH
A
B
C(H+)
A>B
与Zn反应快 慢
A>B
与足量Zn反
应产生H2量
A=B
人教版选修4 化学:3.1 弱电解质的电离 课件(共35张PPT)
醋酸电离过程中正逆反应速率随时间的变化关系图像 V(速率)
V电离 V结合
V电离=V结合≠ 0
电离平衡状态
t1
t (时间)
【交流研讨】 根据上图及化学平衡理论,分析一元弱酸(HA) 一元 弱碱(BOH)的电离平衡过程,并完成问题:
式 1.写出弱酸,弱碱的电离方程
2.填写下表
0 变大 不变
0 变大 不变
(4) Cu(OH)2
H + +ClO=K + +H + +SO42-
= Ca2+ +CO32-
Cu 2+ +2OH-
:
3.0.1mol/L的CH3COOH溶液中
CH3COOH
CH3COO- + H+对于该平
衡,下列叙述正确的是( B )
A.加水时,平衡向逆反应方向移动
B.加少量NaOH固体,平衡向正反应方向移动
水溶液中存在 的粒子
阴、阳离子,水分子
共价键
部分电离,可逆, 用“ ”表示 阴、阳离子,弱电 解质分子,水分子
常见化合物 强酸、强碱、绝大多数盐
弱酸、弱碱、两性 物质、某些氢化物
实例
H2SO4、BaCl2、KOH、 K2S2O8
H3PO4、NH3·H2O、 Al(OH)3、H2O、H2S
【注意】 强弱电解质≠溶液的导电能力强弱 强弱电解质≠物质的溶解性大小
(1)内因:电解质本身的性质。通常电解质越弱电离程 度越小。
(2) 影响电离平衡移动的条件——外因 ①加入试剂:加入增大弱电解质电离出离子浓度的物质,
使电离平衡向逆方向移动
加入减小弱电解质电离出离子浓度的物质, 使电离平衡向电离方向移动
人教版选修4 化学:3.1 弱电解质的电离 课件(共28张PPT)

④ 酸式盐的电离 a 强酸的酸式盐完全电离
NaHSO4 Na H SO42
b 弱酸的酸式盐第一步完全电离 NaHCO3 Na HCO3 HCO3 H CO32
习题9 写出下列各物质的电离方程式
1. NH3.H2O
NH4++OH-
2. HClO H++ClO-
3. H2SO3
H++HSO3-
Ⅱ、当温度一定时,其电离常数是定值。
Ⅲ、电离常数的大小反映强弱电解质的电离程度。K值 越大,弱电解质越易电离,其对应的弱酸(弱碱)越强。
Ⅳ、多元弱酸是分步电离的,一级电离常数程度最大, 一般有K1 》K2 》K3。
3.电离常数的意义:判断弱酸、弱碱的相对强弱。
混合物
三、电解质的电离方程式
1.强电解质 完全电离,符号选用“=”
HCl H Cl NaOH Na OH
2.弱电解质
部分电离,符号选用“ ”
①
② 多元弱碱分步Fe电(OH)离3 F,e3 但3OH用一步电离表示。
③ 两性氢氧化物双向电离
H
AlO
2
H
2O
Al(OH )3
Al3 3OH
②浓度:增大电解质分子的浓度或减少相应离子的浓度,都会 使弱电解质分子向电离为离子的方向移动。加水稀释弱电解 质溶液,电离平衡向右移动,电离程度增大。
③同离子效应 在弱电解质溶液中加入同弱电解质具有相同离 子的强电解质时,电离平衡向逆反应方向移动,抑制电离。
④化学反应 在弱电解质溶液中加入能与弱电解质电离产生 的某种离子反应的物质时,可使平衡向电离的方向移动,促 进电离。
习题3
2. 下列说法是否正确?为什么?
人教版化学选修4第三章第一节---弱电解质的电离优秀课件PPT

实例探究:影响电离平衡因素?
在醋酸溶液中,存在如下电离平衡:
CH3COOH
H+ + CH3COO—
加入固体NaOH,电离平衡向___正___反应方向
移动,c(H+)_____减__小_____
加入固体CH3COONa,电离平衡向___逆___反 应方向移动,c(H+)___减__小_______
加水,电离平 衡向 正
D 达到电离平衡状态的是
()
A.醋酸的浓度达到1 mol·L-1
B.H+的浓度达到0.5 mol·L-1
C.醋酸分子的浓度、醋酸根离子的浓度、
H+的浓度均为0.5 mol·L-1
D.醋酸分子电离成离子的速率和离子重新 结合成醋酸分子的速率相等
• 2.在醋酸溶液中,CH3COOH的电离达
到平衡的标志是
人教版高中化学
选修4 化学反应原理 第三章 第一节
弱电解质的电离
教学目标:
• 知识与技能
(1)能描述弱电解质在水溶液中的电离平衡; (2)掌握外界因素对电离平衡的影响。
❖ 过程与方法
在运用化学平衡原理分析各种因素对弱电解质的电离平衡影响过程 中,提高迁移应用和综合解决问题的能力,初步形成从微观角度 分析溶质在水溶液中行为的思维方法。
❖情感态度与价值观
(1)感受弱电解质电离平衡中的对立统一关系;
(2)感悟化学的学习价值和实用价值。
教学重难点:
❖ 教学重点
弱电解质在水溶液中的的电离平衡; 影响电离平衡的因素。
❖ 教学难点
电离平衡的概念; 从微观角度认识和分析溶质在水溶液中行为的思维方法。
一、弱电解质的电离平衡
- 电电离离
CH3COOH 结结合合 CH3COO + H+
人教版高中化学选修4第三章第一节 弱电解质的电离 课件(共22张PPT)

三、电离平衡常数
1.表达式
(1)对于一元弱酸 HA: ++A-,平衡常数 K=
C(H+) ·C(A–)
C(HA) 。
(2)对于一元弱碱 BOH:
C(B+) ·C(OH–)
++OH-,平衡常数 K= C(BOH) 。
2.特点
(1)电离平衡常数只与温度有关,升温,K 值 增大 。
(2)多元弱酸的各级电离平衡常数的大小关系是 K1≫K2≫K3,
2.电离平衡的移动---------分清主次
溶液存在 BOH===B++OH-
(×)
(2010·福建理综-10C) (3)醋酸在醋酸钠溶液中电离的程度大于在纯水中电离
的程度
(×)
(2010·全国理综Ⅱ-8C)
(4)某醋酸溶液的 pH=a,将此溶液稀释 1 倍后,溶液的
pH=b,则 a>b
(×)
(2010·全国理综Ⅰ-9A)
•
典型例题分析:
• 基本题型 1.强弱电解质比较---------抓本质区别
D常温下,将物质的量浓度相同的醋酸溶液与氢氧 化钠溶液等体积混合后恰好中和
老师, 看我的!
1.(2011·全国卷)将浓度为0.1mol·L-1HF溶
液加水不断稀释,下列各量始终保持增
大的是( D )
• A C(H+)
B Ka(HF)
• C C(F-) / C(H+)
D C(H+) / C(HF)
量的氢氧化钠
• C.pH=3的两溶液稀释100倍,pH都为5 • D.两溶液中分别加入少量对应的钠盐,c(H+)
均明显减小
5.判断正误:
(1)0.1mol/ LCH3COOH溶液的PH 〉1,原因是
人教版高中化学选修第一节《弱电解质的电离》PPT课件

人教版高中化学选修4第三章 第一节《弱电解质的电离》(共33 张PPT)
人教版高中化学选修4第三章 第一节《弱电解质的电离》(共33 张PPT)
单击此处添加文本具体内容
人教版高中化学选修4第三章 第一节《弱电解质的电离》(共33 张PPT)
什么是电离
• 电解质溶于水或者受热熔化,解离成自由移 动的离子的过程称为电离
《弱电解质的电离》
高二一班
褚文静
课标要求
•1.能描述弱电解质在水溶液中的电离 平衡。 •2.了解酸碱电离理论。
课标解读
•1.了解电解质、非电解质及强、弱电 解质的概念。 •2.理解电解质的电离平衡及影响因素。 •3.了解酸、碱电离的特点
单击此处添加文本具体内容
1.电解质与非电解质
• 在水溶液或熔融状态下能导电的电解质都不能导电的非 电解质化合物
人教版高中化学选修4第三章 第一节《弱电解质的电离》(共33 张PPT)
逆 等 动
特点: 定
变
(1)与化学平衡一样,电离平衡也是动态平衡。 (2)化学平衡原理也适用于电离平衡,当浓度等条 件改变时,弱电解质的电离平衡也会发生移动。
• 电解质溶于水时是由于水分子的作用而电离;熔融时是由于热能破坏化学键而电离成自由移动的 离子,都不是因通电而电离的。
人教版高中化学选修4第三章 第一节《弱电解质的电离》(共33 张PPT)
人教版高中化学选修4第三章 第一节《弱电解质的电离》(共33 张PPT)
人教版高中化学选修4第三章 第一节《弱电解质的电离》(共33 张PPT)
单击此处添加文本具体内容
人教版高中化学选修4第三章 第一节《弱电解质的电离》(共33 张PPT)
为什么醋酸溶于水时只有部 分分子电离成H+和CH3COO-呢?
人教版化学选修四弱电解质的电离ppt

C.c(OH-)/c(NH3·H2O)
D.c(NH4+)/c(OH-)
5、将c(H+)=1×10-2mol/L的CH3COOH和HCl 溶液分别稀释100倍,稀释后两溶液的H+的物质
A 的量浓度分别为a和b,则a和b的关系为( )
A、a>b
B、a<b
C、a=b
D、不能确定
6、pH相同的盐酸和醋酸,分别用蒸馏水稀释至
根据实验现象,讨论下列问题
(1)镁条和酸的反应的实质是什么?影响反应
速率的因素是什么?Mg+2H+ === Mg2++H2
(2)当酸溶液的物质的量浓度相等时,溶液中的 H+浓度是否相等?怎么判断?
反应速率不同,pH不同,说明盐酸和醋酸 中的H+浓度是不同的。
(3)为什么相同体积、相同浓度的盐酸和醋酸中, H+浓度却不同?
Kb=
c(MOH)
5、意义:K值越大,电离程度越大,相应酸 (或 碱)的酸(或碱)性越强。K值只随温度变化。
实验3-2: 向两支分别盛有0.1mol/L醋酸和饱和硼酸溶液 的试管中滴加等浓度Na2CO3溶液,观察现象。
CH3COOH+Na2CO3=
3、多元弱酸的电离:
例:H2CO3
H++HCO3-
离子的电解质。
CH3COOH H++CH3COO-
2、常见强、弱电解质
Ø常见的强电解质:
强酸、强碱、大部分盐、 大部分金属氧化物、活泼金属过氧化物
Ø常见的弱电解质:
弱酸、弱碱、水、极少数的盐(HgCl2)
三、电解质的电离
1、电离
电解质溶于水或受热熔化时,离解成 自由移动的离子的过程叫做电离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.
能描述弱电解质在水溶液中的电离平衡,正确书写电离方程式。 3.理解一定条件下弱电解质的电离平衡移动。(难点)4.了解电离常 数的概念、表达式和意义。 (难点)
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
一、强弱电解质 1.电解质与非电解质
水溶液中或熔融状态下 (1)电解质:在水溶液中或熔融状态下能导电的化合物。
应的现象 泡 溶液的 pH 结论 0
缓慢 产生气泡 反应缓慢,
2.4
相同浓度的盐酸和醋酸,HCl 和 CH3COOH
不同 的电离程度不同
免/费/馈/赠
服/务/教/师
返回菜单
化学· 选修4
(2)强电解质和弱电解质。
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
1.25 ℃时 1 mol· L-1 CH3COOH 溶液中,c(H+)是 1 mol· L-1 吗?为什么?
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
【解析】
H2S 是二元弱酸,分步电离,所以 A 项错误(一般
+ -
只写第一步: H2S H + HS ) ; NaHCO3 为弱酸酸式盐,其中 HCO3 不能拆分为离子形式,B 项错误,应为 NaHCO3===Na + HCO3 ;CH3COOH 为弱酸,部分电离,其电离方程式“===”应改 为“ ” ,D 项错误。
【答案】 C
- - +
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
3.下列叙述中,能证明某物质是弱电解质的是( A.熔融时不导电 B.水溶液的导电能力很差 C.不是离子化合物,而是极性共价化合物 D.溶液中已电离的离子和未电离的分子共存
)
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
【解析】
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
6.查阅资料发现,醋酸、碳酸和硼酸在 25 ℃的电离平衡常 数分别是 1.75×10 5、4.4×10 7(第一步电离)和 5.8×10
- - -10
。它们
的酸性强弱顺序是怎样的?有何规律?
【提示】 醋酸>碳酸>硼酸。K 值越大,酸性越强。
服/务/教/师
在水溶液里都能产生自由移动的离子,都是 电解质 只存在电解质电离产 大量存在弱电解质分 生的阴、阳离子,不 子,少量存在弱电解 存在电解质分子 质电离产生的离子
不同点
粒子存在 的形式
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
不可逆,不存在电离平 可逆, 存在电离平衡, 衡,电离方程式用“===” 电离方程式用“ ” 完全电离 离子键或某些极性键 不完全电离 某些极性键
判断强、弱电解质的关键,是在水溶液里能否完
全电离,是否存在电离平衡。
【答案】 D
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
4 .将下列物质按要求进行分类:①氢氧化钠、②氨水、③ NH3·H2O、④乙醇、⑤HCl、⑥稀硝酸、⑦醋酸、⑧氯化钠、⑨ 氯气 电解质 非电解质 强电解质 弱电解质
服/务/教/师
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
5.醋酸和碳酸均存在电离平衡。请写出醋酸和碳酸电离(第一 级电离)的电离方程式,并写出对应的电离平衡常数的表达式。
【提示】 CH3COOH CH3COO-+H+,K=
c(CH3COO-)· c(H+) c(CH3COOH)
- + c ( HCO ) · c ( H ) 3 + - H2CO3 H +HCO3 ,K= c(H2CO3)
【提示】 小于 1 mol· L-1,因为 CH3COOH 是弱电解质,在 水溶液中部分电离。
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
2.NaCl 是强电解质,所以 NaCl 在任何状态下均可导电,这 种说法正确吗?
【提示】 不正确。NaCl 固体由于未发生电离不能导电。
服/务/教/师
免/费/馈/赠
【答案】
服/务/教/师
C
返回菜单
免/费/馈/赠
化学· 选修4
3.(双选)把 0.05 mol NaOH 固体分别加入下列 100 mL 液体 中,溶液的导电能力变化不大的是( A.自来水 C.0.5 mol/L 醋酸溶液 )
B.0.5 mol/L 盐酸 D.0.5 mol/L 氯化铵溶液
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
【答案】
服/务/教/师
(1)×
(2)×
(3)√
(4)×
返回菜单
免/费/馈/赠
化学· 选修4
2.下列电离方程式中,正确的是( A.H2S 2H +S2
+ -
)
B.NaHCO3 Na +H +CO2 3
+ +
-
C.NaCl===Na +Cl
+
-
D.CH3COOH===CH3COO +H
-
+
【答案】
AD
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
第 4 步运用——精选习题,落实强化 1.下列物质的分类组合全部正确的是( 选项 强电解质 A B C D NaCl 弱电解质 HCl )
非电解质 CO2 CCl4 Cu C2H5OH
NaHCO3 NH3·H2O Ba(OH)2 H2SO4 BaCO3 NaOH
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
【解析】
A 项,HCl 为强电解质;C 项,BaCO3 为强电解
质,Cu 既不是电解质也不是非电解质;D 项,NaOH 为强电解质。
【答案】 B
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
2.下列关于强弱电解质的叙述中正确的是(
)
A.强电解质都是离子化合物,弱电解质都是共价化合物 B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有 溶质分子 D.强电解质的导电能力强,弱电解质的导电能力弱
化学· 选修4
3.一定条件下弱电解质达到电离平衡后,还会继续电离吗?
【提示】 一定条件下,弱电解质达到电离平衡后,还会继
续电离,只是电离成离子的速率和离子结合成分子的速率相等。
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
- 4.H2SO3 在水溶液中的电离方程式:H2SO3 2H++SO2 3 ,
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
2.强电解质其溶液导电能力一定强吗? 【提示】 不一定。
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
3.难溶物 BaSO4、CaCO3 等是强电解质吗? 【提示】学· 选修4
第 2 步阐述——要点归纳,深化知识 1.强电解质、弱电解质的比较 比较项目 相同点 强电解质 弱电解质
返回菜单
服/务/教/师
免/费/馈/赠
化学· 选修4
【解析】 A 项中若醋酸完全电离,则 c(H+)=1 mol/L,而现 在 c(H+)=0.01 mol/L,说明醋酸部分电离,为弱电解质;C 项是
与强碱的反应, 不能说明其电离程度的大小; D 项是在相同条件下, 比较二者导电性强弱,醋酸溶液的导电性弱,说明醋酸溶液中离 子浓度小,即电离程度小,盐酸中的 HCl 是完全电离的,故说明 醋酸是部分电离,为弱电解质。
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
【解析】 本题需要在深刻理解强弱电解质的异同的基础上
弄清强弱电解质与结构的关系,采用举例法来解答。选项 A 中, 可举出 HCl、HNO3 是强电解质来加以否定;选项 B 中,可举出 BaSO4、CaCO3 为强电解质(尽管它们难溶于水,但它们溶于水的 部分是完全电离的)来加以否定;选项 D 中,若强电解质溶液的浓 度很小时,其导电能力也会很弱,从而否定之;仅有选项 C 的说 法是正确的,因强电解质在水溶液中完全电离为离子,不存在溶 质分子,而弱电解质在水溶液中只能部分电离,溶液中还存在溶 质分子。故选 C。
化学· 选修4
2.有关电离常数的注意事项 (1)电离常数的大小由物质本身的性质决定,同一温度下,不 同弱电解质的电离常数不同,K 值越大,电离程度越大。
(2)同一弱电解质在同一温度下改变浓度时,其电离常数不变。
(3)电离常数 K 只随温度的变化而变化,升高温度,K 值增大。 (4)多元弱酸电离常数: K1≫K2≫K3,其酸性主要由第一步电 离决定,K 值越大,相应酸的酸性越强。
返回菜单
化学· 选修4
2.电解质强、弱与物质导电性、溶解性的关系 (1)电解质的强弱与溶液导电能力没有必然联系。如果某强电 解质溶液浓度很小,那么它的导电能力就很弱,溶液导电能力大 小取决于离子浓度大小和离子带电荷多少。 (2)电解质的强、弱与其溶解度无关。某些难溶(或微溶)于水的 盐(如 AgCl、BaSO4 等)溶解度很小,但溶于水的部分却是完全电 离的,它们仍属于强电解质。
化学· 选修4
自 主 学 习
学 科 素 养 实 验 探 究
·
基 础 知 识
·
解 疑 合 探
课 时 作 业
·
重 难 释 疑
服/务/教/师
免/费/馈/赠
返回菜单
化学· 选修4
第一节
弱电解质的电离
服/务/教/师
免/费/馈/赠
