O + H2+ - OH+ +
羧酸及其衍生物和取代酸

O R1 C NH2 NH3
3.氨解:产物为酰胺。
O R1 C Cl NH4Cl
O R1 C O
O C R2 R4 R3 N H O R1 C R4 N R3 +
O R2 C ONH4
O R1 C O R2 R 2 OH
O R1 C NH2 NH3
4.克莱森(Claisen)缩合反应:得到β-羰基酯 例如:
⑷ 酰胺的生成:
O R 1 C OH O O
+
NH3
R 1 C O NH4
△ -H2O
O
R 1 C O─NH2
△ -H2O
R1 C
+H2O N
R 1 C NH2
二元酸也有上述反应。 3.还原:用催化氢化法(H2/Pt)难以还原,LiAlH4可以还原羧基为羟基。
O R C OH LiAlH4 R CH2 OH
O CH2 CH2 C O Cl
PCl5 H3C ( CH 2) 6 COOH H3C ( CH 2) 6 C Cl
⑶ 酯的生成:
O R1 COOH
+
R2 OH
浓 H2SO4
△
R1 C
O
R2
+H2O
上述反应为可逆反应。提高反应速度的措施有两个: a 加入酸作为催化剂; b 升高温度。 提高反应的产率的措施有两个:a 增加反应物醇(一方面是因为副反应主要 来自于醇另一方面是因为醇相对于酸来说较为便宜);b 移去产物,使平衡向 右移动。
名称(俗名) 熔点 沸点 溶解度(克/100克水) PKa
甲酸(蚁酸) 乙酸(醋酸) 苯甲酸(安息香酸) 乙二酸(草酸) 丙二酸(缩苹果酸) 丁二酸(琥珀酸) 顺丁烯二酸(马来酸) 反丁烯二酸(延胡索酸) 邻苯二甲酸(酞酸)
氧化还原反应方程式100个

氧化还原反应方程式100个氧化还原反应方程式100个1. 2Na + Cl2 -> 2NaCl2. 2Al + 3CuCl2 -> 2AlCl3 + 3Cu3. Zn + H2SO4 -> ZnSO4 + H24. 3Fe + 4H2O -> Fe3O4 + 4H25. 2K + Br2 -> 2KBr6. 2H2 + O2 -> 2H2O7. 2Mg + O2 -> 2MgO8. PbO2 + 2HCl -> PbCl2 + H2O + Cl29. 2H2O2 -> 2H2O + O210. 2H2 + 2Br2 -> 4HBr11. CH4 + 2O2 -> CO2 + 2H2O12. 2Cu + O2 -> 2CuO13. 2KBr + Cl2 -> 2KCl + Br214. 2Al + 3Cl2 -> 2AlCl315. CuSO4 + Zn -> ZnSO4 + Cu16. 4NH3 + 5O2 -> 4NO + 6H2O17. 2HCl + Zn -> ZnCl2 + H218. HgO -> Hg + O219. 2H2O + 2K -> 2KOH + H220. 2CuO + C -> 2Cu + CO221. 2Na + H2O -> 2NaOH + H222. 2AgNO3 + Cu -> Cu(NO3)2 + 2Ag23. Fe2O3 + 3CO -> 2Fe + 3CO224. 2HCl + Cu -> CuCl2 + H225. H2O2 + Cl2 -> 2HCl + O226. H2SO4 + 2NaOH -> Na2SO4 + 2H2O27. 2HgO -> 2Hg + O228. 2Ag + H2S -> Ag2S + H229. 2K + 2H2O -> 2KOH + H230. 2NaOH + Cl2 -> NaCl + NaClO + H2O31. 2NO2 + H2O -> HNO3 + HNO232. 2H3PO4 + 3Ca(OH)2 -> Ca3(PO4)2 + 6H2O33. 2HCl + H2S -> 2H2O + S34. 2Na + 2H2O -> 2NaOH + H235. 5Fe2O3 + 3CO -> 10Fe + 3CO236. 4HCl + MnO2 -> MnCl2 + 2H2O + Cl237. 2KClO3 -> 2KCl + 3O238. 2H2O + 2Na -> 2NaOH + H239. 2Fe + 6HCl -> 2FeCl3 + 3H240. 2H2O2 + 2KOH -> 2H2O + 2K2O241. 2NaOH + H2SO4 -> Na2SO4 + 2H2O42. 2HCl + CaCO3 -> CaCl2 + CO2 + H2O43. 2C2H2 + 5O2 -> 4CO2 + 2H2O44. Fe + CuSO4 -> FeSO4 + Cu45. 4HNO3 + Cu -> Cu(NO3)2 + 2H2O + 2NO246. 2H2 + O2 -> 2H2O47. H2O2 + KMnO4 + H2SO4 -> O2 + H2O + K2SO4 + MnSO448. 2AgNO3 + Zn -> Zn(NO3)2 + 2Ag49. 3Na2O2 + 6CO2 -> 3Na2CO3 + 3O250. 2HCl + Na2S2O3 -> 2NaCl + S + SO2 + H2O51. 2Cl2 + Na2S2O3 -> 2NaCl + S2O652. Na2CO3 + H2SO4 -> Na2SO4 + H2O + CO253. C + 2H2O -> CO2 + 2H254. Zn + 2AgNO3 -> Zn(NO3)2 + 2Ag55. C3H8 + 5O2 -> 3CO2 + 4H2O56. BaCl2 + Na2SO4 -> BaSO4 + 2NaCl57. 2CH3OH + 3O2 -> CO2 + 4H2O58. H2O2 + 2KMnO4 + 3H2SO4 -> 3O2 + 2K2SO4 + 2MnSO4 + 4H2O59. Pb + PbO2 + 2H2SO4 -> 2PbSO4 + 2H2O60. C6H12O6 + 6O2 -> 6CO2 + 6H2O61. Zn + 2HCl -> ZnCl2 + H262. 2HgS + O2 -> 2HgO + 2SO263. 2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 8H2O + 5Cl264. Pb + CuCl2 -> PbCl2 + Cu65. 2H3PO4 + 3Mg(OH)2 -> Mg3(PO4)2 + 6H2O66. 2KBr + F2 -> 2KF + Br267. 4C + 5O2 -> 2CO2 + 2CO68. CuO + H2SO4 -> CuSO4 + H2O69. BaCl2 + H2SO4 -> BaSO4 + 2HCl70. Na2CO3 + Ca(OH)2 -> CaCO3 + 2NaOH71. 2Na + Cl2 -> 2NaCl72. 6NaOH + 3Cl2 -> 5NaCl + NaClO3 + 3H2O73. 2AgNO3 + BaCl2 -> 2AgCl + Ba(NO3)274. 5H2O2 + 2MnO2 -> 2H2O + 5O2 + Mn2O375. SO2 + O2 -> SO376. FeS2 + 8O2 -> Fe2O3 + 4SO277. H2O2 + 2FeCl3 -> 2HCl + 2FeCl2 + H2O + Cl278. 4HNO3 + MnO2 -> Mn(NO3)2 + 2H2O + 2NO2 + O279. 2HNO3 + Cu -> Cu(NO3)2 + H2O + NO280. C2H6 + O2 -> CO2 + H2O81. 2FeCl3 + SnCl2 -> 2FeCl2 + SnCl482. 2C8H18 + 25O2 -> 16CO2 + 18H2O83. 2Na + H2 -> 2NaH84. Zn + HCl -> ZnCl2 + H285. 3Cl2 + 6NaOH -> 5NaCl + NaClO3 + 3H2O86. 6NaOH + 3H2 + 2Al -> 2Al(OH)3 + 3Na2O87. C6H8O6 + O2 -> CO2 + H2O88. H2O2 + 2KI -> 2KOH + I2 + H2O89. 2Cr + 3HCl -> 2CrCl3 + 3H290. 4Al + 3O2 -> 2Al2O391. Fe3O4 + 4H2SO4 -> 3FeSO4 + 4H2O92. 2HCl + Na2S2O3 -> 2NaCl + S + SO2 + H2O93. 2ZnS + 3O2 -> 2ZnO + 2SO294. 2NaOH + FeCl2 -> 2NaCl + Fe(OH)295. NH4NO3 -> N2O + 2H2O96. 2C8H18 + 17O2 -> 16CO2 + 18H2O97. 4Fe + 3O2 -> 2Fe2O398. SnCl2 + 2HCl -> SnCl4 + H299. H2 + Cl2 -> 2HCl100. 2H2 + O2 -> 2H2O氧化还原反应是化学中非常重要的类型之一。
基础有机化学(邢其毅、第三版)第四章PPT4

§4 烯烃§4.1 烯烃的结构1、双键(C= C)的结构π键特点: a.π键不能独立存在;与σ键共存; b.π键不能旋转;产生几何异构; c, π键富含电子;易与缺电子试剂反应; d, π键受原子核控制弱;易被极化。
CH2 = CCF3 CF3H H C H H H C C CF3 CF3H C H-CF3 为吸电子基团 2. 几何异构 A. 产生条件 a. 分子中有阻碍旋转的因素 b. 被阻碍旋转的碳原子上连有不同基团C H3 C = C H cis a C = C b♦ 产生顺反异构的条件:C H3 HH C = C C H3 tra n s c dC H3 Ha ≠ b;c ≠ d总结 —— 异构体的分类几何异构 立体异构 对映异构 构型异构 部位异构 异构 构象异构 链异构 官能团异构B. 几何异构的标识a. 顺反命名法 相同基团在同侧时称为顺(cis); 在异侧时称为反(trans);CH3 C=CCH3H C=CCH3H H 顺-2-丁烯H CH3 反-2-丁烯C1的两个基团与C2的两个基团相同时, 常使用该命名法.b. Z/E标识法 (普遍适用)含不同基团时,先按定序规则排大小, 两个大的在同侧时为Z,异侧为E1Cl C=CCH3 2Cl C=C CH3C 2H5 CH32C 2H5 1 CH3 E-2-氯-3-甲基-2-戊烯Z-2-氯-3-甲基-2-戊烯注意:顺反命名和Z/E命名的区别 顺反 两碳原子上基团相同 Z/E 各种均可,与R/S对应§4.2 烯烃的命名1.习惯命名法CH3 - C = CH2 CH3异丁烯 CH2 = CH CH3CH=CH CH2=CHCH2 CH2= (-CH2-) 乙烯基 丙烯基 烯丙基 亚甲基2. 系统命名法 a. 选含双键的最长碳链为主链; b. 从双键最近处编号; c. 双键位置写在母体化合物命名前加‘-’; 取代基写在更前面; d. 如有几何异构,在最前面用Z,E标识。
氧化还原反应化学式

非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性:F2 + H2 === 2HF F2 +Xe(过量)===XeF2 2F2(过量)+Xe===XeF4 nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O2 2F2+2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI ===2NaF+I2 F2 +Cl2 (等体积)===2ClF 3F2 (过量)+Cl2===2ClF3 7F2(过量)+I2 ===2IF7 Cl2 +H2 ===2HCl 3Cl2 +2P===2PCl3 Cl2 +PCl3 ===PCl5 Cl2+2Na===2NaCl 3Cl2 +2Fe===2FeCl3 Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2 Cl2 +2NaI===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HCl Cl2+Na2S===2NaCl+S Cl2 +H2S===2HCl+S Cl2+SO2+2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O2 2O2+3Fe===Fe3O4 O2+K===KO2 S+H2===H2S 2S+C===CS2S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnSN2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3NN2+6Rb===2Rb3N P2+6H2===4PH3 P+3Na===Na3P2P+3Zn===Zn3P2 2.还原性S+O2===SO2 S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O 3S+4HNO3(稀)===3SO2+4NO+2H2O N2+O2===2NO4P+5O2===P4O10(常写成P2O5) 2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2O C+2F2===CF4C+2Cl2===CCl4 2C+O2(少量)===2CO C+O2(足量)===CO2C+CO2===2CO C+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅) Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl) Si(粉)+O2===SiO2 Si+C===SiC(金刚砂) Si+2NaOH+H2O===Na2SiO3+2H2 3,(碱中)歧化Cl2+H2O===HCl+HClO (加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O 2Cl2+2Ca(OH)2===CaCl2+Ca (ClO)2+2H2O 3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O 4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO43C+CaO===CaC2+CO 3C+SiO2===SiC+2CO 二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH 4Na+O2===2Na2O2Na2O+O2===2Na2O2 2Na+O2===Na2O2 2Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H2 2Na+2NH3===2NaNH2+H2 4Na+TiCl4(熔融)===4NaCl+Ti Mg+Cl2===MgCl2 Mg+Br2===MgBr22Mg+O2===2MgO Mg+S===MgS Mg+2H2O===Mg(OH)2+H2 2Mg+TiCl4(熔融)===Ti+2MgCl2 Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C 2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2 Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl3 4Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg4Al+3MnO2===2Al2O3+3Mn 2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe 2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H2 2Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化) Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H2 2Fe+3Br2===2FeBr3Fe+I2===FeI2 Fe+S===FeS 3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2 Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2 (铁在酸性环境下,不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn) 三, 非金属氢化物(HF,HCl,H2O,H2S,NH3) 1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O 4HCl(g)+O2===2Cl2+2H2O 16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2===4HF+O2 2H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O 2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O 2 高中化学方程式小结(仅供参考)H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O 2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl 4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O 4NH3+6NO===5N2+6HO(用氨清除NO) NaH+H2O===NaOH+H2 4NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H2 2,酸性: 4HF+SiO2===SiF4+2H2O (此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HCl H2S+Fe===FeS+H2H2S+CuCl2===CuS+2HCl H2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HCl H2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2=== FeS+2HCl↑ 2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3) 3,碱性:NH3+HCl===NH4Cl NH3+HNO3===NH4NO3 2NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3↓+NH4Cl (此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F2 2HCl===H2+Cl2 2H2O===2H2+O2 2H2O2===2H2O+O2 H2S===H2+S2NH3===N2+3H2 四,非金属氧化物1,低价态的还原性:2SO2+O2===2SO3 2SO2+O2+2H2O===2H2SO4 (这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HCl SO2+Br2+2H2O===H2SO4+2HBr SO2+I2+2H2O===H2SO4+2HI SO2+NO2===SO3+NO 2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2 (用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2 CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2 CO+H2O===CO2+H2 2,氧化性:SO2+2H2S===3S+2H2O SO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH (不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O 2NO2+Cu===4CuO+N2 CO2+2Mg===2MgO+C (CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾) SiO2+2H2===Si+2H2O SiO2+2Mg===2MgO+Si 3,与水的作用: SO2+H2O===H2SO3 SO3+H2O===H2SO43NO2+H2O===2HNO3+NO ↑ N2O5+H2O===2HNO3P2O5+H2O===2HPO3 P2O5+3H2O===2H3PO4 (P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO3 4,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3 (这是硫酸厂回收SO2的反应.先用氨水吸收SO2, 再用H2SO4处理:2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气) SO2+Ca(OH)2===CaSO3+H2O (不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别) SO3+MgO===MgSO4 SO3+Ca(OH)2===CaSO4+H2O CO2+2NaOH(过量)===Na2CO3+H2O CO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O 2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3 SiO2+CaO===CaSiO3 SiO2+2NaOH===Na2SiO3+H2O (常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2 ↑ SiO2+CaCO3===CaSiO3+CO2 ↑ 五,金属氧化物1,低价态的还原性: 6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2↑+2H2O 2,氧化性:Na2O2+2Na===2Na2O (此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al. 一般通过电解制Mg和Al. Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O 3,与水的作用: Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2 ↑ (此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ; 2H2O2===2H2O+O2↑. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2) MgO+H2O===Mg(OH)2 (缓慢反应) 4,与酸性物质的作用:Na2O+SO3===Na2SO4 Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O 2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2 MgO+SO3===MgSO4 MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O (Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O) FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2O Fe2O3+3H2S(g)===Fe2S3+3H2O Fe3O4+8HCl===FeCl2+2FeCl3+4H2O 六,含氧酸 3 高中化学方程式小结(仅供参考)1,氧化性: 4HClO3+3H2S===3H2SO4+4HCl ↑ HClO3+HI===HIO3+HCl ↑ 3HClO+HI===HIO3+3HCl ↑HClO+H2SO3===H2SO4+HCl ↑ HClO+H2O2===HCl+H2O+O2 ↑ (氧化性:HClO>HClO2>HClO3>HClO4, 但浓,热的HClO4氧化性很强) 2H2SO4(浓)+C===CO2↑+2SO2↑+2H2O2H2SO4(浓)+S===3SO2↑+2H2O H2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2↑+6H2O2H2SO4(浓)+Cu===CuSO4+SO2↑+2H2OH2SO4(浓)+2HBr===SO2↑+Br2+2H2OH2SO4(浓)+2HI===SO2↑+I2+2H2O H2SO4(稀)+Fe===FeSO4+H2 ↑ 2H2SO3+2H2S===3S+2H2O 4HNO3(浓)+C===CO2+4NO2↑+2H2O 6HNO3(浓)+S===H2SO4+6NO2↑+2H2O5HNO3(浓)+P===H3PO4+5NO2↑+H2O6HNO3+Fe===Fe(NO3)3+3NO2↑+3H2O4HNO3+Fe===Fe(NO3)3+NO↑+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2↑+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O 2,还原性:H2SO3+X2+H2O===H2SO4+2HX (X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4 H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl ↑ 3,酸性:H2SO4(浓) +CaF2===CaSO4+2HF ↑H2SO4(浓)+NaCl===NaHSO4+HCl ↑H2SO4(浓)+2NaCl===Na2SO4+2HCl ↑H2SO4(浓)+NaNO3===NaHSO4+HNO3 3H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO4 2H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca (H2PO4)2 3HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2 ↑ (用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBr H3PO4(浓)+NaI===NaH2PO4+HI 4,不稳定性:2HClO===2HCl+O2 ↑ 4HNO3===4NO2↑+O2↑+2H2O H2SO3===H2O+SO2 ↑ H2CO3===H2O+CO2 ↑H4SiO4===H2SiO3+H2O 七,碱1,低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)3 2NaOH+SO2(少量)===Na2SO3+H2O NaOH+SO2(足量)===NaHSO3 1,与酸性物质的作用:2NaOH+SiO2===NaSiO3+H2O 2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2O NaOH+HCl===NaCl+H2O NaOH+H2S(足量)===NaHS+H2O 2NaOH+H2S(少量)===Na2S+2H2O 3NaOH+AlCl3===Al(OH)3+3NaCl NaOH+Al (OH)3===NaAlO2+2H2O (AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2O Mg(OH)2+2NH4Cl===MgCl2+2NH3.H2O Al(OH)3+NH4Cl 不溶解3,不稳定性: Mg(OH)2===MgO+H2O 2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2O Cu(OH)2===CuO+H2O 八,盐1,氧化性: 2FeCl3+Fe===3FeCl2 2FeCl3+Cu===2FeCl2+CuCl2 (用于雕刻铜线路版) 2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCl Fe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应) Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl↑+S ↓ 2FeCl3+2KI===2FeCl2+2KCl+I2 FeCl2+Mg===Fe+MgCl2 2,还原性: 2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO↑+3S↓ +4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O2Na2SO3+O2===2Na2SO4 3,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2↓ +NH4ClAlCl3+3NH3.H2O===Al(OH)3↓ +3NH4ClFeCl3+3NH3.H2O===Fe(OH)3↓ +3NH4Cl 4,与酸性物质的作用: Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaCl Na2CO3+HCl===NaHCO3+NaCl NaHCO3+HCl===NaCl+H2O+CO2 ↑3Na2CO3+2AlCl3+3H2O===2Al(OH)3↓ +3CO2↑+6NaCl3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓ +3CO2↑+6NaCl3NaHCO3+AlCl3===Al(OH)3↓ +3CO2 ↑3NaHCO3+FeCl3===Fe(OH)3↓ +3CO2 ↑3Na2S+Al2(SO4)3+6H2O===2Al(OH)3↓ +3H2S ↑3NaAlO2+AlCl3+6H2O===4Al(OH)3 ↓ 5,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2↑+H2ONH4HCO3===NH3+H2O+CO2 ↑ 2KNO3===2KNO2+O2 ↑ 2Cu(NO3)3===2CuO+4NO2+O2 ↑2KMnO4===K2MnO4+MnO2+O2↑ 2KClO3===2KCl+3O2 ↑ 2NaHCO3===Na2CO3+H2O+CO2 ↑Ca(HC O3)2===CaCO3+H2O+CO2 ↑ CaCO3===CaO+CO2 ↑ MgCO3===MgO+CO2↑ H2SO3===H2O+SO2↑。
有机化学第10章

• 重排: 有一些醇(除大多数伯醇外)与氢卤酸反应, 时常有重排产物生成,如: 例1:
CH3 CH3 H HCl CH3-C-CH2-CH3 CH3-C— C-CH3 Cl OH H
重排反应历程:
CH3 CH3 CH3
Why?
CH3 CH3C-CH2CH3
+
+ CH3C-CHCH3 HCl CH3C-CHCH3 -H 2O CH C-CHCH 重排 3 3 H OH H +OH2 H Cl-
构造式
习惯命名法
衍生物命名法
系统
(4) 不饱和醇的系统命名:应选择连有羟基同时含有重 键(双键和三键)碳原子在内的碳链作为主链,编号时尽 可能使羟基的位号最小:
4-(正)丙基-5-己烯-1-醇
(5) 芳醇的命名,可把芳基作为取代基:
2
1-苯乙醇 (-苯乙醇)
1
CH2 -CH3 OH
3-苯基-2-丙烯-1-醇 (肉桂醇)
H+, 25℃
(CH3)3C-OH
该反应历程:
(CH3)2C=CH2 + H+ (CH3)3 C+
H2 O
(CH3)3C-OH2 (CH3)3C-OH + H+
+
• 不对称烯烃, 在酸催化下水合,往往中间体碳正离子 可发生重排:
H+的加成符合马氏规律
(CH3)3CCH=CH2
H+
重排
①H2O ②-H+
RCH2-OH + HBr H SO RCH2Br + H2O 2 4 RCH2-OH + HCl ZnCl RCH2Cl + H2O 2
100种有机化学反应

11. Chichibabin 吡啶类合成法 醛、酮类与氨或胺类在 Al2O3 等催化剂存在下,加压加热,脱氢脱水,生成吡啶类化合
3CH3CHO
+ NH3
N
CH3
+ 3H2O + H2
此法不易得纯产物,
物。
还有其他化合物生成。 12. Chichibabin 对称合成法 碳酸二乙酯与三分子格氏试剂反应,中间产物经水解得到对称叔醇类。
OCH2CH=CH2
OH CH2CH=CH2
CH2CH=CH2 OH 200℃ OCH2CH=CH2
200℃
OH CH2CH=CH2 250℃ Cl OCH2CH=CH2
;
Cl
醚分子中,
16. 17. 18. 19.
如临位未被取代则不起重排反应,产生复杂的热分解作用。此反应是在苯环引入丙基的 简易方法,因为烯丙基可还原成丙基。 Claisen 缩合反应(P352~354) Claisen-Schmidt 反应(P287) Clemmensen 还原(P291) Cope 消除反应 这个反应是由氧化叔胺消除羟胺来产生烯烃。反应在低温进行且产量较高,当加热到 120℃时,具有光学活性的纯氧化叔胺 1-(N,N-二甲氨基)-3-苯基丁烷就得到具有旋光 性的纯 3-苯基丁烯-1,而且总是定量进行。
Cl 环氧醚类和羟基缩酮类为副产 同时缩环: 物。在此条件下,二卤代酮也可发生重排,产生α、β-不饱和酸 28. Feist-Benary 合成法 此法用来合成呋喃类化合物,在吡啶或氨存在下,α-氯化羰基化合物或α,β-氯醚类与 1,3-二羰基化合物发生缩合反应,生成呋喃类化合物。
R C CH2 Cl Cl H CH2 Cl OC2H5 C2H5Cl HC CH2 Cl O O H2C O C CH3 O COOR' R COOR'
第十章烷基化反应

C2H5
C2H5
87%
NH2
+2CH2=CH2
(C2H5)2AlCl 300OC, 6.5-7MPa, 115min
C2H5
C2H5
97.9%
烷基铝作催化剂,使烷基有选择性地进入芳环氨基或羟基的邻位;遇水 或空气会分解燃烧,因此,反应要求无水、隔绝空气,具有良好的搅拌。
3、烯烃对酚类的C烷基化反应
CH3 CH
70%
+
CH3
CH CH2
AlCl3
CH3 CH2CH2CH3
30 %
§7.3 N-烷基化反应
常用的烷基化剂 醇和醚:甲醇、乙醇、甲醚、乙醚等
取代烷 卤烷:氯甲烷、碘甲烷、溴乙烷、氯苄等 基化剂
酯类:硫酸二甲酯、硫酸二乙酯、磷酸三甲酯等
加成烷 基化剂 烯烃衍生物:丙稀腈、丙烯酸、丙烯酸甲酯 还原烷 醛酮:各种脂肪族和芳香族的醛酮 基化剂
烷基化反应在精细有机合成中的应用
O CNH2 OH O
+EtBr
NaOH 80~100 C 1.96MPa
O
CNH2 OEt 75%
镇痛药邻乙氧 基苯甲酰胺
NHCH2Ph N
Me2NCH2CH2 NCH2Ph NaNH2/Tol 6h 88% N
+ClCH2CH2NMe2HCl
抗组胺药
CH CH COOH
R R
+
R
2
R
R
+ H+
R
+ R+
利用该原理制备1,2,3-三烷基苯、4-叔丁基苯乙 酮等难于制备的化合物。
R' R R (CH3)3CCl AlCl3 R R R' Cl AlCl3 R R
基础有机化学反应总结

基础有机化学反应总结一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH 33H 323H 32CH CH 2CH 32CH CH=CH (CH 3CH 2CH 2)3-H 3CH 2CH 2C22CH 3CH 2OCH 2CH 2CH 3H 3CH 2CH 2C2CH 2CH 3+OH -OHB-OC H 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2BOC H 2CH 2CH 3CH 2CH 2CH 3H 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH 3NaOH3HOC H 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH-CH 3HH OH3、X 2加成C CBr /CCl CC Br【机理】CC CC Br BrC CBr +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
氧化反应

COOH
CH3
(反应在酸性介质中进行,不论有几个甲基,最终只氧化一个)
※ 严格注意温度的影响。
2.氧化成酸或酮
O CrO3/HOAc 40℃
O
CrO3 /HOAc(75%) H3CO 40℃、2hr H3CO O
①铬酸:
Na2Cr2O7+H2O+H+ CrO3+H2O
C8H17
CrO3/HOAc/H2SO4
C H
CH3
CH3
④ 环内双键,在②前提下优先氧化环上的烯丙位
OH CH2CH3
(Z)
SeO2
(Z)
CH2CH3
HOAc
末端双键:重排、羟基引入末端
CH3CH2CH2CH2CH CH2
SeO2
CH3CH2CH2CH2 CH CH2OH
2 铬酐—吡啶(分子内盐) (Collins试剂(CrO3.2PyCH2Cl2) )
双键移动。
3 有机过酸酯 (引入酰氧基后水解生成醇)
OH
得烯丙醇
CH3CO3C(CH3)3
CH3CH2CH
CH2
O
CH3CO3C(CH3)3
CH3CHCH OH
CH2
C6H5COOC 常用 CH3COOC
O
CH3
3
CH3
3
第二节 醇的氧化 一 伯、仲醇被氧化成醛、酮
R R'
CH OH
R
[O]
仲
' C O R 酮
CHO
只氧化一个苄基
CH3
CH3
CH3 CHO
CS2
R
+2CrO2Cl2
R
R=H 90%
燃料燃烧反应机理

• 然后
CO+OH →CO2+H
r22
30
•
CO+OH →CO2+H
– R22是CO氧化的主要路径
r22
– r22产生的H原子供给r1, 加速CO的氧化速率
• 随着烷烃分子数的增加, 分之链的数目, 以及自由基异 构体的数目也快速增加 • 烷基自由基在烷烃的氧化过程中是非常重要的
7
• 2、naphthenes环烷, 环烷类 (cycloalkane或cyclanes)
• 单键、饱和和环状结构的化合物, • 分子式:CmH2m • Cyclo propane环丙烷 cyclo hexane环己烷
• 下面介绍一下关于燃料组分的命名法则或基本术语
4
1、烷烃 paraffin alkanes
• 开链, 单键, 饱和结构, 分子式CmH2m+2 • 最简单的烷烃是甲烷, Methane, CH4, 天然气的主要成分。 • Normal-paraffin—直链结构 n-butane,正丁烷 • Iso-paraffin—分支结构 i-butane,异丁烷
– 反应路径
• 导致燃料消耗的路径 • 中间组分的生成与消失 • 最终燃烧产物的形成
2
• § 4-1燃料
• 气体燃料
– H2、CO、HC(轻质的)\ 等
• 液体燃料
– 重的碳氢、醇类等
• 固体燃料
– 煤炭、木材、金属等 • • 在所有的燃料中,碳氢化合物组成了大部分燃料成分 碳氢燃料具有高的能量密度,低的成本,在以后人类社会的很长 历史时期,燃烧碳氢燃料将仍然是人类获取能源的主要方式之一
醇、酚、醚和环氧化合物

H3C O
2. 芳环上的取代反应
(1)卤化(掌握三取代、二取代和单取代的方法)
三取代 二取代
OH + Br2 H2OBr
OH Br
OH + Br2
Br
OH
H2O
Br
HBr
鉴别苯酚的一 个特征反应
单取代 OH
+ Br2
Br
CS2 0℃
OH +
OH Br
Br
(2)磺化
OH 98%H2SO4
OH SO3H
R ' R C OH C O H H C H 2 H I O 3H 2 O
OO
RCC HR ' H IO 4 RCO HR ' CH
OO H
O
O
-羟基酮
二、醇的制备
1.卤代烷水解 只适合合成苄醇或烯丙醇。
CH2
CHCH2Cl
Na2CO3 H2O
CH2
CHCH2OH
CH2Cl Na2CO3 H2O
OC 3 OC CO + O C 3 C H H O
傅瑞斯重排
OCOCH3
25oC HO
COCH3
AlCl3
165oC
COCH3 OH
酚的酰基化反应
OH
OH
+ C 6 H 1C 3 O(1 C )(2 )A H l3 3 ,O 1 + lC 40l ℃CO 6 H 13 C +
OH
OH
催化剂消耗量大 OH
R '
R '
R M g X + R '-C -H无 水 乙 醚R -C H -O M g X H H 2 O + R C H O H
羟基OH与烃基或苯环侧链上的碳原子相连的化合物称
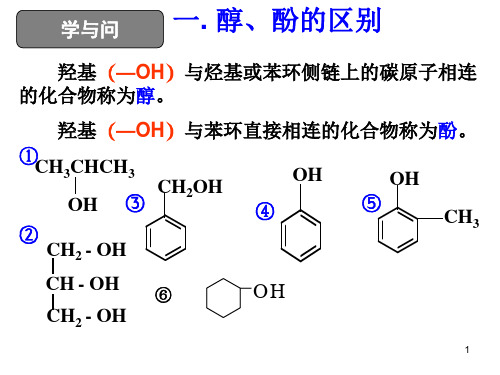
乙醇
苯甲醇
苯酚
结构简式 官能团 结构特点
CH3CH2OH
CH2OH
OH
OH
OH
OH
链烃基连羟 羟基与苯环 苯环直接连
基
不直接相连 羟基
3
二、醇的性质和应用
• 乙醇的物理性质
乙醇俗称酒精
回忆 乙醇有那些物理性质?
❖颜 色:无色透明 ❖气 味:特殊香味 ❖状 态:通常情况下为液体 ❖密 度:比 水 小 , 200C 时 的 密 度 是
溴乙烷
说明:⑴该反应与卤代烃的水解反
H C—C—H 应是相互竞争的关系,碱性时易于
卤代烃与水的水解反应,酸性时易
H O—H 于醇与HX的取代。
羟基被取代
⑵该反应常用醇、卤化钠、浓硫酸 共热制HX。 C2H5OH+NaBr+H2SO4
→△ C2H5Br+NaHSO4+H2O 7
醇的性质和应用
(3)酯化反应
思考与交流名称相对分子质量沸点甲醇32647乙烷30886乙醇46785丙烷44421丙醇60972丁烷5805表31相对分子质量相近的醇与烷烃的沸点比较表32含相同碳原子数不同羟基数的醇的沸点比较名称分子中羟基数目沸点乙醇785乙二醇19731丙醇97212二丙醇ohch2甲基1丙醇a
学与问 一. 醇、酚的区别
慎沾到皮肤上,应立即用 酒精 洗涤。
31
苯酚的化学性质
苯环对羟基的影响
1、苯酚的酸性 ——俗名石炭酸,有弱酸性。
OH +NaOH
ONa +H2O
(易溶于水)
澄清
浑浊
32
苯酚的酸性到底有多弱?
-ONa + CO2 + H2O →
氢氧化根离子化学式

氢氧化根离子化学式
氢氧化根离子的化学式是OH-。
这个离子是由氧原子和氢原子
组成的,其中氧原子带有负一价电荷,而氢原子带有正一价电荷。
因此,氢氧化根离子的化学式为OH-。
这个离子在化学反应中起着
重要的作用,特别是在酸碱中和反应中。
它是强碱的主要成分之一,可以与酸中的氢离子结合,形成水分子。
在化学方程式中,氢氧化
根离子通常以OH-的形式出现,表示它在溶液中的存在。
这个化学
式是化学和生物化学中非常基础的知识,对于理解溶液的酸碱性质
以及许多化学反应的进行都具有重要意义。
希望这个回答能够满足
你的需求。
第六章-氧化反应(2)

ArCH(OCrCl2OH)2 Etar d复 合体
H2O
ArCH2
H OC rO Cl2
ArCHOCrCl2OH
ArCHO
2H2CrO3
ArCH2OCrCl2OH HOCrOCl2
2. 氧化形成酮、羧酸
苄位亚甲基被氧化成相应的酮,常用的氧化剂或催化剂有两类: 铈的络合物和铬(Ⅵ)的氧化物或铬酸盐。如硝酸铈铵(CAN), 反应在酸性介质中进行,一般用硝酸作反应介质,收率较高。
Collins 试剂
O
F 5 min
F (84%)
3.用过(氧)酸酯氧化
过酸酯在亚铜盐催化下,可在烯丙位烃基上引入酰氧基,
经水解可得烯丙醇类,常用试剂有过醋酸叔丁酯和过苯甲酸 叔丁酯。
PhCOOOC(CH3)3/CuBr
1) reflux (50%~77%) 2) 80~82oC, 4h (71%~80%)
复合物
H2O
离子型机理解释:
CH3
C rO 2C l2
C rO 2C l2
C H( OC rC l2O H) 2
H HCH
OO Cr
Cl Cl Etard复合体
H2O
CHO
自由基型机理解释:
Br
CHO
(80%)
CH2OCrCl2OH
2H2CrO3
ArCH3
CrO2Cl2
ArCH2OCrCl2OH
CrO2Cl2
(100%)
CH3
COOH CH3
CAN 高温
CH3 CH3
CAN
50oC~60oC
CHO CH3
CAN氧化机理:单电子转移过程,其中经历产生苄醇的阶段:
ArCH3 ArCH2
保护基团

+ ROSiMe3
H2O
ROH + Me3SiOH
I
7.1 羟基的保护基团
2. 形成叔丁基醚类 ROC(CH3)3
醇与异丁烯在Lewis 酸催化下制备。叔丁基为一巨大的取代基( bulky group),脱去时需用酸处理:
ROH + BF3 Et2O Cat 2 N HCl,MeOH,
2
O
Th
HO P h3C C l P y rid ine (8 0 % ) Th (P h C H 2 O )2 P ( O )C l P y rid in e P h3C O C H
P h3C O C H (C H 3 C O )2 O P y rid in e (9 8 % ) Th
2
O
HO
P h3C O C H
NaBH4 (75%)
CH2OH NHCOCH3 CH3O CHO
H5IO6
BCl3 (100%)
CH2OH NH2 HO CH2OH
7.2 二羟基的保护基团
2. 碳酸酯
在吡啶存在下,光气与顺式 1,2-二醇反应,给出在中性和温和 酸性条件下稳定的碳酸酯,当在这种条件下进行氧化,还原时,能 保护1,2-二醇。 用碱性试剂处理,则二醇从碳酸酯再生。
R C O R' R' R C Y X
保护羰基的方法可分为二种: 保护羰基的方法可分为二种:
一是形成缩酮或其对等物
醛基是最容易形成缩醛或对等物的羰基,而苯环上的 酮基则是反应性最低的羰基。 一般说来,反应性是: 醛基 > 链状羰基(环已酮)> 环戊酮 > α,β-不 饱和酮 > 苯基酮。 缩 酮 的 保 护 基 不 与 碱 , 氧 化 剂 或 亲 核 剂 ( 如 H-, RMgBr)作用,而通常以酸水解回复到羰基。
氧化反应小结

3、硼氢化—氧化反应 、硼氢化 氧化反应 RC≡CH
B2H6
RCH=CH–OH
(RCH=CH)3–B O 重排 RCH2–C–H
OH- H2O2
三、聚合反应 ——自身的亲核加成反应 自身的亲核加成反应 HC≡CH + HC≡CH
HC≡CH Cu2Cl2-NH4Cl Cu2Cl2-NH4Cl
RCHO+R'CHO
RCHO+R'CHO
)
5. I2+RCOOAg(无水 反式 ,2-二醇) 无水) 二醇) 无水 反式1, 二醇 (
还原(H2/Pt,Zn/HCl,(EtO)3P)
[O]
KMnO4氧化 氧化 O3 氧化
RCOOH
LiAlH4 or NaBH4
RCH2OH
烯 烃 的 氧 化 反 应 总 结
H2C
CH3 O2 V2O5
COCH3
氧化反应小结
烃类氧化(卞位、羰基a-位 烃类氧化(卞位、羰基 位、烯丙基 位)
①
H2 C COOEt Pb(OAc)4 COOEt HOHC COOEt COOEt
Pb(OAc)4 、Hg(OAc)2:羰基 位被氧化 位被氧化 :羰基a-位被 成醇
H3C
SeO2/H2O/HOAc :氧化成羰基 a. 有多个烯丙位时,优先氧化取代基多 有多个烯丙位时, 的一侧
CH2=C=O 乙酰基化试剂 O CH3–C–OH 乙酸 OH O CH3–C–Cl 乙酰氯 Cl O CH3–C–OOCCH3 乙酐 OOCCH O CH3–C–OC2H5 乙酸乙酯 OC O CH3–C–NH2 乙酰胺 NH O CH3–C–R 甲基酮 R
4. 醛、酮的氧化反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结果与讨论:
• 对 0 ,从反 应物到产物过 程中,能量单 调递减。 • 对 90 ,从反 应物到产物过 程中,会形成 一个深势阱, 即产生复杂的 中间络合物。
O+H2+反应的两个最小能量反应路径
O+H2+.D2+.HD+的 QCT的速率常数 :
• QCT 速率常数:O + H2+( ), D2+ ( ), 和HD+ ( ) 在基态PES 上 (H+ 或 D+ 交换); • QCT 速率常数:O + H2+(), D2+() ,和HD+() 在激发态 PES (H or D 交换)
• 尽管作者对该反应进行了速率常数和微分 截面的计算,但是仍有许多动力学性质有 待开发,因此该系统依然具有很大的研究 潜力。
O + H2+ - OH+ + H, OH + H+ 质子和H原子的交 换反应及同位素变换的势能面及QCT的研究
导 师:王美山 主 讲 人:王振 研究方向:分子反应动力学 时 间:2014年3月20日
*
专业词汇 研究意义 计算原理 结果与讨论 总结与展望
*专业词汇
1. Proton transfer 2. Translational energy 3. quasi-classical trajectory 4. potential energy surfaces 5. dynamical stereochemistry 质子交换
平动能 准经典轨线 势能面
立体化学动力学 拓扑特征 无势垒
6. Topological characteristics 7. barrierless
8. Kinetics ;dynamics 9. Scalar properties 10. vector properties 11. reagent 12. product 13. collision energy 14. Relative velocity 15. cross-section
角分布
相对取向 质心 极化
活化反应物 最小能量轨道
势能面:
• 随着分子内某一根键的增长,能量会随着 变化,做能量-键长的变化曲线,称为势能 曲线;如果做分子的势能随两种坐标参数 变化的图像,你会发现这是一个面(因为 共有3个量:两种坐标变量加能量,组成三 维空间),就叫势能面;以此类推,整个 分子势能随着所有可能的原子坐标变量变 化,是一个在多维空间中的复杂势能面 (hypersurface),统称势能面
势垒:
• Potential Energy Barrier就是势能比附近的 势能都高的空间区域,基本上就是极值点 了人们 广泛的兴趣,特别是 O+H3+→ OH++H2,OH+ +H2 → H2O++H及其典型的离子分子反应,为 了获得准确的H3O+系统的势能面,就必须获得 H2O+的势能面,而在研究H2O+势能面的时候发 现,该反应O+H2+反应在绝热时会发生质子和H 原子的交换反应,这为我们研究离子和原子的 交换反应的动力学特征提供了丰富的可能性,同 时也是首次的研究O+H2+这个体系
• QCT 总反应速率常数O + H2+( ), D2+ ( ), 和HD+ ( ) ; • LGS的总反应速率常数O + H2+( ), D2+ ( ), 和HD+ ( ) ;
结论: 1.质子交换反应速率约为H原子 交换反应速率的3倍。 2.LGS的总的速率常数是LGS速 率常数的2倍。
O+HD+的OCT的速率常数
*研究意义
计算原理
• 准经典轨线方法:
此方法是一种以经典散射理论为基础的 分子动态学计算方法。采用绝热近似后,电 子和原子核的运动可以分离,这样可以利用 牛顿力学的方法计算核在势能面上的运动的 方法称之为经典轨线法,而在经典轨线法的 基础上人为加入一些重要的量子效应,如轨 线的初末状态用量子力学来描述等,就称之 为准经典轨线法。
Potential energy surfaces and quasiclassical trajectory study of the O + H2+ - OH+ + H, OH + H+ proton and hydrogen atom transfer reactions and isotopic variants (D2+, HD+)
总结和展望
• 这篇文章首先用从头算法借助于适当的多 体展开表达式拟合出了O+H2+的基态和激 发态的PES,然后运用QCT理论计算了反应 的反应速率常数并将这些数据与从LGS中 获得的数据进行比较分析,结果显示,它 们的变化趋势比较一致;最后作者运用 QCT理论计算了该反应的微分反应截面也 与LGS的数据进行比较,对结果进行了分 析。
动力学 标量属性 矢量属性 反应物 产物 碰撞能
相对速度
反应截面
16. Angulardistribution 17. relative orientation 18. center-of-mass 19. Polarization 20. activation of reactants 21.MEP(minimum energy path)
SUM基态
OH++D OD++H
OD+H+ OH+D+
由上图我们可以得知: 1.基态和激发态的反应速率常数的比率对 温度的依赖性比较小。 2.它们的比率不依赖于同位素的替代。
图a
图b
图a中为O+H2+在基态( )激发态( )和总的( )QCT 反应截面及LGS( ) 和总LGS( )的分布; 图b与图a表示类似,但是运用了双对数表示法。
