高二化学电解池的工作原理及应用
电解池的工作原理及其应用

C
C
阳极 : 2Cl -- 2e-=Cl2↑
阴极 : Cu2+ +2e-= Cu
电解
总反应:CuCl2 ==Cu+ Cl2↑
(2)写出以碳棒作电极电解饱和氯化钠溶液的电 极反应式及总反应
阳极 : 2Cl -- 2e-=Cl2↑ 阴极 :2H+ +2e-= H2 ↑
总反应:2NaCl+2H2O=电=解 2NaOH+ Cl2↑ + H2↑
离子的迁移方 阴离子向阳极迁移
向
阳离子向阴极迁移
发生氧化反应
的电极
阳极(接电源正极)
发生还原反应 的电极
相同点 (从原理分析
)
阴极(接电源负极) 都是氧化还原反应
原电池
化学能转化为电能 阴离子向负极迁移 阳离子向正极迁移
负极
正极
巩固提姥 高紧:
1、判断
1 电解、电离均需要通电才能实现()×
2 电解质溶液导电过程就是电解过程()√
3 原电池的正极和电解池的阳极均发生氧化
反应() ×
2、用铂电极(惰性电极)进行电解,下列说法 正确的是() AD
A电解稀硫酸,在阴极和阳极分别产生氢气和 氧气
B电解氯化钠溶液,在阴极析出钠
C电解硫酸钠溶液,在阴极上和阳极上析出产 物的物质的之比是1:2 D电解氯化铜溶液,在阴极上和阳极上析出产 物的物质的之比是1:1
分析电解反应的一般思路:
明确溶液中存在哪些离子 阴阳两极附近有哪些离子 根据阳极氧化,阴极还原分析得出产物
5、电解时离子放电顺序
阴离子失去电子而阳离子得到电子的过程叫放电。
①阴极: 阳离子放电,得电子能力强先放电
高二化学电解池盐桥知识点

高二化学电解池盐桥知识点电解池是化学反应中常见的实验装置,用于将电能转化为化学能或将化学能转化为电能。
在电解池中,盐桥扮演着重要的角色。
本文将介绍高二化学中与电解池盐桥相关的知识点。
一、电解池和盐桥的基本概念电解池是由电极、电解质溶液和外部电源组成的系统。
其中,电极又分为阴极和阳极,电解质溶液则是包含可导电离子的溶液。
而盐桥则是将电解池的阳极和阴极连接起来的重要部分。
二、盐桥的作用1. 平衡电荷:在电解池中,阴极发生还原反应,而阳极发生氧化反应。
这些反应涉及到电子转移,会导致阴极产生过剩电子,阳极则缺少电子。
通过盐桥,这些电子可以在阳极和阴极之间传递,使得电荷得以平衡。
2. 离子传递:在电解质溶液中,阳离子和阴离子会进行迁移,以维持电解质溶液的电中性。
盐桥的存在可以促进阳离子和阴离子的传递,保证电解质溶液中的离子浓度稳定。
三、盐桥的构造和原理1. 盐桥的构造:盐桥通常由玻璃毛细管和盐桥填料(如醋酸纸片、凝胶等)组成。
玻璃毛细管起到结构支撑的作用,而盐桥填料则起到导电离子的传递通道的作用。
2. 盐桥的原理:盐桥中填充的盐桥填料含有可溶于水的化合物,例如氯化钾和硝酸钾。
这些化合物在水中溶解时会生成离子,形成可导电的离子溶液。
通过毛细管,离子溶液能够在阳极和阴极之间传递,以实现电荷和离子的平衡传递。
四、盐桥的注意事项1. 盐桥的维护:盐桥需要定期维护,避免堵塞或干燥。
如发现盐桥填料变硬或颜色变淡,应及时更换。
2. 盐桥的选择:不同的实验需要选择不同材料和形式的盐桥。
例如,在一些酸性溶液中,可以使用过硫酸铵溶液作为盐桥填料。
五、盐桥的应用范围1. 电解池实验:在电解池实验中,盐桥可以帮助维持电解质溶液的离子浓度稳定,确保反应正常进行。
2. 电池工作原理:在电池中,阳极和阴极通过盐桥相互连接,使得电荷平衡,并驱动化学反应进行。
六、小结本文介绍了高二化学中与电解池盐桥相关的知识点。
电解池中的盐桥扮演着平衡电荷和传递离子的重要作用。
电解原理及应用
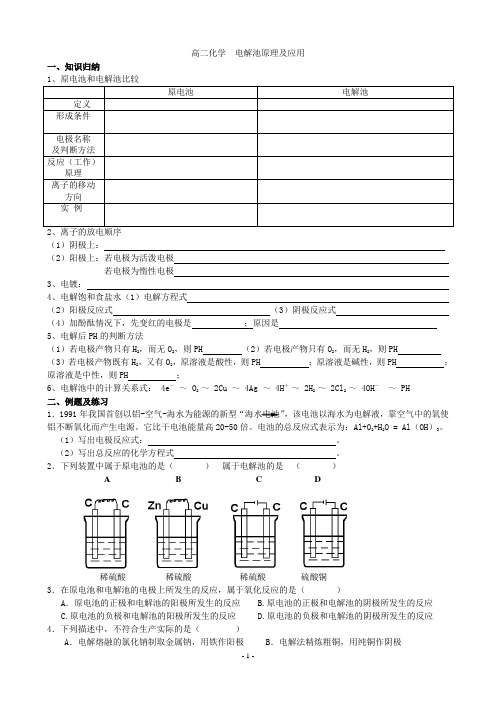
高二化学电解池原理及应用一、知识归纳(1)阴极上:(2)阳极上:若电极为活泼电极若电极为惰性电极3、电镀:4、电解饱和食盐水(1)电解方程式(2)阳极反应式(3)阴极反应式(4)加酚酞情况下,先变红的电极是;原因是5、电解后PH的判断方法(1)若电极产物只有H2,而无O2,则PH (2)若电极产物只有O2,而无H2,则PH (3)若电极产物既有H2,又有O2,原溶液是酸性,则PH ;原溶液是碱性,则PH ;原溶液是中性,则PH ;6、电解池中的计算关系式: 4e—~ O2 ~ 2Cu ~ 4Ag ~ 4H+~ 2H2 ~ 2Cl2 ~ 4OH-~ PH二、例题及练习1.1991年我国首创以铝-空气-海水为能源的新型“海水电池”,该电池以海水为电解液,靠空气中的氧使铝不断氧化而产生电源。
它比干电池能量高20-50倍。
电池的总反应式表示为:Al+O2+H2O = Al(OH)3。
(1)写出电极反应式:。
(2)写出总反应的化学方程式。
2.下列装置中属于原电池的是()属于电解池的是()A B C D稀硫酸稀硫酸稀硫酸硫酸铜3.在原电池和电解池的电极上所发生的反应,属于氧化反应的是()A.原电池的正极和电解池的阳极所发生的反应 B.原电池的正极和电解池的阴极所发生的反应C.原电池的负极和电解池的阳极所发生的反应D.原电池的负极和电解池的阴极所发生的反应4.下列描述中,不符合生产实际的是()A.电解熔融的氯化钠制取金属钠,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在镀件上电镀锌,用锌作阳极5.用惰性电极进行电解,下列说法正确的是()A.电解稀硫酸溶液,实质上是电解水,故溶液PH不变B.电解稀氢氧化钠溶液,要消耗OH—,故溶液PH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:16.关于电解NaCl水溶液,下列叙述正确的是()A.电解时在阳极得到氯气,在阴极得到金属钠 B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性7.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。
【高中化学】高二化学下册电解池知识点

【高中化学】高二化学下册电解池知识点一、电解池的工作原理当外部电源工作时,电子从负极流出,并在与之相连的电极上触发电子的还原反应,称为阴极;最终电子要流入电源的正极,势必在与正极相连的电极上,引发一个失电子的氧化反应,我们称之为阳极。
二、电子流动方向和离子流动方向导线中,电流的产生是电子流动的结果。
溶液中,电流的产生是阴、阳离子流动的结果。
阳离子流向与电流流向保持一致,而阴离子与电子由于带负电荷,其流动方向与电流流向相反。
(即:导线中电子的流向为:电源负极流向电解池的阴极,电解池的阳极流向电源的正极;而溶液中阳离子流向为电解池的阳极流向阴极,阴离子流向为电解池的阴极流向阳极)三、电极反应式和电解反应通式的编写阳极发生失电子的反应,粒子的放电顺序为:活性电极材料s2->i->br->cl->oh->含氧酸根>f-颗粒的放电顺序为Ag+>Fe3+>Cu2+>H+注意:在书写电极反应式时,我们可以毫不犹豫地用实际放电的离子表示(也可用弱电解质分子表示放电微粒);但在书写电解反应总方程式时,如果放电离子来自弱电解质,则用弱电解质的分子式来表示。
例如,电解NaCl溶液时,阳极反应式为:2Cl--2e-=Cl2↑; 阴极反应式:2h++2E-=H2↑ (也可以写成:2H2O+2E-=H2↑ + 2OH-。
将两电极反应式积分得到电解反应的一般方程时,不能写成:2Cl-+2H+=H2↑ + 二氧化氯↑, 因为2H+来自弱电解质,所以它应该是:2Cl-+2H2O=H2↑ + 二氧化氯↑ + 2OH-。
试写出下列过程的电极反应式及电解反应方程式:电解硫酸铜溶液、电解硝酸银溶液,电解盐酸溶液、电解氯化铜溶液,电解硝酸钠溶液、电解氢氧化钠溶液,电解熔融的氯化镁、电解熔融的氧化铝。
四、电解液的回收(原则是“出什么补什么”)如:氯化钠溶液电解后,析出氢气和氯气,若要电解质溶液复原,需往电解后的溶液中通往氯化氢气体,而不可以是盐酸溶液。
1-2 课时3 电解池的工作原理及应用

1-2 课时3 电解池的工作原理及应用知能定位1.掌握电解、电解池概念和电解原理,能正确地判断阴极、阳极,并能正确地写出电极反应式和电解化学方程式。
2.通过学习电解食盐水、电镀,认识电解原理的重要应用。
情景切入通过将电能转化为化学能,可以使许多在通常条件下不能发生的反应得以进行。
这对于化工生产、金属冶炼、实验室研究以及人们的日常生活都具有十分重要的意义。
自主研习一、电解的原理1.熔融氯化钠的电解(1)实验现象:通电后,在阳极周围有〖ZZ(Z〗气泡〖ZZ)〗产生,在阴极上生成银白色金属。
(2)实验分析:①熔融氯化钠中存在的微粒Na+、Cl-。
②通电后离子的运动:阳离子Na+ (填离子符号)移向阴极阴离子Cl- (填离子符号)移向阳极③电极上发生的变化:阴极:2Na++2e-==2Na,阳极:2Cl-==2e-+Cl2↑(3)实验结论:熔融的氯化钠在电流作用下发生了化学变化,分解生成了钠和氯气。
2.基本概念(1)电解在直流电的作用下,在两个电极上分别发生氧化反应和还原反应的过程。
(2)电解池①定义:将电能转化为化学能的装置。
②组成:直流电源,固体电极材料,电解质溶液或熔融电解质,构成闭合回路。
(3)电极与电极反应①阳极:与电源正极相连的电极,发生氧化反应。
阴极:与电源负极相连的电极,发生还原反应。
②电极反应在电极上进行的半反应,它可以表示电极上物质的变化情况和电子的转移情况。
③电极产物的判断电解时电极产物首先看电极材料,如果阳极是活性电极,则电极材料失电子,电极被溶解,溶液中的阴离子不能失电子,如果阳极是惰性电极,则要看溶液中离子失电子能力,即根据阴离子的放电顺序。
阴极只有溶液中的阳离子得电子。
3.工作原理4.电解氯化铜溶液(1)装置图:(2)工作原理二、电解原理的应用1.电解食盐水制备烧碱、氢气和氯气(1)装置(2)现象①阳极上:有气体产生;②阴极上:有气体产生,阴极附近溶液变红。
(3)原理分析及电极反应电解时,Cl-、OH-移向阳极,H+、Na+移向阴极。
第三节 电解池原理(讲课)

二、考纲说明 1、了解电解池的工作原理,能写出 电极反应和总反应方程式。 2、理解电解原理的重要应用 3、能力层级:以接受、吸收、整合 化学信息的能力为主,试题难度中 等以上。 4、考查形式:数形结合、结合氧化 还原的知识、联系生产生活实际。
三、学情分析
知识角度:高二的学生已经在必修1中学习 了氧化还原反应和离子反应,在必修2和选 修4中学习了原电池相关知识,学习本节内 容并不陌生,难度不大。 能力角度:高二学生好奇心和求知欲都较强 ,对实验探究热情高,但抽象思维能力和探 究能力还不够成熟,需要老师适时的组织和 引导。 存在问题:学生在已有的原电池将化学能转 变成电能和现要学习的电解原理将电能转变 成化学能易发生混淆。
4)电极反应的书写: 阳极:2Cl-- 2e-= Cl2↑(氧化反应) 阴极:Cu2+ + 2e- = Cu(还原反应) 总反应式:CuCl2
电解
Cu + Cl2↑
5)阳极的说明:若阳极材料为惰性材料 (石墨、铂),则电极本身不参加电解反 应,其它材料要考虑参加电解反应。
4、离子的放电顺序:
1)阴离子放电(失电子)顺序: S2– >I– >Br– >Cl– > OH– > 含氧酸根离子>F-
常州市西夏墅中学高二化学选修四电解池的工作原理及其应用导学案

[学习目标]1、了解电解池的构造特点及工作原理,能正确书写电解池的阴、阳极的电极反应式及电池反应式。
2、了解电解原理在生产生活中的应用。
[你知道吗?]常温下,金属钠能与氯气发生反应,放出大量的热。
金属铝也能在常温下与氧气发生反应。
2Na(s)+Cl2(g)=2NaCl(s) △H=-822.3 kJ/mol2Al(s)+3/2O2(g)=Al2O3(s) △H=-1675.7 kJ/mol工业上分别以和为原料生产金属钠和金属铝。
你知道工业生产中是如何实现此过程的吗?。
上述过程中是能转化为能。
原电池是将化学能转化为电能的装置,而有的反应在通电下才能进行,这些反应为反应(填“吸热”或“放热”),生成物比反应物增加的化学能由电能提供。
[知识体系]1、电解池是一种把能转变为能的装置。
2、形成条件:(1)与电源相连的两个电极;(2)电解质溶液(或熔融电解质);(3)形成闭合回路。
3、电极判断和反应原理(1)阳极:与电源极相连。
①金属电极(除Pt),金属失电子发生②惰性电极(本身不参与反应,仅仅只导电,如Pt、C),阴离子移向阳极,失电子氧化阴离子在阳极放电(失电子)顺序:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子(NO3-、SO42-等)写出S2-、I-、OH-放电的电极反应式:、、(2)阴极:与电源极相连。
阳离子移向阴极,得电子,发生还原反应。
阴离子在阴极放电(得电子)顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Mg2+>Na+>Ca2+>K+友情提醒:Pb2+、Sn2+、Fe2+、Zn2+浓度很大时,控制电解条件,可以使它们先于H+放电。
4、电子流向:电子由电源的极流到电解池的极,再由电解池的极流回电源的极,通过导线上电子的迁移和电解质溶液中离子的迁移而形成闭合回路。
[交流与讨论]电解熔融氯化钠课本P18[实验探究]U形管中装有氯化铜溶液,插入两根石墨棒作为电极,接通直流电源,将湿润的淀粉碘化钾试纸放在阳极附近,观察U形管内的现象和试纸颜色的变化。
人教版高二化学选修4教学课件:第四章4.3 电解池(共50张PPT)

第2课时 电解原理的 2 应用
• 1. 氯碱工业
• (1)概念 • 用电解饱和食盐水的方法来制取Cl2、NaOH、H2,并
以它们为原料生产一系列化工产品的工业,称为氯碱工业。
• 1. 氯碱工业
• (2)原理
• ①通电前,NaCl溶液中含有的离子是___________。
• 通电时,移向阴极的离子是______,移向Na阳+极C的l− 离H+子O是H−
Fe2+>Zn2+>H+(水)>
•
Al3+、Mg2+、Na+、Ca2+、K+
• 2. 电解产物的判断 • (3)电极产物的判断
离子 S2− 产物 S
SO32− SO42−
I− Br− Cl− OH−
I2
Br2 Cl2 O2
离子 Ag+ Hg2+ Fe3+ Cu2+ H+ 产物 Ag Hg Fe2+ Cu H2
借助于电流,反应进行是 不自发的氧化还原反应。
• 2. 构成条件
直流电源 两个电极 电解质溶液(或熔融电解质) 闭合回路
阴极
阳极
• 3. 工作原理
e-
e-
二、电解原理
• 1. 电解
• 使(直流)电流通过电解质溶液(或熔融电解质)而在阴、 阳两极引起氧化还原反应的过程叫做电解。
电离与电解的比较
合金的方法。 • (2)电解槽构成 • 阴极——待镀金属 • 阳极——镀层金属 • 电镀液——含有镀层金属离子 • (3)特点 • ①阳极参与电极反应 • ②电镀液浓度保持不变
• 3. 电解精炼铜
• (1)电解槽构成 • 阳极:粗铜 (含Zn、Fe、Ni、Au、Ag等杂质) • 阴极:纯铜 • 电解液:CuSO4溶液
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
主厂房安装间面积可确定。A.按一台机组扩大性检修的需要B.按二台机组正常检修的需要C.按一台机组吊装的要求D.按检修多台机组的要求 喜欢自我表现属于人类行为发展过程的A.被动发展阶段B.主动发展阶段C.自主发展阶段D.巩固发展阶段E.自我发展阶段 合同法律关系由哪些要素构成? 正火是将钢件加热到上临界点以上℃,保温一段时间,使其达到完全奥氏体化和均匀化,然后在空气中冷却A.20~30B.30~50C.60~80D.100~120 学生围绕一个主题进行小组合作学习,先独立思考再小组讨论,最后以小组为单位进行全班交流。请问老师运用了教学方式。A.自学辅导法B.讲授法C.讨论法D.启发法 下列各项,不属盆腔炎性疾病后遗症临床表现的是。A.下腹疼痛B.发热恶寒C.腰骶酸痛D.带下量多E.伴有不孕 《中华人民共和国中医药条例》是我国政府制定颁布的第一部专门的中医药。A.法律B.行政法规C.部门规章D.行政规章E.卫生行政规章 乳腺癌常用显像剂为。A.67GaB.111In-WBCC.201TlD.99Tcm-MIBIE.99Tcm-DMSA 电压互感器主要用于测量电流,电流互感器用于测量电压。A.正确B.错误 二极管的主要参数有哪几个? 急性血源性骨髓炎与急性化脓性关节炎鉴别时,下列意义不大的是A.疼痛主要在关节B.迅速出现关节积液C.早期关节活动障碍,一活动即剧痛D.压痛局限在关节周围E.全身感染中毒症状 以下措施有利于提高夜间观测吃水的精度。A.利用强力照明设备B.水面撒轻物C.投小石击起浪花D.以上均是 关于转录调节因子叙述错误的是A.所有转录因子结构均含有DNA结合域和转录激活域B.有些转录因子结构可能含有DNA结合域或转录激活域C.转录因子调节作用是DNA依赖的或DNA非依赖的D.通过DNA-蛋白质或蛋白质-蛋白质相互作用发挥作用E.大多数转录因子的调节作用属反式调节 排汽装置的端差是指的饱和蒸汽温度和温度之差。 要想取得索赔的成功,提出索赔要求不需符合的条件是。A.客观性B.合法性C.合理性D.方向性 ()是介于观察法、专题讨论法和实验法之间的一种方法,适用于描述性调查,目的是为了了解人们的认识、看法、喜好和满意度等,以便在总体上衡量这些量值。A.实验法B.观察法C.问卷调查法D.专题讨论法 以下哪种物质为骨吸收促进因子,抑制骨胶原合成.A.前列腺素B.白细胞介素C.肿瘤坏死因子D.成纤维细胞生长因子E.以上都不是 关于对禽流感的易感性,正确的说法应该是A.老人与鸡易感B.小孩与鸭易感C.禽群和人群普遍易感D.妇女和养禽人员易感E.兽医易感 目前不具备开发条件的水域属于一级功能区中的哪一类。A.保护区B.保留区C.开发利用区D.缓冲区 [单选,配伍题]妊娠合并早期梅毒治疗对青霉素过敏患者选用A.大剂量青霉素B.大观霉素C.盐酸四环素D.乙酰螺旋霉素E.红霉素 我国社会主义法律体系正式宣告形成是在。A、1999年B、2004年C、2008年D、2011年 红细胞破坏后,受何者吞噬A.单核-巨噬细胞系统B.单核细胞C.中性粒细胞D.脾E.肝 水利水电工程环境现状调查应首先采用的方法是。A.收集资料法B.现场调查监测法C.遥感遥测法D.专家征询法 关于甲醇中毒,正确的说法是A.工业酒精兑制的假酒是中毒的主要原因B.甲醇是一种剧烈的神经毒C.甲醇对视神经、视网膜有特殊的损害作用D.甲醇在体内可产生毒性更强的甲醛和甲酸E.患者主要死于酸中毒 适用于水陆联运、水水联运等货物运输的运价是()A.航线运价B.联运运价C.里程运价D.分线运价 在十月革命以前,俄国形成了以等级十分明显的为特征的教育体系。A.双轨制B.单轨制C.私立学校D.贵族学校 不是嗜铬细胞瘤的临床表现的是()A.阵发性高血压B.高血糖C.高代谢D.向心性肥胖E.持续性高血压 设备检修工作应贯彻和、的原则。 什么是医德医风 患者,女性70岁,因双眼视力骤降半天就诊。检查:右眼视力0.02,左眼0.03,结膜无充血,角膜透明,角膜后沉着物阴性,瞳孔对光反射对称、迟钝,晶状体轻度混浊,玻璃体无混浊;视乳头充血水肿。如VEP为各波潜伏期延长、波幅下降;眼底荧光造影为视盘高荧光;视野为巨大中心暗点; 是注册会计师开展业务活动的第一个环节,也是防范业务风险的重要环节。A.接受具体业务B.接受与保持客户关系C.接受与保持客户关系和具体业务D.接受与保持具体业务 运输改变了物品的时间状态,更重要的是改变了物品的状态。A.品种B.批量C.风险D.空间 [单选,案例分析题]某区域电网中现运行一座500kV变电所,根据负荷发展情况需要扩建,该变电所现状、本期及远景建设规模见表15-1。该变电所现有750MVA主变阻抗电压百分比为Uk(1-2)%=14%,本期扩建的2×1000MVA主变电抗电压百分比采用,若三台主变并列运行,它们的负载分布为下列哪 [多选,X型题]下列各项除了哪项外,都是引起腰痛的病因病机A.感受外邪B.肝郁气滞C.饮食不节D.气滞血瘀E.肾亏体虚 酸雨的正确描述是A.使土壤金属迁移加快B.可促进农作物生长C.来源于大气S02、NOD.降雨pH小于2E.可腐蚀建筑物 以下是经鼻气管插管的禁忌证,但不包括A.鼻中隔偏曲B.颅底骨折C.口腔手术D.凝血功能障碍E.鼻外伤骨折 小孔扩散律 48岁,糖尿病史9年,外阴痒2月余,白带无异味,妇检:阴道黏膜充血,白带多,呈凝乳块状。本例最可能的诊断是A.细菌性阴道病B.老年性阴道炎C.外阴硬化性苔藓D.滴虫性阴道炎E.念珠菌阴道炎 P代表该波对于规定的参考电极值为正向,正常的潜伏期平均在()A.50ms左右B.100ms左右C.150ms左右D.200ms左右E.10ms左右 负责电力营销竞赛和电力基础资料管理的部门是。A.省公司市场营销部及各级市场营销部门B.各供电公司用电检查部门C.供电营业所D.客户服务中心
