高二化学电解池的工作原理及应用
高二化学电解池盐桥知识点

高二化学电解池盐桥知识点电解池是化学反应中常见的实验装置,用于将电能转化为化学能或将化学能转化为电能。
在电解池中,盐桥扮演着重要的角色。
本文将介绍高二化学中与电解池盐桥相关的知识点。
一、电解池和盐桥的基本概念电解池是由电极、电解质溶液和外部电源组成的系统。
其中,电极又分为阴极和阳极,电解质溶液则是包含可导电离子的溶液。
而盐桥则是将电解池的阳极和阴极连接起来的重要部分。
二、盐桥的作用1. 平衡电荷:在电解池中,阴极发生还原反应,而阳极发生氧化反应。
这些反应涉及到电子转移,会导致阴极产生过剩电子,阳极则缺少电子。
通过盐桥,这些电子可以在阳极和阴极之间传递,使得电荷得以平衡。
2. 离子传递:在电解质溶液中,阳离子和阴离子会进行迁移,以维持电解质溶液的电中性。
盐桥的存在可以促进阳离子和阴离子的传递,保证电解质溶液中的离子浓度稳定。
三、盐桥的构造和原理1. 盐桥的构造:盐桥通常由玻璃毛细管和盐桥填料(如醋酸纸片、凝胶等)组成。
玻璃毛细管起到结构支撑的作用,而盐桥填料则起到导电离子的传递通道的作用。
2. 盐桥的原理:盐桥中填充的盐桥填料含有可溶于水的化合物,例如氯化钾和硝酸钾。
这些化合物在水中溶解时会生成离子,形成可导电的离子溶液。
通过毛细管,离子溶液能够在阳极和阴极之间传递,以实现电荷和离子的平衡传递。
四、盐桥的注意事项1. 盐桥的维护:盐桥需要定期维护,避免堵塞或干燥。
如发现盐桥填料变硬或颜色变淡,应及时更换。
2. 盐桥的选择:不同的实验需要选择不同材料和形式的盐桥。
例如,在一些酸性溶液中,可以使用过硫酸铵溶液作为盐桥填料。
五、盐桥的应用范围1. 电解池实验:在电解池实验中,盐桥可以帮助维持电解质溶液的离子浓度稳定,确保反应正常进行。
2. 电池工作原理:在电池中,阳极和阴极通过盐桥相互连接,使得电荷平衡,并驱动化学反应进行。
六、小结本文介绍了高二化学中与电解池盐桥相关的知识点。
电解池中的盐桥扮演着平衡电荷和传递离子的重要作用。
电解原理及应用
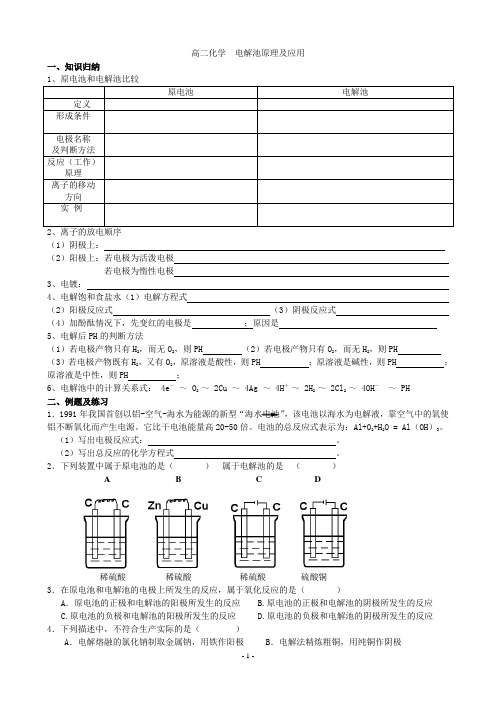
高二化学电解池原理及应用一、知识归纳(1)阴极上:(2)阳极上:若电极为活泼电极若电极为惰性电极3、电镀:4、电解饱和食盐水(1)电解方程式(2)阳极反应式(3)阴极反应式(4)加酚酞情况下,先变红的电极是;原因是5、电解后PH的判断方法(1)若电极产物只有H2,而无O2,则PH (2)若电极产物只有O2,而无H2,则PH (3)若电极产物既有H2,又有O2,原溶液是酸性,则PH ;原溶液是碱性,则PH ;原溶液是中性,则PH ;6、电解池中的计算关系式: 4e—~ O2 ~ 2Cu ~ 4Ag ~ 4H+~ 2H2 ~ 2Cl2 ~ 4OH-~ PH二、例题及练习1.1991年我国首创以铝-空气-海水为能源的新型“海水电池”,该电池以海水为电解液,靠空气中的氧使铝不断氧化而产生电源。
它比干电池能量高20-50倍。
电池的总反应式表示为:Al+O2+H2O = Al(OH)3。
(1)写出电极反应式:。
(2)写出总反应的化学方程式。
2.下列装置中属于原电池的是()属于电解池的是()A B C D稀硫酸稀硫酸稀硫酸硫酸铜3.在原电池和电解池的电极上所发生的反应,属于氧化反应的是()A.原电池的正极和电解池的阳极所发生的反应 B.原电池的正极和电解池的阴极所发生的反应C.原电池的负极和电解池的阳极所发生的反应D.原电池的负极和电解池的阴极所发生的反应4.下列描述中,不符合生产实际的是()A.电解熔融的氯化钠制取金属钠,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在镀件上电镀锌,用锌作阳极5.用惰性电极进行电解,下列说法正确的是()A.电解稀硫酸溶液,实质上是电解水,故溶液PH不变B.电解稀氢氧化钠溶液,要消耗OH—,故溶液PH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:16.关于电解NaCl水溶液,下列叙述正确的是()A.电解时在阳极得到氯气,在阴极得到金属钠 B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性7.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。
电解池的原理

电解池的原理电解池是一种利用电解现象进行化学反应的装置,它由两个电极和电解质溶液组成。
电解质溶液通常是由盐类、酸、碱等化合物溶解在水中形成的,当在电解质溶液中加上电压时,就会发生电解反应,从而产生化学变化。
电解池在工业生产、实验室研究以及日常生活中都有着广泛的应用,比如电镀、水解、电解制氢等。
电解池的原理主要涉及电解质溶液中的离子运动和电极上的电子转移。
在电解质溶液中,正离子会向阴极移动,而负离子则会向阳极移动。
当电解质溶液中加上电压时,阴极会受到负极的吸引,而阳极则会受到正极的吸引,从而导致离子在溶液中的移动。
在电解质溶液中,正离子会向阴极移动,而负离子则会向阳极移动。
当电解质溶液中加上电压时,阴极会受到负极的吸引,而阳极则会受到正极的吸引,从而导致离子在溶液中的移动。
在电解质溶液中,正离子会向阴极移动,而负离子则会向阳极移动。
当电解质溶液中加上电压时,阴极会受到负极的吸引,而阳极则会受到正极的吸引,从而导致离子在溶液中的移动。
在电解质溶液中,正离子会向阴极移动,而负离子则会向阳极移动。
当电解质溶液中加上电压时,阴极会受到负极的吸引,而阳极则会受到正极的吸引,从而导致离子在溶液中的移动。
在电解质溶液中,正离子会向阴极移动,而负离子则会向阳极移动。
当电解质溶液中加上电压时,阴极会受到负极的吸引,而阳极则会受到正极的吸引,从而导致离子在溶液中的移动。
在电解质溶液中,正离子会向阴极移动,而负离子则会向阳极移动。
当电解质溶液中加上电压时,阴极会受到负极的吸引,而阳极则会受到正极的吸引,从而导致离子在溶液中的移动。
电解质溶液中的离子在电解过程中会在电极上发生化学反应,从而导致溶液中的物质发生变化。
在电解质溶液中,阴极会发生还原反应,而阳极则会发生氧化反应。
在阴极上,正离子会接受电子并发生还原反应,而在阳极上,负离子会失去电子并发生氧化反应。
这些化学反应会导致新的物质在电解质溶液中生成,从而实现电解过程中的化学变化。
【高中化学】高二化学下册电解池知识点

【高中化学】高二化学下册电解池知识点一、电解池的工作原理当外部电源工作时,电子从负极流出,并在与之相连的电极上触发电子的还原反应,称为阴极;最终电子要流入电源的正极,势必在与正极相连的电极上,引发一个失电子的氧化反应,我们称之为阳极。
二、电子流动方向和离子流动方向导线中,电流的产生是电子流动的结果。
溶液中,电流的产生是阴、阳离子流动的结果。
阳离子流向与电流流向保持一致,而阴离子与电子由于带负电荷,其流动方向与电流流向相反。
(即:导线中电子的流向为:电源负极流向电解池的阴极,电解池的阳极流向电源的正极;而溶液中阳离子流向为电解池的阳极流向阴极,阴离子流向为电解池的阴极流向阳极)三、电极反应式和电解反应通式的编写阳极发生失电子的反应,粒子的放电顺序为:活性电极材料s2->i->br->cl->oh->含氧酸根>f-颗粒的放电顺序为Ag+>Fe3+>Cu2+>H+注意:在书写电极反应式时,我们可以毫不犹豫地用实际放电的离子表示(也可用弱电解质分子表示放电微粒);但在书写电解反应总方程式时,如果放电离子来自弱电解质,则用弱电解质的分子式来表示。
例如,电解NaCl溶液时,阳极反应式为:2Cl--2e-=Cl2↑; 阴极反应式:2h++2E-=H2↑ (也可以写成:2H2O+2E-=H2↑ + 2OH-。
将两电极反应式积分得到电解反应的一般方程时,不能写成:2Cl-+2H+=H2↑ + 二氧化氯↑, 因为2H+来自弱电解质,所以它应该是:2Cl-+2H2O=H2↑ + 二氧化氯↑ + 2OH-。
试写出下列过程的电极反应式及电解反应方程式:电解硫酸铜溶液、电解硝酸银溶液,电解盐酸溶液、电解氯化铜溶液,电解硝酸钠溶液、电解氢氧化钠溶液,电解熔融的氯化镁、电解熔融的氧化铝。
四、电解液的回收(原则是“出什么补什么”)如:氯化钠溶液电解后,析出氢气和氯气,若要电解质溶液复原,需往电解后的溶液中通往氯化氢气体,而不可以是盐酸溶液。
1-2 课时3 电解池的工作原理及应用

1-2 课时3 电解池的工作原理及应用知能定位1.掌握电解、电解池概念和电解原理,能正确地判断阴极、阳极,并能正确地写出电极反应式和电解化学方程式。
2.通过学习电解食盐水、电镀,认识电解原理的重要应用。
情景切入通过将电能转化为化学能,可以使许多在通常条件下不能发生的反应得以进行。
这对于化工生产、金属冶炼、实验室研究以及人们的日常生活都具有十分重要的意义。
自主研习一、电解的原理1.熔融氯化钠的电解(1)实验现象:通电后,在阳极周围有〖ZZ(Z〗气泡〖ZZ)〗产生,在阴极上生成银白色金属。
(2)实验分析:①熔融氯化钠中存在的微粒Na+、Cl-。
②通电后离子的运动:阳离子Na+ (填离子符号)移向阴极阴离子Cl- (填离子符号)移向阳极③电极上发生的变化:阴极:2Na++2e-==2Na,阳极:2Cl-==2e-+Cl2↑(3)实验结论:熔融的氯化钠在电流作用下发生了化学变化,分解生成了钠和氯气。
2.基本概念(1)电解在直流电的作用下,在两个电极上分别发生氧化反应和还原反应的过程。
(2)电解池①定义:将电能转化为化学能的装置。
②组成:直流电源,固体电极材料,电解质溶液或熔融电解质,构成闭合回路。
(3)电极与电极反应①阳极:与电源正极相连的电极,发生氧化反应。
阴极:与电源负极相连的电极,发生还原反应。
②电极反应在电极上进行的半反应,它可以表示电极上物质的变化情况和电子的转移情况。
③电极产物的判断电解时电极产物首先看电极材料,如果阳极是活性电极,则电极材料失电子,电极被溶解,溶液中的阴离子不能失电子,如果阳极是惰性电极,则要看溶液中离子失电子能力,即根据阴离子的放电顺序。
阴极只有溶液中的阳离子得电子。
3.工作原理4.电解氯化铜溶液(1)装置图:(2)工作原理二、电解原理的应用1.电解食盐水制备烧碱、氢气和氯气(1)装置(2)现象①阳极上:有气体产生;②阴极上:有气体产生,阴极附近溶液变红。
(3)原理分析及电极反应电解时,Cl-、OH-移向阳极,H+、Na+移向阴极。
人教版高二化学选修4教学课件:第四章4.3 电解池(共50张PPT)

第2课时 电解原理的 2 应用
• 1. 氯碱工业
• (1)概念 • 用电解饱和食盐水的方法来制取Cl2、NaOH、H2,并
以它们为原料生产一系列化工产品的工业,称为氯碱工业。
• 1. 氯碱工业
• (2)原理
• ①通电前,NaCl溶液中含有的离子是___________。
• 通电时,移向阴极的离子是______,移向Na阳+极C的l− 离H+子O是H−
Fe2+>Zn2+>H+(水)>
•
Al3+、Mg2+、Na+、Ca2+、K+
• 2. 电解产物的判断 • (3)电极产物的判断
离子 S2− 产物 S
SO32− SO42−
I− Br− Cl− OH−
I2
Br2 Cl2 O2
离子 Ag+ Hg2+ Fe3+ Cu2+ H+ 产物 Ag Hg Fe2+ Cu H2
借助于电流,反应进行是 不自发的氧化还原反应。
• 2. 构成条件
直流电源 两个电极 电解质溶液(或熔融电解质) 闭合回路
阴极
阳极
• 3. 工作原理
e-
e-
二、电解原理
• 1. 电解
• 使(直流)电流通过电解质溶液(或熔融电解质)而在阴、 阳两极引起氧化还原反应的过程叫做电解。
电离与电解的比较
合金的方法。 • (2)电解槽构成 • 阴极——待镀金属 • 阳极——镀层金属 • 电镀液——含有镀层金属离子 • (3)特点 • ①阳极参与电极反应 • ②电镀液浓度保持不变
• 3. 电解精炼铜
• (1)电解槽构成 • 阳极:粗铜 (含Zn、Fe、Ni、Au、Ag等杂质) • 阴极:纯铜 • 电解液:CuSO4溶液
电解原理及其应用课件高二化学同步专题(人教版选择性必修1)

(2)从离子的放电先后顺序角度理解电解池的工作原理
2.原电池与电解池的比较。
装置 类别
原理
装置 特点
原电池
电解池
使氧化还原反应中电 使电流通过电解质溶液或熔
子的转移定向移动,从 融电解质而在阴、阳两极引
而形成电流
起氧化还原反应的过程
将化学能转化成电能 将电能转化成化学能
装置类别 原电池
电解池
实例
1. Cu2O 是一种半导体材料,基于绿色化学理念设计的制取 Cu2O 的电解池示意图(如下
图),电解总反应为 2Cu+H2O=电==解==Cu2O+H2↑。下列说法中正确的是( )
A. 电子的流向:电源负极→石墨电极→Cu→电源正极
B. 铜电极上的电极方程式为 2Cu+H2O-2e-===Cu2O
选择性必修1(人教版202X)
2023-2024学年
第四章 化学反应与电能
电解原理及其应用
突破点1.从微观层面理解电解池
1.电解原理示意图。
重难归纳
(1)从电子、离子、电流的移动方向角度理解电解池的工作原理
一幅图理解电子、离子、电流的移动方向 (注意:)电子不能通过电解质溶液。
①电子移动方向: 电源负极→电解池_阴__极;电解池的_阳__极→电源的正极。 ②离子移动方向: 阳离子:移向电解池_阴__极;阴离子:移向电解池阳___极。 ③电流移动方向: 电源的_正__极→电解池_阳__极;电解池_阴__极→电源负极。
电解池的原理

电解池的原理
电解池是一种利用电能进行化学反应的装置,它由电解槽、电极和电解液组成。
电解池的原理是利用外加电压将电解质溶液或熔融状态的离子化合物分解成阳离子和阴离子,从而进行电解反应,产生新的物质。
首先,电解池中的电解质溶液或熔融状态的离子化合物被加入到电解槽中。
然后,在电解槽中插入两个电极,分别为阴极和阳极。
当外加电压施加到电解槽中时,电解质溶液中的离子会向电极移动。
正电荷的离子会向阴极移动,而负电荷的离子会向阳极移动。
在电解过程中,阴极会吸引阳离子,而阳极会吸引阴离子。
当离子到达电极表
面时,它们会接受或释放电子,从而发生化学反应。
在阴极上,离子会接受电子并发生还原反应,而在阳极上,离子会释放电子并发生氧化反应。
通过这样的电解过程,原来的电解质溶液或离子化合物会被分解成新的物质。
例如,在电解氯化钠的过程中,氯离子会在阳极发生氧化反应,生成氯气,而钠离子会在阴极发生还原反应,生成金属钠。
除了单纯的离子化合物,电解池也可以用来进行电镀、电解制氢、电解制氧等
工业生产过程。
通过调节电解槽中的电解液成分和电压大小,可以控制电解反应的速率和产物的纯度。
总的来说,电解池的原理是利用外加电压将电解质溶液或离子化合物分解成阳
离子和阴离子,从而进行化学反应。
这种原理不仅在工业生产中有着重要的应用,也在电化学研究和实验室中起着关键作用。
通过深入理解电解池的原理,可以更好地掌握电化学知识,为相关领域的研究和应用提供理论基础和技术支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[单选]劳动法律关系最主要的形式是()。A.劳动关系B.劳动雇佣关系C.劳动法务关系D.劳动合同关系 [单选]平版胶印印刷纸类彩印品时,一般合格品的套印规定误差为()。A.小于1mmB.小于2mmC.小于0.2mmD.小于0.1mm [单选,A1型题]煎药器具不宜采用的是()A.瓦罐B.砂锅C.铁质容器D.玻璃容器E.搪瓷制器 [单选,A1型题]患者男,40岁。血尿3天,膀胱镜见膀胱底部有一1.5cm×1.0cm新生物,有蒂,活检为T期,首选治疗方法是()A.化疗B.膀胱部分切除C.经尿道膀胱肿瘤电切除术D.膀胱全切除E.放疗 [单选]用抗甲状腺药物治疗毒性弥漫性甲状腺肿患者时,错的是()A.适用于病情轻,甲状腺较小,年龄在20岁以下者B.治疗中如出现甲状腺肿大加重、血管杂音更明显,而其他甲亢症状缓解时,可加用甲状腺素制剂C.疗程中,疗效考核可用甲状腺摄I131率测定D.整个服药疗程至少1.5~2年E.疗 [单选,A2型题,A1/A2型题]有关"窗口技术"的论述,错误的是()A.利用窗技术可将任一范围的CT值调到人眼可识别的16个灰阶显示B.窗位是指窗宽上限与下限CT值的平均值(中点)C.窗位与窗中心指的是同一个概念D.调窗目的是为了适应胶片的感光度E.视不同组织影像,应适当地调整窗宽/窗 [单选]()什么分析法是对具有复杂联系的社会经济现象进行数量分析的一种科学方法。A.多指标综合分析法B.信息化综合指示法C.投入产出D.综合产业力度法 [多选]新生儿肠旋转不良主要死亡原因为A.低体重儿B.合并其他严重畸形C.广泛肠坏死和穿孔D.术后肠梗阻持续存在或再发E.短肠综合征 [单选]在画转面动画时,角色造型要和()统一。A.原画B.造型设计C.中间画D.设计稿 [单选,A2型题,A1/A2型题]实验室管理者的最主要职责是()。A.决策与筹划,技术与业务B.组织和控制,处理与协调C.技术与业务,影响与号召D.决策与筹划,组织和控制E.影响与号召,处理与协调 [问答题]某建筑工程,地下1层,地上16层。总建筑面积28000m2,首层建筑面积2400m2,建筑红线内占地面积6000m2。该工程位于闹市中心,现场场地狭小。施工单位为了降低成本,现场只设备了一条3m宽的施工道路兼作消防通道。现场平面呈长方形,在其斜对角布置了两个临时消火栓,两者之 [填空题]在旋风预热器的各级管道和旋风筒中,气流和物料热交换作用相对运动方向(),但如果从整体来看,则运动方向()。 [单选]各岗位工作人员对()的业务操作安全负责。A.本单位B.本岗位C.本系统D.其他岗位 [单选,A2型题,A1/A2型题]下列小儿腹股沟疝的临床特点中,错误的是()A.出生后腹膜鞘状突未闭B.腹股沟区解剖结构薄弱、腹ห้องสมุดไป่ตู้松弛是疝发生的主要原因C.最常用的治疗方法是疝囊高位结扎术D.发生率最高的是腹股沟斜疝E.部分可采取保守治疗治愈 [单选]已知单代号网络计划中,工作A最早开始时间(ES)和最早完成时间(EF)分别为10天和24天,则其紧后工作8的最早开始时间(ES2)和最早完成时间(EF2)分别为()。A.10天和l8天B.18天和32天C.18天和24天D.24天和32天 [填空题]一个完整的广告活动,应该包括()、()、()、()、()五个要素。 [单选,A2型题,A1/A2型题]一锅炉房师傅,化学性窒息性气体中毒后皮肤、黏膜呈樱桃红色的原因主要是().A.呼吸加快B.空气氧含量增加C.动脉血氧含量增加D.动静脉血氧差下降E.心跳及血液循环加快 [问答题,简答题]投用蒸汽拌热线的操作? [单选]为使试样处于一种单向和均匀的应力状态下,拉伸试验规定在3个外在条件下进行,这三个条件是。()A.常温、常压、常湿B.常温、等速、常湿C.常温、静载、轴向D.常温、动载、轴向 [多选]下列有关行政法规的说法哪些是正确的?()A.省、自治区、直辖市人民政府认为需要制定行政法规的,应当在每年年初编制国务院立法工作计划前,向国务院报请立项B.起草行政法规,在赋予行政机关必要的职权的同时,应当规定行政机关行使职权的程序C.起草行政法规,涉及有关管理 [单选]下列()属于常用的渠道清淤措施。A、水闸关水搅沙B、高压水流清淤C、冲沙底孔冲沙D、挖泥船清淤 [单选,A1型题]有关RNA的叙述,错误的是()A.tRNA是氨基酸的载体B.hnRNA主要存在于胞质C.rRNA参与核糖体组成D.mRNA具有多聚A尾结构E.mRNA分子中含有遗传密码 [判断题]一般来说,人们随着知识,能力的提高和增强,会自己作出肯定的回答和评价,也希望别人认可并得到他人,集体和社会的尊重与爱护,这就产生了自尊心理.在这里,自我承认往往比社会承认更重要.A.正确B.错误 [单选]秘书对开具介绍信和使用印章具有()。A.签批权B.申请权C.监督权D.反对权 [单选]糖尿病最常见的神经病变是()A.周围神经病变B.神经根病变C.自主神经病变D.脊髓病变E.颅神经病变 [单选,A2型题,A1/A2型题]关于推拿基本手法归纳描述正确的是()A.摩擦、叩击、熏蒸、拿按B.振动、摩擦、摇动、推揉C.振动、充气、拿按、叩击D.叩击、推揉、拿按、电针E.电针、摇动、充气、振动 [不定项选择]依据生命周期分析的原则,环境影响评价中的清洁生产评价指标可分为()。A.生产工艺与装备要求B.产品指标C.废物回收利用指标D.污染物产生指标 [单选,A1型题]在五味中,有毒中药占有较高比例的是()A.辛B.酸C.甘D.苦E.咸 [单选]某学校组织了一次主题为“和睦大家庭”的民族关系图片展,展览内容按20世纪的不同年代分为若干板块,在60年代板块中可能展出的图片是()。A.内蒙古自治区成立30周年庆典B.新中国第一部宪法片段C.西藏自治区成立大会 [单选]性格在一定程度上会掩盖或改造人的()特征A.情绪B.意志C.气质D.理智 [单选]如果两个关系没有公共属性,那么其自然连接操作()A.转化为笛卡儿积操作B.转化为连接操作C.转化为外部并操作D.结果为空关系 [单选]脉压增大常见于A.主动脉瓣关闭不全B.缩窄性心包炎C.心包积液D.肺心病E.心肌炎 [单选,A4型题,A3/A4型题]男,29岁,火焰烧伤3小时,烧伤总面积80%,其中深Ⅱ°30%,Ⅲ°50%,伤后无尿,心律148次/分,呼吸32次/分,伤后头8小时输液4500ml(其中胶体1800ml)后仍无尿。针对无尿首先应()A.加快补液速度B.应用利尿剂C.查血电解质、尿素氮及肌酐D.应用血管 [单选]根据《中华人民共和国票据法》,下列关于票据的表述错误的是()。A.付款人是指在票据上签名并发出票据的人,或者说是签发票据的人。B.票据都有三方基本当事人C.票据是一种有价证券D.票据是无条件支付或无条件委托支付一定金额的凭证 [单选](),就是注重个人修养,待人接物要文明礼貌,不做粗俗鲁莽、有损社会公德的事。A、讲文明、讲礼貌B、讲道理C、讲信用D、讲效益 [单选,A型题]治疗支原体肺炎首选药物应是()A.青霉素GB.氨苄西林C.头孢霉素类D.磺胺类E.红霉素类 [单选]2006年3月,取得建造师资格证书的王某受聘并注册于甲公司,2007年6月工作单位变动后变更注册公司于乙公司,其变更后的注册有效期到()止。A.2009年3月B.2009年6月C.2010年3月D.2010年6月 [单选,A2型题,A1/A2型题]CT成像过程中需要测量体素的()A.质量B.密度C.线性衰减系数D.体积E.每千克电子数 [单选]摆放活动基础时,纵横排列要整齐,不准左右歪斜,基础表面水平,水平误差不超过()。A.6mmB.5mmC.8mmD.l0mm [单选]接收机对邻近干扰的抑制能力主要取决于()。A.高放谐振回路B.中放谐振回路C.混频器
