沪教版九年级化学上册3.1.3 原子结构 相对原子质量ppt课件
3.1 构成物质的基本微粒(相对原子质量)-沪教版化学九年级上册课件
苹果 100g 哈密瓜 400g 西瓜 1600g
思考
把一个苹果作为参照物,称其质量 为100g,计作其相对质量为1
计量原子质量时,选取谁做标准呢???
国际上统一: 以碳12原子质量的1/12作为标准。
C12
O
H
相对原子质量
以一个碳-12原子(其中含6个质
子和6个中子)质量的1/12为标准,其他原子的
质量跟它相比较所得的比值,作为这种原子的
相对原子质量。(符号为Ar)
一个碳原子的质量= 1.993×10-27Kg
标准=
1 12
×1.993×10-26Kg
≈ 1.67×10-27Kg
氢原子质量
氢的相对原子质量= 1.67×10-27Kg =1 1.67×10-27Kg 标准
某原子的相对原子质量
这个原子的实际质量 碳12原子质量×1/12
9
相对原子质量计算
根据公式: 氧原子的相对原子质量=
=15.99799297….≈16
10
相对原子质量计算
根据公式: 铁原子的相对原子质量=
=55.923733065….≈56
若一个R原子的实际质量为A,一个 C—12原子的实际质量为M,则该原子的相 对原子质量Ar为:
Ar(R)=
A M/12
A相对原子质量与原子质量没有什么差别 B两种原子的质量之比等于它们的相对原子质量之比 C 由于原子的质量太小,使用不方便,所以采用相对原 子质量 D相对原子质量就是一个该原子的质量与 一个碳12原子 质量相比所得的。
2.一个碳12原子的质量是1.933×10-26kg,氧的相 对原子质量为16,则一个氧原子的实际质量为 ______________
沪教版初中化学九年级上册 3.1.3 构成物质的基本微粒 课件

氦(He)
氖(Ne)
氩(Ar)
【稳定结构】像稀有气体元素原子这样的结构叫8电子稳
定结构。
若只有一个电子层,则2电子也是稳定
结构(如: He)。
物质状态的变化微观三维模拟动画
固态
液态
气态
氯化钠结构示=
碳 原 子质量的1/12
(1)“相对原子质量”是一个比值;
(2)“相对原子质量”单位为“ 1 ”,可省略。
碳原子的相对原子质量是:12
氧原子的相对原子质量是:16
铁原子的相对原子质量是:56
下一页
相对原子质量的近似值
原子种类 质子数 中子数 核外电子数 相对原子质量
氢
1
练习
练习
1、填表:
原子种类 核电荷数 质子数 中子数 电子数 相对原子质量
H
1
10
1
1
Mg
12
12 12 12
24
Fe
26
26 30
26
56
2、氧原子的相对原子质量为( B ) A、2.657×10-26 B、16 C、2.657×10-26kg
D、16g
3、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数
1897年,英国科学 家汤姆生确认了原子 中都含有带负电的电 子
汤姆生
一、原子的结构
汤姆森的原子模型
在汤姆森的原子模 型中,原子好比是一 个西瓜,里面分散的 西瓜子就是带负电的 电子,西瓜肉就是带 正电的物质。
正电荷
电子
这个模型不久就 被实验事实否定了, 为什么呢?
粒子散射实验
2024版沪教版九年级上册化学全册ppt课件

02
热化学方程式是表示化学反应中能量变化的化学方程式,其中
包含了反应物和生成物的状态以及反应的热效应。
盖斯定律
03
盖斯定律指出,在相同条件下,无论是一步完成的还是分几步
完成的反应,其热效应总是相同的。
7
02 常见的化学物质
2024/1/25
8
氧气、氢气和氮气
氧气的性质和用途
氧气是一种无色、无味、无臭的 气体,化学性质活泼,能支持燃 烧和供给呼吸。氧气在医疗、冶
键等。
2024/1/25
分子间作用力
分子间作用力是分子之间存在的相 互作用力,包括范德华力、氢键等。
物质的三态变化
物质的三态变化与分子间作用力的 变化密切相关。
6
化学反应中的能量变化
2024/1/25
化学反应中的能量变化
01
化学反应往往伴随着能量的吸收或释放,表现为反应体系的温
度发生变化。
热化学方程式
质。
催化剂在反应中的作用研究
催化剂的作用:改变化学 反应速率,提高反应效率。
催化剂的特点
2024/1/25
能改变化学反应速率。
催化剂的应用:广泛应用 于化工生产、环保治理等 领域,如合成氨、汽车尾 气处理等。
本身的质量和化学性质在 反应前后不变。
22
05 定量研究在化学中的应 用
2024/1/25
酚
芳香烃分子中的氢原子被羟基取 代而生成的化合物,具有特殊的 酚香味和弱酸性。
醚
醇分子中的羟基被醚键取代而生 成的化合物,通式为R-O-R',具 有醚香味和一定的水溶性。
2024/1/25
31
油脂、蛋白质等营养物质认识
2024/1/25
3.1构成物质的基本微粒(第3课时原子的构成、相对原子质量)课件--九年级化学沪教版(全国)上册

阅读下表,你能得到什么信息?
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
铁
26
30
26
56
相对原子质量 ≈ 质子数 + 中子数
课时3 原子的构成 相对原子质量
在一般的化学计算中,多采用相对原子质量的近似值。相对原子质量可
从书后附录Ⅱ中查到。试查阅磷、铝、氮、钠、硫、镁6种元素原子的相
对原子质量。
磷P——31
铝Al——27
氮N——14
钠Na——23
硫S——32
镁Mg——24
课时3 原子的构成 相对原子质量
关于原子的质量
(1)原子的质量主要集中在原子核上。
(2)原子质量数值很小,运用书写都不方便,所以国际上一致同意采用了
相对原子质量
(3)相对原子质量是以一种碳原子质量的
为标准,其他原子的质量与它
4.知道原子结构与其化学性质的关系。
重点
课时3 原子的构成 相对原子质量
课时3 原子的构成 相对原子质量
新知学习
原子的构成
原子核
原子
(带正电)
质子 (每个质子带1个单位的正电荷)
中子 (不带电)
电子 (每个电子带1个核电荷数,
核电荷数在数值上与质子数相同。
原子的构成示意图
观察表格,你能发现哪些规律?
原子种类
质子数
中子数
核外电子数
氢
1
0
沪教版九年级化学上册第3章第1节构成物质的基本微粒第3课时原子的构成及相对原子质量课件

【重点难点提示】
1.在原子中质子数不一定等于中子数;对同一原子来说,核电荷数=质子数=核外电子数;
原子不显电性,但原子内存在带电的微粒。
2.某原子的相对原子质量=
一个该原子的质量 一个碳原子质量的 1
相对原子质量≈质子数+中子数
12
【易错易混警示】
1.原子是化学变化中的最小微粒,在化学变化中不可再分。
化中原子是最小粒子,原子没有破裂,而氢弹爆炸中原子破裂了
。
10
8
9.下表为几种常见原子的结构信息,认真阅读分析后回答:
符号
质子数
中子数
核外电子数 相对原子质量
C
6
6
6
12
H
1
0
1
1
O
8
8
8
16
Na
11
12
11
(1)构成原子的微粒有 三 种,原子中一定含有的微粒是 质子和电子 ,从表中数
据可以发现原子的相对原子质量= 质子数+中子数
。
(2)由表中信息可知,结构最简单的原子是氢原子,你还能获得有关原子结构的其他信
= 核外电子数
。
2.相对原子质量
1
以一种碳原子的质量的 12 作为基准,其他原子的质量与这一基准的 比 。
3.相对分子质量
相对分子质量等于 构成分子的各原子 的相对原子质量的总和。
1
【例题】 下列说法中不正确的是( ) A.原子核都是由质子和中子构成的 B.原子都是由原子核和核外电子构成的 C.原子的核外电子数等于核内质子数 D.原子是不显电性的 解析:有的原子核中没有中子,例如氢原子中没有中子,故A不正确;原子都是由原 子核和核外电子构成的,故B正确;原子的核外电子数等于核内质子数,故C正确;由 于原子核所带的电量和核外电子所带的电量相等,电性相反,所以整个原子不显电 性,故D正确。 答案:A
沪教版九年级上册化学 3.1.3 原子结构示意图、相对原子质量 课件 (共22张PPT)
二、相对原子量
氧
2.657×10-26 kg
碳
1.993×10-26 kg
2.657×10-26 kg
氧原子的相对原子质量=
(Ar)
1.993×10-26 kg × 1/12
练习一:
氢原子的质量 = 1.67×10-27 kg 铁原子的质量 = 9.288×10-26 kg 碳原子质量的1/12 = 1.66×10-27kg 求:氢原子和铁原子的相对原子质量。
思考和识记之母。”2021年11月9日星期二8时43分33秒20:43:339 November 2021 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。下午8时43分33秒
下午8时43分20:43:3321.11.9
原子核的半径大 约是原子半径的 十万分之一
原子核比原子小得多
原子
构成原子的粒子的电性和质量
粒子 种类
电性
质子
1个单位 正电荷
质量 1.6726×10-27 kg
中子 不带电 1.6749×10-27 kg
电子
1个单位 负电荷
质子量的1/1836
从下表中你能总结出什么规律?
原子 名称
氢 碳 氧 钠 铁
核电 荷数
1 6 8 11 26
原子核
学完本课题你知道什么
1.原子的构成
核外电子(带负电)
原子
原子核 质子(带正电) 中子(不带电)
2.原子里:质子数=核电荷数=核外电子数 相对原子质量(近似)=质子数+中子数
3.相对原子质量:以一种碳原子质量的1/12作为标准, 其它原子的质量跟它相比较所得的比,就是这种原子 的相对原子质量。
沪教版九年级上册化学《原子结构示意图、相对原子质量》课件公开课 (2)

原子的构成
原子核
(中心;正电荷;体积小)
质子
(带正电)
原子
中子
(不带电)
电子
(核外;带负电)
根据下表的信息,描述氧原子的构成。
原子种类 氧原子
质子数 8
中子数 8
核外电子数 8
8个质子、8个中子构成氧原子核, 氧原子核和核外的8个电子构成氧原子。
几种常见原子的构成
原子种类 氢 碳 氧 钠
质子数 1 6 8 11
2.657x10-26kg 氧原子的相对原子质量=
1.993x10-26kgx1/12
≈16
想一想
相对原子质量表示的意义是什么?
例如:氢的相对原子质量是1,氧的相 对原子质量是16,分别表示什么意义呢?
相对原子质量的意义
碳12原子质量的1/12
氧
氢
2.657x10-26kg
1.67x10-27kg
——中国科学院院士张青莲
一、原子的构成
原子
原子核 (+)
我的收获
质子(+) 中子(不带电)
核外电子(-) 核电荷数 = 质子数 = 核外电子数 二、相对原子质量
原子的实际质量 相对原子质量=
碳12原子质量的1/12
原子质量之比=相对原子质量之比
相对原子质量整数值=质子数+中子数
练一练
将①分子②原子③质子④中子⑤电子⑥原子核六种粒子中, 用序号分别填入下列适当空格中:
一个氧原子的质量是: 0.00000000000000000000000002657千克
一个铁原子的质量是: 0.00000000000000000000000009288千克
原子的质量很小,书写、记忆、运算都很不方便
初中化学沪教版九年级上册原子结构示意图、相对原子质量

探究二:核外电子是怎样运动的? 观看原子的核外电子运动的模拟动画。
氢原子的结构 (1个电子)
行星绕太阳运动
钠原子的结构 (核外11个电子)
二.原子核外电子的排布:分层排布
第一层电子 (2个)
第二层电子 (8个)
第三层电子(1个) 钠原子的结构 (最外层) (11个电子)
电子层: 1 2 3 4 5 6 7
+11 2 8 1
【课后作业】
以“我想像中的原子结构”为题,写一篇科普习作 或画一幅漫画。
人教版九年级化学第三单元《物质构成的奥秘》 的课题2
原子的结构
石狮市实验中学 帅小宝
浙江秦山核电站
福建宁德核电站
【问题思考】
原子是化学变化中的最小微粒。 原子是不可再分的最小微粒吗? 原子世界是什么样的呢? 人类是如何发现原子世界的?
【探索之路】
英国化学家 道尔顿
英国物理学家 汤姆生
英国科学家 卢瑟福
1803年 实心球模型
1904年 葡萄干蛋糕模型
1911年 太阳系模型
英国科学家 玻尔
英国物理学家 查德维克
1913年 波尔模型
1935年 发现质子中子
探究一:原子是怎样构成的?
+
【自学阅读】材料和课本P53并思考:
++
1. 原子是由哪两部分构成?
2. 原子核由哪几种粒子构成?
3. 核电荷数与质子数,电子数有什么关系?
我是一个小小的电子,我在原子里围绕着正中心 的原子核不停地高速运动。虽然空间很大,但我和 我的同伴总想挣脱原子核的吸引。可是原子核这个 小老头很有能耐,虽然只占原子的一丁点空间,里面 却由质子和中子构成。中子不带电,质子带正电,正 好把我身上的负电深深地吸引…
沪教版九年级上册化学课件:3.1第2课时 原子的构成

(2)在原子中质子数一定等于中子数。( ×)
(3)所有原子的原子核都是由质子与中子构成的。( ×) (4)相对原子质量就是原子的实际质量。( ×) 2.下列粒子不属于构成原子的粒子的是( C)
A.质子
B.中子
C.分子
D.电子
3.原子中,下列等量关系不一定正确的是( B)
A.质子数=电子数
B.质子数=中子数
探究点二:相对原子质量 2.如何用公式来表示原子的相对原子质量?
3.如何理解相对原子质量的定义? 答案:(1)相对原子质量≈质子数+中子数。 (2)作为相对原子质量标准的碳原子是原子核中有6个质子和6个中子的一种碳 原子。
数值来源 性质
数值大小 单位
两者的 联系
相对原子质量与原子质量的比较
原子质量
13.(核心素养题)原子是由原子核和电子构成的。原子核在原子中所占体积极小,其
半径约原子半径的十万分之一,因此,相对而言,原子里有很大的空间。α粒子是
带两个单位正电荷的氦原子核。1911年,科学家用一束平行高速运动的α粒子轰击
金箔时(金原子的核电荷数为79,相对原子质量为197),发现三种实验现象:
知识点二 相对原子质量
5.已知磷原子的核电荷数是15,相对原子质量是31,则磷原子的核内质子数是( )
A.15A
B.16
C.31
D.46
6.关于相对原子质量的叙述正确的是(
)
A.相对原子质量是一个比值,它的单位为“1A”
B.相对原子质量只是一个比值,它没有单位
C.相对原子质量就是原子的质量
D.碳的相对原子质量是12 g
6、“教学的艺术不在于传授本领,而在于激励、唤醒、鼓舞”。2021年11月下午3时47分21.11.1715:47November 17, 2021
沪教新课标九年级上册初中化学《第三章 第1节 构成物质的基本微粒 原子结构示意图、相对原子质量》_1
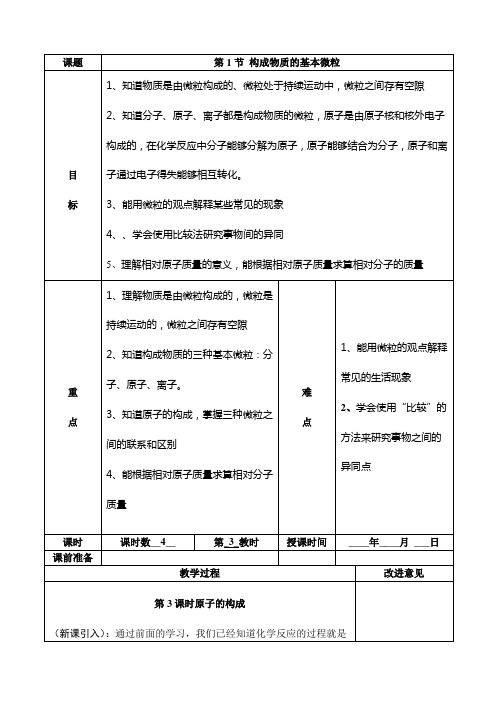
课题第 1 节 构成物质的基本微粒 1、知道物质是由微粒构成的、微粒处于持续运动中,微粒之间存有空隙2、知道分子、原子、离子都是构成物质的微粒,原子是由原子核和核外电子构成的,在化学反应中分子能够分解为原子,原子能够结合为分子,原子和离目子通过电子得失能够相互转化。
标3、能用微粒的观点解释某些常见的现象4、、学会使用比较法研究事物间的异同5、理解相对原子质量的意义,能根据相对原子质量求算相对分子的质量1、理解物质是由微粒构成的,微粒是持续运动的,微粒之间存有空隙2、知道构成物质的三种基本微粒:分1、能用微粒的观点解释重子、原子、离子。
常见的生活现象 难2、学会使用“比较”的方点3、知道原子的构成,掌握三种微粒之点间的联系和区别法来研究事物之间的异4、能根据相对原子质量求算相对分子同点质量课时 课前准备课时数__4__第_3_教时教学过程授课时间 ____年____月 ___日 改进意见第 3 课时原子的构成 (新课引入):通过前面的学习,我们已经知道化学反应的过程就是参加反应的物质的原子重新组合生成新的物质的过程。
那么不同的原 子(如氢原子和氧原子)有什么差异呢? (教师小结):上述问题的答案要从原子的内部去寻找,这就涉及到 又一个新的问题:原子能不能分成更小的微粒? (教师设问):你想象中的原子结构有哪些?(投影介绍):人类理解原子的过程:很早以前,在大家心目中的原子是一个没有内部结构的圆球。
但是,经过 20 世纪整整一个世纪的努力,科学家们不但打开了原子的大门,而且发现小小的原子内部结构复杂,构成原子的基本粒子已经发现了很多种,至今仍然在探索中。
人类对原子内部结构的理解是一部壮丽的史诗——1897 年汤姆生发现电子,说明原子并不是构成物质的最小粒子。
1911 年卢瑟福发现原子核。
(模拟探究):探究原子结构的奥秘:卢瑟福的α 粒子轰击金箔实验。
(问题与讨论):1、若质子质量,正电荷在原子内均匀分布,极少数α 粒子会发生大角度散射吗?____(填会或不会)。
沪教版九年级上册化学 3.1.2 原子 课件 (共34张PPT)

氢的相对原子质量 =
≈1
1.66×10-27 kg
2.657×10-26 kg
氧的相对原子质量 =
≈ 16
1.66×10-27 kg
一种碳原子的质量的1/12约为1.66×10-27 kg
9.288×10-26 kg
铁的相对原子质量 =
≈ 56
1.66×10-27 kg
相对原子质量与原子的质量成正比,原子质 量越大,相对原子质量越大。
1个原子的质量/kg 1.674×10-27 1.993×10-26 2.657×10-26 9.288×10-26
1、相对原子质量
规定以一种碳原子的质量的1/12作 为标准,其它原子的质量跟它比较所得 的值,就是该原子的相对原子质量。
相对原子质量只是一个比值,单位为 1,一般不写出。
例如:
1.674×10-27 kg
28 31 32 23 24 27 39 40
原子种类
铁 铜 锌 银 钡 金 汞 铅
相对原子 质量
56 63.5 65 108 137 197 201 207
一个质子和中子的质量大约相等, 都约等于碳12原子质量的1/12,即约等 于1个氢原子的质量,电子的质量很小, 仅相当于质子(或中子)质量的1/1836。 因此,电子的质量可以忽略不计,原子 的质量主要集中在原子核上。
构成物质的基本微粒
用原子的观点解释化学变化:
原子 原子 原子
分子
新分子
某物质
由分子构成的物质
新物质
原子和分子最大的区别就是: 分子在化学变化中可以再分,而 原子在化学变化中不能再分。
原子通过其他方法可以再分吗?
质子 (带正电荷)
原子核
沪教版初中化学九上 3.1.3 原子结构、相对原子质量 课件(17张PPT)

原子 (+) 中子
质量
(电原中性子) 电核子内有什么?
(-)
卢瑟福(英) 核电荷数=质子数 =核外电子数
三、原子—原子质量
一个碳原子的质量为1.993×10-26kg 一个氧原子的质量为2.657×10-26kg
... ...
相对原子质量(Ar)
是一个比值, 不是实际质量。
基准
碳原子
碳原子质量的1/12 氧原子
原子核的半径大约是原子半径 的十万分之一,在原子中的所占体 积极小。
但原子核几乎集中了原子的全 部质量,电子的质量相对要小得多。
三、原子—原子结构
原子
原子核
三、原子—原子结构
核外电子的分布 和运动有何规律?
三、原子—原子结构
资料卡:原子核外有不同的电子轨道,通常,
第一层能容纳2个电子; 第二层能容纳8个电子; 第三层能容纳18个电子……
(α粒子带正电荷)
现象:
大多α粒子能够穿透金箔,不改变前进方向; 一小部分α粒子改变了原来的运动路径; 极少数α粒子好像碰到了不可穿透的坚硬质点而被弹了回来。
三、原子—原子结构
卢瑟福(英)
“太阳系模型”
三、原子—原子结构
原子核
原子
核外电子
电量大小相等, 但电性相反。
显电中性,为什么?Fra bibliotek三、原子—原子结构
谢谢
原子结构、相对原子质量
原子能不能再分?
三、原子—原子结构
原子结构的发现
道尔顿
1803年
原子像一 个实心球
汤姆生(英)
1897年,汤 姆生发现所有原 子都含有带负电 荷的电子。
“葡萄干 蛋糕模型”
卢瑟福(英) ... ...
沪教版九年级上册化学 构成物质的基本微粒(3).pptx

离子构成的物质溶于水时能形成自由移动 的阳离子和阴离子,这是溶液导电的原因。
分子、原子、离子间的转化关系
分子 聚集
分解 结合
原子 结合 物质 组成 元素
得到或失去电子 结合
离子
请列举由分子、原子、离子组成 的物质各一例,并分别描述它的 构成和组成。
空白演示
在此输入您的封面副标题
符号为“1”,一 般可不写出。
所求原子的质量 相对原子质量=
碳原子的质量×1/12
相对分子质量
相对分子质量等于构成分子的各原子 相对原子质量的总和。
1、试根据相对原子质量的定义计算:铝原子和 钠原子的相对原子质量。
(mc=1.993×10-26kg,mF=4.482×10-26kg, mNa=3.819×10-26kg) 2、请根据课本P73表3-4相对原子质量的数据,
初中化学课件
鼎尚图文 整理制作
九年级化学(上册)第三章物质构成的奥秘
构成物质的基本微粒
——长中化学组
原子的结构
复习提问:
原子
. 原子核 (+) 核外电子 (-)
.
质子(+) 中Biblioteka (不带电)原子的质量相对原子质量
以一种碳原子的质量的1/12作为基准,其 他原子的质量与这一基准的比,称为这 种原子S的I制相单对位原为子“一质”量,。
2、化学反应的实质是原子的重新组合,在 组合过程中,原子总是力求使自身的结构 趋于或达到稳定结构。
3、在化学变化中原子常通过得到或者失去 电子的途径来达到稳定结构。
氯化钠的形成
沪教版九年级上册化学 3.1.3 原子结构示意图、相对原子质量 课件 (共18张PPT)

检测题:
1.若作为相对原子质量标准的碳原子的质量为mkg,
则相对原子质量为n的碘原子的质量是( )
A. 12n kg
m
B. 12 kg
mn
C.
mn 12
kg
D. n kg
12m
2.下列物质的相对分子质量最大的是 ( )
A.氧气(O2) C.水(H2O)
B.二氧化碳(CO2) D.氢氧化钙[Ca(OH)2]
交流与讨论
A的大因大微 多是1多粒数91数a轰1粒年主有击α子要一粒,金是个能英子箔原相穿国时不子对透科,核较改金学很大发变箔家小的现原,,空卢:而原间来瑟子且的福内不用运部改一和动变束原方原子带向。来之正间。的电前原荷进a粒方子向 B也有有一一部小部分分α粒a粒子子改改变变了了原原来来的的运运动动路途径经; 。原 因 C甚极是至你有少α能粒极数子试少近α带着数粒时正对受的子电到上a,被粒斥述经弹力子现过而被了带象改弹正回进变了电行来了荷回运解原的来动释金因。方吗原是向子?核a粒附子。撞到了。体积
课堂感悟
谈谈你的收获与体会
课堂作业要求:
1.认真审题 2.书写工整 3.解题规范 比谁做得又快又对!
沪教版 九年级化学上册
第三章 物质构成的奥秘
第1节 构成物质的基本微粒
——原子
第一节 构成物质的基本微粒
原子的构成、原子的质量
学习目标
1.知道原子由原子核和核外电子构成;
2.初步了解相对原子质量的概念, 学会查找相对原子质量表;
3.能根据相对原子质量计算相对分子 质量。
自学指导一
请认真自学P69“拓展视野” 上方的内容,2分钟后能回答下列 思考题:
检测题:
1.下列对原子构成的理解错误的是( ) A.原子整体不显电性 B.原子核比原子小得多 C.原子是不可分割的实心球体 D.原子质量主要集中在原子核上
3.1.3原子结构相对原子质量课件-九年级化学沪教版上册

3. 下表是几种原子的构成,下列有关说法不正确的是( )
原子种类 氢 氧 氯
质子数 1 8 17
中子数 0 8 18
核外电子数 1 8 17
A. 原子核都由质子和中子构成 B. 原子中质子数不一定等于中子数 C. 原子核所带正电荷数等于核内质子数 D. 原子不显电性 【答案】A
4. [创新题] [2021·温州期末]考古人员使用碳14(质子数为6) 年代检测法,测出三星堆出土的“鸟形金饰片”(如图)距 今约3200年至3000年。下列模型能表示碳14原子结构的 是( )
(防止液体喷出伤人)。
从而使油和水不再分层的现象。其中洗涤剂所起的作用叫乳化作用。
液体受热溢出),使试管与桌面约成45°的角度(增
N D. 12 M
7. 关于相对原子质量的说法:①相对原子质量是一个原子 1
的实际质量,②相对原子质量是一个原子质量的 12 , ③相对原子质量是原子的相对质量,是一个比值,④相
沪教版·化学·九年级上册
第3章 物质构成的奥秘
原子结构 相对原子质量
基础训练
1. 英国科学家汤姆生最早发现了原子中存在一种带负电的
微粒,证明了原子是可以再分的。汤姆生发现的这一微
粒是( C )
A. 原子核
B. 质子
C. 电子
D. 中子
2. 知识梳理有助于我们对已学知识的巩固,如图是某同学 学习物质结构层次后以氧气为例进行的梳理,下列选项 中与a、b、c对应的是( A ) A. 原子、原子核、核外电子 B. 原子核、原子、核外电子 C. 原子、核外电子、原子核 D. 核外电子、原子核、原子
(4)决定原子质量大小的粒子是____________。
C. 由1个带负电的质子和1个电子构成
沪教新课标九年级上册初中化学《第三章 第1节 构成物质的基本微粒 原子结构示意图、相对原子质量》_4

原子的结构(第一课时)1、知识与技能了解原子是由质子、中子和电子构成的利用图形、图示,化抽象为直观,初步学会使用类比、归纳、概括的方法收集和加工信息2、情感态度与价值观通过对微观世界的探索,增加学习化学的兴趣二:教学重难点1、教学重点原子构成微粒间的关系2、教学难点原子各构成微粒间关系式的应用三:教学过程1、新课导入PPT展示原子学说的发展过程,引导学生猜想原子核是否可分2、新课讲授知识点一:原子的结构提问:原子核是否可分学生:思考并回答展示:原子的微观结构图形和原子结构的相关数据学生:根据图示和原子结构相关数据描述原子构成提问:原子是否显电性?学生:思考并回答问题。
释疑:原子不显电性的原因展示:构成原子的各粒子带电情况归纳:核电荷数=质子数=核外电子数表格展示:碳、氢、氧、氟、氖、钠原子的构成微粒数由表格数据归纳:1、原子一般来说是由质子、中子、电子构成,但并不是所有原子核内都有中子(如氢);2.核外电子数=核内质子数=核电荷数;3.质子数不一定等于中子数;4.不同种原子的质子数不同;中子数可能相同。
知识点二:原子核外电子排布规律提问:绝大部分原子都不止一个电子,这些电子在原子核外是如何排列的呢?电子的排布有没有一定的规律呢?学生猜想与计论展示:核外电子的分层排布规律展示:原子结构示意图让学生猜想原子结构示意图上各数字和符号的含义,教师最后总结归纳展示:1——18号原子的原子结构示意图,学生分析计论,完成填空四:小结作业1、课堂小结梳理本课重点知识结构2、作业随堂练习并完成课后习题五:板书设计质子原子核中子原子核外电子原子核外电子排布规律:分层排布原子结构示意图六:教学反思成功之处:本课设计紧扣课程标准,教学方法选择较为适当,学生学习效果较好,课堂气氛较为热烈。
不足之处:教学基本功有待提升,师生互动较少。
秋沪教九级化学全册相对原子质量(优秀文档PPT)

核心 相对原子质量
第1节[构解成物析质的]基1本微个粒 铅(Pb)原子质量是
34.419×10-26
kg,一个碳 12 原子质量是 1.993×
0.00000000000000000000000001993 kg 即1.
第 我1们节是1以构0一成-种物2碳6质原的k子基g的本,质微量粒则的 作铅为基原准,子其他的原子相的质对量与原这一子基准质的比量,称是为这种1原.3子94的9.相34对×1原9子1×质0量-1。206 -k26g×kg112≈207.2。
知识点 相对原子质量
A.9.288×10 kg 第1节 构成物质的基本微粒
知识点 相对原子质量 1.铁的相对原子质量是( )
-26
关系式:相对原子质量≈质子数+中子数
B.9.288×10-26 秋沪教九级化学全册相对原子质量课件PPT
0.00000000000000000000000001993 kg 即1. 40+(16+1)×2=74
第1节 构成物质的基本微粒
[归纳提升]
相对原子质量只是一个比值,不是原子的实际质量,相对原 子质量与原子的实际质量成正比,即实际质量越大的原子,其相 对原子质量也越大。
[课堂速记]
第1节 构成物质的基本微粒
核心 相对原子质量
核心 例1 相对原子质量1个铅(Pb)原子质量是34.419×10-26 kg,一个碳12原子质量是
第1节 构成物质的基本微粒
例 2 下列叙述正确的是( C ) A.相对原子质量是原子质量的简称 B.C-12 原子的相对原子质量是 12 g C.相对原子质量是一个比值 D.相对原子质量等于碳原子质量的112
1 [解析] 国际上以一种碳原子的质量的12作为标准,其他原子的质量跟它相比较 所得到的比值,就是该原子的相对原子质量,单位是“1”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
能力提升练
15.如图为某原子结构模型的示意图,其中a、b、c是构 成该原子的三种不同粒子,下列说法正确的是( ) A.决定该原子种类的粒子是b B.原子中b与c的数目一定相同 C.原子中a与c的数目一定相同 D.原子的质量集中在a和c上
基础巩固练
9.已知某原子的实际质量为 M g,又知碳 12 原子的实际质量为 N g ,则该原子的相对原子质量为( A ) A.12NM B.12MN C.12MN D.12NM
基础巩固练
10.有两种不同的原子,一种核内有6个质子和6个中子,
另一种核内有6个质子和7个中子,则它们不相等的是
( D)
20 A
21 见习题 22 (1)106 (2)122.5 (3)58 23 见习题
基础巩固练
1.对认识原子的结构作出突出贡献的科学家是( C ) A.道尔顿 B.张青莲 C.卢瑟福 D.拉瓦锡
基础巩固练
2.下列各种粒子中,带负电荷的是( A ) A.电子 B.中子 C.质子 D.原子核
基础巩固练
A.核电荷数
B.核外电子数
C.原子的带电量 D.原子的质量
基础巩固练
11.下列说法中正确的是( ) A.原子的质量主要集中在原子核上 B.相对原子质量就是原子的实际质量 C.相对原子质量近似等于质子数和电子数之和 D.相对原子质量是一个比值,没有单位
此页为防盗标记页(下载后可删)
教师课堂用语在学科专业方面重在进行“引”与“导”,通过点拨、搭桥等方式让学生豁然开朗,得出结论,而不是和盘托 出,灌输告知。一般可分为:启发类、赏识类、表扬类、提醒类、劝诫类、鼓励类、反思类。
1. 你真让人感动,老师喜欢你的敢想、敢说、敢问和敢辩,希望你继续保持下去。 2. 这么难的题你能回答得很完整,真是了不起!你是我们班的小爱因斯坦。 3. 你预习的可真全面,自主学习的能力很强,课下把你的学习方法介绍给同学们,好不好? 4. 哎呀. 通过你的发言,老师觉得你不仅认真听,而且积极动脑思考了,加油哇! 四、提醒类
能力提升练
【点拨】本题运用信息处理法解答。由大多数α粒子能穿透 金箔,而且不改变原来的前进方向,说明原子内有相对较大 的空间;有一小部分α粒子改变了原来的运动路径,说明α粒 子途经金原子核附近时,受到斥力而改变了原来的运动路径; 极少数α粒子被弹了回来,说明α粒子撞击到带正电荷、质量 大、体积小的金原子核而被弹回。金原子的核外电子数=核 电核数=79。根据上述分析可知,原子核体积很小;原子内 部有相对较大的空间;原子核与α粒子的电性相同;原子中 有相对较大的空间,原子不是一个实心球体。
基础巩固练
5.同一原子中,下列说法错误的是( B ) A.质子和电子的数目相同 B.原子和中子的电性不同 C.原子核和电子的质量不同 D.原子核和原子的体积不同
基础巩固练
6.下列关于原子的叙述,不正确的是( C ) A.原子是化学变化中的最小粒子 B.原子可以直接构成物质 C.原子不带电是因为原子中不存在带电粒子 D.核外电子在原子核外的空间里作高速运动
【点拨】原子呈电中性是因为原子核所带的正电荷与核外 电子所带的负电荷电量相等,电性相反。
基础巩固练
7.道尔顿、汤姆生和卢瑟福等科学家对原子结构进行了 不断探索,下列叙述正确的是( )
①原子由原子核和核外电子构成 ②原子的质量主要集中在原子核上 ③原子核在原子中所占的体积极小
A.①② B.①③ C.②③ D.①②③
一、启发类
1. 集体力量是强大的,你们小组合作了吗?你能将这个原理应用于生活吗?你的探究目标制定好了吗? 2. 自学结束,请带着疑问与同伴交流。 3. 学习要善于观察,你从这道题中获取了哪些信息? 4. 请把你的想法与同伴交流一下,好吗? 5. 你说的办法很好,还有其他办法吗?看谁想出的解法多? 二、赏识类
【答案】A
能力提升练
19.【中考·连云港】铀235(其原子核内有92个质子,相 对原子质量为235)是核电站的主要燃料,下列有关说 法正确的是( B ) A.铀原子属于非金属原子 B.该原子的核电荷数为92 C.该原子核内有51个中子 D.该原子核外有143个电子
能力提升练
20.诺贝尔化学奖得主之一的瑞典科学家维特里希巧妙地 选用生物大分子中的某些原子(X)作为测量对象,测出 相邻X原子间的距离和方位,再通过计算机破译了某些 生物大分子的空间结构。已知X2+核外有24个电子,该 原子的相对原子质量是56,则X的中子数是( A ) A.30 B.32 C.48 D.80
基础巩固练
12.关于相对原子质量的说法有:①相对原子质量是一
个原子的实际质量,②相对原子质量是一个原子质量
的1/12,③相对原子质量是原子的相对质量,是一个
比值,④相对原子质量近似等于质子数和中子数之和,
⑤相对原子质量的单位是“g”,⑥一般化学计算时采
用相对原子质量的近似值。其中正确的是( B )
(3) 极 少 数 α 粒 子 被 弹 了 回 来 。 原 因 是 _α_粒__子__撞__击__了___金__原__子__核__而__被__弹__回__(_或__α_粒___子__撞__击__了__带__ _正__电__荷__、__质__量__大__、__体__积__很__小__的__金__原__子__核__而__被__弹__回__)_。
1. 说得太好了,老师佩服你,为你感到骄傲! 2. 你的设计(方案、观点)富有想象力,极具创造性。 3. 我非常欣赏你的想法,请说具体点,好吗? 4. 某某同学的解题方法非常新颖,连老师都没想到,真厉害! 5. 让我们一起为某某喝彩!同学们在学习过程中,也要敢于猜想,善于猜想,这样才能有所发现,有所创造! 三、表扬类
能力提升练
【点拨】本题采用图示分析法解答。首先分析原子结构模 型图可知,a带负电荷,为核外电子,b不带电,为中子,c 带正电荷,为质子。质子数决定原子的种类,故决定原子 种类的是c而不是b,A错误;原子中质子数一定等于核外电 子数,但质子数不一定等于中子数,故B错误,C正确;原 子的质量主要集中在原子核上,核外电子的质量可忽略不 计,即原子的质量主要集中在b和c上,D错误。 【答案】C
能力提升练
22.请计算下列各物质的相对分子质量: (1)Na2CO3:__1_0_6_________________________; (2)KClO3:__1_2_2_._5____________________; (3)Mg(OH)2:___5_8_______________________。
能力提升练
21.阅读短文,回答问题。 1911年,英国科学家卢瑟福用一束平行高速运动
的α粒子(α粒子是带两个单位正电荷的氦原子核)轰击 金 箔 时 ( 金 原 子 的 核 电 荷 数 为 79 , 相 对 原 子 质 量 为 197),发现大多数α粒子能穿透金箔,而且不改变原 来的前进方向,但是也有一小部分α粒子改变了原来 的运动路径,甚至有极少数的α粒子被弹了回来。
能力提升练
16.【中考·重庆A】碳12是指含6个中子的碳原子。下列
对氧16和氧18两种氧原子的说法正确的是( A )
A.质子数相同
B.质量相同
C.电子数不相同 D.16和18表示原子个数
能力提升练
17.已知碘-131的原子核内质子数为53,质子数与中子 数 之 和 为 131 , 则 下 列 关 于 该 原 子 的 说 法 正 确 的 是 ( C) A.中子数为88 B.核外电子数为131 C.核电荷数为53 D.1个该原子的质量为131 g
能力提升练
(1)有一小部分α粒子改变了原来的运动路径。原因是α粒 子途经金原子核附近时,受到斥力而改变了原来的运 动路径。
(2) 大 多 数 α 粒 子 不 改 变 原 来 的 前 进 方 向 。 原 因 是 __原__子__内__有__相__对__较__大__的__空__间_______________。
素养核心练
23.已知每个电子的质量约为每个质子(或中子)质量的 1/1 836,通过下表,可以总结出的规律有:
原子种类 质子数 中子数 核外电子数 相对原子质量
氢10来自11碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
硫
16
16
16
32
素养核心练
(1)_不__是__所__有__原__子__核__内__都__有__中__子_________________; (2)_在__原__子__中__,__质__子__数__=__核__外__电__子__数_____________; (3)_原__子__中__质__子__数__与__中__子__数__不__一__定__相__等___________; (4)_不__同__种__类__的__原__子__,__质__子__数__不__同__(_合__理__即__可__)____。
能力提升练
(4)金原子的核外电子数为____7_9_______。 (5) 由 此 可 推 测 有 关 原 子 内 部 结 构 , 其 中 正 确 的 是
___B_、__C________________。 A.原子核体积较大 B.原子内部有相对较大的空间 C.原子核与α粒子的电性相同 D.原子是一个实心球体
3.【中考·温州改编】联合国把2019年定为“元素周期表 年”。俄国科学家门捷列夫对元素周期表的编制作出 巨大贡献,人们将101号元素命名为“钔”来纪念他。 钔原子的核电荷数为101,则钔原子的质子数为( A ) A.101 B.157 C.258 D.359
