脂肪酶实验方案
脂肪酶活测定
一.脂肪酶活测定原理:脂肪酶在一定条件下,将甘油三酯水解。
在不同水解阶段可分别产生脂肪酸、甘油二酯、甘油一酯及甘油。
水解所产生的脂肪酸可以用标准的氢氧化钠滴定,用滴定值表示酶活力。
酸碱滴定法 :酶活力以国际单位表示,即在一定条件下,脂肪酶水解脂肪每分钟产生1微克分子脂肪酸的酶量定为一个国际单位。
脂肪酶活力单位=(A-B)*nf/t*v式中:A为样品耗碱液ml数,B为对照组耗碱液ml数,n为每毫升碱液微克分子数(n=cM=0.05x23x1000),f为稀释倍数,t为作用时间(分),v:反应的酶液的体积二.挥发性脂肪酸(VFA)的测定滴定法分析1原理:将废水以磷酸酸化后,从中蒸发出挥发性脂肪酸,再以酚酞为指示剂用NaOH 溶液滴定馏出液。
废水中的氨态氮可能对测定形成干扰,因此应当首先在碱性条件下蒸发出氨态氮。
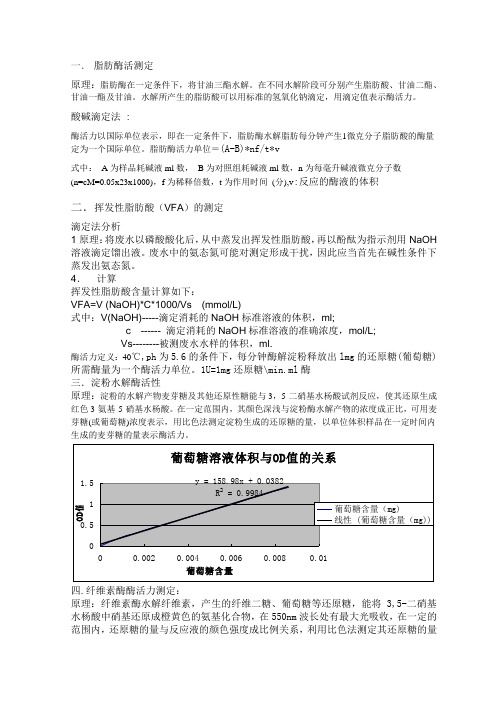
4.计算挥发性脂肪酸含量计算如下:VFA=V (NaOH)*C*1000/Vs (mmol/L)式中:V(NaOH)-----滴定消耗的NaOH标准溶液的体积,ml;c ------ 滴定消耗的NaOH标准溶液的准确浓度,mol/L;Vs--------被测废水水样的体积,ml.酶活力定义:40℃,ph为5.6的条件下,每分钟酶解淀粉释放出lmg的还原糖(葡萄糖)所需酶量为一个酶活力单位。
1U=1mg还原糖\min.ml酶三.淀粉水解酶活性原理:淀粉的水解产物麦芽糖及其他还原性糖能与3,5-二硝基水杨酸试剂反应,使其还原生成红色3-氨基-5-硝基水杨酸。
在一定范围内,其颜色深浅与淀粉酶水解产物的浓度成正比,可用麦芽糖(或葡萄糖)浓度表示,用比色法测定淀粉生成的还原糖的量,以单位体积样品在一定时间内生成的麦芽糖的量表示酶活力。
四.纤维素酶酶活力测定:原理:纤维素酶水解纤维素,产生的纤维二糖、葡萄糖等还原糖,能将3,5-二硝基水杨酸中硝基还原成橙黄色的氨基化合物,在550nm波长处有最大光吸收,在一定的范围内,还原糖的量与反应液的颜色强度成比例关系,利用比色法测定其还原糖的量就可测定纤维素酶的活力。
脂肪酶

显色剂,均匀搅拌3min,油酸分子与Cu2+
生成绿色的络合物,4000r/min离心10min
后取上层有机相在710nm处测定吸光度。
(三)、对硝基苯酚法
1、溶液配制准备
底物溶液配制:量取对硝基苯酚棕榈酸酯(pNPP)0.0378g,加入Triton X-100 1mL,用50mmoL/L Tris-HCL缓冲液(pH值8.0)定容100mmL。
8
9
10
10
20
14
38
33
五、结果与讨论
测定速度: 滴定法 稳定性: 铜皂法 铜皂法 对硝基苯酚法 对硝基苯酚法 滴定法
灵敏度:
对硝基苯酚法
铜皂法
滴定法
实际应用中,可根据不同需要选择测定方法。
酶相互间无法进行正常的活力比较。本实验就酸
碱ቤተ መጻሕፍቲ ባይዱ定法、铜皂法、对硝基苯酚法三种常用方法 进行了比较。
二、实验材料
脂肪酶,生物工程研究室提供
榨汁机,分析天平,碱性滴定管, 分光光度计,pH计,离心机,恒温水浴锅
脂肪酶活力单位
脂肪酶活力单位定义:在一定条件下,
每分钟释放出1μmoL脂肪酸的酶的量定义为
一个脂肪酶活力单位(U)。
三、实验方法
(一)、滴定法
底物溶液(乳化液)配制:量取4%PVA溶液150mL, 加入橄榄油50mL,用榨汁机处理3min,现配现用。
脂肪酶溶液配制:配制pH值为7.38的0.5mg/mL脂
肪酶溶液。
(二)、铜皂法
1、脂肪酸吸光度标准曲线的绘制
配制一系列不同浓度的油酸溶液,分别 取4mL油酸溶液置于锥形瓶中,加入1mL
18.32
16.98
19.23
脂肪酶实验方案

脂肪酶实验方案富集培养基( %) :酵母膏0. 02 , Na2HPO4 0.35 , K2HPO4 0. 15 , MgSO4·7H2O 0. 05 , NaCl 0.05 , 橄榄油1. 0 , pH 7. 0.溴甲酚紫筛选平板分离培养基 ( %) : 牛肉膏0. 5 , 蛋白胨1. 0 , NaCl 0. 5 ,葡萄糖0. 3 ,聚乙烯醇1. 0 ,橄榄油2. 5 , 琼脂1. 5 ;灭菌后加入过滤灭菌的溴甲酚紫(50 mg/ 100 mL) 0. 4 mL , pH 6.0 ,7.0 ,8. 0.种子培养基( %) :葡萄糖 2. 0 , (NH4 ) 2SO4 0.5 , K2HPO4 0.1 ,MgSO4·7H2O 0. 05 , 蛋白胨2. 5 ,橄榄油1. 0 , pH 7. 0.发酵培养基( %) :蛋白胨2. 0 , 蔗糖0. 5 , 橄榄油1. 0 , (NH4 ) 2SO4 0. 1 , MgSO4 〃7H2O 0. 05 ,K2HPO4 0. 1 ,pH 自然产脂肪酶菌株的筛选:将细菌接种到种子培养基上,于30 ℃,200 r/ min 摇床培养24 h,划线于溴甲酚紫筛选平板分离培养基上。
观察已生长的菌落周围有无透明圈,有红色水解圈的菌落对应的菌株即为产脂肪酶菌株。
脂肪酶高产菌株的筛选:(1)产脂肪酶菌株发酵培养:将产脂肪酶菌液按 1 %的接种量接入50 mL 发酵培养基中(250 mL 三角瓶) ,30 ℃,200 r/ min 摇床培养48 h;(2)上清液的制备:经6000 rpm/min离心10 min,收集上清液,用0.20 μm滤膜对上清液过滤除菌,滤液分装后-20℃保存待用;(3)(i)度法测定各菌株产酶相对大小:在pH7.5, 30℃条件下, 每分钟释放 1 μmol 对-硝基酚( ρ- nitrophenol) 所需的酶量, 定义为一个活力单位。
脂肪酶测定标准操作程序

脂肪酶测定标准操作程序1. 摘要脂肪酶检测用于定量测定人血清或血浆中脂肪酶的活力,用于临床相关疾病的辅助诊断。
2. 适用范围程序适用于日立7600自动生化分析仪检测血清、血浆中LPS 的浓度。
3. 职责使用日立7600自动生化分析仪进行测定LPS 浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP 的改动,可由任一使用本SOP 的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4. 检测方法上海科华生物工程股份有限公司生产的二脂肪酶监测试剂盒采用的是酶法。
5. 原理1,2-领-二月桂基-消旋-甘油-3戊二酸(6-甲基试卤素灵)酯−−→−脂肪酶1,2-领-二月桂基-消旋-甘油+戊二酸+6-甲基试卤素灵 1,2-领-二月桂基-消旋-甘油-3戊二酸(6-甲基试卤素灵)酯在样本中的脂肪酶的作用下水解生成1,2-领-二月桂基-消旋-甘油、戊二酸以及红色的6-甲基试卤素灵。
由于甲基试卤素灵在波长570nm 附近处有吸收峰所以在一定脂肪酶活力范围内,570nm 处吸光度的变化值与样本中脂肪酶活力成正比。
6. 仪器日立7600自动生化分析仪7. 试剂7.1 试剂来源:上海科华生物工程股份有限公司提供7.2 试剂瓶内主要成分:R1:Good ’s 缓冲液、共脂肪酶、脱氧胆酸钠、乙酸钙R2:酒石酸缓冲液、1,2-领-二月桂基-消旋-甘油-3戊二酸(6-甲基试卤素灵)酯、牛脱氧胆酸钠。
7.3 试剂稳定性:试剂避光保存于2-8℃,若无污染,可稳定至失效期,本试剂有效期为12个月。
试剂不可冰冻。
试剂开瓶后冷藏于分析仪中可以保存14天。
7.4 试剂准备:试剂为即用式。
8.标准品和质量控制8.1校准程序:使用某某公司提供的标准品对自动分析仪进行校准。
按照公司标准品使用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品响应量通过合适的数学模型绘制校准曲线。
8.2质控品某某公司提供的生化复合定值质控血清做为室内质控品。
脂肪酶的测定

脂肪酶的测定脂肪酶是一种能够加速脂肪分解的酶类物质,它在人类的体内起着非常重要的作用。
脂肪酶的测定是衡量人体脂肪代谢能力的一种方法,可以用于研究肥胖、代谢疾病等疾病的发病机制。
脂肪酶的测定方法有很多种,其中最常用的是化学法和免疫法。
化学法是利用化学反应测定脂肪酶的活性,它的原理是将样品与一种特定底物反应,通过测定产生的底物或反应产物的浓度,来计算脂肪酶的活性。
常用的底物有三酰甘油、辅酶A等。
免疫法则是利用特异性抗体与脂肪酶结合反应,进行测定。
这种方法具有灵敏度高、特异性好、操作简单等优点。
在进行脂肪酶测定前,需要收集样品。
常用的样品有血浆、血清、尿液等。
对于血浆和血清样品,需要在采集后立即离心分离血清或血浆,避免冷藏时间过长而影响测定结果。
对于尿液样品,需要在采集后立即保存在冰箱中,避免样品在室温下发生酶解反应。
此外,还需要注意样品的质量和数量,以保证测定结果的准确性。
脂肪酶的测定结果可以反映人体脂肪代谢能力的强弱。
正常情况下,脂肪酶的活性处于一定的范围内。
如果脂肪酶活性过高,说明人体脂肪代谢能力较强,有利于减肥和预防肥胖等疾病;反之,如果脂肪酶活性过低,说明人体脂肪代谢能力较弱,容易出现肥胖和代谢性疾病等问题。
需要注意的是,脂肪酶的测定结果并不是唯一的评估指标,还需要结合其他指标如体重、体脂率、血糖、血脂等指标进行综合分析。
此外,脂肪酶的测定结果也受到许多因素的影响,如年龄、性别、饮食、运动等因素都会对脂肪酶活性产生影响,因此需要综合考虑。
脂肪酶的测定是衡量人体脂肪代谢能力的一种方法,它对于研究肥胖和代谢疾病等疾病的发病机制具有重要的意义。
在进行脂肪酶测定时,需要注意样品的采集、处理和测定方法的选择,以保证测定结果的准确性。
芽孢杆菌液体发酵产脂肪酶实验报告

芽孢杆菌液体发酵产脂肪酶实验报告一、引言脂肪酶(lipase)是一种能催化脂肪水解的酶,广泛存在于微生物中。
而芽孢杆菌(Bacillus)是一种常见的细菌,具有良好的产酶性能和酶稳定性。
本实验旨在通过芽孢杆菌的液体发酵过程,获得高效产脂肪酶的条件,并对其产酶能力进行评价。
二、材料与方法2.1 发酵菌种的培养与保存1.预先培养芽孢杆菌菌株。
2.将菌株保存在琼脂斜面培养基中,并置于4℃冰箱保存。
2.2 液体发酵过程1.准备适宜的发酵培养基。
2.将预培养菌株接种到发酵培养基中,初始菌液浓度为OD600=0.2。
3.在适宜的温度(如30℃)下进行培养,并设定一定的培养时间(如48小时)。
4.定时取样,测定菌液中脂肪酶的活性,并监测菌液的各项指标变化。
2.3 脂肪酶活性测定1.取培养液中适量的样品。
2.根据脂肪酶活性检测试剂盒的说明书进行实验操作。
3.记录结果并计算菌液中脂肪酶的活性。
三、结果与讨论3.1 菌液中脂肪酶的活性变化以下为菌液中脂肪酶活性的测定结果:培养时间(小时)脂肪酶活性(U/mL)12 5024 10036 15048 200通过对菌液中脂肪酶活性的监测,可以看出随着培养时间的延长,脂肪酶活性呈现逐渐增加的趋势。
在培养48小时时,菌液中脂肪酶活性达到最高峰,为200 U/mL。
3.2 脂肪酶产量的评价为评价菌株的产酶能力,计算菌液中单位体积的产酶能力,即单位体积菌液中的脂肪酶活性。
在本实验中,采用菌液中脂肪酶活性最高的时间点(48小时)进行单位体积产酶能力的计算。
假设培养液的体积为V mL,计算单位体积的脂肪酶活性为:200U/mL。
由此可见,在本实验中,芽孢杆菌液体发酵过程中,脂肪酶的产量为200 U/mL。
四、结论本实验通过芽孢杆菌的液体发酵过程,成功获得了高效产脂肪酶的菌株。
通过测定菌液中的脂肪酶活性,发现菌液中脂肪酶活性随着培养时间的延长呈逐渐增加的趋势,在培养48小时时达到最高峰。
脂肪酶活检测原理及方法

脂肪酶活检测原理及方法脂肪酶活检测原理及实际方法:一、原理以及标准曲线做法1.对硝基苯酚酯(4-Nitrophenyl ester)是脂肪酶水解活力测定中运用最为广泛的一种底物,脂肪酶水解其产生pNP(对硝基苯酚)在碱性条件下显黄色,在410nm下有吸光值,且灵敏度很高。
2.所需试剂有:CAS 碳链长度出货号价格名称830-03-5 C2 N8130-1G ¥462 对硝基苯乙酸酯2635-54-9 C4 N9876-1G ¥570 对硝基苯丁酸酯1956-10-1 C8 21742-1G-F ¥487 对硝基苯辛酸酯1956-11-2 C12 61716-1G ¥435 对硝基苯月桂酸酯1492-30-4 C16 N2752-1G ¥379 对硝基苯棕榈酸酯14617-86-8 C18 N3627-1G ¥2621.97 对硝基苯硬酸脂全部为色谱纯试剂,购于sigma公司3.标准曲线绘制:a.标准对硝基苯酚母液(2mM,2mmol / L):称取0.02789g的对硝基苯酚(p-NP)溶于100ml 的溶液B(即不同pH的缓冲液),置于棕色试剂瓶内,4℃冰箱保存。
方法一:b.标准曲线绘制:分别取0.02,0.04,0.06,0.08,0.12,0.16ml的对硝基苯酚母液(2mM),用溶液B(即不同pH 的缓冲液)稀释至4ml,分别测定在410nm处的吸收值。
以对硝基苯酚浓度x(对应浓度分别是0.01,0.02,0.03,0.04,0.06,0.08,单位:mM)为横坐标,吸光值y为纵坐标,绘制标准曲线。
方法二:全部对硝基苯酚经过与测酶活相同的处理,获得吸光度。
b.标准曲线的绘制:分别取0、1.875、3.75、7.5、15、22.5、30、45μL的对硝基苯酚分别加入62.5、60.625、58.75、55、47.5、40、32.5、17.5μL的异丙醇和(全部都是)562.5的溶液B,40℃15min,95%乙醇,10000r / min,3min,测出标准曲线。
脂肪酶(LIP)测定标准操作程序SOP文件

4-8℃7天
-20℃1年
不能应用其他种类的抗凝剂,否则会造成结果的假性偏低,因为其他抗凝剂会造成lip的失活。
4试剂
4.1试剂
来源:ROCHE配套试剂(详见试剂说明书)。
贮存条件及稳定性:未打开试剂盒:2-8℃储存至效期末
R1:打开后机上稳定28天R2:Fra bibliotek开后机上稳定28天
准备:直接使用。
S.VOLUME(NORMAL) [ 3 ]
SD LIMIT [ 0.1 ]
S.VOLUME(DECREASE) [14/3/140]
SENSITIVITY LIMIT(LOW) [ 3.7 ]
S.VOLUME(INCREASE) [ 6 ]
SENSITIVITY LIMIT(HIGH) [ 6.5 ]
ABCD医院
生化实验室
文件编号:
ABCD-SOP-04-09
脂肪酶(LIP)测定
版序:ABCD
页码:第1页,共3页
1测定方法
速率法。
2测定原理
1,2-氧-dilauryl-消旋-甘油-3-戊二酸酯脂肪酶1,2-氧-dilauryl-消旋-甘油+戊二酸酯戊二酸酯自发降解戊二酸+methylresorufin
5仪器
ROCHE MODULAR P或日立7060生化分析仪。
6上机操作
见仪器作业指导书。
7参考范围
成年人:13-60/l
8性能指标
本法线性范围为3-303U/l,不准确度允许范围 ±10%,不精密度CV=0.65%,灵敏度为3U/l。
9注意事项
9.1血清标本出现溶血、脂血、黄疸或抗坏血酸的干扰情况参见抗干扰能力。
PROZONE LIMIT [ 0/LOWER ]
脂肪酶测定标准操作规程

血清脂肪酶测定标准操作规程1 检验申请单独检验项目申请:血清脂肪酶(缩写LPS)测定;组合项目申请:胰腺炎检测。
临床医生根据需要提出检验申请。
2 标本采集与处理2.1标本采集2.1.1常规静脉采血约2 ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
2.1.2检验申请单和血标本试管标上统一且唯一的标识符。
2.1.3急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5下列标本为不合格标本2.1.5.1标本量不足:少于0.3ml的全血标本,或少于0.1ml的血清或血浆。
2.1.5.2对反应吸光度有干扰的标本,包括严重溶血标本。
2.1.5.3无法确认标本与申请单对应关系的。
2.1.5.4其他如标识涂改、标本试管破裂等。
2.2标本保存2.2.1接收标本后在30min内将标本离心分离出血清。
2.2.2标本保存时间:室温(15~25℃)下可稳定1天,普通冰箱中(2~8℃)稳定7天。
-20℃可保存数月;-70℃至少可保存半年;应避免标本反复冻溶。
为避免标本中水分挥发使血清浓缩,对保存时间超过1天的标本均加塞密闭或覆盖湿巾。
2.2.3已完成测试的标本保持完整的识别号,置4~8℃冰箱内保存7天。
2.3标本采集的注意事项2.3.1采血前使受检者保持平静、松弛和空腹状态。
抽血前3天内避免高脂饮食,24小时内不饮酒。
2.3.2如果使用血浆,推荐的抗凝剂是肝素。
EDTA、草酸盐、氟化钠、枸橼酸对酶有抑制作用。
2.1.5 抽血前最好停用影响血脂的药物(如调脂药、避孕药、某些降压药、激素等)数天或数周,否则应记录用药情况。
3 方法原理采用1,2-邻-二月桂宗甘油-3-戌二酸-(6'-甲基试卤灵)-酯作为底物,OH-脂肪酶1,2-邻-二月桂宗甘油-3-戌二酸-(6'-甲基试卤灵)-酯 ----------1,2-邻-二月桂宗甘油 + 戌二酸 + 甲基试卤灵在570nm波长下,根据产物红色的甲基试卤灵生成速率测定脂肪酶的活性。
脂肪酶的检测方法

脂肪酶的检测方法1. 引言脂肪酶是一类能催化脂肪酯的水解反应的酶。
脂肪酶在食品工业、医学领域等具有重要的应用价值。
为了准确、快速地检测脂肪酶的活性和浓度,科学家们开发了多种检测方法。
本文将详细介绍脂肪酶的相关概念以及常用的检测方法,并对其优缺点进行比较分析。
2. 脂肪酶的概述脂肪酶是一种水解酶,主要催化脂肪酯的水解反应,将脂肪酯分解为甘油和脂肪酸。
脂肪酶广泛存在于动植物的组织中,如胃液、胆汁、胰液等。
脂肪酶的作用对于人体的脂肪消化和吸收至关重要,但过高或过低的脂肪酶活性都可能对人体健康产生不良影响。
3. 脂肪酶的检测方法概述常见的脂肪酶检测方法包括传统的酶活性测定法、光谱法、电化学法、电镜法等。
下面将分别介绍这些方法的原理、步骤以及优缺点。
3.1 传统的酶活性测定法•原理:该方法通过测定脂肪酶对底物的水解反应,间接反映脂肪酶的活性。
•步骤:1.准备含有脂肪酶的样品和底物溶液。
2.混合样品和底物溶液,并控制反应条件(温度、pH等)。
3.反应一段时间后停止反应。
4.使用比色法、比浊法等方法来测定反应产物(如甘油)的含量。
•优点:方法简单、成本低廉。
•缺点:测定结果受其他干扰物影响较大,灵敏度相对较低。
3.2 光谱法•原理:该方法利用脂肪酶催化反应过程中底物或产物的光学性质变化来检测脂肪酶活性。
•步骤:1.准备含有脂肪酶的样品和底物溶液。
2.在一定时间内记录底物或产物的光谱变化。
3.分析光谱数据,计算脂肪酶活性。
•优点:结果准确、灵敏度较高。
•缺点:需要专用的光谱仪器,成本相对较高。
3.3 电化学法•原理:该方法利用脂肪酶催化反应过程中产生的电流或电势变化来检测脂肪酶活性。
•步骤:1.在电极表面修饰脂肪酶或底物,并固定在电极上。
2.浸入电解质溶液中,建立电化学检测系统。
3.测量电流或电位的变化,并计算脂肪酶活性。
•优点:结果准确、实时监测。
•缺点:需要专用的电化学仪器,操作复杂。
3.4 电镜法•原理:该方法通过电镜观察样品中脂肪酶的形态和数量来评估脂肪酶活性。
脂肪酶、淀粉酶测定方法

脂肪酶测定——采用p-NPP法取0.5g样品,加去离子水10mL,40℃水浴浸泡2h,过滤。
取滤液1mL于试管中,加入pH8.0缓冲液3mL和1mmol/L p-NPP溶液0.1mL 于40℃下精确反应3min,迅速置于冰上终止反应。
在波长405nm处测定吸光度值。
对照管酶液用等体积去离子水代替,其余试剂相同。
Npp标准曲线Y=0.287x+0.0861(y:吸光度x:NPP浓度(umol/L))试剂配制:1mmol/L p-NPP溶液:称取0.0378g pNPP,加入1mL曲拉通-100与5mL异丙醇,用Tris-HCL(pH8.0)定容至100mL。
pH8.0 Tris-HCl:50mL 0.1M tris碱溶液与29.2mL 0.1M HCl溶液混合,加蒸馏水定容至100mL。
淀粉酶测定称取六神曲0.5g,研细,用20mL去离子水40℃浸泡1h,过滤。
取2只250mL的碘瓶,各加入5%的淀粉液25mL,10mL醋酸钠缓冲液(pH4.5),10mL蒸馏水,摇匀,40℃水浴预热5min。
A管中加入滤液5mL,准确反应1h,立即加2mol/L HCl 1mL终止反应,B管中先加入HCl,再加滤液5mL。
2只碘瓶分别加入0.05mol/L碘液10mL,0.1mol/L氢氧化钠45mL,边滴边振摇,暗处放置20min,加入1mol/L 硫酸2mL,用0.1mol/L硫代硫酸钠滴定至无色。
每份样品测定3次。
记录消耗硫代硫酸钠的体积,计算得淀粉酶活力。
淀粉酶活力是指1g六神曲粉末在一定条件下(T=40℃,pH=5.0),1h 内催化可溶性淀粉水解生成葡萄糖的毫克数。
计算公式:淀粉酶活力=[c×(vB-vA)·M·N]/2×m·t式中:c为硫代硫酸钠的浓度(mol/L),M为葡萄糖的摩尔质量(g/mol),N为酶液稀释倍数,V A为样品滴定值(mL),VB为空白滴定液(mL),m为六神曲的取样量(g),t为反应时间(h),淀粉酶活力单位为mg/(g·h) 。
脂肪酶的检测方法

脂肪酶的检测方法
脂肪酶是一种重要的酶类物质,它在人体内起着分解脂肪的作用。
脂肪酶的检测方法有多种,下面将介绍其中的几种常见方法。
1. 酶活力测定法
酶活力测定法是一种常见的脂肪酶检测方法。
该方法通过测定脂肪酶对底物的催化作用,来确定脂肪酶的活力。
具体操作步骤为:将待测样品与底物混合,加入适量的缓冲液,然后在一定的温度和时间下反应。
反应结束后,通过测定反应液中的产物浓度或底物消耗量来计算脂肪酶的活力。
2. 免疫学检测法
免疫学检测法是一种基于抗体与抗原相互作用的检测方法。
该方法通过检测脂肪酶在样品中的含量,来确定脂肪酶的水平。
具体操作步骤为:将待测样品与特异性抗体结合,形成抗原-抗体复合物。
然后加入标记有荧光物质的二抗,使其与复合物结合。
最后通过荧光信号的强度来测定脂肪酶的含量。
3. 基因检测法
基因检测法是一种通过检测脂肪酶基因的变异来确定脂肪酶水平的方法。
该方法通过PCR扩增脂肪酶基因,然后对扩增产物进行测序,检测基因序列中的变异情况。
根据不同的基因变异类型,可以预测脂肪酶的活力水平。
总之,脂肪酶的检测方法有多种,每种方法都有其特点和适用范围。
在实际应用中,应根据需要选择合适的方法进行检测。
血清脂肪酶操作程序

血清脂肪酶操作程序1.目的规范血清脂肪酶(LPS)检测试验,确保检测结果准确性和重复性。
2.范围本操作规程适用于生化室工作人员、实习人员、进修人员的操作前培训。
3.术语4.测定原理比浊法LPS甘油三酯 + 2 H 2O单酸甘油酯+2脂肪酸 在上述反应中,通过在340nm 波长处测定吸光度的下降速率,即可测得样本中LPS 的活力。
5. 标本采集与处理5.1标本类型:标本最好不要溶血。
留取标本后请尽快分离血清/血浆。
5.2标本稳定性:血清标本在室温下保存可稳定5天,在20-25℃稳定24h 。
6. 试剂6.1试剂:本科使用朗道试剂盒,干粉试剂。
试剂内主要成分如下:规格: 20×2.5ml6.2试剂准备试剂为液体单试剂,缓冲液溶解后即用。
6.3试剂稳定性 原装试剂在2~8℃避光保存,稳定至有效期。
试剂开瓶溶解后2~8℃稳定7天。
7.仪器参数设定AU2700参数设定:朗道试剂仪器参数具体参加试剂厂家提供的相应仪器的参数说明书.8.校准:具体参见临床生化校准程序8.1 校准条件:8.1.1仪器光路系统经过光路保养或更换光源等重要部件后。
8.1.2仪器经过大保养后。
8.1.3挪动仪器的安装地点。
8.1.4更换试剂批号。
8.1.5室内质控失控。
8.2 AU2700朗道试剂系统的校准:8.2.1 准备:朗道配套校准物,3ml蒸馏水溶解.8.2.2 保存和稳定性:原校准品在2~8℃保存至有效期,溶解后2~8℃稳定5天.8.2.3保存位置:2号冰箱。
8.2.4操作步骤:蓝色样本架的1号位置放蒸馏水;黄色样本架的相应位置放定标液→仪器主画面[USER] →[Calibration] →[选择校准项目]→[START]→[YES]。
9.室内质控及失控纠正:见临床生化室内质控程序9.1质控物来源:柏乐液体质控品(批号:45612/45613)。
9.2质控物储存条件及准备:-15~-20℃保存至有效期,从低温冰箱取出后室温平衡30分钟。
脂肪酶酶活测定方法

0.05mol/L氢氧化钠按GB/T601配制与标定。
使用时稀释10倍。
10g/LGB/T603配制。
1.5 待测酶液的制备称取酶样品1g~2g,精确至0.0002g,用磷酸缓冲液溶解并稀释。
如果是粉末,可加少量缓冲液研磨再稀释。
测定时控制酶液浓度,样品与对照消耗碱量之差控制在1mL~2mL范围内。
1.6 测定1.6.1 电位滴定法①②取两个100mL烧杯,分别作为空白A和样品B,分别参加底物溶液4mL和缓冲液5mL,再于A中参加95%酒精15.00mL,于40℃±0.2℃水浴中预热5min,然后各加1mL酶液,立即混匀计时,准确反响15min后,于B中立即补加15.00mL95%酒精终止反响,取出。
③在烧杯中参加一转子,置于电磁搅拌器上,边搅拌,边用氢氧化钠标准溶液滴定,至pH10.3,为滴定终点,记录消耗氢氧化钠标准溶液的体积。
1.6.2①取两个100mL三角瓶,分别作为空白A和样品B,分别参加底物溶液4mL和缓冲液5mL,再于A中参加95%酒精15.00mL,于40℃±0.2℃水浴中预热5min,然后各加1mL酶液,立即混匀计时,准确反响15min后,于B中立即补加15.00mL 95%酒精终止反响,取出。
②于A、B瓶中各酚酞两滴,用氢氧化钠标准溶液滴定,直至微红色并保持30s不退色为滴定终点,记录消耗氢氧化钠标准溶液的体积。
1.6.3 计算脂肪酶制剂的酶活力按以下公式计算:式中:X1——样品的酶活力,u/g;V1——滴定样品时消耗氢氧化钠标准溶液的体积,单位为毫升〔mL〕;V2——滴定空白时消耗氢氧化钠标准溶液的体积,单位为毫升〔mL〕;c——氢氧化钠标准溶液,单位为摩尔每升〔mol/L〕50——0.05mol/L氢氧化钠溶液1.00mL相当于脂肪酸50μmol;n1——样品的稀释倍数;0.05——氢氧化钠标准溶液浓度换算系数;15——反响时间15min,以1min计算。
脂肪酶酶活测定方法

附录A(规范性附录)脂肪酶酶活测定方法A.1 原理碱性脂肪酶可将甘油酯(油、脂)水解,在不同阶段可释放出脂肪酸、甘油二酯、甘油单酯及甘油。
水解生成的脂肪酸,可以用标准的碱溶液滴定,以滴定值表示酶活力。
反应式为:RCOOH+NaOH RCOONa+H2OA.2 适用范围本规定仅适用于脂肪酶对油脂水解活性测定方法。
A.3 用语定义A.3.1 酶活在一定条件下(温度36℃和pH9.4),水解甘油三酯每分钟生成1μmol脂肪酸的酶量,即为一个国际单位,以u/ml或者u/g表示。
A.3.2 基质被酶水解的物质,又称为底物。
A.4 试剂A.4.1 0.05 mol/LGly-NaOH缓冲液(pH9.4)A液:0.2 mol/L NaOH,称取NaOH(A.R)8.0 g,用蒸馏水定容至1000 ml;B液:0.2 mol/L Gly,称取甘氨酸15.014 g,用蒸馏水定容1000 ml;使用前取A液16.8 ml + B液50 ml,加部分蒸馏水稀释,再用酸度计调节pH至9.4,定容到200 ml。
A.4.2 橄榄油分析纯。
A.4.3 4%聚乙烯醇(PVA)溶液称取聚乙烯醇40 g(聚合度1750+50),加1000 ml 0.05 mol/L pH 9.4Gly - NaOH 缓冲液,沸水浴完全溶解后,冷却,必要时过滤,溶解过程中蒸发的水分要用蒸馏水补充,定容至1000 ml。
A.4.4 乙醇含量在95 %以上,为分析纯。
A.4.5 0.01 mol/L NaOH称取0.40 g A.R的NaOH,溶于新制备的冷却蒸馏水中并定容至1000 ml,置冰箱。
取分析纯邻苯二甲酸氢钾(A.R)少量于称量瓶中,105℃烘干至恒重(约2小时),然后称取4份,每份各0.600 g,分别放入4个100ml容量瓶中,加蒸馏水定容至刻线,溶解后,分别取10ml至4个250ml的三角瓶中,各取加入40 ml蒸馏水,摇允后,加三滴1 %酚酞,用待标定的NaOH溶液滴定至微红,即为终点。
脂肪酶(LPS)检测

迪信泰检测平台
脂肪酶(LPS)检测
脂肪酶(Lipase, LPS),又称为甘油酯水解酶,是一类特殊的酯键水解酶,具有对油水界面的亲和力,可催化甘油三酯水解生成脂肪酸和甘油(或者甘油二酯和单酯),在脂质代谢中发挥重要的作用。
脂肪酶普遍存在于动植物组织及微生物中,脂肪酶活性测定对于脂肪代谢分析具有重要意义,血清中脂肪酶活性测定可用于疾病的诊断。
迪信泰检测平台采用生化法,可高效、精准的检测脂肪酶活性变化。
此外,我们还提供其他脂肪代谢类的检测服务,以满足您的不同需求。
生化法测定脂肪酶样本要求:
1. 请确保样本量大于0.2g或者0.2mL。
周期:2~3周。
项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:
1. 实验步骤(中英文)。
2. 相关参数(中英文)。
3. 图片。
4. 原始数据。
5. 脂肪酶活性信息。
迪信泰检测平台可根据需求定制其他物质测定方案,具体可免费咨询技术支持。
脂肪酶活性条件试验设计

脂肪酶活性条件试验设计脂肪酶的最适温度测定试验一、目的:测量脂肪酶的最适反应温度二、原理:脂肪酶能分解脂肪产生脂肪酸,使得反应液ph下降,用0.01mol/LNaOH溶液中和所产生的脂肪酸,所消耗的0.01mol/LNaOH溶液体积与酶的活性成正相关性。
不同温度下,酶的活性与温度的关系可以通过0.01mol/LNaOH溶液体积间接反映出来。
三、方法:为保证测量结果的准确,脂肪酶的最适反应温度试验在国标里脂肪酶的活性测定的检验方法基础上改动震荡水浴温度,其余尽量保持不变。
四、检测步骤:酶活的测定(NaOH滴定法)固体:精密称取固状酶粉0.500g,放入小烧杯中,用约50ml缓冲液溶解,磁力搅拌15-20分钟,转移至100ml容量瓶中,用缓冲液都次冲洗烧杯,同时转移到容量瓶中,(注意不要起泡),定容至刻度,振摇1分钟左右,静置20分钟以上,取上清液再次进行下一步稀释,稀释倍数:以样品与对照消耗碱量之差在4.5-5.5ml范围内。
液体:准确吸取1ml样品于100ml容量瓶中,用缓冲液定溶到刻度,摇匀,进行下一步稀释,稀释倍数:以样品与对照品之差在4.5-5.5ml范围内。
再次稀释不得超过两次。
测定:取100ml三角瓶3只,其中2只是试样,1只是空白对照,每杯中的组成液为:4.0ml 缓冲液(pH9.4),5.0ml橄榄油乳化液,1.0ml酶液。
以上除酶液以外的组成液置于20摄氏度水浴锅预热5分钟,然后精确加入1ml酶液,精确计时,缓慢震荡(80次每分钟),保温10分钟,立即加入95%酒精20ml,取出,加入10ml30%氯化钠溶液,摇匀,使之破乳约1分钟,并同时做空白对照,对照同样品一样,先预热5分钟,保温10分钟,立即加入20ml95%酒精(1ml酶液先加入该20ml95%酒精灭活)。
用0.01mol/NaOH滴定样品至空白溶液的pH。
反应后的样品应在半小时内完成滴定。
通过计算算出酶的活性,记录结果。
脂肪酶测定SOP_LIP临床意义_检验科生化项目SOP

文件编号:
版本号:
页码:第页共页
1检测原理
当辅助脂肪酶、胆汁盐和氯化钙存在,脂肪酶能催化脂肪酶底物1,2-o-双十二烷基-rac-甘油-3-戊二酸-(6’-甲基试卤灵)酯的水解(反应图示如下)。通过水解生成不稳定的中间产物戊二酸-6’-甲基试卤灵酯。然后中间产物被H2O水解生成游离的甲基试卤灵,在577 nm波长上吸光。用577/700 nm的双波长反应可测定脂肪酶的活性。反应的比率与样本中脂肪酶的含量成正比。
5.2校准条件
在室内质控失控、更换试剂批号、更换仪器主要配件或进行大保养后均需校准。无特殊情况校准周期为3个月。
5.3校准程序
主屏幕按F5:PROCESS CTRL→F1:CALIBRATION,按enter→F2:SET-UP&RUN,按项目键选择所需要校准的项目名称METHOD,选中相应试剂批号LOT,输入操作者姓名Operator、校准液货号Calibrator
脂肪酶测定
文件编号:
版本号:
页码:第页共页
Product和批号Lot,以及最低值校准液在样品架上的位置Start at Position,最后把校准液各个水
平的值按照由低到高的顺序输到对应位置,按F4:ASSIGN CUPS指定样品杯,校准液按顺序排列在样品架上,按F7:LOAD/RUN→F4:RUN或“RUN”运行键运行校准程序。
3.1.1试剂组成
试剂船1~3孔为脂肪酶底物0.24 mM,胆汁盐10 mM,钠盐,钾盐,酒石酸盐缓冲液1.6 mM,片剂;4~6孔为三羟甲基氨基甲烷缓冲液50 mM,氯化钙2.0 mM,辅助脂肪酶2.8 x 105 U/Ld,片剂;7~8孔为NaOH0.53 M,液体。
3.1.2试剂准备
脂肪酶分解油脂实验报告

脂肪酶分解油脂试验汇报一、试验目的使用本公司生产脂肪酶催化油脂分解,研究最适脂肪酶添加量、最适PH、温度、反应时间。
二、试验理论基础脂肪酶催化三酰甘油酯及其他一些水不溶性酯类的水解、醇解、酯化、转酯化及酯类的逆向合成反应。
三、试验材料大豆油、脂肪酶(酶活10万单位)、聚乙烯醇、去离子水、氢氧化钠、酚酞、高速搅拌机、恒温摇床、PH计、分析天平、三角瓶;四、实验步骤1.量取10ml油脂,10ml聚乙烯醇,高速搅拌机中搅拌至油脂完全分散至聚乙烯醇中;2.量取30ml去离子水,加入到1体系中,高速搅拌形成稳定乳化体系;3.NaoH溶液调节PH值,加入一定量脂肪酶,震荡。
4.放入40℃、150r/min恒温摇床反应一定时间后,用0.1mol/LNaoH 滴定测定脂肪酸含量。
五、实验结论1.脂肪酶最适反应PH为7.5。
PH为7-8时,反应结束上层颜色黄色加深,下层颜色接近透明,其中经脂肪酸测定,PH为7.5时脂肪酸含量较高。
其他反应PH 值上层颜色仍接近乳白色。
2.脂肪酶最适反应时间为24h左右PH为7.5的条件下,酶的添加量取800PPm,考察最适反应时间24、36、48h。
经脂肪酸含量测定24-48h脂肪酸含量相差不大,可取最短时间。
3.脂肪酶最佳添加量为600ppm左右。
分别取300-800ppm浓度梯度进行脂肪酶添加量考察。
经脂肪酸含量测定600ppm脂肪酸含量相对较高。
六、试验不足1.由于本试验周期较长,规定试验时间较短,试验器材有限,最佳反应温度考察未进行,试验取经验值40±0.2℃。
2.重复性试验次数较少,不具备完全说服力。
3.试验紧靠肉眼观察和单一脂肪酸含量测定,数据片面,影响试验未知因素较多,实验过程仍需优化,结果仍需验证。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
脂肪酶实验方案
富集培养基( %) :酵母膏0. 02 , Na2HPO4 0.35 , K2HPO4 0. 15 , MgSO4·7H2O 0. 05 , NaCl 0.05 , 橄榄油1. 0 , pH 7. 0.
溴甲酚紫筛选平板分离培养基 ( %) : 牛肉膏0. 5 , 蛋白胨1. 0 , NaCl 0. 5 ,葡萄糖0.
3 ,聚乙烯醇1. 0 ,橄榄油2. 5 , 琼脂1. 5 ;灭菌后加入过滤灭菌的溴甲酚紫(50 mg/ 100 mL) 0.
4 mL , pH 6. 0 ,7.0 ,8. 0.
种子培养基( %) :葡萄糖2. 0 , (NH4 ) 2SO4 0.5 , K2HPO4 0. 1 ,MgSO4·7H2O 0. 05 , 蛋白胨2. 5 ,橄榄油1. 0 , pH 7. 0.
发酵培养基( %) :蛋白胨2. 0 , 蔗糖0. 5 , 橄榄油1. 0 , (NH4 ) 2SO4 0. 1 , MgSO4 〃7H2O 0. 05 ,K2HPO4 0. 1 ,pH 自然
产脂肪酶菌株的筛选:将细菌接种到种子培养基上,于30 ℃,200 r/ min 摇床培养24 h,划线于溴甲酚紫筛选平板分离培养基上。
观察已生长的菌落周围有无透明圈,有红色水解圈的菌落对应的菌株即为产脂肪酶菌株。
脂肪酶高产菌株的筛选:
(1)产脂肪酶菌株发酵培养:将产脂肪酶菌液按1 %的接种量接入50 mL 发酵培养基中(250 mL 三角瓶) ,30 ℃,200 r/ min 摇床培养48 h;
(2)上清液的制备:经6000 rpm/min离心10 min,收集上清液,用0.20 μm滤膜对上清液过滤除菌,滤液分装后-20℃保存待用;
(3)(i)度法测定各菌株产酶相对大小:在pH7.5, 30℃条件下, 每分钟释放 1 μmol 对-硝基酚( ρ- nitrophenol) 所需的酶量, 定义为一个活力单位。
脂肪酶催化对- 棕榈酸硝基苯酯分解产生ρ- nitrophenol, 在该过程中不断测定其光吸收值的变化。
根据单位时间产生ρ- nitrophenol 的量来反应脂肪酶的活力。
(本实验采用如下方法:分别向各菌株等量上清液中加入等量过量的对- 棕榈酸硝基苯酯,在反应过程中不断测定其光吸收值的变化,根据吸光值变化幅度确定产酶量大小。
)
[A液:16.5mmol/L的对硝基苯棕搁酸酯(p一NPP)的异丙醇溶液(冷藏,两周内使用)。
B液:含有0.4%Trilonx一100和0.1%阿拉伯树胶的50mmol/L的Tris一HCI缓冲液(pH8.0)。
测定时,将相应的A液与B液1:9混和,取100ul适当浓度的酶液加人900ul的上述混和液中,混匀,37℃反应10min后,用可见分光光度计(410nm)读取A值。
在此反应条件下,对硝基苯的消光系数是1.46x105cm3/mol。
1个单位的脂肪酶活力定义为每分钟分解p一NPP并释放出1umol对硝基苯所需的酶量。
]
(ii)平板法:采用三丁酸甘油脂平板鉴定法,鉴定板含2 %的三丁酸甘油脂乳化液和2 %的琼脂粉。
取10μl粗酶液加入鉴定板上各小孔(直径0. 20cm) 中,特定温度下放置12h 后,通过水解透明圈的直径大小来测定脂肪酶酶活性大小。
菌株产酶条件的优化
碳源对产酶的影响;分别选用葡萄糖、蔗糖、可溶性淀粉、麦芽糖、玉米粉、糊精、玉米淀粉、大豆油、橄榄油为碳源(均为2 %) 进行发酵,以平板透明圈法测定其产酶情况。
氮源对产酶的影响;以2 %糊精为碳源,分别选用蛋白胨、酵母膏、豆饼粉、牛肉膏、硫酸铵、硝酸铵(均为3 %) 为氮源进行产酶实验。
起始pH 值对产酶的影响:1 mol/ L 的HCl 和1 mol/ L 的NaOH 调节发酵培养基的初始pH 值, 分别为4. 0 ,5. 0 ,6. 0 , 7. 0 ,8. 0 和9. 0 ,在30 ℃下发酵2 d ,测定酶活,考察初始pH 值对酶活的影响. 结果显示,初始pH对产酶的影响很大,该菌株产酶的最佳起始pH 值在7. 0 左右,当pH 在9 的时候,菌体几乎不生长,产酶下降
温度对产酶的影响:优化的培养基,在不同温度下(24 ,26 ,28 ,30 ℃) 摇瓶发酵培养,寻找最佳的发酵温度. 菌株060805 在28 ℃下产脂肪酶最多
不同Mg2 + 浓度对产酶的影响;变发酵培养基中Mg2 + 的浓度,观察不同浓度的Mg2 + 对产酶的影响
脂肪酶的酶学特性
温度:脂肪酶酶促反应受温度影响很大, 在一定范围内温度升高反应速率加快, 一般来讲酶促反应的Q10为1~2。
另一方面, 温度过高会使酶蛋白变性失活。
大多数显示脂肪酶最佳温度范围介于30℃~40℃。
(25~55 ℃范围内以5 ℃为梯度以分光光度法(下同) 测定酶活)PH:脂肪酶的活力受pH 影响很大, pH 的变化可影响酶活性中心部位活性基团的解离, 从而影响到酶与底物的结合或催化底物转变为产物。
经调查, 大多数脂肪酶最适pH 值6~9。
(取一定量的纯化酶液与等体积的pH5. 0~11. 0 的各种缓冲液混匀,置于4 ℃下存放24h 后检测酶活(以未处理的酶液作为对照) )
热稳定性:取20 mL 酶液分别置于40 、50 、60 、70 ℃恒温水浴处理60 min , 每隔10min 取样测定残留酶活力(以未经处理的酶液作对照) .(一定量的纯化酶液分别置于不同温度下恒温处理30min(以未处理的酶液为对照) 分光光度法(下同) 检测其酶活)
影响脂肪酶活力的活性因子:肪酶活性的影响因子很多, 包括各种金属离子和有机化合物及表面活性剂等物质。
Ca2+和Mg2+、Na+、K+和Li+、Cu2+、Mn2+、Fe2+、Ba2+、Fe3+、Zn2+(取一定量的酶液分别与等体积10mmolPL 的各种金属离子及不同浓度的表面活性剂混匀,置于4 ℃下存放24h 后测定酶活(以未处理的酶液作为对照))。
