测定α淀粉酶活力的方法
α–淀粉酶活力测定[辅导]
![α–淀粉酶活力测定[辅导]](https://img.taocdn.com/s3/m/063e7ad19fc3d5bbfd0a79563c1ec5da50e2d602.png)
α–淀粉酶活力测定----目视碘比色法一实验目的1. 了解α–淀粉酶酶活力测定原理。
2.掌握α–淀粉酶酶活力测定的方法步骤。
二、实验原理比色法作为一种定量分析的方法,是以生成有色化合物的显色反应为基础,通过比较或测量有色物质溶液颜色深度来确定待测组分含量的方法。
常用的比色法有两种:目视比色法和光电比色法,两种方法都是以朗伯比尔定律 (A=kLC)为基础。
酶活力的大小、即酶量的多少用酶活力单位(U)(active unit)表示。
1961年国际生物化学学会酶学委员会提出采用统一的“国际单位”(IU)来表示酶的活力,规定为:在最适条件(25℃)下,每分钟内催化1微摩尔(μmol)底物转化为产物所需的酶量定为一个活力单位,即1IU = 1μmol /min。
这样酶的含量就可用每克酶制剂或每毫升酶制剂含有多少酶活力单位来表示(U/g或U/ml)。
淀粉(紫蓝色,30分子以上)红色糊精(红棕色,7-30分子)无色糊精(7分子以下)、麦芽糖不显色。
通过测定酶促反应分解一定量淀粉的时间,以标准糊精(红色糊精)和碘反应的颜色作为终点指示(所给定的淀粉都已转化为糊精的时间)。
碘比色法酶活力规定:在60℃条件下,1小时转化1g 淀粉变为糊精的酶量定义为1个酶活力单位。
三、实验操作1.取试管1支,加入1ml标准糊精和3ml 标准稀碘液。
2.取锥形瓶一个,加入2%淀粉20ml和Ph6.0的缓冲液5ml。
3.将锥形瓶置于60℃水浴中,保温5分钟。
4.在比色盘中加入比色碘液,每穴2滴。
5.在锥形瓶中加入淀粉酶溶液2 ml,摇匀,开始计时。
6.在反应的前4分钟,每隔1分钟从锥形瓶中取1滴液体,与比色稀碘液混合,而后,每隔30秒从锥形瓶中取1滴液体与稀碘液混合,直至呈色与终点色一致。
四、酶活性计算实验注意事项:(1)测定酶促反应在锥形瓶中进行,标准反应在试管中进行。
(2)比色盘第1号位加入标准糊精和2滴标准碘液。
(3)应时间大约在10-15分钟。
可见分光光度法测定α-淀粉酶活力

5
6
化 学 与 生 物 工 程 2020,Vol.37No.03 www.
hxy
swgc.
com
Chemi
s
t
r
i
oeng
i
nee
r
i
ng
y& B
do
i:
10.
3969/
i
s
sn.
1672-5425.
2020.
03.
013
j.
张雪娇,田欢,刘春叶,等 .可见分光光度法测定 α
G淀粉酶活力[
J].化学与生物工程,
o
r
t
i
ono
fc
omp
l
exf
o
rmedbyI3- ands
t
a
r
ch,
t
hea
c
t
i
v
i
t
fα
p
yo
,
amy
l
a
s
ei
sde
t
e
rmi
nedbyv
i
s
i
b
l
espe
c
t
r
opho
t
ome
t
r
i
chi
sde
t
e
rmi
nedt
hr
ought
heamoun
to
fs
t
a
r
chhyd
r
o
G
y wh
,
l
edbe
hec
onc
en
t
r
a
t
DNS法测定α淀粉酶活力的方法

生物学研究中关于糖测定中常用 的方法
菲林试剂滴定——还原糖,常量分析 DNS比色法——还原糖,微量分析 蒽酮比色法——总糖,微量分析
配制系列浓度稀释液的方法
线性稀释——稀释液的浓度梯度是相同的 (0,0.2,0.4,0.6,0.8,1.0……);
对数稀释(倍数稀释)——系列溶液的浓 度比是一常数,取决于稀释梯度——2倍稀 释(1、1/2、1/4、1/8……);10倍 稀释(1、1/10、1/100、 1/1000……);
调和浓度稀释——系列溶液的浓度为连续 排列整数的倒数(1,1/2,1/3,1/4, 1/5……)。
α-淀粉酶酶活力测定的原理
底物(反应物)为淀粉——碘比色法(反 应一定量淀粉为糊精的时间) 产物为麦芽糖、糊精等——麦芽糖为还原 糖,可以用测定还原糖的方法来测定其生 成量(如DNS法),从而计算出酶活力单 位。
计算公式:根据标准曲线计算。
3,5-二硝基水杨酸(DNS)试剂 配制说明
21g 氢氧化钠(先加入溶解);
182g 酒石酸钾钠(同上);
6.3g DNS(3,5-二硝基水杨酸),加 热完全溶于上述溶液中;
5g 重蒸苯酚(冷却后加入);
5g 无水亚硫酸钠(冷却后加入);
完全溶解后定容至1000ml,贮存时间越 长越稳定。
酶 活 力 测 定 步 骤 ( 流 程 )
蒸馏水 (mL)
2.0 1.6 1.2 0.8 0.4 0
麦芽糖含量 (mg)
0 0.4 0.8 1.2 1.6 2.0
DNS试剂 (mL)
2.0 2.0 2.0 2.0 2.0 2.0
加入完成混匀后沸水浴5min,定容至25mL混匀比色。
预留发酵液酶活力测定 需要稀释倍数
实验一 α-淀粉酶活力的测定

颜色变化终点要照像,并多媒体型实验结果 单独标注班级和小组名提交或图片型实验结果 直接写入在实验报告书里。
[实验报告书书写要求]
1. 实验报告书的编写要参考教师提出的写作格式规范。 2. 即:题目、作者(包括同组成员)、单位(班级和组别)、
酶活力单位(g/ml)=(60/T×20×2%×N)÷0.5
60 —酶活定义中反应时间为60min; T —反应时间(min); 20 —可溶性淀粉的毫升数; 2% —可溶性淀粉浓度; N —酶液稀释倍数; 0.5 —测定时所用的稀酶液量(ml)。
表 1 α-淀粉酶活力测定结果
X
[实验结果处理要求]
酶活力单位gml60t202n05实验结果计算实验结果计算重复数反应时间min酶活力gmlmin要求实验过程中淀粉的颜色变化过程录像或颜色变化终点要照像并多媒体型实验结果单独标注班级和小组名提交或图片型实验结果直接写入在实验报告书里
实验一 α-淀粉酶活力的测定
[实验性质] 验证性实验 [实验学时] 2学时 [实验目的] (1) 掌握淀粉酶糖化淀粉的原理;
[实验步骤]
第一步:待测酶液的配制; 第二步:标准色的配制; 第三步:样品的酶解反应; 第四步:计算。
1. 待测酶液的制备
α-淀粉酶
1.000 g
①
50 mL
2. 标准色的配制
150mL
60℃,30 min
250 mL
③可溶性淀粉 2.0g
酶液
2%淀粉液
A液
②
B液
8.0 mL 1.0 mL
3. 样品测定步骤
中文摘要、中文关键词、英文摘要、英文关键词、前言、材 料与方法、结果与讨论、结论、参考文献等顺序。 2. 报告书的篇幅要求2000字以上。 3. 参考文献必须5篇以上,并至少有一篇英文。 4. 提交时间限为每周一 下午3点。先交到课代表,由课代表汇 总之后按时送到任课老师办公室。 5. 领取的报告书要妥善保管,期末考试时作参考。
α-淀粉酶测定的操作规程
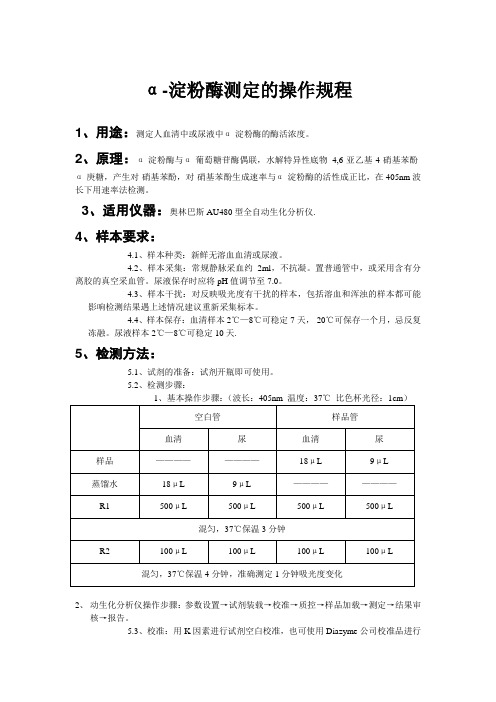
α-淀粉酶测定的操作规程1、用途:测定人血清中或尿液中α-淀粉酶的酶活浓度。
2、原理:α-淀粉酶与α-葡萄糖苷酶偶联,水解特异性底物4,6-亚乙基-4-硝基苯酚-α-庚糖,产生对-硝基苯酚,对-硝基苯酚生成速率与α-淀粉酶的活性成正比,在405nm波长下用速率法检测。
3、适用仪器:奥林巴斯AU480型全自动生化分析仪.4、样本要求:4.1、样本种类:新鲜无溶血血清或尿液。
4.2、样本采集:常规静脉采血约2ml,不抗凝。
置普通管中,或采用含有分离胶的真空采血管。
尿液保存时应将pH值调节至7.0。
4.3、样本干扰:对反映吸光度有干扰的样本,包括溶血和浑浊的样本都可能影响检测结果遇上述情况建议重新采集标本。
4.4、样本保存:血清样本2℃—8℃可稳定7天,-20℃可保存一个月,忌反复冻融。
尿液样本2℃—8℃可稳定10天.5、检测方法:5.1、试剂的准备:试剂开瓶即可使用。
5.2、检测步骤:2、动生化分析仪操作步骤:参数设置→试剂装载→校准→质控→样品加载→测定→结果审核→报告。
5.3、校准:用K因素进行试剂空白校准,也可使用Diazyme公司校准品进行校准操作,当试剂更换批号、出现质控漂移、仪器做完保养后及重要零件更换时,须重新校准。
5.4、结果计算:全自动生化分析仪会自动给出检测结果。
3、6、参考范围:(各医院应根据本地区实际情况建立自己的参考范围。
)7、注意事项:7.1、试剂具有一定的酸碱性,避免直接接触皮肤和眼睛,切勿吞咽。
7.2、使用后的器具应按照规定处理,扔入指定的垃圾箱内,不可随处乱扔,防止环境污染和二次使用。
7.3、由于运输过程产生渗液或漏夜的产品,或在运输贮存中没有按照说明书要求进行维护的试剂,不可使用。
7.4、试剂只用于体外诊断。
8、参考文献:中华人民共和国卫生部医政司,全国临床检验操作规程(第三版),东南大学出版社,2006。
王惠萱、李雪梅、王冈,临床检验操作手册,云南科技出版社,2008.陆永绥、李清华、张伟民主编,临床检验自动化仪器分析标准操作规程,浙江大学出版社,2006.。
α-淀粉酶测定标准操作程序

α-淀粉酶测定标准操作程序1.摘要α-淀粉酶试剂盒适用于定量测定人血清、肝素化血浆、尿液样本中α-淀粉酶的活力。
2.适用范围程序适用于日立7600自动生化分析仪检测血清、血浆中α-AMY的浓度。
3.职责使用日立7600自动生化分析仪进行测定α-AMY浓度的工作人员要严格按照本SOP程序进行,室负责人监督管理;本SOP的改动,可由任一使用本SOP的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4.检测方法上海科华生物工程股份有限公司的α-AMY试剂测定采用CNPG3方法。
5.原理底物CNPG3在α-AMY催化下产生的 2-氯-4-硝基苯酚(CNP)引起波长405nm 处吸光度上升,上升的速率与α-淀粉酶的活力成正比。
5CNPG3−−→−AMY3CNP+2CNP2+3G3+2G6.仪器日立7600自动生化分析仪7.试剂7.1试剂来源:上海科华生物工程股份有限公司提供7.2试剂瓶内主要成分:MES缓冲液(PH6.0)、醋酸钙、硫氰酸钾、CNPG3。
表面活性剂、防腐剂7.3试剂稳定性:试剂避光保存于2-8℃,若无污染,可稳定至失效期,本试剂有效期为12个月。
试剂不可冰冻。
试剂打开后冷藏于分析中可保存28天。
7.4试剂准备:试剂为即用式。
8.标准品和质量控制8.1校准程序:使用某某公司提供的标准品对自动分析仪进行校准。
按照公司标准品使用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品响应量通过合适的数学模型绘制校准曲线。
8.2质控品某某公司提供的生化复合定值质控血清做为室内质控品。
每日在测定前做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
8.3质控数据管理:按程序对检验后的质控后结果进行转换,及时质控数据进行分析处理,如出现失控值,应及时分析失控原因,并填写好相关失控记录。
8.4质控判断规则:按《Westgard多规则质控方法测定标准操作程序》8.5室间质评:分别参加某地区室间质评,对回报的室间质评结果按《室间质量评价程序》进行处理。
二硝基水杨酸淀粉酶

二硝基水杨酸淀粉酶
二硝基水杨酸(2,4-dinitrosalicylicacid,简称DNS)淀粉酶法是一种用于检测淀粉酶(也称为α-淀粉酶)活性的常见方法。
这种方法基于淀粉的降解产生还原糖,进而与DNS反应,形成有色产物,可以通过测定产物的吸光度来定量测定淀粉酶的活性。
这个方法的基本步骤如下:
1.淀粉的降解:
淀粉酶催化淀粉分解成较小的多糖分子,主要是麦芽糖。
2.DNS试剂的添加:
加入DNS试剂,DNS试剂中的二硝基水杨酸与还原糖反应,生成有色产物。
3.热处理:
将反应混合物进行热处理,使得产物进一步显色。
4.吸光度测定:
使用分光光度计测定混合物的吸光度,吸光度值与还原糖的浓度成正比,从而可以间接地测定淀粉酶的活性。
这个方法是一种常用的、相对简便的淀粉酶活性测定方法,广泛应用于食品工业、酿酒业、生物技术等领域。
由于其敏感性和可操作性,使得这个方法在实验室和工业生产中得到广泛应用。
酶活力测定讲解

2019/5/10
20
2.试剂 ? Folin- 酚试剂见“蛋白质含量测定”。 ? 0.4mol/L 碳酸钠溶液。 ? 0.4mol/L 三氯乙酸溶液。 ? 缓冲溶液
①PH7.5 磷酸缓冲液,适用于中性蛋白酶。 ②pH3.0 乳酸缓冲液,适用于酸性蛋白酶。 ③pH10.5 硼酸缓冲溶液,适用于碱性蛋白酶。
取两个100ml三角瓶分别于空白瓶和样品瓶中各加底物溶液4ml和磷酸缓冲液5ml于空白瓶加入95乙醇15ml40水浴预热5min然后在两瓶中各加待测酶液1ml立即混匀计时40水浴中准确反应15min在样品瓶中立即补加95乙醇15ml终止反应取出于空白瓶和样品瓶中各加酚酞指示液005mollnaoh标准溶液滴定直至微红并保持30s不退为其终点记录消耗005mollnaoh标准溶液的体积201951035计算酶活力定义
上述各种缓冲溶液,均须用 pH计校正。
2019/5/10
21
10g/L 酪蛋白溶液:称取酪蛋白 1.000g ,准确至 0.001g ,用少量 0.5mol/L NaOH 溶液(若酸性 蛋白酶则用浓乳酸 2~3滴)湿润后,加入适量 的各种适宜 pH 的缓冲溶液约 80mL ,在沸水浴 中边加热边搅拌,直至完全溶解,冷却后,转 入100mL 容量瓶中,用适宜的 pH 缓冲溶液稀 释至刻度。此溶液在冰箱内贮存,有效期为 3d 。
1.原理 α-淀粉酶水解淀粉为小相对分子质量的
糊精和少量的麦牙糖及葡萄糖,使淀粉 与碘呈蓝紫色反映逐渐变红棕色直至消 失,观察并测定颜色的消失速度可以衡 量酶活力的大小。
2019/5/10
8
2.试剂 原碘液:同“分光光度法”。 稀碘液:同“分光光度法”。
20g/L 可溶性淀粉溶液:同“分光光度法”
测定α淀粉酶活性

测定α-淀粉酶活性的两种方法的比较研究发布时间:2009-09-27来源:生物网文章标签:α-淀粉酶酶活性生物论坛2009-2012年中国α-淀粉酶市场调研及投细菌α-淀粉酶产生菌种筛选α-淀粉酶的活性测定及比活计算摘要α-淀粉酶活性是衡量小麦穗发芽的一个生理指标,为此提出了对小麦α-淀粉酶活性的快速测定方法的研究。
α-淀粉酶活性的测定方法有多种,本文仅探讨了常用的3.5-二硝基水杨酸法和凝胶扩散法。
结果表明,两种方法的测定结果差异不显著,而且两者呈显著正相关;从变异系数上看,后者的变异程度较低,其精度较高;从误差来源上看,前者引起误差的因素较后者多;后者较为简便快速,准确度较高,重复性较好,可用于大批量样品的分析。
关键词小麦α-淀粉酶活性 3.5-二硝基水杨酸法凝胶扩散法1材料和方法1.1 材料和试剂①萌芽的小麦取当年小麦种子,按小麦萌发试验培养,2天后用于测验。
②1%淀粉溶液。
③ 0.40NNaOH。
④PH5.60的柠檬酸缓冲液A.称取柠檬酸20.01g,溶解后稀释至1L;B.称取柠檬酸钠29.41g,溶解后稀释至1L。
取A液13.70ml与B液26.30ml混匀,即为pH5.60的缓冲液。
⑤3.5-二硝基水杨酸精确称取3.5-二硝基水杨酸1g溶于20ml1NaOH中,加入50ml蒸馏水,再加入30g酒石酸钾钠,待溶解后,用蒸馏水稀释至100ml,盖紧瓶塞,勿使二氧化碳进入。
⑥麦芽糖标准液称取麦芽糖0.10g溶于少量蒸馏水中,仔细移入100ml容量瓶中,用蒸馏水稀释至刻度。
⑦α-淀粉酶提取缓冲液20mmol/L醋酸钠(2.7216g/L) 1mmol/L氯化钙(0.11099g/L) pH5.5。
⑧5%(V/V)碘—碘化钾溶液 1.95gKI+0.65gI2溶解在100ml蒸馏水中。
⑨α-淀粉酶36.18u/mg Sigma公司逐级稀释10, 2.50,0.625,0.15625, 0.03906,0.009765mg/mL系列标准液。
二、α-淀粉酶活力的测定2010(精)

3.2 器材(每组)
15ml大试管10支 5ml移液管10支 1ml移液管5支 10ml移液管10支 比色皿1套(4个) 双蒸水1瓶(50ml) 洗瓶1个 玻璃平皿1套 50ml小广口瓶(棕色)2个 50ml 容量瓶 1个 100ml 容量瓶 1个 500ml 试剂瓶2个 100ml 试剂瓶2个 250ml 三角瓶2个 200ml烧杯2个 500ml烧杯1个 记号笔1支、吸耳球、称量纸、药勺、试管架、 研钵、纱布
2.实验原理
α-淀粉酶能够将淀粉分 子中的α-1,4糖苷键随机切 成长短不一的短链糊精、少量 麦芽糖和葡萄糖,而使淀粉对 碘的呈蓝色特性反应逐渐消失, 呈现棕红色,其颜色消逝的速 度与酶活性有关,可以用来表 示淀粉酶水解的程度,因而能 购通过反应后溶液的吸光度值 衡量酶的活力。
3.试剂和溶液
3.4 磷酸缓冲液(pH6.0) 4.52g磷酸氢二钠(Na2HPO4·12H2O) 和0.8g柠檬酸(C6H8O7·H2O),定容至 100ml。pH计校正后使用。
3.5 盐酸溶液(0.1M/L) 100ml
4. 仪器及器材
4.1 仪器
电子天平
恒温水浴锅 分光光度计 记时器
2台
3.1 原碘液 称取2.2g碘和4.4g碘化钾完全 溶解后定容至100ml,储存于棕色瓶 中(教师准备)。 3.2 稀碘液 吸取原碘液2ml,加20g碘化钾 用水溶解并定容至500ml。 3.3 可溶性淀粉溶液 称取2.000g(精确到0.001g) 可溶性淀粉于烧杯中,加适量蒸馏 水调成浆糊状物,边搅拌边加入沸 水90ml,搅拌加热至完全透明冷却 后定容至100ml,现配现用。
生物技术专业系统实验(四)
淀粉酶活力的测定

收集1管的同学,将0.05 mL稀释到15 mL 收集2管的同学,将0.05 mL稀释到10 mL
1、分别计算0时刻、5 min时刻的A540nm平均值。 2、根据图表中的实验结果,并利用实验 “3,5-二
硝基水杨酸比色法测定糖的含量”中制作的标准 曲线,计算淀粉酶的活力。
需要详细过程。
5 min时刻吸光值
5 min时刻还原糖mg数
0 min时刻吸光值
0 min时刻还原糖mg数
二者相减,计算酶活力。 1 U=1 mg 还原糖/min·mL 酶*稀释倍数
七. 思考题
1、在测定酶活力时应注意哪些反应条件?为什么? 2、本实验中两次加入NaOH溶液的意义是什么?
八、分析
1.三种酶活力大小顺序是怎样,为什么是这样? 2.酶液的稀释倍数是否要改变。 3.计算酶液的总活力、回收率。
操作
0号管 0时刻 5min时刻 0时刻 5min时刻 0时刻 5min时刻 B1 B1’ F1 F1’ B2 B2’ F2 F2’ B3 B3’ F3 F3’
淀粉酶液 (ml)
0.3
0.2
0.5
H2O (ml) 3.5 pH 6.8缓冲液 0.3 % NaCl
预热
各 1 ml 各 1 ml 摇匀, 37 ℃ 水浴 2 min
实验七 淀粉酶活力的测定
一、实验目的
掌握测定淀粉酶活力的原理和基本方法
二、实验原理
DNS法测定α-淀粉酶活力的方法课件(1)

密封121.3 ℃ 灭菌处理20min)。用时注意酶
污染。
14
标准曲线制作相关试剂加入表
试剂
管号 123456
标准麦芽糖溶液
(mL)
0 0.4 0.8 1.2 1.6 2.0
蒸馏水 (mL)
2.0 1.6 1.2 0.8 0.4 0
麦芽糖含量 (mg)
0 0.4 0.8 1.2 1.6 2.0
DNS试剂 (mL)
淀粉酶活力的大小与产生的还原糖的量成正比。
用标准浓度的麦芽糖溶液制作标准曲线,用比色
法测定淀粉酶作用于淀粉后生成的还原糖的量,
以单位样品(重量或体积)在一定时间内生成的
麦芽糖的量表示酶活力。
7
酶活力测定(DNS比色法)
酶活力定义:在一定反应条件下(本实验为40 ℃ ,pH5.6或6.0),1分钟反应生成1mg麦 芽糖的酶量定义为1个酶活力单位。
利用Excel中相关统计分析工具,完成回 归方程的计算及分析,并绘制标准曲线图。
12
相关试剂(第一种)
标准麦芽糖溶液(1mg/mL):精确称取 1g麦芽糖,用蒸馏水溶解并定容至 1000mL。
0.1mol/L pH5.6的柠檬酸缓冲液:称取 柠檬酸(C6H8O7·H2O )5.78g,柠檬酸 钠(Na3C6H5O7·2H2O)21.32g ,用 蒸馏水溶解并定容至1000mL。
称取磷酸氢二钠(Na2HPO4.12H2O)45.3g, 柠檬酸(C6H8O7·H2O )7.74g,先在烧杯中 用蒸馏水使之溶解,然后转入容量瓶中定容至
1000mL。
1%马铃薯淀粉溶液:称取1g马铃薯淀粉
(105℃烘干2hr)溶于100mL 0.2mol/L
pH6.0 磷酸氢二钠-柠檬酸缓冲液中(一般需要
α-淀粉酶活力的测定

α-淀粉酶活力的测定α-淀粉酶活力的测定姓名___学号___ 一、实验目的:1. 掌握α-淀粉酶活力测定的基本原理及其实验方法。
二、实验原理: α-淀粉酶- 是一种内切酶- 只能水解α-1, 4糖苷键- 不能水解α-1,6糖苷键- 不能水解α-1,6糖苷键附近的α-1,4糖苷键- 产物为糊精、低聚糖、麦芽糖和少量葡萄糖α-淀粉酶活力测定的方法1(反应底物: 可溶性淀粉2(反应环境: 60?,pH为6.0,常压。
3(产物: 还原性葡萄糖4(活力测定方法:1)测定还原糖产生速度2)测定淀粉遇碘显色力下降的速度3)测底物粘度下降的进度• 还原糖与黄色的 3,5- 二硝基水杨酸显色反应来测定.• 生成物颜色的深浅与还原糖的量成正比.• 以每克酶在一定时间内生成的还原糖(麦芽糖)量表示酶活大小.三、试剂与仪器:1、仪器(1)电子天平(2)容量瓶 100mL(3)试管(4)恒温水浴锅(5)紫外可见分光光度计(6)烧杯 250 mL2(试剂(1)1% 可溶性淀粉溶液:称取可溶性淀粉(以绝干计)1. 000g(精确至0.001g,用水调成浆状物(在搅动下缓缓倾入70mL沸水中。
然后,以30mL水分几次冲洗装淀粉的烧杯,洗液并入其中,加热至完全透明,冷却,定容至100mL。
此溶液需要当天配制。
(2)0.4mol/L 氢氧化钠: 称取 1.6g 氢氧化钠,溶于少量蒸馏水,定容至100 mL.1(3)磷酸缓冲液(pH6.0): 称取磷酸氢二钠(Na2HPO4?12H2O)45.23g、柠檬酸(C6H8O7?H2O)8.07g,用水溶解并定容至1000mL。
配好后用pH计校正。
(4)3,5- 二硝基水杨酸:精确称取 1g 3,5- 二硝基水杨酸溶于 20mL 1mol/L 氢氧化钠中,加入 50mL 蒸馏水,再加入 30g 酒石酸钾钠,待溶解后用蒸馏水稀释至100mL ,盖紧瓶塞,防止CO2进入.(5)麦芽糖标准液(1mg/ml):称取0.100g麦芽糖,溶于少量蒸馏水,定容至100mL .(6)α-淀粉酶:枯草芽孢杆菌生成,最适pH 5.5-7.5,最适温度 50~70? 四、测定步骤:1. 麦芽糖标准曲线的制作:取25ml刻度试管7支,编号.分别加入麦芽糖标准液(lmg/ml) 0, 0.2, 0.6, 1.0,1.4, 1.8,2.0 ml ,然后用吸管向各管加蒸馏水使溶液达 2.0ml ,再各加 3 , 5 -二硝基水杨酸试剂2.0m1 ,置沸水浴中加热5min .取出冷却,用蒸馏水稀释至25 m1 .混匀后用分光光度计在520 nm 波长下进行比色,记录吸光度.以吸光度为纵坐标,以麦芽糖含量(mg)为横坐标,绘制标准曲线.2. 待测酶液的制备:称取酶粉0.1g,精确至0.0002g,先用少量的磷酸缓冲液溶解,并用玻璃搅拌棒捣研,将上清液小心倾入容量瓶中,沉渣部分再加入少量缓冲液,如此捣研3-4次,最后全部移入容量瓶中,用缓冲液定容至100mL,摇匀。
实验一α-淀粉酶活力的测定

结果处理与计算
数据处理
根据实验数据,我们计算了酶活力、 反应速率等参数。
图表绘制
我们使用图表展示了实验结果,以便 更直观地分析数据。
结果分析
酶活力比较
通过比较不同浓度酶液的酶活力,我们可以得出酶活力与酶浓度 之间的关系。
反应速率分析
通过分析反应速率,我们可以了解酶促反应的动力学特征。
结论总结
综合以上分析,我们可以得出实验一α-淀粉酶活力测定的结论, 并为其应用提供依据。
用紫外可见分光光度计在540nm波长处测定各管 的吸光度值。
数据记录与处理
01
记录实验数据,计算α-淀粉酶活力。
02
根据实验数据绘制标准曲线和酶 活性曲线。
04
结果分析
数据记录
实验数据
在实验过程中,我们记录了不同浓度 酶液处理后的反应时间、温度、pH值 等数据。
实验误差
在实验过程中,我们尽量减小误差, 如使用精确的测量工具、多次测量取 平均值等。
05
实验总结与讨论
实验总结
01
实验原理
本实验通过测定α-淀粉酶催化淀粉水解生成可溶性糖的速率,从而确定
酶活力的大小。
02 03
实验步骤
准确称取适量淀粉和底物溶液,加入试管中,加入适量酶液,在适宜温 度下恒温水浴一定时间,然后加入碘液和氢氧化钠溶液终止反应,最后 用斐林试剂进行滴定。
实验结果
通过滴定结果计算出α-淀粉酶活力的大小。
DNS溶液
称取3,5-二硝基水杨酸6.3g,溶解于50mL蒸馏水中,加入2mol/L氢氧化钠溶液 16.8mL,再加入20%酒石酸钾钠溶液10mL和2mol/L硫酸溶液20mL,混合均匀后 加热至80℃,不断搅拌,直至溶液呈透明。冷却后用蒸馏水定容至100mL,避光保 存。
α-淀粉酶菌株摇瓶发酵初筛、复筛及酶活力测定

摇瓶发酵初筛方法及步骤
发酵培养基灭菌冷却后,利用接种环接种 一环上周培养好的斜面菌种(1瓶/株)。 37 ℃摇瓶培养(往复式,110转/分钟) 3天。 3天后小漏斗加少许脱脂棉花过滤发酵液。 测定发酵液中α-淀粉酶酶活力单位(碘比 色法)——先测原发酵液、低于5min的稀 释后重测(2、5、10倍,控制终点反应时 间为5-10min)。 根据结果选出1~2株进行下周的复筛试验。
液体接种用种子菌液制备
划线接种斜面,30℃培养7天以上备用 (充分产芽孢)。 复筛试验用: 挑取斜面菌种2环,洗涤于10mL无菌水 中,制成菌悬液备用接种,接种前制备。 正交试验用: 30mL无菌水洗涤斜面(1支),制成菌 悬液备用接种,接种前制备。
其它器材
1mL无菌吸管 10支(本学期不需要准备) 2mL无菌吸管 4支。 分别标记清楚。 10mL无菌水 1支,装于18×180mm试 管(全班统一包扎灭菌)。 30mL无菌水 2瓶装于250mL三角瓶中, 包扎,121.3℃灭菌20分钟备用。
α -淀粉酶菌株摇瓶发酵初筛、 复筛及酶活力测定
目的要求
了解利用微生物摇瓶发酵初筛、复筛的目 的及要求,其基本原理及方法。 了解摇瓶发酵培养的原理、要求和方法技 术。 了解液体摇瓶发酵用培养基的配制要求。 进一步熟悉掌握碘比色法(部颁标准)测 定α -淀粉酶活力的原理和方法步骤。
基本原理
摇瓶培养发酵技术是在抗生素生产的需求 条件下发展而来的——需求增加,规模扩 大,产量增加,调控控制。 浅层培养发酵→深层培养发酵(实验室、 工业生产) 根据用途配制含有适合营养基质的液体培 养基 细胞悬浮于相应液体培养基质中,通过振 荡,细胞得到充分溶解氧,接触较为新鲜 的均匀营养物质,细胞代谢活性较高。
平均
测定α-淀粉酶活力的方法

实验五激活剂、抑制剂、温度及PH对酶活性的影响一、目的要求通过实验加深对酶性质的认识,了解测定α-淀粉酶活力的方法。
二、实验原理酶是生物体内具有催化作用的蛋白质,通常称为生物催化剂。
酶催化的反应称为酶促反应。
生物催化剂催化生化反应时具有:催化效率好、有高度的专一性、反应条件温和、催化活力与辅基,辅酶,金属离子有关等特点。
For personal use only in study and research; not for commercial use能提高酶活力的物质,称为激活剂。
激活剂对酶的作用有一定的选择性,其种类多为无机离子和简单的有机化合物。
使酶的活力中心的化学性质发生变化,导致酶的催化作用受抑制或丧失的物质称为酶抑制剂。
氯离子为唾液淀粉酶的激活剂,铜离子为其抑制剂。
应注意的是激活剂和抑制剂不是绝对的,有些物质在低浓度时为某种酶的激活剂,而在高浓度时则为该酶的抑制剂。
如氯化钠达到约30%浓度时可抑制唾液淀粉酶的活性。
酶促反应中,反应速度达到最大值时的温度和PH值称为某种酶作用时的最适温度和PH值。
温度对酶反应的影响是双重的:一方面随着温度的增加,反应速度也增加,直至最大反应速度为止;另一方面随着温度的不断升高,而使酶逐步变性从而使反应速度降低。
同样,反应中某一PH范围内酶活力可达最高,在最适PH的两侧活性骤然下降,其变化趋势呈钟形曲线变化。
食品级α-淀粉酶是一种由微生物发酵生产而制备的微生物酶制剂,主要由枯草芽孢杆菌、黑曲霉、米曲霉等微生物产生。
但不同菌株产生的酶在耐热性、酶促反应的最适温度、PH、对淀粉的水解程度,以及产物的性质等均有差异。
α-淀粉酶属水解酶,作为生物催化剂可随机作用于直链淀粉分子内部的α-1,4糖苷键,迅速地将直链淀粉分子切割为短链的糊精或寡糖,使淀粉的粘度迅速下降,淀粉与碘的反应逐渐消失,这种作用称为液化作用,生产上又称α-淀粉酶为液化淀粉酶。
α-淀粉酶不能水解淀粉支链的α-1,6糖苷键,因此最终水解产物是麦芽糖、葡萄糖和α-1,6键的寡糖。
α-淀粉酶酶活力测定实验(碘比色法)

酶活力测定的方法
碘比色法(有相应的国家标准) 在一定反应条件下,1小时转化1g淀粉变为糊精的酶量定义 为1个酶活力单位 3,5-二硝基水杨酸比色法(DNS法) 在一定反应条件下,1分钟反应生成1mg麦芽糖的酶量定义 为1个酶活力单位 注意:去除β-淀粉酶的干扰 医学上的一些测定方法(专用试剂盒,通过生化仪器反应 测定,需要微量快速)
α-淀粉酶酶活力测定实验 ——目视碘比色法
酶活力单位测定的介绍
测定的目的——纯化不容易;纯化过程中容易失活——质量 (重量)不能用于定量; 酶活力和酶活性的差别 酶活力反应的实质——催化反应速度高低 酶活力单位的定义及表示——增加可比性 国际标准(25℃、1min、1umol) 实际应用的标准 酶活力的测定方法 单位时间内底物的减少量或产物的增加量 反应完一定量底物的时间长短 测定物的要求:可测性、反应的专一性、稳定性、简便性 比酶活力的定义——1mg酶蛋白的酶活力(有时用1g表示) 测定过程中的条件控制——温度、pH等
β -淀粉酶
淀粉-1,4-麦芽糖 苷酶 α -1,4 非还原端 2糖单位 不能跨越 麦芽糖、极限糊精
糖化淀粉酶
淀粉-1,4-葡萄糖 苷酶、糖化酶 α -1,4 非还原端 1糖单位 跨越 葡萄糖 80%-100%
异淀粉酶
淀粉α -1,6-葡萄 糖苷酶、支链淀粉 酶 α -1,6 非还原端 分枝点 可切断分支 糊精
比色终点,计下反应时间(与标准比色管颜色相同) 代入公式计算酶活力单位 注意:发酵液或酶液可能需要稀释,使加入的酶量可以在规定时间内完成反应。
α-淀粉酶测定反应比色稀碘液检 测显色变化过程
反应终点颜色
思考题
报告测定结果? 目视碘比色法在测定α-淀粉酶酶活力时需要注意哪 些问题? 通过查阅资料,还有哪些关于α-淀粉酶酶活力测定 的方法?说明其基本原理及主要适用范围?
α-和β-淀粉酶活性的测定

α-和β-淀粉酶活性的测定α-淀粉酶能将淀粉分子的α-1.4糖苷键任意切断成长短不一的短链糊精及少量麦芽糖和葡萄糖,使淀粉对碘呈蓝紫色的特异反应消失,以该颜色消失的速度计算酶的活力。
β-淀粉酶是从淀粉的非还原性末段分解2个葡萄糖单位的α-1.4糖苷键生成麦芽糖。
因此可用DNS法测定溶液中还原糖的含量。
1.仪器设备分光光度计、恒温水浴等。
2.操作方法1)粗酶液制备取新鲜植物材料10g,洗净、剪碎,按1:2(w/v)比例加20ml0.1mol/L NaAc缓冲液(含6mmol/L CaCl2,pH5.0)及少量石英砂研磨,一层尼龙布过滤。
滤液在20000r/min离心20min,取上清液用10mmol/L NaAc缓冲液透析。
过夜后用20000r/min离心10min,取上清液定容,备用。
2)绘制β-极限糊精标准曲线称取100mgβ-极限糊精,加少量水调成糊状,倾入10ml沸蒸馏水,不断的搅拌、加热,煮至透明。
流水冷却后定容至10ml,即每毫升含10mgβ-极限糊精。
取25~200μlβ-极限糊精(0.25~2.0mg)加水定容至0.5ml,再加5.0ml0.01%I2-KI溶液于560nm处测定其光密度(OD)值。
以光密度为纵坐标,β-极限糊精含量为横坐标绘制β-极限糊精标准曲线。
3.α-淀粉酶活力测定(植物生理学通讯,1986,4:63)取0.1~0.5ml粗酶液(相当于含0.1~0.2g鲜重),加0.5mlβ-极限糊精,加10mmol/L NaAc缓冲液定容至1.0ml,摇匀后在30℃保温。
隔不同时间取0.1ml反应液加5.0ml0.01%的I2-KI试剂,0.4ml H2O,摇匀后在560nm处测其光密度。
按OD值查标准曲线。
计算单位为:mgβ-极限糊精降解/g(鲜重)·h。
4.β-淀粉酶活力的测定(麦芽糖浆生产工艺,上海市轻工业局科技情报研究所出版1989,171)。
1)酶反应在具塞试管中加5ml2%可溶性淀粉,1ml0.1mol/L NaAc(pH5.0)缓冲液,3.9ml H2O,在37℃预热5min,加0.1ml酶液,保温30min后煮沸10min。
α、β-淀粉酶活性测定
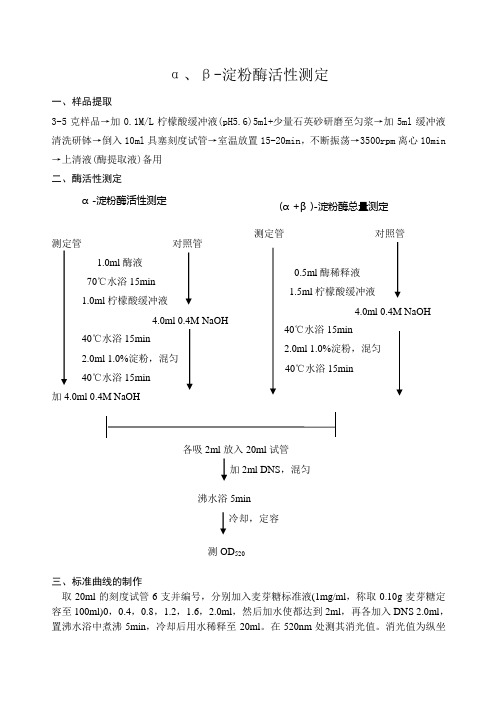
α、β-淀粉酶活性测定
一、样品提取
3-5克样品→加0.1M/L 柠檬酸缓冲液(pH5.6)5ml+少量石英砂研磨至匀浆→加5ml 缓冲液清洗研钵→倒入10ml 具塞刻度试管→室温放置15-20min ,不断振荡→3500rpm 离心10min →上清液(酶提取液)备用
二、酶活性测定
α-淀粉酶活性测定 测定管 对照管 1.0ml 酶液 70℃水浴15min 1.0ml 柠檬酸缓冲液 4.0ml 0.4M NaOH 40℃水浴15min 2.0ml 1.0%淀粉,混匀 40℃水浴15min
加4.0ml 0.4M NaOH
各吸2ml 放入20ml 试管
加2ml DNS ,混匀
沸水浴5min
冷却,定容
测OD 520
三、标准曲线的制作
取20ml 的刻度试管6支并编号,分别加入麦芽糖标准液(1mg/ml ,称取0.10g 麦芽糖定容至100ml)0,0.4,0.8,1.2,1.6,2.0ml ,然后加水使都达到2ml ,再各加入DNS 2.0ml ,置沸水浴中煮沸5min ,冷却后用水稀释至20ml 。
在520nm 处测其消光值。
消光值为纵坐
(α+β)-淀粉酶总量测定
测定管 对照管
0.5ml 酶稀释液
1.5ml 柠檬酸缓冲液
4.0ml 0.4M NaOH
40℃水浴15min
2.0ml 1.0%淀粉,混匀
40℃水浴15min
标,麦芽糖为横坐标作标准曲线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验五激活剂、抑制剂、温度及PH对酶活性的影响
一、目的要求通过实验加深对酶性质的认识,了解测定α-淀粉酶活力的方法。
二、实验原理
酶是生物体内具有催化作用的蛋白质,通常称为生物催化剂。
酶催化的反应称为酶促反应。
生物催化剂催化生化反应时具有:催化效率好、有高度的专一性、反应条件温和、催化活力与辅基,辅酶,金属离子有关等特点。
能提高酶活力的物质,称为激活剂。
激活剂对酶的作用有一定的选择性,其种类多为无机离子和简单的有机化合物。
使酶的活力中心的化学性质发生变化,导致酶的催化作用受抑制或丧失的物质称为酶抑制剂。
氯离子为唾液淀粉酶的激活剂,铜离子为其抑制剂。
应注意的是激活剂和抑制剂不是绝对的,有些物质在低浓度时为某种酶的激活剂,而在高浓度时则为该酶的抑制剂。
如氯化钠达到约30%浓度时可抑制唾液淀粉酶的活性。
酶促反应中,反应速度达到最大值时的温度和PH值称为某种酶作用时的最适温度和PH值。
温度对酶反应的影响是双重的:一方面随着温度的增加,反应速度也增加,直至最大反应速度为止;另一方面随着温度的不断升高,而使酶逐步变性从而使反应速度降低。
同样,反应中某一PH范围内酶活力可达最高,在最适PH的两侧活性骤然下降,其变化趋势呈钟形曲线变化。
食品级α-淀粉酶是一种由微生物发酵生产而制备的微生物酶制剂,主要由枯草芽孢杆菌、黑曲霉、米曲霉等微生物产生。
但不同菌株产生的酶在耐热性、酶促反应的最适温度、PH、对淀粉的水解程度,以及产物的性质等均有差异。
α-淀粉酶属水解酶,作为生物催化剂可随机作用于直链淀粉分子内部的α-1,4糖苷键,迅速地将直链淀粉分子切割为短链的糊精或寡糖,使淀粉的粘度迅速下降,淀粉与碘的反应逐渐消失,这种作用称为液化作用,生产上又称α-淀粉酶为液化淀粉酶。
α-淀粉酶不能水解淀粉支链的α-1,6糖苷键,因此最终水解产物是麦芽糖、葡萄糖和α-1,6键的寡糖。
本实验通过淀粉遇碘显蓝色,糊精按其分子量的大小遇碘显紫蓝、紫红、红棕色,较小的糊精(少于6个葡萄糖单位)遇碘不显色的呈色反应,来追踪α-淀粉酶作用于淀粉基质的水解过程,从而了解酶的性质以及动力学参数。
三、激活剂和抑制剂对唾液淀粉酶活力的影响
(一)试剂及材料
1、1:30唾液淀粉酶配置用蒸馏水漱口,1min后收集唾液,以1:30倍蒸馏水稀释。
2、0.2%可溶性淀粉称取可溶性淀粉0.2g,预加20mL蒸馏水调匀,然后倒入80mL沸水中,继续煮沸至溶液透明,冷却后补水至100mL。
3、1%NaCl溶液称取1.0 g氯化钠,加水溶解稀释至100mL 。
4、1%CuSO4溶液称取1.0 g硫酸铜,加水溶解稀释至100mL。
5、标准稀碘液称取11g碘,22g碘化钾,置研钵中,加入适量的水研磨至碘完全溶解,并加水稀释定容至500mL。
吸取2mL 上述碘液,加入10 g碘化钾,用水稀释至500 mL。
(二)仪器设备电热恒温水浴锅。
(三)操作方法
取试管3根,编号后按下表配置实验样液。
用点滴管并不断从试管中吸取样液于比色白瓷板,用稀碘液检验试管内淀粉被淀粉酶水解的程度,记录各试管内样液遇碘不显蓝色的先后顺序,解释实验现象的原因。
四、温度与PH值对α-液化淀粉酶活力的影响
(一)试剂与材料
1、2%可溶性淀粉溶液称取可溶性淀粉2.0g(预先在105℃烘干),预加20mL蒸馏水调匀,然后倾入80mL沸水中煮沸至溶液透明,冷却后定容至100mL。
2、PH4.0 、5.0、6.0、7.0、8.0 磷酸氢二钠–柠檬酸缓冲溶液
(1)0.2 mol /mL Na2HPO4 称取35.60g Na2HPO4.2H2O,用水溶解定容至100mL。
(2)使用酸度计,用柠檬酸调整至所需的PH值。
3、供试酶液的制备称取固体α-液化淀粉酶1.00g,加入PH6.0磷酸氢二钠–柠檬酸缓
冲溶液100mL (缓冲液的加入量视酶活力大小而定,控制酶解反应在5-10min内完成),于40℃恒温水浴中活化0.5小时,然后用3000rpm / min离心机离心分离5min,酶提取液于冰箱保存,供试验用。
4、标准比色液
甲液:称取氯化钴(CoCl.6H2O)40.2439g、干燥重铬酸钾0.4748 g,溶解并定容至500mL。
乙液:称取铬黑T 40.00mg,溶解并定容至100mL。
使用时取甲液40.0mL、乙液5.0 mL,混合。
混合比色液宜放置冰箱保存,使用7天后重新配置。
5、标准稀碘液。
(二)仪器设备电热恒温水浴锅。
(三)操作方法
1、用滴管吸取一定量标准比色液于白色瓷比色板空穴中,作为判断酶解反应终点的标准色。
2、不同温度对α-液化淀粉酶活力的影响
取4根Φ25×200mm 试管,按下表配制反应溶液。
加入供试酶液后,立即用秒表或手表记时,充分要匀,定时用点滴管从各反应试管中分别吸取1-2滴反应液,滴入预先盛有2/3 稀碘液的比色白瓷板孔穴内,从淀粉遇碘显色的变化情况,跟踪淀粉在淀粉酶作用下被水解的过程,当穴内颜色反应由紫色逐渐变为红棕色,与标准比色液的颜色相同时,即达反应终点,记录酶解反应完成所需时间。
3、不同PH值对α-液化淀粉酶活力的影响
取5根Φ25×200mm 试管,按下表配制反应溶液。
其它操作与温度对酶活力影响实验相同。
五、结果计算和讨论
淀粉酶活力单位定义为 在一定条件下,1 g 酶制剂1小时内液化可溶性淀粉的克数。
酶活力单位(U/g)=
n t ⨯⨯⨯⨯5
.01
02.02060 式中:20——可溶性淀粉的用量(mL ); t ——酶解反应完成所需的时间(min
); 0.5——测定时稀释酶液用量(mL ); 0.02——可溶性淀粉溶液的浓度(g/mL ); n ——酶制剂稀释倍数
1、不同温度对α-液化淀粉酶活力影响的结果记录
2、不同pH 值对α-液化淀粉酶活力影响的结果记录
分别以PH值、温度为横坐标,以酶活力单位为纵坐标,绘制PH值—酶活力单位、温度—酶活力单位图。
讨论分析实验结果。
六、思考题
1、从实验操作技能方面考虑,做好本实验的操作要点是什么?
2、实验过程中若激活剂或抑制剂的作用不明显,如何调整实验方案?
3、进行酶的生化实验必须考虑控制哪些条件?为什么?
4、生化反应用酶前对酶进行活力进行测定,对实验有何实际指导意义?
5、酶在干燥状态下与在水溶液中保存,它的活性受温度的影响是否相同?。
