检验方法确认记录-中和
微生物限度检验方法验证记录

微生物限度检验方法验证记录1.适用范围本方案适用于本公司各品种微生物限度检验方法的验证。
2.目的通过验证确认所采用的方法适合于该药品的微生物限度检查,确保该产品微生物限度检查结果的正确性。
3.职责项目责任人:负责验证方案的起草及具体实施。
验证管理员:负责验证工作的组织、协调及管理。
QA现场监控员:负责验证实施过程中的监督检查,取样,确保结果的可靠性。
QC负责人:负责验证方案中检验方法的审核及按照规定的取样计划对标准检验操作程序的准确执行,负责组织实施。
QC检验员:负责验证方案的起草与参与实施,并对所测数据准确性负责。
质量部经理:负责验证方案及报告的审核和批准。
4. 概述通过验证以确认所采用的方法适合于该药品的微生物限度检查。
根据样品特性制订检验方法和检验条件,按制定的方法进行实验,根据实验结果判断是否符合验证标准。
若符合,按验证的方法和条件进行药品的微生物限度检查;若不符合,重新建立制订检验方法和检验条件,再进行验证,直至验证结果符合设立的验证标准。
5.检查和确认5.1微生物限度检验室,洁净级别1万级;超净工作台,局部100级(确认方法:审阅相关的验证资料)。
微生物限度检验室(洁净级别1万级)验证报告超净工作台(洁净级别100级)验证报告检查结论:验证资料完整,符合相应洁净度要求且在有效期内。
检查人: 日期:5.2与验证相关的文件(确认方法:检索)。
微生物限度检查法操作规程和检定菌传代操作规程净化工作台使用操作规程微生物限度检验室清洁消毒规程培养箱标准操作规程检查结论:验证所需资料齐全、完整,符合验证要求。
检查人: 日期:5.3检验用仪器设备(确认方法:检查、核对)。
符合3Q(IQ、OQ、PQ)要求。
5.3.1 培养箱型号: HP400S生产厂家: 武汉瑞华仪器设备有限公司校验有效期至: 年月日设定温度: 32.5?型号: PYX-280S-A生产厂家: KELI 科力仪器校验有效期至: 年月日设定温度: 25.5?5.3.4超级净化层流台型号: YJ-875生产厂家: 苏州市姑苏空调净化有限公司验证有效期至: 年月日检查结论: 符合要求检查人: 日期:5.4检验用菌种、培养基和试液(确认方法:检查、核对)金黄色葡萄球菌[CMCC(B)26003] 批号生产厂: 中检所枯草芽孢杆菌[CMCC(B)63501] 批号生产厂: 中检所大肠埃希菌[CMCC(B)44102] 批号生产厂: 中检所白色念珠菌[CMCC(F)98001] 批号生产厂: 中检所黑曲霉菌[CMCC(F)98003] 批号生产厂: 中检所β-内酰胺酶:2ml(大于200单位/ml)批号生产厂: 中检所硫乙醇酸盐流体培养基批号: 生产厂: 北京三药科技开发公司改良马丁培养基批号: 生产厂: 北京三药科技开发公司营养肉汤培养基批号: 生产厂: 北京三药科技开发公司改良马丁琼脂培养基批号: 生产厂: 北京三药科技开发公司检查结论: 符合要求检查人: 日期:6. 菌液制备(1)金黄色葡萄球菌新鲜肉汤培养物1ml 9ml0.9%无菌NaCl溶液至_______含菌量_______CFU/ml [CMCC(B)26003] 第_____代 10倍系列稀释(2)枯草芽孢杆菌新鲜肉汤培养物1ml 9ml0.9%无菌NaCl溶液至_______含菌量_______CFU/ml [CMCC(B)63501]第_____代 10倍系列稀释(3)大肠埃希菌新鲜肉汤培养物1ml 9ml0.9%无菌NaCl溶液至_______含菌量_______CFU/ml [CMCC(B)44102]第_____代 10倍系列稀释(4)白色念珠菌新鲜改良马丁培养物1ml 9ml0.9%无菌NaCl溶液至_______含菌量_______CFU/ml [CMCC(F)98001]第_____代 10倍系列稀释(5)黑曲霉新鲜孢子洗脱液1ml 9ml0.9%无菌NaCl溶液至_______含菌量_______CFU/ml [CMCC(F)98003]第_____代 10倍系列稀释7. 实验方案7.1无抑菌活性的供试品供试液的制备7.1.1稀释剂:pH7.0无菌氯化钠-蛋白胨缓冲液7.1.2液体供试品:供试品10ml置锥形瓶中,加入90ml稀释剂,混匀,作为供试液(1:10)。
成品确认检验记录
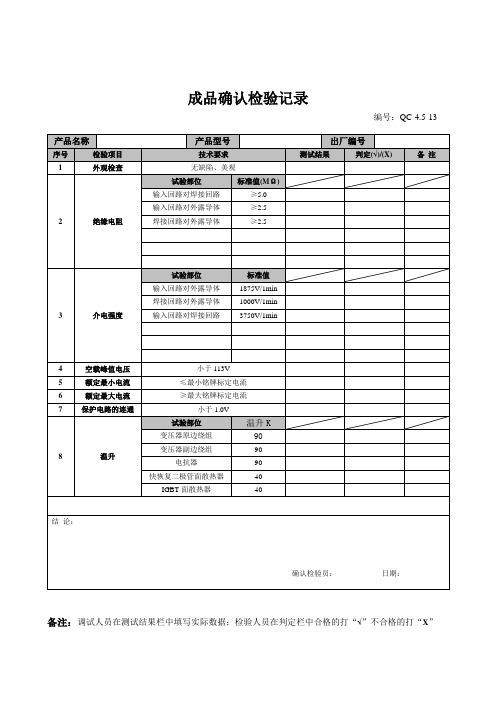
编号:QC-4.5-13
产品名称
产品型号
出厂编号
序号
检验项目
技术要求
测试结果
判定(√)/(X)
备注
1
外观检查
无缺陷、美观
2
绝缘电阻
试验部位
标准值(MΩ)
输入回路对焊接回路
≥5.0
输入回路对外露导体
≥2.5
焊接回路对外露导体
≥2.5
3
介电强度
试验部位
标准值
输入回路对外露导体
1875V/1min
焊接回路对外露导体
1000V/1min
输入回路对焊接回路
3750V/1min
4
空载峰值电压
小于113V
5
额定最小电流
≤最小铭牌标定电流
6
额定最大电流
≥最8
温升
试验部位
温升K
变压器原边绕组
90
变压器副边绕组
90
电抗器
90
快恢复二极管面散热器
40
IGBT面散热器
40
结论:
确认检验员:日期:
备注:调试人员在测试结果栏中填写实际数据;检验人员在判定栏中合格的打“√”不合格的打“X”
氢氧化钠检测方法

氢氧化钠检测方法本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March氢氧化钠检测方法一、实验室测定方法名称:氢氧化钠—氢氧化钠的测定——中和滴定法。
应用范围:该方法采用滴定法测定氢氧化钠的含量。
该方法适用于氢氧化钠。
实验原理:利用酸碱指示剂在溶液pH值不同时显现不同颜色的特性,用酸调整试样溶液的pH至特定值时,通过消耗酸的量计算出试样中氢氧化钠的量与变质的量。
试剂:1. 水(新沸放冷);2. 硫酸滴定液(L);3. 酚酞指示液;4.甲基橙指示液:取甲基橙,加水100mL使溶解,即得。
仪器设备:酸式滴定管、分析天平、容量瓶、锥形瓶、铁架台、移液管。
操作步骤:供试品加新沸过的冷水适量使溶解后,放冷,用水稀释至刻度,摇匀,精密量取25mL,加酚酞指示液3滴,用硫酸滴定液(L)滴定至红色消失,记录消耗硫酸滴定液(L)的容积(mL),加甲基橙指示液2滴,继续加硫酸滴定液(L)至显持续的橙红色,根据前后两次消耗硫酸滴定液(L)的容积(mL),算出供试量中的碱含量(作为NaOH计算)并根据加甲基橙指示液后消耗硫酸滴定液(L)的容积(mL),算出供试量中NaCO的含量。
[14]注:“精密称取”系指称取重量应准确至所称取重量的千分之一,“精密量取”系指量取体积的准确度应符合国家标准中对该体积移液管的精度要求。
变质检验NaOH变质后会生成NaCO化学方程式:2NaOH + CO=NaCO+ HO1.样品中滴加过量稀盐酸若有气泡产生,则氢氧化钠变质。
原理:2HCl + NaCO=2NaCl + CO↑+ HO(空气中含有少量的CO,而敞口放置的NaOH溶液能够与CO 反应,生成NaCO和HO从而变质;HCl中的H+能够与NaCO中的CO32-离子反应生成CO气体和HO,通过气泡产生这个现象来检验变质)注:HCl会优先与NaOH反应生成NaCl和HO。
内审员考核试题

内审员考核试题一、判断1.内审只是对现场的抽样检查.( 错)2.某车检站发现新标准GB7258-2004版与97版有不同之处,但在开始使用新标准之前,并未对GB7258-2004版的不同点按新开展项目进行验证和评审。
(对)3.程序文件是质量手册的支持性文件,应具有可操作性和可检查性 .( 对)4.保证检验的公正性,客户不能进入实验室现场观看测试过程。
(错)5.当采用非标准方法进行检验时,检验机构不必征得客户的同意。
(错)6.质量体系文件包括:质量手册、程序文件、技术文件及作业指导书、记录和表格等。
(对)7.组织质量体系管理评审是技术负责人的一项职责。
(错)8.实验室所有与客户签订的合同都必须评审,并保存书面的评审证据。
(对)9.测量仪器的特性可以用[示值]误差,最大允许误差等描述。
(对)10.对检测实验室、校准实验室都要求制定评定测量不确定度的程序.(对)11.检验机构在开展所有新工作前均应进行评审。
(对)12.内审员的职责是发现质量体系运行的问题. (错)13.申请计量认证/审查认可的实验室必须具备检测承检产品的全部参数的能力,不可以借用外部设备。
(错)14.当实验室发现不符合工作时,应立即采取纠正措施.(错)15.被检定仪器的检定证书上给出的扩展不确定度U就是被检定仪器的B类不确定度。
(错)16.现场评审中,如被评审方有要求,评审组成员可以对其进行一定程度的咨询。
(错)17.为防止使用作废或无效文件,所有体系文件应经过审批,并有程序加以控制.(对)18.实验室不是企业,没有合同评审的必要.(错)19.为保证检验的公正性,客户不能进入实验室现场观看测试过程。
(错)20.检验机构应对全部关系检验质量的检验工作编制作业指导书,并在质量文件中规定。
( 对)21.实验室用于检测/校准的所有设备在每次使用前必须进行校准.(错)二、填空1.的可信度的程序。
2.3.___,包括上次校准的日期、再校准或失效日期。
片碱的检测方法

注:HCl会优先与NaOH反应生成NaCl和H₂O。因为NaOH是强碱,而Na₂CO₃是水溶液显碱性。
天津凯诺威化工
注1:“精密称取”系指称取重量应准确至所称取重量的千分之一,“精密量取”系指量取体积的准确度应符合国家标准中对该体积移液管的精度要求。
变质检验
NaOH变质后会生成Na₂CO₃
化学方程式:2NaOH + CO₂=Na₂CO₃+ H₂O
1.样品中滴加过量稀盐酸若有气泡产生,则氢氧化钠变质。
原理:2HCl + Na₂CO₃=2NaCl + CO₂↑+ H₂O
注:不滴加NH₄Cl,因为Na₂CO₃溶于水后呈碱性是因为会有OH¯根离子,NH₄+与OH¯跟结合也会有刺激性气味,无法区分是原有氢氧化钠导致还是碳酸钠导致。
②在NaOH中加入过量CaCl2:1.若有白色沉淀生成,则说明NaOH变质2.加入无色酚酞,若无色酚酞不变色,则说明完全变质。若无色酚酞变红,说明部分变质。
标定:取在270~300℃干燥恒重的基准无水碳酸钠约0.3g,精密称定,加水50mL使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液颜色有绿色变为暗紫色。每1mL硫酸滴定液(0.1mol/L)相当于10.60mg的无水碳酸钠。根据本液消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
2.样品中滴加澄清石灰水,若有白色沉淀生成,则氢氧化钠变质。
氢氧化钠的检验方法

氢氧化钠的检验方法氢氧化钠(NaOH)是一种常见的无机化合物,也是一种强碱。
检验氢氧化钠的方法主要包括外观观察、化学反应和仪器分析等多种方法。
下面,将详细介绍几种常用的氢氧化钠检验方法。
1. 外观观察法:外观观察法是最简单直观的方法。
氢氧化钠为固体晶体,一般为白色粉末状。
我们可以通过裸眼观察样品的颜色、形状和纯度等特征来初步判断其是否为氢氧化钠。
2. 气味检测法:氢氧化钠具有特殊的氨味,可以通过闻气味来判断样品是否为氢氧化钠。
但是需要注意的是,由于氢氧化钠在空气中易吸湿,会形成碱性氢氧化钠,故应避免直接闻氢氧化钠样品。
3. 中和反应法:氢氧化钠是一种强碱,可以与酸反应生成盐和水。
通过对待检样品进行酸碱中和反应,可以进一步确认是否为氢氧化钠。
具体方法是将待检样品溶解在水中,然后滴加酸(如盐酸),如出现中和反应产生气体、变色或加热等现象,则可以初步确认为氢氧化钠。
4. 溶解性检测法:氢氧化钠可溶于水,生成氢氧化钠溶液。
溶解性检测法可以通过观察待检样品在水中的溶解情况来判断是否为氢氧化钠。
将待检样品分别与不同溶剂(如水、醇等)接触,观察其溶解情况,如果溶解度较高、水溶液呈碱性,则可以初步判定为氢氧化钠。
5. 电导率测定法:电导率测定法是一种仪器分析方法,通过测定待检样品的电导率来判断是否为氢氧化钠。
氢氧化钠是一种良好的电解质,具有较高的电导率。
可使用电导仪或电导率计对待检样品进行测定,如果测得的电导率较高,则可以确认为氢氧化钠。
需要注意的是,以上方法只是检验氢氧化钠的常用方法,并不能完全保证结果的准确性。
对于一些特殊情况,还可借助其他现代分析技术,如红外光谱、质谱等对样品进行分析,以确保检验结果的准确性。
检验方法验证管理规程

1.目的:通过验证考察所采用的检验方法是否准确、可靠,能始终如一地获得客观实际的数据或结果。
2.范围:本规程适用于本公司检验仪器的确认、检验方法的验证。
3.职责:◆供货方:负责检验用精密仪器的安装确认。
◆设备工程科:负责检验方法的验证方案、报告起草与实施,对所测数据准确性负责。
协助检验方法的确定。
◆QC负责人:负责验证工作的管理,协助检验方法验证方案的起草,组织协调验证工作,并总结验证结果,起草验证报告。
◆质量管理科科长:负责验证方案及报告的审核。
◆质量授权人:负责验证方案及报告的批准。
4.内容:4.1验证工作示意图4.2检验方法验证的前提◆检验方法验证的前提是在检验方法开发阶段已完成方法的测试条件的优选工作,排除了干扰因素。
对定量测定而言,方法的准确度和精密度试验应在这一阶段完成。
◆仪器:已经过校正且在有效期内。
◆人员:人员应经过充分的培训,熟悉方法及所使用的仪器。
◆参照品或参考品:购自法定机构(中国药品生物制品检定所)的法定参照品;购自可靠的供应商(有法定的资质证明)。
◆材料:所用材料,包括试剂、实验用容器等,均应符合试验要求。
◆稳定性:在开始进行方法验证之前,考察试验溶液和试剂的稳定性,确保在检验周期内试验溶液和溶剂是稳定的。
4.3检验方法验证的方式:前验证、回顾性验证。
◆前验证:系指在正式投入使用前按照设定的方案进行试验,获得证据以证实检验方法达到预期要求的行为。
包括研究开发实验室和质量管理部对检验方法进行的前验证。
●研究开发实验室的前验证是从方法的开发为起点,以方法的验证告终。
通常需三个步骤:通过文献设计方法——通常在产品开发的同时提出检验方案;通过条件试验初定方法——进行检验方法的筛选和条件优化试验;●通过验证确定方法——进行适用性试验,其基本内容包括检测仪器、准确度、精密度、线性范围、选择性等。
●通过其他分析人员(最好是没有参加该方法开发试验的人员)进行重复性试验——发现方法的薄弱环节,使方法的文稿更具体、操作更完善。
化妆品微生物标准检验方法总则及注解

化妆品微生物标准检验方法总则及注解中华人民共和国国家标准化妆品微生物标准检验方法 UDC 668:576 .85.07总则 (GB7918.1-87)Standard methods of microbiological examination for cosmeticsGeneral rules1 样品的采集及注意事项1.1 所采集的样品,应具有代表性,一般视每批化妆品数量大小,随机抽取相应数量的包装单位。
检验时,应分别从两个包装单位以上的样品中共取10g或10ml。
包装量小的样品,取样量可酌减。
1.2 供检样品,应严格保持原有的包装状态。
容器不应有破裂,在检验前不得启开,以防再污染。
1.3 接到样品后,应立即登记,编写检验序号,并按检验要求尽快检验。
如不能及时检验,样品应放不室温阴凉干燥处,不要冷藏或冷冻。
1.4 若只有一个样品而同时需做多种分析,如细菌、毒理、化学等,则宜先取出部分样品作细菌检验,再将剩余样品作其他分析。
1.5 在检验过程中,从开封到全部检验操作结束,均须防止微生物的再污染和扩散,所用器皿及材料均应事先灭菌,全部操作应在无菌室内进行。
或在相应条件下,按无菌操作规定进行。
1.6 如检出烘大肠菌群或其他致病菌,自报告发出起该菌种及被检样品应保存一个月备查。
2 供检样品的制备2.1 培养基和试剂2.1.1 生理盐水氯化钠8.5g蒸馏水1000ml溶解后,分装到加玻璃珠的锥形瓶内,每瓶90ml,121℃(15 1b)20min高灭菌。
2.1.2 SCDLP液体培养基成分:酪蛋白胨 17g大豆蛋白胨 3g氯化钠 5g磷酸氢二钾 2.5g葡萄糖 2.5g卵磷脂 1g吐温80 7g蒸馏水 1000ml制法:将上述成分混合后,加热溶解,凋pH为7.2~7.3分装,121℃(15 1b)20min 高压灭菌。
注意振荡,使沉淀于底层的吐温80充分混合,冷却至25℃左右使用。
注:如无酪蛋白胨和大豆蛋白胨,也可用日本多胨代替。
消毒液消毒效力及有效期验证

稀释级
结果
杀灭
对数值
试验组活菌浓度对数值
试验组活菌浓度对数值
0.5%84消毒液
金黄色葡萄大肠埃希菌
10-1
10-2
10-3
10-4
枯草芽孢杆菌
10-1
10-2
10-3
10-4
白色念珠菌
10-1
10-2
10-3
10-4
结论:
。
操作人/日期:复核人/日期:
表6表面试验法试验记录
样品培养:大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌于30~35℃培养3天,白色念珠菌于20~25℃培养5天,培养结束后点计菌落数。
结果计算:计算试验组和对照组的活菌浓度(cfu/ml),并换算为对数值(N),并按下式计算杀灭对照值
杀灭对数值(KL) =对照组平均活菌浓度的对数值(NO)-试验组活菌浓度对数值(NX)
●第1组
目的:观察消毒液对试验菌有无杀灭或抑制能力。
操作方法:吸取消毒剂4.5ml于试管内,吸加0.5ml菌悬液(含菌量为1×108cfu/ml~5×108cfu/ml),混匀。作用10分钟,吸此样液0.5ml至含有4.5ml稀释液试管中混匀。吸取该最终样液0.5ml,接种于平皿中,做活菌培养计数。金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌用TSA培养基;白色念珠菌用SDA培养基。
中和剂选择实验结果消毒剂组间误差率结论第一组第二组第三组第四组第五组第六组金黄色葡萄球菌大肠枯草芽孢杆菌白色念珠菌乙醇溶液金黄色葡萄球菌大肠枯草芽孢杆菌白色念珠菌84消毒液金黄色葡萄球菌大肠枯草芽孢杆菌白色念珠菌操作人日期
1
本文件用于验证洁净区按照规定的消毒程序消毒能够达到消毒、防止污染的目的,在消毒有效期内能确保其消毒效力符合要求。
酸碱中和滴定

2.原理:以酸碱中和反应为基础:H+ + OH- = H2O
在达到滴定终点(即酸碱恰好完全反应)时:
有 n(H+) = n(OH-)
对于一元酸与一元碱: C酸V酸=C碱V碱
例题 : 用 0.1100mol/L 的 HCl 溶液滴定 22.00mL 未知 浓度的 NaOH 溶液, 滴定完成时,用去 HCl 溶液 29.00mL 。通过中和滴定测得 NaOH 溶液的物质的 量浓度是多少?
7 10
0刻度处
25ml刻 度处
7.47mL
8
8
9.1mL
25ml酸式滴定管
滴定管
量筒
练一练
练习2:有一支50mL的滴定管,其中盛有溶液, 液面恰好在10mL刻度处,把滴定管中的液体全
部流下排除,承接在量筒中,量筒中的溶液的
体积( )A
A.大于40.0mL
C.小于40.0mL
B.等于40.0mL
D.等于10.0mL
引出pH值突变概念 及范围
问题2:滴定终点时多半滴和少半滴溶液性质发生怎样改变 ? PH发生怎样改变?(一滴溶液的体积约为0.04mL)
问题3:以NaOH加入量为横坐标,以pH值变化为纵坐标, 绘制中和滴定曲线
PH
中和滴定曲线
12 10 8 6
反应终点
突 变4.3—9.7 范 围
4
2 加入NaOH(ml)
两位
☆ 2、滴定管使用注意事项:
⑴酸式滴定管:
⑵碱式滴定管:
可盛装酸性溶液,强氧化性溶液;不能盛装碱性 溶液,HF
盛装碱性溶液,不能盛放酸性溶液和强氧化性溶 液(如KMnO4,K2Gr2O7,H2O2等),防止橡胶管被腐蚀。
理化检验原始记录

理化检验原始记录实验目的:通过理化检验方法对物质进行分析,确定其性质和组成。
实验步骤及结果:1.溶液酸碱中和滴定实验实验步骤:a.取10mL酸性溶液放入锥形瓶中。
b.用滴定管分次滴加NaOH溶液。
每一滴都要充分搅拌,并记录下加入的滴数。
c.当溶液的颜色由红变为黄时停止滴定,记录下总滴数。
d.重复实验三次。
实验结果:实验次数,酸性溶液体积(mL),NaOH溶液滴数(滴)---,---,---1,10,202,10,213,10,22计算平均滴数:(20+21+22)/3=21滴2.测定溶液的密度实验步骤:a.准备好密度计和待测液体。
b.用蒸馏水进行清洗,保证密度计的清洁度。
c.将密度计放入待测液体中,等待一段时间使温度平衡。
d.读取密度计上的刻度并记录下来。
实验结果:待测液体的密度为1.05g/mL。
3.测量溶液的酸碱度实验步骤:a.准备好pH计和待测溶液。
b.将pH电极插入待测溶液中,等待一段时间使测量结果稳定。
c.读取pH计上的数值并记录下来。
实验结果:待测溶液的pH值为7.24.测定化合物的熔点实验步骤:a.准备好熔点仪和待测化合物。
b.将待测化合物装入熔点管中,确保填充均匀。
c.将熔点管放入熔点仪中,加热直到化合物开始熔化。
d.注意观察化合物状态的变化,并记录下熔化的温度范围。
实验结果:待测化合物的熔点范围为75-80°C。
5.测定溶液中元素的浓度实验步骤:a.准备好比色计和溶液。
b.将溶液放入比色计中,调节比色计的波长至最佳测量位置。
c.读取比色计上的读数并记录下来。
实验结果:溶液中元素的浓度为0.5 mg/L。
实验结论:经过理化检验的分析与实验结果比较后,得出以下结论:- 酸性溶液的中和滴定结果表明,平均需要滴加NaOH溶液21滴,可推断酸性溶液的浓度为0.1 mol/L。
-待测液体的密度为1.05g/mL。
-待测溶液的酸碱度为中性,pH值为7.2-待测化合物的熔点范围为75-80°C。
微生物限度检测方法验证操作规程(2015年版)

微生物限度检测方法验证操作规程1 目的确认所采用的方法适合于该产品的微生物限度检测。
2 依据《中国药典》2015版。
3 范围所有需进行微生物限度检测的产品。
4 责任4.1验证小组负责检验方法验证/确认方案的起草、验证/确认方案的实施。
4.2验证委员会负责验证/确认方案的审批,验证/确认结论的审核。
5 程序5.1 由验证小组提出验证申请,验证方案编制完成后,填写《确认和验证方案审批表》,经验证小组会签,报验证委员会审核,由生产负责人和质量负责人批准后,验证方案编制人对验证小组其余人员进行培训后,方可按验证方案试验。
5.2 试验完成后及时编制验证报告,并填写《验证报告审批表》,经验证小组会签,报验证委员会审核,由生产负责人和质量负责人批准后,验证报告结论才可实施。
6 内容6.1 概述通过验证以确认所采用的方法适合于该产品的需氧菌总数、霉菌和酵母菌总数的测定及控制菌的检查。
根据样品特性制订检验方法和检验条件,按制定的方案进行试验,根据验证结果判断是否符合验证标准。
若符合,按验证的方法和条件进行产品的微生物限度检查;若不符合,重新建立制订检验方法和检验条件,再进行验证,直至验证结果符合设立的验证标准。
6.2 需氧菌总数、霉菌和酵母菌总数计数方法的验证6.2.1 验证用菌株铜绿假单胞菌[CMCC(B)10 104]金黄色葡萄球菌[CMCC(B)26 003]枯草芽孢杆菌[CMCC(B)63 501]黑曲霉[CMCC(F)98 003]白色念珠菌[CMCC(F)98 001]6.2.2 验证用菌液制备6.2.2.1接种铜绿假单胞菌、金黄色葡萄球菌与枯草芽孢杆菌至胰酪大豆胨液体培养基中,于30~35℃培养18~24小时。
取上述培养物各1ml,用0.9%无菌氯化钠溶液或pH7.0无菌氯化钠蛋白胨缓冲液制成适宜浓度的菌悬液,备用。
6.2.2.2 接种白色念珠菌至沙氏葡萄糖液体培养基中,于20~25℃培养2~3天。
中国药典2019年版无菌、微生物限度及细菌内毒素检查方法学验证内容简介

菌名
分类
芽孢
对氧需求
铜绿假单胞菌 革兰氏阴性杆菌
无芽孢 需氧
枯草芽孢杆菌 革兰氏阳性杆菌
有芽孢 需氧
金黄色葡萄球菌 革兰氏阳性球菌
无芽孢 需氧
大肠埃希菌
革兰氏阴性短杆菌 无芽孢 需氧
生孢梭菌
梭菌
有芽孢 厌氧
2019年8月
17
菌种的要求: 传代次数不得超过5代(从菌种保存中心获得的 冷冻干燥菌种为第0代),并采用适宜的菌种保 藏技术,以保证试验菌株的生物学特性。
2019年8月
19
接种黑曲霉的新鲜培养物至改良马丁琼脂斜 面培养基上,23~28℃培养5~7天,加入3~ 5ml0.9%无菌氯化钠溶液,将孢子洗脱,然 后,吸出孢子悬液(用管口带有薄的无菌棉 花或纱布能过滤菌丝的无菌毛细吸管)至无 菌试管内,用0.9%无菌氧化钠溶液制成每 lml含孢子数小于100cfu的孢子悬液。
2019年8月
15
无菌检查验证用菌株:
金黄色葡萄萄球菌 (Staphylococcus aureus) [CMCC(B) 26 003]
铜绿假单胞菌 (Pseudomonas aeruginosa) [CMCC(B) 10 104] **拟修订为大肠埃希菌
枯草芽孢杆菌 (Bacillus subtilis) [CMCC(B) 63 501]
2019年8月
35
举例说明上市抽验样品无菌检查方法学验证检验量(液 体制剂)
≤1ml
每个菌10支,共60支(全取样)
1<V<5 共30(取样量为半量)
5≤V<20 建议30(取样量为2ml,建议全部过滤)
20≤V<50 建议30(取样量为5ml,建议全部过滤)
检测方法验证记录

检测方法验证记录一、引言在科学研究和工程实践中,检测方法验证是一项重要的工作,其目的是验证所使用的检测方法在特定条件下的准确性、可靠性和适用性。
本实验旨在通过对特定检测方法的验证来保证其在实际应用中的可靠性和有效性。
二、材料与方法1.材料:本实验所需材料包括检测设备、样品、标准品、校准曲线等。
2.方法(1)选择适当的样本量和浓度范围,以确保实验覆盖全面。
(2)根据制定的检测流程,按照标准操作方法进行样品制备、样品处理和检测。
(3)根据实验要求,确定所需的标准品浓度范围并制备标准溶液。
(4)通过校准曲线法对标准品进行浓度测定,以验证检测方法的准确性和线性范围。
(5)重复实验多次,统计实验结果,并计算检测方法的精密度和重复性。
三、结果与分析1.标准曲线根据所提供的标准品浓度及其对应的检测结果,绘制标准曲线。
通过分析标准曲线的线性度、斜率和截距等参数来评估检测方法的准确性和灵敏度。
校准曲线的表达式:y = ax + b其中,y为检测结果,x为标准品浓度,a为斜率,b为截距。
2.精密度和重复性通过重复检测同一样品多次,计算实验结果的变异系数来评估检测方法的精密度和重复性。
变异系数(CV)的计算公式如下:CV=(标准差/均值)×100%四、综合评价根据以上结果和分析,对检测方法的准确性、可靠性和适用性进行综合评价。
1.准确性:通过与标准品的比较,评估检测方法的准确性。
若检测结果与标准结果相接近且误差较小,则说明检测方法的准确性较高。
2.可靠性:通过重复检测同一样品多次,评估检测方法的可靠性。
若实验结果的变异系数较小,则说明检测方法的可靠性较高。
3.适用性:根据实验样品的需求,评估检测方法的适用性。
若检测方法能够准确、可靠地检测出样品中所需的成分或特性,则说明检测方法具有较高的适用性。
五、结论与建议根据综合评价结果,得出对检测方法的结论和建议。
1.结论:根据实验结果分析,本次检测方法验证结果良好,证明该方法在特定条件下具有较高的准确性、可靠性和适用性。
消毒剂消毒效力检测方法验证方案

概述:本公司现使用四种消毒剂进行消毒,分别为酸性苯酚,碱性苯酚,杀孢子剂和75%乙醇,根据其使用目的和使用条件的不同选择不同的检测消毒剂效力的方法。
为确保能够准确检测消毒剂的消毒效力现对消毒剂消毒效力的检测方法做出验证。
目的:消毒剂消毒效力检测方法有两种,为表面试验法和定量悬浮试验法,,通过验证表面试验法和定量悬浮试验法中中和剂中和效力的挑战性试验以及用于检测样品中的微生物的方法的促菌生长能力(试验方法的灵敏度)。
范围:适用于检测酸性苯酚,碱性苯酚,杀孢子剂,75%乙醇的消毒效力检测方法。
验证小组成员及职责由化验室操作人员起草方案;化验室负责人及质保部负责人审核;验证委员会批准后由化验室操作人员执行。
验证过程应严格按照规定的内容执行,若因特殊原因确实需要变更时,应填写验证方案变更申请及批准书,报验证委员会批准。
验证进度安排验证时间:2012年6月15日~2012年6月30日。
验证依据及参考文献1《药品生产验证指南》(?年版)2《消毒技术规范》(2012年版)3《中国药典》(2010年版)4《药品微生物学检验技术》验证内容1器材与试剂1.1培养基(见培养基配制记录)1.2稀释液:1%蛋白胨-PBS溶液1.3中和剂:0.1%卵磷脂+1%吐温80溶液1.4无菌载片:5cm的正方形不锈钢片,:5cm的正方形玻璃片1.5无菌试管50ml、无菌平皿(90mm)、含玻璃珠的无菌三角瓶、计时器、净化工作台、漩涡混合器、恒温培养箱1.6消毒剂:75%酒精,酸性苯酚,碱性苯酚,杀孢子剂,甲酚皂,新洁尔灭。
1.7移液器及配套无菌吸头:0-100ul,100-1000ul2中和剂鉴定试验(实验结果见附表2)2.1试验目的::通过该试验,确认所用的中和剂对对应的消毒剂有良好的中和作用,中和剂本身及其与消毒剂的反应产物应对微生物无抑菌或杀菌作用切对微生物的生长无影响。
2.2菌液的制备及计数取金黄色葡萄球菌、大肠埃希菌、枯草杆菌芽孢菌的新鲜培养物用0.9%无菌氯化钠溶液做10倍系列稀释成约108CFU/ml的工作菌液。
消毒剂消毒效力验证

一、目的确认各洁净级别的操作间及设备外表面按照规定的消毒程序消毒能够达到消毒、防止污染的目的。
二、范围本验证方案适用于本公司洁净区的墙面、天花板、门窗、机器设备、仪器、操作台、地漏、推车、桌椅等表面以及操作人员双手(手套)的消毒等。
三、术语本方案涉及术语:杀灭对数值:微生物数量以对数表示时,消毒后与消毒前比较,以其减少的对数值来表达杀灭效果。
四、内容1概述本公司的洁净区分为A级、C级和D级,拟定用于洁净区表面消毒的有3种消毒剂:75%乙醇、0.1%新洁尔灭溶液、0.2%新洁尔灭溶液。
本次验证方案将选用以上3种消毒剂分别进行验证试验。
作用对象一样的消毒剂每月轮换使用,避免表面微生物产生耐药菌株。
在利用消毒剂进行表面擦拭消毒过程中消毒剂的作用时间应不少于10分钟,利用消毒剂进行浸泡消毒的不少于5分钟。
2确认项目验证项目技术标准确认所用的中和剂对对应的消毒剂有良好的中和作用,对试验用菌中和剂鉴定试验剂及其恢复期培养无害或无不良影响。
定量悬浮试验通过浸泡或液封消毒,确定消毒效力符合要求。
表面试验法通过擦拭消毒,确定消毒效力符合要求。
A级:1CFU/25cm2现场考察试验C级:≤25CFU/25cm2D级:≤50CFU/25cm23.验证用仪器仪表和物品序号1 2 3 4 5 6 7 8 9恒温恒湿培养箱营养琼脂培养基改良马丁琼脂培养基营养肉汤培养基大豆酪蛋白琼脂培养基接触碟改良马丁培养基金黄色葡萄球菌大肠埃希菌枯草杆菌芽孢名称是否已验证并在有设备编号或批号效期内是□否□是□否□是□否□是□否□是□否□是□否□是□否□是□否□是□否□是□否□是□否□是□否□是□否□是□否□10白色念珠菌11121314结论:检查人/日期:复核人/日期:4.验证过程4.1中和剂鉴定试验4.1.1试验目的通过该试验,确认所用的中和剂对对应的消毒剂有良好的中和作用,对试验用菌剂及其恢复期培养无害或无不良影响。
4.1.2菌液的制备及计数4.1.2.1金黄色葡萄球菌、大肠埃希菌、枯草杆菌芽孢菌工作菌液的制备接种金黄色葡萄球菌、大肠埃希菌、枯草杆菌芽孢菌的新鲜培养物至营养肉汤培养基中,30~35℃培养18~24小时。
抗-HBs抗体阳性血清中和确认HBsAg方法的建立

文献标识码 B
文 章 编 号 17 — 920 )6 0 7 — 2 6 4 12 (0 80 — 6 7 0 1
11 阴性 对 照 血 清 收 集 收 集 2 0 .. 5 0 8年 6 7月 本 室 使 用 的 山 东 潍 坊 三 维 生 物 工 程 集 团有 限 公 司 HBA LS 法 诊 断 s gE IA 试 剂 剩 余 阴性 对 照 血 清 . ̄保存 . 用 前 混 合 均 匀 4C 使 1 . 抗 一 s 体 阳性 血 清 f 称 “ HB 血 清 ”收集 .6 1 HB 抗 下 抗一 s ) 五 天 内收 集 本 实 验 室 检 测 乙 肝 病 毒 标 志 物 抗 一 s 体 HB 抗 强 阳性 ( 一 B 抗 体 SC 抗 H s / O值 大 于 2) 0的标 本 剩 余 血 清 . 集 收 期间 4 ℃保 存 ; 集 结 束 将 所 有 血 清 混 合 均 匀 , E IA 法 、 收 用 LS 化 学 发 光 法 再 次 检 测 乙肝 五 项标 志 物 .结 果 应 为 抗 一 s HB 抗
实 验 与 检 验 医学
20 0 8年 1 2月 第 2 6卷
第 6期
・7 6 7・
・
经验交流 ・
抗一 B 抗体 阳性血 清 中和确认 H s g H s B A 方法 的建立
雷 震 谢 南 中 图分 类 号 R 4 .2 3 322 4 66 . 7 . R +
1 材 料 与方 进 行 稀 释 后 再 确认 x 0 %> 0 需
12 灵 敏 度 将 2 n l H s g 比 血 清 用 阴性 对 照 .2 . .  ̄m 的 B A 参 0 血 清 精 确 稀 释 为 1 、。、.、.、.r/ l 列 浓 度 血 清 。 . 09 0807 06l m 系 0 g
中和剂效力确认试验备选方案

试验方案来源于《药品GMP指南》2010版悬液定量试验载体定量试验7.4.3.1中和剂效力测试:用于验证中和剂是否能够有效抑制消毒剂的杀菌性;吸取 0.1mL的试验菌悬液于试管内,加9.9mL中和产物溶液(以 0.9mL消毒剂加 9mL中和剂,作用10min配制而成)于试管内,混匀,作用10min,进行平板计数。
7.4.3.2中和剂毒性测试:用于验证中和剂本身是否会对微生物产生抑制/杀灭作用;吸取 0.1mL的试验菌悬液于试管内,加入0.9mL生理盐水(模拟代替消毒液),混匀,加入 9mL中和剂,作用10min,进行平板计数。
7.4.3.1中和剂效力测试:用于验证中和剂是否能够有效抑制消毒剂的杀菌性;取菌片一片置于试管内,加 10mL中和产物溶液(以1mL消毒剂加 9mL中和剂,作用10min 配制而成)于试管内,作用10min,用电动混匀器混合20s,或将试管振打80次,进行平板计数。
7.4.3.2中和剂毒性测试:用于验证中和剂本身是否会对微生物产生抑制/杀灭作用;取菌片一片置于试管内,加入1mL生理盐水(模拟代替消毒液),加入 9mL中和剂,作用10min,用电动混匀器混合20s,或将试管振打80次,进行平板计数。
7.4.3.3计算:记录每个稀释度1.0mL样品的菌落数,选取一个合适梯度的读数,该梯度的两块平板的读数(记为a1和a2)都应处于30~300CFU之间;然后使用以下公式计算N C和N T,中和剂效力测试记为N T,中和剂毒性测试记为N C;N C或N T= lg(a1+a2)/2×10/dd=稀释液的稀释系数;N T=lg中和剂效力测试中初始混合液菌浓度;N C=lg中和剂毒性测试中初始混合液菌浓度;7.4.3.4重复次数:每项测试重复三次,以判断该方法是否稳定。
7.4.3.5接受标准:-0.3≤N C–N T≤0.3试验方案来源于GB∕T 38502-2020《消毒剂实验室杀菌效果检验方法》悬液定量试验载体定量试验7.4.3.1目的:通过所设各组试验结果综合分析,确定所用中和剂是否具有良好的中和作用,对试验用微生物恢复和培养无不良影响。
消毒剂效果确认方案附件
3
培养基管理规程
4
菌种管理规程
5
变更管理规程
6
偏差管理规程
7
8
9
10
11
12 备注:
版本号
确认人/日期
复核人/日期 1/1
南京 XXXX 科技有限公司
酸性苯酚(LpH)消毒剂效果确认方案附件
附录 3:仪器设备校验确认记录 XX-VP-O-0021-2020.00.R03
仪器名称 生物安全柜 恒温培养箱
确认人/日期
复核人/日期
1/1
南京 XXXX 科技有限公司
酸性苯酚(LpH)消毒剂效果确认方案附件
附录 5:菌种确认记录 XX-VP-O-0021-2020.00.R05
菌种名称
菌种编号
传代次数
传代日期
金黄色葡萄球菌
生长是否正常 □是 □否
大肠埃希菌
□是 □否
铜绿假单胞菌
□是 □否
白色念珠菌
□是 □否
管内备用。 培养温度:
培养时间:
取白色念珠菌的沙氏葡萄糖琼脂斜面培养物一环,接种至10ml沙氏葡萄糖液体培养基内
20 ~25℃培养2 ~ 3天。 培养温度:
培养时间:
取20~25℃培养5~7天的黑曲霉沙氏葡萄糖琼脂培养物加入3~5ml 含0.05%聚山梨酯80
的pH7.0无菌氯化钠-蛋白胨缓冲液,将孢子洗脱,用移液器吸出孢子悬液至无菌试管内备用。
稀释至 含菌量
cfu/ml cfu/ml cfu/ml cfu/ml cfu/ml cfu/ml cfu/ml
含菌量 cfu/ml
2/2
南京 XXXX 科技有限公司
酸性苯酚(LpH)消毒剂效果确认方案附件
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(酉阳县环境监测站)检验方法确认记录文件编号:YUHJ-A-2015 使用部门:分析室序号:8
标准名称/编号水质氨氮的测定蒸馏-中和滴定法/HJ537-2009
指定确认人员石白斌陈珊确认日期2015.7.1
方法变更时填写变更内容:
□编号□年号□方法原理□仪器□标准品□试剂□使用范围变化□操作过程□计算过程□其它
变更/偏离的简要说明(可加附页):
是否需要技术验证:□是□否
采用新标准时填写
□国际□国外□国家□行业√□实验室□其它
1、实验室能否正确使用该方法:
对方法原理是否充分理解□是□否
检测仪器设备是否满足方法要求□是□否
辅助设备是否满足方法要求□是□否
实验室环境条件是否满足方法要求□是□否
所需对照物是否备齐□标准物质□参考标准□菌株□不适用所需试剂、器皿是否满足要求□是□否
仪器操作人员是否经过授权□是□否
2、需要进行技术验证:
确认结论:满足检测要求□是□否满足客户要求□是□否
岗位高级工程师/实验室负责人:日期:
□可以采用(□存档□发放至相关实验室)□需编制作业指导书□不适用□仍需进一步验证()
技术负责人:日期:
附标准文本/技术验证记录(如果需要)
第1版2015年7月1日发布2015年10月1日实施第1页。
