【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)
【化学】初三化学《溶液》解题技巧(超强)及练习题(含答案)含解析

【化学】初三化学《溶液》解题技巧(超强)及练习题(含答案)含解析一、选择题1.点:溶解度曲线上的每个点(即饱和点)表示的是某温度下某种物质的溶解度。
即曲线上的任意一点都对应有相应的温度和溶解度。
温度在横坐标上可以找到,溶解度在纵坐标上可以找到。
溶解度曲线上的点有三个方面的作用:(1)根据已知的温度可以查出有关物质的溶解度;(2)根据物质的溶解度也可以查出它所对应的温度;(3)可以判断或比较相同温度下,不同物质溶解度的大小(或饱和溶液中溶质的质量分数的大小)。
2.下表是KCl与KNO3在不同温度的溶解度。
下列说法不正确...的是()A.20℃时,KC1的溶解度大于KNO3的溶解度B.两物质溶解度相等的温度在20~30℃之间C.40℃时,5gKCl中加10g水可得33.3%溶液D.50℃时,10g KNO3中加20g水,充分溶解后再降温到30℃,有KNO3固体析出【答案】C【解析】试题分析:由两种物质的溶解度可知20℃时,KNO3溶解度小于KC1的溶解度,A正确;由表格数据可知温度在20~30℃时,两物质的溶解度有相同的部分,即两物质溶解度相等的温度在20~30℃之间,B正确;40℃时,KCl的溶解度为40g,即该温度下40g氯化钾溶解在100g水中恰好形成饱和溶液,那么10g水中最多溶解4g氯化钾,形成的溶液的溶质质量分数=4g/14g ×100%=28.6%,C错误;30℃时硝酸钾的溶解度为45.8g,即该温度下45.8g硝酸钾溶解在100g水中恰好形成饱和溶液,那么20g水中最多溶解硝酸钾9.16g,即50℃时,10g KNO3中加20g水,充分溶解,再降温到30℃,有KNO3固体析出,D正确。
故选C。
考点:溶解度3.20℃时,往100g硝酸钾溶液中加入20g硝酸钾,充分搅拌,硝酸钾部分溶解。
下列说法正确的是A.硝酸钾的溶解度变大B.溶质的质量分数保持不变C.所得溶液是饱和溶液D.所的溶液的质量为120g【答案】C【解析】【分析】【详解】A、硝酸钾的溶解度只受温度一个外界因素的影响,温度不变,溶解度不变,故A不正确;B、硝酸钾部分溶解,溶质的质量分数变大,故B不正确;C、硝酸钾部分溶解,则溶液为饱和溶液,故C正确;D、20g的硝酸钾部分溶解,溶液的质量小于120g,故D不正确。
【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.交点:两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的。
2.盐场晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,它们的溶解度曲线如下图所示。
下列说法正确的是A.MgSO4的溶解度始终随温度的升高而减小B.t1℃时,KCl和MgSO4两溶液所含溶质质量一定相等C.t2℃时,100gMgCl2的饱和溶液中含有agMgCl2D.将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和变为不饱和【答案】D【解析】【分析】【详解】A、由溶解度曲线可知,MgSO4的溶解度不是始终随温度的升高而减小,故A错误;B、t1℃时,氯化钾和硫酸镁的溶解度相等,如果两种溶液是饱和溶液,并且溶液质量相等,则溶质质量一定相等,但题目未告知两溶液质量是否相等,故B错误;C、t2℃时,溶解度的含义是100g水中最多能溶解ag氯化镁,因此100gMgCl2的饱和溶液中含有氯化镁的质量小于ag,故C错误;D、氯化钾的溶解度随着温度的升高而增大,将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和溶液变成不饱和溶液,故D正确。
故选:D。
3.如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是A.t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多C.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90g D.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多【答案】A【解析】A、一定温度下,饱和溶液溶质的质量分数=s100g s+×100%。
t1℃时,甲、乙的溶解度相等,甲、乙两种饱和溶液的溶质质量分数相等,正确;B、没有确定溶液的质量无法比较甲、乙饱和溶液析出晶体的质量,错误;C、t2℃时,甲的溶解度为50g,即100g水中最多溶解50g的甲,40g甲加入50g水中,充分溶解后只能溶解25g,所得的溶液质量为75g,错误;D、t2℃时,甲的溶解度大于乙的溶解度,配制等质量饱和溶液,甲所需要水的质量比乙少,错误。
【化学】初三化学《溶液》解题技巧及练习题含解析

【化学】初三化学《溶液》解题技巧及练习题含解析一、选择题1.如图是a 、b 、c 三种物质的溶解度曲线,下列分析正确的是A .P 点表示物质A 和C 的溶解度都为20gB .若a 中混有少量b ,可采用蒸发结晶法分离提纯aC .将t 2℃时a 、b 、c 三种物质的饱和溶液降温至t 1℃时,a 溶液中析出的晶体不一定最多D .将t 1℃时a 、b 、c 三种物质的饱和溶液升温至t 2℃时,所得溶液的溶质质量分数关系是a >b >c【答案】C【解析】A.根据溶解度曲线的交叉点表示的意义解答;B. 据a 、b 的溶解度受温度影响情况分析提纯物质的方法;C.根据饱和溶液的质量分析解答。
D. 据三种物质的溶解度随温度变化情况及饱和溶液中溶质质量分数的计算式分析解答。
解:A. P 点表示t 1℃时物质a 和c 的溶解度都为20g 。
故错误;B. 由于a 、b 物质的溶解度随温度的升高而增加且a 物质的溶解度受温度的影响变化较大,当a 物质中混有少量b 物质时,可采用降温结晶的方法得到较纯净的a 物质。
故错误;C. 将t 2℃时a 、b 、c 三种物质的饱和溶液降温至t 1℃时,由于a 、b 、c 三种溶液的质量不一定相等,故a 溶液中析出的晶体不一定最多。
正确;D. 据图可知:a 、b 的溶解度随温度的升高而增大,c 的溶解度随温度的升高而减小;所以将t 1℃时a 、b 、c 三种物质的饱和溶液均升温到t 2℃时,a 、b 溶质质量不变,溶剂质量不变,溶质质量分数不变,c 析出晶体,依然是饱和溶液,又t 1℃时a 、c 的溶解度相同,此时a 、c 的溶质质量分数相等,而a 升温后变为不饱和溶液,溶质的质量分数与升温前相等,据饱和时质量分数的计算式+100g溶解度溶解度×100%,可知溶解度越大质量分数也就越大,t 2℃时溶液中溶质质量分数最大的是b >a >c 。
故错误。
2.下列关于溶液的说法错误的是( )A .固体、液体、气体都可以做溶质B .NH 4NO 3溶解过程中吸热,溶液温度降低C .欲使100克KNO 3溶液的质量分数由5%变成10%,可向其中加入5克KNO 3固体D.25℃时,将某KNO3溶液蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a 与b的质量不一定相等【答案】C【解析】试题分析:A、溶质可以是固体、液体、气体,故A说法正确;B、NH4NO3溶解过程中吸热,溶液温度降低,故B说法正确;C、溶质质量分数:,故C错;D、如果硝酸钾溶液蒸发溶剂前,是饱和溶液,蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a与b的质量一定相等,如果硝酸钾溶液蒸发溶剂前,是不饱和溶液,蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a与b的质量一定不相等,故D说法正确。
【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.NH4Cl和Na2SO4的溶解度表及溶解度曲线如图.下列说法错误的是A.乙为NH4Cl B.t3应介于40℃﹣50℃C.55℃时,分别将两饱和溶液蒸发等质量的水,得到固体质量甲>乙 D.等质量的甲、乙饱和溶液从t3降温到t1,析出的晶体质量相等【答案】C【解析】A. 据溶解度表可知,NH4Cl的溶解度随温度升高而增大,故乙是NH4Cl,正确;B、40℃时,Na2SO4的溶解度是48.4g,50℃时,溶解度变小,是47.5g,且t3℃时两种物质的溶解度相等,故t3应介于40℃﹣50℃,正确;C、据溶解度表分析可知,55℃时,NH4Cl的溶解度大于Na2SO4的溶解度,故分别将两饱和溶液蒸发等质量的水,得到固体质量乙>甲,错误;D、两种物质的溶解度从t3降温到t1时,溶解度变化相同,故等质量的甲、乙饱和溶液从t3降温到t1,析出的晶体质量相等,正确。
故选C。
2.如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是A.t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多C.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90gD.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多【答案】A【解析】A、一定温度下,饱和溶液溶质的质量分数=s100g s×100%。
t1℃时,甲、乙的溶解度相等,甲、乙两种饱和溶液的溶质质量分数相等,正确;B、没有确定溶液的质量无法比较甲、乙饱和溶液析出晶体的质量,错误;C、t2℃时,甲的溶解度为50g,即100g水中最多溶解50g的甲,40g甲加入50g水中,充分溶解后只能溶解25g,所得的溶液质量为75g,错误;D、t2℃时,甲的溶解度大于乙的溶解度,配制等质量饱和溶液,甲所需要水的质量比乙少,错误。
【化学】初三化学《溶液》解题技巧(超强)及练习题(含答案)含解析

【化学】初三化学《溶液》解题技巧(超强)及练习题(含答案)含解析一、选择题1.如图为甲、乙两种物质的溶解度曲线,下列说法正确的是A.20℃时,12 g的乙物质能完全溶于50 g的水中B.30℃时,甲物质的溶解度大于乙物质的溶解度C.将甲溶液从50℃降温到30℃时,一定有晶体析出D.将接近饱和的乙溶液变为饱和溶液,可以升高温度【答案】B【解析】A.根据20℃时,乙物质的溶解度分析;B.根据30℃时,甲、乙两物质的溶解度分析;C.根据溶液是否饱和分析;D.根据乙的溶解度随温度的升高而增大分析。
解:A. 由图可知,20℃时,乙物质的溶解度为20g。
因此20℃时,12 g的乙物质不能完全溶于50 g的水中,故错误;B. 由图可知,30℃时,甲物质的溶解度大于乙物质的溶解度,正确;C. 将甲溶液从50℃降温到30℃时,不一定有晶体析出,因为此时溶液不一定饱和,故错误;D. 由图可知,乙物质的溶解度随温度的升高而增大。
因此将接近饱和的乙溶液变为饱和溶液,可以升高温度是错误的。
点睛:饱和溶液与溶解度。
2.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法错误的是()A.t2℃时,将甲、乙的两种饱和溶液分别降温到t1℃,所得溶液都是饱和溶液B.t1℃时,向50g水中加入甲可得80g饱和溶液,则乙在该温度下的溶解度为60gC.甲中混有少量乙时,可用降温结晶的方法提纯甲D.t2℃时,将等质量的甲、乙两种溶液分别降温到0℃,甲溶液的溶质质量分数一定小于乙溶液的溶质质量分数【答案】D【解析】【详解】A、t2℃时,将甲、乙的两种饱和溶液分别降温到t1℃,所得溶液都是饱和溶液正确,因为甲、乙两种固体物质的溶解度,都是随温度升高而增大,正确但不符合题意,故选项错误;B、t1℃时,向50g水中加入甲可得80g饱和溶液,则乙在该温度下的溶解度为60g正确,因为该温度下50g水溶解了30g溶质,那么100g是就恰好溶解60g溶质,正确但不符合题意,故选项错误;C、甲中混有少量乙时,可用降温结晶的方法提纯甲正确,因为甲的溶解度随温度的升高变化比乙大,正确但不符合题意,故选项错误;D、t2℃时,将等质量的甲、乙两种溶液分别降温到0℃,甲溶液的溶质质量分数一定小于乙溶液的溶质质量分数错误,因为没有指明溶液是否饱和,错误符合题意,故选项正确;故选D。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.列表和作图是常用的数据处理方法.结合材料所绘图表判断下列说法正确的是( )A.表格与图象均能反映温度对固体物质溶解度的影响,表格比图像更直观体现变化规律B.由表格数据可知,物质的溶解度只受温度影响C.40℃时,将50g NaOH分别投入到100g水和酒精中都能得到饱和溶液D.40℃时,将CO2通入饱和的NaOH酒精溶液中有沉淀生成【答案】A【解析】A.通过分析溶解度表和溶解度曲线可知,图象与表格均能反映温度对固体物质溶解度的影响,其中图象的优点是变化规律更直观,故A错误;B.由表格数据可知,物质的溶解度受温度和溶剂影响,故B错误;C.40℃时,氢氧化钠在水中的溶解度是129g,氢氧化钠在酒精中的溶解度是40g,所以将50gNaOH分别投入到100g水和酒精中,在水中不能形成饱和溶液,故C错误;D.40℃时,碳酸钠在酒精中难溶,所以将CO2通入饱和的NaOH酒精溶液中有沉淀生成,故D正确;故选D。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
2.现用98%的浓硫酸配制1000mL溶质质量分数为20%的稀硫酸 ( 密度为 1.14g/mL)。
下列说法正确的是A.实验中需要用到的玻璃仪器有天平、烧杯、量筒、玻璃棒和胶头滴管等B.配制该稀硫酸需要加水800mLC.配制稀硫酸时用到玻璃棒,其作用是引流D.该稀硫酸中,溶液质量:溶剂质量 =5:4【答案】D【解析】A、根据用浓硫酸配稀硫酸的步骤考虑需要的玻璃仪器;B、根据用配制的溶液的总质量减去浓硫酸的质量就是加入水的质量,再除以水的密度就是水的体积;C、根据浓硫酸的稀释方法考虑;D、根据稀硫酸的溶质质量分数计算出溶液质量与溶剂质量之比.解:A、用浓硫酸配稀硫酸的步骤:计算、量取、配制,所以用到量筒、烧杯、玻璃棒、胶头滴管,故A错误;B、稀硫酸的质量:1000mL×1.14g/mL=1140g,含有溶质质量:1140g×20%=228g,浓硫酸的质量为:=232.65g所以需要水的质量:1140g-232.65g=907.35g,体积为907.35mL,故B错;C、配制稀硫酸时用到玻璃棒,其作用是不断搅拌,散热,故C错;D、溶质质量分数为20% 的稀硫酸中设溶质20g、溶液为100g,则溶剂为80g,所以溶液质量:溶剂质量=100g:80g=5:4;故D正确。
【化学】初三化学《溶液》解题技巧及练习题含解析

【化学】初三化学《溶液》解题技巧及练习题含解析一、选择题1.交点:两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的。
2.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。
下列说法正确的是( )A.该温度下,KNO3的溶解度为30gB.乙溶液的质量分数为30%C.降低温度,可以使甲溶液变成饱和溶液D.升高温度,甲、乙两溶液的质量分数都增大【答案】C【解析】溶解度是指在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。
A.该温度下,KNO3的溶解度为80g 2020g g+=100g x ,x=50g,故A错误;B. 乙溶液的质量分数为5010050gg g+×100%=33.3%,故B错误;C. 降低温度,可以使甲溶液变成饱和溶液,硝酸钾溶解度随温度升高而增大,故C正确;D. 硝酸钾溶解度随温度升高而增大,升高温度,甲、乙两溶液的质量分数都不变,故D错误。
点睛∶硝酸钾溶解度随温度升高而增大,影响固体溶解度的因素是温度,溶质和溶剂本身的性质。
3.t℃测得某物质(不含结晶水)在不同质量的水中溶解达到饱和状态时所溶解该物质的质量,绘制成如图中斜线。
下列说法错误的是A.t℃时该物质的溶解度为40gB.N点表示溶液中溶质的质量分数为20%C.加溶质能使M点的溶液达到饱和状态D.图中4点表示的溶液中溶质质量分数的关系是:N<M<P=Q【答案】B【解析】A.由图示可知t℃时该物质的溶解度为40g,故A正确;B.N点表示100g水中溶解20g溶质,溶液中溶质的质量分数为20100%10020ggg⨯+≠20%,故B错误;C.M点为80g水中溶解了20克溶质,此时溶液为不饱和溶液,添加溶质能使M点的溶液达到饱和状态,故C正确;D.P、Q均是这一温度的饱和溶液故此溶液溶质质量分数相等,M与N溶质是相同的而溶剂不同,可判断出N<M,由于温度相同时不饱和溶液最浓,可知它们的关系是:N<M<P=Q,故D正确;答案为B。
【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)
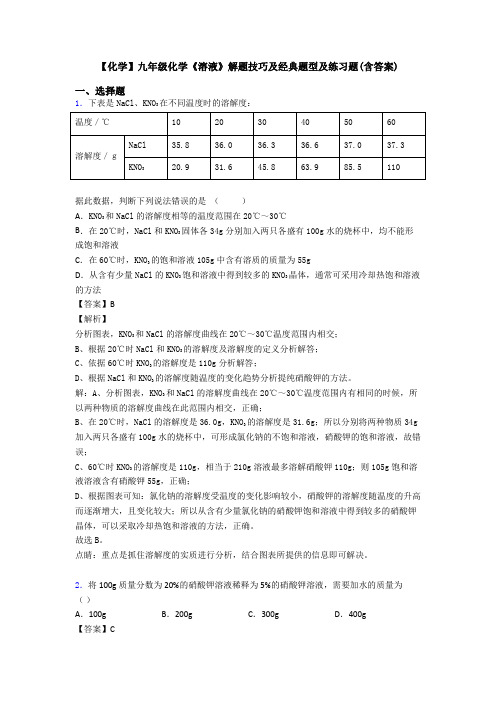
【化学】九年级化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.下表是NaCl、KNO3在不同温度时的溶解度:据此数据,判断下列说法错误的是()A.KNO3和NaCl的溶解度相等的温度范围在20℃~30℃B.在20℃时,NaCl和KNO3固体各34g分别加入两只各盛有100g水的烧杯中,均不能形成饱和溶液C.在60℃时,KNO3的饱和溶液105g中含有溶质的质量为55gD.从含有少量NaCl的KN03饱和溶液中得到较多的KNO3晶体,通常可采用冷却热饱和溶液的方法【答案】B【解析】分析图表,KNO3和NaCl的溶解度曲线在20℃~30℃温度范围内相交;B、根据20℃时NaCl和KNO3的溶解度及溶解度的定义分析解答;C、依据60℃时KNO3的溶解度是110g分析解答;D、根据NaCl和KNO3的溶解度随温度的变化趋势分析提纯硝酸钾的方法。
解:A、分析图表,KNO3和NaCl的溶解度曲线在20℃~30℃温度范围内有相同的时候,所以两种物质的溶解度曲线在此范围内相交,正确;B、在20℃时,NaCl的溶解度是36.0g,KNO3的溶解度是31.6g;所以分别将两种物质34g 加入两只各盛有100g水的烧杯中,可形成氯化钠的不饱和溶液,硝酸钾的饱和溶液,故错误;C、60℃时KNO3的溶解度是110g,相当于210g溶液最多溶解硝酸钾110g;则105g饱和溶液溶液含有硝酸钾55g,正确;D、根据图表可知:氯化钠的溶解度受温度的变化影响较小,硝酸钾的溶解度随温度的升高而逐渐增大,且变化较大;所以从含有少量氯化钠的硝酸钾饱和溶液中得到较多的硝酸钾晶体,可以采取冷却热饱和溶液的方法,正确。
故选B。
点睛:重点是抓住溶解度的实质进行分析,结合图表所提供的信息即可解决。
2.将100g 质量分数为20%的硝酸钾溶液稀释为5%的硝酸钾溶液,需要加水的质量为()A.100g B.200g C.300g D.400g【答案】C【解析】【分析】【详解】根据稀释前后溶质质量不变,可设需要加水的质量为x,100g×20%=(100g+x)×5%,解得x=300g,故选C.3.20℃时,往100g硝酸钾溶液中加入20g硝酸钾,充分搅拌,硝酸钾部分溶解。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.交点:两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的。
2.如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是A.t1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等B.由t2℃降温到t1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多C.t2℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为90gD.t2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多【答案】A【解析】A、一定温度下,饱和溶液溶质的质量分数=s100g s+×100%。
t1℃时,甲、乙的溶解度相等,甲、乙两种饱和溶液的溶质质量分数相等,正确;B、没有确定溶液的质量无法比较甲、乙饱和溶液析出晶体的质量,错误;C、t2℃时,甲的溶解度为50g,即100g水中最多溶解50g的甲,40g甲加入50g水中,充分溶解后只能溶解25g,所得的溶液质量为75g,错误;D、t2℃时,甲的溶解度大于乙的溶解度,配制等质量饱和溶液,甲所需要水的质量比乙少,错误。
故选A。
点睛:一定温度下,饱和溶液溶质的质量分数=s100g s+×100%。
3.下表是KCl与KNO3在不同温度的溶解度。
下列说法不正确...的是()温度/℃20304050KCl34.0g37.0g40.0g42.6gKNO331.6g45.8g63.9g85.5gA.20℃时,KC1的溶解度大于KNO3的溶解度B.两物质溶解度相等的温度在20~30℃之间C.40℃时,5gKCl中加10g水可得33.3%溶液D.50℃时,10g KNO3中加20g水,充分溶解后再降温到30℃,有KNO3固体析出【答案】C【解析】试题分析:由两种物质的溶解度可知20℃时,KNO3溶解度小于KC1的溶解度,A正确;由表格数据可知温度在20~30℃时,两物质的溶解度有相同的部分,即两物质溶解度相等的温度在20~30℃之间,B正确;40℃时,KCl的溶解度为40g,即该温度下40g氯化钾溶解在100g水中恰好形成饱和溶液,那么10g水中最多溶解4g氯化钾,形成的溶液的溶质质量分数=4g/14g ×100%=28.6%,C错误;30℃时硝酸钾的溶解度为45.8g,即该温度下45.8g硝酸钾溶解在100g水中恰好形成饱和溶液,那么20g水中最多溶解硝酸钾9.16g,即50℃时,10g KNO3中加20g水,充分溶解,再降温到30℃,有KNO3固体析出,D正确。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.甲、乙两种不含结晶水的固体的溶解度曲线如图所示.下列说法中正确的是A .t 3℃时,甲的饱和溶液溶质与溶液的质量比为1:2B .t 1℃时,甲的溶解度大于乙的溶解度C .t 2℃时,甲、乙溶液的溶质质量分数都为30%D .t 2℃时,质量相同的甲、乙饱和溶液分别升温至t 3℃,为达饱和状态,需加入甲的质量大于乙的质量【答案】D【解析】A 、t 3℃时,甲物质的溶解度是50g ,所以甲的饱和溶液溶质与溶液的质量比为1:3,故A 错误;B 、通过分析溶解度曲线可知,t 1℃时,甲的溶解度小于乙的溶解度,故B 错误;C 、t 2℃时,甲、乙物质的溶解度是30g ,所以甲、乙饱和溶液的溶质质量分数都为30130g g×100%=23.1%,故C 错误; D 、t 3℃时,甲物质的溶解度大于乙物质的溶解度,所以t 2℃时,质量相同的甲、乙饱和溶液分别升温至t 3℃,为达饱和状态,需加入甲的质量大于乙的质量,故D 正确。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
2.如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是A .t 1℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等B .由t 2℃降温到t 1℃,甲饱和溶液比乙饱和溶液析出晶体的质量多C .t 2℃时,将40g 甲物质加入50g 水中,充分溶解后溶液的质量为90gD .t 2℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多【答案】A 【解析】A、一定温度下,饱和溶液溶质的质量分数=s100g s+×100%。
【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.甲、乙两种不含结晶水的固体的溶解度曲线如图所示.下列说法中正确的是A .t 3℃时,甲的饱和溶液溶质与溶液的质量比为1:2B .t 1℃时,甲的溶解度大于乙的溶解度C .t 2℃时,甲、乙溶液的溶质质量分数都为30%D .t 2℃时,质量相同的甲、乙饱和溶液分别升温至t 3℃,为达饱和状态,需加入甲的质量大于乙的质量【答案】D【解析】A 、t 3℃时,甲物质的溶解度是50g ,所以甲的饱和溶液溶质与溶液的质量比为1:3,故A 错误;B 、通过分析溶解度曲线可知,t 1℃时,甲的溶解度小于乙的溶解度,故B 错误;C 、t 2℃时,甲、乙物质的溶解度是30g ,所以甲、乙饱和溶液的溶质质量分数都为30130g g×100%=23.1%,故C 错误; D 、t 3℃时,甲物质的溶解度大于乙物质的溶解度,所以t 2℃时,质量相同的甲、乙饱和溶液分别升温至t 3℃,为达饱和状态,需加入甲的质量大于乙的质量,故D 正确。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
2.下图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法不正确的是A .10℃时,甲、乙两种物质的饱和溶液浓度相同B .保持20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液C.30℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为80gD.10℃时,将两种饱和溶液升温至30℃,溶液中溶质的质量分数都增大【答案】D【解析】【分析】【详解】A、根据溶解度曲线,10℃时,甲、乙的溶解度都是20g,故甲、乙两种物质的饱和溶液浓度相同,选项A正确;B、保持20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液,选项B正确;C、根据溶解度曲线,30℃时,甲物质的溶解度为60g,故将40g甲物质加入到50g水中并充分搅拌,只能溶解30g,故充分溶解后溶液的质量为80g,选项C正确;D、根据溶解度曲线,物质甲、乙的溶解度都随温度的升高而增大,故10℃时,将两种饱和溶液升温至30℃,都成为30℃时的不饱和溶液,但溶液中的溶质、溶剂质量都不变,故溶质质量分数也不变,选项D错误。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.甲、乙、丙三种固体物质的溶解度曲线如图所示,下列叙述正确的是()A.t1℃时将等质量的乙、丙溶于水中,分别配成饱和溶液,所得溶液质量:乙=丙B.将t1℃时甲、丙的饱和溶液升温到t2℃,两种溶液中溶质的质量分数相等C.要将接近饱和的丙溶液变为饱和溶液,可以采用降温或蒸发的方法D.t3℃时,将三种物质的饱和溶液恒温蒸发等量水后,析出溶质的质量顺序:甲>丙>乙【答案】A【解析】A、t1℃时,乙的溶解度等于甲,将等质量的甲、乙分别配成饱和溶液,所需要的水的质量相等,故所得溶液质量甲=乙,故正确;B、将t1℃时甲、丙的饱和溶液升温到t2℃,甲的溶解度随温度的升高而增大,故溶液组成不变,而丙的溶解度随温度的升高而减小,会析出晶体,溶质质量分数会减小,但t2℃是丙的溶解度大于t1℃时甲的溶解度,故两种溶液中溶质的质量分数丙大于甲,故错误;C、由溶解度曲线可知,丙的溶解度随着温度的降低而增大,因此要将接近饱和的丙溶液变为饱和溶液,可以采用升温或蒸发的方法,故正确;D、t3℃时三种物质的溶解度关系为甲>乙>丙,将t3℃时三种物质的饱和溶液恒温蒸发等量水后,析出溶质的质量甲>乙>丙,故错误。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
2.如图是甲乙两种物质的溶解度曲线,下列说法正确的是()A.甲的溶解度大于乙的溶解度B.t℃时,甲乙饱和溶液中溶质的质量分数相等C.升高温度能使接近饱和的甲溶液变为饱和溶液D.10℃时,分别用100g水配制甲乙的饱和溶液,所需甲的质量大于乙的质量【答案】B【解析】【分析】【详解】A、由两种物质的溶解度曲线可以看出,当0~t℃时,乙的溶解度大于甲的溶解度,选项A 错误;B、t℃时,二者的溶解度相等,饱和溶液中溶质的质量分数也相等,选项B正确;C、由甲物质的溶解度曲线可以看出,甲物质的溶解度随着温度的升高而增大,所以升高温度不能使接近饱和的甲溶液变为饱和溶液,选项C错误;D、过10℃作一条垂直于横坐标的垂线,看垂线与曲线的交点高低,从图象可以看出,此时乙的溶解度大于甲的溶解度,选项D错误。
【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.交点:两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的。
2.20℃时,往100g硝酸钾溶液中加入20g硝酸钾,充分搅拌,硝酸钾部分溶解。
下列说法正确的是A.硝酸钾的溶解度变大B.溶质的质量分数保持不变C.所得溶液是饱和溶液D.所的溶液的质量为120g【答案】C【解析】【分析】【详解】A、硝酸钾的溶解度只受温度一个外界因素的影响,温度不变,溶解度不变,故A不正确;B、硝酸钾部分溶解,溶质的质量分数变大,故B不正确;C、硝酸钾部分溶解,则溶液为饱和溶液,故C正确;D、20g的硝酸钾部分溶解,溶液的质量小于120g,故D不正确。
故选C。
3.面:对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。
如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加适量的溶质使之到达曲线上;第二种方法是蒸发掉过量的溶剂。
4.如图是A、B、C三种物质的溶解度曲线,下列说法不正确的是A.t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>AB.当A中含有少量B时,可以通过冷却热饱和溶液的方法提纯AC.t2℃时,A和C的饱和溶液中含有相同质量的溶质D.将t2℃时A、B、C的饱和溶液同时降温至t1℃后,所得溶液中溶质的质量分数由大到小的顺序是B>C>A【答案】C【解析】A、由溶解度曲线可知,在t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A,正确;B、A的溶解度随温度的升高而增大,当A中含有少量B时,可以通过冷却热饱和溶液的方法提纯A,正确;C、由于不知道A和C的饱和溶液的质量,所以无法确定其中含有溶质的质量是否相同,错误;D、由t2℃降温到t1℃,C的溶质质量分数不变,而A和B的溶解度减小,导致溶质质量分数减小,由图可知t1℃时B的溶解度大于t2℃时C的溶解度大于t1℃时A的溶解度,因此B>C>A,正确。
【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)
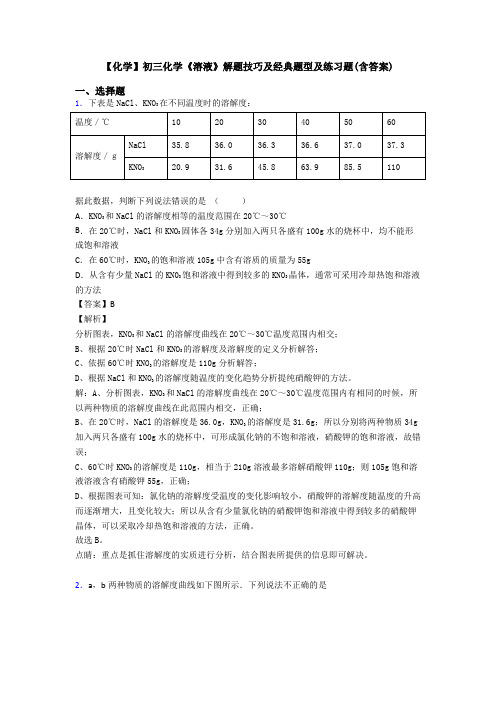
【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.下表是NaCl、KNO3在不同温度时的溶解度:据此数据,判断下列说法错误的是()A.KNO3和NaCl的溶解度相等的温度范围在20℃~30℃B.在20℃时,NaCl和KNO3固体各34g分别加入两只各盛有100g水的烧杯中,均不能形成饱和溶液C.在60℃时,KNO3的饱和溶液105g中含有溶质的质量为55gD.从含有少量NaCl的KN03饱和溶液中得到较多的KNO3晶体,通常可采用冷却热饱和溶液的方法【答案】B【解析】分析图表,KNO3和NaCl的溶解度曲线在20℃~30℃温度范围内相交;B、根据20℃时NaCl和KNO3的溶解度及溶解度的定义分析解答;C、依据60℃时KNO3的溶解度是110g分析解答;D、根据NaCl和KNO3的溶解度随温度的变化趋势分析提纯硝酸钾的方法。
解:A、分析图表,KNO3和NaCl的溶解度曲线在20℃~30℃温度范围内有相同的时候,所以两种物质的溶解度曲线在此范围内相交,正确;B、在20℃时,NaCl的溶解度是36.0g,KNO3的溶解度是31.6g;所以分别将两种物质34g 加入两只各盛有100g水的烧杯中,可形成氯化钠的不饱和溶液,硝酸钾的饱和溶液,故错误;C、60℃时KNO3的溶解度是110g,相当于210g溶液最多溶解硝酸钾110g;则105g饱和溶液溶液含有硝酸钾55g,正确;D、根据图表可知:氯化钠的溶解度受温度的变化影响较小,硝酸钾的溶解度随温度的升高而逐渐增大,且变化较大;所以从含有少量氯化钠的硝酸钾饱和溶液中得到较多的硝酸钾晶体,可以采取冷却热饱和溶液的方法,正确。
故选B。
点睛:重点是抓住溶解度的实质进行分析,结合图表所提供的信息即可解决。
2.a,b两种物质的溶解度曲线如下图所示.下列说法不正确的是A.将℃时b的饱和溶液加水可变为不饱和溶液B .将℃时a的饱和溶液降温至℃,溶液质量不变C.℃时,两种物质的饱和溶液中溶质质量分数a bD.将℃时a、b的饱和溶液分别降温至℃,两溶液的溶质质量分数相等【答案】B【解析】试题分析:A、任何物质的饱和溶液加水都可变为不饱和溶液,故将t1℃时b的饱和溶液加水可变为不饱和溶液,正确,B、根据溶解度曲线,物质a的溶解度随温度的升高而增大,故将t2℃时a的饱和溶液降温至t1℃,有晶体析出,故溶液质量变小,错误,C、根据溶解度曲线,t2℃时,物质a的溶解度比物质b的溶解度要更大,故两种物质的饱和溶液中溶质质量分数a>b,正确,D,根据溶解度曲线,t1℃时, a、b种物质的溶解度大小关系是:a=b,将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等,正确,故选B考点:溶解度曲线的意义3.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是( )①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数;③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.点:溶解度曲线上的每个点(即饱和点)表示的是某温度下某种物质的溶解度。
即曲线上的任意一点都对应有相应的温度和溶解度。
温度在横坐标上可以找到,溶解度在纵坐标上可以找到。
溶解度曲线上的点有三个方面的作用:(1)根据已知的温度可以查出有关物质的溶解度;(2)根据物质的溶解度也可以查出它所对应的温度;(3)可以判断或比较相同温度下,不同物质溶解度的大小(或饱和溶液中溶质的质量分数的大小)。
2.将100g 质量分数为20%的硝酸钾溶液稀释为5%的硝酸钾溶液,需要加水的质量为()A.100g B.200g C.300g D.400g【答案】C【解析】【分析】【详解】根据稀释前后溶质质量不变,可设需要加水的质量为x,100g×20%=(100g+x)×5%,解得x=300g,故选C.3.a、b、c三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是()A.t1℃时,a的饱和溶液65g中含有溶剂50gB.将t2℃时a、b、c三种物质的饱和溶液,降温至t1℃时,C溶液中溶质的质量分数保持不变C.要从b溶液中得到b,通常可采用蒸发溶剂使其结晶的方法D.在t2℃时,a、b两种溶液中溶质的质量分数相同【答案】D【解析】【分析】【详解】A. 在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。
溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。
t1℃时,a的溶解度为30g,故65g饱和溶液中含有溶剂50g,选项A正确;B. 将t2℃时a、b、c三种物质的饱和溶液,降温至t1℃时,C的溶解度变大,溶质质量不变,所以溶液中溶质的质量分数保持不变,选项B正确;C. b 的溶解度受温度影响较小,要从b溶液中得到b,通常可采用蒸发溶剂使其结晶的方法,选项C正确;D. 在t2℃时,a、b两种物质的溶解度相同,其饱和溶液中溶质的质量分数相同,但不饱和溶液中溶质的质量分数不一定相等,选项D错误。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.NaCl、KNO3两种固体物质的溶解度曲线如图所示。
下列说法正确的是:A.KNO3的溶解度大于NaCl的溶解度B.将两种物质的饱和溶液从50℃降至20℃,析出KNO3最多C.使NaCl从其饱和溶液中析出,最好采用蒸发溶剂的方法D.20℃时,30gNaCl加入到50g水中充分溶解,所得溶液中NaCl的质量分数为37.5%【答案】C【解析】A. 比较溶解度大小,一定指明温度,错误;B. 将等质量的两种物质的饱和溶液从50℃降至20℃,析出KNO3最多,错误;C. 提纯溶解度受温度影响不大的物质,采用蒸发溶剂的方法,正确;D. 20℃时,NaCl的溶解度是31.6g,故50g水最多能溶解15.8gNaCl,将30gNaCl加入到50g水中,不能全部溶解,所得溶液是饱和溶液,所得溶液中NaCl的质量分数为24.0%,错误。
故选C。
点睛:考查学生溶解度曲线的应用能力。
2.t℃测得某物质(不含结晶水)在不同质量的水中溶解达到饱和状态时所溶解该物质的质量,绘制成如图中斜线。
下列说法错误的是A.t℃时该物质的溶解度为40gB.N点表示溶液中溶质的质量分数为20%C.加溶质能使M点的溶液达到饱和状态D.图中4点表示的溶液中溶质质量分数的关系是:N<M<P=Q【答案】B【解析】A.由图示可知t℃时该物质的溶解度为40g,故A正确;B.N点表示100g水中溶解20g溶质,溶液中溶质的质量分数为20100%10020ggg⨯+≠20%,故B错误;C.M点为80g水中溶解了20克溶质,此时溶液为不饱和溶液,添加溶质能使M点的溶液达到饱和状态,故C正确;D.P、Q均是这一温度的饱和溶液故此溶液溶质质量分数相等,M与N溶质是相同的而溶剂不同,可判断出N<M,由于温度相同时不饱和溶液最浓,可知它们的关系是:N<M<P=Q,故D正确;答案为B。
点睛:准确理解图像并获取信息是解题关键,此图象是t℃时物质的溶解情况,不能验证不同温度下溶解度大小的关系,图中四点的含义分别是N点100g水中溶解20g溶质的不饱和溶液;M点80g水中溶解20g溶质的不饱和溶液;P点100g水中溶解40g溶质的饱和溶液;Q点这一温度下的饱和溶液,利用这些相关知识可解决此题。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)

【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.点:溶解度曲线上的每个点(即饱和点)表示的是某温度下某种物质的溶解度。
即曲线上的任意一点都对应有相应的温度和溶解度。
温度在横坐标上可以找到,溶解度在纵坐标上可以找到。
溶解度曲线上的点有三个方面的作用:(1)根据已知的温度可以查出有关物质的溶解度;(2)根据物质的溶解度也可以查出它所对应的温度;(3)可以判断或比较相同温度下,不同物质溶解度的大小(或饱和溶液中溶质的质量分数的大小)。
2.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是( )①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数;③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.①③ C.②④ D.③④【答案】A【解析】①称量的氯化钠固体中含有不溶性杂质,导致氯化钠质量偏小,从而导致配制的氯化钠溶液溶质质量分数偏小,正确;②用量筒量取水时仰视读数,导致读数偏小,而量筒中水的体积偏大,最终导致配制的氯化钠溶液溶质质量分数偏小,正确;③往烧杯中加水时有水溅出,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,错误;④溶液具有均一性,将配制好的溶液往试剂瓶中转移时有少量溅出,溶质质量分数不变,错误。
故选A。
3.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是A.t2℃时,甲、乙两种物质的溶解度相等B.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>丙>甲C.甲的溶解度随温度的升高而增大D.t1℃时,丙的饱和溶液中溶质的质量分数为28.6%【答案】B【解析】A、根据溶解度曲线的交点解答;B、据三种物质的溶解度随温度变化情况及饱和溶液中溶质质量分数的计算式分析解答;C、根据溶解度曲线解答;D、根据饱和溶液溶质质量分数解答。
解:A、根据题中溶解度曲线图可知t2℃时,甲乙两种物质的溶解度相等,故正确;B、根据曲线图,甲、乙的溶解度都随温度的升高而增大,故将t3℃时甲、乙的饱和溶液降温至t1℃,都有晶体析出,都成为t1℃时的饱和溶液,但由于在t1℃,乙的溶解度大于甲,故此时甲、乙的饱和溶液溶质的质量分数大小关系是乙>甲,而丙的溶解度都随温度的升高而减少,故将t3℃时丙的饱和溶液降温至t1℃,变为不饱和溶液,但溶液中的溶质、溶剂质量都不变,而通过观察,丙在t3℃时的溶解度要小于甲在t1℃时的溶解度,故丙的溶质的质量分数最小,故所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙,错误;C、根据题中溶解度曲线图可知, 甲的溶解度随温度的升高而增大,故正确;D、t1℃时,丙的饱和溶液中溶质的质量分数为4040100gg g⨯+100%=28.6%,故正确。
【化学】初三化学《溶液》解题技巧及练习题含解析

【化学】初三化学《溶液》解题技巧及练习题含解析一、选择题1.甲、乙两种物质的溶解度曲线如图所示。
下列说法正确的是()A.a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液B.甲和乙的溶解度相等C.a2℃时,在 100 g 水中加入 60 g 甲,形成 160 g 溶液D.a1℃时,甲和乙各 30 g 分别加入 100 g 水中,均形成饱和溶液【答案】D【解析】A、由图象可知,甲、乙的溶解度随着温度的升高而增大,因此a1℃时甲和乙的饱和溶液,升温到a2℃时变为不饱和溶液,错误;B、物质的溶解度与温度有关,a1℃时,甲和乙的溶解度相等,不是a1℃时,甲和乙的溶解度不等,错误;C、a2℃时,甲的溶解度为50g,在100g水中加入60g甲,形成饱和溶液,并有10g甲溶解不了,错误;D、a1℃时,甲和乙的溶解度均为30g,所以甲和乙各30g分别加入100g水中,均形成饱和溶液,正确。
故选D。
2.20℃时,往100g硝酸钾溶液中加入20g硝酸钾,充分搅拌,硝酸钾部分溶解。
下列说法正确的是A.硝酸钾的溶解度变大B.溶质的质量分数保持不变C.所得溶液是饱和溶液D.所的溶液的质量为120g【答案】C【解析】【分析】【详解】A、硝酸钾的溶解度只受温度一个外界因素的影响,温度不变,溶解度不变,故A不正确;B、硝酸钾部分溶解,溶质的质量分数变大,故B不正确;C、硝酸钾部分溶解,则溶液为饱和溶液,故C正确;D、20g的硝酸钾部分溶解,溶液的质量小于120g,故D不正确。
故选C。
3.一定温度下,向盛有100g蔗糖溶液的烧杯中再加入5克蔗糖,充分搅拌后一定不变的是A.溶质的质量B.溶液的质量C.溶质的质量分数D.蔗糖的溶解度【答案】D【解析】【分析】溶液由溶质和溶剂组成,溶液的质量等于溶质和溶剂的质量和,被溶解的物质叫溶质。
【详解】在一定温度下,向盛有100克蔗糖溶液的烧杯中再加入5克蔗糖,不确定蔗糖是否溶解,溶质、溶液、溶质的质量分数不能确定是否改变,影响固体物质溶解度的因素是温度,温度没有改变,溶解度一定不改变,故选D。
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)
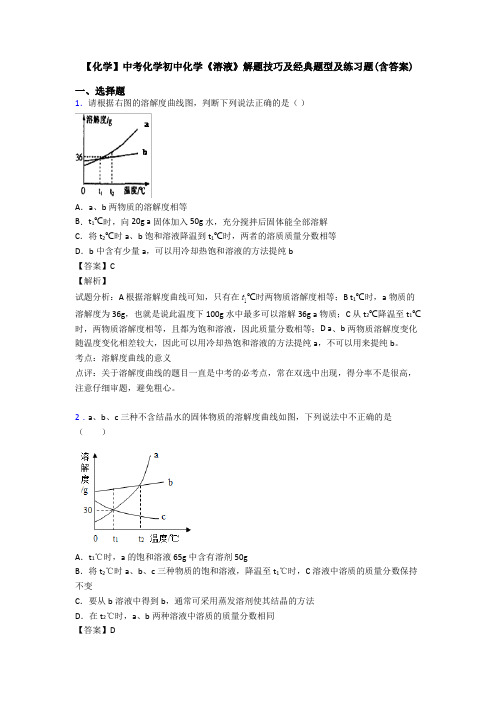
【化学】中考化学初中化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.请根据右图的溶解度曲线图,判断下列说法正确的是()A.a、b两物质的溶解度相等B.t1℃时,向20g a固体加入50g 水,充分搅拌后固体能全部溶解C.将t2℃时a、b饱和溶液降温到t1℃时,两者的溶质质量分数相等D.b中含有少量a,可以用冷却热饱和溶液的方法提纯b【答案】C【解析】试题分析:A 根据溶解度曲线可知,只有在℃时两物质溶解度相等;B t 1℃时,a物质的溶解度为36g,也就是说此温度下100g水中最多可以溶解36g a物质;C 从t2℃降温至t1℃时,两物质溶解度相等,且都为饱和溶液,因此质量分数相等;D a、b两物质溶解度变化随温度变化相差较大,因此可以用冷却热饱和溶液的方法提纯a,不可以用来提纯b。
考点:溶解度曲线的意义点评:关于溶解度曲线的题目一直是中考的必考点,常在双选中出现,得分率不是很高,注意仔细审题,避免粗心。
2.a、b、c三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是()A.t1℃时,a的饱和溶液65g中含有溶剂50gB.将t2℃时a、b、c三种物质的饱和溶液,降温至t1℃时,C溶液中溶质的质量分数保持不变C.要从b溶液中得到b,通常可采用蒸发溶剂使其结晶的方法D.在t2℃时,a、b两种溶液中溶质的质量分数相同【答案】D【解析】【分析】【详解】A. 在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。
溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。
t1℃时,a的溶解度为30g,故65g饱和溶液中含有溶剂50g,选项A正确;B. 将t2℃时a、b、c三种物质的饱和溶液,降温至t1℃时,C的溶解度变大,溶质质量不变,所以溶液中溶质的质量分数保持不变,选项B正确;C. b 的溶解度受温度影响较小,要从b溶液中得到b,通常可采用蒸发溶剂使其结晶的方法,选项C正确;D. 在t2℃时,a、b两种物质的溶解度相同,其饱和溶液中溶质的质量分数相同,但不饱和溶液中溶质的质量分数不一定相等,选项D错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【化学】初三化学《溶液》解题技巧及经典题型及练习题(含答案)一、选择题1.列表和作图是常用的数据处理方法.结合材料所绘图表判断下列说法正确的是( )A.表格与图象均能反映温度对固体物质溶解度的影响,表格比图像更直观体现变化规律B.由表格数据可知,物质的溶解度只受温度影响C.40℃时,将50g NaOH分别投入到100g水和酒精中都能得到饱和溶液D.40℃时,将CO2通入饱和的NaOH酒精溶液中有沉淀生成【答案】A【解析】A.通过分析溶解度表和溶解度曲线可知,图象与表格均能反映温度对固体物质溶解度的影响,其中图象的优点是变化规律更直观,故A错误;B.由表格数据可知,物质的溶解度受温度和溶剂影响,故B错误;C.40℃时,氢氧化钠在水中的溶解度是129g,氢氧化钠在酒精中的溶解度是40g,所以将50gNaOH分别投入到100g水和酒精中,在水中不能形成饱和溶液,故C错误;D.40℃时,碳酸钠在酒精中难溶,所以将CO2通入饱和的NaOH酒精溶液中有沉淀生成,故D正确;故选D。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
2.下图是不含结晶水的甲、乙两种固体物质的溶解度曲线,下列叙述正确的是A.t1℃时,100g甲的饱和溶液中含有50g甲B.t1℃时,配制甲乙两种物质的饱和溶液,需要相同体积的水C.t1℃时,将等质量的甲、乙的饱和溶液升温至t2℃,溶液质量仍然相等D.要从含少量乙的甲中提纯甲,通常可采用蒸发结晶的方法【答案】C【解析】A.由图知t1℃时,甲物质的溶解度是50g,即100g水中最多能溶解甲物质50g,故A错误;B. t1℃时,甲、乙两物质的溶解度都是50g,但是不知道所配甲乙两种物质的饱和溶液的质量是否相等,故需要的水的体积也不一定相等,故此选项错误;C. 因两物质的溶解度都是随温度的升高而增大,故当t1℃时,将等质量的甲、乙的饱和溶液升温至t2℃,两溶液都变为不饱和溶液,故溶液质量仍然相等,此选项正确。
D.因甲物质的溶解度受温度影响较大,所以应采用降温结晶的方法。
故错误。
答案为C。
3.如图是两种固体物质的溶解度曲线(不含结晶水,且在同一杯溶液中相互不干扰)。
对此,下列判断正确的是( )A.甲、乙在20℃时,溶液质量分数相等B.30℃时,同一杯甲乙二者饱和溶液,甲溶质质量不一定比乙多C.分别恒温蒸发30℃时两杯溶液,析出的甲比乙多D.30℃时,将60g甲的饱和溶液降温到20℃时,析出5g甲物质【答案】D【解析】A. 甲、乙在20℃时,饱和溶液的溶质质量分数相等,错误;B. 30℃时,同一杯甲乙二者饱和溶液,甲溶质质量一定比乙多,错误;C. 分别恒温蒸发30℃时两杯两种物质的饱和溶液,析出的甲比乙多,错误;D. 30℃时,将60g甲的饱和溶液降温到20℃时,析出5g甲物质,正确。
故选D。
4.下面是四个实验相关的图象其中对应表示正确的是()A.I是在一定温度下,向不饱和的ΚNO3溶液中加ΚNO3固体B.Ⅱ是向一定量的CuSO4溶液中滴加N a OH溶液C.Ⅲ是将一定量的稀H2SO4加水稀释D.Ⅳ是实验室加热一定量的ΚM n O4制取O2【答案】D【解析】本题主要考查饱和溶液和不饱和溶液;实验室制取氧气的反应原理;酸碱溶液的稀释;盐的化学性质。
A、原溶液的溶质质量分数不为0%,即图象的起点不能在0处;硝酸钾溶液达到饱和后,溶质的质量分数不变,故A错误;B、向一定量的CuSO4溶液中滴加NaOH溶液,随着氢氧化钠溶液的滴加混合物的总质量应不断的增加,故B错误;C、将一定量的稀H2SO4加水稀释,随着水的加入,溶液的pH应逐渐增大且无限的接近7,故C错误;D、加热一定量的高锰酸钾一段时间后开始生成氧气,当高锰酸钾完全分解后不再生成氧气,故D正确;故选D。
5.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.将100g10%的甲溶液稀释到4%需加入150g水B.t1℃时,将25g丙溶解到50g水中能得到饱和溶液C.t2℃时,甲、乙溶液中溶质的质量分数一定相等D.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得到的三种溶液中溶质的质量分数大小关系是乙>甲>丙【答案】C【解析】A.将100g10%的甲溶液稀释到4%需加入水的质量为:10010%4%g-100g=150g,故A正确;B.t1℃时,丙物质的溶解度是40g,所以将25g丙加入到50g水中充分溶解后能得到饱和溶液,故B正确;C.t2℃时,甲、乙物质的溶解度相等,所以饱和溶液中溶质的质量分数一定相等,故C错误;D.t1℃时,乙物质的溶解度最大,丙物质的溶解度次之,甲物质的溶解度最小,降低温度,甲、乙会析出晶体,丙物质不会析出晶体,应该按照t3℃时的溶解度进行计算,所以将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得到的三种溶液中溶质的质量分数大小关系是乙>甲>丙,故D正确;故选C。
6.KNO3和KCl在不同温度时的溶解度曲线如图所示,下列说法正确的是A .温度低于40℃时,KNO 3的溶解度一定小于KCl 的溶解度B .将等质量的KNO 3和KCl 的饱和溶液从60℃降温到20℃,析出晶体的质量KNO 3大于KClC .将10℃时KNO 3、KCl 的饱和溶液升温至60℃,KNO 3溶液中溶质的质量分数比KCl 大D .将20℃时100gKCl 的饱和溶液升温至60℃,需要再加入11.5gKCl 固体才能使溶液恰好饱和【答案】B【解析】A 、在30℃-40℃时,两条曲线有交点,此时KNO 3的溶解度和KCl 的溶解度相等,故错误;B 、将等质量的KNO 3和KCl 的饱和溶液从60℃降温到20℃,KNO 3的溶解度比KCl 的溶解度变化大,析出晶体的质量KNO 3大于KCl ,故正确;C 、将10℃时KNO 3的溶解度大于KCl 的溶解度,根据饱和溶液溶质的质量分数公式100%100g+ 溶解度溶解度可知,将10℃时KNO 3、KCl 的饱和溶液溶质质量分数KCl 大于KNO 3,升温至60℃,KNO 3、KCl 的溶解度都增大,但溶液的成分都没有变化,KNO 3溶液中溶质的质量分数比KCl 小,故错误;D 、20℃时,KCl 的溶解度为34.0g ,60℃时,KCl 的溶解度为45.5g ,如果水为100g 饱和溶液从20℃时升温至60℃,需要再加入11.5gKCl 固体才能使溶液恰好饱和,但是题干中为100g 溶液,故错误。
点睛:固体溶解度曲线的作用可从点、线、面和交点四方面来理解:7.如图是a 、b 、c 三种物质的溶解度曲线,下列分析正确的是A .P 点表示物质A 和C 的溶解度都为20gB .若a 中混有少量b ,可采用蒸发结晶法分离提纯aC .将t 2℃时a 、b 、c 三种物质的饱和溶液降温至t 1℃时,a 溶液中析出的晶体不一定最多D .将t 1℃时a 、b 、c 三种物质的饱和溶液升温至t 2℃时,所得溶液的溶质质量分数关系是a >b >c【答案】C【解析】A.根据溶解度曲线的交叉点表示的意义解答;B. 据a 、b 的溶解度受温度影响情况分析提纯物质的方法;C.根据饱和溶液的质量分析解答。
D. 据三种物质的溶解度随温度变化情况及饱和溶液中溶质质量分数的计算式分析解答。
解:A. P 点表示t 1℃时物质a 和c 的溶解度都为20g 。
故错误;B. 由于a 、b 物质的溶解度随温度的升高而增加且a 物质的溶解度受温度的影响变化较大,当a 物质中混有少量b 物质时,可采用降温结晶的方法得到较纯净的a 物质。
故错误;C. 将t 2℃时a 、b 、c 三种物质的饱和溶液降温至t 1℃时,由于a 、b 、c 三种溶液的质量不一定相等,故a 溶液中析出的晶体不一定最多。
正确;D. 据图可知:a 、b 的溶解度随温度的升高而增大,c 的溶解度随温度的升高而减小;所以将t 1℃时a 、b 、c 三种物质的饱和溶液均升温到t 2℃时,a 、b 溶质质量不变,溶剂质量不变,溶质质量分数不变,c 析出晶体,依然是饱和溶液,又t 1℃时a 、c 的溶解度相同,此时a 、c 的溶质质量分数相等,而a 升温后变为不饱和溶液,溶质的质量分数与升温前相等,据饱和时质量分数的计算式+100g溶解度溶解度×100%,可知溶解度越大质量分数也就越大,t 2℃时溶液中溶质质量分数最大的是b >a >c 。
故错误。
8.甲、乙、丙三种固体物质的溶解度曲线如图所示,下列叙述正确的是( )A .t 1℃时将等质量的乙、丙溶于水中,分别配成饱和溶液,所得溶液质量:乙=丙B .将t 1℃时甲、丙的饱和溶液升温到t 2℃,两种溶液中溶质的质量分数相等C .要将接近饱和的丙溶液变为饱和溶液,可以采用降温或蒸发的方法D .t 3℃时,将三种物质的饱和溶液恒温蒸发等量水后,析出溶质的质量顺序:甲>丙>乙【答案】A【解析】A 、t 1℃时,乙的溶解度等于甲,将等质量的甲、乙分别配成饱和溶液,所需要的水的质量相等,故所得溶液质量甲=乙,故正确;B 、将t 1℃时甲、丙的饱和溶液升温到t 2℃,甲的溶解度随温度的升高而增大,故溶液组成不变,而丙的溶解度随温度的升高而减小,会析出晶体,溶质质量分数会减小,但t 2℃是丙的溶解度大于t 1℃时甲的溶解度,故两种溶液中溶质的质量分数丙大于甲,故错误;C 、由溶解度曲线可知,丙的溶解度随着温度的降低而增大,因此要将接近饱和的丙溶液变为饱和溶液,可以采用升温或蒸发的方法,故正确;D 、t 3℃时三种物质的溶解度关系为甲>乙>丙,将t 3℃时三种物质的饱和溶液恒温蒸发等量水后,析出溶质的质量甲>乙>丙,故错误。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
9.a,b两种物质的溶解度曲线如下图所示.下列说法不正确的是A .将℃时b的饱和溶液加水可变为不饱和溶液B.将℃时a的饱和溶液降温至℃,溶液质量不变C.℃时,两种物质的饱和溶液中溶质质量分数a bD.将℃时a、b的饱和溶液分别降温至℃,两溶液的溶质质量分数相等【答案】B【解析】试题分析:A、任何物质的饱和溶液加水都可变为不饱和溶液,故将t1℃时b的饱和溶液加水可变为不饱和溶液,正确,B、根据溶解度曲线,物质a的溶解度随温度的升高而增大,故将t2℃时a的饱和溶液降温至t1℃,有晶体析出,故溶液质量变小,错误,C、根据溶解度曲线,t2℃时,物质a的溶解度比物质b的溶解度要更大,故两种物质的饱和溶液中溶质质量分数a>b,正确,D,根据溶解度曲线,t1℃时, a、b种物质的溶解度大小关系是:a=b,将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等,正确,故选B考点:溶解度曲线的意义10.根据如图所示的溶解度曲线,判断下列说法正确的是A.50℃时,分别将等质量的硝酸钾和氯化铵溶于适量的水恰好配成饱和溶液,所得溶液的质量前者比后者大B.60℃时,把40g硝酸钾和40g氯化钾分别加入到50g水中,充分搅拌,降温至10℃ ,氯化钾析出的晶体质量多C.70℃时,50g硝酸钠饱和溶液中所含溶剂质量:100g硝酸钾饱和溶液中所含溶剂质量=1:2D.80℃时,向与100g氯化钾饱和溶液相同质量的水中加入153g硝酸钠充分搅拌后,最终硝酸钠完全溶解【答案】C【解析】A. 50℃时,硝酸钾的溶解度大于氯化铵的溶解度,所以50℃时,分别将等质量的硝酸钾和氯化铵溶于适量的水恰好配成饱和溶液,所需水的质量是硝酸钾小于氯化铵,所得溶液的质量前者比后者小,错误;B.60℃时,硝酸钾的溶解度是110g,50g水中最多溶解55g,40g硝酸钾硝酸钾全部溶解,60℃时,氯化钾的溶解度大于40g,小于50g,所以50g水中溶解氯化钾的质量少于25g,即60℃时形成的是饱和溶液,降温到10℃,硝酸钾的溶解度小于氯化钾的溶解度,所以硝酸钾析出的晶体质量多,错误;C. 70℃时,硝酸钠的溶解度等于硝酸钾的溶解度,所以它们的饱和溶液中溶质质量分数相等,溶液具有均一性,所以70℃时,50g硝酸钠饱和溶液中所含溶剂质量:100g硝酸钾饱和溶液中所含溶剂质量=1:2,正确;D. 80℃时,氯化钾的溶解度是50g,100g氯化钾饱和溶液中所含水的质量是:100g×(1-50g50g100g)=23×100g,80℃时,硝酸钠的溶解度是150g,则23×100g水最多溶解的硝酸钠的质量为:23×150g=100g,所以加入153g硝酸钠充分搅拌后,最终硝酸钠不能完全溶解,错误。
