工程热力学第2讲-第1章基本概念
热工基础第二讲

T2 T1
Q2 Q1
p1V1 T1
p2V2 T2
26
温标
国际温标:各国公认并执行的唯一法定温标 国际温标通常具备以下条件:
① 尽可能接近热力学温标; ② 复现精度高,各国均能以很高的准确度复现 同样的温标,确保温度量值的统一; ③ 用于复现温标的标准温度计,使用方便,性 能稳定。
27
国际温标(ITS-90)
1-5 工质的状态变化过程(热力过程)
1)膨胀性 2)流动性 3)热容量 4)稳定性,安全性 5)对环境友善 6)价廉,易大量获取
3
物质三态中 气态最适宜。
名词定义
热源(高温热源) : 工质从中吸取热能的物系。可恒温可变温 例如:锅炉、燃烧室、汽缸、工艺余热等
冷源(低温热源) : 接受工质排出热能的物系。可恒温可变温 例如:环境、工艺余冷、土壤等
温度T(K) 933.473 1234.93 1337.33 1357.77
物质 Al Ag Au Cu
状态 凝固点 凝固点 凝固点 凝固点
ITS-90 定义的固定点总共17个,这些固定点的准 确度为mK级;低温下限延伸了,按3He蒸汽压方程, 下限定到0.65K。
31
2. 标准仪器 将ITS-90的整个温标分为4个温区,其相应标
( K、℃、℉)
℉在我国不常用,而在欧美比较常用。国家相关标准 中规定,符号t表示摄氏度(℃),符号T表示开尔文(K)。
C
=
5 9
(F
- 32)
F = 9 C + 32 5
33
温度单位
温度单位
1-3 工质的热力学状态及基本状态参数 2. 压力:
定义: 单位面积上所受的垂直作用力称为压力(即压强)
工程热力学课件第1章 基本概念

(a22 a23 / Tr a24 / Tr2 a25 / Tr3 a26 / Tr4 ) r6 (a27 / Tr a28 / T a29 / T a30 / T )
4 r 7 r
(a31 a32 / Tr a33 / Tr2 ) r8 (a34 a35 / Tr2 a36 / Tr3 ) r9
热力循环的评价指标
逆循环:消耗外部功,将低温热源的热量传给高温 热源→制冷循环 T0
目的:要Q2
评价指标:制冷系数
Q1
W
Q 收益 吸热 2 e = W 代价 耗功
Q2
T2
[例] 某空调名牌上参数:制冷量:3200W;输入电功率: 1200W,求:该空调机的制冷系数。
混合过程
p1 p1>p2
p2
• • • • • • • • • • • • • • • • •
★
★ ★
★ ★ ★ ★ ★
★ ★ ★
★ ★
★
引入可逆过程的意义
准静态过程是实际过程的理想化过程,但并非最优
过程,可逆过程是最优过程,为评价实际过程的完善程 度提供了一个比较基准。
可逆过程的功与热完全可用系统内工质的状态参数
2 2
强度参数与广延参数
强度参数:与物质的量无关的参数,如压力 p、温度T
广延参数:与物质的量有关的参数可加性 如 质量m、容积 V、内能 U、焓 H、熵S
V 比参数: v m 比容
单位:/kg
U u m 比内能
/kmol
H h m 比焓
S s m 比熵
具有强度量的性质
1.2.3 平衡状态
工程热力学

(2)由表B 的读数可知21p p p p p B b C +=+= ⇒ 21p p > 又 C 表为真空表⇒ 21p p p b >>又 )(21b A B B p P p p p p ++=+= 得 表A 的读数为真空度,A 表为真空表∴ 7324971=-=-=C b p p p (KPa )609736731-=--=--=b B A p p p p (KPa ) 即表A 的读数为真空度60KPa(注:表B 的环境压力为容器2的压力) 4、比体积及密度(1)比体积v :单位质量的物质所占有的体积,单位:Kg m /3表达式为:mVv =或 v m V ⋅= 其中:v ——比体积, V ——体积(3m ) m ——质量(Kg )(2)密度:单位体积物质的质量,单位:3/m Kg 表达式为:Vm =ρ v 和ρ互成倒数,因此不是相互独立的参数。
注:工程热力学中通常用v 作为独立参数。
§1-4 平衡状态、状态方程式、坐标图例1:A 、B 两物体的温度分别为A T 、B T ,且B A T T >,当相互接触后,经过一段时间,A 物体的温度逐渐降低,B 物体的温度逐渐升高,最后A 、B 两物体的温度趋于一致。
例2:有一封闭容器,有隔板将其分成A 、B 两部分,A 有气体,B 抽成真空。
当把隔板抽开后,由于A 、B 两边压力不等,A 的气体会向B 转移,过一段时间后,A 、B 两边气体的压力会趋于一致。
2、状态方程对于简单可压缩系统,在处于平衡状态时,两个独立的状态参数确定后,其它的状态参数可通过一定的热力学函数关系来确定,这样系统的平衡状态就完全确定了。
温度、压力和比体积这三个基本状态参数之间的函数关系是最基本的热力学函数关系,称为状态方程,可表示为: 0),,(=T v p f或写成显式形式为: ),(v T p p = ),(v p T T = ),(T p v v =这里只给出表达形式,针对具体情况,状态方程有具体的表述,我们将在以后的章节中进行介绍。
f工程热力学 第一章 基本概念_OK

51
热量
❖ 定义:热力系和外界之间仅仅由于温度不同而通 过边界传递的能量
❖ 热量是热力系与外界相互作用的另一种方式,在 温差的推动下,以微观无序运动方式传递的能量。
3
什么是工质?
❖定义:实现能量转化的媒介物质 ❖制冷工程中又称为制冷剂 ❖对工质的要求:
1)膨胀性 2)流动性 3)热容量 4)稳定性,安全性 5)对环境友善 6)价廉,易大量获取
❖物质三态中气态最适宜作为工质
2021/7/24
4
什么是热力系统?
❖被人为地分割出来,作为热力学研究对象 的有限物质系统
p1
2021/7/24
1)系统任何平衡态可 表示在坐标图上
2)过程线中任意一点
2
为平衡态
3)非平衡态无法在图
v
上用实线表示
35
第1章 基本概念
1-1 工质和热力系统 1-2 状态参数 1-3 平衡状态 1-4 热力过程 1-5 功和热量
1-6 热力循环
2021/7/24
36
如何描述非平衡过程
平衡状态
p pb pg p pb pv
pg
p
pv
pb
p
24
环境压力与大气压力
❖环境压力指压力表所处环境的压力 ❖大气压力指当地大气的压力
▪ 环境压力一般为大气压,但不绝对 ▪ 大气压随时间、地点变化
❖在计算时绝对压力时要看清楚环境压力是 否为大气压力
2021/7/24
25
温度和压力
❖都是强度量 ❖压力的变化速度快,以音速传播 ❖温度的变化慢,随着热量的传递而改变 ❖压力的改变具有即时性 ❖温度的改变具有滞后性
能量交换
状态变化
工程热力学 课件 第一章 基本概念

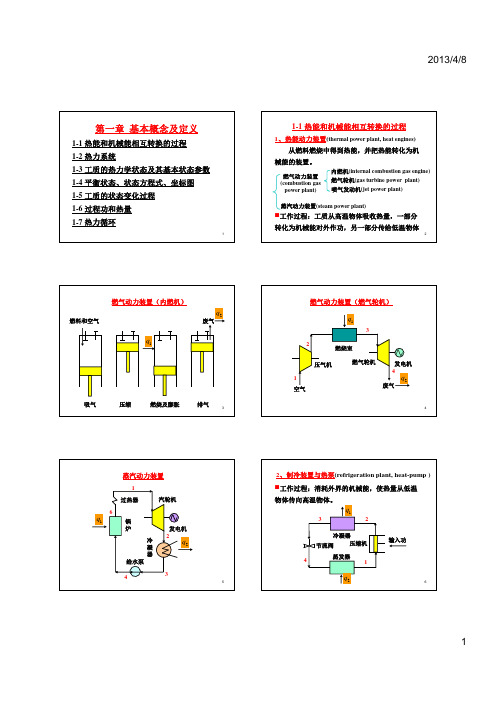
1-1 热能在热机中转变成机械能的过程
➢ 热能动力装置
▪ 从燃料燃烧中得到热能,以及利用热能得到动力的 整套设备(包括辅助设备)统称为热能动力装置
▪ 燃气动力装置—内燃机,由气缸和活塞组成 ▪ 蒸气动力装置,由锅炉、汽轮机、冷凝器、泵等组
成 ▪ 共性:用某种媒介物质(工质)从某个能源(高温
2.取全部气体为热力系,利用理想气体状态方程
m p1,minV1 p2 V1 VB
RgT1
RgT2
3.气球排斥大气作功,界面上反力为恒值,可用如下公式
计算
W p0V2 V1
➢ 过程热量
▪ 热力学中把热量定义为热力系和外界之间仅仅由 于温度不同而通过边界传递的能量
▪ 热量的单位是J(焦尔),工程上常用kJ(千焦)
➢ 可逆过程和不可逆过程
▪ 当完成了某一过程之后,如果有可能使工质沿相 同的路径逆行而回复到原来状态,并使相互作用 中所涉及到的外界亦回复到原来状态而不留下任 何改变,这一过程就叫做可逆过程
▪ 不满足上述条件的过程为不可逆过程
▪ 可逆过程的基本特征:是准平衡过程,满足热的 和力的平衡条件,同时过程中没有任何耗散效应
m
2
w12 1 pdv
▪ 工程热力学中约定:气体膨胀所作的功为正值, 外力压缩气体所消耗的功为负值
▪ 功不是状态参数而是过程量,功的数值不仅决定 于工质的初态和终态,还和过程的中间途径有关
▪ 闭口系工质在膨胀过程中所作的功一部分因摩擦 而耗散,一部分反抗大气压力作功,余下部分才 是可被利用的功
w=W/m 单位时间内完成的功称为功率,单位为W(瓦)
1W=1J/s
1kW=1kJ/s
➢ 可逆过程的功
《工程热力学》第一章 基本概念

热力系统: 被人为分割出来的作为热力学分析对象的有限
物质系统(工质或空间),简称系统、体系。 与系统发生物质、能量交换的物体称为外界
(或环境)。 系统与外界之间的分界面称为边界。
边界的性质: 可以是真实的,也可以假想; 可以是固定的,也可以移动。
(1)闭口系统:
与外界无物质交换、 仅有能量交换的系统。系 统的质量始终保持恒定, 也称为控制质量系统。
飞轮动能推动活塞压缩,消耗功,功的大小与飞 轮动能大小相同; 压缩工质消耗的能量与膨胀过程对外做的功相等; 工质向热源放出的热量与膨胀吸收的热量相等。 总体效果:热源、工质和机器均回到原来状态。
如果系统完成了某一过程之后,可以沿原路逆 行回复到原来的状态,并且不给外界留下任何变 化,这样的过程为可逆过程。
图过程线1-2。过程中所作的膨胀功为:
W Fext dx Fdx pAdx pdV
2
W12 1 pdV
膨胀功在p-v图上可
用过程线下方的面积来表
示,因此p-v图也叫示功
图
F
Fext
如果工质为1kg,所作的功为:
w 1 pdV pdv
m
2
w12 1 pdv
工程热力学约定: 膨胀:dv > 0 , w > 0
温熵图也称示热图
示热图与示功图一样,是对热力过程进行分析 的重要工具
ds q
T
根据熵的变化判断一个可逆过程中系统与外界 之间热量交换的方向:
ds 0 , q 0 , 系统吸热; ds 0 , q 0 , 系统放热。 ds 0 , q 0 , 系统绝热,定熵过程。
熵的说明
1、熵是状态参数
热量如何表达?
热量是否可以用类似于功的
工程热力学 第一章 基本概念

p0
p
1.
.
.
p,T
2 v
准静态过程的工程条件
破坏平衡所需时间 (外部作用时间)
>>
恢复平衡所需时间 (驰豫时间)
有足够时间恢复新平衡 准静态过程
p
示功图
1. W mkg工质:
.
W =pdV
V
2
W pdV
1
2
1kg工质: p外
p
1 2
w =pdv
w pdv
1
2
可逆过程的定义 Reversible process
热量是否可以用类似于功的式子 表示?
?
引入“熵”
热量与容积变化功
能量传递方式
性质
容积变化功
过程量
传热量
过程量
推动力
标志 公式
压力 p
d V , dv
温度 T
dS , ds
w pdv
q Tds w pdv q Tds
准静态或可逆 可逆
条件
熵( Entropy)的定义
熵的简单引入
压力p测量
一般是工质(working media)绝对压力 (absolute pressure)与环境压力(atmospheric pressure) 的相对值 ——相对压力 Relative pressure 注意:只有绝对压力 p 才是状态参数
绝对压力与相对压力 Absolute P & Relative P
系统经历某一过程后,如果能使系 统与外界同时恢复到初始状态,而不留 下任何痕迹,则此过程为可逆过程。
注意:可逆过程只是指可能性,并不 是指必须要回到初态的过程。
工程热力学基本概念1绝热刚性容器内的气体通过阀门向
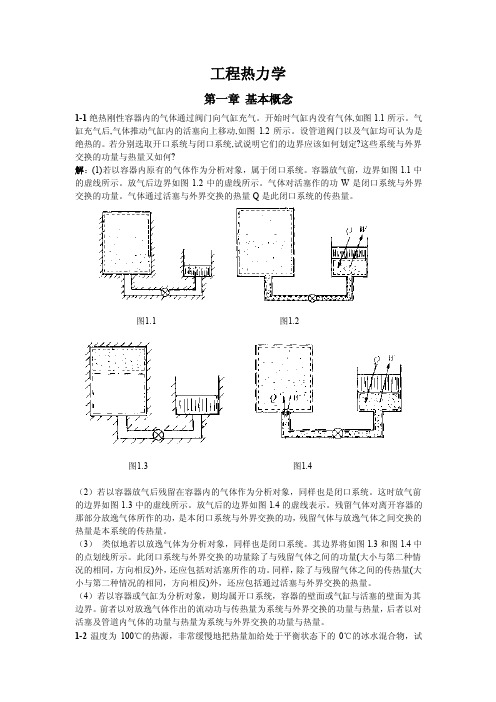
工程热力学第一章基本概念1-1绝热刚性容器内的气体通过阀门向气缸充气。
开始时气缸内没有气体,如图1.1所示。
气缸充气后,气体推动气缸内的活塞向上移动,如图1.2所示。
设管道阀门以及气缸均可认为是绝热的。
若分别选取开口系统与闭口系统,试说明它们的边界应该如何划定?这些系统与外界交换的功量与热量又如何?解:(1)若以容器内原有的气体作为分析对象,属于闭口系统。
容器放气前,边界如图1.1中的虚线所示。
放气后边界如图1.2中的虚线所示。
气体对活塞作的功W是闭口系统与外界交换的功量。
气体通过活塞与外界交换的热量Q是此闭口系统的传热量。
图1.1 图1.2图1.3 图1.4(2)若以容器放气后残留在容器内的气体作为分析对象,同样也是闭口系统。
这时放气前的边界如图1.3中的虚线所示。
放气后的边界如图1.4的虚线表示。
残留气体对离开容器的那部分放逸气体所作的功,是本闭口系统与外界交换的功,残留气体与放逸气体之间交换的热量是本系统的传热量。
(3)类似地若以放逸气体为分析对象,同样也是闭口系统。
其边界将如图1.3和图1.4中的点划线所示。
此闭口系统与外界交换的功量除了与残留气体之间的功量(大小与第二种情况的相同,方向相反)外,还应包括对活塞所作的功。
同样,除了与残留气体之间的传热量(大小与第二种情况的相同,方向相反)外,还应包括通过活塞与外界交换的热量。
(4)若以容器或气缸为分析对象,则均属开口系统,容器的壁面或气缸与活塞的壁面为其边界。
前者以对放逸气体作出的流动功与传热量为系统与外界交换的功量与热量,后者以对活塞及管道内气体的功量与热量为系统与外界交换的功量与热量。
1-2温度为100℃的热源,非常缓慢地把热量加给处于平衡状态下的0℃的冰水混合物,试问:1、冰水混合物经历的是准静态过程吗?2、加热过程是否可逆?解:此热力过程为准静态过程,因为此热力过程的弛豫时间很短,热源非常缓慢地把热量加给冰水混合物,则冰水混合物重建热力平衡的时间远远小于传热过程对冰水混合物平衡状态的破坏,所以可以近似地把此热力过程看作是准静态过程。
工程热力学 第一章 基本概念及定义
1-2 热力系统
1、基本概念
■热力系统(thermodynamic system)
被人为地从周围物体中分割出来,作为热力学
分析对象的有限物质系统。
■外界(surrounding)
与系统发生质能交换的物体。
■边界(boundary)
系统与外界的分界面。
8(a)汽轮机
(a)开口系统
●表压力
(gauge pressure)和真空度(vacuum)
e p v p 压力计处于环境压力下测得的工质压力。
●各压力之间的关系
24
b e
p
p p =+b v
p p p =-当绝对压力高于大气压力时:当绝对压力低于大气压力时:
均匀>平衡>稳定。
pdV
图上,可以用过程
体积变化功的正负与体积的变化相同,
工质膨胀时对外界作功,工质压缩时外界对工质V。
试分别求两过程的
1
初、终状态相同,但中间途径不同,因此膨胀功不同。
41。
工程热力学课件-基本概念

大氣壓(at),毫米汞柱(mmHg),毫米水柱(mmH2O)
1 kPa = 103 Pa
1bar = 105 Pa
換 1 MPa = 106 Pa
算 關
1 atm = 760 mmHg = 1.013105 Pa
係 1 mmHg = 133.3 Pa
1 at = 1 kgf/cm2 = 9.80665104 Pa
溫度的一般解釋:冷熱程度的度量。 溫度的微觀概念:大量分子熱運動的強烈程度。
m 2
平均平動動能
BT
溫度
2
溫度的熱力學定義:
比例常數
處於同一熱平衡狀態的各個熱力系,必定有某一宏觀特 徵彼此相同,用於描述此宏觀特徵的物理量即為溫度。
是確定一個系統是否與其它系統處於熱平衡的物理量。
熱力學第零定律
熱平衡(Thermal equilibrium) 在沒有外來影響的情況下, 兩物體相互作用最終達到相 同的冷熱狀況。
開口系統(Open system):有物質流穿過 邊界的系統,又稱為控制體積或控制體 (Control volume)。 開口系統的介面稱為控制介面。 開口系統和閉口系統都可能與外界發生能量 (功和熱)傳遞。
絕熱系統與孤立系統
絕熱系統(Adiabatic system):系統 與外界之間沒有熱量傳遞的系統。
平衡的本質
溫差 — 熱不平衡勢 壓差 — 力不平衡勢 相變 — 相不平衡勢 化學反應 — 化學不平衡勢
平衡的本質:不存在不平衡勢 In an equilibrium state there are no unbalanced potentials
平衡與穩定
穩定(steady):參數不隨時間變化
銅棒各點溫度不再隨時間 變化,達到穩定,但不是 平衡狀態。 原因在於系統受外界影響。 若以(銅棒+熱源+冷源) 為系統,則系統平衡嗎?
第一章 基本概念——【工程热力学】

本章基本要求
➢了解几种典型热力系统的工作原理
➢掌握工程热力学中一些基本术语和概念:热力 系统、平衡态、准平衡过程、可逆过程等。
➢掌握状态参数的特征,基本状态参数p、v、T
的定义和单位等。掌握热量和功量这些过程量的 特征,并会用系统的状态参数对可逆过程的热量、 功量进行计算。
➢了解工程热力学分析问题的特点、方法和步骤。
工程单位:
标准大气压(atm , 也称物理大气压) 巴(bar) 工程大气压(at) 毫米汞柱(mmHg) 毫米水柱(mmH2O)
各压力单位之间的换算关系
Pa
Pa
1
bar
1×105
atm 101325
at
98066.5
mmHg 133.322
mmH2O 9.80665
bar
1×10-5 1
atm
at
状态和状态参数 状态参数的特征:
1、单值性:状态确定,则状态参数也确定,反之亦然 2、状态参数的变化量与路径无关,只与初终态有关
状态参数的微分特征
设 z =z (x , y)
dz
z x
y
dx
z y
x
dy
状态参数是点函数, 其微分是全微分
充要条件:
2z xy
2z
yx
可判断是否 是状态参数
定义:
一个热力系统,如果在不受外界影响 的条件下(重力除外),系统的状态能够 始终保持不变,则系统的这种状态称为平 衡状态。
问题
以铜棒为系统。经过足够长时间后, 是否可以称为处于平衡状态?
各种平衡
1、热平衡Thermal equilibrium : 温差 Temperature differential 热不平衡势Unbalanced potentials
工程热力学第一章基本概念PPT课件

详细描述
等压过程在各种工业生产过程中发挥着重要作用,如蒸汽机、汽轮机、燃气轮机等热力机械中的工作过程。此外, 在制冷技术、气体压缩、气体分离等领域也广泛应用等压过程。在生活中,等压过程也随处可见,如气瓶的压力 保持、气瓶压力的调节等。
感谢您的观看
THANKS
06
热力学第三定律
绝对零度不能达到原理
绝对零度是热力学的最低温度,理论 上不可能通过任何有限过程达到。
这一定律对于理解热力学的基本概念 和原理非常重要,因为它揭示了热力 学过程不可逆性。
这是由于热力学第三定律指出,熵在 绝对零度时为零,而熵是系统无序度 的量度,因此系统必须经历无限的过 程才能达到绝对零度。
04
热力学第一定律
能量守恒
1 2
能量守恒定律
能量不能凭空产生,也不能消失,只能从一种形 式转化为另一种形式。
热力学能
系统内部能量的总和,包括分子动能、分子位能 和内部势能等。
3
热力学第一定律表达式
ΔU = Q + W,其中ΔU表示系统能量的变化,Q 表示系统吸收的热量,W表示系统对外做的功。
热量与功的转换
是与系统相互作用的其它物质或 能量的总和。
状态与状态参数
状态
描述系统在某一时刻的物理状态,包括宏观和微观状态。
状态参数
描述系统状态的物理量,如压力、温度、体积、内能等。
热力学平衡
热力学平衡
系统内部各部分之间以及系统与外界 之间达到相对静止的一种状态。
热力学平衡的条件
系统内部不存在宏观的净力、净热和 净功。
热力学的应用领域
能源转换
热能转换为机械能: 如内燃机、蒸汽机和 燃气轮机等。
工程热力学第一章基本概念

受重力影响,大部分热力系统内部存在压力变化,但该变化相对很小,通常忽略不计。 The variation of pressure as a result of gravity in most thermodynamic system is relatively small and usually disregarded
热力学温标(Kelvin scale):纯水三相点温度为273.16K,每1K为水三相点温度的1/273.16。
朗肯温标(Rankine scale):以绝对零度为起点的华氏温标
温标之间的换算
基本状态参数——压力(Pressure)
微观概念:大量分子碰撞器壁的结果。
单位面积上的压力
分子浓度
平均平动动能
在没有外来影响的情况下,两物体相互作用最终达到相同的冷热状况。
热力学第零定律 1931年 T
热力学第一定律 18401850年 E
热力学第二定律 18541855年 S
热力学第三定律 1906年 S基准
闭口系统的质量保持恒定
开口系统(Open system):有物质流穿过边界的系统,又称为控制体积或控制体(Control volume)。
开口系统的界面称为控制界面。
开口系统和闭口系统都可能与外界发生能量(功和热)传递。
闭口系统与开口系统
绝热系统(Adiabatic system):系统与外界之间没有热量传递的系统。
化学平衡( Chemical equilibrium ) 系统中化学成分不随时间变化 if its chemical position does not change with time. That is, no chemical reactions occur. 化学反应——化学不平衡势
工程热力学 基本知识点

第一章基本概念1.基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。
边界:分隔系统与外界的分界面,称为边界。
外界:边界以外与系统相互作用的物体,称为外界或环境。
闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。
开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。
绝热系统:系统与外界之间没有热量传递,称为绝热系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
单元系:由一种化学成分组成的系统称为单元系。
多元系:由两种以上不同化学成分组成的系统称为多元系。
均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
相对压力:相对于大气环境所测得的压力。
(完整版)工程热力学知识总结

第一章基本概念1.基本概念热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。
边界:分隔系统与外界的分界面,称为边界。
外界:边界以外与系统相互作用的物体,称为外界或环境。
闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。
开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。
绝热系统:系统与外界之间没有热量传递,称为绝热系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
单元系:由一种化学成分组成的系统称为单元系。
多元系:由两种以上不同化学成分组成的系统称为多元系。
均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。
热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。
热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。
压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。
相对压力:相对于大气环境所测得的压力。
工程热力学课件_第一章 基本概念

过程每一步的不平衡势差都很小。
系统内部随时接近于平衡态——准平衡。
p
1
.
.
.
2
v
空天工程系
30
工程热力学 Engineering Thermodynamics
准静态过程有实际意义:
解决了平衡和变化的矛盾;
既可实现热功转换,又可以用状态参数的变化来描述。
准静态过程的条件:
破坏平衡所需时间
7.热力系统、外界、边界定义?(董天力回答)
8.闭口系统、开口系统、绝热系统、孤立系统?
(李致远回答前两个,陈若雨回答后两个)
9.简单可压缩系统
10.热力状态、状态参数定义?(张希回答)
11.基本状态参数、导得状态参数定义、举例?(任羿霏回答)
空天工程系
19
工程热力学 Engineering Thermodynamics
换算关系: t
= T − 273.15
摄氏温标的每1℃和开尔文温标的每1K是相等的。
空天工程系
14
工程热力学 Engineering Thermodynamics
压力
宏观上:工质垂直作用于器壁单位面积上的力——压力。
微观上:大量分子撞击固体壁面的平均效果。
常用单位:
1 bar = 105 Pa
1 MPa = 106 Pa
闭口系统
闭口系统
开口系统
孤立系统
空天工程系
9
工程热力学 Engineering Thermodynamics
三、其它分类方式
相态
单相系—工质是单一相态(如气相或液相)的物质,水蒸气
多相系—工质是多种相态(如气-液两相或气-液
-固三相等)物质的混合物
工程热力学1 基本概念

标准大气压(atm):1atm=0.101325MPa
.
12
3.基本状态参数
(3)绝对压力P 、表压力Pg、真空度Pv
相对压力 表压力Pg 真空度Pv
系统相对与大气压力的 数值(不是状态参数)
绝对压力
系统真实压力(是状态参数)
Pg=P–Pb Pv= Pb – P
当Pg>>Pb时,取Pb =0.1MPa
可逆循环 不可逆循环
P
1 2
4
正循环(动力循环)1-2-3-4-1
逆循环1-4-3-2-1
制冷循环 热泵.循环
3
v
20
循环的经济性指标用工作系数来表示
工作系数
效果(收益) 代价
Q1为与高温热源交换的热量, Q2为与低温热源交换 的热量
动力循环的经济性用循环的热效率来衡量
t
W Q1
制冷循环的经济性用循环的制冷系数来衡量
.
10
2.状态参数分类
强度量 尺度量
压力、温度 体积、热力学能、焓、熵
基本参数 导出参数
压力、温度、体积 热力学能、焓、熵
.
11
3.基本状态参数
a.压力:系统表面单位面积上的垂直作用力。
(1)压力的单位:1N/m2 = 1Pa(帕)
(2) (2)1大05气Pa压力:Pb
1MPa = 106Pa ; 1bar =
Q 系统的边界
W
系统的边界 图1 膨胀中的燃气
.
图2 流动中的工质
2
二、系统的类型
1.按系统与外界交换的形式分类
系统与外界有三种相互作用形式:质、功、热
1)开口系统:系统与外界有物质交换
工质流入
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 1 1 1 1 1
mmHg kPa bar MPa atm at
= = = = = =
133.3 Pa 103 Pa 105 Pa 106 Pa 760 mmHg = 1.013105 Pa ≈ 1 bar 1 kgf/cm2 = 9.80665104 Pa
工业或一般科研测量:压力传感器、压力表
V v m
1
v
m V
1.2 热力状态
强度参数与广延参数:( 是否与物质的量有关 )
强度参数:与物质的量无关的参数。如压力 p、温度T、速度c、高度z
广延参数:与物质的量有关的参数可加性。如质量m、摩尔数n、容
积 V、熵S、内能 U、焓 H、动能Ek、位能Ep
比参数:
单位:/kg /kmol
具体工程问题具体分析。注意“突然”“缓慢”!
1.3 热力过程
可逆过程:
定义:系统经历某一过程后,如果能使系统与外界同时恢复到初始状
态,而不留下任何痕迹,则此过程为可逆过程。
注意:可逆过程只是指可能性,并不是指必须要回到初态的过程。 可逆过程的功与热完全可用系统内工质的状态参数表达,可不考虑系
1
a
b 2
1
1, a
1,b
dz 0
2 z 2 z xy yx
z z dz dx dy x y y x
1.2 热力状态
基本状态参数_压力p:
就是物理中的压强。
基本单位: Pa (Pascal), N/m2
不平衡势差
状态变化
能量传递
1.2 热力状态
状态方程:
定义:将任一因变量表示为自变量的函数关系式。 单组分单相系统:f (p, v, T ) = 0 理想气体状态方程: pV mRT 实际气体状态方程:?
pv RT
p-v图(示功图):
对简单可压缩系统 N = 2,可用两个独立状态参数在平面坐标图上表 示系统所处的状态。 说明: 1)系统任何平衡态可表示在坐标图上; 2)过程线中任意一点为平衡态; 3)不平衡态无法在图上用实线表示。
性在于它说明了温度的定义和温度的测量方法。
1.2 热力状态
基本状态参数_温度T: 四种常用温标之间的关系:
绝对K 373.15 摄氏℃ 100 水沸点 华氏°F 212 发烧 100 32 0 朗肯° R 671.67 559.67 491.67 459.67
T [ K ] t[ O C ] 273.15
系统与外界是否传热、功、质:非孤立系 均匀系 单元系 单相系
最重要的热力系统_简单可压缩系统:
只交换热量和一种准静态的容积变化功(压缩功或膨胀功)!
1.1 热力系统
热力系统的分类图解:
m
非孤立系+相关外界=孤立系
1
2
1 开口系 1+2 闭口系
Q W
1+2+3 绝热闭口系 1+2+3+4 孤立系
平衡态自由度 独立参数数目N 系统内的组分数 – 系统相数 + 2 不平衡势差的数目(不平衡势差彼此独立) 能量转换方式的数目 各种功的方式 + 热量 n + 1 n 容积变化功、电功、拉伸功、表面张力功等 简单可压缩系统只交换热量和一种准静态的容积变化功,简单可压缩 系统的独立变量数:N = n + 1 = 2 = = = = =
pv pb p
1.2 热力状态
基本状态参数_温度T: 温度的定义:
传统:冷热程度的度量。 感觉 微观:衡量分子平均动能的量度。 T ∝0.5mw 2 热力学定义:温度是确定一个系统是否与其它系统处于热平衡的宏观 物理量。
温度的常用单位: K ,℃ 温度的测量:
理论基础——热力学第零定律。 测量工具——温度计。工业或一般科研测量:水银温度计,酒精温度
p0
p
1.
.
.
p,T
2
v
1.3 热力过程
准静态(准平衡)过程:
既是平衡,又是变化。 准静态过程既可用状态参数描述,又可进行热功转换。 只有准静态过程才能在坐标图中用连续实线表示,才可以用热力学方 法分析。
疑问:理论上准静态应无限缓慢,工程上怎样处理?
一般的工程过程都可认为是准静态过程! 例:活塞式内燃机 2000转/分,曲柄 2冲程/转,0.15米/冲程 。 活塞运动速度=20002 0.15/60=10 m/s 压力波恢复平衡速度(声速)350 m/s
过程装备与控制工程专业
工程热力学
第二讲
山东大学机械工程学院 过程装备与控制工程研究所
本讲内容
CH0 基本概念 1.1热力系统
• 系统 边界 平衡状态 外界 状态方程
1.2 热力状态
• 状态参数
1.3 热力过程
• 准静态(准平衡)过程 • 可逆过程 • 热力循环
学习要求
CH1 基本概念
1 理解并掌握热力系统、状态、过程的基本概念:
具有强度参数的性质
V v m
比容积
U u m
比内能
H h m
比焓
S s m
比熵
1.2 热力状态
平衡状态:
定义:在不受外界影响的条件下(重力场除外),如果系统的状态参 数不随时间变化,则该系统处于平衡状态。 平衡的本质:不存在不平衡势 平衡的条件: 1、热平衡 温差 — 热不平衡势 2、力平衡 压差 — 力不平衡势 3、相平衡 相变 — 相不平衡势 4、化学平衡 化学反应 — 化学不平衡势
不可逆过程:
不可逆根源:不平衡势差、耗散效应—功变热的效应(摩阻、电阻、 非弹性变性、磁阻等)。 实际过程都是不是可逆过程,但为了研究方便,先按理想情况(可逆 过程)处理,用系统参数加以分析,然后考虑不可逆因素加以修正。
常见的不可逆过程:
T1 T1>T2 Q •• • • •• • • • 真空 • • •
系统、边界、外界、封闭系统、敞开系统、简单热力系统、绝 热系统、孤立系统; 状态、状态参数、基本状态参数、导出状态参数、强度参数、 广度参数、平衡状态、自由度、状态方程; 过程、准静态过程、可逆过程、循环、正循环、逆循环、可逆 循环、不可逆循环; 压力、绝压、表压、真空度、温度、温标、比容; 过程量、状态量, p – V 图、T – S 图; 等等。
自由膨胀
p1
p1>p2
p2
• • •• ★★★ ★ • • ★★ • ★ • • •★ ★ • •• ★ ★ •• • • ★★ ★
T2
不等温传热
(阀门)节流过程
混合过程
1.3 热力过程
热力循环:
定义:热力系统经过一系列变化回到初态,这一系列变化过程称为热 力循环。 意义:要实现连续热功转换,必须构成循环。 分类: <循环方向> 正循环,逆循环 <是否包含不可逆过程> 不可逆循环,可逆循环
平衡状态
非平衡状态
状态不变化
状态变化
能量不能转换
无法简单描述
热力学引入 准静态过程
准静态(准平衡)过程:
有足够时间恢复新平衡 准静态过程 工程条件:
破坏平衡所需时间 (外部作用时间)
>>
恢复平衡所需时间 (驰豫时间)
1.3 热力过程
一般过程:
p1 = p0+重物重量/A T1 = T0
p
1
2
p-v图
v
1.2 热力状态
平衡与稳定:
稳定:参数不随时间变化。 稳定但可以存在不平衡势差,去掉外界影响, 则状态变化。 稳定不一定平衡,但平衡一定稳定。
平衡与均匀:
平衡不一定均匀,单相平衡态则一定是均匀的。 平衡:时间上 均匀:空间上
1.3 热力过程
准静态(准平衡)过程的引入:
1.1 热力系统
热力系统选取的人为性:
热力系的选取取决于研究目的和方法,具有随意性,但选取不当将 不便于分析。
举例:
锅 炉
过热器
汽轮机 发电机
凝 汽 器 给水泵
1.1 热力系统
热力系统的分类:
系统与外界是否传质: 系统与外界是否传热: 系统与外界是否传功: 系统物理化学性质是否均匀: 系统工质种类是否单一: 系统工质相态是否单一: 开口系 非绝热系 非绝功系 / / / / / / / 闭口系 绝热系 绝功系 孤立系 非均匀系 多元系 多相系
计,热电偶,热电阻,辐射温度计,铂电阻温度计。
温度计组成:物质特性、基准点、刻度。 温标:温度的数值表示法。四种常用温标
1.2 热力状态
热力学第零定律(R.W. Fowler in 1931):
如果两个系统分别与第三个系统处于热平衡,
则两个系统彼此必然处于热平衡。
具体表述如下: 1.可以通过使两个体系相接触,并观察这两个体 系的性质是否发生变化而判断这两个体系是否已经达到平衡。 2.当外界条件不发生变化时,已经达成热平衡状态的体系,其内部的 温度是均匀分布的,并具有确定不变的温度值。 3.一切互为平衡的体系具有相同的温度,所以,一个体系的温度可以 通过另一个与之平衡的体系的温度来表达;或者也可以通过第三个 体系的温度来表达。 意义:热力学第零定律用来作为进行体系测量的基本依据,其重要
2 掌握热力学第零定律
1.1 热力系统
基本概念:
热力系统(热力系、系统): 作为研究对象的人为指定范围内的物质。 边界(控制面):系统和外界之间的分界面。 外界:系统之外的物质。
边界:
