职业院校技能大赛--工业分析检验(高职组)竞赛试题
全国高职院校职业技能大赛赛题

全国高职院校职业技能大赛赛题
1.电气自动化类:设计一个自动控制系统,实现工业生产自动化。
2. 机械制造类:制作一款精密机械零部件,达到高精度加工要求。
3. 电子信息类:设计一套智能家居系统,包含家庭安防、智能家居控制等功能。
4. 计算机应用类:开发一款高效实用的办公自动化软件,实现办公自动化流程。
5. 医疗卫生类:设计一套智能化的医疗影像诊断系统,实现医疗影像数据的自动诊断和分析。
6. 环境监测类:设计一套全方位的环境监测系统,实现对空气、水质、噪音等指标的实时监测。
7. 物流管理类:设计一套电子商务物流管理系统,实现快递、物流、货运等业务的自动化处理。
8. 公共安全类:设计一套智能化的城市交通管理系统,实现道路交通监测、交通流量管理等功能。
- 1 -。
2012年全国职业技能竞赛工业分析与检验竞赛试题库

职业技能竞赛辅导资料2012年全国职业技能竞赛工业分析与检验竞赛试题库(高职类)林壮森编化学工程系2013.03.29目录1 单选题B 1 各行各业的职业道德规范()。
A 完全相同B 有各自的特点C 适用于所有的行业D 适用于服务性行业B 2 化学检验工的职业守则最重要的内涵是()。
A 爱岗敬业,工作热情主动B认真负责,实事求是,坚持原则,一丝不苟地依据标准进行检验和判定 C 遵守劳动纪律D 遵守操作规程,注意安全D 3 下面有关爱岗敬业的论述中错误的是()。
A 爱岗敬业是中华民族的传统美德B 爱岗敬业是现代企业精神C爱岗敬业是社会主义职业道德的一条重要规范。
D 爱岗敬业与企业精神无关B 4 下面有关爱岗敬业与职业选择的关系中正确的是()。
A 当前严峻的就业形式要求人们爱岗敬业B 是否具有爱岗敬业的职业道德与职业选择无关C是否具有爱岗敬业的职业道德只与服务行业有关 D 市场经济条件下不要求爱岗敬业A 5 人力资源的特点包括()。
A 能动性、再生性和相对性B 物质性、有用性和有限性C可用性、相对性和有限性D 可用性、再生性和相对性B 6 高级分析工是属国家职业资格等级()。
A 四级B 三级C 二级D 一级C 7 化学检验工必备的专业素质是()。
A 语言表达能力B 社交能力C 较强的颜色分辨能力D 良好的嗅觉辨味能力A 8 为了保证检验人员的技术素质,可从()。
A 学历、技术职务或技能等级、实施检验人员培训等方面进行控制B具有良好的职业道德和行为规范方面进行控制 C 学历或技术职务或技能等级两方面进行控制D 实施有计划和针对性地培训来进行控制1.1 计量和标准化基础知识C 10 《中华人民共和国计量法实施细则》实施的时间是()。
A 1987年1月19日B 1986年7月1日C 1987年2月1日D 1985年9月6日A 进口的计量器具,必须经县级以上人民政府计量行政部门检定合格后,方可销售;B个体工商户可以制造、修理简易的计量器具;C使用计量器具不得破坏其准确度,损害国家和消费者的利益;D制造、销售未经考核合格的计量器具新产品的,责令停止制造、销售该种新产品,没收违法所得,可以并处罚款。
工业分析技能大赛题库--多选题

序号题目选项A 选项B 选项C 选项D 答案1 属于化学检验工的职业守则内容的是()。
爱岗敬业,工作热情主动实事求是,坚持原则,依据标准进行检验和判定遵守操作规程,注意安全熟练的职业技能ABC2 职业守则包括()。
遵守操作规程,注意安全认真负责,实事求是,坚持原则,一丝不苟地依据标准进行检验和判定努力学习,不断提高基础理论水平和操作技能实验室的纪律ABC3 化学检验工应遵守的规则有()。
遵守操作规程,注意安全努力学习,不断提高基础理论水平和操作技能认真负责,实事求是,坚持原则,一丝不苟地依据标准进行检验和判定遵纪守法,不谋私利,不徇私情ABCD4 下列哪些属于化学检验工职业守则的内容()。
爱岗敬业,工作热情主动认真负责,实事求是,坚持原则,一丝不苟地依据标准进行检验和判定努力学习,不断提高基础理论水平和操作技能遵纪守法,热爱学习ABC5 化学检验工的职业守则()。
爱岗敬业,工作热情主动努力学习,不断提高基础理论水平和操作技能遵纪守法,不谋私利,不徇私情遵守操作规程,注意安全ABCD6 "化学检验工职业守则内容为()。
" 爱岗敬业,工作热情主动认真负责,实事求是,坚持原则,一丝不苟地依据标准进行检验和判定努力学习,不断提高基础理论水平和操作技能遵纪守法,不谋私利,不徇私情遵守劳动纪律,遵守操作规程,注意安全。
ABCDE7 化学检验工的职业守则包括()。
认真负责,实事求是,坚持原则,一丝不苟地依据标准进行检验和判定努力学习,不断提高基础理论水平和操作技能遵纪守法,不谋私利,不徇私情爱岗敬业,工作热情主动ABCD8 下面所述内容属于化学检验工职业道德的社会作用的()。
调节职业交往中从业人员内部以及从业人员与服务对象之间的关系有助于维护和提高本行业的信誉促进本行业的发展有助于提高全社会道德水平ABCD9 化学检验工专业素质的内容有()。
努力学习,不断提高基础理论水平和操作技能掌握化学基础知识和分析化学知识标准化计量及质量基础知识电工基础知识和计算机操作知识 B C D10 化学检验人员应具备()。
职业院校技能大赛--工业分析检验(高职组)竞赛试题

“工业分析检验”赛项(高职组)竞赛试题一、化学分析考核方案(公开试题)(一)EDTA(0.05mol/L)标准滴定溶液的标定1.操作步骤称取1.5g 于850±50℃高温炉中灼烧至恒重的工作基准试剂ZnO (不得用去皮的方法,否则称量为零分)于100mL 小烧杯中,用少量水润湿,加入20mLHCl (20%)溶解后,定量转移至250mL 容量瓶中,用水稀释至刻度,摇匀。
移取25.00mL 上述溶液于250mL 的锥形瓶中(不得从容量瓶中直接移取溶液),加75mL 水,用氨水溶液(10%)调至溶液pH 至7~8,加10mL NH 3-NH 4Cl 缓冲溶液(pH≈10)及5滴铬黑T (5g/L ),用待标定的EDTA 溶液滴定至溶液由紫色变为纯蓝色。
平行测定4次,同时做空白。
2.计算EDTA 标准滴定溶液的浓度c (EDTA),单位mol/L 。
注: [M (ZnO)=81.39 g/mo1]。
计算公式 39.81)(10000.25000.25)(0⨯-⨯⨯=V V m EDTA c (二)硫酸镍试样中镍含量的测定1.操作步骤称取硫酸镍液体样品xg ,精确至0.0001g ,加水70mL ,加入10mLNH 3-NH 4Cl 缓冲溶液(pH ≈10)及0.2g 紫脲酸铵指示剂,摇匀,用EDTA 标准滴定溶液[c (EDTA)=0.05mol/L]滴定至溶液呈蓝紫色。
平行测定3次。
2. 计算镍的质量分数w (Ni),以g/kg 表示。
注:[M (Ni)=58.69 g/mo1]。
计算式: 10001000)()(⨯⨯⨯=m Ni M cV Ni w 注:1.所有原始数据必须请裁判复查确认后才有效,否则考核成绩为零分。
2.所有容量瓶稀释至刻度后必须请裁判复查确认后才可进行摇匀。
3.记录原始数据时,不允许在报告单上计算,待所有的操作完毕后才允许计算。
4. 滴定消耗溶液体积若>50mL 以50mL 计算。
2020全国技能大赛-工业分析检验竞赛赛题

2020年全国职业院校技能大赛改革试点赛中职组工业分析检验赛项竞赛样题2020年9月2020年全国职业院校技能大赛改革试点赛中职组工业分析检验赛项竞赛赛卷一、竞赛项目1:气相色谱法测定废水中有机物的含量1、实验准备进入实训室之前,首先穿好实验装备,穿上实验服、平底鞋,戴好护目镜和实验手套等,拿好实验记录表;检查实验室是否存在危险源,选择实验所有器具和药品。
2、气路系统操作按次序依次并正确打开载气、助燃气、燃气钢瓶等,调节好载气流量。
3、预热气相色谱仪打开气相色谱仪开关,打开计算机,开启工作站软件。
4、配制样品按照浓度系列配制好标准样品。
5、设计测试方案在工作站进行测试方案编辑,正确选择进样源为GC进样器,并对测试方法进行保存。
6、样品测试按照顺序依次输入样品瓶号,利用设计的测试方案进行样品测试,并获得样品色谱图。
7、数据处理按照程序完成峰面积积分、建立校正表,得到每个组分的标准曲线,完成样品数据分析,保存分析结果并生成报告。
8、关闭仪器关闭空气、氢气钢瓶,仪器降温,关闭仪器电源,退出工作站,关闭计算机,关闭氮气钢瓶。
二、竞赛项目2:地表水氨氮水样采集1、采样前准备选择并清洗采水器、装样容器;准备水样保护剂(硫酸1:1);携带pH广泛试纸、无氨水和水样防护品(报纸)等。
2、采样在规定的采样点,规定的采样深度,用水样将采水器和装样容器洗涤三遍,采集平行样3个和空白样1个,加入保护剂(硫酸1:1),调节pH在规定范围内,做好现场描述和采样记录,贴好标签,对水样采取适当保护措施,将水样安全带回实验室。
3、保存将水样放置于指定存储地点。
三、竞赛项目3:化学分析:混合碱试样的测定盐酸标准滴定溶液的标定(1 mol/L)盐酸标准滴定溶液的标定:采用减量法称取一定量基准试剂,溶解后在指示剂的指示下,用盐酸标准滴定溶液进行标定,平行测定4次,并做空白实验。
混合碱试样的测定减量法称取混合碱试样,加入酚酞指示剂,用盐酸标准滴定溶液滴定,记录第一终点消耗体积。
第三届全国有色金属行业职业院校学生职业技能竞赛决赛分析工理论试题二

[题型]:单选题1、采用双指示剂法用盐酸标准溶液滴定某溶液时,当V1>V2,溶液的组成为( A )。
A、NaOH+Na2CO3B、NaHCO3C、Na2CO3+NaHCO3D、Na2CO3答案:A分数:1难度:1所属知识点:化学基础与化学分析2、标定盐的基准物质有( A )。
A、无水碳酸钠B、草酸钠C、重铬酸钾D、邻苯二甲酸氢钾答案:A分数:1难度:2所属知识点:化学基础与化学分析3、用NaOH溶液滴定H3PO4,第一化学计量点时,中和产物为( B )。
A、H3PO4B、Na H2PO4C、Na2 HPO4D、Na 3PO4答案:B分数:1难度:1所属知识点:化学基础与化学分析4、不能用来作标准溶液的物质是( C )。
A、盐酸B、硫酸C、硝酸D、高氯酸答案:C分数:1难度:2所属知识点:化学基础与化学分析5、用标准氢氧化钠溶液滴定盐酸溶液,若用酚酞为指示剂,滴定误差为( A )。
A、正值B、负值C、无误差D、无法判断答案:A分数:1难度:2所属知识点:化学基础与化学分析6、用0.1000mol/LNaOH滴定0.1000mol/L的HCl及HAc时两条滴定曲线的形式( D )。
A、完全相同B、化学计量点前相同,计量点后不同C、完全不同D、化学计量点前不同,计量点后相同答案:D分数:1难度:3所属知识点:化学基础与化学分析7、某分析结果为50%,若真实值为49%,则相对误差为( A )。
A、+2%B、-2%C、+1%D、-1%答案:A分数:1难度:1所属知识点:化学基础与化学分析8、决定精密度的误差是(B)误差。
A、系统B、偶然C、过失D、方法和试剂答案:B分数:1难度:1所属知识点:化学基础与化学分析9、莫尔法的指示剂是( B )。
A、曙红B、铬酸钾C、铁铵矾D、荧光黄答案:B分数:1难度:1所属知识点:化学基础与化学分析10、用浓H2SO4(分析纯)配制(1+3)的硫酸溶液500ml,需浓H2SO4和水的毫升数为( B )。
2017 技能大赛 高职 正式赛卷 工业分析与检验 理论试题

在气固色谱中,如被分离组分沸点、极性相近但分子直径不同,可选用活性炭作吸附剂。 ( ) 测定运动粘度时,粘度计的选择:务使试样的流动时间不少于200s,内径0.4mm的粘度计 流动时间不少于300s。( ) 杜马法对于大多数含氮有机化合物的氮含量测定都适用。( ) 凡向水体排放污染物,超标要收费,不超标不收费。( ) 偏差表示测定结果偏离真实值的程度。( ) 盐酸和硼酸都可以用NaOH标准溶液直接滴定。( ) 在滴定分析中一般利用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止 滴定,这一点称为化学计量点。( ) 库仑分析法的理论基础是法拉第电解定律。( ) 煤中水分测定的仲裁分析为通氮干燥法。( )
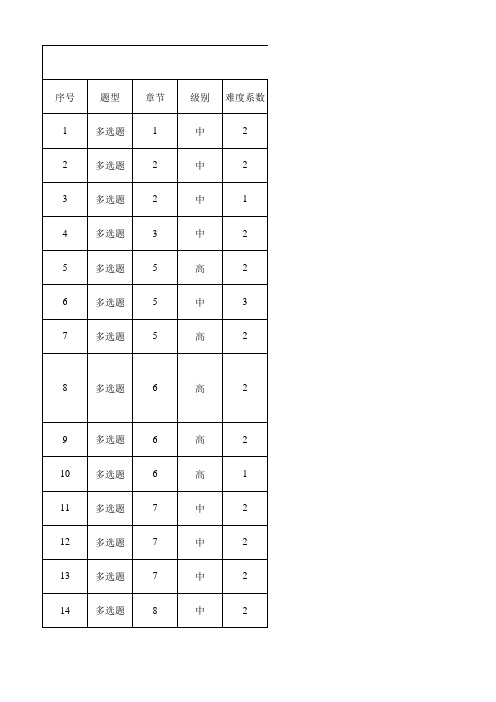
2017年全国职业院校技能竞赛工业分析与检验赛项(高职组)理论试题— 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 题型 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 9 10 10 10 11 11 12 13 13 级别 难度系数 中 中 中 中 中 高 中 中 中 高 中 中 中 中 高 中 高 高 高 高 中 1 2 2 2 2 2 3 2 2 2 2 2 2 3 2 2 1 3 1 2 3
答案 √ × √ × √ × √ × × √ × √ × √ √ √ √ × × √ ×
× × √ × × × × √ √
22 23 24 25 26 27 28 29 30
判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题 判断题
13 14 15 16 5 6 6 12 14
高 高 高 中 中 高 中 高 高
2018年山东省职业院校工业分析与检验技能竞赛

2018年山东省职业院校工业分析与检验技能竞赛化学分析实施方案高锰酸钾标准滴定溶液的标定1.操作步骤用减量法准确称取2.0g ,精确至0.0002g ,于105~110℃烘至恒重的基准草酸钠(不得用去皮的方法,否则称量为零分)于100mL 小烧杯中,用50mL 硫酸溶液(1+9)溶解,定量转移至250mL 容量瓶中,用水稀释至刻度,摇匀。
用移液管准确量取25.00mL 上述溶液放入锥形瓶中,加75mL 硫酸溶液(1+9),用配制好的高锰酸钾滴定,近终点时加热至65℃,继续滴定到溶液呈粉红色保持30s 。
平行测定3次,同时作空白试验。
2.计算公式)21(])([10000.25000.25)()51(422442240O C Na M V KMnO V O C Na m KMnO c ⨯-⨯⨯=式中:c (4KMnO 51)—4KMnO 51标准滴定溶液的浓度,mol/L ;V (KMnO 4)—滴定时消耗KMnO 4标准滴定溶液的体积,mL ; V 0—空白试验滴定时消耗KMnO 4标准滴定溶液的体积,mL ; m (Na 2C 2O 4)—基准物Na 2C 2O 4的质量,g ;M (422O C Na 21)—222O 21C Na 摩尔质量,67.00g/mol 。
过氧化氢含量的测定1.操作步骤用减量法准确称取2.0 g 双氧水试样,精确至0.0002g ,置于已加有100mL 硫酸溶液(1+15)的锥形瓶中,用KMnO 4标准滴定溶液[c(4KMnO 51)=0.1mol/L]滴定至溶液呈浅粉色,保持30s 不褪即为终点。
平行测定3次,同时作空白试验。
2.计算公式1000)(1000)21(]-)([)51(O H 2204422⨯⨯⨯⨯=样品)(m O H M V KMnO V KMnO c w式中:w (H 2O 2)—过氧化氢的质量分数,g/kg ;c (4KMnO 51)—4KMnO 51标准滴定溶液的浓度,mol/L ;V (KMnO 4)—滴定时消耗KMnO 4标准滴定溶液的体积,mL ; V 0—空白试验滴定时消耗KMnO 4标准滴定溶液的体积,mL ; m (样品)— H 2O 2试样的质量,g ;M (22O H 21)—22O H 21的摩尔质量,17.01g/mol 。
全国分析检验工技能大赛题目

鉴定点/难度系数序号职业道德13233343526378393计量和标准化基础知识103113123133142153163173182192203212222233243252263273283293303 312 322 333 343 353 363 373 383 392403413423 433 442452 461 473 483 493502513 523 533 543 552 562 573 583 593 603 613 622643 652 661 673 683 692 702 712 722 732 741 752 762 773 783 792 803 813 823 832 843 852 863 873 883 893 903 912 923 933 942 953973983993化学试剂100310121022103310431053106210731083109311031111112211321143115211631172误差理论、数理统计基础知识、安全常识11811191120112121222123212421252 1261 1272 1282 1292 1303 1313 1322 1332 1342 1352 1362 1372 13811392 1402 1412 1422 1433 1442 1452 1461 1472 1482 14931501 15131521 1531 1543 1551 156215731583 15931603 1613 1623 1632 1643 1651 1662 1673 1682 1693 1703 1712 1722 1732174217521762 1772 1783 1792 1802 1812 1823 1833 1842 1853 1863 1871883 1893 19031911192219331943195319631972198319932002201220222033204320512061207220832092210321122122滴定分析基础知识21312141215121632171218121912201221122212232 2241 2252 2262 2271 2282 2293 2301 2312 2322 2331 2343 2353 2362 2373 2382 2391 2402 2412 2423 2433 2441 2452 2462 2472 24812492 2502 251225222532 2542 2551 2562 2572 2582 2593 2601 2613 2621 2631 2643 2653 2663 2672 2682 2692 2702 2712 2722 2732 2742 2752 2762 2772 2782 2792 280128122822283128422853286228722881289229012912292229322942295329622972298329933002溶液理化特性3011302130313041305230613071308330923103 3113 3122 3131 3142 3152 3161 3172 3182 3191 3201 3211 3222 3231 3241 3251 3261 3273 3282 3292 3301 3311 3322 3332 3341 3351 3361 3371 3381 33913402341134223431344334523462347234823492350135113522353335423552356135723581359136023611化学反应基础36223632364136533663367136813692 3702 3712 3721 37323743 3753 3763 3773 3782 3793 3802 3812 3822 3832 3843 3853 3861 38713881 3891 3902 3912 3921 3933 3943 3952 39623972 3982 3992 4003 4012 4023 4031 4043 405240624072408240924102411341214133414241524161417241824191420242124222准备42314242425342624273428142934302分光光度法4312432143334341435243624374382439144024412环境保护知识442144324443445344624471448144924501451345224532454245514562457245814591460246124621463146434652466146714681469147014713472247324743475247634772检验准备4783479248014812482348324842485148634872488248914902491149224931494249524963497349824992500250125022503150425051检测与测定506150725082509251025111512351325142515351625172518251925203521252215232 5243 5252 5262 5272 5281 5292 5303 5312 5322 5332 5342 5352 5362 5372 5383 5392 5402 5411 5421 5432 5442 5452 5462 5473 5482 5491 550255115522 5532 5543 5553 5562 5572 5581 55925601 5612 5622 5631 5641 5652 5662 5673 5681 56925703 5712 5722 5732 574257535762 5771 5782 5792 5802 5812 58235833 5842 5853 5863 58725881 5892 5902 5913 5921 59325942 5953 5962 5971 5981 5992 600260126022 6032 6041 605260626073 6082 6091 6101 6113 6121 6131614261536163 6173 6181 6192 6201 6212 6222 6232 6242 6252 6262 6272 6282 6291 6303 6312 6322 63326342 6353 6363 6372 6382 6393 6402 6411 6421 643164426451 6462 6471 64826493 6502 6513 6522 6532 6542 655165616571 6581 6592 6602 6612 6623 6632 6643 6651 6662 6671 6681 66916702 6712 6722 6732 6743 6752 6762 67726781 6793 6803 681368226831684368516862 6872 6883 6893 6901 6913 6922 6931 6942 6953 6961 6973 6983 6993 7003 7011 7022 7031 7042 7052 7063 7072 708270917102711271227132修验仪器设备71437152716271727182719172017212722272337242725272627271728272927302731373237331 7342 7352 7361 7372 7382 7392 7403 7412 7422 7432 7442 7452 7462 7472 7482 7492 7503 7512 7523 7532 75417551 7562 7572 75827592 7603 7612 7622 7631 7642 7651 7662 7672 7681 7693 7702 7712 7722 7732 7742 7751 7762 7772 778277917803 7812 7823 7832题目参考答案认真负责,实事求是,坚持原则,一丝不苟地依据标准进行检验和判定是√化学检验工的职业守则内容之一。
2019年全国职业院校技能大赛中职组 “工业分析检验”项目真题技能试题比赛理论试题

回馏装置 HG/T
产生正误差 准确度高,精密 度一定高
蒸馏装置
GB
产生负误差 准确度高,系统 误差、偶然误差 一定小
已知某碱溶液是NaOH与Na2CO3的混合液,用
HCl标准溶液滴定,现以酚酞做指示剂,终点时
耗去HCl溶液V1mL,继而以甲基橙为指示剂滴定
至终点时又耗去HCl溶液V2mL,则V1与V2的关 系不应是( )。
干扰,可加入( )。
碘化钾
氟化氢铵
莫尔法测Cl-含量,要求介质的pH值在6.5
~10.0范围,若酸度过高,则( )。 AgCl沉淀不完全 AgCl沉淀易胶溶
某溶液的吸光度A=0.500,其百分透光度为
( )。
69.4 50.0
单选题 单选题 单选题 单选题 单选题 单选题
下列说法正确的是( )。
原子吸收光谱产生的原因是( )。 气相色谱分析样品中各组分的分离是基于 ( )的不同。 既可调节载气流量,也可来控制燃气和空 气流量的是( )。 液相色谱中用作制备目的的色谱柱内径一 般在( )mm以上。 用铂坩埚处理样品时,可使用以下哪种熔 剂( )。
内容。
规定
合成果为基础
欲配制pH=5的缓冲溶液,应选用下列( )共
轭酸碱对。
NH2OH2+—NH2OH
(NH2OH的 pKb=3.38)
HAc-Ac-(HAc的
pKa=4.74)
单选题 单选题 单选题
单选题 多选题
关于玻璃电极膜电位的产生原因,下列说 法正确的是( )。 采用氧瓶燃烧法测定硫的含量时,将有机 物中的硫转化为( )。
类型 单选题 单选题 单选题 单选题 单选题
单选题 单选题 单选题 单选题
2017年全国职业院校技能大赛中职组工业分析检验赛项竞赛试题1

2017年全国职业院校技能大赛中职组工业分析检验赛项竞赛试题1、理论部分理论考核题库参见《化学检验工职业技能鉴定试题集》,化学工业出版社2015年6月出版,书号978-7-122-23572-5,范围为中级篇试题,不包含各章节计算题、综合题以及第四章化学反应与溶液基础知识。
理论考核样题一、单选题1.欲配制pH=10的缓冲溶液选用的物质组成是()。
A.NH3·H2O -NH4Cl B.HAc-NaAc C.NH3·H2O -NaAc D.HAc- NH3·H2O 2.闭口杯闪点测定仪的杯内所盛的试油量太多,测得的结果比正常值()。
A.低 B.高C.相同D.有可能高也有可能低3.用艾氏卡法测煤中全硫含量时,艾氏卡试剂的组成为()。
A.MgO+Na2CO3(1+2) B.MgO+Na2CO3(2+1)C.MgO+Na2CO3(3+1) D.MgO+Na2CO3(1+3)4.催化氧化法测有机物中的碳和氢的含量时,CO2和H2O所采用的吸收剂为()。
A.都是碱石棉 B.都是高氯酸镁 C.CO2是碱石棉,H2O是高氯酸镁D.CO2是高氯酸镁,H2O是碱石棉5.在液相色谱法中,提高柱效最有效的途径是()。
A.提高柱温 B.降低板高C.降低流动相流速D.减小填料粒度6.热导池检测器的灵敏度随着桥电流增大而增高,因此,在实际操作时桥电流应该()。
A.越大越好 B.越小越好C.选用最高允许电流 D.在灵敏度满足需要时尽量用小桥流7.固定其他条件,色谱柱的理论塔板高度,将随载气的线速度增加而()。
A.基本不变 B.变大C.减小 D.先减小后增大8.原子吸收光谱法是基于从光源辐射出待测元素的特征谱线,通过样品蒸气时,被蒸气中待测元素的()所吸收,由辐射特征谱线减弱的程度,求出样品中待测元素含量。
A.分子 B.离子C.激发态原子D.基态原子9.在红外光谱分析中,用KBr制作为试样池,这是因为()。
2012年全国职业技能竞赛工业分析与检验竞赛试题库

职业技能竞赛辅导资料2012年全国职业技能竞赛工业分析与检验竞赛试题库(高职类)林壮森编化学工程系2013.03.29目录1 单选题B 1 各行各业的职业道德规范()。
A 完全相同B 有各自的特点C 适用于所有的行业D 适用于服务性行业B 2 化学检验工的职业守则最重要的内涵是()。
A 爱岗敬业,工作热情主动B认真负责,实事求是,坚持原则,一丝不苟地依据标准进行检验和判定 C 遵守劳动纪律D 遵守操作规程,注意安全D 3 下面有关爱岗敬业的论述中错误的是()。
A 爱岗敬业是中华民族的传统美德B 爱岗敬业是现代企业精神C爱岗敬业是社会主义职业道德的一条重要规范。
D 爱岗敬业与企业精神无关B 4 下面有关爱岗敬业与职业选择的关系中正确的是()。
A 当前严峻的就业形式要求人们爱岗敬业B 是否具有爱岗敬业的职业道德与职业选择无关C是否具有爱岗敬业的职业道德只与服务行业有关 D 市场经济条件下不要求爱岗敬业A 5 人力资源的特点包括()。
A 能动性、再生性和相对性B 物质性、有用性和有限性C可用性、相对性和有限性D 可用性、再生性和相对性B 6 高级分析工是属国家职业资格等级()。
A 四级B 三级C 二级D 一级C 7 化学检验工必备的专业素质是()。
A 语言表达能力B 社交能力C 较强的颜色分辨能力D 良好的嗅觉辨味能力A 8 为了保证检验人员的技术素质,可从()。
A 学历、技术职务或技能等级、实施检验人员培训等方面进行控制B具有良好的职业道德和行为规范方面进行控制 C 学历或技术职务或技能等级两方面进行控制D 实施有计划和针对性地培训来进行控制1.1 计量和标准化基础知识C 10 《中华人民共和国计量法实施细则》实施的时间是()。
A 1987年1月19日B 1986年7月1日C 1987年2月1日D 1985年9月6日A 进口的计量器具,必须经县级以上人民政府计量行政部门检定合格后,方可销售;B个体工商户可以制造、修理简易的计量器具;C使用计量器具不得破坏其准确度,损害国家和消费者的利益;D制造、销售未经考核合格的计量器具新产品的,责令停止制造、销售该种新产品,没收违法所得,可以并处罚款。
2019 年全国职业院校技能大赛 工业分析检验赛项(中职组)理论考核题库

第七章 配位滴定知识 ........................................................................................................................................... 58 一、单选题 ........................................................................................................................................................... 58 二、判断题 ........................................................................................................................................................... 62 三、多选题 ........................................................................................................................................................... 63
2019年山东省职业院校技能大赛工业分析检验赛项赛题

2019年山东省职业院校技能大赛“工业分析检验”赛项赛题(一)理论知识考核(二)仿真操作考核液相色谱与质谱连用仿真考核——虚拟样品的定性和定量测定(三)实践操作考核未知试样中铁含量的测定1. 氧化还原滴定法测定未知铁试样溶液(I )的浓度 (1)配制重铬酸钾标准滴定溶液用减量法准确称取 0.61g 己在120℃±2℃的电烘箱中干燥至恒重的基准试剂重铬酸钾,溶于水,移入250mL 容量瓶中,用水定容并摇匀。
计算重铬酸钾标准滴定溶液浓度按下式计算:3-72272272210××)O Cr K 61()O Cr K (=)O Cr K 61(实V M m c 式中:c (722O Cr K 61)——722O Cr K 61标准滴定溶液的浓度,mol/L ; V 实——250 mL 容量瓶实际体积,mL ;m (722O Cr K )——基准物K 2Cr 2O 7的质量,g ;M (722O Cr K 61)——722O Cr K 61摩尔质量,49.031g/mol 。
(2)准确移取未知铁试样溶液(I ) 25mL 于250mL 锥形瓶中,加12mL 盐酸(1+1),加热至沸,趁热滴加氯化亚锡溶液还原三价铁,并不时摇动锥形瓶中溶液,直到溶液保持淡黄色,加水约100mL ,然后加钨酸钠指示液10滴,用三氯化钛溶液还原至溶液呈蓝色,再滴加稀重铬酸钾溶液至钨蓝色刚好消失。
冷却至室温,立即加30mL 硫磷混酸和15滴二苯胺磺酸钠指示液,用重铬酸钾标准滴定溶液滴定至溶液刚呈紫色时为终点,记录重铬酸钾标准滴定溶液消耗的体积。
平行测定3次,同时做空白试验。
空白试验用未知铁试样溶液(I )进行测定,准确取样1mL ,其余步骤同上。
(3)计算被测未知铁试样溶液(I )中铁的浓度和平行测定的相对极差。
空白试验消耗的重铬酸钾标准滴定溶液的体积按下式计算:实际体积)实(实际体积)实(体积的平均值)实(实际消耗重铬酸钾mLFe 125mLFe 实-V V V V V 0⨯=未知铁试样溶液(I )中铁的浓度按下式计算:实际体积)实(积)实(实际消耗重铬酸体)(mLFe 250722-×)O Cr K 61(=)Fe (V V V c c注:M (Fe )——Fe 的摩尔质量,55.85g/mol 。
工业分析检验竞赛试题库(判断

鉴定点/ 难度系数 题目 参考答案 序号 职业道德 认真负 责,实事 求是,坚 持原则, 一丝不苟 地依据标 1 3 准进行检 √ 验和判定 是化学检 验工的职 业守则内 容之一。 () 分析检验 的目的是 为了获得 样本的情 2 3 × 况,而不 是为了获 得总体物 料的情况 。() 化学检验 工职业道 德的基本 要求包 括:忠于 职守、专 研技术、 3 3 √ 遵章守纪 、团结互 助、勤俭 节约、关 心企业、 勇于创新 等。() 经安全生 产教育和 培训的人 4 3 √ 员可上岗 作业。 ()
√
×
√
×
√
16
3
17
3
18
2
19
2
产品质量 水平划分 为优等品 、一等品 、二等品 和三等品 四个等级 () 化工产品 质量检验 中,主成 分含量达 到标准规 定的要 求,如仅 有一项杂 质含量不 能达到标 准规定的 要求时, 可判定为 合格产品 。() 建筑工程 不适用于 《中华人 民共和国 产品质量 法》,但 是,建设 工程使用 的建筑材 料、建筑 构配件和 设备适用 于本法。 () 在化验室 的管理过 程中需要 实施整体 管理,不 能只管局 部。()
×
√
√
√
×
46
1
47
3
48
3
49
3
50
2
2000版 ISO9000 族标准的 结构有四 个核心标 准。() ISO14000 指的是质 量管理体 系, ISO19000 指的是环 境管理体 系。() ISO9000 族标准是 环境管理 体系系列 标准的总 称。() ISO的定 义是为进 行合格认 证工作而 建立的一 套程序和 管理制度 。() ISO是世 界上最大 的国际标 准化机 构,负责 制定和批 准所有技 术领域的 各种技术 标准。 ()
2021年河北省职业院校技能大赛(中职组)“工业分析检验”理论和实操试卷

实操试卷操作方案未知试样中铁含量的测定1. 氧化还原滴定法测定未知铁试样溶液(I )的浓度(1)配制重铬酸钾标准滴定溶液用减量法准确称取适量的己在120℃±2℃的电烘箱中干燥至恒量的基准试剂重铬酸钾,溶于水,移入250mL 容量瓶中,用水定容并摇匀。
计算重铬酸钾标准滴定溶液浓度按下式计算:3-72272272210××)O Cr K 61()O Cr K (=)O Cr K 61(实V M m c 式中:c (722O Cr K 61)——722O Cr K 61标准滴定溶液的浓度,mol/L ; V 实——250 mL 容量瓶实际体积,mL ;M (722O Cr K )——基准物K 2Cr 2O 7的质量,g ;M (722O Cr K 61)——722O Cr K 61摩尔质量,49.031g/mol 。
(2)移取未知铁试样溶液(I ) 25mL 于250mL 锥形瓶中,加12mL 盐酸(1+1),加热至沸,趁热滴加氯化亚锡溶液还原三价铁,并不时摇动锥形瓶中溶液,直到溶液保持淡黄色,加水约100mL ,然后加钨酸钠指示液10滴,用三氯化钛溶液还原至溶液呈蓝色,再滴加稀重铬酸钾溶液至钨蓝色刚好消失。
冷却至室温,立即加30mL 硫磷混酸和15滴二苯胺磺酸钠指示液,用重铬酸钾标准滴定溶液滴定至溶液刚呈紫色时为终点,记录重铬酸钾标准滴定溶液消耗的体积。
平行测定3次,同时做空白试验。
空白试验用未知铁试样溶液(I )进行测定,取样为1mL ,其余步骤同上。
(3)计算被测未知铁试样溶液(I )中铁的浓度和平行测定的相对极差。
空白试验消耗的重铬酸钾标准滴定溶液的体积按下式计算:实际体积)实(实际体积)实(体积的平均值)实(实际消耗重铬酸钾mLFe 125mLFe 空实×-=V V V V V 0 未知铁试样溶液(I )中铁的浓度按下式计算:实际体积)实(积)实(实际消耗重铬酸体)(mLFe 250722-×)O Cr K 61(=)Fe (V V V c c注:M (Fe )——Fe 的摩尔质量,55.85g/mol 。
17年全国职业院校技能竞赛工业分析与检验赛项(高职组)理论试题
不能减少测定过程中偶然误差的方法( )。
下列多元弱酸能分步滴定的有( )。
为减小间接碘量法的分析误差,滴定时可用下列( 法。
)的方
原子吸收光谱仪主要由(
)等部件组成。
气相色谱仪包括的部件有(
)。
在列举的条件中( )属于气相色谱仪的技术指标。
土壤退化是土壤生态遭受破坏的最明显的标志,下列属于当前土 壤退化类型的是( )。
被高锰酸钾溶液污染的滴定管可用( )溶液洗涤。
下列有关毒物特性的描述正确的是( )。
我国的法定计量单位是由( )组成。
基准物质必须具备的条件有( )。
系统误差包括( )。
下列有关平均值的置信区间的论述中,错误的有()。 称取混合碱试样0.6839g,以酚酞为指示剂,用0.2000mol/L的HCl 标准溶液滴定至终点,用去HCl溶液23.10mL,再加入甲基橙指示 剂,继续滴定至终点,又耗去HCl溶液26.81mL,混和碱的组成及 各组分含量为( )。已知M (NaOH)=40.00g/mol, M (Na2CO3)=105.99g/mol,M (NaHCO3)=84.01g/mol。 非水滴定溶剂的种类有( )。
酸性溶剂
碱性溶剂
醋酸(pKa=4.74) EDTA是乙二胺四乙酸的简称 直接滴定法是用EDTA直接滴定被测物质
In与MY应有相同的颜色
甲酸(pKa=3.74)
分析工作中一般用乙二胺四乙酸二钠盐 块
返滴定法是先加过了EDTA,然后用另一 种金属离子滴定剩余的EDTA
MIn应有足够的稳定性,且K'MIn>K'MY
四氯化碳
烯烃
磷酸
盐酸
Na2S2O3
d [d HHc (N ] anKn K 21 HSAcO K xn cn n 3a(1a H) KKAcx aa)21 n ( ( I 2 1 4 )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
“工业分析检验”赛项(高职组)竞赛试题一、化学分析考核方案(公开试题)(一)EDTA(0.05mol/L)标准滴定溶液的标定1.操作步骤称取1.5g 于850±50℃高温炉中灼烧至恒重的工作基准试剂ZnO (不得用去皮的方法,否则称量为零分)于100mL 小烧杯中,用少量水润湿,加入20mLHCl (20%)溶解后,定量转移至250mL 容量瓶中,用水稀释至刻度,摇匀。
移取25.00mL 上述溶液于250mL 的锥形瓶中(不得从容量瓶中直接移取溶液),加75mL 水,用氨水溶液(10%)调至溶液pH 至7~8,加10mL NH 3-NH 4Cl 缓冲溶液(pH≈10)及5滴铬黑T (5g/L ),用待标定的EDTA 溶液滴定至溶液由紫色变为纯蓝色。
平行测定4次,同时做空白。
2.计算EDTA 标准滴定溶液的浓度c (EDTA),单位mol/L 。
注: [M (ZnO)=81.39 g/mo1]。
计算公式 39.81)(10000.25000.25)(0⨯-⨯⨯=V V m EDTA c (二)硫酸镍试样中镍含量的测定1.操作步骤称取硫酸镍液体样品xg ,精确至0.0001g ,加水70mL ,加入10mLNH 3-NH 4Cl 缓冲溶液(pH ≈10)及0.2g 紫脲酸铵指示剂,摇匀,用EDTA 标准滴定溶液[c (EDTA)=0.05mol/L]滴定至溶液呈蓝紫色。
平行测定3次。
2. 计算镍的质量分数w (Ni),以g/kg 表示。
注:[M (Ni)=58.69 g/mo1]。
计算式: 10001000)()(⨯⨯⨯=m Ni M cV Ni w 注:1.所有原始数据必须请裁判复查确认后才有效,否则考核成绩为零分。
2.所有容量瓶稀释至刻度后必须请裁判复查确认后才可进行摇匀。
3.记录原始数据时,不允许在报告单上计算,待所有的操作完毕后才允许计算。
4. 滴定消耗溶液体积若>50mL 以50mL 计算。
二、仪器分析考核方案(公开试题)紫外-可见分光光度法测定未知物(一)仪器1.紫外可见分光光度计(UV-1800PC-DS2);配1cm 石英比色皿2个(比色皿可以自带);2.容量瓶:100mL 15个;3.吸量管:10mL 5支;4.烧杯: 100mL 5个;(二)试剂1.标准溶液:任选四种标准试剂溶液(水杨酸、1,10-菲啰啉、磺基水杨酸、苯甲酸、维生素C 、山梨酸、硝酸盐氮、糖精钠)2.未知液:四种标准溶液中的任何一种。
(三)实验操作1.吸收池配套性检查石英吸收池在220nm 装蒸馏水,以一个吸收池为参比,调节τ为100%,测定其余吸收池的透射比,其偏差应小于0.5%,可配成一套使用,记录其余比色皿的吸光度值作为校正值。
2.未知物的定性分析将四种标准试剂溶液和未知液配制成约为一定浓度的溶液。
以蒸馏水为参比,于波长200~350nm 范围内测定溶液吸光度,并作吸收曲线。
根据吸收曲线的形状确定未知物,并从曲线上确定最大吸收波长作为定量测定时的测量波长。
190~210nm 处的波长不能选择为最大吸收波长。
3. 标准工作曲线绘制分别准确移取一定体积的标准溶液于所选用的100mL 容量瓶中,以蒸馏水稀释至刻线,摇匀。
(绘制标准曲线必须是七个点,七个点分布要合理)。
根据未知液吸收曲线上最大吸收波长,以蒸馏水为参比,测定吸光度。
然后以浓度为横坐标,以相应的吸光度为纵坐标绘制标准工作曲线。
4.未知物的定量分析确定未知液的稀释倍数,并配制待测溶液于所选用的100mL 容量瓶中,以蒸馏水稀释至刻线,摇匀。
根据未知液吸收曲线上最大吸收波长,以蒸馏水为参比,测定吸光度。
根据待测溶液的吸光度,确定未知样品的浓度。
未知样平行测定3次。
(四)结果处理根据未知溶液的稀释倍数,求出未知物的含量。
计算公式:0X C C n =⨯0C ——原始未知溶液浓度,μg/mL ;X C ——查出的未知溶液浓度,μg/mL ;n ——未知溶液的稀释倍数。
三、理论考核(样题)一、单选题1.欲配制pH=10的缓冲溶液选用的物质组成是( )。
A .NH 3-NH 4ClB .HAc-NaAcC .NH 3-NaAcD .HAc-NH 32.闭口杯闪点测定仪的杯内所盛的试油量太多,测得的结果比正常值( )。
A .低B .高C .相同D .有可能高也有可能低3.用艾氏卡法测煤中全硫含量时,艾氏卡试剂的组成为( )。
A .MgO+Na 2CO 3(1+2)B .MgO+Na 2CO 3(2+1)C .MgO+Na 2CO 3(3+1)D .MgO+Na 2CO 3(1+3)4.催化氧化法测有机物中的碳和氢的含量时,CO 2和H 2O 所采用的吸收剂为( )。
A .都是碱石棉B .都是高氯酸镁C .CO 2是碱石棉,H 2O 是高氯酸镁D .CO 2是高氯酸镁,H 2O 是碱石棉5.在液相色谱法中,提高柱效最有效的途径是( )。
A.提高柱温B.降低板高C.降低流动相流速D.减小填料粒度6.热导池检测器的灵敏度随着桥电流增大而增高,因此,在实际操作时桥电流应该()。
A.越大越好B.越小越好C.选用最高允许电流D.在灵敏度满足需要时尽量用小桥流7.固定其他条件,色谱柱的理论塔板高度,将随载气的线速度增加而()。
A.基本不变B.变大C.减小D.先减小后增大8.原子吸收光谱法是基于从光源辐射出待测元素的特征谱线,通过样品蒸气时,被蒸气中待测元素的()所吸收,由辐射特征谱线减弱的程度,求出样品中待测元素含量。
A.分子B.离子C.激发态原子D.基态原子9.在红外光谱分析中,用KBr制作为试样池,这是因为()。
A.KBr晶体在4000~400cm-1范围内不会散射红外光B.KBr在4000~400cm-1范围内有良好的红外光吸收特性C.KBr在4000~400cm-1范围内无红外光吸收D.在4000~400cm-1范围内,KBr对红外无反射10.有两种不同有色溶液均符合朗伯-比耳定律,测定时若比色皿厚度,入射光强度及溶液浓度皆相等,以下说法正确的是()。
A.透过光强度相等B.吸光度相等C.吸光系数相等D.以上说法都不对11.分光光度法测定微量铁试验中,铁标溶液是用()药品配制成的。
A.无水三氯化铁B.硫酸亚铁铵C.硫酸铁铵D.硝酸铁12.25℃时AgCl在纯水中的溶解度为1.34×10-5mol/L,则该温度下AgCl的K sp值为()A.8.8×10-10B.5.6×10-10C.3.5×10-10D.1.8×10-1013.EDTA滴定金属离子M,MY的绝对稳定常数为K MY,当金属离子M的浓度为0.01mol/L 时,下列lgαY(H)对应的pH值是滴定金属离子M的最高允许酸度的是()。
A.lgαY(H)≥lgK MY-8 B.lgαY(H)=lgK MY-8C.lgαY(H)≥lgK MY-6 D.lgαY(H)≤lgK MY-314.产生金属指示剂的封闭现象是因为()。
A.指示剂不稳定B.MIn溶解度小C.K'MIn<K'MY D.K'MIn>K'MY15.间接碘量法对植物油中碘值进行测定时,指示剂淀粉溶液应()。
A.滴定开始前加入B.滴定一半时加入C.滴定近终点时加入D.滴定终点加入16.在配位滴定中,金属离子与EDTA形成配合物越稳定,在滴定时允许的pH值()。
A.越高B.越低C.中性D.不要求17.乙二胺四乙酸根(-OOCCH2)2NCH2CH2N(CH2COO-)2可提供的配位原子数为()。
A.2 B.4 C.6 D.818.酸碱滴定中选择指示剂的原则是()。
A.指示剂应在pH=7.0时变色B.指示剂的变色点与化学计量点完全符合C.指示剂的变色范围全部或部分落入滴定的pH突跃范围之内D.指示剂的变色范围应全部落在滴定的pH突跃范围之内19.双指示剂法测混合碱,加入酚酞指示剂时,消耗HCl标准滴定溶液体积为15.20mL。
加入甲基橙作指示剂,继续滴定又消耗了HCl标准溶液25.72mL,那么溶液中存在()。
A.NaOH+Na2CO3B.Na2CO3+NaHCO3C.NaHCO3D.Na2CO3 20.使分析天平较快停止摆动的部件是()。
A.吊耳B.指针C.阻尼器D.平衡螺丝21.实验室三级水不能用以下办法来进行制备()。
A.蒸馏B.电渗析C.过滤D.离子交换22.可用下述那种方法减少滴定过程中的偶然误差()。
A.进行对照试验B.进行空白试验C.进行仪器校准D.增加平行测定次数23.各种试剂按纯度从高到低的代号顺序是()。
A.GR>AR>CP B.GR>CP>AR C.AR>CP>GR D.CP>AR>GR24.使用浓盐酸、浓硝酸,必须在()中进行。
A.大容器B.玻璃器皿C.耐腐蚀容器D.通风厨25.计量器具的检定标识为黄色说明()。
A.合格,可使用B.不合格应停用C.检测功能合格,其他功能失效D.没有特殊意义26.我国企业产品质量检验不可用下列哪些标准()。
A.国家标准和行业标准B.国际标准C.合同双方当事人约定的标准D.企业自行制定的标准27.高级分析工是属国家职业资格等级()。
A.四级B.三级C.二级D.一级28.pH玻璃电极和SCE组成工作电池,25℃时测得pH=4.00的标液电动势是0.209V,而未知试液电动势E x=0.312V,则未知试液pH值为()。
A.4.7 B.5.7 C.6.7 D.7.729.在21℃时由滴定管中放出10.07mL纯水,其质量为10.04g。
查表知21℃时1mL纯水的质量为0.99700g。
该体积段的校正值为()。
A.+0.04mL B.-0.04mL C.0.00mL D.0.03mL30.c(Na2CO3)=0.31mol/L的Na2CO3水溶液的pH是()。
K a1=4.2×10-7、K a2=5.6×10-11 A.2.13 B.5.6 C.11.87 D.12.1331.下列四个数据中修改为四位有效数字后为0.5624的是()。
(1)0.56235 (2)0.562349 (3)0.56245 (4)0.562361A.1,2,4 B.1,3,4 C.2,3,4 D.1,2,3,432.比较两组测定结果的精密度()。
甲组:0.19%,0.19%,0.20%,0.21%,0.25%;乙组:0.18%,0.20%,0.20%,0.21%,0.22%A.甲、乙两组相同B.甲组比乙组高C.乙组比甲组高D.无法判别33.已知酸性介质中φϴ(Ce4+/Ce3+)﹦1.44V,φϴ(Fe3+/Fe2+)=0.68V。
