液液混合物的分离
混合物的分离方法

混合物的分离方法混合物是由两种或更多种物质混合在一起形成的物质,常见的混合物有固体-固体混合物、固体-液体混合物、液体-液体混合物和气体-气体混合物等。
在实际应用中,我们经常需要将混合物中的各种成分分离出来,以便进行进一步的研究或利用。
下面将介绍几种常见的混合物分离方法。
一、过滤法过滤法主要用于分离固体-固体混合物或固体-液体混合物。
该方法基于固体颗粒的大小和固体颗粒与液体之间的亲疏性原理进行分离。
当混合物中的固体颗粒较大且与液体不溶时,可以通过过滤纸或筛网将固体颗粒过滤出来。
如果是固体-液体混合物,过滤后获得的液体即为所需成分。
二、蒸馏法蒸馏法主要用于分离液体-液体混合物或液体-气体混合物。
该方法利用物质沸点的差异来实现分离。
首先将混合物加热,待沸点较低的组分汽化为气体,然后通过冷凝装置使其再次变为液体,最后通过收集器收集分离出的不同成分。
三、离心法离心法主要用于分离悬浮在液体中的固体颗粒。
该方法基于固体颗粒在离心力的作用下,由于重力不同而沉淀或漂浮的原理进行分离。
将混合物放入离心机中旋转,通过离心力使固体颗粒向下沉淀,然后将上清液体倒出,即可得到分离后的成分。
四、结晶法结晶法主要用于分离固体-液体混合物。
该方法依据溶质在溶剂中的溶解度随温度变化而不同的特点进行分离。
将混合物溶解在适当的溶剂中,通过加热或冷却的方式,使溶剂中的溶解度发生变化,从而使溶质结晶出来。
通过过滤可将固体与溶剂分离。
五、气体吸附法气体吸附法主要用于分离气体-气体混合物。
该方法利用吸附材料对特定气体的吸附选择性实现分离。
将混合物通入吸附剂床层中,床层中的吸附剂会选择性地吸附其中的某一种气体,从而实现分离。
待吸附过的气体排出,即可得到所需气体。
总结:混合物的分离方法有过滤法、蒸馏法、离心法、结晶法和气体吸附法等。
在实际应用中,我们可以根据混合物的成分以及要求的纯度选择合适的分离方法。
这些方法不仅广泛用于实验室分析和工业生产中,也在日常生活中有许多应用,例如饮用水的净化和药品的制备等。
液体有机化合物的分离和提纯
2-5 液体有机化合物的分离和提纯在生产和实验中,经常会遇到两种以上组分的均相分离问题。
例如某物料经过化学反应以后,产生一个既有生成物又有反应物及副产物的液体混合物。
为了得到纯的生成物,若反应后的混合物是均相的,时常采用蒸馏(或精馏)的方法将它们分离。
一、简单蒸馏通过简单蒸馏可以将两种或两种以上挥发度不同的液体分离,这两种液体的沸点应相差30℃以上。
1. 简单蒸馏原理液体混合物之所以能用蒸馏的方法加以分离,是因为组成混合液的各组分具有不同的挥发度。
例如,在常压下苯的沸点为80.1℃,而甲苯的沸点为110.6℃。
若将苯和甲苯的混合液在蒸馏瓶内加热至沸腾,溶液部分被汽化。
此时,溶液上方蒸气的组成与液相的组成不同,沸点低的苯在蒸气相中的含量增多,而在液相中的含量减少。
因而,若部分汽化的蒸气全部冷凝,就得到易挥发组分含量比蒸馏瓶内残留溶液中所含易挥发组分含量高的冷凝液,从而达到分离的目的。
同样,若将混合蒸气部分冷凝,正如部分汽化一样,则蒸气中易挥发组分增多。
这里强调的是部分汽化和部分冷凝,若将混合液或混合蒸气全部冷凝或全部汽化,则不言而喻,所得到的混合蒸气或混合液的组成不变。
综上所述,蒸馏就是将液体混合物加热至沸腾,使液体汽化,然后,蒸气通过冷凝变为液体,使液体混合物分离的过程,从而达到提纯的目的。
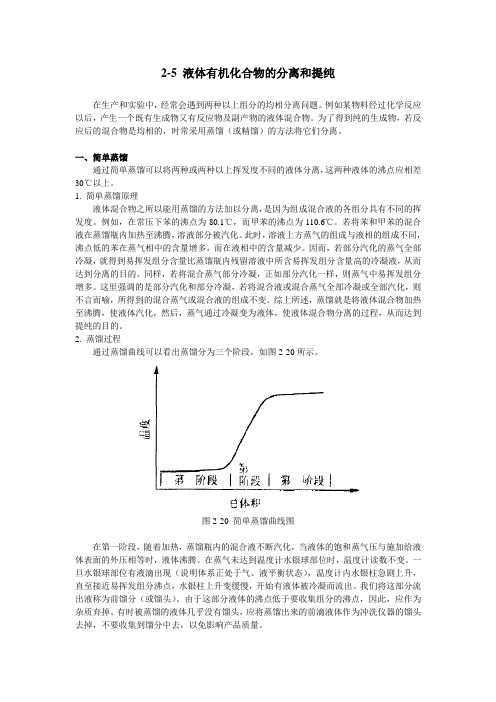
2. 蒸馏过程通过蒸馏曲线可以看出蒸馏分为三个阶段,如图2-20所示。
图2-20 简单蒸馏曲线图在第一阶段,随着加热,蒸馏瓶内的混合液不断汽化,当液体的饱和蒸气压与施加给液体表面的外压相等时,液体沸腾。
在蒸气未达到温度计水银球部位时,温度计读数不变。
一旦水银球部位有液滴出现(说明体系正处于气、液平衡状态),温度计内水银柱急剧上升,直至接近易挥发组分沸点,水银柱上升变缓慢,开始有液体被冷凝而流出。
我们将这部分流出液称为前馏分(或馏头)。
由于这部分液体的沸点低于要收集组分的沸点,因此,应作为杂质弃掉。
有时被蒸馏的液体几乎没有馏头,应将蒸馏出来的前滴液体作为冲洗仪器的馏头去掉,不要收集到馏分中去,以免影响产品质量。
液液相分离研究方法

液液相分离研究方法液液相分离是一种常用的化学分离技术,用于将混合物中的两种或多种不相溶的液体分离开来。
液液相分离具有操作简便、效率高等优点,在化学、生物、环境等领域中有着广泛的应用。
液液相分离的基本原理是根据不同物质在两种不相溶的溶剂中的溶解度差异,通过适当的操作使两种或多种物质分别溶解在不同的溶剂相中,从而实现物质的分离。
常见的液液相分离方法包括浸出法、萃取法、析出法等。
浸出法是利用溶剂对混合物进行提取,使其中一种或多种物质溶解到溶剂中。
浸出法常用于从固体混合物中提取有机物或无机物。
例如,从植物中提取活性成分时,常采用浸出法。
浸出法的关键是选择合适的溶剂,使目标物质较好地溶解于溶剂中,而其他杂质则不易溶解。
萃取法是利用两种不相溶的溶剂之间的亲疏性差异,实现物质的分离。
常见的萃取法有液液萃取和固相萃取两种。
液液萃取是在两种互不相溶的溶剂中进行的,其中一种溶剂(通常为有机溶剂)能较好地溶解目标物质,另一种溶剂(通常为水)则不溶解目标物质。
通过适当的操作,使目标物质从一个溶剂相转移到另一个溶剂相中,从而实现物质的分离。
固相萃取是利用具有选择性吸附性能的固体吸附剂将目标物质从溶液中吸附到固体表面,然后通过适当的洗脱步骤将目标物质从固体吸附剂上解吸下来。
析出法是利用两种或多种溶剂中某种物质溶解度的变化,通过溶剂的挥发或冷却等方法将该物质析出出来。
常见的析出法有溶剂挥发法和冷却析出法。
溶剂挥发法是将溶液中的溶剂挥发掉,使溶质溶解度降低,从而导致溶质析出。
冷却析出法是通过降低溶液的温度,使溶质的溶解度下降,从而使溶质析出。
为了实现液液相分离,需要根据不同的分离目标选择合适的溶剂和操作条件。
选择合适的溶剂应考虑溶质的性质、溶剂相的亲疏性以及分离效果等因素。
操作条件包括温度、压力、搅拌速度等,这些条件的选择应根据实际情况进行优化,以提高分离效率。
在液液相分离过程中,还可以借助一些辅助技术提高分离效果。
例如,可以使用离心机加速溶液的分离;可以利用蒸馏技术将目标物质从溶剂中回收;可以通过pH调节或加入表面活性剂等手段改变溶液的性质,以促进物质的分离。
混合物的分离方法

混合物的分离方法
物理方法:
1、过滤:分离固液物质的方法。
例如:分离氯酸钾和二氧化锰、分离泥沙和氯化钠。
2、蒸馏:利用液体混合物各组分的沸点不同,把它们一一分离,得到不同的物质。
例如:石油的分馏、分离液态空气。
3、结晶:利用某物质的溶解度随温度的变化不同,把物质分开。
(1)蒸发结晶:物质的溶解度随温度的升高而增大不明显。
例如:从硝酸钾和氯化钠中分离出氯化钠。
(2)降温结晶:物质的溶解度随温度升高而增大明显。
例如:从硝酸钾和氯化钠中分离出硝酸钾。
化学方法:
原则:杂不增,纯不减,易分离。
步骤:(1)选某试剂和杂质反应,与被提纯物质不反应。
(2)生成物质不能成为新的杂质,最好生成被提纯物质或生成与被提纯物质状态不一致的物质,易除去。
(3)如果通过前两步不能除去杂质,那就选试剂和被提纯物质反应,生成物与杂质的状态不一致,分离后再把生成的杂质转化成原被提纯的物质。
例如:(1)CO2(CO)利用CO的还原性除杂——CuO+CO=Cu+CO2,其中生成物CO2是被提纯物质,而生成物Cu的状态与被提纯物质CO2不一致,因此易分离。
(2)BaCl2(NaOH)由于BaCl2溶于水,而Na+又不能形成沉淀,不易除去,因此就选择一种试剂与BaCl2反应,形成钡的沉淀,通过过滤得到钡的沉淀,在把钡的沉淀转化成BaCL2.即通过BaCl2+Na2CO3=BaCO3↓+2NaCl,把BaCO3过滤出来,并和稀盐酸反应生成BaCl2,从而把NaOH除去达到目的。
无论是物理方法还是化学方法,都需要学生对基础知识掌握扎实,不但会用还要灵活运用。
分离混合物的常用方法

分离混合物的常用方法
1、过滤法:就是将混合物液体部分滤去,以不溶解的固体物质留下来,这种分离方
法简单易行。
2、蒸馏法:是分离液体混合物的一种有效方法。
蒸发时,比蒸发温度高、蒸发汽饱
和度小的液体会先挥发,从而获得比较纯的液体。
3、离心法:是以离心力为驱动力,利用离心机使混合物离心分离的一种方法,该方
法可以用于分离不溶性固体混合物。
4、萃取法:是以不同溶剂的溶解性的矛盾,用多种溶剂逐个萃取对混合物的有效成分,从而实现对混合物的分离的一种方法。
5、冷凝法:当溶解混合物的分解成分的沸点有很大的差距时,可以利用冷凝法实现。
大分子混合物长久放入室温,又或是加入溶剂(如乙醇),然后在-10°C时进行冷凝处理,它们在冰水中溶解性大大改变,从而使分子形成团集聚时,单一分子从溶液中分离出来,
由于相互之间结合,从而实现分子的分离。
6、凝胶法:是在混合物中加入凝胶剂,以调节液体粘度,当固液沉积时,利用比重
差分离。
7、浓缩法:是利用抽滤法,经低温浓缩后分离的一种方法,把凝体浓缩,使它的比
重变大,就可以实现分离。
液相的分离原理

液相的分离原理液相分离是一种常见的分离技术,它基于不同物质在液体介质中溶解度不同的原理,通过溶解度差异将混合物中的组分分离出来。
液相分离广泛应用于化学、生物、环境等领域,用于纯化、分析、提取等工作。
液相分离的原理可以归纳为以下几种。
1. 溶解度差异原理:混合物成分在液相中的溶解度不同,从而实现分离。
不同物质的溶解度受到多种因素的影响,如温度、压力、溶剂性质等。
通过控制这些因素,可以改变物质在液相中的溶解度,从而实现分离。
2. 色谱层析原理:利用液相中组分在固相(或液相)上的吸附或分配行为差异,实现分离。
色谱层析可以通过对吸附剂性质、样品预处理、流动相条件的调节等控制,提高分离效果。
常见的色谱层析方法包括薄层色谱、柱层析、气相色谱等。
3. 蒸发结晶原理:通过控制溶液中溶质溶解度的变化,将其中的溶质超过溶解度的部分通过蒸发结晶的方法从溶液中分离出来。
4. 萃取原理:不同物质对具有选择性的溶剂的亲和力不同,通过这种差异实现分离。
常用的萃取方法包括溶剂萃取、液液萃取、固相萃取等。
5. 离子交换原理:离子交换作为一个重要的液相分离技术,通过离子交换树脂对溶液中的阳离子或阴离子进行选择性吸附和释放,实现对离子的分离。
离子交换具有特异性、高效性和重复使用等优点,广泛应用于分析、制备和废水处理等领域。
6. 悬浮剂法:利用不同物质在悬浮剂中的浮力、沉力差异,实现分离。
悬浮剂法常用于固体颗粒或胶体的分离,例如沉淀法、沉降法、离心法等。
液相分离技术的具体选择要根据分离目标的性质、混合物的成分、样品量等因素综合考虑。
当然,不同的液相分离技术也可以结合使用,通过多个步骤实现更高效的分离效果。
液相分离的优点在于操作简单方便,适用于大多数物质的分离,分离效果较好。
此外,液相分离技术具有高效、可控性强、适用范围广等优点,已经成为现代化学分析领域不可或缺的方法之一。
虽然液相分离技术具有明显的优点,但也存在一些问题。
比如,需要较多的分离剂、消耗较大的能源、操作时间较长等。
液液萃取(溶剂萃取).

11 液液萃取(溶剂萃取)Liquid-liquid extraction(Solventextraction)11.1 概述一、液液萃取过程:1、液液萃取原理:根据液体混合物中各组分在某溶剂中溶解度的差异,而对液体混合物实施分离的方法,也是重要的单元操作之一。
溶质 A + 萃取剂 S——————〉S+A (B) 萃取相 Extract分层稀释剂 B B + A (S…少量) 萃余相 Raffinate(残液)一般伴随搅拌过程 => 形成两相系统,并造成溶质在两相间的不平衡则萃取的本质:液液两相间的传质过程,即萃取过程是溶质在两个液相之间重新分配的过程,即通过相际传质来达到分离和提纯。
溶剂 extractant(solvent)S 的基本条件:a、S 不能与被分离混合物完全互溶,只能部分互溶;b、溶剂具有选择性,即溶剂对A、B两组分具有不同溶解能力。
即(萃取相内)(萃余相内)最理想情况: B 与 S 完全不互溶 => 如同吸收过程: B 为惰性组分相同:数学描述和计算实际情况:三组分分别出现于两液相内,情况变复杂2 、工业萃取过程:萃取不能完全分离液体混合物,往往须精馏或反萃取对萃取相和萃余相进行分离,而溶剂可循环使用。
实质:将一个难于分离的混合物转变为两个易于分离的混合物举例:稀醋酸水溶液的分离:萃取剂:醋酸乙酯3 、萃取过程的经济性:取决于后继的两个分离过程是否较原液体混合物的直接分离更容易实现( 1 )萃取过程的优势:(与精馏的关系)a、可分离相对挥发度小或形成恒沸物的液体混合物;b、无相变:液体混合物的浓度很低时,精馏过于耗能(须将大量 B 汽化);c、常温操作:当液体混合物中含有热敏性物质时,萃取可避免受热;d、两相流体:与吸附离子交换相比,操作方便。
( 2 )萃取剂的选择——萃取过程的经济性a、分子中至少有一个功能基,可以与被萃取物质结合成萃合物;b、分子中必须有相当长的烃链或芳香环,可使萃取剂和萃合物容易溶解于有机相,一般认为萃取剂的分子量在350-500之间较为合适。
混合物的分离方法

混合物的分离方法混合物是由两种或更多种物质以非化学反应的方式组成的物质。
常见的混合物包括悬液、溶液、气体混合物等。
分离混合物的方法有很多种,下面将介绍一些常见的分离方法。
1. 过滤法过滤法是将悬浮在液体中的固体颗粒分离出来的方法。
通过过滤纸、滤网等过滤介质,液体能够通过而固体颗粒被滞留下来。
这种方法常用于分离悬浊液、浆料等。
2. 蒸馏法蒸馏法是通过物质的沸点差异将混合物中的液体成分分离的方法。
混合物被加热,液体成分会沸腾并转化为气体,然后通过冷凝得到纯净的液体。
这种方法常用于分离溶液、酒精等。
3. 结晶法结晶法是将溶液中的固体物质沉淀出来的方法。
通过加热或降低温度,使得溶质达到饱和状态,再逐渐减小溶剂的温度,使溶质析出结晶。
这种方法常用于分离溶液中的无机盐、有机物等。
4. 萃取法萃取法是利用溶质在不同溶剂中的亲和性差异将混合物中的物质分离出来的方法。
通过将混合物与合适的溶剂接触,目标物质会更倾向于溶解在其中,然后通过分液漏斗等工具将两种液体分离。
这种方法常用于分离有机物、天然产物等。
5. 离心法离心法是通过离心机产生高速离心力将混合物中不同密度的粒子分离的方法。
离心力使得密度较大的粒子沉降至离心管底部,而密度较小的粒子则上浮至上层,从而实现分离。
这种方法常用于分离悬浮液、血液成分等。
6. 电泳法电泳法是利用物质在电场中的运动速度差异将混合物中的成分分离的方法。
通过将混合物施加电场,带电粒子会沿着电场方向移动,根据大分子与小分子的运动速度差异,实现它们的分离。
这种方法常用于分离蛋白质、核酸等。
7. 气相色谱法气相色谱法是通过物质在固定相和流动相间的分配系数差异将混合物中的成分分离的方法。
通过将混合物蒸发到气相,再通过柱管中的固定相将成分逐一分离。
这种方法常用于分离有机化合物、气体混合物等。
8. 磁选法磁选法是利用物质对磁性的不同反应将混合物中的磁性物质分离出来的方法。
通过施加磁场,磁性物质会受到吸引而分离出来,而非磁性物质则不受影响。
高中常见液体混合物的分离与提纯

高中常见液体混合物的分离与提纯1. 蒸馏法蒸馏法是一种常见的液体混合物分离方法,适用于两种具有不同沸点的组分的混合物。
通过加热混合物,并在一定条件下进行蒸发和冷凝,可以将低沸点的组分分离出来。
这种方法常用于分离液体和液体之间的混合物,例如纯化酒精或提取香精物质。
2. 结晶法结晶法适用于含有可溶性固体的液体混合物。
通过在适当的溶剂中溶解混合物,并进行冷却或蒸发,可以使其中一种或多种固体溶质结晶出来,从而实现分离和提纯的目的。
这种方法常用于分离溶液中的杂质或纯化某些化合物。
3. 过滤法过滤法是一种用于分离固体和液体的混合物的常见方法。
通过使用不同孔径的滤纸、滤网或过滤膜,可以将固体颗粒分离出来,而将液体通过。
这种方法常用于分离悬浮物、沉淀物或其他杂质。
4. 萃取法萃取法适用于存在两种或更多互不相溶的液体组分的混合物。
通过将混合物与一个适合的溶剂混合并搅拌,目标组分可以在两个液体相之间转移。
这种方法常用于分离有机物或提取天然物质。
5. 色谱法色谱法是一种常用的分离和提纯液体混合物的方法。
通过利用不同组分在固定相和流动相之间的相互作用和迁移速度差异,可以实现分离和提纯的目的。
常见的色谱法包括薄层色谱、气相色谱和高效液相色谱。
6. 离心法离心法适用于含有固体颗粒或悬浮物的液体混合物。
通过使用离心机,可以通过离心力使固体颗粒沉积到管底,从而与液体分离。
这种方法常用于分离血液中的血细胞、沉淀物或其他悬浮物。
以上是高中常见液体混合物的分离与提纯方法的简要介绍。
在进行实验操作时,请注意安全性和操作规范,并根据具体情况选择最合适的方法。
常用的分离混合物的方法

常用的分离混合物的方法
常用的分离混合物的方法包括:
1. 过滤:将固体物质和液体物质分离,常用的过滤装置包括滤纸和过滤漏斗。
2. 蒸馏:利用物质的沸点差异,将液体混合物分离为纯液体组分。
常见的蒸馏方法有简单蒸馏、分馏和真空蒸馏。
3. 结晶:通过溶解度的差异,将溶液中的固体组分结晶出来。
结晶过程一般包括溶解、冷却和结晶。
4. 萃取:利用物质在不同溶剂中的溶解度差异,将混合物中的某一成分提取出来。
萃取常用的溶剂有水、醚、醇等。
5. 气相色谱:利用不同物质在固定相和流动相中的分配系数差异,分离混合物。
气相色谱主要用于分析和测定混合物的组成。
6. 液相色谱:利用不同物质在液相中的分配系数差异,分离混合物。
液相色谱常用的分离技术有正相色谱和反相色谱。
7. 电泳:利用不同物质在电场中的迁移速度差异,分离混合物。
电泳常用的方法有凝胶电泳、毛细管电泳等。
8. 离心:利用离心力使混合物中的组分沉淀或分层,分离混合物。
离心常用的离心机有台式离心机和超速离心机。
9. 精馏:通过多次蒸馏和冷凝,分离混合物中的不同组分。
精馏常用于分离液体混合物。
10. 磁力分离:利用磁性物质的特性,将混合物中的磁性组分分离出来。
磁力分离常用于分离固体和固体混合物。
混合物的分离和提纯的方法

混合物的分离和提纯的方法
混合物的分离和提纯的方法有以下几种:
1. 过滤: 过滤是将固体和液体混合物中的固体颗粒从液体中分离出来的方法。
通过将混合物通过滤纸或者筛网,固体颗粒会被截留在滤纸或者筛网上,而液体则通过滤纸或者筛网流出。
2. 蒸馏: 蒸馏是一种通过液体的沸点差异分离液体混合物组分的方法。
混合物被加热,液体组分蒸发并通过冷凝器冷却成为液体,而固体成分则留在烧瓶中。
3. 晶体化: 晶体化常用于从溶液中分离出所需的固体晶体。
将溶液慢慢蒸发,溶质因为溶剂的质量损失而溶解度下降,直至溶质达到饱和,形成晶体。
4. 萃取: 萃取是一种利用两种互不相溶的溶剂来分离混合物中的组分的方法。
其中一种溶剂选择性地溶解其中一种组分,而另一种组分仍然留在原溶液中,通过分液漏斗分离两种溶液并收集目标组分。
5. 离心: 离心是一种利用离心机使混合物中不同密度的组分分离的方法。
通过快速旋转离心机,重力作用使密度不同的组分分层,并可借助离心管取出所需的组分。
这些方法可以单独使用,也可以根据混合物的性质和成分组合使用,以实现对混
合物的有效分离和提纯。
分离方法有哪些

分离方法有哪些分离方法是指将混合物中的各种成分进行分离的方法。
在化学、生物、环境等领域都有着广泛的应用。
下面将介绍几种常见的分离方法。
首先,最常见的分离方法之一是过滤法。
过滤法是利用不同颗粒大小的过滤介质,将混合物中的固体颗粒和液体分离的方法。
例如,在实验室中,我们常用滤纸、滤膜等过滤介质进行固液分离。
过滤法操作简单,成本低廉,适用于固体颗粒较大且分离要求不高的情况。
其次,蒸馏法也是一种常见的分离方法。
蒸馏法是利用混合物中各成分的沸点差异,通过加热使其中一种或几种成分转化为气态,再通过冷凝使其重新变为液态,从而实现分离的方法。
蒸馏法适用于液体混合物的分离,如酒精和水的分离就是通过蒸馏法实现的。
蒸馏法分离效果好,但能耗较高,操作复杂。
此外,结晶法也是一种常见的分离方法。
结晶法是通过控制溶液中溶质的溶解度,使其从溶液中析出晶体,从而实现分离的方法。
结晶法适用于固体溶液的分离,如盐和水的分离就是通过结晶法实现的。
结晶法操作简单,成本较低,但对溶质的溶解度要求较高。
最后,离心法也是一种常见的分离方法。
离心法是利用离心机将混合物中的各成分根据密度差异进行分离的方法。
离心法适用于固液或液液混合物的分离,如细胞和细胞器的分离就是通过离心法实现的。
离心法分离效果好,但设备成本较高。
综上所述,分离方法有过滤法、蒸馏法、结晶法和离心法等多种。
在实际应用中,我们可以根据混合物的性质和分离要求选择合适的分离方法,以达到高效、经济、环保的分离效果。
希望本文介绍的分离方法能够为您的工作和学习提供一些帮助。
混合物分离的操作方法

混合物分离的操作方法
混合物分离的操作方法根据不同的混合物性质和需求会有不同的方法,常见的分离方法包括以下几种:
1. 过滤:用于分离固体与液体混合物,通过过滤纸、滤膜等过滤器可以将固体颗粒截留,使液体通过,达到分离的目的。
2. 蒸馏:用于分离液体混合物,根据不同的沸点来蒸发和重新凝结不同组分的液体。
常见的蒸馏有简单蒸馏、分馏、提取等方法。
3. 萃取:用于提取混合物中的某一组分。
通过溶剂的选择性溶解性,将目标组分溶解到溶剂中,再通过蒸发或其他方法得到纯净的目标组分。
4. 结晶:用于分离溶液中的固体组分。
通过加热或者降温使溶解度变化,使溶质析出成晶体。
5. 离心:用于分离悬浮物和溶液的混合物。
通过高速旋转离心机,重力作用使得高密度的悬浮物向外靠近,低密度的溶液向内迁移。
6. 电泳:用于分离带电粒子的混合物。
通过电场的作用,使带电粒子向正或负电极迁移,从而实现分离。
7. 磁性分离:用于分离带磁性物质的混合物。
通过磁性材料对带磁性物质的吸附或排斥,实现分离。
需要根据具体情况选择合适的方法进行混合物的分离,有时也需要结合多种方法进行操作。
混合物分离的方法和原理

混合物分离的方法和原理
混合物分离提纯的方法主要包括分级结晶法、分步沉淀法、选择性氧化还原法、吸收/吸附法、液液溶剂萃取法、蒸馏法等。
这些方法的原理和应用如下:
1. 分级结晶法:通过加热蒸发溶液,控制溶液的密度,使其中一部分溶质结晶析出。
经反复的操作可以达到分离提纯的目的。
2. 分步沉淀法:常选用适宜的试剂或调节pH,使溶液中的某一部分沉淀析出。
经反复的操作,也可达到分离提纯的目的。
3. 选择性氧化还原法:用适宜的氧化剂或还原剂,使混合物中的某些成分氧化或还原,并进一步达到分离提纯的目的。
4. 吸收/吸附法:用适宜的试剂吸收混合物中的某些成分,或者用适宜的物
质吸附混合物中有的某些成分,从而达到分离提纯的目的。
5. 液液溶剂萃取法:选用适宜的溶剂,把混合物中的某些成分溶解吸收,从而达到分离提纯的目的。
6. 蒸馏法:控制混合溶液蒸气的冷凝温度,使不同沸点的成分分步冷凝析出,从而达到分离提纯的目的。
7. 加热法:当混合物中混有热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出去。
8. 沉淀法:在混合物中加入某种试剂,使其中一种以沉淀的形式分离出去的方法。
使用该方法一定要注意不能引入新的杂质。
9. 酸碱法:被提纯的物质不与酸碱反应,而杂质可与酸碱反应,用酸碱作除杂试剂。
10. 转化法:不能通过一次达到分离目的的,需要经过多次转化,将其转化成其它物质才能分离,然后再将转化的物质恢复为原物质。
以上方法仅供参考,具体使用哪种方法需要根据混合物的性质和分离要求来决定。
混合物分离和提纯的方法

混合物分离和提纯的方法混合物分离和提纯是化学实验室中常见的任务,它们涉及到不同物质之间的分离以及从混合物中提取纯净物质的过程。
本文将介绍常见的混合物分离和提纯的方法,包括物理方法和化学方法。
物理方法是利用物质的物理性质差异进行分离和提纯的方法,常见的物理方法有:1. 过滤法:适用于固体与液体的分离。
将混合物通过滤纸或者滤膜过滤,固体颗粒被滤下,液体则通过滤纸或滤膜留下。
2. 蒸馏法:适用于液体的分离和提纯。
混合物中的不同组分有不同的沸点,利用加热混合物,将其中沸点较低的组分蒸发出来,再通过冷凝装置将其冷凝成液体收集。
3. 结晶法:适用于固体的分离和提纯。
通过加热溶液,使溶质溶解度降低,然后冷却溶液,使溶质重新结晶出来,通过过滤分离出固体。
4. 萃取法:适用于液液体系的分离。
利用不同溶剂对不同物质有不同的溶解度,使混合物和萃取剂共同摇匀后分层,通过分离漏斗将两相分离。
5. 离心法:适用于固液和液液固体系统的分离。
通过离心机使颗粒较大的固体在离心力的作用下沉淀到底部,使液体相分离。
化学方法是利用化学反应将混合物中的不同组分转化为易分离和提纯的物质的方法,常见的化学方法有:1. 氧化还原反应:适用于氧化和还原性质不同的物质的分离。
通过加入适当的氧化剂或还原剂使其中一部分物质氧化或还原生成易分离的产物。
2. 酸碱中和反应:适用于酸性和碱性物质的分离。
将酸性或碱性物质与适量的酸或碱反应生成无溶解度的盐类,然后通过沉淀或过滤分离。
3. 沉淀法:适用于混合物中含有有机物和无机物的分离。
通过加入沉淀剂,使其中一部分物质生成难溶或不溶的沉淀,然后通过过滤分离。
4. 气体吸收法:适用于混合物中含有可溶性气体的分离。
将混合物通入适当的吸收剂中,使其中一种气体被吸收,然后通过蒸馏或其他方法分离。
5. 结合多种方法:在分离和提纯的过程中,常常需要结合多种方法进行。
例如,对固体混合物进行萃取后,再通过过滤或蒸馏进行提纯。
总结起来,混合物分离和提纯的方法多种多样,我们需要根据混合物的性质和要求选择合适的方法。
分离液态混合物操作方法

分离液态混合物操作方法分离液态混合物是一种常见的实验操作,常用于分离具有不同物理性质的液体组分。
以下是一种操作方法,用于分离液态混合物。
1. 确定混合物的性质:首先要确定混合物的成分和性质。
了解混合物的成分有助于选择合适的分离技术和条件。
2. 选择分离技术:根据混合物的性质选择合适的分离技术。
常见的分离技术包括蒸馏、萃取、结晶、吸附、扩散、过滤等。
3. 蒸馏分离:蒸馏是根据不同组分的沸点差异进行分离的方法。
将混合物加热到沸点,产生蒸汽,然后通过冷凝器冷凝收集。
沸点较低的组分首先蒸发,沸点较高的组分较晚蒸发。
常见的蒸馏方法有简单蒸馏、分馏蒸馏和真空蒸馏。
4. 萃取分离:萃取是利用溶剂与混合物中某个组分的选择性溶解性进行分离的方法。
将混合物与适量的溶剂混合,通过溶解不同组分的差异,使其在溶液中得以分离。
随后,利用各组分在溶剂中的溶解度差异,通过萃取、洗涤、搅拌等操作,使组分分离。
5. 结晶分离:结晶是利用溶质在溶剂中溶解度的差异进行分离的方法。
将混合物溶解于适量的溶剂中,加热以溶解全部溶质,再通过降温或蒸发溶剂的方法进行结晶分离。
由于溶质在不同条件下的溶解度不同,可以实现不同组分的分离。
6. 吸附分离:吸附是利用固体吸附剂对混合物中组分选择性吸附分离的方法。
将混合物通过一定的吸附剂,根据各组分与吸附剂的相互作用力不同,实现组分的分离。
常见的吸附剂有硅胶、活性炭、沸石等。
7. 过滤分离:过滤是利用均匀混合物中颗粒或物质与溶剂不容易相互溶解的特性进行分离的方法。
将混合物经过滤器,颗粒或物质留在滤器上,过滤液通过滤器被分离出来。
根据混合物的实际情况,可以选择单一的分离技术,也可以结合多种分离技术进行操作。
分离液态混合物时,需要根据实验要求和混合物性质选择合适的分离策略。
同时,为了保证分离效果和实验安全,还需要仔细控制操作条件,例如温度、压力、溶剂选择等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3 萃取过程计算 3.1级式接触过程数学描述 单级:(理论级) ①物料衡算 F S R E
FxFA SzA RxA EyA 0 SzS RxS EyS
②相平衡 yA f ( xA ) yS ( yA) xS (xA)
(质量分率),
选择性系数β=8。
试求:萃取液量E0为多少kg?
解:xFA 0.40,xFS 0 , F=100kg
y
0 A
x
0 A
/(1 /(1
y
0 A
)
x
0 A
)
y
0 A
1
x
0 A
(
1)
x
0 A
8 0.3 0.774 1 (8 1) 0.3
E0
F
xFA
x
0 A
y
0 A
x
0 A
为多少?
FxFA
解:⑴作图画切线,
得y0max=0.91; ⑵划ER线和FS线, 得M点,
S FM 86 0.31 F MS 278
S=0.31F=0.31×100=31kg
⑶M=F+S=131kg
R M ME 131 125 90kg
RE
182
图中读得xA=0.16 萃余百分数 RxA 90 0.16 0.48
直接精馏是否更经济 萃取适用情况:
⑴恒沸物(或α<1.05) ⑵轻组分浓度很低 ⑶热敏性物料
1.6 萃取剂的选择(过程优劣的主要因素) ⑴A在S中溶解度大 ⑵选择性高 ⑶A与S之间的相对挥发度高 ⑷S在B中的溶解度小 1.7与吸收、精馏比较 ⑴部分互溶—过程复杂性 ⑵液液系统σ, Δρ比气液系统小
—设备的复杂性 ⑶流动方式
气液—并流、逆流 液液—错流、逆流用得多
2 液液相平衡 2.1 物料衡算 三组分,用平面表示
两股料液混合时
M RE MzS RxS EyS MzA RxA EyA
均符合杠杆定律
E zA xA zS xS R yA zA yS zS
为什么和点总是在连线上,差点在延长线上?
为什么此线不会打折?
2.2 溶解度曲线
观察刚出现浑浊时的数据 先放B, 轮流加A、S 先放S, 轮流加B、A
2.3 平衡联结线和共轭相 先放B+S(M1点),逐渐加A
临界混溶点不一定在最高处
2.4 分配曲线与分配系数
分配系数:
A的:
kA
yA xA
B的:kB
yB xB
萃取相 萃余相
2.5 选择性系数β
或 B YZ
S X XF
当Y=KX, Z=0
X XF 1 SK / B
②多级错流萃取
③多级逆流萃取
Smin=?
本次讲课习题: 第十一章 1,2,3
定义 yA / yB
xA / xB
kA kB
y
0 A
x0 ABiblioteka / /yB0x
0 B
y
0 A
1
x
0 A
(
1)
x
0 A
条件?
思考: kA=1是否可进行萃取分离? β=1呢? 什么时候β=∞?
2.6 温度、压力对相平衡的影响 压力对液液相平衡影响可忽略 大多物系:温度↑,互溶度↑, 操作范围↓, yA0max↓
100 0.4 0.3 0.774 0.3
21kg
例2 某三元物系的溶解度曲线与平衡联结线如图 所示。用纯溶剂对100kg进料进行单级萃取,
xFA 0.3 (质量分率),xFS 0 ,试求: ⑴萃取液可达到的最大浓度为多少?
⑵为使萃取液浓度达到
最大,溶剂用量应为
多少?
⑶萃余百分数 RxA
第十一章 液液萃取 1 概述 1.1过程目的----液液混合物的分离 1.2工业背景 例如,磺化碱熔法制间苯二酚
1.3 基本依据—溶解度的差异(选择性的溶解度) 溶剂S的必要条件
⑴与B相不完全互溶 ⑵对A有选择性的溶解度 1.4 实施方法—液液充分接触传质、分相,
溶剂回收 1.5 主要操作费—溶剂再生
FxFA 100 0.3
3.2 多级错流萃取
观点:同样溶剂用量, 多级错流的分离效果比 单级萃取效果好, xAn低, 萃余百分数小
Rn xAn
FxFA
3.3完全不互溶物系萃取计算 B与S完全不互溶,用比质量分数X,
kgA kgB
,Y,
kgA kgS
①单级萃取
物料衡算:
S(Y Z ) B( XF X )
6个方程,解6个未知数
计算方法⑴6个方程联立 ⑵图解法(常用,简捷,计算精度不高)
MFS S FM M FS E MR M ER
例1 在B-S部分互溶的单级萃取中,料液量为
100kg, 含溶质A为40kg,其余为稀释剂B。用纯溶
剂萃取,溶剂比(S/F)为1。脱溶剂后,萃余液浓
度
x
0 A
0.3
