不同比重硫酸的凝固点
硫酸(50%工业级)(SDS)更新于20170819

化学品安全技术说明书第一部化学品及企业标识化学品中文名:硫酸化学品英文名:sulfuric acid企业名称:上海锦业环境技术有限公司企业地址:邮编:传真:联系电话: 021-********企业应急电话:第二部分危险性概述紧急情况概述:腐蚀、中毒。
GHS危险性类别:根据化学品分类、警示标签和警示性说明规范系列标准(参阅第十五部分)皮肤腐蚀/刺激-1A,严重眼睛损伤/眼睛刺激性-1,对水环境的危害-急性3,标签要素:象形图:警示词:危险危险信息:引起严重皮肤灼伤和眼睛损伤。
对水生生物有害。
防范说明:密闭操作,注意通风。
操作尽可能机械化、自动化。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴防尘面具(全面罩),穿橡胶耐酸碱服,戴橡胶耐酸碱手套。
远离易燃、可燃物。
预防措施:在得到专门指导后操作。
在未了解所有安全措施之前,切勿操作;穿耐酸防护服,戴橡胶耐酸手套及防护眼镜,禁止一切接触,接触其烟雾时,要佩戴防毒面具,避免吸入酸雾;操作后彻底清洁皮肤,污染的衣物单独存放,清洗备用;保持良好的卫生习惯。
密闭操作,注意通风;禁止排入环境。
事故响应:如果皮肤接触,立即脱去所有被污染的衣物,用大量流动清水冲洗皮肤。
污染的衣服需洗净后方可重新使用;眼睛接触,立即翻开上下眼睑,用流动清水彻底冲洗;立即就医,不得延迟;如果吸入,迅速将患者转移至空气新鲜处,休息,保持呼吸道通畅,如呼吸困难,给氧;如有呼吸系统症状的,立即进行人工呼吸,就医;食入:用水漱口,不要催吐,给饮牛奶或蛋清,就医;如果泄露,通过围堰收集起来;发生火灾时,使用干粉、二氧化碳、砂土灭火;避免水流冲击物品,以免遇水会放出大量热量发生喷溅而灼伤。
安全储存:硫酸贮罐设置明显的安全标志,保持阴凉、干燥、通风。
不与易燃或可燃物、禁配物混储。
废弃处置:泄漏物及时收容或用吸收剂覆盖,按相关法规收集处置。
禁止直接排入环境。
物理化学危害:硫酸,分子式H2SO4,分子量为98,纯粹品是无色油状液体,50%的硫酸,比重1.4(18℃)。
硫酸的理化性质及危险特性表
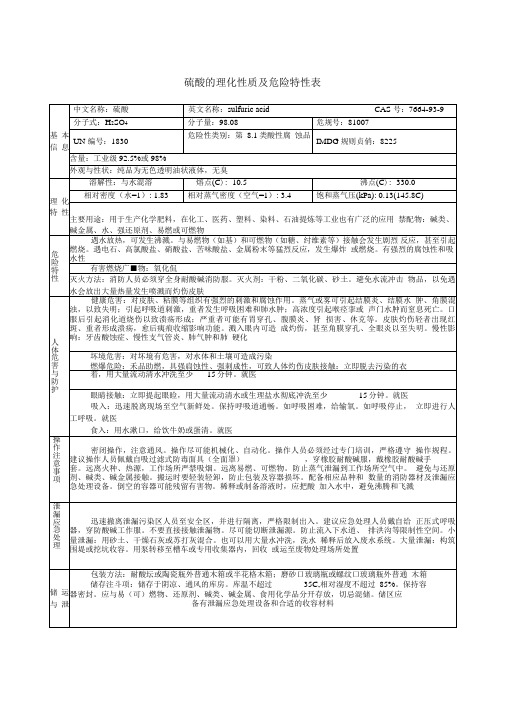
硫酸的理化性质及危险特性表
漏运输注意事项:本品铁路运输时限使用钢制企业自备罐车装运,装运前需报有关职能人员批准。
处铁路非罐装运输时应严格按照铁道部〈〈危险货物运输规则》中的危险货物配装表进行配装。
起运
理时包装要完整,装载应稳妥。
运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。
严禁与易燃物或可燃物、还原剂、碱类、碱金属、食用化学品等混装混运。
运输时运输车辆应配备泄漏应急处理设备。
运输途中应防曝晒、雨淋,防高温。
公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。
硫酸浓度与比重对照表
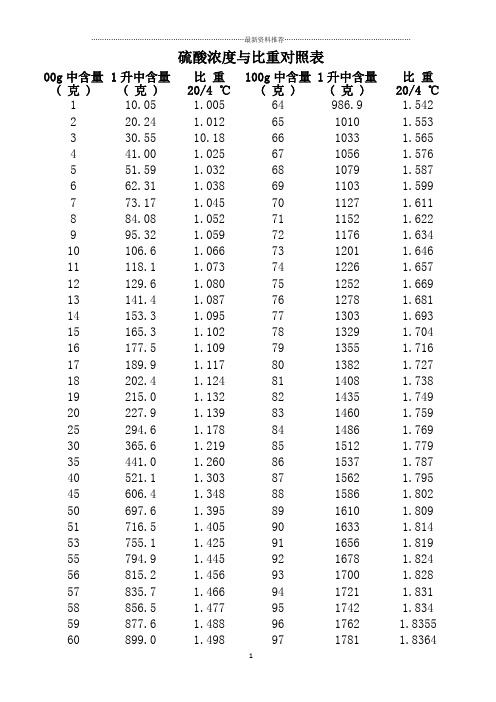
硫酸浓度与比重对照表00g中含量( 克 )1升中含量( 克 )比重20/4 ℃100g中含量( 克 )1升中含量( 克 )比重20/4 ℃1 10.05 1.005 64 986.9 1.5422 20.24 1.012 65 1010 1.5533 30.55 10.18 66 1033 1.5654 41.00 1.025 67 1056 1.5765 51.59 1.032 68 1079 1.5876 62.31 1.038 69 1103 1.5997 73.17 1.045 70 1127 1.6118 84.08 1.052 71 1152 1.6229 95.32 1.059 72 1176 1.63410 106.6 1.066 73 1201 1.64611 118.1 1.073 74 1226 1.65712 129.6 1.080 75 1252 1.66913 141.4 1.087 76 1278 1.68114 153.3 1.095 77 1303 1.69315 165.3 1.102 78 1329 1.70416 177.5 1.109 79 1355 1.71617 189.9 1.117 80 1382 1.72718 202.4 1.124 81 1408 1.73819 215.0 1.132 82 1435 1.74920 227.9 1.139 83 1460 1.759 25 294.6 1.178 84 1486 1.769 30 365.6 1.219 85 1512 1.779 35 441.0 1.260 86 1537 1.787 40 521.1 1.303 87 1562 1.795 45 606.4 1.348 88 1586 1.80250 697.6 1.395 89 1610 1.80951 716.5 1.405 90 1633 1.814 53 755.1 1.425 91 1656 1.81955 794.9 1.445 92 1678 1.82456 815.2 1.456 93 1700 1.82857 835.7 1.466 94 1721 1.83158 856.5 1.477 95 1742 1.83459 877.6 1.488 96 1762 1.835560 899.0 1.498 97 1781 1.836461 920.6 1.509 98 1799 1.836162 942.4 1.520 99 1816 1.834263 964.5 1.531 100 1831 1.8305硝酸的百分比浓度、当量浓度及比重对照表盐酸浓度与比重对照表HCL含量( 克 )比重20/4℃HCL含量( 克 )比重20/4℃100g中含量1升中含量100g中含量1升中含量1 10.03 1.003 22 243.8 1.1082 20.16 1.008 24 268.5 1.1194 40.72 1.018 26 293.5 1.1296 61.67 1. 028 28 319.0 1.1398 83.01 1.038 30 344.8 1.14910 104.7 1.047 32 371.0 1.15912 126.9 1.057 34 397.5 1.16914 149.5 1.068 36 424.4 1.17916 172.4 1.078 38 451.6 1.18918 195.8 1.088 40 479.2 1.19820 219.6 1.098磷酸浓度与比重对照表H3PO含量( 克 ) 比重20/4 ℃H3PO含量( 克 ) 比重20/4 ℃100g中含量1升中含量100g中含量1升中含量1 10.04 1.004 55 758.5 1.3793 30.49 1.014 60 855.6 1.4265 51.37 1.025 65 958.8 1.4758 83.36 1.042 70 1068 1.52610 105.3 1.053 75 1184 1.579 15 162.4 1.082 80 1306 1.633 20 222.7 1.113 85 1436 1.689 25 286.6 1.146 90 1571 1.746 30 354.2 1.180 96 1746 1.819 35 425.6 1.216 98 1807 1.844 40 501.6 1.254 100 1870 1.870 45 581.9 1.29350 667.5 1.335氯化钠溶液浓度与比重对照表%比重%比重10℃时20℃时10℃时20℃时1 1.00707 1.00534 14 1.10491 1.100852 1.01442 1.01246 16 1.12056 1.11621 4 1.02920 1.02680 18 1.13643 1.13190 6 1.04408 1.04127 20 1.15254 1.14779 8 1.05907 1.05589 22 1.16891 1.16395 10 1.07419 1.07068 24 1.18557 1.18040 12 1.08946 1.08566 26 1.20254 1.19717 脱脂、除锈、磷化工艺中出现的问题、原因及解决办法一、脱脂部分二、除锈部分硫酸比重与温度变化关系:依GB/T11198.1-11198.15ρ20 = ρt[1 + .000025(20-t) -(20-t)k]式中,ρ20 -----是20℃时的密度g/cm3ρt-----是测定时密度计指示的密度,0.000025是密度计玻璃膨胀系数t------测定时试样的温度K-----试样密度的温校正系数,如下表序号比重范围K 备注1 1.151~1.200 0.00072 1.221~1.420 0.00083 1.421~1.560 0.00094 1.561~1.700 0.0015 1.701~1.770 0.00116 1.771~1.840 0.0012三、磷化部分。
硫酸技术操作规程

硫酸技术操作规程一、产品说明一、产品特性:硫酸的最冲要的基本化学工业产品之一,外观为无色透明的油状液体。
广泛应用于化肥、合成纤维、国防军工、冶金、石油化工个医药工业部门。
1.硫酸的化学组成:分子式:H2SO4分子量:98.08O‖分子结构式:H O—S—OH‖O发烟硫酸分子式:H2SO4·xSO3O O‖‖发烟硫酸分子结构式:HO—S—O—S—OH‖‖O O2.硫酸的物理性质:(1)硫酸是SO3与水的化合物,其外观为一种无色透明油状液体。
(2)密度:硫酸水溶液的密度随着硫酸含量的增加而增大,至98.3%时达最大值,过后则逐渐降低,至100%硫酸时为止,发烟硫酸的密度随游离SO3含量增加而增大。
表一硫酸水溶液的密度(20℃时)图一三氧化硫水溶液在40℃时的密度变化硫酸的密度随温度的升高而减小,其密度与温度的关系数据见表二:(3)结晶温度:硫酸水溶液与烟硫酸的结晶温度随着硫酸含量的不同而在一个较大的范围内曲折波动,表三所示我厂几种不同产品硫酸及发烟硫酸的结晶温度。
(4)蒸汽压:在一定温度下硫酸溶液上总蒸汽压随硫酸含量的增大而降低,在98.3%时最低。
而发烟硫酸则随着SO3量的增大总蒸汽压值就会增加,同时,硫酸的蒸汽压随温度的升高而增大。
表四为硫酸及发烟硫酸的蒸汽总压力毫米汞柱。
(5)沸点硫酸水溶液的沸点是随硫酸含量的增大而逐渐上升的,直至硫酸浓度达到98.3%时,沸点338.8℃时为最大值。
过后再继续增加硫酸含量,则沸点下降。
100%硫酸的沸点为279.9℃的发烟硫酸的沸点是随游离三氧化硫含量的增加而逐渐降低至44.7℃(即三氧化硫的沸点)为止。
图二硫酸与发烟硫酸的沸点[在760m/m汞柱时]我厂硫酸产品的沸点如下:硫酸水溶液与发烟硫酸的粘度随着其中硫酸含量的不同而不同,它们都随着温度的降低而增加。
表五硫酸粘度与温度的关系(7)比热容硫酸溶液的比热随着浓度的增加而逐渐减小,至酸浓度为100%时为最小。
硫酸MSDS

硫酸MSDS硫酸是一种无色无味的油状液体,是一种高沸点难挥发的强酸,能以任意比例与水混溶。
作为基本化学工业中的重要产品之一,硫酸不仅是许多化工产品的原料,还广泛应用于其他国民经济部门。
它是化学六大无机强酸之一,也是所有酸中最常见的强酸之一。
硫酸的物理性质包括:无色无味澄清粘稠油状液体,浓硫酸的密度为1.84g/mL,摩尔质量为98g/mol,物质的量浓度为18.4mol/L,相对密度为1.84,沸点为338℃,凝固点为在10℃下无水酸,98%硫酸在3℃时凝固。
浓硫酸溶解时放出大量的热,因此稀释时应该“酸入水,沿器壁,慢慢倒,不断搅。
”硫酸也是良好的干燥剂,用以干燥酸性和中性气体,如CO₂,H₂,N₂,NO₂,HCl,SO₂等。
硫酸的化学性质包括:脱水性、强氧化性、难挥发性和强酸性。
它主要用于生产化学肥料,在化工、医药、塑料、染料、石油提炼等工业也有广泛的应用。
在使用硫酸的过程中,需要注意其危险性。
浓硫酸稀释时应该小心操作,避免酸液飞溅造成安全隐患。
同时,硫酸也是易制毒、易制爆的化学品,受公安部门管制。
如果误食或接触硫酸,应立即进行急救措施。
皮肤接触:如果大量硫酸与皮肤接触,应先用干布吸去,但不要用力按或擦,以免擦掉皮肤。
少量硫酸接触则无需使用干布。
然后应用大量冷水冲洗,并用3%-5%碳酸氢钠溶液冲洗。
用大量冷水冲洗剩余的液体,最后再用NaHCO3溶液涂于患处,最后用0.01%的苏打水(或稀氨水)浸泡。
最好就医。
眼睛接触:如果接触到硫酸,应立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
最好就医。
吸入:如果吸入硫酸,应迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如果呼吸困难,应给输氧。
如果呼吸停止,应立即进行人工呼吸。
最好就医。
食入:如果误食硫酸,应用水漱口,并给饮牛奶或蛋清。
最好就医。
消防措施:硫酸遇水会放热,可能发生沸溅。
与易燃物(如苯)和可燃物(如糖、纤维素等)接触会发生剧烈反应,甚至引起燃烧。
硫酸常识

硫酸(化学式:H₂SO₄),硫的最重要的含氧酸。
无水硫酸为无色油状液体,10.36℃时结晶,通常使用的是它的各种不同浓度的水溶液,用塔式法和接触法制取。
前者所得为粗制稀硫酸,质量分数一般在75%左右;后者可得质量分数98.3%的纯浓硫酸,沸点338℃,相对密度1.84。
硫酸是一种最活泼的二元无机强酸,能和许多金属发生反应。
高浓度的硫酸有强烈吸水性,可用作脱水剂,碳化木材、纸张、棉麻织物及生物皮肉等含碳水化合物的物质。
与水混合时,亦会放出大量热能。
其具有强烈的腐蚀性和氧化性,故需谨慎使用。
是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等,也广泛应用于净化石油、金属冶炼以及染料等工业中。
常用作化学试剂,在有机合成中可用作脱水剂和磺化剂。
硫酸发现于公元8世纪。
阿拉伯炼丹家贾比尔通过干馏硫酸亚铁晶体得到硫酸。
一些早期对化学有研究的人,如拉齐、贾比尔等,还写了有关硫酸及与其相关的矿物质的分类名单;其他一些人,如伊本·西那医师,则较为重视硫酸的种类以及它们在医学上的价值。
[1]在17世纪,德国化学家Johann Rudolf Glauber将硫与硝酸钾混合蒸汽加热制出硫酸,在这过程中,硝酸钾分解并氧化硫令其成为能与水混合并变为硫酸的三氧化硫(SO3)。
于是,在1736年,伦敦药剂师Joshua Ward用此方法开拓大规模的硫酸生产。
在1746年,John Roebuck则运用这个原则,开创铅室法,以更低成本有效地大量生产硫酸。
经过多番的改良后,这个方法在工业上已被采用了将近两个世纪。
[2] 由John Roebuck创造的这个生产硫酸的方法能制造出浓度为65%的硫酸,后来,法国化学家约瑟夫·路易·盖-吕萨克以及英国化学家John Glover将其改良,使其能制造出浓度高达78%的硫酸,可是这浓度仍不能满足一些工业上的用途。
约翰·道尔顿在1808年绘制的早期硫酸分子图在18世纪初,硫酸的生产都依赖以下的方法:黄铁矿(FeS2)被燃烧成硫酸亚铁(FeSO4),然后再被燃烧,变为能在480℃下分解成氧化铁以及能用以制造任何浓度硫酸的三氧化硫的硫酸铁[Fe2(SO4)3]。
硫酸浓度与比重对照表格

硫酸浓度与比重对照表100g中含量( 克 )1升中含量( 克 )比重20/4 ℃100g中含量( 克 )1升中含量( 克 )比重20/4 ℃1 10.05 1.005 64 986.9 1.5422 20.24 1.012 65 1010 1.5533 30.55 10.18 66 1033 1.5654 41.00 1.025 67 1056 1.5765 51.59 1.032 68 1079 1.5876 62.31 1.038 69 1103 1.5997 73.17 1.045 70 1127 1.6118 84.08 1.052 71 1152 1.6229 95.32 1.059 72 1176 1.63410 106.6 1.066 73 1201 1.64611 118.1 1.073 74 1226 1.65712 129.6 1.080 75 1252 1.66913 141.4 1.087 76 1278 1.68114 153.3 1.095 77 1303 1.69315 165.3 1.102 78 1329 1.70416 177.5 1.109 79 1355 1.71617 189.9 1.117 80 1382 1.72718 202.4 1.124 81 1408 1.73819 215.0 1.132 82 1435 1.74920 227.9 1.139 83 1460 1.759 25 294.6 1.178 84 1486 1.769 30 365.6 1.219 85 1512 1.779 35 441.0 1.260 86 1537 1.787硝酸的百分比浓度、当量浓度及比重对照表盐酸浓度与比重对照表HCL含量( 克 )比重20/4℃HCL含量( 克 )比重20/4℃100g中含量1升中含量100g中含量1升中含量1 10.03 1.003 22 243.8 1.1082 20.16 1.008 24 268.5 1.1194 40.72 1.018 26 293.5 1.1296 61.67 1. 028 28 319.0 1.1398 83.01 1.038 30 344.8 1.14910 104.7 1.047 32 371.0 1.15912 126.9 1.057 34 397.5 1.16914 149.5 1.068 36 424.4 1.17916 172.4 1.078 38 451.6 1.18918 195.8 1.088 40 479.2 1.19820 219.6 1.098 磷酸浓度与比重对照表H3PO含量( 克 ) 比重20/4 ℃H3PO含量( 克 ) 比重20/4 ℃100g中含量1升中含量100g中含量1升中含量1 10.04 1.004 55 758.5 1.3793 30.49 1.014 60 855.6 1.4265 51.37 1.025 65 958.8 1.4758 83.36 1.042 70 1068 1.52610 105.3 1.053 75 1184 1.57915 162.4 1.082 80 1306 1.63320 222.7 1.113 85 1436 1.68925 286.6 1.146 90 1571 1.74630 354.2 1.180 96 1746 1.81935 425.6 1.216 98 1807 1.84440 501.6 1.254 100 1870 1.87045 581.9 1.29350667.5 1.335氯化钠溶液浓度与比重对照表%比 重%比 重10℃时 20℃时 10℃时20℃时 1 1.00707 1.00534 14 1.10491 1.10085 2 1.01442 1.01246 16 1.120561.11621 4 1.02920 1.02680 18 1.13643 1.13190 6 1.04408 1.04127 20 1.15254 1.14779 8 1.05907 1.05589 22 1.16891 1.16395 10 1.07419 1.07068 24 1.18557 1.18040 121.089461.08566261.202541.19717脱脂、除锈、磷化工艺中出现的问题、原因及解决办法一、脱脂部分二、除锈部分硫酸比重与温度变化关系:依GB/T11198.1-11198.15ρ20 = ρt[1 + .000025(20-t) -(20-t)k]式中,ρ20 -----是20℃时的密度g/cm3ρt-----是测定时密度计指示的密度,0.000025是密度计玻璃膨胀系数t------测定时试样的温度K-----试样密度的温校正系数,如下表序号比重围K备注1 1.151~1.2000.00072 1.221~1.4200.00083 1.421~1.5600.00094 1.561~1.7000.0015 1.701~1.7700.00116 1.771~1.8400.0012三、磷化部分。
硫酸工艺操作规程

熔硫岗位安全操作规程1.硫磺的性质随温度的不同,硫磺呈多种状态存在,常温下为固体,不溶于水,但溶于二硫化碳。
1.1融点118.9℃ 1.5自然点260-450℃1.2凝固点114.5℃ 1.6闪点225℃1.3沸点444.6℃ 1.7真比重 1.92-2.071.4燃点250℃ 1.8假比重 1.2351.11液体硫磺的温度超过157℃粘度急剧上升,达到188℃时,便几乎不能流动,所以,快速熔硫槽、锥形沉降槽、液硫大罐和液硫管线的温度必须控制在120-155℃的范围内,本规程规定135-145℃。
1.12硫磺粉尘爆炸极限35g/Nm3。
2.岗位任务与管理范围2.1岗位任务2.1.1将原料岗位送来的固体硫磺在快速熔硫槽内熔化为液体硫磺。
2.1.2将沉降、澄清后的液体硫磺经粗硫泵送入液硫过滤器,经过过滤后送入液硫大罐(5000t)。
2.1.3保证快速熔硫槽、锥形沉降槽、澄清池、液硫大罐、硫磺管线内的温度在135-145℃之间,保证以上设备内的液硫液位。
2.1.4负责液硫过滤器的开、停,停下后应及时进行反吹。
2.1.5保持液硫大罐的液硫液位,保证为焚硫岗位提供充足的液体硫磺。
2.1.6每小时检查设备、管道,发现问题及时向值班工长汇报。
2.1.7所有记录应及时、准确、整洁、字迹工整。
2.1.8做好所属区域内的清理卫生工作,做到安全文明生产。
2.2管理范围:2.2.1两台快速熔硫槽及其搅拌。
2.2.2四台锥形沉降槽。
2.2.3澄清池及两台粗硫泵。
2.2.4四台液硫过滤器。
2.2.5液硫大罐。
2.2.6蒸汽加热管线、盘管、带蒸汽夹套的输硫管线、水管线、阀门、电器、仪表、安全装置,以及上述范围内的建筑物。
3.工艺流程与操作指标3.1工艺流程(文字说明)3.1.1固体硫磺→两台快速熔硫槽→四台锥形沉降槽→澄清池→粗硫泵→四台液硫过滤器→液硫大罐→精硫泵至焚硫炉3.1.2工艺流程说明3.1.2.1由原料岗位送来的固体硫磺经胶带机加入快速熔硫槽(V201a、b)中,经蒸汽间接加热熔融后成为液体硫磺,经溢流管线溢流至锥形沉降槽(V202a、b)进行一次沉降,再溢流进入锥形沉降槽(V202c、d)进行二次沉降以除去硫磺中的大颗粒杂质。
硫酸浓度与比重对照表

硫酸浓度与比重对照表 Revised as of 23 November 2020硫酸浓度与比重对照表100g中含量(克)1升中含量(克)比重20/4℃100g中含量(克)1升中含量(克)比重20/4℃1642651010 3661033 4671056 5681079 6691103 7701127 8711152 9721176 10731201 11741226 12751252 13761278 14771303 15781329 16791355 17801382 18811408 19821435 20831460 25841486 30851512 35861537 40871562 45881586 50891610 51901633 53911656 55921678 56931700 5794172158951742 59961762 60971781 61981799 62991816 631001831硝酸的百分比浓度、当量浓度及比重对照表盐酸浓度与比重对照表HCL含量(克)比重20/4℃HCL含量(克)比重20/4℃100g中含量1升中含量100g中含量1升中含量1222244266288301032123414361638184020磷酸浓度与比重对照表H3PO含量(克)比重20/4℃H3PO含量(克)比重20/4℃100g中含量1升中含量100g中含量1升中含量15536056587010681075118415801306208514362590157130961746359818074010018704550氯化钠溶液浓度与比重对照表%比重%比重10℃时20℃时10℃时20℃时114 216 418 62082210241226脱脂、除锈、磷化工艺中出现的问题、原因及解决办法一、脱脂部分二、除锈部分硫酸比重与温度变化关系:依GB/ρ20=ρt[1+.000025(20-t)-(20-t)k]式中,ρ20-----是20℃时的密度g/cm3ρt-----是测定时密度计指示的密度,是密度计玻璃膨胀系数t------测定时试样的温度K-----试样密度的温校正系数,如下表序号比重范围K备注1~2~3~4~5~6~三、磷化部分。
硫酸

硫酸硫酸(化学式:H2SO4),是硫的最重要的含氧酸,酸性强。
无水硫酸为无色油状液体,10.36℃时结晶。
通常使用的是它的各种不同浓度的水溶液,用塔式法和接触法制取。
前者所得为粗制稀硫酸,质量分数一般在75%左右;后者可得质量分数98.3%的浓硫酸,沸点338℃,相对密度1.84。
硫酸是一种最活泼的二元无机强酸,能和绝大多数金属发生反应。
高浓度的硫酸有强烈吸水性,可用作脱水剂,碳化木材、纸张、棉麻织物及生物皮肉等含碳水化合物的物质。
与水混合时,亦会放出大量热能。
其具有强烈的腐蚀性和氧化性,故需谨慎使用。
是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等,也广泛应用于净化石油、金属冶炼以及染料等工业中。
常用作化学试剂,在有机合成中可用作脱水剂和磺化剂。
中文名硫酸分子式H₂SO₄标况状态透明无色无臭液体熔点10.371 ℃溶解度与水任意比互溶动态粘滞度0.021 Pa s (25℃) 外文名Sulfuric acid分子量98.078密度 1.8305 g/cm³沸点337 ℃蒸汽压6×10⁻⁵mmHg 表面张力0.0735 N/m目录•1发现历史•2存在情况•地球•金星•木卫二•3物理性质•浓度的差异•极性与导电性•4化学性质•腐蚀性•浓硫酸特性•稀硫酸特性•5制备方法•实验室制法•工业制法•其他制备工艺•6应用领域•工业用途•农业用途•日常家居用途•7毒理性质•实验室风险•工业风险•急救措施•8储存方法1发现历史硫酸发现于公元8世纪。
阿拉伯炼丹家贾比尔通过干馏硫酸亚铁晶体得到硫酸。
一些早期对化学有研究的人,如拉齐、贾比尔等,还写了有关硫酸及与其相关的矿物质的分类名单;其他一些人,如伊本·西那医师,则较为重视硫酸的种类以及它们在医学上的价值。
在17世纪,德国化学家Johann Rudolf Glauber将硫与硝酸钾混合蒸汽加热制出硫酸,在这过程中,硝酸钾分解并氧化硫令其成为能与水混合并变为硫酸的三氧化硫(SO3)。
硫酸性质

物理性质:纯净的浓硫酸是一种无色透明的油状粘稠液体,几乎比水重一倍,98%酸的比重为1.83。
工业上的硫酸系指SO3与水以任何比例溶合的溶液。
如果SO3和水的分子比小与1,就是硫酸的水溶液;分子比大于1,称为发烟硫酸。
硫酸浓度的表示方法:硫酸浓度的表示法,是以其中所含H2SO4的重量百分数来表示的。
发烟硫酸是以其中所含游离SO3或者以所含总的SO3的百分数来表示的。
1.2.1 温度硫酸的结晶温度随浓度的不同在一个较大的范围曲折波动,84.48%~93.77%硫酸结晶温度在8.56℃~-34.86℃之间,94%~100%硫酸结晶温度在-31.9℃~10.371℃之间,84.48%~93.77%硫酸结晶温度随硫酸浓度升高结晶温度降低。
94%~100%硫酸结晶温度随硫酸浓度升高而升高,93%酸和98%酸结晶温度分别为-27℃和-0.7℃。
1.2.2 密度浓度在98.3%以下硫酸水溶液的密度随浓度升高而增大,98.3%时达到最大值,过后则递减。
发烟硫酸的密度也随其中SO3含量升高而增大,SO3达62%时为最大值,过此之后则减小。
1.2.3 沸点浓度小98.3%时,沸点随浓度升高而升高,98.3%时最高(336℃),之后酸浓度上升,沸点反而下降,100%硫酸沸点为296.2℃。
1.2.4 硫酸表面的蒸汽组成硫酸溶液上面的总蒸汽压,随着硫酸浓度的增大而降低,且在98.3%时为最低,浓度超过98.3%总蒸汽压随浓度升高而增大。
在同样浓度下,硫酸溶液上面的总蒸汽压随温度升高而增大。
浓硫酸的平衡水蒸汽压力很低,40℃时92%硫酸液面上的平衡水蒸汽压力小于0.02mmHg,是同一温度下的饱和水蒸汽压力的1/3000。
所以浓硫酸广泛用做干燥剂。
硫酸液面的气相中有H2SO4、SO3、H2O,它们之间存在下列反应:H2SO4 = SO3+H2O硫酸蒸汽的分解程度随温度的升高而加大,随压力的上升而降低。
在常压、常温下,硫酸蒸汽的分解实际很少。
硫酸比重与浓度 冰点-概述说明以及解释

硫酸比重与浓度冰点-概述说明以及解释1.引言1.1 概述硫酸是一种重要的无机酸,其浓度和比重是化学领域中常用的参数。
浓度是指溶液中溶质所占的比例,而比重则是指物体与等体积纯水相比的重量比值。
硫酸的浓度和比重之间存在着紧密的关系,其变化规律受多种因素影响。
在本文中,我们将重点探讨硫酸比重与浓度以及硫酸浓度与冰点之间的关系。
首先,我们将介绍硫酸的性质和特点,包括其化学组成、物理性质和常见的用途。
随后,我们将详细讨论硫酸浓度与比重的变化规律,探究不同浓度下硫酸的比重变化情况。
接着,我们会引入冰点的概念及影响因素,并研究硫酸浓度对冰点的影响。
通过实验研究,我们将探讨不同浓度的硫酸在低温下的冰点,以及可能导致冰点变化的原因。
最后,在结论部分,我们将总结硫酸比重与浓度的关系,并得出结论。
同时,我们也会总结硫酸浓度与冰点之间的关系,并对未来的研究方向进行展望。
通过深入研究硫酸比重与浓度、硫酸浓度与冰点的关系,我们将有助于更好地理解硫酸的特性和应用,并为相关领域的研究提供参考和借鉴。
1.2 文章结构文章结构部分的内容如下:文章结构:本文主要以硫酸的比重和浓度以及其与冰点之间的关系为研究对象,分为引言、正文和结论三部分。
引言部分将对本文的研究目的、概述和文章结构进行介绍。
首先,本文将通过实验和理论研究探讨硫酸的比重与浓度之间的关系,并研究硫酸浓度与冰点的关系。
其次,本文将通过总结和分析相关研究成果,得出关于硫酸比重与浓度、硫酸浓度与冰点的结论,并对未来的研究进行展望。
正文部分分为两个主要章节:硫酸比重与浓度的关系和硫酸浓度与冰点的关系。
在第一章节中,将探讨硫酸的性质和特点,解释硫酸浓度与比重的变化规律。
在第二章节中,将介绍冰点的概念和影响因素,以及进行硫酸浓度与冰点的实验研究。
结论部分将对整篇文章进行总结。
首先,对硫酸比重与浓度的关系进行总结,说明硫酸浓度与比重之间的变化规律。
然后,对硫酸浓度与冰点的关系进行总结,指出浓度对冰点的影响。
