共沸精馏实验报告
共沸精馏实验报告

化工专业实验报告实验名称:共沸精馏实验人员:江成林同组人:母晓群、黄菲实验地点:天大化工技术实验中心624 室实验时间:2012年4月19日班级/学号:2009 级化工1 班3 组3009209064号指导教师:陈艳英实验成绩:共沸精馏一、实验目的1.通过实验加深对共沸精馏过程的理解;2.熟悉精馏设备的构造,掌握精馏操作方法;3.能够对精馏过程做全塔物料衡算;4.学会使用气相色谱分析气、液两相组成。
二、实验原理精馏是利用不同组份在气-液两相间的分配,通过多次气液两相间的传质和传热来达到分离的目的。
对于不同的分离对象,精馏方法也会有所差异。
例如,分离乙醇和水的二元物系。
由于乙醇和水可以形成共沸物,而且常压下的共沸温度和乙醇的沸点温度极为相近,所以采用普通精馏方法只能得到乙醇和水的混合物,而无法得到无水乙醇。
为此,在乙醇-水系统中加入第三种物质,该物质被称为共沸剂。
共沸剂具有能和被分离系统中的一种或几种物质形成最低共沸物的特性。
在精馏过程中共沸剂将以共沸物的形式从塔顶蒸出,塔釜则得到无水乙醇。
这种方法就称作共沸精馏。
乙醇-水系统加入共沸剂苯以后可以形成四种共沸物。
现将它们在常压下的共沸温度、共沸组成列于表1。
为了便于比较,再将乙醇、水、苯三种纯物质常压下的沸点列于表2。
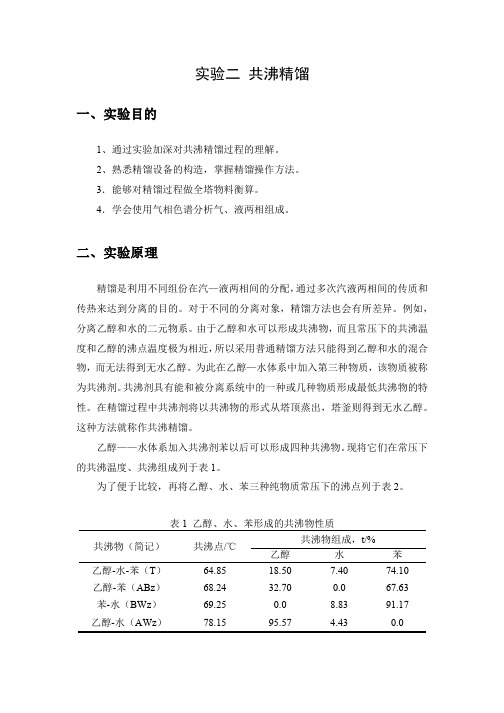
表1 乙醇水-苯三元共沸物性质共沸物(简记)共沸点/℃共沸物组成,t%乙醇水苯乙醇-水-苯(T)64.85 18.5 7.4 74.1乙醇-苯(ABZ)68.24 32.7 0.0 67.63苯-水(BWZ)69.25 0.0 8.83 91.17乙醇-水(AWZ)78.15 95.57 4.43 0.0表2 乙醇、水、苯的常压沸点物质名称(简记)乙醇(A)水(W)苯(B)沸点温度(℃)78.3 100 80.2从表1和表2列出沸点看,除乙醇-水二元共沸物的共沸物与乙醇沸点相近之外,其余三种共沸物的沸点与乙醇沸点均有10℃左右的温度差。
化工实验之 共 沸 精 馏
时间
组分 水
保留时间 /min 0.075 0.227 1.925 0.080 0.273 1.999 0.092 0.277 2.256 0.087 0.255 0.056 0.237 0.090 0.291
峰面积 /μ V ∗ s 6655 135896 74844 5654 173385 56104 4513 208657 12121 6841 349285 6381 329586 3261 176856
塔釜液中乙醇含量:70.93 × 0.8836 = 62.67g 则塔内残余乙醇的含量为:76.30 − 4.43 − 4.44 − 62.67 = 4.76g ⑵对塔内苯进行物料衡算 原料液中苯含量 41.21g
富水相中苯含量: X苯 1 = 29922 × 1.273 = 0.1557 90212 × 0.755 + 138460 × 1 + 29922 × 1.273
三、装置、流程及试剂
1.装置 本实验所用的精馏塔为内径Ф 20×200mm的玻璃塔。内装Ө网环型Ф 2×2 mm的高效散 装填料。填料层高度1.2m。 塔釜为一只结构特殊的三口烧瓶。上口与塔身相连:侧口用于投料和采样;下口为出料 口;釜侧玻璃套管插入一只测温热电阻,用于测量塔釜液相温度,釜底玻璃套管装有电加热 棒,采用电加热,加热釜料,并通过一台自动控温仪控制加热温度,使塔釜的传热量基本保 持不变。 塔釜加热沸腾后产生的蒸汽经填料层到达塔顶全凝器。 为了满足各种不同操作方式 的需要,在全凝器与回流管之间设置了一个特殊构造的容器。在进行分相回流时,它可以用 作分相器兼回流比调节器;当进行混相回流时,它又可以单纯地作为回流比调节器使用。这 样的设计既实现了连续精馏操作,又可进行间歇精馏操作。 此外, 需要特别说明的是在进行分相回流时, 分相器中会出现两层液体。 上层为富苯相、 下层为富水相。实验中,富苯相由溢流口回流入塔,富水相则采出。当间歇操作时,为了保
共沸精馏
共沸精馏一、实验目的:1.通过实验加深对共沸精馏过程的理解。
2.熟悉精馏设备的构造,掌握精馏操作方法。
3.能够对精馏过程做全塔物料衡算。
4.学会使用气相色谱分析气、液两相组成。
二、实验原理:精馏是利用不同组份在气一液两相间的分配,通过多次气液两相间的传质和传热来达到分离的目的。
对于不同的分离对象,精馏方法也会有所差异。
例如,分离乙醇和水的二元物系。
由于乙醇和水可以形成共沸物,而且常压下的共沸温度和乙醇的沸点温度极为相近,所以采用普通精馏方法只能得到乙醇和水的混合物,而无法得到无水乙醇。
为此,在乙醇一水系统中加入第三种物质,该物质被称为共沸剂。
共沸剂具有能和被分离系统中的一种或几种物质形成最低共沸物的特性。
在精馏过程中共沸剂将以共沸物的形式从塔顶蒸出,塔釜则得到无水乙醇。
这种方法就称作共沸精馏。
乙醇—水系统加入共沸剂苯以后可以形成四种共沸物。
现将它们在常压下的共沸温度、共沸组成列于表1。
为了便于比较,再将乙醇、水、苯三种纯物质常压下的沸点列于表2。
表1-1 乙醇—水—苯三元共沸物性质表1-2 乙醇、水、苯常压沸点从表1和表2列出沸点看,除乙醇一水二元共沸物的共沸点与乙醇沸点相近之外,其余三种共沸物的沸点与乙醇沸点均有10℃左右的温度差。
因此,可以设法使水和苯以共沸物的方式从塔顶分离出来,塔釜则得到无水乙醇。
整个精馏过程可以用图1 来说明。
图中A、B、W分别为乙醇、苯和水的英文字头;AB Z、AW Z、BW Z代表三个二元共沸物,T表示三元共沸物。
图中的曲线为25℃下乙醇、水、苯三元混合物的溶解度曲线。
该曲线下方为两相区,上方为均相区。
图中标出的三元共沸组成点T是处在两相区内。
以T为中心,连接三种纯物质A、B、w及三个二元共沸点组成点AB Z、AW Z、BW Z,将该图分为六个小三角形。
如果原料液的组成点落在某个小三角形内。
当塔顶采用混相回流时精馏的最终结果只能得到这个小三角形三个顶点所代表的物质。
共沸精馏 曹新月
22437 103431 13804 38889 162020 24994
16.06428 74.05234 9.88338 17.21478 71.72136 11.06387
组分质量/g 乙醇:10.03g 水:1.99g 苯:2.08g
计算举例:
标准液中水浓度 =
水的峰面积*$%
(1)
水的峰面积*$%&乙醇的峰面积&苯的峰面积*$'
12 加料口; 13 出料口
图 2 共沸精馏实验装置
本实验所用的精馏塔为内径Ф20mm 的玻璃塔。内装三角螺旋高效散装填料。 填料层高度 1.2m。
塔釜为一只结构特殊的三口烧瓶。上口与塔身相连:侧口用于投料和采样; 下口为出料口;釜侧玻璃套管插入一只测温热电阻,用于测量塔釜液相温度,釜 底玻璃套管装有电加热棒,采用电加热,加热釜料,并通过一台自动控温仪控制 加热温度,使塔釜的传热量基本保持不变。塔釜加热沸腾后产生的蒸汽经填料层 到达塔顶全凝器。为了满足各种不同操作方式的需要,在全凝器与回流管之间设 置了一个特殊构造的容器。在进行分相回流时,它可以用作分相器兼回流比调节 器;当进行混相回流时,它又可以单纯地作为回流比调节器使用。这样的设计既 实现了连续精馏操作,又可进行间歇精馏操作。
乙醇-苯(ABz)
68.24
32.70
0.0
67.63
苯-水(BWz)
69.25
0.0
8.83
91.17
乙醇-水(AWz)
78.15
95.57
4.43
0.0
物质名称(简记) 沸点温度/℃
表 2 乙醇、水、苯的常压沸点
乙醇(A)
水(W)
78.30
100.0
天津大学—共沸精馏实验研究报告

个人收集整理仅供参考学习目录一、实验目地二、实验原理 (3) (3)三、装置、流程及试剂 (4)3.1 装置 (4)3.2 流程 (4)3.3 试剂 (5)四、实验步骤 (5)五、原始数据记录表 (6)六、数据处理 (8)6.1 全塔物料衡算及塔顶三元共沸物地组成分析 (8)1> 对塔内水进行物料衡算 (8)2> 对塔内乙醇进行物料衡算 (8)3> 对塔内苯进行物料衡算 (8)4> 塔内总持液量衡算 (9)5> 对物料衡算结果地分析 (9)6> 塔顶三元共沸物组成计算 (9)6.2 25℃下乙醇一水一苯三元物系地溶解度曲线及简要说明 (10)七、思考题 (11)7.1 共沸物加入量地计算 (11)7.2 全塔物料衡算所需地实验数据 (11)7.3 三元共沸物组成地误差及其分析 (11)一、实验目地1> 通过实验加深对共沸精馏过程地理解;2> 熟悉精馏设备地构造,掌握精馏操作方法;3> 能够对精馏过程做全塔物料衡算;4> 学会使用气相色谱分析气、液两相组成;二、实验原理精馏是利用不同组份在气 -液两相间地分配,通过多次气液两相间地传质和传热来达到分离地目地 .对于不同地分离对象,精馏方法也会有所差异 .例如,分离乙醇和水地二元物系 .由于乙醇和水可以形成共沸物,而且常压下地共沸温度和乙醇地沸点温度极为相近,所以采用普通精馏方法只能得到乙醇和水地混合物,而无法得到无水乙醇 .为此,在乙醇 -水系统中加入第三种物质,该物质被称为共沸剂 .共沸剂具有能和被分离系统中地一种或几种物质形成最低共沸物地特性.在精馏过程中共沸剂将以共沸物地形式从塔顶蒸出,塔釜则得到无水乙醇.这种方法就称作共沸精馏 .b5E2RGbCAP乙醇 -水系统加入共沸剂苯以后可以形成四种共沸物.现将它们在常压下地共沸温度、共沸组成列于表 1.为了便于比较,再将乙醇、水、苯三种纯物质常压下地沸点列于表 2.表 1 乙醇水 - 苯三元共沸物性质共沸物(简记)共沸点/℃共沸物组成, t%乙醇水苯乙醇- 水- 苯(T)64.8518.57.474.1 Z68.2432.70.067.63乙醇- 苯(AB)苯- 水( BW Z)69.250.08.8391.17乙醇 - 水( AW Z)78.1595.57 4.430.0物质名称(简记)表2 乙醇、水、苯地常压沸点乙醇( A)水(W)苯( B)沸点温度(℃)78.310080.2从表1和表2列出沸点看,除乙醇- 水二元共沸物地共沸物与乙醇沸点相近之外,其余三种共沸物地沸点与乙醇沸点均有10℃左右地温度差 . 因此,可以设法使水和苯以共沸物地方式从塔顶分离出来,塔釜则得到无水乙醇 . p1EanqFDPw整个精馏过程可以用图 1来说明 . 图中 A、B、W分别为乙醇、苯和水地英文字头; AB,AW,BW代表三个二元个人收集整理仅供参考学习水、苯三元共沸物地溶解度曲线 . 该曲线地下方为两相区,上方为均相区 . 图中标出地三元共沸组成点 T是处在两相区内 . DXDiTa9E3d以T为中心,连接三种纯物质 A、B、W及三个二元共沸点组成点 AB Z、AW Z、BW Z,将该图分为六个小三角形 . 如果原料液地组成点落在某个小三角形内 . 当塔顶采用混相回流时精馏地最终结果只能得到这个小三角形三个顶点所代表地物质 . 故要想得到无水乙醇,就应该保证原料液地组成落在包含顶点 A地小三角形内,即在 ATAB Z或 ATAW Z内 . 从沸点看,乙醇 - 水地共沸点和乙醇地沸点仅差 0.15 ℃,就本实验地技术条件无法将其分开 . 而乙醇 - 苯地共沸点与乙醇地沸点相差10.06 ℃,很容易将它们分离开来 . 所以分析地最终结果是将原料液地组成控制在ATAB Z中. RTCrpUDGiT图1中F代表未加共沸物时原料乙醇、水混合物地组成 . 随着共沸剂苯地加入,原料液地总组成将沿着 FB连线变化,并与 AT线交于 H点,这时共沸剂苯地加入量称作理论共沸剂用量,它是达到分离目地所需最少地共沸剂量. 5PCzVD7HxA 上述分析只限于混相回流地情况,即回流液地组成等于塔顶上升蒸汽组成地情况 . 而塔顶采用分相回流时,由于富苯相中苯地含量很高,可以循环使用,因而苯地用量可以低于理论共沸剂地用量 . 分相回流也是实际生产中普遍采用地方. jLBHrnAILg法 . 它地突出优点是共沸剂地用量少,共沸剂提纯地费用低三、装置、流程及试剂3.1 装置本实验所用地精馏塔为内径Ф20× 200mm 地玻璃塔 .内装有经改装后地高效散装填料(型号未知) .填料层高度约为 1.2m.xHAQX74J0X塔釜为一只结构特殊地三口烧瓶 .上口与塔身相连:侧口用于投料和采样;下口为出料口;釜侧玻璃套管插入一只测温热电阻,用于测量塔釜液相温度,釜底玻璃套管装有电加热棒,采用电加热,加热釜料,并通过一台自动控温仪控制加热温度,使塔釜地传热量基本保持不变 .塔釜加热沸腾后产生地蒸汽经填料层到达塔顶全凝器 .为了满足各种不同操作方式地需要,在全凝器与回流管之间设置了一个特殊构造地容器.在进行分相回流时,它可以用作分相器兼回流比调节器;当进行混相回流时,它又可以单纯地作为回流比调节器使用.LDAYtRyKfE 此外,需要特别说明地是在进行分相回流时,分相器中会出现两层液体 .上层为富苯相、下层为富水相 .实验中,富苯相由溢流口回流入塔,富水相则采出 . 由于本实验只做间歇操作,为了保证有足够高地溢流液位,富水相应在实验结束后取出 .Zzz6ZB2Ltk3.2 流程具体试验流程见图 2 所示 .3.3 试剂本实验所用地实验试剂为乙醇80.0g 和苯 37.1g.四、实验步骤1.称取 80g 地乙醇和 37.1g 地苯加入塔釜中,并分别对原料乙醇和苯进行色谱分析,确定其组成 .2.向全凝器中通入冷却水,开启釜电加热系统,并把系统调整至全回流,调节加热电流慢慢升至 0.4A(注意不要使电流过大,以免设备突然受热而损坏) . 然后记录下此时地时间、塔釜和塔顶地初始温度、加热电流以及塔釜和上、下段加热电流 .dvzfvkwMI13.待釜液沸腾,开启塔身保温电源,调节保温电流,上段为0.2A,下段为0.2A,并持续 30 分钟,以使填料层具有均匀地温度梯度,保证全塔处在正常地操作范围内 .rqyn14ZNXI4.一个小时后,打开回流比调节器,调至5:1,并在后面地 2 小时内,每 20分钟中对塔釜样品做一次色谱分析,分别记录下水、乙醇和苯地气相色谱峰面积 .EmxvxOtOco5.过 20 分钟后把回流比调节器调至3:1,再过两个 5 分钟后分别把回流比调节器调至 1:1 和 1:3.6.做完前面 2 个小时地最后一组色谱分析之后,发现样品中苯地存在,于是把塔顶放空一格,等其溢流之后 5 分钟,再做一组塔釜气象色谱分析,并记录相关数据 .SixE2yXPq57.关闭电源,将所有蒸出液放入分液漏斗,放置 5 分钟,将分离后地富苯相和富水相及釜液分别称重并用色谱分析,并分别记录下各自地质量和其各组分地气象色谱峰面积 .6ewMyirQFL8.关闭冷却水,结束实验 .五、原始数据记录表表 3 精馏过程各时刻实验记录设备编号: 03上段釜加下段塔顶塔釜峰面积 / μV*s峰地百分含量 /%加热加热时刻热电温度控温电流电流流/A/℃/℃水乙醇苯水乙醇苯/A/A14:0.210.370.2018.417.4——————0715:0.200.370.2161.071.9515019074388 2.1479.518.2 05923740546979315:0.200.370.2161.675.74219209818731.9597.10.8625144097847507 15:0.200.380.2061.875.838842228— 1.7198.2—4571286871416:0.200.370.2061.775.626962073—1.2898.7—05283661634 16:0.200.380.2061.875.715501600—0.9599.0—25449194081:24960.8299.1160.200.380.2061.775.62073——4549353764717:0.200.370.2061.875.717742456 18970.7198.50.76 00601502766083617:0.200.370.2061.875.711792059—0.5699.4—12049343066表 4 塔顶塔釜产物分析记录物相名质量 /g 峰面积 / μV*s峰地百分含量 /%称水乙醇苯水乙醇苯富水相10.181049341479824191635.5911250.1919714.21691富苯相25.86908347828182551 3.79308619.9731176.23381塔釜液71.30—20760123268—89.9215610.07844表 5 原料组成色谱分析记录表试剂乙醇苯波峰组面积1212成水1286613394——乙醇217703219566——苯——214129213013表 6色谱③分析条件柱 1:压力 0.065MPa柱 2:压力0.065MPa kavU42VRUs柱箱温度: 1450C气化室温度: 110检测室温度:110y6v3ALoS89水乙醇苯保留时间(分钟)0.1530.435 1.955校正因子0.722 1.000 1.278桥电流: 100mA 信号衰减: 6 进样量: 0.6μ LP i %=六、数据处理6.1 全塔物料衡算及塔顶三元共沸物地组成分析1> 对塔内水进行物料衡算原料乙醇中水含量:M2ub6vSTnP富苯相中水含量:0YujCfmUCw富水相中水含量:eUts8ZQVRd塔釜液中水含量:则塔内残余水含量为:0.0461g2> 对塔内乙醇进行物料衡算原料中乙醇含量:sQsAEJkW5T富苯相中乙醇含量:GMsIasNXkA富水相中乙醇含量:TIrRGchYzg塔釜液中乙醇含量:则塔内残余乙醇含量为:g 3> 对塔内苯进行物料衡算原料中苯含量:富苯相中苯含量:7EqZcWLZNX富水相中苯含量:lzq7IGf02E塔釜液中苯含量:zvpgeqJ1hk则塔内残余苯地含量为:4> 塔内总持液量衡算塔内残余液理论量为g而实际塔内残余液量为0.0461+g两者完全相等 .5> 对物料衡算结果地分析塔内总残余液比例:从上述计算可以看出,塔内残余液占了很大地比例,其中既包括了乙醇,也包括了苯,且两者质量比例大约为 0.8754 : 1. NrpoJac3v1而对于塔内水地衡算结果为负值这一事实,由于其值很小且趋近于零,所以我认为可能是实验时地系统误差和随机误差导致地 . 1nowfTG4KI6>塔顶三元共沸物组成计算组分水所占比例:相对误差:组分乙醇所占比例:相对误差:组分苯所占比例:相对误差:总结上述结果得到下表:表 7 塔顶三元共沸物组成水乙醇苯质量0.2700.6360.094分数相对45.9%14.2%27.0%误差6.225 ℃下乙醇一水一苯三元物系地溶解度曲线及简要说明右图所示为 25oC 下水—乙醇—苯地三元相图,其中、、分别代表乙醇、A B W苯和水; AB Z、AW Z、BW Z代表三个二元共沸物, T 表示三元共沸物;图中地曲线即为 25℃下乙醇—水—苯三元物系地溶解度曲线;线段FB则为加料线 .fjnFLDa5Zo 将乙醇—水地混合物加入塔釜中,此时即对应右图中地 F 点,随着苯地加入,原料液地组成点逐渐地向 B 点迁移 .由三元相图原理可知,如果原料液地组成点落在某个小三角形内 .当塔顶采用混相回流时精馏地最终结果只能得到这个小三角形三个顶点所代表地物质.所以如果想得到无水乙醇,就应该保证原料液地组成落在包含顶点A 地小三角形内,即在ATABz或ATAWz内.从沸点看,乙醇—水地共沸点和乙醇地沸点仅差 0.15℃,就本实验地技术条件无法将其分开 .而乙醇—苯地共沸点与乙醇地沸点相差10.06℃,很容易将它们分离开来 .所以应该将原料液地组成控制在ATABz中.也就是说,应该通过控制苯地加入量,使得原料液地组成点落在线段 HI 之间即可 .tfnNhnE6e5将适量地苯加入塔釜中,通过控制适宜地塔釜温度和塔顶回流比,即可以在塔釜中得到较为纯净地乙醇,塔顶得到两元和三元共沸物,从而达到了乙醇和水分离地目地 .HbmVN777sL七、思考题7.1 共沸物加入量地计算首先,通过指定地压力条件查阅相关地文献,确定三元共沸物和所有地两元共沸物地地组成,画出该压力条件地水—乙醇—苯地三元相图,如右图所示 .其中A、B、W 分别代表乙醇、苯和水; AB Z、AW Z、BW Z代表三个二元共沸物, T 表示三元共沸物;图中地曲线为乙醇—水—苯三元物系地溶解度曲线 .V7l4jRB8Hs然后连接 F、 B 两点,交ATAB Z于 H 和 I 两点 .由沸点地参数可知,要想得到纯净地乙醇,原料液地组成点应该落在ATAB Z中,故点 H、I 两点分别为苯地最小加入量和最大加入量.83lcPA59W9最后,量取线段IF、 BI、 HF、 BH 地长度待用,通过杠杆定理可得,m B,min=m F*|HF|/|BH|,而m B,max= m F*|IF|/|BI|,即苯地加入量应该控制在其二者之间 .mZkklkzaaP7.2 全塔物料衡算所需地实验数据一共需要 8 组数据才可以对全塔做物料衡算 .它们分别是: 1>原料液地总质量质量 m f;2>原料液各组分地气相色谱峰面积百分数 x fi;3>塔釜液质量 m F;4>塔顶富水相质量 m dW5>塔顶富苯相质量 m dB;6>塔釜液各组分地气相色谱峰面积百分数x Fi;7>塔顶富水相各组分地气相色谱峰面积百分数 x dWi;8>塔顶富苯相各组分地气相色谱峰面积百分数 x dBi;AVktR43bpw7.3 三元共沸物组成地误差及其分析三元共沸物组成地误差已经求出,见表7.但我认为最后地数据有误差,并不是试验中地失误导致地 .因为通过水—乙醇—苯地三元相图可以得知,从理论上讲,塔顶应该得到地是二元和三元共沸物地混合物,而非纯净地三元共沸物 .因此想准确地算出三元共沸物地组成是不可能地,任何估算都会产生很大地误差 .ORjBnOwcEd在上面地数据结果是建立在假设塔顶液相全部是三元共沸物地基础上地,而这一假设显然与相图地理论相违背,并且通过相图我们可以看出,在最后地塔顶液相中,二元共沸物在其中占有了相当地比例,不可被忽略不计,因此这一假设必然会带来很大地误差 .2MiJTy0dTT版权申明本文部分内容,包括文字、图片、以及设计等在网上搜集整理.版权为个人所有This article includes some parts, including text,pictures, and design. Copyright is personal ownership.gIiSpiue7A 用户可将本文地内容或服务用于个人学习、研究或欣赏,以及其他非商业性或非盈利性用途,但同时应遵守著作权法及其他相关法律地规定,不得侵犯本网站及相关权利人地合法权利. 除此以外,将本文任何内容或服务用于其他用途时,须征得本人及相关权利人地书面许可,并支付报酬 . uEh0U1YfmhUsers may use the contents or services of this articlefor personal study, research or appreciation, and other non-commercial or non-profit purposes, but at the same time,they shall abide by the provisions of copyright law and otherrelevant laws, and shall not infringe upon the legitimaterights of this website and its relevant obligees. In addition, when any content or service of this article is used for other purposes, written permission and remuneration shall beobtained from the person concerned and the relevantobligee.IAg9qLsgBX转载或引用本文内容必须是以新闻性或资料性公共免费信息为使用目地地合理、善意引用,不得对本文内容原意进行曲解、修改,并自负版权等法律责任. WwghWvVhPEReproduction or quotation of the content of this articlemust be reasonable and good-faith citation for the use of news or informative public free information. It shall notmisinterpret or modify the original intention of the contentof this article, and shall bear legal liability such ascopyright. asfpsfpi4k。
天津大学化工学院专业实验实验报告2 共沸精馏

0.724
1.000
1.170
表 5-2 原料及产品质量记录表
原料
塔顶回收液
乙醇/g
苯/g
80.0
39.1
富水相/g 9.0
富苯相/g 25.8
塔釜回收液/g 68.1
6
共沸精馏实验报告
表 5-3 塔釜气相色谱分析数据记录表
取样时间
峰序号
保留时间/min
峰面积
峰面积百分比/%
1
0.429
15:00
70.1
0.20
75.3
0.20
76.3
0.22
76.3
0.20
76.3
0.20
76.2
0.20
76.2
0.20
塔釜加热电 流/A 0.37 0.37 0.37 0.37 0.37 0.37 0.37 0.37
下段加热电 流/A 0.20 0.19 0.19 0.20 0.19 0.19 0.19 0.19
88.19856 11.80144
时间
14:12 14:53 15:13 15:33 15:53 16:13 16:33 16:53
塔顶温度 /℃ 30.2 62.7 63.2 63.2 63.4 63.3 63.4 63.4
表 5-6 电流-温度变化表
塔釜温度 /℃ 26.6
上段加热电 流/A 0.22
本实验要求的是由乙醇-水混合物制取纯乙醇,但由水-乙醇的汽液平衡相 图(图 2-1)可知,水-乙醇体系存在最低恒沸点,故无法通过一次蒸馏得到纯 乙醇。为此采用特殊精馏操作得到纯乙醇。
图 2-1 乙醇-水二元体系的 T-xy 图
1
共沸精馏实验报告
天津大学—共沸精馏实验报告

天津大学—共沸精馏实验报告本次实验是关于共沸精馏的实验,通过该实验旨在掌握共沸精馏的原理及方法,并能够运用共沸精馏技术对多组分混合物进行分离纯化。
实验仪器与试剂:1. 蒸馏装置:共沸精馏塔、比重计、冷却器、加热器、恒温水浴等。
2. 试剂:氧化铝、异丙醇、甲醇、正丁醇、苯醚等。
实验方法:1. 实验前准备:将蒸馏装置清洗干净,提前加入少量氧化铝粉末,并将冷却器预先加热至恒温水浴的温度,保证无水汽冷凝现象发生。
2. 实验操作步骤:① 将多组分混合物放入共沸精馏塔中,加热至大气压下的沸点。
比重较小的组分先挥发出来,通过冷凝器和收集瓶收集。
② 在比重较小的组分挥发完毕后,温度会上升。
当温度稳定时,表明混合物即将共沸。
此时我们用手触摸共沸精馏塔身体的两侧,用温度感受器监测温度变化情况,等到蒸馏液出现温度下降时,对废液进行处理,用比重计对收集瓶中的液体进行检查。
③ 重复步骤①、步骤②,直到所有组分均被收集。
实验结果:通过实验,我们将氧化铝、异丙醇、甲醇、正丁醇、苯醚等多个组分的混合物进行了共沸精馏。
结果表明,在温度约为78℃的时候,异丙醇和甲醇两个组分同时开始挥发,形成共沸。
在此温度下,我们从收集瓶中检测到挥发的物质的比重,发现仅为0.79,是两种组分的比重的平均值。
这说明,经过共沸精馏后,我们获得的是两种组分的混合物而非单一物质。
总结:通过本次实验,我们成功运用了共沸精馏技术,对多组分混合物进行了分离纯化。
我们在实验过程中注意到,共沸精馏必须掌握好温度的变化情况,以便准确把握组分的挥发情况,同时我们也发现,共沸的组分可能不是单一组分,需要通过其他方法进一步纯化。
在未来的实验中,我们还需进一步探究并掌握其他的分离方法以满足不同物质的分离需求。
乙醇和水的分离实验报告

乙醇-水精馏实验报告实验名称:共沸精馏实验人员:同组人:实验地点:实验时间:班级/学号:指导教师:实验成绩:共沸精馏一、实验目的1. 通过实验加深对共沸精馏过程的理解2. 熟悉精馏设备的构造掌握精馏操作方法3. 能够对精馏过程做全塔物料衡算4. 学会使用气相色谱分析气、液两相组成。
二、实验原理精馏是利用不同组份在气-液两相间的分配,通过多次气液两相间的传质和传热来达到分离的目的。
对于不同的分离对象,精馏方法也会有所差异。
例如分离乙醇和水的二元物系。
由于乙醇和水可以形成共沸物而且常压下的共沸温度和乙醇的沸点温度极为相近。
所以采用普通精馏方法只能得到乙醇和水的混合物。
而无法得到无水乙醇。
为此,在乙醇-水系统中加入第三种物质,该物质被称为共沸剂。
共沸剂具有能和被分离系统中的一种或几种物质形成最低共沸物的特性。
在精馏过程中共沸剂将以共沸物的形式从塔顶蒸出,塔釜则得到无水乙醇。
这种方法就称作共沸精馏。
乙醇-水系统加入共沸剂苯以后可以形成四种共沸物。
现将它们在常压下的共沸温度、共沸组成列于表1。
为了便于比较再将乙醇、水、苯三种纯物质常压下的沸点列于表2。
从表1和表2列出沸点看除乙醇-水二元共沸物的共沸物与乙醇沸点相近之外其余三种共沸物的沸点与乙醇沸点均有10℃左右的温度差。
因此,可以设法使水和苯以共沸物的方式从塔顶分离出来,塔釜则得到无水乙醇。
整个精馏过程可以用图1来说明。
图中A、B、W分别为乙醇、苯和水的英文字头,ABZ,AWZ,BWZ代表三个二元共沸物,T表示三元共沸物。
图中的曲线为25℃下的乙醇、水、苯三元共沸物的溶解度曲线。
该曲线的下方为两相区上方为均相区。
图中标出的三元共沸组成点T是处在两相区内。
以T为中心连接三种纯物质A、B、W及三个二元共沸点组成点ABZ、AWZ、BWZ将该图分为六个小三角形。
如果原料液的组成点落在某个小三角形内。
当塔顶采用混相回流时精馏的最终结果只能得到这个小三角形三个顶点所代表的物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
塔釜气相
乙醇 苯 水
10:40
塔釜液体
乙醇 苯 水
11:05
富水相
乙醇 苯 水
11:15
富苯相
乙醇 苯
水 11:29 持液 乙醇 苯 水 10:11 标准液 乙醇 苯
0.255 0.666 2.498 0.213 0.635 2.574
2121 86862 45671 29705 109326 16052
此外,需要特别说明的是在进行分相回流时,分相器中会出现两层液体。上 层为富苯相、 下层为富水相。 实验中, 富苯相由溢流口回流入塔, 富水相则采出。 当间歇操作时,为了保证有足够高的溢流液位,富水相可在实验结束后取出。 2.试剂 实验试剂为:含水乙醇、苯。试剂中各组分的含量采用色谱分析得到。 四、实验步骤 1.称取60.71g含水乙醇和33.41g苯加入塔釜中,并分别对原料乙醇和苯进 行色谱分析,确定其组成。 2.向全凝器中通入冷却水,并开启釜电加热系统,调节加热电流慢慢升至 0.4 A(注意不要使电流过大,以免设备突然受热而损坏)。待釜液沸腾,开启 塔身保温电源,调节保温电流,上下段均为0.1A,以使填料层具有均匀的温度梯 度,保证全塔处在正常的操作范围内。 3.每隔20 min记录一次加热电流、保温电流、塔顶温度、塔釜温度。每隔 10 min取塔釜气相样品分析组成。 4.当塔头有液体出现,全回流30 min稳定后,调节回流比进行混相回流操 作,回流比为5:1。 5.待分相器内液体开始溢流,并分成两相,上层为苯相,下层为水相,且 能观察到三元共沸物在苯相中以水珠形态穿过,溶于水相中,此时,调节回流比 为1:3。 6.待塔釜液体中无苯存在时,停止加热,取出釜液,称重、分析组成。 7.将塔顶馏出液用分液漏斗分离,分别称重,依次用气相色谱仪分析富水 相、富苯相组成。 8.分析以上产品后,填料内的持液回流至塔釜内,将其取出,称重、分析 组成。 9.切断设备的供电电源,关闭冷却水,将实验用品放回原位,结束实验。
所用药品规格: 1、 所用乙醇质量分数为 95%, 生产厂家为利安隆博华天津医药化学有限公司 (天 津) ,生产编号为:XK13-011-00026。 2、所用苯质量分数≥99.5%,生产厂家为利安隆博华天津医药化学有限公司(天 津) ,生产编号为:XK13-201-00590。 表 4 精馏过程各时刻数据记录表 下段加 塔釜加 塔顶温 塔釜控 热电流 热电流 度/℃ 温/℃ /A /A 0.10 0.11 0.09 0.10 0.10 0.10 0.40 0.40 0.38 0.38 0.38 0.38 21.2 21.2 63.4 63.5 63.5 63.5 19.2 64.1 69.3 71.1 75.5 75.8
75.7
1:3
10:25 10:30
0.10 0.10
0.10 0.10
0.38 0.38
63.4 63.5
75.6 75.7
1:3 0
馏出液溢 流,调节 R=1:3 釜液第一 次取样分 析 釜液第二 次取样分 析 停止实验
表 5 色谱分析条件 气相色谱条件 汽化温度/℃ 检测温度/℃ 柱箱温度/℃ 柱前压 1 /MPa 柱前压 2 /MPa 桥电流/mA 衰减 110.1 150.1 145.0 0.060 0.064 100 7 表 6 色谱分析数据表 保留时间 色谱峰 /min 水 乙醇 苯 水 10:20 塔釜气相 乙醇 苯 水 10:25 塔釜气相 乙醇 苯 水 10:33 塔釜液体 乙醇 苯 水 11:05 富水相 乙醇 苯 水 11:15 富苯相 乙醇 苯 0.246 0.627 0.289 0.653 0.229 0.622 0.246 0.619 0.195 0.627 2.565 0.290 0.747 2.340 质量相对校正因子 水 乙醇 苯 进样量/µl 0.2 0.80
1.装置
本实验所用的精馏塔为内径Ф 20 mm的玻璃塔。 内装三角螺旋高效散装填料。 填料层高度1.2 m。 塔釜为一只结构特殊的三口烧瓶。上口与塔身相连:侧口用于投料和采样; 下口为出料口;釜侧玻璃套管插入一只测温热电阻,用于测量塔釜液相温度,釜 底玻璃套管装有电加热棒,采用电加热,加热釜料,并通过一台自动控温仪控制 加热温度, 使塔釜的传热量基本保持不变。塔釜加热沸腾后产生的蒸汽经填料层 到达塔顶全凝器。 为了满足各种不同操作方式的需要,在全凝器与回流管之间设 置了一个特殊构造的容器。 在进行分相回流时,它可以用作分相器兼回流比调节 器;当进行混相回流时,它又可以单纯地作为回流比调节器使用。这样的设计既 实现了连续精馏操作,又可进行间歇精馏操作。
10:15
水 11:25 持液 乙醇 苯 水 10:07 标准液 乙醇 苯
0.239 0.629 2.410 0.255 0.658 2.605
3352 139619 75051 38089 139203 19731
1.53735 64.03921 34.42344 19.30388 70.54968 10.14644
取样量 三组分取样总量
乙醇 70.52251 71.39705 f2
苯 10.24851 13.52942 f3
色谱分析测量百分数 X A
f'A f'A
式中, f ' -----组分 A 的相对校正因子,A-----色谱峰面积 为减小试验中的操作误差,以三人测得百分含量平均值代替色谱峰面积
时刻 8:52 8:58 9:31 9:49 10:07 10:14
上段加 热电流 /A 0.10 0.10 0.09 0.10 0.10 0.10
回流比 无回流 ∞ 5:1 5:1 5:1 1:3
备注 开始实验 全回流开 始 全回流结 束,调节 R=5:1
10:20
0.10
0.10
0.38
33.91729 19.15408 70.49534 10.35057
备注:标准液:乙醇 9.71g,苯 1.84g,水 2.05g 六、实验数据处理 1.相对校正因子计算 表7 相对校正因子计算表 水 测得百分含量/% (数据取平均值) 实际百分含量/% 相对校正因子 实际百分含量XA = 19.22898 15.07353 f1
共沸精馏
一、实验目的: 1.通过实验加深对共沸精馏过程的理解。 2.熟悉精馏设备的构造,掌握精馏操作方法。 3.能够对精馏过程做全塔物料衡算。 4.学会使用气相色谱分析气、液两相组成。 二、实验原理: 精馏是利用不同组份在汽—液两相间的分配,通过多次汽液两相间的传质和 传热来达到分离的目的。对于不同的分离对象,精馏方法也会有所差异。例如, 分离乙醇和水的二元物系。 由于乙醇和水可以形成共沸物,而且常压下的共沸温 度和乙醇的沸点温度极为相近, 所以采用普通精馏方法只能得到乙醇和水的混合 物,而无法得到无水乙醇。为此在乙醇—水体系中加入第三种物质,该物质被称 为共沸剂。 共沸剂具有能和被分离系统中的一种或几种物质形成最低共沸物的特 性。在精馏过程中共沸剂将以共沸物的形式从塔顶蒸出,塔釜则得到无水乙醇。 这种方法就称作共沸精馏。 乙醇—水体系加入共沸剂苯以后可以形成四种共沸物。现将它们在常压下的 共沸温度、共沸组成列于表 1。 为了便于比较,再将乙醇、水、苯三种纯物质常压下的沸点列于表2。 表1 乙醇水-苯三元共沸物性质 共沸物(简记) 共沸点/℃ 乙醇-水-苯 (T) 乙醇-苯(ABZ) 苯-水(BWZ) 乙醇-水(AWZ) 64.85 68.24 69.25 78.15 共沸物组成,t% 乙醇 18.5 32.7 0.0 95.57 水 7.4 0.0 8.83 4.43 苯 74.1 67.63 91.17 0.0
备注:标准液:乙醇 9.71g,苯 1.84g,水 2.05g
色谱分 析时刻
样品 原料乙醇 原料苯
表 7 同组人数据参考(吴迪) 保留时间 色谱峰 峰面积 /min 水 乙醇 苯 水 0.075 0.452 0.289 0.653 0.229 0.622 0.285 0.619 0.226 0.658 2.603 0.290 0.761 2.475 13998 192947 2916 16026 2213 136036 1517 102983 101824 111794 20055 2533 13618 69558
色谱分 析时刻
样品 原料乙醇 原料苯
峰面积 12548 172728 2916 16026 2213 136036 2546 177662 87353 96389 17018 4631 26486 132761
峰面积百分 数 6.77286 93.22714 1.78695 98.21303 1.60065 98.39935 1.41269 98.28731 43.51108 48.01210 8.47682 2.82570 16.16225 81.01204
五、实验数据 表 3 物料质量记录表 锥形瓶重/g 含水乙醇 苯 塔顶液 馏出液富水相 馏出液富苯相 釜底液 填料内持液 79.00 42.36 37.31 51.14 42.33 总重/g 109.81 47.55 62.38 90.51 62.39 物料重/g 61.47 33.08 30.81 5.19 25.07 39.37 21.06
������ ������
(百分含量=
, XA
f A f'A
'
f'
A A ) A f' A
水含量:X1
f 1 23.83636 100 19.11076 f 1 23.83636 f 2 69.94801 f 3 6.21563
又∵ f 1 23.83636 f 2 69.94801 f 3 6.21563 100 ∴ f 1 0.80 同理,
表2 乙醇、水、苯的常压沸点 物质名称(简记) 沸点温度(℃) 乙醇(A) 78.3 水(W) 100 苯(B) 80.2
