光催化降解甲基橙
实验16-光催化降解甲基橙

实验16 光催化降解染料甲基橙一、目的要求1、掌握确定反应级数的原理和方法;2、测定甲基橙光催化降解反应速率常数和半衰期;3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。
二、实验原理光催化始于1972年,Fujishima和Honda 发现光照的TiO2单晶电极能分解水,引起人们对光诱导氧化还原反应的兴趣,由此而推动了有机物和无机物光氧化还原反应的研究。
1976年,Cary等报道,在近紫外光照射下,曝气悬浮液,浓度为50 µg/L 的多氯联苯经半小时的光反应,多氯联苯脱氯,这个特性引起了环境研究工作者的极大兴趣,光催化消除污染物的研究日趋活跃。
在水的各类污染物中,有机物是最主要的一类。
美国环保局公布的129种基本污染物中,有9大类共114种有机物。
国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2、H2O,而污染物中含有的卤原子、硫原子、磷原子和氮原子等则分别转化为X-,SO42-,PO43-,PO43-,NH4+,NO3-等离子。
因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。
光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。
“光催化”这一术语本身就意味着光化学与催化剂二者的有机结合,因此光和催化剂是引发和促进光催化反应的必要条件。
光催化以半导体如TiO2、ZnO、CdS、A-Fe2O3、WO3、SnO2、ZnS、SrTiO3、CdSe、CdTe、In2O3、FeS2、GaAs、GaP、SiC、MoS2 等作光催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点,故TiO2事目前广泛研究、效果较好的光催化剂。
光催化降解甲基橙

N-TiO2的制备及可见光降解有机污染物的测定一、目的要求1、N掺杂TiO2光催化剂的简易液溶液制备;2、测定甲基橙在可见光作用下的光催化降解反应速率常数;3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。
二、实验原理国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2, H2O。
因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。
光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学与环境化学等多个学科,因此多相光催化科技就是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。
光催化以半导体如TiO2,ZnO,CdS,WO3,SnO2,ZnS,SrTiO3等作催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点。
TiO2就是目前广泛研究、效果较好的光催化剂之一。
半导体之所以能作为催化剂,就是由其自身的光电特性所决定的。
半导体粒子含有能带结构,通常情况下就是由一个充满电子的低能价带与一个空的高能导带构成,它们之前由禁带分开。
研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为3、2eV,半导体的光吸收阈值λg与禁带宽度Eg的关系为(nm)=1240/E g(eV)当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e-),在价带上产生带正电的光生空穴(h+),形成光生电子-空穴对。
空穴具有强氧化性;电子则具有强还原性。
当光生电子与空穴到达表面时,可发生两类反应。
第一类就是简单的复合,如果光生电子与空穴没有被利用,则会重新复合,使光能以热能的形式散发掉。
第二类就是发生一系列光催化氧化还原反应,还原与氧化吸附在光催化剂表面上物质。
光催化甲基橙实验报告单

一、实验目的1. 了解TiO2光催化的基本原理;2. 掌握TiO2光催化降解甲基橙的影响因素,如pH、甲基橙初始浓度等对甲基橙脱色率的影响;3. 学会利用分光光度法测定甲基橙的浓度。
二、实验原理1. 甲基橙(MO)是一种阳离子型染料,其分子结构中含有偶氮基(—NN—),不易被传统的氧化法彻底降解,容易造成环境污染。
2. TiO2作为一种半导体材料,具有良好的光催化活性。
在光照射下,TiO2表面会产生电子-空穴对,电子与甲基橙发生氧化还原反应,使甲基橙褪色。
三、实验仪器与试剂1. 仪器:紫外可见分光光度计、磁力搅拌器、pH计、锥形瓶、烧杯、容量瓶、移液管等。
2. 试剂:甲基橙、TiO2、无水乙醇、盐酸、氢氧化钠、氯化钠、氯化钾等。
四、实验步骤1. 配制甲基橙溶液:准确称取一定量的甲基橙,用无水乙醇溶解,配制成一定浓度的甲基橙溶液。
2. 配制TiO2悬浮液:称取一定量的TiO2,加入适量无水乙醇,搅拌至TiO2完全溶解。
3. 设置实验组:分别设置不同pH、甲基橙初始浓度、TiO2投加量的实验组。
4. 搅拌:将甲基橙溶液和TiO2悬浮液混合,置于磁力搅拌器上,控制搅拌速度。
5. 光照:将混合液置于紫外可见分光光度计下,进行光照反应。
6. 取样:光照一定时间后,取出部分混合液,用无水乙醇稀释,测定甲基橙的浓度。
7. 计算脱色率:根据甲基橙的浓度,计算脱色率。
五、实验结果与分析1. pH对甲基橙脱色率的影响实验结果表明,随着pH的升高,甲基橙的脱色率逐渐降低。
当pH=3时,甲基橙的脱色率达到最高。
2. 甲基橙初始浓度对脱色率的影响实验结果表明,甲基橙初始浓度越高,脱色率越低。
当甲基橙初始浓度为10 mg/L 时,脱色率达到最高。
3. TiO2投加量对脱色率的影响实验结果表明,随着TiO2投加量的增加,甲基橙的脱色率逐渐升高。
当TiO2投加量为1 g/L时,脱色率达到最高。
六、结论1. 光催化降解甲基橙实验表明,TiO2光催化剂对甲基橙具有较好的降解效果。
光催化降解甲基橙实验报告详解

光催化降解甲基橙实验报告详解实验目的:本实验旨在通过光催化技术研究甲基橙在紫外光照射下的降解效果,并探讨光催化剂的种类对甲基橙降解率的影响。
实验原理:光催化是利用光照射下的光催化剂,通过产生活性氧化物来降解有机污染物的技术。
在本实验中,我们选用了双氧水和二氧化钛作为光催化剂,紫外光作为激发光源。
实验方法:1.实验前准备:将甲基橙溶液通过稀释至所需浓度,并将光催化剂溶液制备好。
2.实验操作:按照不同的实验方案,将甲基橙溶液和光催化剂溶液混合,然后分别在紫外光照射下进行降解反应。
3.实验记录:在一定时间间隔内,取出一定量的样品,通过紫外可见分光光度计测定其吸光度,并根据标准曲线计算出甲基橙的浓度。
实验结果:实验结果显示,在紫外光照射下,无论是使用双氧水还是二氧化钛作为光催化剂,甲基橙的降解率均呈现出增加的趋势。
随着反应时间的延长,甲基橙的浓度逐渐下降。
在使用双氧水时,降解率先快速增加,然后趋于平缓,在60分钟后达到最大值。
而在使用二氧化钛时,降解率也呈现出类似的趋势,但达到最大值的时间延后到了90分钟。
实验讨论:1.产生活性氧化物:在紫外光照射下,光催化剂吸收光能并产生活性氧化物,例如羟基自由基(·OH)和超氧自由基(·O2^-)。
这些活性氧化物能够与甲基橙分子发生氧化还原反应,从而使其降解。
2.活性氧化物的生成机制:在使用双氧水作为光催化剂时,紫外光能够使双氧水分解成羟基自由基,而这些羟基自由基是甲基橙降解的主要活性氧化物。
而在使用二氧化钛作为光催化剂时,紫外光能够使二氧化钛表面产生电子空穴对,这些电子空穴能够与水分子发生反应,生成羟基自由基。
因此,双氧水和二氧化钛均能有效降解甲基橙。
3.光催化剂选择:在本实验中,二氧化钛在降解甲基橙方面的效果稍好于双氧水。
这可能是因为二氧化钛具有较大的比表面积和较好的光吸收性能,能够提供更多的活性氧化物产生位点。
结论:本实验通过光催化技术研究了甲基橙在紫外光照射下的降解效果,并发现双氧水和二氧化钛均能有效降解甲基橙。
光催化降解甲基橙实验报告

光催化降解甲基橙实验报告光催化降解染料甲基橙一、目的要求1、掌握确定反应级数的原理和方法;2、测定甲基橙光催化降解反应速率常数和半衰期;3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。
二、实验原理光催化始于1972年,Fujishima和Honda 发现光照的TiO单晶电极能分解水,引起人们对光诱导2氧化还原反应的兴趣,由此推动了有机物和无机物光氧化还原反应的研究。
1976年,Cary等报道,在近紫外光照射下,曝气悬浮液,浓度为50μg/L 的多氯联苯经半小时的光反应,多氯联苯脱氯,这个特性引起了环境研究工作者的极大兴趣,光催化消除污染物的亚牛日趋活跃。
国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2 H2O,而污染物中含有的卤原子、硫原子、磷原子和氮原子等则分别转化为X-,SO42-,PO43-,PO43-,NH4+,NO3-等离子。
因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。
光催化技术的研究涉及到原子物理、凝聚态物 2理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。
光催化以半导体如TiO,ZnO,CdS,FeO,322WO,SnO,ZnS,SrTiO,CdSe,CdTe,InO,32323FeSGaAs,GaP,SiC,MoS等作催化剂,其中TiO222,具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点,帮TiO是目前广泛研究、效果较2好的光催化剂。
半导体之所以能作为催化剂,是由其自身的光电特性所决定的。
半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。
研究证明,当pH=1时锐钛矿型TiO 的禁带宽度为3.2eV,半导体的光吸2收阈值λg与禁带宽度Eg的关系为λ(nm)=1240/Eg(eV)g当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e-),在价带上产生带正电+),形成光生电子-的光生空穴(h空穴对。
二氧化钛光催化剂降解甲基橙影响因素研究实验方案

二氧化钛光催化剂降解甲基橙影响因素研究实验方案一实验目的不同因素对二氧化钛光催化剂降解甲基橙的影响二实验原理光催化的原理是利用光来激发二氧化钛等化合物半导体,利用它们产生的、电子和空穴来参加氧化—还原反应。
当能量大于或等于能隙的光照射到半导体纳米粒子上时,其价带中的电子将被激发跃迁到导带,在价带上留下相对稳定的空穴,从而形成电子—空穴对。
由于纳米材料中存在大量的缺陷和悬键,这些缺陷和悬键能俘获电子或空穴并阻止电子和空穴的重新复合。
这些被俘获的电子和空穴分别扩散到微粒的表面,从而产生了强烈的氧化还原势.光催化剂对于化学反应的催化降解机理是,当催化剂受到可见光照射并吸收光能后,会发生电子跃迁成电子-空穴对.然后使吸附于催化剂表面的有机污染物发生氧化还原反应进行降解,或者氧化其表面吸附的氢氧根( OH- ) ,使之生成氧化性更强的羟基自由基( ·OH) .通过这些过程最终将体系中的污染物氧化成水、二氧化碳和无机盐等物质. TiO2 作为一种性能优异的半导体光催化剂,已经被很多的科研工作者进行过研究。
三实验仪器和试剂甲基橙二氧化钛盐酸氢氧化钠氯化钾pt 72型分光光度计磁力搅拌器四二氧化钛的制备制备二氧化钛的方法有很多本实验采用溶胶-凝胶法将钛酸丁脂与无水乙醇按一定比例混合搅拌,通过超声波震荡形成溶胶,再将其凝胶固化,最终通过热处理焙烧制得TiO2 薄膜材料。
Ti(OR)n+H2O → Ti(OH)n+ROH (1)-Ti–OH+HO-Ti- → -Ti–O-Ti+H2O (2)-Ti-OR+HO-Ti- → -Ti-O–Ti+ROH (3)式中的R 为有机基团。
最后获得的氧化物的结构和形态依赖于水解和缩聚反应的相对反应程度,当金属- 氧桥- 聚合物达到一定宏观尺寸时,形成网状结构从而溶胶形成凝胶。
经加热烘干,得到黄色的晶体,再将其研磨成粉末,最后再经过热处理得到二氧化钛。
五实验方法光催化反应具体过程称取0 .500 g TiO2 ,量取250ml浓度为20mg/l甲基橙溶液置于反应器中经磁力搅拌15 min后, 引入光源, 反应过程中,控制溶液温度,每隔一定的时间取样, 离心分离, 取上层清液,利用紫外分光光度仪测定甲基橙的吸光度并求出其浓度 .(先用紫外可见分光光度计做甲基橙标准溶液的标准曲线,然后测试催化后的溶液吸光度,在曲线上找到对应的浓度)六对比条件1 不同的PH的影响2 不同温度的影响3 二氧化钛的浓度的影响4 Zn等金属的影响5 光照强度的影响6 氯离子是否有影响。
ZnO光催化降解甲基橙的研究

2
4
6
8
1 O
l 2 甲基 橙 ( m g / L )
图2甲基橙 降解率 随甲基橙浓度 的变化 曲线 2 . 3 - 3 光照时间对 甲基橙溶液光降解率的影响 在 本组实验 中 , 固定 Z n O的量 、 甲基橙溶液 的浓度 , 只保 留光照 时 间一个 变量 , 在1 只烧杯 中装入 2 0 0 mL浓度 为 l O mg / L的甲基橙溶 液 。 向烧杯 中加 入 0 . 4 g Z n O产 品, 光照2 0 a r i n 、 4 0 mi n 、 6 0 mi n 、 8 0 mi n 、 1 0 0 a r i n、 1 2 0 mi n, 每隔 2 0 a r i n 取样本上清液用 分光光度计测量 吸光值 A 0 、 吸光值 A , 计算其降解率 , 结果 见图 3 所示 。
蓬8 4 逝 8 2
8 0
78 76
7 4
图1 甲基橙降解率随 Z n O 量对的变化曲线图 2 . 3 . 2甲基橙溶液浓度对光降解率的影响 使用相 同用量催化剂光催化 甲基橙 , 分别在 5只烧杯 中装入 2 0 0 mL 浓度 各为 2 m g / L 、 4 m # L 、 6 m g / L 、 8 m g / L 、 l O m g / L 、 1 2 m g / L的 甲基 橙溶 液 。 每个烧杯加入0 . 4 g Z n 0产品。光照 2 小时 , 取上清液用分光光度计 测量 吸光值 A 。 、 吸光值 A 计算其降解率 , 结果见图 2 。 由图2 可见, 在前 5 个样 本 中甲基橙溶 液的降解率 依次升高 , 说明 降解率 随着 甲基橙溶液 的浓度升高 而升高 , 在样本 6 中, 随着 甲基橙溶 液 的浓度的升高而 甲基橙溶液 的降解率却降低 。在本实验条件 下 , 甲 ∞ ∞ ∞ ∞ 加 0 均选用 2 基橙 溶液的浓度最好 为 l O m g / L , 以下 的实验中催化剂浓度 g / L , 甲基橙溶液 的浓度均选用 1 0 mg / L 。
实验 TiO2光催化降解甲基橙性能研究-liang

实验二 TiO 2光催化降解甲基橙性能研究一、目的要求1、掌握确定反应级数的方法;2、测定甲基橙光催化降解反应速率常数和半衰期;3、了解光催化反应仪的以及可见分光光度计的使用方法。
二、基本原理1972年Fujishima 和Honda 发现光照的TiO 2单晶电极能分解水,推动了有机物和无机物光氧化还原反应的研究。
1976年,Cary 在近紫外光的照射下用二氧化钛的悬浊液可使多氯联苯脱氯,光催化反应逐渐成为人们关注的热点之一。
光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解为相对环境友好的2CO ,2H O 等无机化,污染物中的X原子、S 原子、P 原子和N 原子等则分别转化为X -,24SO - -,34PO -,4NH +,3NO --等无机离子。
光催化法具有能够彻底消除有机污染物,无二次污染,且可在常温常压下进行等优点,因此在消除污染物的研究领域日趋活跃。
光催化通常以半导体如2TiO ,ZnO ,CdS ,23Fe O ,3WO ,2SnO ,ZnS ,3SrTiO , CdSe ,CdTe ,23In O ,2FeS ,GaAs ,GaP ,SiC ,2MoS 等作催化剂,其中2TiO 具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点,是目前广泛研究、效果较好的光催化剂。
目前,纳米2TiO 的制备技术及在水和气相有机、无机污染物的光催化去除等研究取得很大进展,是极具前途的环境污染深度净化技术,在环境保护领域受到广泛关注。
半导体自身的光电特性决定其催化剂特性。
半导体含有能带结构,一般是由一个充满电子的低能价带和一个空的高能导带构成,中间隔着禁带。
当半导体价带上的电子吸收光能被激发到导带,在导带上产生带负电的高活性光生电子(e -),在价带上留下空穴产生带正电的光生空穴(h +),形成光生电子-空穴对,研究证明,当pH=1时用能量等于或大于禁带宽度的光(λ<388nm 的近紫外光)照射锐钛矿型2TiO 半导体光催化剂时,空穴的能量为7.5eV ,具有强氧化性;电子则具有强还原性。
光催化降解甲基橙实验

光催化降解甲基橙实验一、实验目的1、了解TiO2光催化的基本原理;2、了解TiO2光催化降解甲基橙的影响因素如pH、甲基橙初始浓度等对甲基橙脱色率的影响;3、学会利用分光光度法测定甲基橙的浓度。
二、实验原理(一)甲基橙性质甲基橙(Methyl Orange: MO)别名金莲橙D,又名对二甲基氨基偶氮苯横酸钠。
甲基橙为红色鳞状晶体或粉末,微溶于水,不溶于乙醇。
甲基橙的变色范围:pH < 3.1时变红,pH > 4.4时变黄,3.1~4.4时呈橙色。
甲基橙属于阳离子型染料,是常用的纺织染料的一种,主要用于对腈绝纤维的染色。
由于甲基橙分子结构中含有偶氮基(一N=N —),不易被传统的氧化法彻底降解,容易造成环境污染。
(二)T iO2光催化原理半导体材料TiO2作为光催化剂具有化学稳定性高、耐酸碱性好、对生物无毒、不产生二次污染、廉价等优点,故以TiO2为催化剂的非均相纳米光催化氧化是一种具有广阔应用前景的水处理新技术,倍受人们青睐。
TiO2半导体光催化反应机理图如图1-1所示。
半导体粒子具有能带结构,一般由填满电子的低能价带(VB )和空的高能导带(CB)构成,价带中最高能级与导带中的最低能级之间的能量差叫禁带宽度(简写为Eg)。
半导体的光吸收闽值与带隙能Eg有关,其关系式为:乃=1240/Eg (eV)。
锐钛矿型的TiO2带隙能为3.2 eV,光催化所需入射光最大波长为387.5 nm。
当波长小于或等于387.5 nm 的光照射时,TiO2价带上的电子(e-)被激发跃迁至导带,在价带上留下相应的空穴(h+),且在电场的作用下分离并迁移到表面:_ + _TiO2 + h v—h + e (1-1)光生空穴(h+)是一种强氧化剂(E VB =3.1V),可将吸附在TiO2颗粒表面的OH-和H2O分子氧化成OH自由基,OH能够氧化相邻的有机物,亦可扩散到液相中氧化有机物:H2O + h+—• OH ++H (1-2)OH- + h+—• OH (1-3)导带电子(Q)是一种强还原剂(E CB = -0.12V),它能与表面吸附的氧分子发生反应,产生O2超氧离子自由基以及OOH自由基02 + e —• 2O (1-4)H2O + O2 —• 00H + OH (1-5)2 • OOH—0 + H2O2 (1-6)H2O2 + e-—• OH + OH (1-7)H2O2 + O2-—• OH + OH (1-8)上述反应过程中产生的活性氧化物种如:OH、O2-、HOO、H2O2等,可以氧化包括难生物降解化合物在内的众多有机物,使之完全矿化成H2O、CO2等无机小分子。
光催化降解甲基橙

N-TiO2的制备及可见光降解有机污染物的测定一、目的要求1、N掺杂TiO2光催化剂的简易液溶液制备;2、测定甲基橙在可见光作用下的光催化降解反应速率常数;3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。
二、实验原理国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2, H2O。
因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。
光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。
光催化以半导体如TiO2,ZnO,CdS,WO3,SnO2,ZnS,SrTiO3等作催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点。
TiO2是目前广泛研究、效果较好的光催化剂之一。
半导体之所以能作为催化剂,是由其自身的光电特性所决定的。
半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。
研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为,半导体的光吸收阈值λg与禁带宽度Eg的关系为(nm)=1240/E g(eV)当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e-),在价带上产生带正电的光生空穴(h+),形成光生电子-空穴对。
空穴具有强氧化性;电子则具有强还原性。
当光生电子和空穴到达表面时,可发生两类反应。
第一类是简单的复合,如果光生电子与空穴没有被利用,则会重新复合,使光能以热能的形式散发掉。
第二类是发生一系列光催化氧化还原反应,还原和氧化吸附在光催化剂表面上物质。
光催化降解甲基橙

光催化降解染料甲基橙一、目的要求1、掌握确定反应级数的原理和方法;2、测定甲基橙光催化降解反应速率常数和半衰期;3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。
二、实验原理国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2 H2O,而污染物中含有的卤原子、硫原子、磷原子和氮原子等则分别转化为X-,SO42-,PO43-,PO43-,NH4+,NO3-等离子。
因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。
光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。
光催化以半导体如TiO2,ZnO,CdS,Fe2O3,WO3,SnO2,ZnS,SrTiO3,CdSe,CdTe,In2O3,FeS2,GaAs,GaP,SiC,MoS2等作催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点,帮TiO2是目前广泛研究、效果较好的光催化剂。
半导体之所以能作为催化剂,是由其自身的光电特性所决定的。
半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。
研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为3.2eV,半导体的光吸收阈值λg与禁带宽度Eg的关系为Λg(nm)=1240/Eg(eV)当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e-),在价带上产生带正电的光生空穴(h+),形成光生电子-空穴对。
空穴的能量为7.5 eV,具有强氧化性;电子则具有强还原性。
当光生电子和空穴到达表面时,可发生两类反应。
光催化降解甲基橙实验报告详解6页

光催化降解甲基橙实验报告详解6页实验目的:利用TiO2光催化技术,研究甲基橙在紫外光下的降解过程。
实验过程:1.将TiO2复合材料放入普通玻璃试管中,使其均匀分散。
2.分别加入甲基橙溶液,使溶液体积占试管的1/4。
3.将试管放入紫外灯光源下,照射不同时间,记录时间和甲基橙颜色深浅的变化。
4.将反应混合物利用滤纸过滤,将过滤后的溶液用吸光光度计测定其吸光度。
实验结果:1.照射10min后,甲基橙的颜色由橙色转变为浅黄色。
4.用吸光光度计测定吸光度,得到不同时间下的吸光度值,表格如下:时间(min)吸光度0 0.75 0.510 0.415 0.320 0.125 0实验分析:1.光催化技术是利用光照的能量来激发催化剂,从而加速化学反应的过程。
在本实验中,TiO2光催化剂被激发后,产生活性氧和羟基自由基,这些自由基能够降解甲基橙这种有机物。
2.从实验结果可以看出,经过一定时间的紫外光照射后,甲基橙的颜色不断变淡,直至完全消失。
这说明甲基橙被光催化剂分解成了更小的有机物,最终变成了无色化合物。
3.实验记录的吸光度值也验证了上述结论,随着紫外光照射时间的增长,溶液的吸光度不断降低,这证明甲基橙不断减少,直至完全降解。
4.光催化技术具有环境友好、能源高效、降解效果好等优点,因此在环境污染治理、废水处理等方面有广泛的应用前景。
本实验利用了TiO2光催化技术,研究了甲基橙在紫外光下的降解过程。
实验结果表明,经过一定时间的紫外光照射后,甲基橙被光催化剂分解成了更小的有机物,最终变成了无色化合物。
光催化技术具有环境友好、能源高效、降解效果好等优点,值得进一步研究和推广应用。
TiO2光催化氧化降解甲基橙的研究进展

TiO2光催化氧化降解甲基橙的研究进展[摘要] 水污染问题尤其是高毒性难降解的染料废水污染问题已经成为人们关注的热点。
水溶性偶氮染料是印染业污染治理的主要对象,该类物质不仅色度高,而且难以降解。
甲基橙是典型的偶氮染料,本文主要就以TiO2光催化降解甲基橙的研究现状进行了综述。
[关键词]TiO2甲基橙光催化氧化[Abstract] The problem of water polution especially the dye wastewater with high toxic and difficult degradation is attracting more and more attentions.Water-solube azo dyes not only with high chroma but degradate very difficultly ,which has became the main project of deal polution in dying industry.MO is the typical azo dye.In this paper,the present research about photocatalytic degradation MO with TiO2 are reviewed.[Keywords] TiO2Methyl Orangephotocatalytic oxidation染料废水主要来源于染料及染料中间体生产行业,是由各种产品和中间体结晶母液、生产过程中流失的物料及冲刷地面的污水等组成[1]。
染料废水具有成分复杂、色度高、排放量高、毒性大、可生化性差的特点。
偶氮染料是印染行业中最常用的染料之一,占染料总使用量的50%左右[2],具有很大的生物毒性,严重污染了环境,因此染料废水一直是废水处理中的难题。
甲基橙是典型的偶氮染料,其水溶液具有染料废水的典型特征,不仅色度高,而且难以降解,故实验室常用甲基橙作为模型反应物研究如何有效的进行废水处理。
光催化降解甲基橙的研究

橙 溶 液 质 量 浓 度 为 6i l 、i2 入 量 为 O 5g L p 值 为 2时 , ge T 加 n 0 . / 、H 甲基橙 降解 率最 大 ; 加 少 量 的 F¨ 可 提 高 甲基 橙 的 添 e 降 解 率 , 最佳 投 加 量 为 0 1m o L 其 . m l 。利 用 光 催 化 降 解 有 机 染 料 废 水 具 有 广 阔 的发 展 前 景 。 / 关 键 词 0 甲基 橙 2 光催化 降 解 率 ‘
维普资讯
第 2 1卷第 1 0期 20 0 7年 1 0月
化 工 8 T 1I J
Ch emia n s  ̄ Ti e c lI du t m s
VoI21, . No. 0 1
Oc . 0. 0 7 t1 2 0
光 催 化 降 解 甲基 橙 的 研 究
Ab ta t Ph tc tl t e r d t n M eh lOr n e b aay tTi s n e tg td.T e rs l n iae h t h sr c o o aayi d ga ai t y a g y c t]s O2Wa i v siae c o h e u t id c t d ta ,t e s
染料 废水 主要 来 源 于 染 料 及染 料 中间 体 生 产 行
的一 O H自由基 , 而 将 有机 物 氧化 而脱 色 [ 引。 当 从 体 系中存 在氧 化 剂 如 H O 、 2 2 2 F 时 可 提 高 TO i2的光 催化 效率 。 甲基 橙属 于偶 氮 染料 , 用光催 化 法降解 甲基 橙 且 鲜见 报 道 。本 文 以 TO i2为 光催 化 剂 ,0w 的石 英 紫 3 外灯 为光源 , 甲基 橙 溶 液 进 行 光催 化 降 解 , 对 系统 探
(最新整理)光催化降解甲基橙

(完整)光催化降解甲基橙编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)光催化降解甲基橙)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)光催化降解甲基橙的全部内容。
N-TiO2的制备及可见光降解有机污染物的测定一、目的要求1、N掺杂TiO2光催化剂的简易液溶液制备;2、测定甲基橙在可见光作用下的光催化降解反应速率常数;3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法.二、实验原理国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2, H2O。
因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。
光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。
光催化以半导体如TiO2,ZnO,CdS,WO3,SnO2,ZnS,SrTiO3等作催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点。
TiO2是目前广泛研究、效果较好的光催化剂之一。
半导体之所以能作为催化剂,是由其自身的光电特性所决定的.半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。
研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为3.2eV,半导体的光吸收阈值λg与禁带宽度Eg 的关系为(nm)=1240/E g(eV)当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e—),在价带上产生带正电的光生空穴(h+),形成光生电子—空穴对。
光催化降解甲基橙实验报告详解

光催化降解染料甲基一.目的襄求1.掌握勖定反应级数的.原理和方法:3测定甲基棱光催化降解反喊速率常数莉平衣期;工了解可她光分光光度计的构造.工作原理.掌握分光光度汁的使用方法.二、实验原理光催化始于1972年.Fi市茹血合和H由壶发现光照的TiO上单晶电极能分解.水,引起人们对光透导辄优还原反匝的兴趣,由此推动了有机物和无机物光氧化还原反随的研究.1976年.的序等报道,在近紫外洸照射下.曝气悬浮液।浓度为的多氯联革经半小时的光反[3名氯谖茉脱翼.这个特性引起了环境研究工作者的极大黑趣,光催化消除涔染物的亚牛日趟活跃*国内姆大量研究表明,光催化法能枸.数地将蜂类,南代有机物.表面活性剂、染料,衣药”酚类、芳展类等有机污染物降解,最鲁无机化为C02H20.而污染物中含有的南原子.磁盛子,璘原子和就摩子等则分别转化为乂-PD4J-.FG43^NH4-F.N0£等离子.因此,光催化技术具有在常温常压下遵行,彻底消除有机污染物,无二次污染等优点.光催化技术的研究涉没到朦子物理।凝聚态物理’胶体化学“化学反应动力学'催生材料、*化学•和环境牝学等多个学科,闲此多相光催化科技是集这些学科F一体的多种学科或叉汇合而成的一门新兵的科学.光催化以半导悻如TiO2,2no.Cd七,/电0力WO Q SnO2.ZnS.SrTiO iT CdSe.CdTe,InQ h FE匕Ga As-G#.Si C等作催化剂,其中TiQ具有价廉无毒、化学及物理稳定性好、耐光腐烛,催化活性好等优点,帮TiCh是目前广泛研究、效果敕好的蚩催化剂.半导体之所以能作为催化剂,是由其自身的光电特性所决定的。
华导体粒子含有能带结构.通常情况下是由一个充满电子的低能揄帝和一个空的高能导带两成.它们之前由禁帝分开.研究证明.苜pH=l肘能敛矿型Ti6的禁带宽度为3NeV.半导体的光吸收弱值二目与禁带宽度Eg的关系为X s(nm)=124O/Eg(tV)当用能黄等于或大于禁带麻度的洸(*。
BiOIZrO2光催化降解甲基橙性能研究

收稿日期:2018-08-23基金项目:河南省科技攻关项目(182102210564,182102210563);河南省高等学校重点科研项目(18A150018);郑州师范学院环境催化科研创新团队(702010);郑州师范学院大学生创新实验计划项目(DCZ2017014);郑州地方高校市级大学生创新创业训练计划建设项目作者简介:孙海杰(1982-),男,副教授,博士,研究方向为多相催化通信作者:陈凌霞(1968-),女,教授,研究方向为精细品化工BiOI/ZrO 2光催化降解甲基橙性能研究孙海杰,陈凌霞,李晓艳,杨梦丽,蔡文娟(郑州师范学院化学化工学院,环境与催化工程研究所,郑州450044)摘要:采用沉淀-浸渍法制备了不同BiOI 负载量的BiOI/ZrO 2催化剂,并考察了不同BiOI 负载量对BiOI/ZrO 2催化剂光催化降解甲基橙性能的影响.结果表明,随BiOI 负载量的增加,BiOI/ZrO 2催化剂吸附甲基橙和降解甲基橙的能力都先升高后降低.当BiOI 与ZrO 2物质的量比为0.5时,催化剂吸附甲基橙的能力和光催化降解甲基橙的能力都达到最佳,甲基橙吸附率达到了69.7%,甲基橙降解率达到了94.9%.在BiOI 负载量相同和制备方法相同情况下,BiOI 与ZrO 2物质的量比为0.5的催化剂吸附和降解甲基橙能力都比纯BiOI 的强.甲基橙在不同BiOI 负载量的BiOI/ZrO 2催化剂上降解反应为一级反应,BiOI 与ZrO 2物质的量比为0.5的催化剂上速率常数最大(0.024min -1).关键词:光催化;甲基橙;碘氧化铋;二氧化锆中图分类号:O 643.3文献标识码:APerformance of BiOI/ZrO 2Catalyst for PhotocatalyticDegradation of Methyl OrangeSUN Haijie ,CHEN Lingxia ,LI Xiaoyan ,YANG Mengli ,CAI Wenjuan(Institute of Environmental and Catalytic Engineering ,Department of Chemistry ,Zhengzhou Normal University ,Zhengzhou 450044,China )Abstract :BiOI/ZrO 2catalysts with different loadings were prepared by a precipitation-impregnation method.The effects of different BiOI loadings on the performance of BiOI/ZrO 2catalysts for the photocatalytic degradation of methyl orange were investigated.The results showed that the ability of BiOI/ZrO 2catalyst to adsorb methyl orange and degrade methyl orange was increased first and then was decreased with the increasing of BiOI loading.When the ratio of BiOI to ZrO 2was 0.5,we found the ability of the catalyst to adsorb methyl orange and the ability of photocatalytic degradation of methyl orange were the best.The adsorption rate of methyl orange reached 69.7%,and the degradation rate of methyl orange reached 94.9%.Under the same conditions of BiOI loading and preparation method ,the ability of the catalyst with a ratio of BiOI to ZrO 2of 0.5to adsorb and degrade methyl orange was stronger than that of pure BiOI.The photocatalytic degradation of methyl orange over BiOI/ZrO 2catalysts with the different BiOI loadings was followed the first order reaction ,and the rate constant over the BiOI/ZrO 2catalyst with a molar ratio of BiOI to ZrO 2of 0.5was the largest.Key words :photocatalytic ;methy orange ;BiOI ;ZrO 2随着工业的复兴,排放到环境中的有机污染物的种类和数量不断增多,环境污染问题日益严重.在目前面临的环境污染问题中,污水问题并长期处于环境污染治理问题的前列[1-2].现如今,我国的江河湖泊等都受到大面积不同程度的损害,而这些损害的来源一般都是食品加工、造纸等工业废水.在这些工业废水中,有机污染物所占的比例不断增加.而大多数有机废水具有成分复杂、毒性强、色度深、抗光解、抗热等特点,采用传统的物理[3]、生化[4]或化学氧化法[5]处理的过程中存在着降解速率低、降解周期长等问题.因此,如何高效合理地处理有机废水已经成为目前大家所关注的热点问题.随着环境污染问题的日益加剧,相对应地出现了许多新型的污水处理技术.在众多新型处理技术中,光催化降解技术显示出诱人的研究前景[6-9].作为最早出现的光催化材料TiO 2在处理污水、净化空气等时因具有无污染物、无毒、卫生安全等特点而备受关注[10].但同时由于它的禁带较宽(约3.2eV ),TiO 2只能对紫外光响应,在实际应用中受到限制.近年来,BiOI/Bi 2WO 6光催化材料[11]、BiOI 基合光催化材料[12]、AgI/BiOI 异质催化剂[13]等对可见光响应的材料被开发出来,其中BiOI 是一种具有优良光催化降解性能的催化剂.然而,在使用过程中,单独使用BiOI 作为光催化材料时存在着许多弊端,如BiOI 见光易分解等.二氧化锆是一种具有优良性能的载体,这是由于二氧化锆是唯一一种同时拥有酸性、碱性和氧化性的载体,而且二氧化锆固体是一种p-型半导体,在使用时容易形成氧空穴.因此,本文用沉淀-浸渍法制备了BiOI/ZrO 2催化剂,通过ZrO 2和BiOI 共同作用来提高BiOI 的光催化降解有机污染的性能.1实验部分1.1实验仪器和药品1.1.1药品ZrO 2(自制,制备方法见参考文献[14]),硝酸(分析纯,北京化工厂),五水合硝酸铋、氢氧化钠、聚乙烯吡咯烷酮、碘化钠(分析纯,天津市科密欧化学试剂有限公司).1.1.2实验仪器智能磁力搅拌器(ZNCL-G 型,巩义市科华仪器设备有限公司),大功率LED 光源(CEL-LED 型,北京中教金源科技有限公司),紫外可见分光光度计(TU-1800型,北京普析通用公司),循环水式真空泵(SHZ-DⅢ型,巩义市予华仪器有限责任公司).1.2催化剂制备用台秤称取0.79g Bi (NO 3)3·5H 2O ,放入500mL 圆底三颈烧瓶中,并加入150mL 蒸馏水.再称取2.0g ZrO 2、2.0g PVP (聚乙烯吡咯烷酮),倒入烧瓶中.同时放入磁子,开启搅拌.向烧瓶中加入2.5mL 3mol/L HNO 3溶液.称取0.42g NaI 固体置于小烧杯中,加入65mL 的蒸馏水溶解,备用.用1mol/L NaOH 溶液调节三颈烧瓶中的反应液pH 为2.6,之后用蒸馏水调节反应液pH 至2.7.将圆底三颈烧瓶置于60℃的恒温油浴锅中,将上述NaI 溶液倒入滴液漏斗中,缓慢滴加到三颈烧瓶中(每秒约2~3滴).滴加后,将油浴温度调节至120℃,当温度升到120℃时,冷凝回流4h .趁热抽滤,并用蒸馏水洗涤催化剂至中性.最后将制备的催化剂放入60℃真空干燥箱中干燥4h ,得到BiOI 与ZrO 2物质的量之比为0.1的BiOI/SiO 2催化剂.将Bi (NO 3)3·5H 2O的质量改为1.58、2.37、3.95、5.53、7.11g ,NaI 的量同比例增加,其他步骤同上,制备BiOI 和ZrO 2的物质的量比分别为0.2,0.3,0.5,0.7,0.9的BiOI/SiO 2催化剂.不同BiOI 和SiO 2的物质的量比的BiOI/SiO 2催化剂记作BiOI/SiO 2-x ,x 为BiOI 和SiO 2的物质的量比.1.3光催化性能评价打开LED 灯,预热30min .称取0.20g 催化剂,倒入反应釜中.移取200mL 10.06mg/L 的甲基橙溶液倒入反应釜中,放入磁力搅拌子,调节搅拌速度.将反应釜进行避光处理,时间为60min ,使反应液与催化剂吸附平衡,取样.然后,缓慢打开LED 光源的冷凝水,再打开LED 光源,在匀速搅拌下进行光催化降解反应,并间隔一定时间进行取样.取样结束后,将样品放入离心机进行离心分离,设置转速为10000r/min ,时间为10min .离心时间结束后,取出离心管,缓慢取上层的澄清液,用TU-1800型分光光度计测量溶液的吸光度.1.4催化剂表征催化剂物相在日本理学公司的Ultima IV 型X-射线衍射仪(XRD )上进行测定,使用的扫射射线是Cu K α射线,其管电压、管电流分别为40kW 、40mA ,扫描的2θ范围为10°~90°.催化剂的禁带宽度在Cary-5000型UV-Vis 漫反射吸收光谱仪上进行测定,扫描范围为200~800nm .2结果与讨论图1给出了BiOI 和ZrO 2不同物质的量比的BiOI/ZrO 2催化剂的XRD 图.可以看出,BiOI/ZrO 2催化剂样品引用格式:孙海杰,陈凌霞,李晓艳,等.BiOI/ZrO 2光催化降解甲基橙性能研究[J ].河南科学,2019,37(1):48-52.--49第37卷第1期河南科学2019年1月上出现了BiOI 和ZrO 2特征衍射峰,没有多余的衍射峰存在,说明所制备的BiOI/ZrO 2催化剂是由BiOI 相和ZrO 2相共同组成的.还可以看出,随着BiOI 和ZrO 2的物质的量比的增加,BiOI 相衍射峰的强度逐渐增强,说明所制备BiOI/ZrO 2催化剂中BiOI 相含量增加.图2为不同BiOI 与ZrO 2物质的量比的BiOI/ZrO 2催化剂的紫外可见漫反射光谱图.可以看出,二氧化锆在可见光范围内没有吸收,这是因为在可见光范围内,二氧化锆不能激发形成自由移动的电子.碘氧化铋与二氧化锆复合材料对光的响应范围扩大,且向长波方向移动.图3为ZrO 2、BiOI 和BiOI/ZrO 2-0.5催化剂的(a )为ZrO 2;(b )为BiOI/ZrO 2-0.1;(c )为BiOI/ZrO 2-0.3;(d )为BiOI/ZrO 2-0.5;(e )为BiOI/ZrO 2-0.7;(f )为BiOI/ZrO 2-0.9;(g )为BiOI图1不同物质的量比的BiOI/ZrO 2催化剂的XRD 图Fig.1XRD patterns of BiOI/ZrO 2catalyst with the different molar ratios(a )为ZrO 2;(b )为BiOI/ZrO 2-0.1;(c )为BiOI/ZrO 2-0.3;(d )为BiOI/ZrO 2-0.5;(e )为BiOI/ZrO 2-0.7;(f )为BiOI/ZrO 2-0.9;(g )为BiOI图2不同物质的量比的BiOI/ZrO 2催化剂的紫外可见漫反射光谱图Fig.2UV-Visible diffuse reflectance spectra of BiOI/ZrO 2catalyst with the different molar ratios(a )为ZrO 2;(b )为BiOI/ZrO 2-0.5;(c )为BiOI图3ZrO 2、BiOI 和BiOI/ZrO 2-0.5催化剂的紫外可见漫反射光谱图Fig.3UV-Visible diffuse reflectance spectra of ZrO 2,BiOI and BiOI/ZrO 2-0.5catalysts--50紫外可见漫反射光谱图.用截线法作出吸收波长λ0(nm ),利用公式禁带宽度E g =1240/λ0(eV )计算出禁带宽度[15].BiOI/ZrO 2-0.5催化剂禁带宽度约为1.8235eV ;纯的ZrO 2的禁带宽度约为5.0202eV ;纯的BiOI 的禁带宽度约为1.8507eV ,可见ZrO 2和BiOI 复合能拓宽催化剂的可见光的吸光范围,增强光吸收性能.BiOI/ZrO 2-0.5催化剂的可见光吸收带向长波方向移动的趋势最大,基本与纯的BiOI 的吸收带接近.图4为不同BiOI 和ZrO 2物质的量比的BiOI/ZrO 2催化剂的光催化降解甲基橙性能.可以看出,随着BiOI 和ZrO 2的物质的量比的增加,在60min 避光吸附处理过程中,BiOI/ZrO 2催化剂对甲基橙的吸附能力呈现出先增加后减少的趋势.开灯后,随着BiOI 和ZrO 2的物质的量比的增多,催化剂降解甲基橙的能力先增加后减少.当BiOI 和ZrO 2的物质的量比为0.5时,BiOI/ZrO 2催化剂对甲基橙吸附和降解能力都达到最佳.纯的ZrO 2对甲基橙吸附能力以及对甲基橙的降解能力都是零.纯的BiOI 催化剂对甲基橙的吸附能力很弱,60min 仅有13.8%的甲基橙被吸附,且纯的BiOI 对甲基橙降解性能也较差,60min 仅降解了53.5%的甲基橙.而当BiOI 和ZrO 2的物质的量比为0.5时,BiOI/ZrO 2催化剂60min 吸附了69.7%的甲基橙,60min 降解了94.9%的甲基橙.由此可知,BiOI/ZrO 2-0.5对甲基橙的吸附性能以及对甲基橙的光催化降解性能都达到最优,这说明在对甲基橙的降解过程中,ZrO 2作为载体和BiOI 催化剂共同作用,不仅可以提高BiOI 对甲基橙的吸附能力,而且也可以提高BiOI 的光催化降解性能和光稳定性能.在甲基橙与BiOI/ZrO 2组成的光催化体系中,反应动力学方程见式(1):-d c d t=kc n ,(1)式(1)中:c 为甲基橙的质量浓度,单位为mg/L ;t 为反应时间,单位为min ;k 为反应速率常数,单位为min -1;n 为反应级数.图5给出了不同BiOI 和ZrO 2物质的量比的BiOI/ZrO 2催化剂上甲基橙质量浓度的对数ln (c 0/c t )对反应时图4不同物质的量比的BiOI/ZrO 2催化剂的光催化降解甲基橙性能Fig.4Performance of BiOI/ZrO 2catalysts with the different molar ratios for photocatalytic degradation of methyl oranget )图5不同物质的量比的BiOI/ZrO 2催化剂对甲基橙的ln (c 0/c t )~t 关系曲线Fig.5Relationship between ln (c 0/c t )and t of methyl orange over BiOI/ZrO 2catalyst with the different ratios引用格式:孙海杰,陈凌霞,李晓艳,等.BiOI/ZrO 2光催化降解甲基橙性能研究[J ].河南科学,2019,37(1):48-52.--51第37卷第1期河南科学2019年1月间t 的关系.可以看出,ln (c 0/c t )与t 之间均呈良好的线性关系,表明甲基橙在不同BiOI 和ZrO 2物质的量比的BiOI/ZrO 2催化剂上的吸附和光降解反应为一级反应,该直线的斜率为反应速率常数.一级反应动力学方程的反应速率常数越大,则该反应的反应速率越快,催化剂的催化活性越好.通过拟合,得到ZrO 2、BiOI/ZrO 2-0.1、BiOI/ZrO 2-0.3、BiOI/ZrO 2-0.5、BiOI/ZrO 2-0.7、BiOI/ZrO 2-0.9和BiOI 催化剂对甲基橙光降解速率常数为0、0.015、0.019、0.024、0.018、0.016和0.005min -1,表明BiOI/ZrO 2-0.5催化剂光催化降解甲基橙的性能最好.3结论1)随BiOI 负载量的增加,BiOI/ZrO 2催化剂吸附甲基橙和降解甲基橙的能力都先升高后降低.当BiOI 与ZrO 2物质的量比为0.5时,催化剂吸附甲基橙的能力和光催化降解甲基橙的能力都达到最佳,甲基橙吸附率达到了69.7%,甲基橙降解率达到了94.9%.2)在BiOI 负载量相同和制备方法相同情况下,BiOI 与ZrO 2物质的量比为0.5的催化剂吸附和降解甲基橙能力都比纯BiOI 的强.3)甲基橙在不同BiOI 负载量的BiOI/ZrO 2催化剂上降解反应为一级反应,BiOI 与ZrO 2物质的量比为0.5的催化剂上速率常数最大(0.024min -1).参考文献:[1]孙军.我国沿海经济崛起视阔下的海洋环境污染问题及其治理[J ].江苏大学学报,2017,19(1):46-50.[2]马文霞.我国工业产业集聚与环境污染关系的研究[J ].西安石油大学学报,2016,26(1):35-41.[3]李庆云.偶氮类染料废水处理技术的研究进展[J ].当代化工,2016,45(9):2217-2220.[4]梁丽丹.我国有机磷农药废水的生化法处理研究进展[J ].环境污染治理技术与设备,2002,3(3):69-73.[5]陈莎.催化湿式氧化法处理有机废水的催化剂研究[J ].环境科学与管理,2007,32(3):119-123.[6]崔玉民.光催化技术在降解有机污染物方面的应用[J ].感光科学与光化学,2004,22(6):434-443.[7]黄进.光催化氧化降解水中有机污染物技术综述[J ].重庆环境科学,2001,23(5):30-34.[8]赫荣安.碘氧化铋光催化材料的研究进展[J ].中国材料进展,2017,36(1):17-39.[9]王燕琴.卤氧化铋光催化剂的研究进展[J ].化工进展,2014,33(3):660-667.[10]姜鸿基,李彦锋,叶正芳,等.纳米TiO 2光催化剂的制备及在降解有机物方面的研究进展[J ].功能材料,2002,33(4):360-362.[11]崔玉民,洪文珊,李慧泉,等.BiOI/Bi 2WO 6对甲基橙和苯酚光催化降解及光催化机理[J ].无机化学学报,2014,30(2):431-441.[12]赵高禹,李龙,田甜.BiOI 基复合光催化材料的研究进展[J ].广州化工,2016,44(13):18-20.[13]张琼,陈卓华,徐作成,等.AgI/BiOI 异质结催化剂的制备及其可见光催化降解酸性橙Ⅱ的性能研究[J ].中山大学学报,2012,51(6):82-102.[14]孙海杰,陈凌霞,陈秀丽,等.ZrO 2织构性质对Ru-B/ZrO 2催化剂的结构及其苯选择加氢性能的影响[J ].石油化工,2015,44(9):1066-1070.[15]邱剑勋,王承遇,陶瑛,等.TiO 2与ZnFe 2O 4薄膜禁带宽度测定及对光催化效率的影响[J ].材料导报,2003,17(3):81-82.(编辑康艳)--52。
光催化降解染料甲基橙1
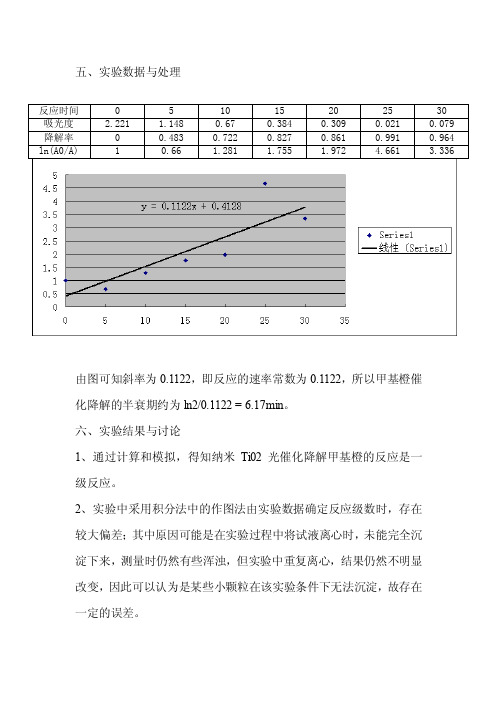
五、实验数据与处理
ln(A0/A) 1 0.66 1.281 1.755 1.972 4.661 3.336
由图可知斜率为0.1122,即反应的速率常数为0.1122,所以甲基橙催
化降解的半衰期约为ln2/0.1122 = 6.17min。
六、实验结果与讨论
1、通过计算和模拟,得知纳米Ti02 光催化降解甲基橙的反应是一
级反应。
2、实验中采用积分法中的作图法由实验数据确定反应级数时,存在
较大偏差;其中原因可能是在实验过程中将试液离心时,未能完全沉
淀下来,测量时仍然有些浑浊,但实验中重复离心,结果仍然不明显
改变,因此可以认为是某些小颗粒在该实验条件下无法沉淀,故存在
一定的误差。
七、思考题
1、实验中为什么用蒸馏水作为参比溶液来调节分光光度计的透光率值为100%?一般选择参比溶液的原则是什么?
用蒸馏水作参比溶液来调节分光光度计的透光率值为100%,以消除溶液中的水对光的吸收反射或散射造成的误差。
一般选择参比溶液的原则:当试样溶液、显色剂及所用的其它试剂在测定波长处均无吸收时,可选用蒸馏水作参比液;若有显色剂或其它试剂对入射光有吸收,应选用试剂空白为参比;若试样中其它组分有吸收,而显色剂无吸收且不与其它组分作用,应选用不加显色剂的试样溶液作参比液。
2、甲基橙溶液需要准确配制吗?
不需要。
根据实验结论可知,甲基橙浓度可以通过分光光度计测量;因此整个实验中甲基橙溶液是不需要准确配制的。
3、甲基橙光催化降解速率与哪些因素有关?
影响甲基橙光催化降解速率因素有:纳米Ti02 颗粒大小、光照强度、搅拌程度、催化剂的用量、温度、溶液初始pH、溶液初始浓度等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
光催化降解染料甲基橙
专业班次:应用化学3班学号:
姓名:日期: 2015年5月12日
1.实验目的
1、掌握确定反应级数的原理和方法;
2、测定甲基橙光催化降解反应速率常数和半衰期;
3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。
2.实验原理
国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2 H2O,而污染物中含有的卤原子、硫原子、磷原子和氮原子等则分别转化为X-,SO42-,PO43-,PO43-,NH4+,NO3-等离子。
因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。
光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。
光催化以半导体如TiO2,ZnO,CdS,Fe2O3,WO3,SnO2,ZnS,SrTiO3,CdSe,CdTe,In2O3,FeS2,GaAs,GaP,SiC,MoS2等作催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点,帮TiO2是目前广泛研究、效果较好的光催化剂。
半导体之所以能作为催化剂,是由其自身的光电特性所决定的。
半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。
研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为3.2eV,半导体的光吸收阈值λg与禁带宽度Eg的关系为
λg(nm)=1240/Eg(eV)
当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e-),在价带上产生带正电的光生空穴(h+),形成光生电子-空穴对。
空穴的能量为7.5 eV,具有强氧化性;电子则具有强还原性。
当光生电子和空穴到达表面时,可发生两类反应。
第一类是简单的复合,如果光生电子与空穴没有被利用,则会重新复合,使光能以热能的形式散发掉
e-+h+==N+energy(hv’<hv or heat)
第二类是发生一系列光催化氧化还原反应,还原和氧化吸附在光催化剂表面上物质。
TiO2→e-+h+
OH-+h+→·OH
H2O+h+→·OH+H+
A+h+→·A
另一方面,光生电子可以和溶液中溶解的氧分子反应生成超氧自由基,它与H+离子结合形成.OOH自由基:
O2+e-+H+→·O2-+H+→·OOH
2HOO·→O2+H2O2
H2O2+·O2→OH+OH-+O2
·O2-+2H+→H2O2
此外·OH,·OOH和H2O2之间可以相互转化
H2O2+·OH→·OOH+H2O2
利用高度活性的羟基自由基.OH无选择性地将氧化包括生物难以降解的各种有机物并使之完全无机化。
有机物在光催化体系中的反应属于自由基反应。
四基橙染料是一种常见的有机污染物,无挥发性,且具有相当高的抗直接光分解和氧化的能力;其浓度可采用分光光度法测定,方法简便,常被用做光催化反应的模型反应物。
四基橙的分子式如图1所示:
从结构上看,它属于偶氮染料,这类染料是染料各类中最多的一种,约占全部染料的50%左右。
根据已有实验分析,甲基橙是较难降解的有机物,因而以它作为研究对象有一定的代表性。
3.仪器试剂
722型分光光度计1台;125W高压汞灯1支;反应器1个;充气泵1个;恒温水浴1套;磁力搅拌器1台;离心机1台;台秤1台;秒表1块;移液管(10mL)2支;500 mL量筒1支;吸耳球;离心管7支。
甲基橙贮备液(1000mg/L);纳米TiO2(P25)。
4.实验步骤
1、了解可见光分光光度计的原理与使用方法,参阅有关教材及文献资料。
2、调整分光光度计零点
打开722型分光光度计电源开关,预热至稳定。
调节分光光度计的波长旋钮至462nm。
打开比色槽盖,即在光路断开时,调节“0”旋钮,使透光率值为0.取一只1cm比色皿,加入参比溶液蒸馏水,擦干外表面(光学玻璃面应用擦镜纸擦拭),放入比色槽中,确保放蒸馏水的比色皿在光路上,将比色槽盖合上,即光路通时,调节“100”旋钮使透光率值为100%。
3、四基橙光催化降解
进行光催化反应实验时,首先向反应器内加入10mL的1000 mg/L的甲基橙贮备液,并加480mL水稀释,配成500mL的20 mg/L的甲基橙溶液,然后加入0.2g纳米TiO2催化剂,磁力搅拌使之悬浮。
避光充空气搅拌30min,使甲基橙在催化剂的表面达到吸附/脱附平衡,移取10mL溶液于离心管内。
然后开通冷却水,并开启淘汰进行光催化反应25min,每隔5min 移取10mL反应液,经离心分离后,取上清液进行可见分光光度法分析。
采用722型可见分光光度计,通过反应液的吸光度A测定来监测甲基橙的光催化脱色和分解效果。
在0—20 mg/L范围内,甲基橙溶液浓度与其462nm处的吸收什呈极显著的正相关(相关系数达0.999以上)。
5.数据处理
1、设计实验数据表,记录温度。
A0,A 等数据;甲基橙降解率。
表——1
2、 采用积分法中的作图法由实验数据确定反应级数。
根据本实验的原理部分知道,该反应是一个表面催化反应,而一般表面催化反应更多的是零级反应;不妨设纳米Ti02光催化降解甲基橙的反应是一级反应:即r=k 1(a-x ); 显然,以浓度ln(a-x)对时间t 作图:
图——1
据图——1可知,在0—20min 中时ln(a-x)~t 关系成一直线,因此符合假设,即纳米Ti02光催化降解甲基橙的反应是一级反应。
3、 由所得直线的斜率求出反应的速率常数k 1
根据图——2可知:反应的速率常数k 1=0.12min
-1 。
4、 计算甲基橙光催化降解的半衰期t 1/2。
甲基橙光催化降解的半衰期t 1/2=ln2/k 1=5.78min
5、 甲基橙降解率计算:η=(c 0-c )/c 0,其中c 0为光照前降解液浓度,c 为降解后的浓度。
由于甲基橙溶液浓度和它的吸光度呈线性关系,所以降解脱色率又可以由吸光度计算,降解率/
η
0 40.12% 85.44% 91.53% 95.10% 95.10% 95.10% ln(a-x) 3.0 2.48 0.96 0.53 0 0 0
即η=(A0-A)/A0,其中A0为光照前降解液吸光度,A为降解后吸光度。
甲基橙的降解率,如表——1所示,η~t的线性关系如图——2所示。
如图——2
6.实验结果与讨论
1、通过计算和模拟,得知纳米Ti02光催化降解甲基橙的反应是一级反应。
2、500mL20 mg/L的甲基橙溶液,0.2克纳米TiO2为催化剂,在高压汞灯光照条件下,30min 中内可以最大降解率约95.10%。
3、该实验中采用积分法中的作图法由实验数据确定反应级数时,ln(a-x)~t的线性相关度为94%,存在较大偏差;其中原因可能是在实验过程中将试液离心时,未能完全沉淀下来,测量时仍然有些浑浊,但实验中重复离心,结果仍然不明显改变,因此认为是某些小颗粒在该实验条件下无法沉淀,故存在一定的误差。
7.思考题
1、实验中,为什么用蒸馏水作参比溶液来调节分光光度计的透光率值为100%?一般选择
参比溶液的原则是什么?
用蒸馏水作参比溶液来调节分光光度计的透光率值为100%,以消除溶液中的水对光的吸收反射或散射造成的误差。
一般选择参比溶液的原则:当试样溶液、显色剂及所用的其它试剂在测定波长处均无吸收时,可选用蒸馏水作参比液;若有显色剂或其它试剂对入射光有吸收,应选用试剂空白为参比;
若试样中其它组分有吸收,而显色剂无吸收且不与其它组分作用,应选用不加显色剂的试样溶液作参比液。
2、甲基橙溶液需要准确配制吗?
答:不需要;根据实验结论可知,甲基橙浓度可以通过分光光度计测量;因此整个实验中甲基橙溶液是不需要准确配制的。
3、甲基橙光催化降解速率与哪些因素有关?
影响甲基橙光催化降解速率因素有:纳米Ti02颗粒大小、光照强度、搅拌程度、催化剂的用量、温度、溶液初始pH、溶液初始浓度等。
