Mitsunobu 反应-050815
mitsunobu机理

mitsunobu机理
Mitsunobu机理是一种由日本化学家Mitsunobu Osakada提出的有机化学反应。
Mitsunobu机理通过引入特定“辅助试剂”可以实现困难的偶联反应,是有机试剂中开发和应用最广泛的种类。
Mitsunobu机理是一种加入一些碱性试剂(例如醋酸铵、三乙胺硝酸和磺酸铵)形成酯类反应物的反应,利用其机理可以实现有机物和其他有机
物之间的偶联反应,而不需要进行难以实现的加成反应。
Mitsunobu机理也是一种可用于制备高分子有机物的重要反应。
Mitsunobu机理可将有机物升级,在反应过程中,以一种叫做“被动态”饮料的形式将有机物由LDA转化为其他活性加成反应物,从而实现高值有
机物的制备。
另外,Mitsunobu机理还可以用来实现复杂的化学体系的合成,如生物有机物的合成,因此Mitsunobu机理也可以用于药物及其他生物大分子的
合成。
此外,Mitsunobu机理可以用于更有用的反应中,例如光催化控制的合成,将Mitsunobu机理的反应用在光催化中,可以实现更可控的反应条件,获得更高的反应效率及不可重复的物质产物。
而且Mitsunobu机理也可以
在非常低温下进行,可大大降低生产污染。
总之,Mitsunobu机理是一种非常重要的反应机理,它可以在低温、高纯、无污染的环境中应用。
Mitsunobu机理的应用范围很广,它可以合成高分子的有机化学物质,广泛用于合成药物和生物分子,甚至可以应用到光催化反应中,具有广泛而重要的应用前景。
Mitsunobu反应(光延反应)有替代方法了,底物范围得到极大丰富

Mitsunobu反应(光延反应)有替代方法了,底物范围得到极大丰富醇的羟基可以通过其它试剂活化,因此是一个潜在的亲电试剂,可以和各种亲核试剂进行反应。
其中该类反应还诞生了几个人名反应,Appel反应和Mitsunobu反应是比较著名的两个。
然而上述几类反应虽然使用广泛,但是或多或少还存在一些缺点。
对Mitsunobu反应来说,首先对亲核试剂的酸度有要求,基本上需要pKa ≤ 15,小于11是最理想的选择。
其次,偶氮类化合物在加热条件下或其它因素影响下有爆炸的危险。
第三,反应操作过程中需要慢慢滴加反应试剂。
因此,发展安全易操作的醇的脱氧亲核取代显得很有必要和意义。
最近来自上海有机所的Xiao团队报道了Ph3P/ICH2CH2I体系用于醇类底物的高效脱氧取代反应,构建C-O, C-N, C-S和C-X (X = Cl, Br, and I)等键(图1)。
图1:醇的脱羟基亲核取代反应。
图片来源:Chem. Commun.作者首先进行了构建C-N键和C-S键的反应研究。
该反应体系不仅对苄醇有良好的包容性,脂肪醇也可较好地参与反应。
此外,亲核试剂可以是芳胺,咪唑,叠氮酸,也可以是芳基硫酚,也可以是烷基硫醇。
最高可以达到定量的产率(图2)。
图2:构建C-N和C-S键。
图片来源:Chem. Commun.作者接着进行了构建C-O和C-X键的研究。
从图3可以看出,苄醇或脂肪醇可以高效地与酚的钠盐,醇的钠盐,羧酸钠盐以及卤素的钠盐或四丁基卤素铵盐反应,产率最高可达到99%(图3)。
图3:构建C-O和C-X键。
图片来源:Chem. Commun.除了1,2 -二碘乙烷,其它的1,2 -二碘乙烷衍生物也可很好地进行反应(图4)。
图4:构建C-O和C-X键。
图片来源:Chem. Commun.该方法还可用于氧标记醇的合成(图5)。
图5:氧标记醇的合成。
图片来源:Chem. Commun.作者提出了如图6的反应机理(图6)。
羟基变为氨基mitsunobu反应

Mitsunobu反应是一种常用的有机合成反应,通常用于将一个官能团转化为另一个官能团。
其中,羟基转化为氨基的Mitsunobu反应也是一种常见的应用。
在这种反应中,通常使用三种试剂:胺、亚磷酸酯和醇。
具体反应机理如下:
1. 胺和亚磷酸酯反应,生成亚胺盐。
2. 醇和亚胺盐反应,生成胺盐和磷酸酯。
3. 胺盐和另一种醇反应,生成最终的产物和水。
在这个过程中,羟基被转化为氨基,而胺被还原为亚胺盐。
最终产物中的氨基可以进一步用于合成其他化合物。
需要注意的是,Mitsunobu反应的反应条件通常比较温和,但反应时间较长,需要较长时间的反应才能得到较高的产率。
此外,反应中使用的试剂也需要注意安全使用,避免产生有害气体或危险物质。
mitsunobu反应合成叠氮

mitsunobu反应合成叠氮
Mitsunobu反应是一种重要的有机合成方法,它通常用于醇和
酚的官能团转化。
然而,要将Mitsunobu反应应用于叠氮化合物的
合成则需要考虑一些特殊因素。
首先,叠氮化合物的合成通常需要使用亲核试剂来进行亲核取
代反应。
Mitsunobu反应的反应条件可能对叠氮化合物的稳定性造
成影响,需要谨慎选择反应条件以避免叠氮基团的分解或其他副反
应的发生。
其次,选择适当的试剂对于Mitsunobu反应合成叠氮化合物至
关重要。
通常情况下,选择合适的叠氮前体以及磷酸酯、二醇和亚
砜等试剂是至关重要的。
需要仔细考虑试剂的选择以及反应条件的
优化,以确保叠氮化合物能够有效地合成。
此外,Mitsunobu反应合成叠氮化合物的反应机理可能会有所
不同,需要进行详细的研究和优化。
叠氮化合物的合成通常需要考
虑其稳定性、反应条件、试剂选择以及反应机理等多个方面的因素。
总的来说,虽然Mitsunobu反应在醇和酚的官能团转化中表现
出色,但要将其应用于叠氮化合物的合成则需要更多的研究和优化工作。
对于合成叠氮化合物,研究人员需要仔细考虑反应条件、试剂选择以及反应机理等多个方面的因素,以确保叠氮化合物能够高效地合成。
希望这些信息能够对你有所帮助。
Mitsunobu反应

经典化学合成反应标准操作Mitsunobu 反应编者:谢军药明康德新药开发有限公司化学合成部目录1.前言 (2)2.醇的翻转 (3)2.1 Mitsunobu 法醇的构型翻转合成方法示例 (7)3.Mitsunobu 醚化反应 (8)3.1 Mitsunobu 法醚的合成方法示例 (9)4.Mitsunobu 氨基取代反应 (10)4.1 Mitsunobu 法利用苯磺酰胺合成胺方法示例 (13)4.2 Mitsunobu 法利用DPPA合成伯胺方法示例 (13)4.3 Mitsunobu 法分子内关环合成相应的环状胺方法示例 (14)4.4 Mitsunobu 法合成丙二烯方法示例 (14)5.Mitsunobu 硫代反应 (16)5.1 Mitsunobu 法合成硫醚方法示例 (16)6.Mitsunobu 卤代反应 (18)6.1 Mitsunobu 法合成卤代物方法示例 (18)7.其他手性翻转试剂 (20)1. 前言1967年,Oyo Mitsunobu 报导了在三苯膦(PPh3)和偶氮二甲酸二乙酯(DEAD)作用下酸和醇缩合成酯的新方法1。
当底物为仲醇的时候,与羟基相连的碳原子的构型会发生翻转。
经过多年的研究和发展,形成了一大类合成方法,我们称之为Mitsunobu 反应。
这类反应被广泛应用在有机合成,特别是天然产物的合成中2。
2.醇的翻转在Mitsunobu 反应中,DEAD 和三苯膦首先生成一个活性的甜菜碱式中间体(betaine intermediate ),这个活性中间体夺取作为亲核试剂的酸的质子并同时活化醇,随后经过S N 2取代,得到手性翻转的酯;将得到的酯水解,其净结果是醇的构型翻转。
R O R OH Ar O23反应在很温和的条件下进行,通常反应温度是在0o C 到室温,大部分基团都不会影响反应。
但亲核试剂质子的pKa 值必须小于甜菜碱式中间体(betaine intermediate )的pKa 值(~13),否则亲核试剂的质子不能被中间体(betaine intermediate )夺取,反应不能进行。
Mitsunobureaction光延反应

Mitsunobureaction光延反应在二烷基偶氮二羧酸盐和三烷基或三芳基膦存在下,伯醇和仲醇被亲核试剂取代,被称为Mitsunobu reaction(光延反应)1967年O. Mitsunobu(光延旺洋)等报道,在偶氮二羧酸二乙酯(DEAD)和三苯基膦(Ph3P)的存在下,仲醇可以有效地与羧酸进行酰化。
几年后,研究表明,在该反应条件下,具有光学活性的仲醇的构型发生了完全的反转。
后来发现,这一方法对于合成具有旋光活性的胺、叠氮化物、醚、硫醚甚至烷烃都是通用的。
最早发表:Mitsunobu, O.; Yamada, M. Bull. Chem. Soc. Jpn. 1967, 40, 2380−2382. 综述:Mitsunobu, O. Synthesis 1981, 1−281)伯、仲醇是最佳底物,仲醇的构型完全翻转;2)叔醇不发生反应,但某些叔丙炔醇已成功转化;3)亲核试剂为较酸性化合物(pKa≤15);4)在氧亲核试剂中,羧酸生成酯、醇和酚生成醚,而硫醇和硫酚生成硫醚;5)常见的氮亲核试剂有亚胺、羟基酸、氮杂环、酰肼;6)也可以形成碳碳键,但亲核试剂主要是活性亚甲基化合物(β-二酮、β-酮酯等);然而,β-二酯的反应活性性较低;7)分子内反应也可行,可制备3-、4-、5-、6-、7元环醚和环胺;8)当卤化物离子源(如烷基、酰基卤化物、卤化锌)与DEAD/Ph3P 一起使用时,醇底物会转化为相应的伯卤和仲卤化物;9)反应通常在四氢呋喃中进行,但也可以使用1,4-二氧六烷和DCM;10)Ph3P或 (n-Bu)3P是最常用的磷酸盐;11)偶氮二羧酸试剂通常是DEAD和DIAD,这两种试剂可以互换使用;12)反应温度通常在0 ℃至25 ℃之间,但某些位阻基底可能需要更高的温度;13)在典型的程序中,将膦、醇和亲核试剂的混合物溶解,随后滴加偶氮二甲酸酯溶液;或者,偶氮二甲酸酯先与膦反应,然后醇和亲核试剂的混合溶液滴加。
mitsunobu反应常用溶剂

mitsunobu反应常用溶剂摘要:1.Mitsunobu 反应简介2.Mitsunobu 反应的常用溶剂3.溶剂选择对反应的影响4.实际应用案例正文:一、Mitsunobu 反应简介Mitsunobu 反应是一种将醇通过氧化剂的作用转化为醛或酮的化学反应,该反应由日本化学家Mitsunobu, O.于1967 年发现。
该反应的特点是条件温和,产率高并带有构型翻转。
在有机合成领域,Mitsunobu 反应被广泛应用于各种醇的转化,为制备复杂化合物提供了有效的手段。
二、Mitsunobu 反应的常用溶剂Mitsunobu 反应常用的溶剂包括以下几种:1.乙醚2.乙酸乙酯3.乙醇4.丙酮5.氯仿6.苯这些溶剂在反应过程中起到溶解反应物、提高反应速率和调节反应平衡的作用。
三、溶剂选择对反应的影响溶剂的选择对Mitsunobu 反应的产率和选择性有重要影响。
一般来说,极性溶剂有利于反应的进行,非极性溶剂则不利于反应。
此外,溶剂的沸点、溶解度和稳定性也会对反应产生影响。
在实际操作中,需要根据反应物的性质和反应条件选择合适的溶剂。
四、实际应用案例Mitsunobu 反应在实际应用中有很多案例,例如:1.用于制备醛和酮:通过Mitsunobu 反应,可以将醇转化为醛或酮,从而用于合成复杂的有机化合物。
2.用于合成生物活性分子:在药物化学和生物化学领域,Mitsunobu 反应常被用于合成生物活性分子,如药物和生物标志物等。
3.用于合成高分子材料:Mitsunobu 反应可用于制备具有特定性能的高分子材料,如耐热、耐腐蚀和生物相容性等。
总之,Mitsunobu 反应在有机合成领域具有重要意义,而溶剂的选择则是影响反应效果的关键因素。
mitsunobu反应常用溶剂

mitsunobu反应常用溶剂一、mitsunobu反应简介mitsunobu反应,又称mitsunobu偶联反应,是一种有机化学中的常见反应,通常用于合成含有一个或多个立体中心的有机化合物。
该反应以日本化学家Teruaki Mitsunobu命名,其基本原理是将一个有机化合物与另一个有机化合物通过磷化合物进行偶联。
在mitsunobu反应中,溶剂的选择至关重要,因为它直接影响到反应的速率和产物的纯度。
二、mitsunobu反应常用溶剂类型及特点1.醇类溶剂醇类溶剂在mitsunobu反应中应用广泛,如甲醇、乙醇、异丙醇等。
它们具有良好的极性,可以促进反应物之间的相互作用,提高反应速率。
同时,醇类溶剂对环境友好,易于生物降解。
但需要注意的是,过量使用醇类溶剂可能导致反应温度升高,使反应失控。
2.醚类溶剂醚类溶剂如乙醚、甲醚等,在mitsunobu反应中也具有重要作用。
醚类溶剂的极性较低,可以降低反应物之间的相互作用,使反应在较低温度下进行。
此外,醚类溶剂具有较高的沸点,可以提高反应物的蒸汽压,促进反应进行。
但醚类溶剂有毒性,使用时需注意安全。
3.酯类溶剂酯类溶剂如乙酸乙酯、丙酸乙酯等,也在mitsunobu反应中有一定的应用。
酯类溶剂具有较低的极性,可以提高反应物的溶解度,促进反应进行。
同时,酯类溶剂具有较宽的沸点范围,有利于分离和提纯反应产物。
但酯类溶剂对某些催化剂有抑制作用,使用时需注意。
4.非极性溶剂非极性溶剂如石油醚、环己烷等,在mitsunobu反应中也有应用。
非极性溶剂可以降低反应物的相互作用,使反应在较低温度下进行。
此外,非极性溶剂可以提高反应物的蒸汽压,促进反应进行。
但非极性溶剂对某些催化剂有失活作用,使用时需注意。
三、溶剂选择对mitsunobu反应的影响溶剂选择对mitsunobu反应的影响主要表现在反应速率、反应温度、催化剂活性、产物纯度等方面。
合适的溶剂可以提高反应速率,降低反应温度,提高催化剂活性,有利于产物的纯化。
mitsunobu反应现象

mitsunobu反应现象Mitsunobu反应是一种有机合成中常用的反应方法,以日本化学家三宅光信的名字命名。
该反应可以将醇和酸互变为醚,是一种重要的醚化反应。
Mitsunobu反应的基本原理是通过亲核试剂(如醇)与亲电试剂(如酸)反应生成一个活化的试剂,然后与底物发生反应。
这个活化的试剂通常是底物与酸的复合物,通过一系列的步骤进行反应,最终生成醚。
Mitsunobu反应的步骤主要包括以下几个方面:1. 活化试剂的生成:首先将底物与酸混合,生成一个活化的试剂。
这个活化的试剂具有较强的亲电性,可以与亲核试剂发生反应。
2. 亲核试剂的加入:将亲核试剂(醇)加入到活化的试剂中,形成中间体。
3. 中间体的分解:中间体会经历一个断裂的过程,生成一个活化的烷基试剂和一个酸。
这个活化的烷基试剂是反应的关键中间体。
4. 底物的加入:将底物加入到活化的烷基试剂中,发生反应。
这个反应是醚化反应的关键步骤。
5. 生成醚:经过一系列的步骤,底物与活化的烷基试剂发生反应,最终生成醚化合物。
Mitsunobu反应的优点是反应条件温和,底物范围广泛,可以用于合成不同类型的醚化合物。
此外,该反应不需要氧气和高温,反应条件较为温和,适用于实验室和工业生产中。
然而,Mitsunobu反应也存在一些限制。
首先,该反应需要使用亲电试剂,所以对于一些亲电试剂活性较低的底物来说,反应效果可能不理想。
其次,该反应所需的试剂较多,反应步骤较多,操作较为繁琐,需要进行一系列的实验室操作。
总的来说,Mitsunobu反应作为一种重要的有机合成方法,广泛应用于醚化反应中。
它的独特反应机理和优点使得它在有机合成中具有重要的地位。
未来,随着对于更高效、更环保的有机反应方法的研究,Mitsunobu反应可能会得到更广泛的应用和改进。
Mitsunobu_反应研究进展

湖南工程学院课程论文学院化学化工学院班级姓名学号课程论文题目Mitsunobu反应研究进展课程名称科学前沿讲座评阅成绩成绩评定老师签名日期:2014年09月25日Mitsunobu 反应研究进展摘要Mitsunobu 反应可以在温和的中性反应条件下形成C—O, C—N, C—S, C—C等键, 因此被广泛地应用于各类天然产物的全合成或化合物的官能团转化, 是一个比较重要的反应.关键词Mitsunobu 反应; 研究; 进展; 合成; 综述Recent Progress of Mitsunobu ReactionAbstract Mitsunobu reaction is one of the most efficient methods for the construction of the C—O, C—N,C—S and C—C bonds under mild and neutral conditions which is widely used in the total synthesis of various natural products and the transformation of functional group, and this paper reviews the recent progress of such reaction.Keywords Mitsunobu reaction; research; progress;synthesis; review官能团的转化在有机合成化学中占了极其重要的地位, 我们在合成中经常需要进行官能团转化, 构建新的化学键, 如C—O, C—N, C—S, C—C等化学键. 而Mitsunobu 反应[1](Eq. 1)是在偶氮二碳酸二乙酯(DEAD)或者偶氮二碳酸二异丙酯(DIAD)和三苯基膦作用下,醇类化合物和酸性化合物发生分子内或分子间脱水反应, 形成C—O, C—N, C—S, C—C等键的反应. 它最早是在1967 年由Mitsunobu 等[2]发现. Mitsunobu 反应一般是在温和的中性条件下进行的, 同时, 如果是手性醇参加反应, 醇羟基所连碳原子的绝对构型一般会发生翻转, 因此, Mitsunobu 反应广泛应用于各类天然产物的全合成或化合物的官能团转化, 是一个应用范围较为广泛的反应. 本文就近年来Mitsunobu 反应的研究进展作一简要的综述.1 Mitsunobu 反应的机理研究Mitsunobu[1]认为, 该反应经过如Scheme 1 所示四个过程. (a) DEAD (1)和三苯基膦(2)进行加成, 形成季鏻盐3, (b)对季鏻盐 3 进行质子化, (c)形成烷氧鏻盐4,(d)发生SN2型取代反应, 构型发生翻转, 生成产物R2X.这是一个氧化还原反应, 三苯基膦被氧化成为三苯氧膦, 偶氮二碳酸二乙酯被还原成为肼二碳酸二乙酯.近年来, 对Mitsunobu 反应机理研究得比较多[3~5],美国化学家Varasi 等结合以前的研究基础, 以及自己在实验中发现的一些现象, 用31P NMR 对Mitsunobu 反应进行了仔细的研究. 结合实验结果, 他提出了如Scheme 2 所示的反应机理. 他发现, 酸性化合物在反应过程中加入的时间不同, 反应的机理就有所不同. 反应的第一步仍然是DEAD (1)和三苯基膦(2)进行加成, 形成季鏻盐3. 当 3 形成时酸存在于反应体系中, 或者此时加入酸, 季鏻盐 3 就会马上发生质子化形成中间体5. 此时加入醇, 中间体 5 就会缓慢的形成鏻盐4, 接着发生S N2取代反应并生成产物. 当 3 形成时, 如反应体系中没有酸存在, 此时加入醇, 一半季鏻盐 3 会与醇发生反应,形成二烷氧基鏻盐6, 在此时加入酸, 剩下的季鏻盐会发生质子化生成5, 而 6 也会很快和酸发生反应生成鏻盐4, 同时释放出一半的醇去和中间体 5 发生反应. 在此反应过程中, 从 5 到 4 的反应过程非常慢, 从 6 到 4 的反应过程则非常快.2 Mitsunobu 反应完成的官能团转换通常, 邻溴代醇类化合物的醚化比较困难, 尤其是形成芳基醚的情况. Santhosh 等[6]用Mitsunobu 反应实现了这一过程(Scheme 3), 酚和邻溴代醇吡喃化合物在Mitsunobu 反应条件下进行醚化, 条件温和, 产率和立体选择性都比较好. 有趣的是, 顺式化合物7 与酚在Mitsunobu 反应条件下醚化, 得到反式的醚化物8, 而反式化合物9 与酚进行同样的反应, 也得到了反式的醚化物8. 这一立体选择性与通常Mitsunobu 反应中的立体选择性有所不同, 可能是位阻原因造成的.光学纯的芳基环氧化合物在天然产物的手性合成中具有很重要的作用, 它一般是通过立体选择性环氧化的方法进行合成, 但对于末端烯烃如苯乙烯, 环氧化比较困难. Weissman 等[7]用Mitsunobu 反应轻松地拿到了手性芳基环氧化合物. 他先将苯乙烯化合物10 用Sharpless 不对称双羟化反应进行双羟化得到邻二醇化合物11, 继而在Mitsunobu 反应条件下进行分子内醚化,以大于99 %的ee 值得到手性芳基环氧化合物12 (Scheme 4). 这一反应对于芳环上连有拉电子基团的化合物比较有效. 因为Sharpless 不对称双羟化反应和Mitsunobu 反应都易于操作, 使得这一反应在有机合成中的应用前景比较广阔.合成取代肼类化合物是近年来研究的热点. Jamart[8]以化合物13 为原料, 通过Mitsunobu 反应合成了化合物14, 然后脱去邻苯二甲酰基就可以得到1,1-二取代的肼15 (Scheme 5). 从而证明化合物13 在Mitsunobu 反应中是一个很好的酸, 可以和一级、二级或者苄基醇进行烷基化反应.Rafferty[9]用Mitsunobu 反应发展了一条合成取代苄胺的新方法. 用活化的苄醇16 和取代的胺进行Mitsunobu 反应, 以较好的产率得到了取代的苄胺17(Eq. 2). 这些苄胺是合成一些杂环化合物的关键中间体.Gougoutas[10]发展了一种合成磺酸酯的新方法. 他是在Mitsunobu 反应条件下用手性的二级醇18 和甲磺酸进行酯化, 得到构型翻转的磺酸酯19 (Eq. 3).膦酸酯的应用比较广泛, 但以往合成膦酸酯的方法都比较烦琐. Campbell[11,12]将Mitsunobu 反应应用好的效果(Eq. 4).Zbiral[13]用苯硫酚和醇22在Mitsunobu 反应条件下合成硫醚23, 同时化合物的绝对构型发生翻转(Eq.5).Dziadulewicz[14]发现咪唑25 可以和醇24 在Mitsunobu 反应条件下反应, 得到N-烷基取代的咪唑26(Eq. 6). 这一方法简便易行, 收率也比较好, 为合成手性的离子液提供了原料.\Silks[15]用Mitsunobu 反应对硒化物进行烷基化. 硒化物27 和醇或者卤代物在Mitsunobu 反应条件下进行反应, 分别以82 %~92 %和76 %~97 %的产率得到了Se烷基化产物28 (Eq. 7).Jackson[16,17]用一级胺29 和二氧化碳在Mitsunobu条件下反应, 合成了异氰酸酯33. 当用三苯基膦反应时, 只有烷基胺的产率较高, 而用三丁基膦反应时, 烷基胺和芳基胺的收率都很好. 他认为反应是这样进行的, 一级胺先和二氧化碳反应生成化合物30, 30 再和Mitsunobu 反应的中间体进行反应, 生成中间体31 和32, 32 脱去31 上的氢, 生成异氰酸酯33 (Scheme 6).在Mitsunobu 反应条件下也可以发生碳烷基化反应, 生成新的碳碳键. 一般情况下, Mitsunobu反应在碳碳键的形成中应用不大, 主要是因为一般碳氢键氢的酸性都比较弱. Macor[18]用邻硝基芳基乙腈34 作为酸, 与醇发生Mitsunobu 反应, 形成碳碳键, 生成化合物35(Eq. 8).化合物36 也可以作为酸在Mitsunobu 条件下和手性醇发生反应形成手性的碳碳键[19](Eq. 9). 它可以作为丙二酸二乙酯的替代物, 相比丙二酸二乙酯来说它有两个优点, 一是避免了二烷基化反应, 二是有其他官能团存在时反应不受影响.丙二酸二三氟乙酯(38)在经典的Mitsunobu 反应条件下可以和一级醇、部分二级醇发生反应, 得到单烷基化或者双烷基化产物39 (Eq. 10). 它在Mitsunobu 烷基化反应中可以作为方便实用的碳亲核试剂[20].Meldrum 酸40 在有机合成中是一个非常有用的合成子. 它同烯丙醇和苄醇进行Mitsunobu 烷基化反应,得到了很高产率的二烷基化产物41[21]. 这是Mitsunobu 反应首次应用于高度烯醇化并含有β-二羰基环状化合物的碳烷基化反应(Eq. 11).3 Mitsunobu 反应在合成复杂化合物中的应用杯环芳烃在20世纪得到了广泛的发展, 主要是因为其对反应具有区域选择性. Bitter[22]首次用Mitsunobu 反应实现了对叔丁基硫代杯环芳烃42 的选择性氧烷基化, 得到1,3 醚化的产物43. 可以在杯环芳烃上面接上不同的官能团, 从而以简捷的方法得到了用别的方法不易得到的含有反应活性官能团的中间体(Eq. 12).Bitter[23]用对叔丁基硫代杯环芳烃42 和低聚1,2-乙二醇进行Mitsunobu 偶联, 得到1,3-杯冠化合物44. 这一新方法的优点有: 反应时间短, 条件温和, 产率与其他环化方法接近等. 这一方法可以大量地制备1,3-杯冠化合物, 从而为1,3-杯冠化合物的合成提供了简便的方法(Eq. 13).Mulzer[24]发展了一条新的而且很有效的合成手性α-氨基酸的路线. 此路线的关键步骤是手性二级烯丙醇45 与邻苯二甲酰亚胺进行Mitsunobu反应, 得到构型完全翻转的氨基醇化合物46 , 经过官能团转化, 最终得到手性α-氨基酸47 (Scheme 7).Etoposide (48)是一种已经应用于临床的治疗肺癌的药物, 研究表明, 它很容易被水解或者发生差向异构化, 生成羟基酸或者顺式的内酯酮. Kadow[25]报道了一种简单的方法, 将化合物48 转化为内酰胺52, 他认为内酰胺52 不容易水解和发生差向异构化, 同时又保持了化合物48 的抗癌活性. 先将48 与肼在MeOH/AcOH体系中回流, 可以得到化合物49. 49 与过量的苯甲醛反应, 得到化合物50. 化合物50 进行分子内的Mitsunobu 环化反应, 得到预期的环化产物51. 将51 用Raney 镍进行还原, 就得到了内酰胺52 (Scheme 8) .Danishefsky[26]在合成大环化合物15-Aza-dEpoB(59)时, 用Mitsunobu 反应作为关键步骤, 翻转羟基的构型, 同时引入氮原子. 他用手性醇53 与叠氮酸发生Mitsunobu 反应, 得到构型翻转的叠氮化合物54, 接着进行钯催化下的Suzuki 偶联反应得到化合物55. 还原55 的叠氮基成氨基, 用Boc 保护氨基得到化合物56. 56 进行Ru 催化下的Noyori 还原, 生成化合物57. 脱去化合物57 中的Boc 保护基, 将酯水解成酸, 分子内关环,得到化合物58, 脱去Troc 保护基, 最终合成了大环化合物59 (Scheme 9).1996年Hoger[27]将Mitsunobu 反应首次用于以芳基醚作为连接骨架的树枝状化合物的合成中, 如Scheme 10 所示. 他以3-羟基间苯二甲酸酯60 为起始原料, 用硅试剂保护酚羟基得到化合物61, 还原酯基得到二醇化合物62. 化合物62 和化合物60 发生Mitsunobu 反应, 得到了一级树枝状化合物63, 脱去63 的硅保护基得到化合物64, 64 继续与62 进行Mitsunobu 反应, 就可以得到二级树枝状化合物65.为了寻找比抗坏血酸66 具有更好活性的化合物,人们一般对抗坏血酸进行碳烷基化或者氧烷基化, 合成抗坏血酸的衍生物. 但由于抗坏血酸上面含有四个羟基, 对其选择性氧烷基化比较麻烦. Hindsgaul[28]用Mitsunobu 反应实现了对抗坏血酸 3 位羟基的选择性烷基化, 如Scheme 11所示. 将抗坏血酸的DMF 溶液在-78 ℃下与DEAD、三苯基膦混合, 然后与醇发生反应得到单一的产物, 经过与文献对比, 确定此产物为3-氧烷基化产物68. Hindsgaul 认为反应是经过67 这个中间体进行的. 利用这一反应, 通过两次Mitsunobu 反应, 还可以得到2,3-不同取代的二烷基化产物. 这一反应的优点, 一是不需要保护5,6-位的羟基, 缩短了反应步骤;二是一般的醇都可以进行反应, 原料易得; 三是反应条件温和, 易于操作.Ko[29]发现顺式的α,β-二羟基酯类化合物进行Mitsunobu 反应时, 对于β位的羟基有完全的区域选择性(Scheme 12). 他将α,β-不饱和酯69 用Sharpless 不对称双羟化试剂进行双羟化, 得到顺式的α,β-二羟基酯70, 70 再与叠氮酸进行Mitsunobu 反应, 就得到反式的α-羟基-β-叠氮基酯71. 如果70 先与PPTS 进行Mitsunobu 反应, 得到反式的α-羟基-β-对甲苯磺酯基酯72, 接着用叠氮基取代对甲苯磺酯基就可以得到顺式的α-羟基-β-叠氮基酯73. 在这几步反应中, 顺式的α,β-二羟基酯类化合物进行Mitsunobu 反应时, 只有β位的羟基参与反应, α位的羟基几乎不参与反应, 表现出完全的区域选择性. Ko 的解释是: 由于酯基的拉电子效应使得α位的羟基具有更强的酸性, 同样的效应使得β位的羟基氧上的非键合电子具有更强的亲核性. 那么在适当的条件下, 亲电试剂将会选择同β位的羟基进行反应. 由于这一选择性, 就可以由顺式的α,β-二羟基酯类化合物得到顺式的和反式的一对非对映异构化合物, 这样就使得Sharpless 不对称双羟化反应的应用更加广泛.周其林等[30]将消旋二级醇76 与邻苯二甲酰亚胺75 在手性环状膦胺试剂74 及DEAD存在下进行Mitsunobu 反应, 得到了取代的二酰亚胺(+)-77以及没有反应的光学纯的醇(+)-76 (Eq. 14). 这样就达到了对二级醇进行拆分的目的, 这在有机合成中是非常有用的. 尽管目前这一反应的非对映选择性还不是太好, 但如果找到比较好的手性膦试剂, 非对映选择性将会得到相应提高.Chandrasekhar[31]用(1S)-2-酮蒎酸79 作为手性辅助剂, 在Mitsunobu 反应条件下对消旋的二级醇78 进行拆分, 得到没有反应的醇及相应的酯80, 反应的非对映选择性比较高, de 值大于75 % (Eq. 15). 将得到的酯水解后, 得到手性的醇. 这样就将消旋的二级醇拆分得到了一对对映异构体, 反应的收率在75 %左右, ee 值在80 %左右.近年来人们对Mitsunobu 反应的研究和应用在不断深入, 尤其在天然产物的全合成方面应用较多. 如张雅文等[32]用Mitsunobu 反应对化合物81 的羟基进行苯基化作为关键反应步骤, 合成了(4S)-苯氧基-(S)-脯氨酸82(Scheme 13).潘鑫复等[33]将Mitsunobu 反应应用在1,4-手性苯并二氧六环木脂素的不对称全合成中, 作为构建手性1,4-苯并二氧六环骨架的关键步骤(Scheme 14).Hughes 等[34]利用Mitsunobu 环化反应作为关键步骤, 合成了Bassiatin 及其立体异构体. 在Mitsunobu 环化反应中, Marianne 发现反应物的滴加速度影响着产物的立体构型(Scheme 15).Lepore 等[35]发现超声波可以加速酚与醇的Mitsunobu 反应速度, 尤其是空间位阻比较大的时候更能得到比较好的效果(Scheme 16).Alvarez等[36]采用Mitsunobu 反应和Baeyer-Villiger 反应作为关键步骤, 采用固相合成法合成了片螺素L, U(Scheme 17), 这也是首次利用固相合成片螺素.4 结束语综上所述, 在温和的Mitsunobu 反应条件下, 醇类化合物和酸性化合物发生反应, 形成C—C, C—O, C—N, C—S 等新化学键, 而且, 对于手性醇类化合物, 其绝对构型在反应后一般都发生翻转. 因此, Mitsunobu反应广泛用于天然产物的全合成, 可以合成一些结构特殊的化合物, 用于官能团的转化、保护以及化合物构型的转化等方面. 可以预见, 随着人们对其研究的深入, 它的用途必将更加深入和广泛.References[1] Mitsunobu, O. Synthesis 1981, 1.[2] Mitsunobu, O.; Yamada, M. Bull. Chem. Soc. Jpn. 1967, 40, 2380.[3] Crich, D.; Dyker, H.; Harris, R. J. J. Org. Chem. 1989, 54, 257 and references therein.[4] V arasi, M.; Walker, K. A. M.; Maddox, M. L. J. Org. Chem. 1987, 52, 4235 and references therein.[5] Hughes, D. L.; Reamer, R. A.; Bergan, J. J.; Grabowski, E. J. J. J. Am. Chem. Soc. 1988, 110, 6487 and referencestherein.[6] Santhosh, K. C.; Balasubramanian, K. K. Synth. Commun. 1994, 24(8), 1049.[7] Weissman, S. A.; Rossen, K.; Reider, P. J. Org. Lett. 2001, 3, 2513.[8] Brosse, N.; Pinto, M.; Jamart, B. J. Org. Chem. 2000, 65, 4370.[9] Nikam, S. S.; Kornberg, B. E.; Rafferty, M. F. J. Org. Chem. 1997, 62, 3754.[10] Anderson, N. G.; Lust, D. A.; Malley, M. F.; Gougoutas, J. Z. J. Org. Chem. 1996, 61, 7955.[11] Campbell, D. A. J. Org. Chem. 1992, 57, 6331.[12] Campbell, D. A.; Bermak, J. C. J. Org. Chem. 1994, 59, 658.[13] Loibner, H.; Zbiral, E. Helv. Chim. Acta 1976, 59, 2100.[14] Kim, E. J.; Koa, S. Y.; Dziadulewicz, E. K. Tetrahedron Lett. 2005, 46, 631.[15] Wu, R.; Odom, J. D.; Dunlap, R. B.; Silks, L. A. Tetrahedron: Asymmetry 1999, 10, 1465.[16] Horvath, M. J.; Saylik, D.; Elmes, P. S.; Jackson, W. R. Tetrahedron Lett. 1999, 40, 363.[17] Saylik, D.; Horvath, M. J.; Elmes, P. S.; Jackson, W. R. J. Org. Chem. 1999, 64, 3940.[18] Macor, J. E.; Wehner, J. M. Tetrahedron Lett. 1991, 32, 7195.[19] Hillier, M. C.; Desrosiers, J. N.; Marcoux J. F.; Grabowski, E. J. J. Org. Lett. 2004, 6, 573.[20] Takacs, J. M.; Xu, Z. R.; Jiang, X. T.; Leonov, A. P.; Theriot, G. C. Org. Lett. 2002, 4, 3843.[21] Shing, T. K. M.; Li, L. H.; Narkunan, K. J. Org. Chem. 1997, 62, 1617.[22] Bitter, I.; Csokai, V. Tetrahedron Lett. 2003, 44, 2261.[23] Csokai, V.; Grun, A.; Bitter, I. Tetrahedron Lett. 2003, 44, 4681.[24] Mulzer, J.; Funk, G. Synthesis 1995, 101.[25] Kadow, J. F.; Vyas, D. H.; Doyle, T. W. Tetrahedron Lett.1989, 30, 3299.[26] Stachel, S. J.; Chappell, M. D.; Lee, C. B.; Danishefsky, S. J. Org. Lett. 2000, 2, 1637.[27] Hoger, S. Synthesis 1997, 20.[28] Tahir, H.; Hindsgaul, O. J. Org. Chem. 2000, 65, 911.[29] Ko, S. Y. J. Org. Chem. 2002, 67, 2689.[30] Li, Z.-M.; Zhou, Z.-H.; Wang, L.-X.; Zhou, Q.-L.; Tang, C. C. Tetrahedron: Asymmetry 2002, 13, 145.[31] Chandrasekhar, S.; Kulkarni, G. Tetrahedron: Asymmetry 2002, 13, 615.[32] Shen, Z.-X.; Zhou, H.; Ma, J.-M.; Liu, Y.-H.; Zhang, Y.-W. Chin. J. Org. Chem. 2004, 24, 1213 (in Chinese).(沈宗旋, 周华, 马济美, 刘艳华, 张雅文, 有机化学, 2004, 24, 1213.)[33] Pan, X.-F.; Chen, X.-C. Chin. J. Org. Chem. 2001, 21, 1060(in Chinese).(潘鑫复, 陈小川, 有机化学, 2001, 21, 1060.)[34] Hughes, A. B.; Sleebs, M. M. J. Org. Chem. 2005, 70, 3079.[35] Lepore, S. D.; He, Y.-J. J. Org. Chem. 2003, 68, 8261.[36] Cironi, P.; Manzanares, I.; Albericio, F.; Alvarez, M. Org. Lett. 2003, 5, 2959.。
mitsunobu反应 工艺

mitsunobu反应工艺
Mitsunobu反应是一种有机化学中常用的合成方法,用于将醇
和酸或醇和亲电试剂(如酰氯、酰亚胺、酰氯等)以反应生成醚化合物。
Mitsunobu反应的工艺步骤如下:
1. 首先将底物醇与底物酸(或底物亲电试剂)以摩尔比1:1的
比例加入反应容器中。
2. 加入偶联试剂(如二甲基亚磷酸二甲酯DMAD、三苯基膦等)。
3. 加入有机溶剂(如氯仿、二氯甲烷等)使反应体系充分溶解。
4. 加入还原剂(如三氯化磷PCl3)。
5. 在适当的温度下搅拌反应体系一段时间(通常为数小时至过夜)。
6. 反应结束后,通过水洗或萃取将有机层和水层分离。
7. 干燥有机层,除去有机溶剂。
8. 纯化产物。
Mitsunobu反应因其高效、选择性好、适用于多种官能团的底
物等优点,被广泛应用于有机化学合成中。
mitsunobu反应常用溶剂

mitsunobu反应常用溶剂摘要:1.MITsunobu反应简介2.MITsunobu反应常用溶剂3.溶剂选择对反应的影响4.结论正文:MITsunobu反应是一种在醇类溶剂中进行的偶联反应,也被称为Mitsunobu氧化反应。
该反应由日本化学家Mitsunobu首次报道,是一种非常实用的有机合成方法。
在MITsunobu反应中,醇类溶剂的选择非常关键,不同的溶剂会对反应的速率和产物的收率产生影响。
以下是一些常用的溶剂及其特点。
1.醇类溶剂醇类溶剂是MITsunobu反应中最常用的溶剂,如甲醇、乙醇、异丙醇等。
醇类溶剂可以提供质子,有利于反应的进行。
醇类溶剂的极性对反应有影响,极性太强或太弱都不利于反应的进行。
通常,中等极性的醇类溶剂如乙醇和异丙醇是最适合进行MITsunobu反应的。
2.醚类溶剂醚类溶剂如乙醚、四氢呋喃、二氧六环等也可以用于MITsunobu反应。
醚类溶剂相对于醇类溶剂,极性较弱,因此可以用于极性较弱的反应底物。
此外,醚类溶剂对反应的立体选择性有影响,可以使反应产生较高的立体选择性。
3.酮类溶剂酮类溶剂如丙酮、丁酮等也可以用于MITsunobu反应。
酮类溶剂可以提供质子,但其极性较醇类溶剂弱,因此适用于反应底物极性较弱的场合。
4.酸类溶剂酸类溶剂如硫酸、盐酸等可以用于MITsunobu反应。
酸类溶剂可以提供质子,增加反应的速率,但同时也会影响反应的选择性。
因此,酸类溶剂通常与其他溶剂如醇类、醚类等混合使用。
总之,在MITsunobu反应中,溶剂的选择对反应的速率和产物的收率具有重要影响。
Mitsunobu 反应

经典化学合成反应标准操作1.前言 (2)2.醇的翻转 (3)2.1 Mitsunobu 法醇的构型翻转合成方法示例 (7)3.Mitsunobu 醚化反应 (8)3.1 Mitsunobu 法醚的合成方法示例 (9)4.Mitsunobu 氨基取代反应 (10)4.1 Mitsunobu 法利用苯磺酰胺合成胺方法示例 (13)4.2 Mitsunobu 法利用DPPA合成伯胺方法示例 (13)4.3 Mitsunobu 法分子内关环合成相应的环状胺方法示例 (14)4.4 Mitsunobu 法合成丙二烯方法示例 (14)5.Mitsunobu 硫代反应 (16)5.1 Mitsunobu 法合成硫醚方法示例 (16)6.Mitsunobu 卤代反应 (18)6.1 Mitsunobu 法合成卤代物方法示例 (18)7.其他手性翻转试剂 (20)1. 前言1967年,Oyo Mitsunobu 报导了在三苯膦(PPh3)和偶氮二甲酸二乙酯(DEAD)作用下酸和醇缩合成酯的新方法1。
当底物为仲醇的时候,与羟基相连的碳原子的构型会发生翻转。
经过多年的研究和发展,形成了一大类合成方法,我们称之为Mitsunobu 反应。
这类反应被广泛应用在有机合成,特别是天然产物的合成中2。
2.醇的翻转在Mitsunobu 反应中,DEAD 和三苯膦首先生成一个活性的甜菜碱式中间体(betaine intermediate ),这个活性中间体夺取作为亲核试剂的酸的质子并同时活化醇,随后经过S N 2取代,得到手性翻转的酯;将得到的酯水解,其净结果是醇的构型翻转。
R O R OH Ar O23反应在很温和的条件下进行,通常反应温度是在0o C 到室温,大部分基团都不会影响反应。
但亲核试剂质子的pKa 值必须小于甜菜碱式中间体(betaine intermediate )的pKa 值(~13),否则亲核试剂的质子不能被中间体(betaine intermediate )夺取,反应不能进行。
Mitsunobu 反应-050815

经典化学合成反应标准操作Mitsunobu 反应编者:谢军药明康德新药开发有限公司化学合成部目录1.前言 (2)2.醇的翻转 (3)2.1 Mitsunobu 法醇的构型翻转合成方法示例 (7)3.Mitsunobu 醚化反应 (8)3.1 Mitsunobu 法醚的合成方法示例 (9)4.Mitsunobu 氨基取代反应 (10)4.1 Mitsunobu 法利用苯磺酰胺合成胺方法示例 (13)4.2 Mitsunobu 法利用DPPA合成伯胺方法示例 (13)4.3 Mitsunobu 法分子内关环合成相应的环状胺方法示例 (14)4.4 Mitsunobu 法合成丙二烯方法示例 (14)5.Mitsunobu 硫代反应 (16)5.1 Mitsunobu 法合成硫醚方法示例 (16)6.Mitsunobu 卤代反应 (18)6.1 Mitsunobu 法合成卤代物方法示例 (18)7.其他手性翻转试剂 (20)1. 前言1967年,Oyo Mitsunobu 报导了在三苯膦(PPh3)和偶氮二甲酸二乙酯(DEAD)作用下酸和醇缩合成酯的新方法1。
当底物为仲醇的时候,与羟基相连的碳原子的构型会发生翻转。
经过多年的研究和发展,形成了一大类合成方法,我们称之为Mitsunobu 反应。
这类反应被广泛应用在有机合成,特别是天然产物的合成中2。
2.醇的翻转在Mitsunobu 反应中,DEAD 和三苯膦首先生成一个活性的甜菜碱式中间体(betaine intermediate ),这个活性中间体夺取作为亲核试剂的酸的质子并同时活化醇,随后经过S N 2取代,得到手性翻转的酯;将得到的酯水解,其净结果是醇的构型翻转。
ROROH ArO23反应在很温和的条件下进行,通常反应温度是在0o C 到室温,大部分基团都不会影响反应。
但亲核试剂质子的pKa 值必须小于甜菜碱式中间体(betaine intermediate )的pKa 值(~13),否则亲核试剂的质子不能被中间体(betaine intermediate )夺取,反应不能进行。
经典化学反应Mitsunobu 反应-

经典化学合成反应标准操作Mitsunobu 反应目录1.前言 (2)2.醇的翻转 (3)2.1 Mitsunobu 法醇的构型翻转合成方法示例 (7)3.Mitsunobu 醚化反应 (8)3.1 Mitsunobu 法醚的合成方法示例 (9)4.Mitsunobu 氨基取代反应 (10)4.1 Mitsunobu 法利用苯磺酰胺合成胺方法示例 (13)4.2 Mitsunobu 法利用DPPA合成伯胺方法示例 (13)4.3 Mitsunobu 法分子内关环合成相应的环状胺方法示例 (14)4.4 Mitsunobu 法合成丙二烯方法示例 (14)5.Mitsunobu 硫代反应 (16)5.1 Mitsunobu 法合成硫醚方法示例 (16)6.Mitsunobu 卤代反应 (18)6.1 Mitsunobu 法合成卤代物方法示例 (18)7.其他手性翻转试剂 (20)1. 前言1967年,Oyo Mitsunobu 报导了在三苯膦(PPh3)和偶氮二甲酸二乙酯(DEAD)作用下酸和醇缩合成酯的新方法1。
当底物为仲醇的时候,与羟基相连的碳原子的构型会发生翻转。
经过多年的研究和发展,形成了一大类合成方法,我们称之为Mitsunobu 反应。
这类反应被广泛应用在有机合成,特别是天然产物的合成中2。
2.醇的翻转在Mitsunobu 反应中,DEAD 和三苯膦首先生成一个活性的甜菜碱式中间体(betaine intermediate ),这个活性中间体夺取作为亲核试剂的酸的质子并同时活化醇,随后经过S N 2取代,得到手性翻转的酯;将得到的酯水解,其净结果是醇的构型翻转。
R O R OH Ar O23反应在很温和的条件下进行,通常反应温度是在0o C 到室温,大部分基团都不会影响反应。
但亲核试剂质子的pKa 值必须小于甜菜碱式中间体(betaine intermediate )的pKa 值(~13),否则亲核试剂的质子不能被中间体(betaine intermediate )夺取,反应不能进行。
无需三苯基膦,只需催化量的有机磷就能实现Mitsunobu反应!
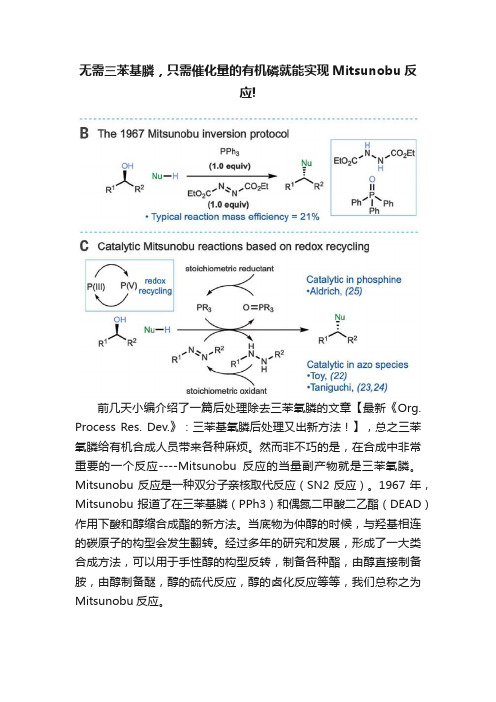
无需三苯基膦,只需催化量的有机磷就能实现Mitsunobu反应!前几天小编介绍了一篇后处理除去三苯氧膦的文章【最新《Org. Process Res. Dev.》:三苯基氧膦后处理又出新方法!】,总之三苯氧膦给有机合成人员带来各种麻烦。
然而非不巧的是,在合成中非常重要的一个反应----Mitsunobu反应的当量副产物就是三苯氧膦。
Mitsunobu反应是一种双分子亲核取代反应(SN2反应)。
1967年,Mitsunobu 报道了在三苯基膦(PPh3)和偶氮二甲酸二乙酯(DEAD)作用下酸和醇缩合成酯的新方法。
当底物为仲醇的时候,与羟基相连的碳原子的构型会发生翻转。
经过多年的研究和发展,形成了一大类合成方法,可以用于手性醇的构型反转,制备各种酯,由醇直接制备胺,由醇制备醚,醇的硫代反应,醇的卤化反应等等,我们总称之为Mitsunobu反应。
说到Mitsunobu反应,小伙伴们肯定立刻想到三苯基膦/DEAD(DIAD), 但是2019年《Science》上发表了一篇名为《Redox-neutral organocatalytic Mitsunobu reactions》文章,通讯作者是诺丁汉大学化学系Ross M. Denton教授,Ross M. Denton教授团队开发的是一种不涉及氧化还原反应的有机催化的Mitsunobu反应。
传统的Mitsunobu反应中涉及氧化还原反应,三苯基膦被氧化为三苯氧膦,DEAD被氧化为二烷氧酰基肼,而且都会化学当量参与反应。
他们利用一种二苯基苄基氧膦作为催化剂,在加热条件下就可以实现Mitsunobu反应,反应产生的唯一副产物就是水。
经过验证基本上可以实现各种类型的Mitsunobu反应,构型反转也非常有效。
甚至可以实现传统Mitsunobu反应不能实现的脂肪醇的自身成醚反应。
【Science 365, 910–914 (2019);DOI: 10.1126/science.aax335】反应机理五价有机膦催化剂的氧化态始终不变,作者推测它将被酸性前亲核试剂活化,并进行循环和脱水得到氧鏻盐2,通过醇亲核开环得到常规中间体烷氧基鏻-亲核离子对3。
mitsunobu反应机理

mitsunobu反应机理Mitsunobu反应(也称为加氟芳基氯酸酯反应)是一种常见的有机化学反应,使用来进行有机物之间的不对称芳基化反应,是加氟芳基化反应的一种。
Mitsunobu反应属于逆向脱水反应,通常用于界面活性剂,药物,杂质和其他有机物的合成中。
它是由日本有机化学家O. Mitsunobu在1971年开发的,当时他受到了英国皇家化学会的F. G. A. Stone奖的鼓励。
Mitsunobu反应的一般机理可以概括为三步:首先,一种叫做diphenylphosphinoxidaziridine(DPPO)的金属醚-zirconium(IV)配体被选择,用来触发反应的发动机。
其次,酸性活性剂把反应物中的芳基氯醛活性基团进行脱水反应,生成一个羰基,然后羰基与DPPO中的Zirconium(IV)配体发生反应,从而生成Zirconium(IV)-芳基羰基配合物。
最后,酸性活性剂把Zirconium(IV)-芳基羰基配合物中的Zirconium(IV)去除,形成最终的芳基酸,同时反应机理完成。
Mitsunobu反应可用于多种有机物的芳基化反应,如苯甲酸和diphenylmethanol,以及一些复杂的有机物,如脂肪酸,混合酸和多种端羟基化合物等。
它也可以被用于完成不对称芳基化反应,一种特殊的反应是羰基化的新的不对称催化反应,其中醛的羰基可以被一个不对称的催化剂单独识别,从而实现不对称的转化效果。
由于不过度配位,易于分离粉末并产生高收率,Mitsunobu反应已成为重要的有机合成方法,广泛应用于芳香族,烯烃和乙酰胺等有机物的合成中,目前已经被广泛用于有机化学的合成研究领域中。
利用Mitsunobu反应合成5′-脱氧-5′-乙酰硫代腺苷

硫醚键。该方法总收率 较低 , 主要是 引入易离去
基 团后 容易 受 嘌呤 环 上 一 的攻击 而形 成 环 核苷
tres p (o l ido 9 6 )adoes p ye f 84 ) epcvl.T esut ew s he t sta ye f . % e t l 6 n n t (ido6 .% ,rset e e l i y h t eu a r r
c r ce ie y ha a trz d b H NMR n a d MS.Th o sb e r a t n me ha s wa o i e c o d n o t e e p si l e c i c nim s prv d d a c r i g t h o fc ha OH x i ie r ee t e r p a e y a eyt i r u n t e o e se t o a tt t5 e h b td mo e s lci e lc d b c tl o g o p i n tp me h d. v h h Ke wo ds:a e o i e;5'Ac tl i 一 d o y ce sd y r d n sn - e yt o 5 一 e x nu lo i e;Mis n b e c in;s n h ss h tu o u r a t o y t e iNG — i I Do g e S o -i Yiwe
( o eeo hm syadC e cl nier g SuhC iaU iesyo eh o g ,G aghu5 04 , hn ) C U g f e ir n hmi g e n , ot hn nvrt f cn l y u nzo 16 0 C ia C t aE n i i T o
Mitsunobu反应及其在药物化学中的应用

Mitsunobu反应及其在药物化学中的应⽤综述与专论Mitsunobu 反应是以⽇本青⼭学院⼤学有机化学家光延旺洋(Oyo Mitsunobu )教授命名的⼈名反应。
1967年光延旺洋等⾸先报道,在偶氮⼆羧酸⼆⼄酯(DEAD )和三苯膦(TPP )存在下羧酸与伯醇、仲醇成酯,并提出了反应机理[1]。
1971年光延旺洋等发现光学纯仲醇(S )-(+)-2-⾟醇在DEAD 和TPP 存在下与苯甲酸成酯时⼿性碳发⽣了构型翻转[2]。
1981年光延旺洋发表有关DEAD 和TPP 组合在有机合成中应⽤的综述,推动了Mitsunobu 反应的发展和应⽤[3]。
Hughes 分别于1992及1996年发表了2篇关于Mitsunobu 反应的全⾯综述[4,5]。
国内任新峰等Mitsunobu Reaction and Its Applications in Medicinal ChemistryZHANG Qing-wen 1, ZHOU Hou-yuan 1*, YOU Qi-dong 2(1. Shanghai Institute of Pharmaceutical Industry, Shanghai 200437; 2. China Pharmaceutical University, Nanjing 210009) ABSTRACT : This review deals with the general sketch and recent progress of Mitsunobu reaction, as well as its applications in medicinal chemistry with focus placed on synthesis and con ? guration inversion of drugs and natural products transformation.Key Words : Mitsunobu reaction; medicinal chemistry; application; synthesis; reviewMitsunobu 反应及其在药物化学中的应⽤张庆⽂1,周后元1*,尤启冬2(1. 上海医药⼯业研究院,上海 200437;2. 中国药科⼤学,江苏南京 210009)摘要:介绍了Mitsunobu 反应的基本概况和研究新进展。
05-醚和环氧化物的人名反应
在1900年稍后的时间,G. Darzens发展了这个反应并是之称为 具有普适性的反应,并且发现乙醇钠是非常有效的缩合试剂 。
Darzens反应
二、Darzens反应的特点
1、除了金属钠和乙醇钠之外,氨基钠和其他许多碱,比如N-乙 基 -N- 三 丁 基 锡 的 氨 基 甲 酸 酯 (carbamate) 也 都 可 以 用 来 碱 性 Darzens反应。
Mitsunobu偶联反应
Mitsunobu偶联反应
Mitsunobu偶联反应
一、背景(Background)
O. Mitsunobu等人在1967年报道了仲醇在偶氮二羧酸二乙酯 (diethyl azodicarboxylate, DEAD)和三苯基膦存在下与羧酸发生 酯化反应。几年之后,研究表明,光学活性的(optical)仲醇在 经过这样的反应之后构型(configuration)发生了完全翻转。更 多的研究表明,这个合成过程可以很有效地合成光学活性的 胺、叠氮化物、醚、硫醚甚至烷烃。
二、Darzens反应的特点(续)
3、-氯代酯比溴代酯和碘代酯能获得更好的收率。除了-氯代 酯外, -氯代砜(sulfone)、腈、酮、酮亚胺(ketimine)、硫醇 的羧酸酯(thiol ester)、酰胺等都可以进行Darzens反应得到相 应的缩水甘油衍生物。
4、 缩水甘油酯是有广泛用途的合成中间体:通过各种亲核试剂 对环氧官能团开环;缩水甘油酯通过热裂解脱羧基可以生成 比原料醛/酮多一个C的同类物。
Darzens反应
三、Darzens反应的改进
Darzens反应最有用的改进是Aza-Darzens反应(Aza-,氮杂), 就是-卤代酯和亚胺反应,因此这一反应也称为Darzens氮丙 啶(aziridine)合成法。 更新的Aza-Darzens反应可以制备光学醇的氮丙啶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
经典化学合成反应标准操作Mitsunobu 反应编者:谢军药明康德新药开发有限公司化学合成部目录1.前言 (2)2.醇的翻转 (3)2.1 Mitsunobu 法醇的构型翻转合成方法示例 (7)3.Mitsunobu 醚化反应 (8)3.1 Mitsunobu 法醚的合成方法示例 (9)4.Mitsunobu 氨基取代反应 (10)4.1 Mitsunobu 法利用苯磺酰胺合成胺方法示例 (13)4.2 Mitsunobu 法利用DPPA合成伯胺方法示例 (13)4.3 Mitsunobu 法分子内关环合成相应的环状胺方法示例 (14)4.4 Mitsunobu 法合成丙二烯方法示例 (14)5.Mitsunobu 硫代反应 (16)5.1 Mitsunobu 法合成硫醚方法示例 (16)6.Mitsunobu 卤代反应 (18)6.1 Mitsunobu 法合成卤代物方法示例 (18)7.其他手性翻转试剂 (20)1. 前言1967年,Oyo Mitsunobu 报导了在三苯膦(PPh3)和偶氮二甲酸二乙酯(DEAD)作用下酸和醇缩合成酯的新方法1。
当底物为仲醇的时候,与羟基相连的碳原子的构型会发生翻转。
经过多年的研究和发展,形成了一大类合成方法,我们称之为Mitsunobu 反应。
这类反应被广泛应用在有机合成,特别是天然产物的合成中2。
2.醇的翻转在Mitsunobu 反应中,DEAD 和三苯膦首先生成一个活性的甜菜碱式中间体(betaine intermediate ),这个活性中间体夺取作为亲核试剂的酸的质子并同时活化醇,随后经过S N 2取代,得到手性翻转的酯;将得到的酯水解,其净结果是醇的构型翻转。
ROROH ArO23反应在很温和的条件下进行,通常反应温度是在0o C 到室温,大部分基团都不会影响反应。
但亲核试剂质子的pKa 值必须小于甜菜碱式中间体(betaine intermediate )的pKa 值(~13),否则亲核试剂的质子不能被中间体(betaine intermediate )夺取,反应不能进行。
低极性的溶剂有利于反应,通常用四氢呋喃,乙醚,二氯甲烷和甲苯作为溶剂,有时候乙酸乙酯,乙腈和DMF 也用作溶剂。
最早将Mitsunobu 手性翻转用于天然产物的合成的一个例子如下,只需一步就将5α-choletan-3β-ol 转变为5α-choletan-3α-ol,而此前这个转化需要好几步反应才能实现3。
1991年,Eli Lilly 的化学家Martin 和Dodge 发现用p-硝基苯甲酸(PNBA)作为亲核试剂对立体位阻较大的醇的翻转更有效4。
Buszek和Jeong据此合成了Octalatin A 和B的前体5。
p-硝基苯甲酸(PNBA)还能有效地抑制副反应:醇的消除6。
所以,在Mitsunobu 反应中,通常使用p-硝基苯甲酸(PNBA)。
Tsunoda等发现,对于位阻较大的醇,TMAD(N, N, N’, N’-tetramethyl- azodicarboxamide) 和三丁基膦的体系效果比较好7。
分子内的Mitsunobu反应为内酯的合成提供了一个有效的方法。
Verderas等利用这个方法合成了一系列的氨基酸8。
磺酸类化合物也能参与Mitsunobu 反应,在生成磺酸酯的同时得到手性翻转的产物9,10。
2.1 Mitsunobu 法醇的构型翻转合成方法示例Inversion of (-)-menthol 113O2A 250-mL, three-necked, round-bottomed flask is equipped with a stirring bar, nitrogen inlet, rubber septum, and thermometer. The flask is charged with 3.00 g of (1R, 2S, 5R)-(−)-menthol (19.2 mmol), 12.9 g of 4-nitrobenzoic acid (77.2 mmol), 20.1 g of triphenylphosphine (PPh3) (76.6 mmol), and 150 mL of tetrahydrofuran. The flask is immersed in an ice bath, and 12.1 mL of diethyl azodicarboxylate (77 mmol) is added dropwise at a rate such that the temperature of the reaction mixture is maintained below 10°C. Upon completion of the addition, the flask is removed from the ice bath and the solution is allowed to stir at room temperature overnight (14 hr) and subsequently at 40°C for 3 hr. The reaction mixture is cooled to room temperature, diluted with 150 mL of ether, and washed twice with 100 mL portions of saturated aqueous sodium bicarbonate solution. The aqueous layers are combined and back-extracted with 100 mL of ether. The combined organic layers are dried over sodium sulfate. Excess solvent and other volatile reaction components are completely removed under reduced pressure initially on a rotary evaporator and then under high vacuum (approximately 0.2 mm for 3 hr at 30°C). The resulting semi-solid is suspended in 40 mL of ether and the suspension is allowed to stand at room temperature overnight. The mixture is stirred while 20 mL of hexanes is slowly added. The resulting white solid is filtered under vacuum and the filter cake is washed with 200 mL of 50% (v/v) ether-hexanes. The solvent is removed from the filtrate on a rotary evaporator under reduced pressure to give a yellow oil that is dissolved in 10 mL of methylene chloride and diluted with 40 mL of 8% ether-hexanes. The solution is applied to a flash chromatography column and eluted with 8% ether-hexanes to give 5.03 g (85.6%) of pure nitrobenzoate ester as a white crystalline solid.3.Mitsunobu 醚化反应在Mitsunobu 反应中,羟基也可以作为亲核试剂参与S N2取代,结果是生成醚。
但通常只限于酚羟基和pKa<13的羟基,否则反应不能进行。
如下面苯酚的葡糖苷化,两步收率达到55%12。
如果作为亲电试剂的羟基活性足够高,或反应生成稳定的环状产物,对于较低活性的羟基,Mitsunobu 醚化反应也能进行13。
Tsunoda 等发现TMAD能促进反应进行,从而得到较高的产率14。
3.1 Mitsunobu 法醚的合成方法示例OH3HO+OCHOA solution of benzyl alcohol (0.200 g, 1.85 mmol), 4-hydroxybenzaldehyde (0.226 g,1.85 mmol), and PPh3(0.582 g,2.22 mmol) was stirred in dry THF (20 mL) at 0 °C under a nitrogen atmosphere. To this mixture was added dropwise DIAD (0.44 mL, 2.22 mmol) over a period of 5 min, and the reaction was monitored by TLC. After complete disappearance of starting material (1 h), the solvent was evaporated under reduced pressure and the resulting oil purified by flash column chromatography (hexane/AcOEt, 8/2). Phenyl ether (0.297 g, 76%) was finally obtained as a white powder after precipitation from CH2Cl2/petroleum ether. 154.Mitsunobu 氨基取代反应氨基化合物也可以作为Mitsunobu 反应中的亲核试剂,取代羟基,生成取代的氨基化合物。
同样,参与反应的胺必须有足够的酸性(pKa<13),能被PPh3/DEAD体系夺去质子。
酰胺,磺酰胺,亚胺和叠氮化合物都可以参与反应。
Weinreb 用这种方法,在经过连续两次的Mitsunobu 反应后,合成了天然产物Sarain A的主环16。
