医疗器械临床试验立项申请表
试剂医疗器械临床试验申请表

(适用于诊断试剂和医疗器械考核)
试
验
信
息
产品名称
型号规格
医疗器械分类
(可复选)
1.□境内一类□境内二类□境内三类□境外
2.□有源医疗器械□无源医疗器械型
3.□接触或进入人体器械□非接触人体器械
临床试验类型
医疗器械□医疗器械临床试用试剂考核□体外诊断试剂
□医疗器械临床验证□体内诊断试剂
注册产品标准号
主要用途
对照医疗器械/试剂盒
名称型号
批号有效期
生产单位
合格检验报告□有□无
本中心临床试验病例数
本研究总病例数
试验方法
(可复选)
□随机双盲□随机单盲□随机开放
□使用组织样本□使用血、尿样本□使用遗传物质样本
□其他,描述:
研究对象
□正常人□病人,请描述:
要求具备的特殊条件
□重症监护□隔离区□手术□儿童□重症监护
□静脉输注□计算机断层扫描□基因治疗□妇科
□管制药品(麻醉药/精神药)
□其他(请具体说明):
专
业
组
主要研究者
签名
主要研究者
联系方式
主要研究者
指定联系人
签名
主要研究者
指定联系人
联系方式
申办方
申办方名称
申办方联系人
签名
申办方联系人
联系方式
CRO
CHale Waihona Puke O名称CRO联系人签名
CRO联系人
联系方式
机构备案材料
详见“试剂/医疗器械临床试验报送机构资料列表”
最新医疗器械临床试验审批申请表

5.代理人承诺书
6.代理人营业执照副本或者机构登记证明复印件
7.试验产品描述
8.临床前研究资料
9.产品技术要求
10.产品注册检验报告和预评价意见表
11.产品说明书及标签样稿
12.临床试验方案
13.伦理委员会同意临床试验开展的书面意见
14.符合性声明
15.申请人所在地公证机构出具的关于原文/英文资料公证件
英文
联系人
电话
传真
电子邮箱
邮编
组织机构代码
申请人所在地
生产地址
中文
原文
英文
代理人
名称
住所
邮编
联系人
电话
传真
电子信箱
代理人所在地
组织机构代码
应附资料
1.企业营业执照副本复印件(境内申请人)
2.组织机构代码证复印件(境内申请人)
3.境外申请人注册地或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件
□
□
□
□
□
□
□
□
□
□
□
□
□
□
□
□
其他需要说明的问题
申请人/代理人(签章)填表人(签字)
日期: 年 月 日 日期: 年 月 日
奥咨达小编提醒你,
快捷医疗器械注-册、zi询、各国ren-证、体系、临-床试验等一条龙高质量服务,服-务超过2600家企业,技术过硬,成功率高。报jia?快来问问奥咨达客fu吧!
最新医疗器械临床试验审批申请表
产品名称:________________
申 请 人:________________
临床试验立项申请审批表CTI-A--A02-V0临床试验立项申请审批表

临床试验申请审批表(申请者签名、盖章并签署日期)
2.
国家食品药品监督管理总局《药物临床试验批件》部分Ⅳ期可不要求
3.
申办者资质证明及委托函;
4.
试验用药物检验合格报告
5.
临床试验方案摘要
6.
临床试验方案(注明版本号和日期)
7.
病例报告表(注明版本号和日期)
8.
知情同意书(注明版本号和日期)
9.
研究者手册(注明版本号和日期)
临床试验申请审批表(申请者签名、盖章并签署日期)
2.
申办者资质证明(法人证书、营业执照、GMP证书)
3.
医疗器械说明书
4.
注册产品标准或相应的国家、行业标准
5.
试验用医疗器械/诊断试剂研制的质量保证和质量控制文件
6.
试验用医疗器械/诊断试剂的自检报告
7.
临床试验方案摘要
8.
临床试验方案(注明版本号和日期)
□义肢□特殊管理药物(麻醉药申办者签字
(盖章)
日期
以下由专业科室及机构办填写
专业科室评估:
1.是否能保证招募足够的受试人群:是□,否□
2.研究者是否具备足够的试验时间:是□,否□
3.是否具备相应的仪器设备和其他技术条件:是□,否□
4.目前科室承担的与试验药物疾病相同的在研项目:无□,1项□,2项□,2项以上□
科室是否使用过同类药物或医疗器械是□否□
试验用产品
□药物
名称
CFDA批件号:
□食品
名称
CFDA批件号:
□医疗器械
1.□境内II类□境内III类□进口II类□进口III类
2.□有源□无源
3.□植入□非植入
兰州大学第一医院医疗器械临床试验项目申请表1.doc

兰州大学第一医院医疗器械临床试验项目申请表1兰州大学第一医院医疗器械临床试验项目申请表项目名称试验用医疗器械名称规格注册分类1.□境内Ⅱ类□.境内Ⅲ类□.进口Ⅱ类□.进口Ⅲ类□.Ⅰ类2.□有源□.无源3.□植入□.非植入研究形式□临床试用□临床验证专业/科室主要研究者申办单位联系人联系电话联系传真组长单位参加单位□个计划研究病例总数计划研究开始时间相关技术资料清单(复印件)□注册产品标准或相应的国家、行业标准□型式检验报告(完整)(二类体外诊断试剂可不提供)□省级质量技术监督部门检测报告;□产品自测报告;□风险报告□主要研究者履历;□研究者及其他参加人员信息;□临床须知□试验方案(版本号__________和日期__________)□研究病历和/或病例报告表(版本号__________和日期__________)□知情同意书(版本号__________和日期__________)□产品使用说明书;□最新的研究者手册□医疗器械生产许可证;□营业执照;□税务登记证;□组织机构代码证□有关协议及/或临床试验合同□申办者保证所提供资料真实性的声明□申请人(研究者)保证所提供资料真实性的声明□组长单位伦理批件;□本单位伦理批件;□试验中伦理问题的说明(如适用)申请人所在科室意见我同意本专业承接该项临床研究。
我负责该临床试验全过程中的质量保证,承诺该临床试验数据真实可靠,操作规范,符合CFDA《药物临床试验质量管理规范》(GCP)要求。
如有失实,愿意承担相关责任。
主要研究者(签名):机构办公室审核批复意见:注:本申请表于试验开始前由申办单位填写后,交试验机构办。
(内容控制在一页以内)兰州大学2014年度国家自然科学基金项目形式审查明细表1兰州大学2014年度国家自然科学基金项目形式审查明细表1.请申请人逐项认真检查,并在与本项目有关处“□”处打“√”,与本项目无关的项请打“╳”2.本表与申请书一同上交学院,各单位科研秘书根据本表逐条审核申请书无误后,签字盖章确认,注:本自查表仅针对申请书形式审查部分(科学部受理初审),关于申请书内容、资助类别、亚类说明、附注说明、申请代码等填写要求,务必详细阅读指南。
医疗器械临床试验立项审核表
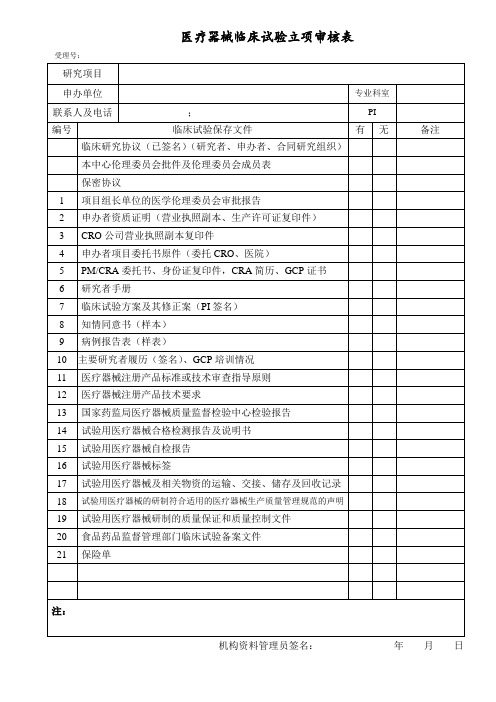
受理号:
研究项目
申办单位
专业科室
联系人及电话
;
PI
编号
临床试验保存文件
有
无
备注
临床研究协议(已签名)(研究者、申办者、合同研究组织)
本中心伦理委员会批件及伦理委员会成员表
保密协议
1
项目组长单位的医学伦理委员会审批报告
2
申办者资质证明(营业执照副本、生产许可证复印件)
3
CRO公司营业执照副本复印件
13
国家药监局医疗器械质量监督检验中心检验报告
14
试验用医疗器械合格检测报告及说明书
15
试验用医疗器械自检报告
16
试验用医疗器械标签
17
试验用医疗器械及相关物资的运输、交接、储存及回收记录
18
试验用医疗器械的研制符合适用的医疗器械生产质量管理规范的声明
19
试验用医疗器械研制的质量保证和质量控制文件
20
4
申办者项目委托书原件(委托CRO、医院)
5
PM/CRA委托书、身份证复印件,CRA简历、GCP证书
6
研究者手册
7
临床试验方案及其修正案(PI签名)
8
知情同意书(样本)
9
病例报告表(样表)
ห้องสมุดไป่ตู้10
主要研究者履历(签名)、GCP培训情况
11
医疗器械注册产品标准或技术审查指导原则
12
医疗器械注册产品技术要求
食品药品监督管理部门临床试验备案文件
21
保险单
注:
机构资料管理员签名:年月日
医疗器械临床试验立项递交资料表

试验方案(注明版本号、版本日期)
13
病例报告表(或电子病例报告表或EDC)样表(注明版本号,版本日期)
14
研究病历样表(注明版本号、版本日期)
15
知情同意书(注明版本号、版本日期)
16
受试者招募广告(如适用)
17
其他受试者相关材料(如适用)
18
试验用医疗器械自检合格报告和具有资质的检验机构出具的1年内的产品注册检验合格报告
医疗器械临床试验立项递交资料表
试验项目
名称
申办方
递交人
序有
无
NA
1
申办者或CRO委托临床试验机构进行临床试验的委托函
2
NMPA审批证明或备案证明
3
申办者的资质证明文件(营业执照;生产许可证等。)
4
申办者委托CRO的委托函及CRO营业执照(如适用)
5
中心实验室或第三方实验室委托函、资质证明文件及室间质评证书(如适用)
6
监查员委托函、简历及资质
7
申办者/CRO委托SMO的委托函及SMO的营业执照(如适用)
8
申办者、CRO、统计单位等试验参加单位信息表
9
我国人类遗传资源采集、保藏、利用、对外提供的既往审批/备案材料(申请书、受理文件、批件、备案证明等)
10
组长单位的伦理批件和成员表
11
研究者手册(注明版本号,版本日期)(如适用)
28
医疗器械临床试验申请表
注:该材料包括但不限以上内容但,一式两份(伦理及机构各一份),资料盖封面章及骑缝章。
19
试验用医疗器械的研制符合适用的医疗器械质量管理体系相关要求的声明
20
产品的动物试验报告
21
医疗器械临床试验申请表
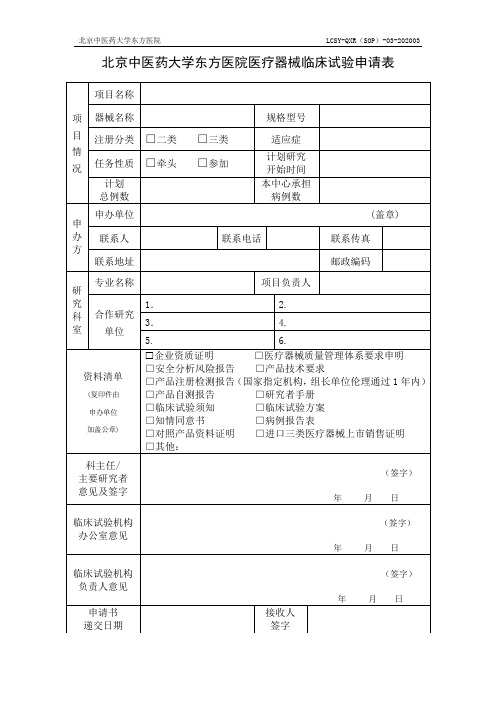
LCSY-QXR(SOP)-03-202003
北京中医药大学东方医院医疗器械临床试验申请表
项目名称
项 器械名称
目 注册分类 □二类
情
况 任务性质 □牵头
计划 总例数
申办单位 申 办 联系人 方
联系地址
□三类 □参加
规格型号
适应症 计划研究 开始时间 本中心承担 病例数
联系电话
(盖章) 联系传真 邮政编码
专业名称 研 究 科 合作研究 室 单位
资料清单
(复印件由 申办单位 加盖公章)
项目负责人
1.
Байду номын сангаас2.
3.
4.
5.
6.
企业资质证明 □安全分析风险报告
□医疗器械质量管理体系要求申明 □产品技术要求
□产品注册检测报告(国家指定机构,组长单位伦理通过 1 年内)
□产品自测报告
□研究者手册
□临床试验须知
□临床试验方案
□知情同意书
□病例报告表
□对照产品资料证明 □进口三类医疗器械上市销售证明
□其他:
科主任/ 主要研究者 意见及签字
(签字) 年 月日
临床试验机构 办公室意见
(签字) 年 月日
临床试验机构 负责人意见
申请书 递交日期
接收人 签字
(签字) 年 月日
医疗器械临床试验立项登记表-天津市人民医院

医疗器械临床试验立项登记表 试验项目名称器械分类 1.□境内Ⅱ类 □境内Ⅲ类□进口Ⅱ类 □进口Ⅲ类(如为Ⅲ类,是□否□Ⅲ类高风险器械)2.□有源 □无源3.□植入 □非植入本中心计划例数专业科室名称 项目负责人统计单位 组长单位需要遗传办备案□是 □否预计试验起止日期研究团队姓名 在项目中承担的工作 姓名 在项目中承担的工作科室是否有正在开展的同类器械临床试验项目? □是 □否如“是”,请具体说明:申办方 单位名称联系人 电话/EmailCRO 单位名称联系人公司固话移动电话SMO单位名称联系人 公司固话 移动电话试验器械名称 规格/型号 批号 有效期 供应方式对照器械名称 规格/型号 批号 有效期 供应方式研究科室意见:□同意 □不同意科主任(或专业负责人)签字/日期如不同意,请说明原因:机构办公室意见:□同意 □不同意主任签字/日期如不同意,请说明原因:院长办公室意见:□同意 □不同意院领导签字/日期如不同意,请说明原因:填表说明:①医疗器械临床试验:“研究团队”项目填写时,应写满6人至少包含主要研究者、协助研究者、研究护士,必须包含1名专职项目质控员(不参与本项目)、2名器械管理员(可由研究医生或研究护士兼职)、1名资料管理员(可由研究医生或研究护士兼职)。
②SMO公司/CRC如填表时未确定,请填写该项目有/无配备CRC即可。
③试验器械、对照器械“供应方式”,请填写申办方“免费提供”或者“受试者自费”即可。
④立项审核时间为7个工作日,请勿擅自修改本表格内容及大小。
医疗器械临床试验申请表
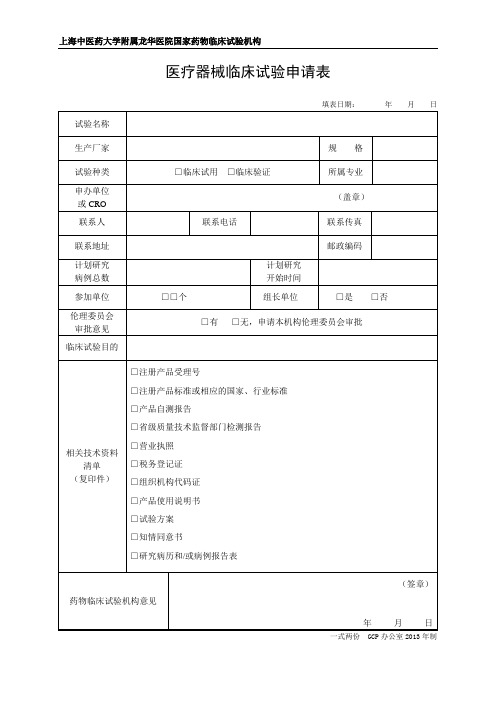
填表日期:年月日
试验名称
生产厂家
பைடு நூலகம்规格
试验种类
□临床试用□临床验证
所属专业
申办单位
或CRO
(盖章)
联系人
联系电话
联系传真
联系地址
邮政编码
计划研究
病例总数
计划研究
开始时间
参加单位
□□个
组长单位
□是□否
伦理委员会
审批意见
□有□无,申请本机构伦理委员会审批
临床试验目的
相关技术资料清单
(复印件)
□注册产品受理号
□注册产品标准或相应的国家、行业标准
□产品自测报告
□省级质量技术监督部门检测报告
□营业执照
□税务登记证
□组织机构代码证
□产品使用说明书
□试验方案
□知情同意书
□研究病历和/或病例报告表
药物临床试验机构意见
(签章)
年月日
一式两份GCP办公室2013年制
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
研究者所在科室意见:
支持该项临床试验在我科室开展,提供人员和场地及仪器设备等保障。
签 名: 年 月 日
临床试验机构的医疗器械临床试验管理部门意见:
已审阅临床试验相关资料,综合专业科室意见,同意进行该临床试验。
签 名: 年 月 日
临床试验机构负责人审批意见:
签 名: 年 月 日
医疗器械临床试验立项申请表(版)
申请编号:
试验项目
名称
中国境内同类产品
□有
□无
试验目的
试验方案版本号及日期
科室
研究者
本机构参
加形式
□平行□负责 □参加
若为参加单位,请填写组长单位:
项目预计
起止日期
年月日——年月日
试验用医疗
器械名称
试验用对照医疗器械名称
分类
.□境内Ⅱ类□境内Ⅲ类□进口Ⅱ类□进口Ⅲ类 .□有源 □无源 .□植入 □非植入
.□其他(需申请批准证书的三类医疗器械)
申办者
联系人
电话
申办者地址
邮编
联系人
电话
地址
邮编
监查员姓名
电话
科室是否使用过同类医疗器械
□是
□否
研究者正在开展和已经完成的
临床试验项目
目前项完成项
需提交的文件
递交文件清单目录
□ 是 □ 否
医疗器械临床试验评估表、立项申请表
□ 是 □ 否
申办方委托书
□ 是 □ 否
□ 是 □ 否
监查计划
□ 是 □ 否
申办方对的委托书
□ 是 □ 否
的身份证复印件、学历证书、个人简历、证书等
□ 是 □ 否
方案摘要(如适用)
□ 是 □ 否
无需办理“人类遗传资源审批申请书”承诺书(如适用)
□ 是 □ 否
其他与立项审查相关的材料
□ 是 □ 否
主要研究者审阅意见:
根据申办者申请,我已审阅所有临床试验相关资料,经本中心伦理委员会审核批准后同意在本专业进行临床试验。在临床试验全过程中,我将严格执行“医疗器械临床试验质量管理规范”,客观、真实提供试验数据,充分保障受试者合法权益,并按要求保存试验资料,按要求完成临床试验任务。
研究者保证所提供资料真实性的声明
□ 是 □ 否
研究者履历及相关文件
□ 是 □ 否
医学或实验室操作的质控证明(若有)
□ 是 □ 否
国家药品监督管理部门的批件(若有)
□ 是 □ 否
产品使用说明书(若有)
□ 是 □ 否
保险和赔偿措施或相关文件
□ 是 □ 否
对照产品使用说明书及合格证(若有)
□ 是 □ 否
原始病历(若有)(版本号:;日期:)
病例报告表文本(版本号:;日期:)
□ 是 □ 否
临床试验机构的设施条件能够满足试验的综述
□ 是 □ 否
申办者及代理人(如有)资质证明文件(是否为涉外企业)
□ 是 □ 否
试验用医疗器械的研制符合适用的医疗器械质量管理体系相关要求的声明
□ 是 □ 否
申办者保证所提供资料真实性的声明及委托书
□ 是 □ 否
适用的技术要求
□ 是□ 否
自检合格报告
□ 是 □ 否
注册检验合格报告
□ 是 □ 否
临床试验方案(版本号:;日期:)
Hale Waihona Puke □ 是 □ 否研究者手册(版本号:;日期:)
□ 是 □ 否
知情同意书文本和其他提供给受试者的书面材料(版本号:;日期:)
□ 是 □ 否
受试者招募文件
□ 是 □ 否
研究者资格证明文件
□ 是 □ 否
