甲醇的电化学催化氧化
电催化醇氧化

电催化醇氧化
电催化醇氧化是指利用电化学方法将醇分子氧化为相应的酮、醛或羧酸产物的过程。
这种过程通常在电极表面进行,在适当的电位下,通过电极上的催化剂或电催化材料促使醇分子发生氧化反应。
电催化醇氧化可以实现高效、选择性和可控的醇转化(氧化)反应,具有以下一些特点和优势:
1.可选择性:通过选择适当的电催化催化剂,可以将特定的
醇选择性地氧化为目标产物。
这可以通过调节电位、电流密度和反应条件来实现。
2.可控性:电位是控制电催化醇氧化的关键参数之一,通过
调节电位,可以控制反应速率和产物分布,实现对反应的细致控制。
3.温和条件:相比于传统的化学氧化方法,电催化醇氧化通
常在相对温和的条件下进行,减少了对温度和化学反应条件的严格要求。
4.能源效率:电催化将电能直接转化为化学能,具有较高的
能源转化效率,可实现能源的可持续利用。
5.环境友好:相比于传统的氧化剂(如高价金属催化剂或强
氧化剂),电催化氧化通常使用的催化剂或纳米材料更环保,减少了对环境的污染。
电催化醇氧化已经在有机合成、能源转化和催化领域中得到广
泛应用,例如用于合成有机合成中间体、燃料电池氧还原反应、CO2转化为高附加值产品等。
同时,该领域还面临着进一步提高效率、选择性和催化剂稳定性等挑战,需要进一步研究和优化。
利用循环伏安发分析甲醇的电化学氧化行为

利用循环伏安发分析甲醇的电化学氧化行为专业:姓名:学号:1.通过实验熟悉和了解电化学工作站的使用方法。
2.在实验过程中巩固加深电化学知识。
3.学习循环伏安法测定电极反应参数的基本原理及方法。
4.学会使用伏安仪 。
5.了解酸性环境下GC 、Pt 的电催化性能。
6.比较GC 与Pt 电催化的异同。
二、实验原理:与H 2O 2燃料电池相比, 直接甲醇燃料电池(DM FC)以其明显的体积比能量优势而倍受关注 。
铂是目前已知对甲醇吸附解离催化活性最好的金属元素,也是在燃料电池环境中稳定性最好的电极材料。
甲醇在铂电极表面上的反应为双途径机理,即甲醇首先解离吸附在电极表面,生成毒性中间体CO,然后再生成CO2。
其反应为:-+-+++−→−+++−→−e H CO O H e H CO OH CH ads 66444223在低温(100K)时,甲醇吸附在铂表面并不发生离解。
分子态的热力学解吸发生在两个温度:直 接与表面接触的甲醇(单分子层甲醇)在180K 时解吸;甲醇的多分子层 140K 时解吸[2~5]。
对吸附态甲醇的研究[2,5]表明,甲醇吸附后,其振动光谱并未发生显著的变化,即吸附面只导致了分子的轻微扰动。
在温度为200~300K 时,甲醇在铂面上离解生成吸附态的CO 和H[2]。
但是,甲醇在铂表面上的吸附脱氢反应并非一个单步反应步骤。
Bagotzky 提出了这样的反应步骤:在纯铂表面,三个氢几乎是同时脱离的,中间没有生成甚至是没有经过甲基氧中间物,第四个氢的脱离要慢一些。
这一机理成功地解释了观测到的甲酰(HCO)中间体,而且与Gasteiger 等在解释Ru 原子于铂表面的双功能机理时提出的量子模型也是一致的。
根据双功能机理,Gasteiger 等[6]认为三个铂原子组成的铂原子簇更有利于甲醇的吸附脱氢。
甲醇在铂电极上发生吸附,然后脱氢同时发生解离吸附反应,生成一系列表面吸附物种(CHXOH)ad(X=0~3)Pt+CH3OH →Pt-(CH3OH)ad ⑴ Pt+Pt-(CH3OH)ad →Pt-(CH2OH)ad +Pt-Had ⑵ Pt+Pt-(CH2OH)ad →Pt-(CHOH)ad+Pt-Had ⑶ Pt+Pt-(CHOH)ad →Pt-(COH)ad+Pt-Had ⑷ Pt+Pt-(COH)ad →Pt-(CO)ad+Pt-Had ⑸ Pt-Had →Pt + H+ + e (6)三、实验仪器:电化学工作站 工作电极(Pt 电极和GC 电极) 参比电极 对电极 浓硫酸 无水甲醇 去离子水1.配制反应所需浓度的溶液(0.5mol/L 硫酸溶液、0.5mol/L 硫酸与甲醇混合溶液)。
甲醇的催化氧化方程式

甲醇的催化氧化过程
一、氧气在催化剂表面吸附并分解成氧原子
在催化氧化过程中,氧气首先在催化剂表面吸附并分解成氧原子。
这个过程是由催化剂的活性表面完成的,它提供了高能量环境,使氧气更容易活化。
氧原子是由单线态氧分子(O2)分解得到的,这个过程可以表示为:
O2(气态)+ e- + * -> 2O(催化剂表面)
二、甲醇在催化剂表面吸附并发生氧化反应,生成甲醛和水
甲醇在催化剂表面吸附并发生氧化反应,生成甲醛和水。
这个过程可以表示为:
CH3OH(液态)+ O(催化剂表面)-> HCHO(气态)+ H2O(液态)
在这个过程中,甲醇被氧化成甲醛,同时消耗了水。
这个反应是放热的,可以提供足够的能量使反应继续进行。
三、甲醛在催化剂表面吸附并发生氧化反应,生成二甲酸和水
甲醛在催化剂表面吸附并发生氧化反应,生成二甲酸和水。
这个过程可以表示为:
HCHO(气态)+ O(催化剂表面)-> HCOOH(液态)+ H2O(液态)
在这个过程中,甲醛被进一步氧化成二甲酸,同时再消耗一部分水。
这个反应同样是放热的,可以提供足够的能量使反应继续进行。
四、二甲酸在催化剂表面吸附并发生氧化反应,生成二氧化碳和水
二甲酸在催化剂表面吸附并发生氧化反应,生成二氧化碳和水。
这个过程可以表示为:
HCOOH(液态)+ O(催化剂表面)-> CO2(气态)+ H2O(液态)
在这个过程中,二甲酸被彻底氧化成二氧化碳和水。
这个反应同样是放热的,可以提供足够的能量使反应继续进行。
甲醇的催化氧化方程式

甲醇的催化氧化方程式
一、甲醇的催化氧化概述
甲醇催化氧化是指在催化剂的作用下,甲醇与氧气发生化学反应,生成甲醛、水以及二氧化碳的过程。
这是一种重要的有机化工过程,广泛应用于化学、石油、能源等领域。
二、甲醇催化氧化的反应条件
甲醇催化氧化的反应条件通常包括以下几点:
1.温度:一般在200-300℃之间;
2.压力:常压即可,无需高压;
3.催化剂:常用的催化剂有铜催化剂、贵金属催化剂等;
4.氧气浓度:一般在10%-30%之间。
三、甲醇催化氧化反应的化学方程式
甲醇催化氧化的化学方程式为:
2CH3OH + O2 → 2CH2O + 2H2O
四、甲醇催化氧化应用领域
甲醇催化氧化技术在多个领域具有广泛应用,如:
1.化学工业:用于生产甲醛、醋酸等化学品;
2.能源领域:作为燃料电池的原料;
3.环境保护:用于处理工业废水、废气等;
4.生物质能:如甲醇燃料电池等。
五、催化氧化技术的发展趋势
1.高效催化剂的研究:研发新型高效、环保的催化剂,提高甲醇催化氧化反应的转化率和选择性;
2.催化剂载体研究:优化载体结构,提高催化剂的稳定性和活性;
3.反应工艺优化:改进反应条件,降低能耗,提高生产效率;
4.集成与优化:将甲醇催化氧化与其他化工过程相结合,实现资源的高效利用和循环经济。
载铂聚苯胺_聚砜复合膜修饰电极对甲醇的电催化氧化行为研究

50mV / s, 即得载铂PAN /PSF复合膜修饰电极。
把PAN /PSF复合膜和载铂PAN /PSF复合膜轻
轻从工作电极上剥下来用于FT IR 和SEM 测试。
1. 3 测试方法
1. 3. 1 电化学测试 在电化学工作站上进行。采
表面积等因素都能影响催化剂性能。研究发现, 一
些催化剂载体存在大的表面积, 并且和催化剂之间
存在相互作用, 这些载体担载的催化剂具有高且稳
定的催化活性。最近研究较多的催化剂载体有活性
炭、炭黑、碳纳米管和导电聚合物等[ 7-11] 。活性炭和
炭黑表面积小, 被具有独特结构、合适的表面积、低
13619276562, E - m a i:l renlijun. w ind@ 163. com
载铂聚苯胺/聚砜复合膜修饰电极对
甲醇的电催化氧化行为研究
任莉君1, 胡中爱2, 李宗孝1, 王晓梅1
( 1. 宝鸡文理学院化学化工系, 陕西宝鸡 721013; 2. 西北师范大学化学化工学院, 甘肃兰州 730070)
Study on electrocatalytic performance of the
platinum-modified polyaniline /polysulfone composite
film electrodes formethanol oxidation
REN L i-jun
by FTIR spectra, themorphology o f the inner layer composite film after plat inum deposition w as
甲醇电催化氧化

甲醇在电极上氧化为CO2需要传输 6 个电子,但是6 个电子同时传递是不太可能的。
部分电子的传输导致一系列稳定的、可溶的中间产物的形成也是不太可能的。
很明显,在铂电极催化剂表面上一定有表面吸附物质,正是这些物质抑制了催化剂的活性。
关于甲醇氧化反应的机理研究,在不同的电解质中可能不同。
一般认为在酸性电解质中,甲醇在Pt 电极上的氧化机理为2Pt + CH3OH → Pt-CH2OH + Pt-H (1-4)2Pt + Pt-CH2OH → Pt2-CHOH + Pt-H (1-5)2Pt + Pt2-CHOH → Pt3-COH + Pt-H (1-6)Pt-H → Pt + H+ +e- (1-7)Pt3-COH → Pt2-C=O + H+Pt + e-→ Pt-C≡O + Pt(1-8)可以看出甲醇首先吸附在Pt 的表面,同时脱去氢,反应速度由大到小依次为是(1-6),(1-5),(1-4)。
Pt3-COH 是主要的吸附物质,即甲醇氧化的中间体,(1-7)反应极快,但在缺少活性氧时,(1-8)占主导地位。
从上述方程式中不难看出,要保证催化剂不被毒化,就必须尽量避免反应(1-8)的发生,而只有电极表面含有大量含氧物种时,氧化反应才能发生。
活性含氧物种通过如下反应发生:M + H2O → M-OHads + H+ + e- (1-9)其中M 可以是Pt 或其它金属,如Ru,Sn 等,对于Pt 来说,Pt-OH ads很难在低电位时大量产生,不能有效阻止中毒现象的发生,因此往往引入其它金属,使得在较低电位下就能够生成大量的含氧物种,促进氧化发应的发生。
活性含氧物种与甲醇吸附中间体之间的反应如下:Pt-CH2OH + M-OH ads→ HCHO + Pt + M + H2O (1-10)Pt2-CHOH + M-OH ads→ HCOOH + 2Pt + M + H2O (1-11)Pt3-COH + M-OH ads→ CO2 + 3Pt + M + 2H+ + 2e-(1-12)在阳极上甲醇氧化的总反应为:CH3OH + H2O → CO2↑ + 6H+ + 6e-(1-13)分析这些反应表明,甲醇氧化是一个涉及多步脱氢的复杂过程,只有在电极表面生成大量含氧物种,甲醇才能完全氧化生成CO2。
甲醇的检测原理

甲醇的检测原理甲醇的检测原理可以通过多种方法实现,其中包括化学方法、光学方法、电化学方法和生物传感器等。
以下将对其中几种常用的原理进行详细介绍。
化学方法:化学方法是通过甲醇与其他物质之间的化学反应,通过观察反应产物的性质变化或测定反应产物的数量来间接检测甲醇的含量。
常用的化学方法有定量测定法、滴定法和比色法等。
以定量测定法为例,甲醇可以与酸性高锰酸钾溶液反应生成二氧化锰和CO2。
通过测定反应后溶液的高锰酸钾含量,就可以计算出甲醇的含量。
这种方法可以通过滴定、分光光度法或化学分析等手段进行。
光学方法:光学方法是利用甲醇与特定物质发生化学反应后,产生光学信号变化来检测甲醇的含量。
常用的光学方法有荧光法、紫外可见光谱法和红外光谱法等。
以荧光法为例,甲醇可以通过与特定荧光探针产生化学反应,使探针的荧光强度发生变化,从而间接测定甲醇的含量。
这种方法具有高灵敏度、快速和无需复杂设备等优点。
电化学方法:电化学方法是利用甲醇与电极表面发生电化学反应,测定反应电流或电势的变化来检测甲醇的含量。
常用的电化学方法有安培法、电化学阻抗谱法和电位法等。
以安培法为例,甲醇溶液可以通过在电极表面发生氧化还原反应产生电流。
通过测定电流的大小和变化,可以计算出甲醇的含量。
这种方法具有灵敏度高、选择性好和实时性强等优点。
生物传感器:生物传感器是利用生物分子(例如酶、抗体或细胞等)与甲醇发生特异性的生物识别反应,将其转化为电化学、光学或质量信号来检测甲醇的含量。
常见的生物传感器包括酶传感器、免疫传感器和细胞传感器等。
以酶传感器为例,将甲醇与特定酶(例如甲醇脱氢酶)反应,酶催化产生的物质在电极表面发生氧化还原反应,可以测量电流的变化来间接测定甲醇的含量。
这种方法具有灵敏度高、选择性好和稳定性好等优点。
综上所述,甲醇的检测原理可以通过化学方法、光学方法、电化学方法和生物传感器等多种方法实现。
根据实际需求和具体条件,可以选择合适的检测原理进行甲醇含量的测定。
PMo12-Pt PVP-RGO复合催化剂的制备及其对甲醇氧化的电催化性能
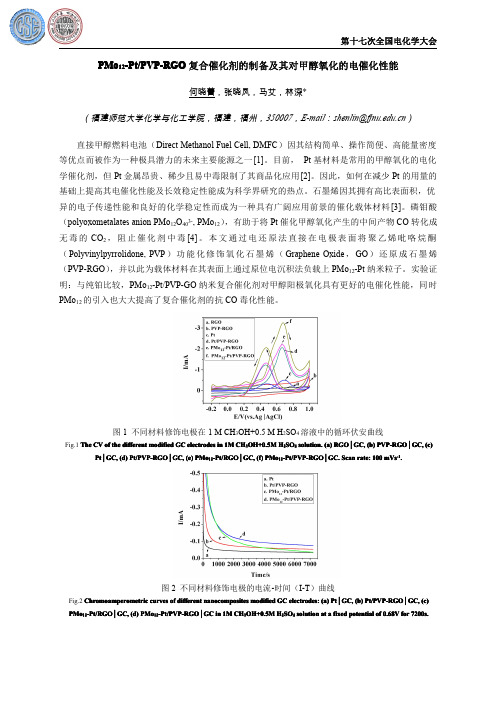
PMo12-Pt/PVP-RGO复合催化剂的制备及其对甲醇氧化的电催化性能何晓蕾,张晓凤,马艾,林深*(福建师范大学化学与化工学院,福建,福州,350007,E-mail:shenlin@)直接甲醇燃料电池(Direct Methanol Fuel Cell,DMFC)因其结构简单、操作简便、高能量密度等优点而被作为一种极具潜力的未来主要能源之一[1]。
目前,Pt基材料是常用的甲醇氧化的电化学催化剂,但Pt金属昂贵、稀少且易中毒限制了其商品化应用[2]。
因此,如何在减少Pt的用量的基础上提高其电催化性能及长效稳定性能成为科学界研究的热点。
石墨烯因其拥有高比表面积,优异的电子传递性能和良好的化学稳定性而成为一种具有广阔应用前景的催化载体材料[3]。
磷钼酸(polyoxometalates anion PMo12O403-,PMo12),有助于将Pt催化甲醇氧化产生的中间产物CO转化成无毒的CO2,阻止催化剂中毒[4]。
本文通过电还原法直接在电极表面将聚乙烯吡咯烷酮(Polyvinylpyrrolidone,PVP)功能化修饰氧化石墨烯(Graphene Oxide,GO)还原成石墨烯(PVP-RGO),并以此为载体材料在其表面上通过原位电沉积法负载上PMo12-Pt纳米粒子。
实验证明:与纯铂比较,PMo12-Pt/PVP-GO纳米复合催化剂对甲醇阳极氧化具有更好的电催化性能,同时PMo12的引入也大大提高了复合催化剂的抗CO毒化性能。
图1不同材料修饰电极在1M CH3OH+0.5M H2SO4溶液中的循环伏安曲线PVP-RGO││GC,(c) Fig.1The CV of the different modified GC electrodes in1M CH3OH+0.5M H2SO4solution.(a)RGORGO││GC,(b)PVP-RGO-Pt/PVP-RGO││GC.Scan rate:100mVs-1.-Pt/RGO││GC,(f)PMo12-Pt/PVP-RGOPt Pt││GC,(d)Pt/PVP-RGOPt/PVP-RGO││GC,(e)PMo12-Pt/RGO图2不同材料修饰电极的电流-时间(I-T)曲线Pt/PVP-RGO││GC,(c) Fig.2Chromoamperometric curves of different nanocomposites modified GC electrodes:(a)Pt Pt││GC,(b)Pt/PVP-RGO-Pt/PVP-RGO││GC in1M CH3OH+0.5M H2SO4solution at a fixed potential of0.68V for7200s.-Pt/RGO││GC,(d)PMo12-Pt/PVP-RGOPMo12-Pt/RGO图3不同材料修饰电极的CO溶出伏安曲线Fig.3CO-stripping voltammograms of the Pt Pt││GC(a),Pt/PVP-RGO│GC(b)and(c)PMo12-Pt/PVP-RGO│GC in0.5M H2SO4solution with scan rate50mVs-1.本研究为国家自然科学基金(No.21171037)资助项目。
利用循环伏安发分析甲醇的电化学氧化行为

利用循环伏安发分析甲醇的电化学氧化行为利用循环伏安发分析甲醇的电化学氧化行为专业:姓名:学号:1.通过实验熟悉和了解电化学工作站的使用方法。
2.在实验过程中巩固加深电化学知识。
3.学习循环伏安法测定电极反应参数的基本原理及方法。
4.学会使用伏安仪。
5.了解酸性环境下GC 、Pt 的电催化性能。
6.比较GC 与Pt 电催化的异同。
二、实验原理:与H 2O 2燃料电池相比, 直接甲醇燃料电池(DM FC)以其明显的体积比能量优势而倍受关注。
铂是目前已知对甲醇吸附解离催化活性最好的金属元素,也是在燃料电池环境中稳定性最好的电极材料。
甲醇在铂电极表面上的反应为双途径机理,即甲醇首先解离吸附在电极表面,生成毒性中间体CO,然后再生成CO2。
其反应为:-+-+++?→?+++?→?e H CO O H e H CO OH CH ads 66444223在低温(100K)时,甲醇吸附在铂表面并不发生离解。
分子态的热力学解吸发生在两个温度:直接与表面接触的甲醇(单分子层甲醇)在180K 时解吸;甲醇的多分子层 140K 时解吸[2~5]。
对吸附态甲醇的研究[2,5]表明,甲醇吸附后,其振动光谱并未发生显著的变化,即吸附面只导致了分子的轻微扰动。
在温度为200~300K 时,甲醇在铂面上离解生成吸附态的CO 和H[2]。
但是,甲醇在铂表面上的吸附脱氢反应并非一个单步反应步骤。
Bagotzky 提出了这样的反应步骤:在纯铂表面,三个氢几乎是同时脱离的,中间没有生成甚至是没有经过甲基氧中间物,第四个氢的脱离要慢一些。
这一机理成功地解释了观测到的甲酰(HCO)中间体,而且与Gasteiger 等在解释Ru 原子于铂表面的双功能机理时提出的量子模型也是一致的。
根据双功能机理,Gasteiger 等[6]认为三个铂原子组成的铂原子簇更有利于甲醇的吸附脱氢。
甲醇在铂电极上发生吸附,然后脱氢同时发生解离吸附反应,生成一系列表面吸附物种(CHXOH)ad(X=0~3)Pt+CH3OH →Pt-(CH3OH)ad ⑴ Pt+Pt-(CH3OH)ad →Pt-(CH2OH)ad +Pt-Had ⑵ Pt+Pt-(CH2OH)ad →Pt-(CHOH)ad+Pt-Had ⑶ Pt+Pt-(CHOH)ad →Pt-(COH)ad+Pt-Had ⑷ Pt+Pt-(COH)ad →Pt-(CO)ad+Pt-Had ⑸ Pt-Had →Pt + H+ + e (6)三、实验仪器:电化学工作站工作电极(Pt 电极和GC 电极)参比电极对电极浓硫酸无水甲醇去离子水1.配制反应所需浓度的溶液(0.5mol/L 硫酸溶液、0.5mol/L 硫酸与甲醇混合溶液)。
第六章 析氢反应机理

析氢反应历程中可能出现的步骤
1.电化学步骤 H+(或H2O)+e-→MH
2.复合脱附步骤 MH+MH→H2,
3.电化学脱附步骤 H+(或H2O)+MH十e
[A] [B] H2 [C]
氢析出过程的反应机理 可以有下面四种基本方案:
电化学步骤 (快)+复合脱附 (慢) 电化学步骤 (慢)+复合脱附 (快) 电化学步骤 (快)+电化学脱附 (慢) 电化学步骤 (慢)+电化学脱附 (快)
2 RT F
ln I K 1
e
0 e
RT F
ln[ H ]
H
常数
2 RT F
ln I K
RT F
ln[ H ] 1
H pH
I , 1
H lg[ H
]
I
,
1
2 .3 RT F
59 mV
但对其它的金属电极,我们不能仅根据实 验测得的b值是118mV,29.5mV或39 mV就简单地推断在此金属上析氢反应的 机理。
这一实验事实意味着虽然反应速度变化了1012倍,然而 动力学规律却并没有改变.类似的情况在动力学研究中 是十分罕见的.
在Pb,Cd,Zn这几种金属电极上的析氢反应与汞电极 上的析氢反应有相似的机理。
(1)溶液组成对 的影响
若阴极极化,IK=ik-ia ,Ik>>i0时,考虑Ψ1效应影响,
Ik
五、验证
1.对于多数金属来说: 11m 8 V
lgI
b 12 .3 n RF T22.3 F R T 11 m8V
b22.3RT1182.95mV 2F 4
酸性环境中甲醇电氧化催化剂的研究进展

酸性环境中甲醇电氧化催化剂的研究进展摘要:甲醇不仅是重要的有机化工原料,还是性能优良的能源和车用原料。
随着石油资源的不断开采和利用,以煤、天然气制甲醇的工艺路线越来越显示出重要性。
国家能源集团宁夏煤业有限公司煤制油装置年产100万t·a-1的甲醇合成单元以煤为原料,在催化剂存在下,用一氧化碳和氢气(俗称合成气)加压加温来制造甲醇。
关键词:燃料电池;甲醇电催化反应;催化剂;酸性环境引言甲醇合成催化剂是该甲醇生产技术路线的关键技术。
Cu-Zn-Al催化剂由于具有良好的低温活性与高温稳定性而成为目前研究最多的合成甲醇催化剂体系。
其中,Cu为主要活性组分,ZnO的加入可以与CuO产生协同效应,提高催化剂活性。
Al2O3作为载体,可以提高催化剂的比表面积和铜的分散度,防止反应过程中因铜晶粒烧结导致催化剂失活,提高催化剂的稳定性。
还有研究表明在Cu-Zn-Al体系催化剂中加入适量MgO,更利于铜晶粒的分散,可以进一步提高催化剂的热稳定性。
1甲醇氧化反应机理对酸性环境中甲醇氧化机理的研究表明甲醇氧化存在双反应路径,包括直接路径(非CO路径)和间接路径(CO路径)。
在CO路径中,甲醇会首先脱氢生成CO,然后被进一步氧化成CO2,而在非CO路径中,甲醇则直接氧化生成CO2。
早期MatthewNeurock运用第一性原理密度泛函理论计算分析甲醇电催化的反应机制。
他认为对于Pt(111),主要是CO路径占主导地位,当电位小于0.6VNHE时,CO会覆盖活性位点并且难以被氧化;而当电位高于0.6VNHE时,水会氧化生成OH;当电位略高于0.66VNHE时,CO会被氧化。
此外他还认为不同的反应路径中,中间体的活化对应所需的Pt活性位点数量不一,如对于非CO路径而言,中间体的活化仅需1~2个Pt原子,而CO路径则需要较大的表面集合和阶梯状活性位点。
根据DFT,具体的反应路径取决于甲醇脱氢是由C-H键还是O-H键的断裂开始的。
电化学共沉积法制备Au—Pt纳米枝晶催化剂及其对醇氧化反应的催化性能

电化学共沉积法制备Au—Pt纳米枝晶催化剂及其对醇氧化反应的催化性能作者:彭凌一干林杜鸿达来源:《中国新技术新产品》2017年第03期摘要:本文采用电化学共沉积法,在无任何表面活性剂的条件下,在Au纳米颗粒表面制备了不同Pt覆盖度的Au@Pt纳米枝晶催化剂。
电化学测试表明,在中等Pt覆盖度时,其对甲醇氧化反应具有最好的催化性能,作为直接甲醇燃料电池阳极催化剂具有较好的应用前景。
关键词:Au核Pt壳催化剂;纳米枝晶结构;甲醇氧化;乙醇氧化中图分类号:O643 文献标识码:A0.引言直接醇类燃料电池(Direct alcohol Fuel Cell,DAFC),采用甲醇或乙醇等为燃料,在氢氧燃料电池受到燃料储存运输限制的情况下,受到了广泛关注。
但甲醇氧化反应(Methanol Oxidation Reaction,MOR)和乙醇氧化反应(Ethanol Oxidation Reaction,EOR)的动力学缓慢,因此需要开发高效稳定的催化剂。
在目前广泛采用的Pt基催化剂中,核壳结构是一种有效的设计手段,因为其一方面可以降低Pt用量,另一方面基底的应变效应或电子相互作用效应可以调控表面Pt原子层的催化性质。
其中Au作基底得到的Au核Pt壳结构催化剂(Au@Pt),是一种高效的醇类氧化催化剂。
相比对球形纳米催化剂,纳米枝晶(Nano dendrites)催化剂可以提供更多的催化活性位点,提高催化活性。
通过化学还原法可以得到可控的Au@Pt枝晶结构,但是合成过程中不可避免地会使用到高分子聚合物表面活性剂,很难在后续处理中除去,对催化反应将带来不利影响。
本文提出了采用电化学共沉积,利用Pt在Au表面自发生长为团簇的特点,制备Au@Pt 枝晶结构催化剂的方法。
这一方法避免了表面活性剂的使用,有利于提高催化活性。
通过控制Pt的沉积量,系统研究了Pt的覆盖度对甲醇和乙醇氧化反应催化活性的影响。
1.实验部分本文中所有的电化学实验均在瑞士万通Autolab PGSTAT204电化学工作站上完成。
基于电化学原位红外光谱方法研究PtAu甲醇电催化氧化机理

第40卷,第10期 光谱学与光谱分析Vol.40,No.1 0,pp8 7-8 82 0 2 0年1 0月 Spectroscopy and Spectral Analysis October,2020 基于电化学原位红外光谱方法研究PtAu甲醇电催化氧化机理李 广,姜艳霞*厦门大学化学化工学院,福建厦门 361000摘 要 研究电化学反应过程的中间物种和反应机理对于构建催化剂表界面组成,结构和性能的构效关系具有重要意义。
衰减全反射红外光谱方法由于隐失波的红外吸收特性,对于表面吸附态物种具有较高的灵敏度,广泛应用于表界面反应机理研究。
基于这一方法,本工作对PtAu的甲醇电催化氧化的机理进行研究。
通过对比反应中主要中间物种(HCOOad和COad)的浓度变化,我们发现甲醇氧化的主要途径是非CO途径;通过分峰拟合的方法对反应中CO的种类和浓度进行分峰和统计,发现反应中存在多种吸附态CO,且随着反应的进行存在CO迁移现象。
利用CO作为探针分子进行毒化实验,证明反应过程中OH主要的吸附位点是Pt。
结合分峰拟合方法对反应过程中多种水进行结构区分和浓度分析,确认弱氢键水参与甲醇电催化氧化反应。
关键词 电化学原位红外光谱;衰减全反射;甲醇电催化氧化文献标识码:A 文章编号:1000-0593(2020)10-0087-02 收稿日期:2020-03-30,修订日期:2020-07-10 基金项目:国家重点研发计划项目(2017YFA0206500),国家自然科学基金项目(21773198,U1705253)资助 作者简介:李 广,1997年生,厦门大学化学化工学院博士生*通讯联系人 e-mail:yxjiang@xmu.edu.cn 随着化石燃料燃烧造成的环境问题与能源危机的日趋严重,开发新型可再生能源受到人们的广泛关注。
燃料电池以其能量密度高,高效清洁无污染成为最有可能的替代能源之一。
甲醇燃料电池以其原料来源广泛,能量密度高受到广泛研究。
niooh甲醇电氧化

niooh甲醇电氧化
甲醇是一种常见的可再生能源,被广泛应用于燃料电池和化工行业。
然而,甲醇的直接氧化反应速率较慢,导致能量转化效率低下。
因此,研究人员一直致力于寻找更高效的电催化剂,以提高甲醇的电化学氧化效率。
近年来,一种新型电催化剂——氢氧化镍(NiOOH)在甲醇电氧化领
域引起了研究人员的广泛关注。
NiOOH作为一种具有高活性和稳定性的电催
化剂,能够有效促进甲醇的氧化反应,提高能量转化效率。
本文将对NiOOH 在甲醇电氧化方面的研究进展进行综述,并探讨其在未来应用中的潜力和挑战。
首先,本文将介绍甲醇电氧化反应的机理和NiOOH的基本性质。
随后,将重点讨论NiOOH在甲醇氧化过程中的催化机理及其影响因素。
在此基础上,本文将综述近年来针对NiOOH电催化剂进行的合成改进和结构优化研究,并评述其对甲醇电氧化性能的影响。
此外,本文还将探讨NiOOH与其他催化剂在甲醇电氧化中的比较研究,并分析NiOOH在实际应用中可能面临的挑战和改进方向。
通过对NiOOH在甲醇电氧化领域的研究,可以更好地了解其作为电催化剂的优势和局限性,为未来进一步开发高效、稳定的甲醇电氧化催化剂提供理论基础和实验指导。
希望本文的综述能够为甲醇电氧化领域的研究提供新的思路和启发,推动该领域的发展和进步。
让我们总结一下本文的重点,我们可以发现,NiOOH作为一种新型电催化剂,在甲醇电氧化方面具有广阔的应用前景。
通过进一步深入研究其催化性能和机理,可以不断提高甲醇的电化学氧化效率,推动可再生能源的发展和利用。
希望本文的内容能够为相关研究提供有益的参考和借鉴,为推动甲醇电氧化领域的研究和应用做出贡献。
甲醇燃烧的电极方程式

甲醇燃烧的电极方程式甲醇(CH3OH)是一种无色、易挥发的液体,常用作燃料或溶剂。
在燃烧过程中,甲醇和氧气(O2)发生化学反应,产生二氧化碳(CO2)、水(H2O)和能量。
甲醇燃烧的电极方程式描述了这一反应过程在电化学系统中的行为。
在电化学系统中,甲醇燃烧的过程涉及两个半反应:氧化甲醇和还原氧分子。
甲醇在阳极(正极)被氧化为二氧化碳,同时还释放出正电荷和电子。
氧分子在阴极(负极)接受这些正电荷和电子,被还原为水。
这两个半反应可以写成如下方程式:甲醇氧化反应(阳极):CH3OH + H2O → CO2 + 6H+ + 6e-甲醇在阳极被氧化为二氧化碳,同时生成了6个正电荷和6个电子。
水在此反应中作为质子供体,提供了反应所需的H+。
氧气还原反应(阴极):O2 + 4H+ + 4e- → 2H2O氧气(O2)在阴极接受反应所需的正电荷和电子,被还原为水。
这是一个4个电子的还原反应,因此需要4个电子和4个正电荷。
甲醇燃烧反应可以写成这两个半反应的综合方程式:CH3OH + O2 → CO2 + 2H2O在燃烧反应中,甲醇和氧气反应生成二氧化碳和水。
这是一个放热反应,同时生成二氧化碳和水的同时释放大量的能量。
甲醇燃烧的电极方程式描述了在电化学系统中甲醇和氧气的氧化还原反应。
由于甲醇的氧化反应和氧气的还原反应需要在两个电极上同时进行,所以这个反应需要一个外部电源来提供电力。
这也是为什么甲醇燃料电池一般是由阳极和阴极两个电极和一个电解质组成的。
阳极和阴极之间的电子通过外部电路流动,实现了甲醇和氧气的反应过程。
总结起来,甲醇燃烧的电极方程式描述了甲醇氧化反应和氧气还原反应在电化学系统中的行为。
这个方程式为研究和设计使用甲醇燃料电池等电化学系统提供了理论和实践依据。
对于甲醇燃烧反应的研究有助于开发高效、清洁的燃料和能源转换技术,促进可持续发展。
第六章 析氢反应机理

产物应是H原子,而不是H2.
精品课件
析氢反应历程中可能出现的步骤
1.电化学步骤 H+(或H2O)+e-→MH
2.复合脱附步骤 MH+MH→H2,
3.电化学脱附步骤 H+(或H2O)+MH十e H2
[A] [B] [C]
精品课件
氢析出过程的反应机理 可以有下面四种基本方案:
电化学步骤 (快)+复合脱附 (慢) 电化学步骤 (慢)+复合脱附 (快) 电化学步骤 (快)+电化学脱附 (慢) 电化学步骤 (慢)+电化学脱附 (快)
(Ⅰ) (Ⅱ) (Ⅲ) (Ⅳ)
(Ⅱ) 、(Ⅳ) 是迟缓放电理论; (Ⅰ)是复合脱附理论; (Ⅲ)是电化学脱附理论。
精品课件
四、三种理论的动力学方程
实验证明,当在金属汞电极上进行析氢反应时,当电流 密度在10-10到102A·cm-2的范围内变化时,氢析出反应 的极化曲线在半对数坐标上是一根直线,其斜率为 0.11—0.12V,这与缓慢放电机理所推导的基本动力学 关系式中的b值相一致。
这一实验事实意味着虽然反应速度变化了1012倍,然而 动力学规律却并没有改变.类似的情况在动力学研究中 是十分罕见的.
精品课件
2.在Pd、Pt、Ni、Fe等金属上析氢机理
吸附氢的能力较强的金属电极上,尽管 b=118mV,但不能轻率认为只有迟缓放电理论 才正确。
Pt、Pd等电极上,极化不大时,H析出是复合脱 附机理,电化学极化大时是电化学脱附机理。
Ni、Fe电极上,H析出历程随电极表面性
MH
,MH
MHM 0 H
如果H吸很少时,可以用 MH代替 aMH。 不通过电流时的电极电势可写成:
甲醇催化氧化

甲醇催化氧化
甲醇催化氧化是一种常见的有机合成反应,它指的是在甲醇作为起始原料的条件下,通过催化剂的作用,使甲醇在一定的条件下氧化成其他产物。
甲醇催化氧化一般包括一步氧化反应和多步氧化反应。
一步氧化反应指的是将甲醇和氧气在一定的催化剂作用下,直接氧化成其他产物;而多步氧化反应则是在一定的催化剂的作用下,先将甲醇氧化成中间产物,再将中间产物氧化成最终产物。
甲醇催化氧化可以分为有机物的催化氧化反应和金属的催化氧化反应。
有机物的催化氧化反应是指在有机物的催化剂的作用下,将甲醇氧化成其他有机物的反应,例如有机酸、醛、酮、醇等,其中常见的催化剂有碳酸酯、醋酸、酰胺等。
而金属的催化氧化则是指在金属催化剂的作用下,将甲醇氧化成其他有机物,例如醇、醛、酮、酯等,其中常见的金属催化剂有银氧化物、铜氧化物等。
甲醇催化氧化反应的条件是温度、压力和催化剂的作用。
一般情况下,甲醇催化氧化反应的温度范围一般在100-400℃之间,不同的反应所需的温度是不同的,一般要根据实验来确定。
甲醇催化氧化反应的压力一般在1-5MPa 之间,催化剂的选择则是根据反应的工艺要求来确定的,
一般甲醇催化氧化反应中使用的催化剂有银、铜、铁、钯、钴和铬等。
甲醇催化氧化反应是一种重要的有机合成反应,它可以用于制备一系列有机物,如醇、醛、酮、酯、酸等,是有机合成中不可或缺的重要方法。
甲醇催化氧化反应的反应条件要求较为严格,但是反应的效率也比较高,可以大大减少合成时间,并且可以得到高纯度的产物,因此,甲醇催化氧化反应在有机合成中有着极其重要的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《应用化学综合实验》(项目化)电化学能源实验指导书课程代码:0703525008 开课学期:第6学期开课专业:应用化学
实验学时:16学时总学分/实验学分:0.5学分
综合实验室(实验中心)名称:生化实验中心二级实验室名称:应用化学专业实验室一、课程简介
《应用化学综合实验》电化学能源实验是化学专业比较新的的一门重要专业综合实验课。
本课程是根据甲醇燃料电池的相关理论与技术而展开的。
学生需具有基本的有机化学、无机化学、电化学等方面的基础知识。
通过本实验的学习,能够是学生了解最基本的甲醇燃料电池的工作原理和核心技术;能够使学生对能源及电化学能源具有初步的认识;能够为学生在将来从事相关工作打下基础。
二、实验的地位、作用和目的
通过此课程的学习,对电化学能源知识具有初步的了解,掌握基本的电化学技术。
三、实验方式与基本要求
实验方式以设计实验为主,从基础理论、材料准备、装置、数据的采集与分析等方面进行自主设计并进行实验。
1、掌握甲醇燃料电池的工作原理。
2、掌握评价甲醇燃料电池性能好坏的方法。
3、能从实验中发现更多的电化学能源相关的技术与理论。
四、报告与考核
设计实验报告和实验报告结果讨论等内容。
考核:1、设计实验的设计思路和方法40%。
2、实验操作和实验结果30%。
3、实验报告和讨论分析30%
五、设备及器材材料配置
六、实验指导书及主要参考书
1、陆天虹. 能源电化学,化学工业出版社,2014.11
2. 哈曼.电化学,化学工业出版社,2010.01
项目简介和设计要求
随着全球对新能源的需求,燃料电池被广泛研究。
甲醇燃料电池是燃料电池中的一种。
使用甲醇水溶液或蒸汽甲醇为燃料供给来源,而不需通过甲醇、汽油及天然气的重整制氢以供发电。
甲醇燃料电池具备低温快速启动、燃料洁净环保以及电池结构简单等特性。
这使得甲醇燃料电池可能成为未来便携式电子产品应用的主流。
本项目针对甲醇燃料电池的核心化学原理,也就是甲醇的催化氧化,来认识、了解燃料电池化学能源的原理。
学习全面的电化学测试、表征和数据处理技术。
设计要求:
(1)学会文献查阅和资料整理。
(2)学会如何参考文献设计实验方案,主要包括原理、实验具体操作步骤、电化学基本实验技术、数据的分析、评价和处理。
甲醇的电化学催化氧化实验指导书
一、目的要求:
1.掌握甲醇的电催化氧化机理和应用价值
2.掌握基本的电化学能源实验原理和技术
3.理解电化学催化的基本原理
二、实验原理:
甲醇燃料电池是直接利用甲醇水溶液为燃料,氧或空气作为氧化剂的一种新型燃料电池。
由于甲醇在室温下为液态,具有很高的能量密度,并且价格便宜,可以直接从石油、天然气、煤等原料中获得,在燃料获取中能量损耗少,系统效率高。
甲醇燃料电池的核心是甲醇在催化剂作用下的电催化氧化。
在酸性条件下,以金属铂等贵金属为催化剂,能够获得比较稳定的能量输出和电池性能。
然而,贵金属的使用使得甲醇燃料电池的成本很高。
在碱性条件下,非贵金属可用作催化剂,并且具有较好的催化氧化甲醇的能力。
本实验要求用大表面金属泡沫镍为催化剂设计在碱性条件下的实验。
同时,通过利用化学置换反应制铂催化剂,对两种不同条件下的甲醇电化学氧化结果进行对比。
在碱性条件下催化反应原理:
总反应式:2CH3OH + 3O2 + 4OH- = 2CO32- + 6H2O
正极:O2 + 4e + 2H2O → 4OH-
负极:CH3OH - 6e + 8OH-→ CO32- + 6H2O
而在酸性条件下,
总反应式: 2CH3OH + 3O2→ 2CO2 + 4H2O
正极:O2 + 4e + 4H+→ 2H2O
负极:CH3OH - 6e + H2O → 6H+ + CO2
三、实验原料和试剂:
泡沫镍,硫酸,氢氧化钾,氯化钠,氯铂酸。
四、实验步骤:
1. 甲醇在非贵金属镍催化剂下的电催化氧化
1.1 碱性条件
1.1.1 泡沫镍预处理:将4条泡沫镍放在0.25 M 硫酸,0.05 M 氯化钠溶液中超声
20分钟,然后用蒸馏水冲洗干净,将处理过的泡沫镍保存在蒸馏水水中。
其中1条泡沫镍放置在0.25 M 硫酸,0.05 M 氯化钠溶液中腐蚀6个小时,然后清洗备用。
1.1.2电解液为 1 M KOH,0.5 M甲醇。
将2 mL电解液放置于电解池中,分别插入
1条泡沫镍做工作电极、Pt对电极和Ag/AgCl参比电极。
循环伏安法条件为:起始电位为0 V,终止电位为1.2 V,扫描速率为10(3圈),20(3圈),50(5圈),100(5圈) mV/s。
利用循环伏安法确定甲醇的氧化电位时需与不含甲醇的电解液做对比进行观察(做20 mV/s扫速的就可以)。
1.1.3在恒电位0.4, 0.5,0.6 V下,运行时间设定为600 s。
对获得的I-t曲线进
行对比观察,了解催化过程的变化。
并了解电流变化的原因。
1.1.4 通过改变甲醇的浓度(0,0.1 M,0.5 M,1 M),利用循环伏安法来观察浓
度与峰电流输出的关系(20 mV/s扫速下进行实验即可)。
为什么这样变化?
1.1.5 利用化学腐蚀方法来改变泡沫镍的表面积(1.1.1中腐蚀的泡沫镍),然后
利用循环伏安法和同步电流法比较催化剂腐蚀前后的催化电流变化。
(注意实验时保持插入深度一致)
2. 甲醇在贵金属铂催化剂下的电催化氧化
铂电极的制备是通过化学置换反应得到的。
利用氯铂酸和镍的自发置换反应来制备铂电极。
制备条件为:泡沫镍条放入3 mL 3 mM 氯铂酸溶液中置换15 h。
2.1 碱性条件
电解液为 1 M KOH。
甲醇浓度为0.5 M。
利用循环伏安法确定甲醇的氧化电位。
在恒电位下,通过观察电流随时间的变化得到催化过程的变化规律。
通过改变甲醇的浓度来观察浓度与电流输出的关系。
2.2 酸性条件
电解液为0.1 M 硫酸。
甲醇浓度1 M。
利用以上描述的电化学方法进行实验观察。
五、数据收集及处理
根据要求,将实验获得的数据进行系统化处理,自行设计撰写实验报告。
所有数据要从软件导出为.txt文件,自行用Excel软件绘图,横、纵坐
标名称及单位要标记明确。
图1: 1.1.2中不同扫速下的CV图对比;
图2:1.1.2不含甲醇和含有甲醇的CV图对比;
图3: 1.1.3中不同恒定电位下的I-t图对比;
图4:1.1.4不同甲醇浓度下的CV图对比;
图5:1.1.5泡沫镍腐蚀前后的CV图和I-t对比;
图7:2.1中Pt电极在KOH条件下的CV图与相同条件下的Ni电极的CV 图对比;;
图8: 2.1中Pt电极在KOH条件下的I-t图与相同条件下的Ni电极的I-t图对比;
图9:2.2中Pt电极在H
2SO
4
条件下的CV图;
图10:2.2中Pt电极在H
2SO
4
条件下的I-t图。
六、注意事项:
1.注意电极的连接要正确。
实验工程中三电极不能相互碰触。
2.参比电极使用后要放回原储藏瓶。
七、思考题
1.酸性和碱性条件对甲醇催化氧化各有哪些优缺点?
2.如何提高甲醇催化氧化的效率?
3.催化剂起什么作用?催化剂优化的方向是什么?
4.化学腐蚀的基本原理是什么?。
