结构化学习题8讲解
王顺荣编高教版社结构化学习题答案第8章

r 以所 r
+
r r - +1=522.1=R/R522.1= 则 r r + r
+
R522.1=
2/1
4 〕 )3/R 3 (- R- )R2(〔 = 2 2 2 2 3 =
2/1
4 3 2 〕 2)MA -2)BA (-2BA〔 1 1 3
就墨石�是于。满半道轨 0∏使并�道轨∏和 � 满填子电个 01 的 3CC 成组。 �键
。容内体具 的述阐所律定学化晶结明说例实举试�律定学化晶结是么什、5
1.8 表 pch pcc pch pch pcc 方立单简 pcc 式型积堆 石红金 2FaC sAiN SnZ 方六 SnZ 方立 lCsC lCaN 式型构结
�系联何有构结积堆与别分�式型构结本基种几有体晶子离、4
。点特的大性脆�高度硬、点熔有具 物合化属金。格晶的新种一成形合化互相素元的金合成组指是则物合化属金。用 作的化强溶固到起以可般一。的格晶剂溶持保仍,剂溶入溶子原质溶下态固在金 合指是体溶固�处之同不的物合化属金、体溶固较比。杂复较常通�同不都元组 的它成组与构结体晶的物合化属金而�同相剂溶的它成组与构结体晶体溶固�答
。带导的满填分部了有
非� ∏个二 ��∏个一 、∏个一中其 �道轨子分型∏个 4 成形肩并道轨子原∏P 个 0 个每�键成 C 的邻近个 3 与道轨化杂 3PS 以 C 个每的上层�中墨石的构结状层
4�道轨 ∏P 的化杂 2ps 与参未个一有尚上 C 个每且。道轨�� 个 3 含团基 3CC 。体缘绝是石刚金故�宽极带禁间带二�带空低最和带满高最的体晶
。别区的体缘绝和体导半、体导释解论理带能的构结体晶用 1
�343106070�艺泽朱 �503106070�玲爱陈 �403106070�女龙汤 �203106070�琳琳翁 �303106070�玲炎董
结构化学习题解答解析

习题选解第一章1.1 E = 1.988⨯10-18Jp = 6.626⨯10-27kg ⋅m ⋅s -1 1.2 h = 6.442⨯10-34J ⋅s w = 5.869⨯10-19J ν0 = 9.11⨯1014s -1 1.4 光子能量21.24eV ;电子动能 5.481eV 1.5 70.8pm1.9 (1)1/4;(2)2.63⨯10-5;(3)2/l ;(4)01.10 3个,E 1 = h 2/(8ml 2);E 2 = 4h 2/(8ml 2);E 3 = 9h 2/(8ml 2) 1.13 301.5 nm 1.16 0.14 nm 1.17 86.2nm1.20 (1)无,l /2;(2)无,0;(3)有,2224n h l ;(4)有,2228n h ml 1.21 (1)是,能量无确定值,22513h E mL =;(2) 是,能量无确定值,2297104h E mL = 1.22 (1) 2222k E mr =,i k φψ, k =0, ±1, ±2, …;(2) 136pm 1.23 (1) h 2/(8ml 2);(2) l /2,2/l ;(3)01.24 n x =3, n y =1, n z =2;n x =3, n y =2, n z =1;n x =2, n y =1, n z =3;n x =2, n y =3, n z =1;n x =1, n y =2, n z =3;n x =1, n y =3, n z =2 1.25 (1)不是,x →∞时,ψ→∞不满足平方可积;(2)不是,x →-∞时,ψ→∞不满足平方可积;(3)不是,在x =0处一阶微商不连续;(4)不是,ψ不满足平方可积;(5) 不是,ψ不满足平方可积,在x =0处一阶微商不连续;(6) 是 1.27 11πsin 42π2n n -;n =3;1/4;说明当n →∞时,一维势箱中运动的粒子,其概率分布与经典力学相同 1.28 (1)1ψ=;(2) ψ=(3) i m φψ=;(4) 0/r a ψ-=1.29 (1)是;(2) 是;(3) 不是;(4) 是;(5) 不是1.31 (1) 是d/d x 和d 2/d x 2的本征函数,本征值分别为a 、a 2(2) 不是d/d x 和d 2/d x 2的本征函数(3) 不是d/d x 的本征函数,是d 2/d x 2的本征函数,本征值为-a 2 (4) 不是d/d x 的本征函数,是d 2/d x 2的本征函数,本征值为-a 2 (5) 不是d/d x 和d 2/d x 2的本征函数 (6) 不是d/d x 和d 2/d x 2的本征函数1.34 无确定值,2258h E ml =1.351.36 (a /2, a /4, a /2),(a /2, 3a /4, a /2);y = a /2 1.37 (1) 是;(2) 是;(3) 不是;(1) 不是 1.38 |p |=nh /2l第二章 2.1 3a 0/2 2.5 22.6 (1) ()22212349R C C C ⎡⎤-++⎣⎦;(2)21C ;;(4)1;(5) 2223()C C - ;(6)0 2.14 (1) -3.4eV ;(2) ;(3)0;(4)r /a 0(5)(6)2.15 (1);(2) n =2, l =1, m =0;(3) E =-3.4eV ,|M | =0,M z = 02.16 (1) 1111(1)(1)(1)(1)(2)(2)(1)(2)s s s s αψβΦαψβ=;(2) E = -78.6eV2.17 (1) 112112112(1)(1)(1)(1)(3)(3)(2)(2)(2)(2)(3)(3)(3)(3)(3)(3)(3)(3)s s s s s s s s s αψβψαΦαψβψααψβψα=或112112112(1)(1)(1)(1)(3)(3)(2)(2)(2)(2)(3)(3)(3)(3)(3)(3)(3)(3)s s s s s s s s sαψβψβΦαψβψβαψβψβ=; (2) E = -204.03eV2.18 (1) 3P 0;(2) 3P 2;(3) 4S 3/2;(4) 6S 5/2;(5) 3F 2;(6) 3F 4;(7) 4F 3/2;(8) 4F 9/2;(9) 5D 4 2.19 (1) 1S(1S 0);(2) 2P(2P 3/2 2P 1/2);(3) 1S(1S 0), 3P(3P 2, 3P 1, 3P 0), 1D(1D 2);(4) 1S(1S 0), 3P(3P 2, 3P 1, 3P 0), 1D(1D 2), 3F(3F 4, 3F 3, 3F 2), 1G(1G 4); (5) 1P(1P 1),3P(3P 2, 3P 1, 3P 0);(6)1S(1S 0), 3S(3S 1), 1P(1P 1),3P(3P 2, 3P 1, 3P 0), 1D(1D 2), 3D(3D 3, 3D 2, 3D 1) 2.21 第一种2.22 未成对电子数:2l +1 基支项:2212l l S ++2.24 (1) 4S 、2D 、2P(2) 4D 、4P 、4S 、2D(2)、2P(2)、2S(2) (3) 4P 、2D 、2P 、2S(4) 4P 、4D 、4F 、2S 、2P(2)、2D(3)、2F(2)、2G (5)1S 3P 1D 1S 1S 3P 1D 3P 3P 5D, 5P,5S, 3D, 3P, 3S, 1D, 1P, 1S3F, 3D,3P1D 1D 3F, 3D, 3P 1G,1F, 1D, 1P,1S3 F 3F 5G, 5F , 5D, 3G, 3F , 3D, 1G, 1F , 1D 3H, 3G, 3F, 3D,3P1G 1G 3H, 3G, 3F 1I, 1H, 1G,1F,1D2.25 I 1= 11.46eV2.26 (1)5;(2)15;(3)4;(4)45;(5)675;(6)1350 ;;(4) 2, 1, 0, -1, -2;(5)5 2.29 (1)A, C ;(2)A, B ;(3)B, C 2.31 2个节面2.32 (1))122z s s p ψψψψ=++;(2) 无,<E>=-6.8eV ,1/3; (3) 3 ,2/3; (4) 有,0,0第三章3.7 (1)OF :(1σ)2(2σ)2(3σ)2(4σ)2(5σ)2(1π)4(2π)3,一个σ键,一个三电子π键,键级3/2,顺磁性(2)NO :(1σ)2(2σ)2(3σ)2(4σ)2(1π)4 (5σ)2(2π)1,1σ,1π,一个三电子π键,键级5/2,顺磁性 (3)CO :(1σ)2(2σ)2(3σ)2(4σ)2(1π)4 (5σ)2,一个σ键,二个π键,键级3,反磁性(4)CN :(1σ)2(2σ)2(3σ)2(4σ)2(1π)4 (5σ)1,一个单电子σ键,二个π键,键级5/2,顺磁性 (5)HF :(1σ)2(2σ)2(3σ)2(1π)4,一个σ键,键级1,反磁性3.8 (1) O 2:2*22*2222*1*1112222222s s s s pz px py px py σσσσσππππ;O 2+:2*22*2222*111222222s s s s pz px py px σσσσσπππ;O 2-:2*22*2222*2*1112222222s s s s pz px py px py σσσσσππππ;键级:O 2+ > O 2 > O 2-;键长:O 2+ < O 2 < O 2- (2) OF :(1σ)2(2σ)2(3σ)2(4σ)2(5σ)2(1π)4(2π)3;OF +:(1σ)2(2σ)2(3σ)2(4σ)2(5σ)2(1π)4(2π)2;OF -:(1σ)2(2σ)2(3σ)2(4σ)2(5σ)2(1π)4(2π)4;键级:OF + > OF > OF -;键长:OF + < OF < OF -3.10 (1)得电子变为AB -型负离子后比原来中性分子键能大的分子:C 2,CN(2)失电子变为AB +型正离子后比原来中性分子键能大的分子:O 2,F 2,NO 3.12 p x -d xy (否);p y -d yz (π);d x 2-y 2-d x 2-y 2(δ);d z 2-d z 2(σ);p x -p x (π) 3.13原子轨道3s 3p z 3p x 3p y 3d z 23d zx 3d yz 3d xy 3d x 2-y 2沿z 轴对称类型(节面数) 0 0 1 10 1 1 2 2 有14对轨道对符合对称性匹配:原子轨道对 3s -3s 3s -3p z 3s -3d z 2 3p z -3p z 3p z -3d z 23d z 2-3d z 2 3p x -3p x 分子轨道类型 σ σ σ σσσπ原子轨道对 3p x -3d xz 3p y -3p y 3p y -3d yz 3d xz -3d xz 3d yz -3d yz 3d xy -3d xy 3d x 2-y 2-3d x 2-y 2分子轨道类型 π π π ππδδ3.14 (1) E I <E 1<E 2<E II ;(2) 222112/()a a a +;(3) 222112/()b b b +;(4) ψI 含φ1(A)原子轨道的成份多一些,ψII 含φ2(B)原子轨道的成份多一些;(5) 这个化学键的电子云会偏向A 原子3.15 1122x s p ψψ=+;21263x y s p p ψψψψ=-+;312662x y z s p p p ψψψψψ=--+;412662x y z s p p p ψψψψψ=---3.17 (1)0.73;(2)0.71;(3)0.683.23 NF :1σ22σ23σ24σ25σ21π42π2,键级:2,顺磁性;NF +:1σ22σ23σ24σ25σ21π42π1,键级:2.5,顺磁性;NF -:1σ22σ23σ24σ25σ21π42π3,键级:1.5,顺磁性第四章4.1 (1)π34,(2)π78,(3) π78,(4) π88,(5) π910,(6) π78,(7) π34,(8) π34,(9)无,(10) π1414,(11) π44,(12) π34(2个),(13) π34(2个),(14) π34(2个),(15)无,(16) π34(2个),(17) π34,(18) π46,(19) π46,(20)π46,(21) π344.6 (1) 1E α=,E 2 = α,3E α=;(2) ()112312φψψ=++)213φψψ-()312312φψψ=-+; (3) -0.828β;(4) C C C0.51.00.7074.8 (1) E 1=α+2β,E 2=E 3=α-β(2) 环丙烯正离子、自由基和负离子的离域能分别为-2β、-β和0(3) )1123φψψψ++,)21232φψψψ=--,)323φψψ=-(4) 4.11 (1) 2个π34,(2) E 1=α+2β, E 2=α+β,E 3=α-β(3) α+2βα+βα-β(4) 离域能为-1.528β 4.14 6α+5.656β第六章6.2 存在对称中心i : C 2h C 4h C 6h D 2h D 4h D 6h D 3d D 5d S 2 S 6存在垂直于主轴的镜面σh :C 2h C 3h C 4h C 5h C 6h D 2h D 3h D 4h D 5h D 6h S 3 S 5 6.3(1) CO —C ∞v ,CO 2—D ∞h ,NO 2+—D ∞h ,乙炔—D ∞h ,H 2S —C 2v ,NH 3—C 3v ,CH 3Cl —C 3v ,HOCl —C s ,H 2O 2—C 2,NO 2—C 2v ,CH 4—T d ,SF 6—O h(2) 重叠式乙烷—D 3h ,交叉式乙烷—D 3d ,椅式环己烷—D 3d ,船式环己烷—C 2v ,丙二烯—D 2d ,CHCl 2Br —C s ,CH 2=C=CCl 2—C 2v ,CHCl=C=CHCl —C 2,CH 3-CCl 3(交叉式)—C 3v , CH 3-CCl 3(重叠式)—C 3v(3) 顺式(重叠式)二茂铁—D 5h ,反式(交叉式)二茂铁—D 5d ,[Co(NH 2–CH 2–CH 2–NH 2)3]3+—D 3,1,3,5,7四甲基–环辛四烯—S 4(4) [PtCl 4]2-—D 4h ,HCHO —C 2v ,顺式二氯乙烯—C 2v ,反式二氯乙烯—C 2h ,CH 2=CCl 2—C 2v ,苯分子—D 6h ,萘分子—D 2h ,对二氯苯—D 2h ,邻二氯苯—C 2v ,间二氯苯—C 2v , BCl 3—D 3h ,[CO 3]2-—D 3h6.4B N B N B N H H H H H HD 3h ,B B BNH 2NH 2H 2ND 3hFH HFHHC 2h , H FF HHH C 2h, HHHHFFC2h ,CC FC 2h ,6.5 (1)D 2h (2)D 2d (3)D 26.6 (1) 去掉2个球有以下3种情况:2vvd (2) 去掉3个球有以下3种情况:s s 3v6.7⑴正三角形D 3h ⑵正方形 D 4h ⑶正六边形D 6h ⑷长方形 D 2h ⑸中国国旗上的一个五角星 D 5h ⑹正三棱锥 C 3v ⑺正三棱柱D 3h ⑻正四棱锥C 4v ⑼正四棱柱 D 4h ⑽双正四棱锥D 4h ⑾正六棱柱D 6h ⑿正四面体T d ⒀正八面体 O h⒁正六面体(即立方体)O h⒂圆锥体C ∞v ⒃园柱体D ∞h6.8 XX XXXXXXXX XXX XXX X XXXXXXX XXXXXX XXX XX Y XXY XYXYYXX YC s C 2D 2dC 2vC i C 1C 2hC s C sC 2vD 2hC 2hC 2hC 4v C 2C 2v第七章 7.1点阵点数目1 1 1 1每个点阵点代表的内容 白1、黑2白1、黑1白1、黑1白3 黑球和白球的数目 白1、黑2白1、黑1白1、黑1白37.7(1)0,0,0; 1/2,1/2,0; 1/2,0,1/2; 0,1/2,1/2; 1/4,1/4,1/4; 1/4,3/4,3/4; 3/4,1/4,3/4; 3/4,3/4,1/4;(2)154.5pm 7.8 (右图)7.9 d 110=233.8pm ;d 220=143.2pm7.10 201pm7.11 (100)与(010):90°;(100)与(001):90°;(100)与(210):26.56°7.14 (1)C 2v ,正交;(2) C 2h ,单斜;(3)D 2h ,正交;(4) D 4h ,四方; (5)D 6h ,六方;(6)C 3v ,三方;(7)C 3i ,三方(8)C 3h ,六方;(9)D 3h ,六方; (10)S 4,四方;(11)C s ,单斜;(12) O h ,立方;(13)T d ,立方; (14) D 2d ,四方;(15)O ,立方;(16) C 6h ,六方;(17) D 3,三方; (18) T ,立方;(19) D 3d 三方;(20)T h ,立方 7.157.17(100)(010)(120)(230)第八章8.1 28.0748.2 21.453gcm-3r=138.7pm8.3 a=b=328pm,c=536pm;3.187gcm-38.4 r =185.8pm,0.967gcm-3,d=303pm8.8 a=352.4pm,8.908gcm-3,r=124.6pm8.14 r=146pm8.17 CaS:正负离子配位数皆为6,正八面体,A1,晶体结构型式为cF;CsBr:正负离子配位数皆为8,立方体,立方简单,晶体结构型式为cP8.18 (2) 154pm;(3) 1.53gcm-3;(4) 274pm8.20 cF;分数坐标:0,0,0; 1/2,1/2,0; 1/2,0,1/2; 0,1/2,1/2;80.99%8.22 (1)Ti4+:000;Ba2+:1/2,1/2,1/2;O2-:0,0,1/2; 0,1/2,0; 1/2,0,0(2) BaTiO3 (3)cP(4)与Ba2+离子配位的O2-负离子数为12;与Ti4+离子配位的O2-负离子数为6(6) A1第九章9.2 cF,a=359pm9.5 (1) a=415.8pm;(2) x = 0.92,(NiO)76(Ni2O3)8;(3) A1,正八面体空隙,92%;(4) 294pm9.8 (1) 21.45gcm-3,r = 186.7pm;(2)有两个,分别来自200和4009.9 (1)19.356gcm-3;(2) 共有7对粉末线,衍射指标依次为(110), (200), (211), (220), (310), (222) (321) 9.10 (1) r = 128pm;(2) 仅有(200)和(400)的衍射峰;(3) (200)与(400)衍射峰对应的2L值分别为50.4mm和116.8mm9.11 (1) a=565.9pm;(2)cF;(3)n = 49.12 (1) r=137.0pm;(2)2级9.16 106.6pm9.17 141.9pm9.18 k1/k2=1.7149.19 11MHz9.26 λ1,λ3,λ5由HCl产生,HCl核间距129pm;λ2,λ4,λ6由HBr产生,HBr核间距143pm9.28 131pm;477.7Nm−19.30 64.32⨯1012s−1;1.5547⨯10−14s;1859.7 Nm−1;12.83kJ;3.859cm−1附录III 模型实习实习一、分子的对称性目的:1. 掌握寻找分子中独立对称元素、判断分子点群的方法;2. 根据分子所属点群判断分子有无偶极矩3. 根据分子所属点群判断分子有无旋光性。
结构化学习题解答8

2 1 / 2
故:d 200 a(2 2 ) 1 / 2 0.5a 176 .2 pm d111 a(12 12 12 ) 1 / 2 a / 3 203 .5 pm d 220 a(2 2 )
2 2 1 / 2
a / 8 124 .6 pm
180 2 L 180 2 L(mm) L 4R 4 (57 .3mm) / 2
由sin 2 求h 2 k 2 l 2 可用第1条线的 sin 2 值去除各线的sin 2 值, 然后乘一个合适的整数使之都接近整数值。 由Bragg公式2d sin 以及立方晶系的 d a (h 2 k 2 l 2 )
rC C (1 a / 4) 2 (1 b / 4) 2 (1 c / 4) 2 a 3 4 3 356 .7 pm 4 154 .4 pm 密度D ZM / NV 8 12 .0 g / 6.02 10 23 ) /(356 .7 10 10 cm) 3 ( 3.51g cm
N ZM / VD 8 28 .0854 g mol 1 (543 .089 pm) 3 (10 30 cm 3 pm 3 ) 2.03283 g cm 3 6.0245 10 23 mol 1
[7.30]已知某立方晶系晶体,其密度为2.16 g· -3,相对分子质 cm 量为234。用Cu Ka射线在直径57.3mm粉末相机中拍粉末图, 从中量得衍射220的衍射线间距2L为22.3mm,求晶胞参数及晶 胞中分子数。
3
[8.15] 四 方 晶 系 的 金 红 石 晶 体 结 构 中 , 晶 胞 参 数 a=458pm,c=298pm ; 原 子 分 数 坐 标 为 : Ti(0,0,0;1/2,1/2,1/2) ; O(0.31,0.31,0;0.69,0.69,0;0.81,0.19,1/2;0.19,0.81,1/2) 。 计算z值相同的Ti—O键长。 [解]:z值相同的Ti—O键是Ti(0,0,0)和O(0.31,0.31,0)之 间的键,其键长rTi-O为:
结构化学练习题集与答案解析

结构化学练习题集与答案解析结构化学练习题一、填空题试卷中可能用到的常数:电子质量(9.110×10-31kg ), 真空光速(2.998×108m.s -1), 电子电荷(-1.602×10-19C ),Planck 常量(6.626×10-34J.s ), Bohr 半径(5.29×10-11m ), Bohr 磁子(9.274×10-24J.T -1), Avogadro 常数(6.022×1023mol -1)1. 导致"量子"概念引入的三个著名实验分别是___, ________ 和__________.2. 测不准关系_____________________。
3. 氢原子光谱实验中,波尔提出原子存在于具有确定能量的(),此时原子不辐射能量,从()向()跃迁才发射或吸收能量;光电效应实验中入射光的频率越大,则()越大。
4. 按照晶体部结构的周期性,划分出一个个大小和形状完全一样的平行六面体,以代表晶体结构的基本重复单位,叫。
程中,a 称为力学量算符A的。
5. 方6. 如果某一微观体系有多种可能状态,则由它们线性组合所得的状态也是体系的可能状态,这叫做原理。
7. 将多电子原子中的其它所有电子对某一个电子的排斥作用看成是球对称的,是只与径向有关的力场,这就是近似。
8. 原子单位中,长度的单位是一个Bohr 半径,质量的单位是一个电子的静止质量,而能量的单位为。
9. He + 离子的薛定谔方程为()。
ψψa A =?10. 钠的电子组态为1s22s22p63s1,写出光谱项______,光谱支项__________。
11. 给出下列分子所属点群:吡啶_______,BF3______,NO3-_______,二茂铁_____________。
12. 在C2+,NO,H2+,He2+,等分子中,存在单电子σ键的是________,存在三电子σ键的是__________,存在单电子π键的是________,存在三电子π键的是_____________。
《结构化学》(7-10章)习题答案全解
《结晶学基础》习题答案目录第7章答案----------------------------------------------------------------------1第8章答案---------------------------------------------------------------------12第9章答案---------------------------------------------------------------------20第10章答案------------------------------------------------------------------251《结晶学基础》第七章习题答案7001 单晶:一个晶体能基本上被一个空间点阵的单位矢量所贯穿。
多晶:包含许多颗晶粒,这些晶粒可能为同一品种,也可能不同品种,由于各晶粒在空间取向可能不同,不能被同一点阵的单位矢量贯穿。
7002 (D) 7004 简单立方; Cs +和Cl -; 4C 37005 (1) 立方F (2) A 和 B (3) 4 个 (4) 4 组 (5) 3a (6) a /2 7007 4n 个 A, 8n 个 B, n 为自然数。
7010 d 111= 249 pm ; d 211= 176 pm ; d 100= 432 pm 7011 六方; D 3h 70127013 依次为立方,四方,四方,正交,六方。
7014 立方 P ,立方 I ,立方 F ; 四方 P ,四方 I 。
7015 旋转轴,镜面,对称中心,反轴; 旋转轴,镜面,对称中心,反轴,点阵,螺旋轴,滑移面;n =1,2,3,4,6; 32个; 七个晶系; 14种空间点阵型式; 230个空间群。
7016 (1) 四方晶系 (2) 四方 I (3) D 4 (4) a =b ≠c , α=β=γ=90° 7017 (1) 单斜晶系,单斜 P (2) C 2h (3) C 2, m , i 7018 (2a ,3b ,c ):(326); (a ,b ,c ):(111); (6a ,3b ,3c ):(122); (2a ,-3b ,-3c ):(322)。
结构化学习题解答8(北大)

根据Bragg方程 2d hkl sin
得:
sin
2d hkl
将立方晶系面间距dhkl、晶胞参数a和衍射指标hkl间的关系式
h2 k 2 l 2 代入,得: sin
d hkl
a
h2 k 2 l 2
2a
154.2 pm 3 2 3 2 3 2 404.9 pm
a3 N 所以,晶胞参数:
1 3 1 3
4 26.98g m ol 4M a 2.70g cm 3 6.022 1023 m ol1 DN
1
面心立方结构中晶胞参 a与原子半径R的关系为a 2 2 R, 数 因此,铝的原子半径为 : 2 2 143.2 pm R a 404.9 pm 2 2
229.1 pm 2 2 2 sin h k l h k l 2a 2 352.4 pm
2 2 2
0.3251 h 2 k 2 l 2
当h2+k2+l2≥11时,sinθ>1,这是不允许的。因此,h2+k2+l2 只能 为3,4和8,即只能出现111,200和220衍射。相应的衍射角为
即锡的相对原子质量为118.3 (d) 由题意,白锡的密度为:
DSn (白) 4M / a 2 cN 4 118.3g m ol1 (583.2 1010 cm) 2 (318.1 1010 cm) 6.022 1023 m ol1 7.26g cm 3
a 8 3
3
rSi 8 3
8 3
117pm 540pm
V a ( D (
117pm) 3 1.58 108 pm3 8 28.09g m ol1
结构化学习题答案

结构化学习题 答案第八章 金属晶体结构8001(C)8002非。
8003非。
六方晶系只有简单六方一种点阵型式,六方晶胞中所含的两个球,均属一个结构基元。
80041:2:18005(E)80060,0,0; 1/3,2/3,1/2 (或 0,0,0; 2/3,1/3,1/2)8007(1) 63,6 简单六方。
(2) 0,0,0; 1/3,2/3,1/2。
(3) (N A ·34πr 3)/0.7405 = 13.95 cm 3 (4) d 002= 2×1.633×160/2 pm = 522.6/2 pm = 261.3 pm8008面; 面8009(1) (1/3,2/3,1/4); (1/3,2/3,3/4);(2) (2/3,1/3,1/8); (2/3,1/3,7/8); (0,0,3/8); (0,0,5/8)8010分子占据面积πr 2; 平行四边形面积 2r ×2r ×sin60°rr r 22866.02⨯⨯π = 0.9078011布拉格角: 34.27°; 40.56°; 66.83°;指标: 111; 200; 220 。
8012(1) a = 352.4 pm(2) d =V N nM A /=2432310524.31002.6/70.584-⨯⨯⨯ g▪cm -3 = 8.906 g▪cm -3 (3) 略8013A 1型堆积为立方面心结构,第一对谱线的衍射指标为111a = 362.0 pmr = 128.0 pm立方面心,每个晶胞中有4个Cu 原子, d = 8.89 g ·cm -38014r = 143 pm; θ= 19.3°8015a = 400.4 pmr = 141.6 pmA 1堆积每个晶胞中有4个Al 原子, d = 2.793 g ·cm -38016(1) r = 138.4 pm(2) 最多能得到(100)的4级衍射8017体心点阵8018r =41(3×4292)1/2= 185.8 pm8019d (110)=330×sin45°pm = 233.3 pmsin θ=0.660, θ=41.3°8020d = 21.45 g ·cm -3r = 138.7 pm8021a = 405.0 pm8021r =41(2×405.02)1/2 pm = 143.2 pm8022a =b =2×146 pm = 292 pmc =292×1.633 pm = 477 pm8023对于体心立方,只能出现h +k +l =偶数之衍射线,即只出现(110),(200), (211),(220), (310),(222),(231),(004)等。
北师大结构化学课后习题答案

北师大构造化学课后习题第一章量子理论根底习题答案1什么是物质波与它的统计说明?参考答案:象电子等实物粒子具有波动性被称作物质波。
物质波的波动性是与微粒行为的统计性联络在一起的。
对大量粒子而言,衍射强度〔即波的强度〕大的地方,粒子出现的数目就多,而衍射强度小的地方,粒子出现的数目就少。
对一个粒子而言,通过晶体到达底片的位置不能精确预料。
假设将一样速度的粒子,在一样的条件下重复屡次一样的试验,肯定会在衍射强度大的地方出现的时机多,在衍射强度小的地方出现的时机少。
因此依据波恩物质波的统计说明,对于单个粒子,ψ2代表粒子的几率密度,在ψ*=ψ时刻t,空间q点旁边体积元τd内粒子的几率应为τd2ψ;在整个空间找到一个粒子的几率应为12⎰τd。
表示波函数具有归ψ=一性。
2如何理解合格波函数的根本条件?参考答案合格波函数的根本条件是单值,连续与平方可积。
由于波函数2ψ代表概率密度的物理意义,所以就要求描绘微观粒子运动状态的波函数首先必需是单值的,因为只有当波函数ψ在空间每一点只有一个值时,才能保证概率密度的单值性;至于连续的要求是由于粒子运动状态要符合Schrödinger方程,该方程是二阶方程,就要求波函数具有连续性的特点;平方可积的是因为在整个空间必为一个有限中发觉粒子的概率肯定是100%,所以积分⎰τψdψ*数。
3如何理解态叠加原理?参考答案在经典理论中,一个波可由假设干个波叠加组成。
这个合成的波含有原来假设干波的各种成份〔如各种不同的波长与频率〕。
而在量子力学中,按波函数的统计说明,态叠加原理有更深入的含义。
某一物理量Q的对应不同本征值的本征态的叠加,使粒子部分地处于Q1状态,部分地处于Q2态,……。
各种态都有自己的权重〔即成份〕。
这就导致了在态叠加下测量结果的不确定性。
但量子力学可以计算出测量的平均值。
4测不准原理的根源是什么?参考答案根源就在于微观粒子的波粒二象性。
5铝的逸出功是4.2eV,用2000Å的光照耀时,问〔a〕产生的光电子动能是多少?(b)及其相联络的德布罗依波波长是多少?(c)假如电子位置不确定量及德布罗依波波长相当,其动量不确定量如何?参考答案(a)依据爱因斯坦光电方程W m h +=221υν,又λνc =,得光电子动能:(b)由德布罗依关系式,相应的物质波波长为(c) 由不确定关系式h Px x ≥∆⋅∆,假设位置不确定量λ≈∆x ,那么动量不确定量6波函数e -x (0≤x≤¥)是否是合格波函数,它归一化了吗?如未归一化,求归一化常数。
夏少武—简明结构化学学习指导-习题及解答

夏少武—简明结构化学学习指导-习题及解答夏少武是国内知名的化学教育专家,他的著作《简明结构化学学习指导》是一本以解析为主的化学教材,帮助学生理解和掌握化学结构与性质的基本概念。
下面是《简明结构化学学习指导》中的一些习题及解答,供学生参考。
第一章:物质的基本结构1.请解释“物质”的概念。
物质是构成宇宙的基本元素,具有质量和占据空间的特性。
物质可以以固态、液态或气态存在,并且可以通过化学反应转化为其他物质。
2.简述物质的物理性质和化学性质的区别。
物理性质是物质自身所具有的不会改变其化学组成的性质,如颜色、密度、熔点等。
而化学性质是指物质在与其他物质发生反应时表现出的性质,如可燃性、可溶性等。
3.什么是分子?分子是什么构成的?分子是由两个或多个原子通过化学键连接在一起形成的稳定的结构单位。
分子可以由相同的原子组成(元素分子)或不同的原子组成(化合物分子)。
4.请解释“离子”的概念。
离子是由于电离而带有正电荷或负电荷的粒子。
正离子是失去了一个或多个电子的原子或分子,带有正电荷;负离子是获得了一个或多个电子的原子或分子,带有负电荷。
5.请解释“简单离子”和“复杂离子”的概念。
简单离子是由一个单一的原子或离子组成的离子。
复杂离子是由多个原子或离子结合形成的离子,它们之间通过共价键连接。
第二章:分子的键合1.解释原子价电子的概念。
原子价电子是指原子外层能量层上未参与化学键形成的电子。
通过对原子的电子层结构的了解,我们可以确定原子的价电子数。
2.解释最外层电子层对于原子化学性质的重要性。
最外层电子层上的电子是原子化学性质的决定因素。
原子通过与其他原子形成化学键来完成其外层电子层的电子配对,从而达到稳定状态。
3.请解释“共价键”和“离子键”的概念。
共价键是由共享电子而形成的化学键。
它是一种原子间的强相互作用,通常存在于非金属原子之间。
离子键是由正负电荷之间的吸引力而形成的化学键,通常存在于金属和非金属离子之间。
4.解释极性键的概念。
结构化学课后习题答案

结构化学课后习题答案结构化化学课后习题答案一、化学键与分子结构1. 选择题a) 正确答案:D解析:选择题中,选项D提到了共价键的形成是通过电子的共享,符合共价键的定义。
b) 正确答案:B解析:选择题中,选项B提到了离子键的形成是通过电子的转移,符合离子键的定义。
c) 正确答案:C解析:选择题中,选项C提到了金属键的形成是通过金属原子之间的电子云重叠,符合金属键的定义。
d) 正确答案:A解析:选择题中,选项A提到了氢键的形成是通过氢原子与高电负性原子之间的吸引力,符合氢键的定义。
2. 填空题a) 正确答案:共价键解析:填空题中,根据问题描述,两个非金属原子之间的键称为共价键。
b) 正确答案:离子键解析:填空题中,根据问题描述,一个金属原子将电子转移到一个非金属原子上形成的键称为离子键。
c) 正确答案:金属键解析:填空题中,根据问题描述,金属原子之间的电子云重叠形成的键称为金属键。
d) 正确答案:氢键解析:填空题中,根据问题描述,氢原子与高电负性原子之间的吸引力形成的键称为氢键。
二、有机化学1. 选择题a) 正确答案:C解析:选择题中,选项C提到了烷烃是由碳和氢组成的,符合烷烃的定义。
b) 正确答案:D解析:选择题中,选项D提到了烯烃是由含有一个或多个双键的碳原子组成的,符合烯烃的定义。
c) 正确答案:B解析:选择题中,选项B提到了炔烃是由含有一个或多个三键的碳原子组成的,符合炔烃的定义。
d) 正确答案:A解析:选择题中,选项A提到了芳香烃是由芳香环结构组成的,符合芳香烃的定义。
2. 填空题a) 正确答案:醇解析:填空题中,根据问题描述,含有羟基(-OH)的有机化合物称为醇。
b) 正确答案:醚解析:填空题中,根据问题描述,含有氧原子连接两个碳原子的有机化合物称为醚。
c) 正确答案:酮解析:填空题中,根据问题描述,含有羰基(C=O)的有机化合物称为酮。
d) 正确答案:酯解析:填空题中,根据问题描述,含有羧基(-COO)的有机化合物称为酯。
结构化学习题集讲解

结构化学习题集习题1:1.1 某同步加速器,可把质子加速至具有100×109eV的动能,试问此时质子速度多大?1.2 计算波长为600nm(红光),550nm(黄光),400nm(蓝光)和200nm(紫光)光子的能量。
1.3 在黑体辐射中,对一个电热容器加热到不同温度,从一个针孔辐射出不同波长的极大值,试从其推导Planck常数的数值:T/℃1000 1500 2000 2500 3000 3500l max/nm 2181 1600 1240 1035 878 7631.4 计算下列粒子的德布洛意波长(1) 动能为100eV的电子;(2) 动能为10eV的中子;(3) 速度为1000m/s的氢原子.1.5 质量0.004kg子弹以500ms-1速度运动,原子中的电子以1000ms-1速度运动,试估计它们位置的不确定度, 证明子弹有确定的运动轨道, 可用经典力学处理, 而电子运动需量子力学处理。
1.6 用测不准原理说明普通光学光栅(间隙约10-6m)观察不到10000V电压加速的电子衍射。
1.7 小球的质量为2mg,重心位置可准确到2μm,在确定小球运动速度时,讨论测不准关系有否实际意义?1.8 判断下列算符是否是线性\厄米算符:(1)(2)(3)x1+x2(4)1.9 下列函数是否是的本征函数?若是,求其本征值:(1)exp(ikx)(2)coskx (3)k (4)kx1.10 氢原子1s态本征函数为(a0为玻尔半径),试求1s态归一化波函数。
1.11 已知一维谐振子的本征函数为其中a n和α都是常数,证明n=0与n=1时两个本征函数正交。
1.12 若是算符的本征函数(B为常数), 试求α值,并求其本征值。
1.13 计算Poisson 方括,1.14 证明Poisson 方括的下列性质:(1)(2)1.15 角动量算符定义为:, ,证明: (1) (2)1.16 在什么条件下?1.17 设体系处于状态中,角动量和M Z有无定值。
结构化学习题答案第8章

第八章晶体的结构与晶体材料小组成员:张海娟(070601301)翁琳琳(070601302)董炎玲(070601303)汤龙女(070601304)陈爱玲(070601305)朱泽艺(070601343)1 用晶体结构的能带理论解释导体、半导体和绝缘体的区别。
答:能带结构可以解释固体中导体、半导体、绝缘体三大类区别的由来。
材料的导电性是由“传导带”中含有的电子数量决定。
当电子从“价带”获得能量而跳跃至“传导带”时,电子就可以在带间任意移动而导电。
一般常见的金属材料,因为其传导带与价带之间的“能隙”非常小,在室温下电子很容易获得能量而跳跃至传导带而导电,而绝缘材料则因为能隙很大(通常大于9 电子伏特),电子很难跳跃至传导带,所以无法导电。
一般半导体材料的能隙约为1 至3 电子伏特,介于导体和绝缘体之间。
因此只要给予适当条件的能量激发,或是改变其能隙之间距,此材料就能导电。
2、金属键和共价键中离域电子有何本质不同?试用费米能级解释之。
答:自旋为半整数(1/2 等)的电子是“费米子”,故金属中的“自由”电子氛1服从费米——狄拉克统计分布规律:f F-D=e( E -E F ) / kT +1式中f F-D为电子在能级E 上的概率,E F 为费米能级,k 为玻耳兹曼常数,T为1热力学温度。
根据f F-D=当E<E F,则f F-D=1;e( E -E F ) / kT +1,T=0K 时,有当E>E F,则f F-D=0;当E=E F,则f F-D=1/2;由f F-D的行为可以看出,费米能级是0K 时电子所能占据的最高能级。
只有0K 时,电子才能完全按能量最低原理充满整个低能级。
而对于能量等于E F 的量子状态其被电子填充的概率仅为1/2。
当T>0K 时,如E-E F=kT时f F-D=0.27,由此可见,在一般温度下,金属中的电子在能级上的分布情况是:绝大部分较低能级被电子充满,但当一部分较高的能级在未被完全充满时,就有电子去占据更高能级了,这是金属具有良好导电性的原因。
《结构化学》(1-5章)习题解析

目录第一章--------------------------------------------------------------------------------------------------1 第二章-------------------------------------------------------------------------------------------------14 第三章-------------------------------------------------------------------------------------------------30 第四章-------------------------------------------------------------------------------------------------42 第五章-------------------------------------------------------------------------------------------------48第一章习题1001 首先提出能量量子化假定的科学家是:---------------------------( )(A) Einstein (B) Bohr (C) Schrodinger (D) Planck 1002 光波粒二象性的关系式为_______________________________________。
1003 德布罗意关系式为____________________;宏观物体的λ值比微观物体的λ值_______________。
1004 在电子衍射实验中,│ψ│2对一个电子来说,代表___________________。
1005 求德布罗意波长为0.1 nm 的电子的动量和动能。
结构化学课后习题及答案
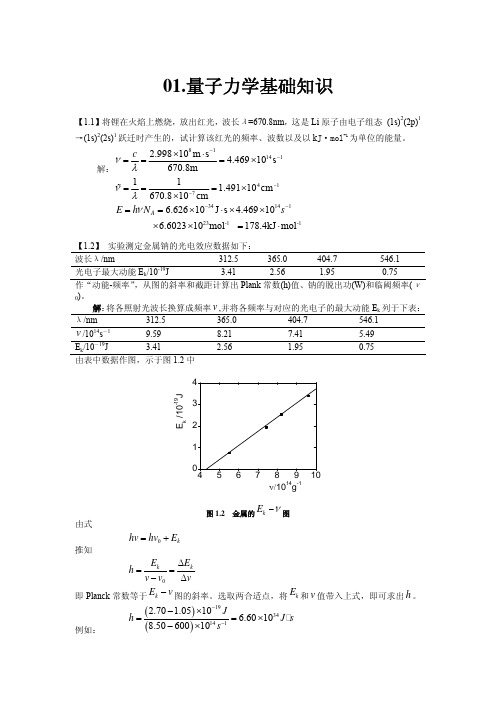
01.量子力学基础知识【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm ,这是Li 原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J·mol -1为单位的能量。
解:811412.99810m s 4.46910s 670.8m cνλ−−×⋅===× 41711 1.49110cm 670.810cm νλ−−===××%3414123-1 -16.62610J s 4.46910 6.602310mol 178.4kJ mol A E h N sν−−==×⋅××××=⋅【1.2】 实验测定金属钠的光电效应数据如下:波长λ/nm 312.5 365.0 404.7 546.1 光电子最大动能E k /10-19J 3.41 2.56 1.95 0.75 作“动能-频率”,从图的斜率和截距计算出Plank 常数(h)值、钠的脱出功(W)和临阈频率(ν0)。
解:将各照射光波长换算成频率,并将各频率与对应的光电子的最大动能E k 列于下表:v λ/nm 312.5 365.0 404.7 546.1v /1014s -19.59 8.21 7.41 5.49E k /10-19J 3.41 2.56 1.95 0.75 由表中数据作图,示于图1.2中E k /10-19Jν/1014g-1图1.2 金属的kE ν−图由式 0k hv hv E =+推知0k kE E h v v v Δ==−Δ即Planck 常数等于图的斜率。
选取两合适点,将和v 值带入上式,即可求出h 。
例如: k E −v k E ()()19341412.708.50 1.0510 6.601060010J h J s s −−−×==×−×图中直线与横坐标的交点所代表的即金属的临界频率,由图可知,。
结构化学基础习题解析

结构化学基础习题解析
本文旨在介绍结构化学的基础习题及其解析,以提高读者对结构化学的理解和应用。
结构化学是一种分析物质的结构的科学,它融合了物理化学、生物化学和化学物理学等学科,是物理、化学和生物研究的重要基础。
结构化学的基本概念是研究物质的结构,其中包括物质的大小、结构、形状及其相互作用。
在结构化学中,研究人员可以使用分子模型和物理量子化学来研究物质的结构和性质,从而推断出发生的化学反应的机理。
结构化学的基础习题主要包括物质的独特性质、分子模型和晶格结构。
首先,物质的独特性质是由其原子组成、结构和配位数等决定的。
研究人员可以利用原子的性质和能量,结合分子模型和物理量子化学,以解释原子的特定性状。
其次,分子模型是一种理解物质结构的技术,包括用不同颜色表示原子、用箱线表示分子结构、计算分子中各原子间的距离,以及计算分子的总能量等。
最后,晶格结构是指物质的晶体构造,即原子、分子和离子之间的特定排列结构,它可以帮助研究人员了解物质的构型特性和性质。
此外,结构化学关注的还有化学反应的机理和过程,以及各种物质的结构变化与物性之间的关系。
研究人员可以利用结构信息,如原子组成、分子模型和晶格结构,解释某一特定物质的特性和行为,从而利用这些信息推断出发生的化学反应机理。
总之,结构化学的基础习题包括独特性质、分子模型和晶格结构,
以及化学反应的机理等内容,是了解物质的结构和性质的基础。
结构化学的基础习题可以帮助读者更合理地使用结构化学来解释物质的结构、性质和行为,从而推断出发生的化学反应的机理,同时提高读者的结构化学知识。
结构化学习题、详解、答案

第一章 量子力学基础题 解1.1. 给出黑体辐射频率分布函数),(T R ν的单位。
解: 黑体辐射的频率分布函数),(T R ν表示黑体辐射的频率分布,ννd ),(T R 表示在温度T 单位时间内由单位黑体表面积上所发射的频率在νννd ~+间的辐射能量。
121s m J s )(---⋅⋅=νR2m J )(-⋅=νRs m w s m sJm J 2-22⋅⋅=⋅⋅=⋅--式中w 是功率.1.2. 分别计算红光λ=600 nm 和X 射线λ=100 pm 的1个光子的能量、动量和质量。
解:λνc=,νh E =,λhp =,2ch m ν=(1) 波长1λ=600 nm 的红光,813419119310m s 6.62610J s 3.31310J 60010mE h ν----⨯⋅==⨯⋅⨯=⨯⨯ 12793411s m kg 10104.1m10600s J 10626.6----⋅⋅⨯=⨯⋅⨯==λhp 19361128123.31310J 3.68110kg (310m s )h m c ν---⨯===⨯⨯⋅ (2)X 射线2λ=100 pm8134152212310m s 6.62610J s 1.98810J 10010mE h ν----⨯⋅==⨯⋅⨯=⨯⨯ 124123422s m kg 10626.6m10100s J 10626.6----⋅⋅⨯=⨯⋅⨯==λhp 15322228121.98810J2.20910kg (310m s )h m c ν---⨯===⨯⨯⋅ 1.3. 计算波长λ=400nm 的光照射到金属铯上所产生的光电子的初速度。
已知铯的临阈波长为600nm解:根据W h T -=ν其中,201, 2e Tm W h υν== 2012e m h h υνν=-51 6.03010(m s )υ-====⨯⋅1.4. 氢原子光谱中巴尔麦系中波长最长的一条谱线的波数、波长和频率各是多少?波长最短的一条呢?解:氢原子光谱中巴尔麦系谱线的波数可表达为4, 3, )121(~~22=-=n n R ν 其中5-11.09710cm ,R=⨯ 称为Rydberg 常数。
北师大_结构化学课后习题答案

北师大 结构化学 课后习题第一章 量子理论基础习题答案1 什么是物质波和它的统计解释?参考答案:象电子等实物粒子具有波动性被称作物质波。
物质波的波动性是和微粒行为的统计性联系在一起的。
对大量粒子而言,衍射强度(即波的强度)大的地方,粒子出现的数目就多,而衍射强度小的地方,粒子出现的数目就少。
对一个粒子而言,通过晶体到达底片的位置不能准确预测。
若将相同速度的粒子,在相同的条件下重复多次相同的实验,一定会在衍射强度大的地方出现的机会多,在衍射强度小的地方出现的机会少。
因此按照波恩物质波的统计解释,对于单个粒子,ψψ=ψ*2代表粒子的几率密度,在时刻t ,空间q 点附近体积元τd 内粒子的几率应为τd 2ψ;在整个空间找到一个粒子的几率应为12=ψ⎰τd 。
表示波函数具有归一性。
2 如何理解合格波函数的基本条件?参考答案合格波函数的基本条件是单值,连续和平方可积。
由于波函数2ψ代表概率密度的物理意义,所以就要求描述微观粒子运动状态的波函数首先必须是单值的,因为只有当波函数ψ在空间每一点只有一个值时,才能保证概率密度的单值性;至于连续的要求是由于粒子运动状态要符合Schrödinger 方程,该方程是二阶方程,就要求波函数具有连续性的特点;平方可积的是因为在整个空间中发现粒子的概率一定是100%,所以积分⎰τψψd *必为一个有限数。
3 如何理解态叠加原理?参考答案在经典理论中,一个波可由若干个波叠加组成。
这个合成的波含有原来若干波的各种成份(如各种不同的波长和频率)。
而在量子力学中,按波函数的统计解释,态叠加原理有更深刻的含义。
某一物理量Q 的对应不同本征值的本征态的叠加,使粒子部分地处于Q 1状态,部分地处于Q 2态,……。
各种态都有自己的权重(即成份)。
这就导致了在态叠加下测量结果的不确定性。
但量子力学可以计算出测量的平均值。
4 测不准原理的根源是什么?参考答案根源就在于微观粒子的波粒二象性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
rC C
1 4
0 2 a2
1 4
0 2 a 2
1 4
0
2
a
2
2
3 a 3 356.7 154.4 pm 44
D MZ NV
12g mol1 8
6.02 1023 m ol1 356.73 1030 cm3
3.51g cm3
习题2. 写出在3个坐标轴上的截距分别为2a、-3b和 -3c的点阵面的指标;写出指标为(321)的点阵面在3 个坐标轴上的截距之比。
2
8
3 c 3 505pm 189pm 88
习题8. 由Ca,Ti和O组成的三元离子晶体的结构可看 作是Ca2+和O2-一起有序地进行立方最密堆积。该晶 体晶胞的顶点位置被Ca2+占据,体心位置被Ti4+占据, 面心位置被O2-占据。 (a)画出晶胞,写出各粒子的坐标参数; (b)写出该晶体的化学式; (c)写出该晶体的空间点阵型式; (d)以Ti4+为晶胞顶点,写出各粒子的分数坐标;
2 3
,
1 3
,
1 2
(c)1mol镁原子的真实体积为: 4 πr3 N 3
而镁晶体中原子的空间利用率为0.7405,所以镁晶体
的摩尔体积为:
4 πr 3N 0.7405 13.95cm3 mol 1 3
(d)计算衍射面间距d002:
d002
4 3a2
h2 hk k2
l2 c2
1
2
习题3. 硅的晶体结构和金刚石相似。20度下测得其立 方晶胞参数a=543.089pm,密度为2.3283,Si的相对 原子质量为28.0854,计算Avogadro常数。
解:由公式,D MZ 可得:N MZ
NV
DV
所以: 28.0854g mol 1 8
N 2.3283g cm3 543.0893 1030 cm 3
6.0245 1023 mol 1
习题4. 冰为六方晶系晶体,晶胞参数a=452.27pm,c
=736.71pm,晶胞中含4H2O,O原子分数坐标为:
据此计算或说0,0明,0;:0,0,0.375;
2 ,1 ,1 ; 332
2Hale Waihona Puke 3,1 3,0.875
(a)计算冰的密度;
(b)计算氢键键长O—H…O;
解:晶面指标为晶面在三个坐标轴上的倒易截数的 互质整数比,即: 1 : 1 : 1
2 3 3
所以:点阵面指标为: 322
设:指标为(321)的点阵面在3个坐标轴上的截数之比 为:r、s、t。则根据晶面指标定义有: 1 : 1 : 1 3 : 2 : 1
rst
r:s:t=2:3:6,即指标为(321)的点阵面在三 个轴上的截距之比为2a:3b:6c。
r 3a 3 429pm 185.8pm 44
钠的理论密度为:
D MZ NV
23g mol1 2
6.02 1023 m ol1 4293 1030 cm3
0.967g cm3
(110)面的间距为(立方晶系):
d110
a
h2 k 2
l2
1 2
429pm12
12
02
1 2
Ca2+
解:(a)晶胞如图所示:
(b)该晶体的化学式为: CaTiO3
(c)属于简单空间点阵型式;
Ti4+ O2-
(d)以Ca的位置为晶胞
顶点写出的分数坐标为:
Ca 2 : 0,0,0 O 2 : 0, 1 , 1 ; 1 ,0, 1 ; 1 , 1 ,0
222 222 Ti 4 : 1 , 1 , 1
222
将坐标原点移到Ti的位置,即坐
标原点由0,0,0变为1/2,1/2,1/2。此
解:(a)晶胞如图所示:
C
2 ,1,1
Si
332
2 ,1,1 338
(b)如图,晶胞中含有2 (c)空间点阵型式:简单六方。
个SiC;
每个点阵点代表2个SiC。
(d)Si作六方最密堆积,C添在四面体空隙中
(e)
1
rSi C
2 3
2 2 a 2 3
1 3
1 2 a 2 3
1 2
1
2
c
2
(c)冰的点阵型式是什么?结构基元包含那些内容。
解:(a) D MZ
NV
18g mol1 4
6.02 1023 m ol1 452.272 736.71 sin60 1030 cm3
0.917g cm3
(b)距离最近的的两个O原子间的距离即为氢 键 键 长 。 所 以 : 氢 键 键 长 为 坐 标 为 (0,0,0) 和 (0,0,0.375)的两个O原子间的距离。
303.4pm
习题6. 金属镁属于A3型结构,镁的原子半径为160pm。 (a)指出镁晶体所属的空间点阵型式; (b)写出晶胞中原子的分数坐标; (c)若原子符合硬球堆积规律,计算金属镁的摩尔体 积; (d)求d002值。
解:(a)空间点阵型式为简单六方(属于六方晶)。
(b)晶胞中原子的分数坐标为: 0,0,0;
r 0.375 0c 0.375 736.71pm 276.3pm
(c)空间点阵型式为简单六方空间点阵型式;结 构基元为4H2O。
习题5. 金属钠为体心立方结构,a=429pm,计算: (a)钠的原子半径; (b)金属钠的理论密度; (c)(110)面的间距。
解:金属钠为体心立方结构,原子在晶胞的体对角线 上紧密接触。这样,有: 3a 4r 所以:钠的原子半径为:
c 4 6 r 1 2 6 160pm 261.3pm 23 23
习题7. 具有六方ZnS型结构的SiC晶体,其六方晶胞参 数为a=308pm,c=505pm。已知C原子的分数坐标为 0,0,0 和 2/3,1/3,1/2 ; Si 原 子 分 数 坐 标 为 0,0,5/8 和 2/3,1/3,1/8。请回答或计算下列问题: (a)按比例清楚地画出这个六方晶胞; (b)晶胞中含有几个SiC; (c)画出点阵型式,说明每个点阵点代表什么? (d)Si作什么型式的堆积,C添在什么空隙中? (e)计算Si-C键长。
晶体结构和性质习题
习题1. 已知金刚石立方晶胞的晶胞参数a=356.7pm, 写出其中碳原子的分数坐标,并计算C-C键长和晶 体密度。
解:金刚石中碳原子分数坐标为:
0,0,0; 0, 1 , 1 ; 1 ,0, 1 ; 1 , 1 ,0; 22 2 2 22
1,1,1; 3,3,1; 1,3,3; 3,1,3 444 444 444 444
