2018初中常见物质的转化关系框图
九级化学物质转化关系图

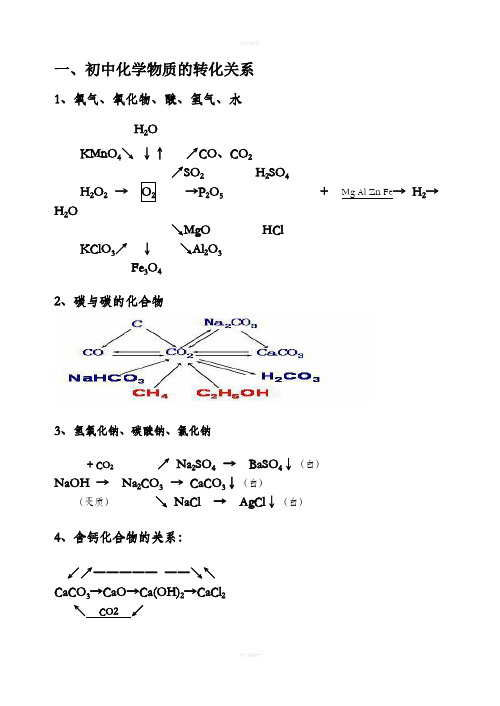
一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡1 / 32 /3 ↗BaCl 2 → BaSO 4↓(白)BaO → Ba(OH)2 ↗↘ + CuS O 4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO 2↙ ↘ Ca(HCO 3)2 → CaCO 3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2O NaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 2 8、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2CaCO 3 ⑸ ⑹ ⑺ ⑻CaCO3Na2CO3CO2CO2NaOHNa2CO3CO2O2H2ONaOH NH4ClNH3⑼⑽⑾⑿3 / 3。
人教版2018年秋九年级化学下册专题复习三框图推断题习题新版

专题复习(三) 框图推断题1.(2018·河北)A~L是初中化学常见物质,它们之间的转化关系如图所示(反应条件已略去)。
其中G是大理石的主要成分,A和I为红色固体,B、D和L为气体。
请回答下列问题:(1)G的化学式为__CaCO3__。
(2)E的组成元素在化合物中常呈现的化合价有__+2,+3__。
(3)反应③的化学方程式为__Fe+CuSO4===FeSO4+Cu[CuCl2、Cu(NO3)2也可以]__。
(4)上述转化中,B和L表现出的化学性质是__还原性__。
2.(河北中考)A~J表示初中化学常见的物质,其中B可用在酸蓄电池中,G是最清洁的燃料,H是蓝色沉淀,各物质间相互转化关系如图所示。
请回答下列问题:(1)G的化学式为__H2__。
(2)E的一种用途是__作导线(或铜锅、铜像等)__。
(3)反应④的基本反应类型为__复分解反应__。
(4)反应③的化学方程式为__CuSO4+2NaOH===Cu(OH)2↓+Na2SO4__。
3.(河北中考)A~I表示初中化学常见的物质,其中C是大理石的主要成分,各物质间相互转化关系如下图所示(反应条件已略去)。
请回答下列问题:(1)C的化学式为__CaCO3__。
(2)A的一种用途是__改良酸性土壤(或作建筑材料、配制农药等)__。
(3)上述转化中没有涉及的基本反应类型是__置换反应__。
(4)反应③的化学方程式为(只写一个)__2NaOH+H2SO4===Na2SO4+2H2O(或NaO H+HCl===NaCl+H2O)__。
4.(河北中考)A~J是初中化学常见的物质,它们的相互转化关系如图所示。
其中A 是一种常见的化肥,不能与碱性物质混合使用;H和D的组成元素相同。
请回答下列问题:(1)反应①的基本反应类型为__分解反应__。
(2)B 的化学式为__NH 3__。
(3)反应③的化学方程式为__2C +O 2=====点燃2CO__。
(4)反应④的实际应用为__冶炼金属__。
初中化学物质转化关系图2

一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→O2→P2O5 + Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓〔白〕NaOH → Na2CO3 → CaCO3↓〔白〕〔变质〕↘ NaCl → AgCl↓〔白〕4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡↗BaCl2→ BaSO4↓〔白〕BaO → Ba(OH)2↗↘ + CuS O4↘Cu(OH)2↓〔蓝〕6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO2↙↘ Ca(HCO3)2 →CaCO3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2O NaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 2 8、常见物质的相互转化关系〔即注明必要的反响物、反响条件〕CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2 CaCO 3 ⑸ ⑹ ⑺ ⑻ CaCO 3 Na 2CO 3 CO 2 CO 2 NaOH Na 2CO 3 CO 2 O 2 H 2O NaOH NH 4ClNH 3 ⑼ ⑽ ⑾ ⑿。
常见物质的转化关系网络图

常见物质的转化关系网络图常见物质的转化关系网络图一、钠及其化合物之间的相互转化SO2(20)HCl(13)/Cl2(19) CO2(12)H2O(10) C a(O H)2(11)NaOHH2O(8) H2O(9)O2 (1) O2 (2) CO2(3) CO2(6)Na Na2O Na2O2Na2CO3NaHCO3NaOH/△(7)O2点燃(4)HCl(14) HCl(15)Cl2(17) CO2(5)NaCl电解(18) 先通NH3再通CO2 (16)粗盐提纯(含有泥沙、Ca2+、Mg2+、SO42-)涉及的化学方程式:(1)4Na+O2=2Na2O(白色固体)(2)2Na2O+O2=2Na2O2(淡黄色固体)(3)2Na2O2+2CO2=2Na2CO3+O2(作为潜水艇供氧剂的原理)(4)2Na+O2Na2O2(5)Na2O+ CO2= Na2CO3(6)Na2CO3+CO2+H2O=2NaHCO3(除去NaHCO3溶液中的少量Na2CO3)(7)NaHCO3+NaOH=Na2CO3+H2O(除去Na2CO3溶液中...的少量NaHCO3)2 NaHCO3Na2CO3+ CO2 +H2O(除去Na2CO3固体中...的少量NaHCO3)(俗名:碳酸钠-纯碱碳酸氢钠-小苏打)(8)Na2O+H2O= 2NaOH(9)2Na2O2+2H2O =4NaOH +O2(10)2Na+2H2O=2NaOH+H2 [现象:浮、熔、游、响、红(滴加酚酞的溶液)] (11)Na2CO3+C a(O H)2=CaCO3 +2NaOH (土法炼碱原理)(12) 2NaOH+CO2(少量)= Na2CO3+H2O(13) NaOH+HCl=NaCl+H2O(14) Na2CO3+2HC l(足量)=2NaCl+CO2 +H2O 可用互相滴加的方法鉴别(15) NaHCO3+HCl(少量)=NaCl+CO2 +H2O 盐酸和碳酸钠溶液(16)NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3(2 NaHCO3Na2CO3+ CO2 +H2O )(侯氏制碱法原理)(17)2Na+Cl22NaCl(现象:白烟)(18) 2NaCl(熔融)2Na+Cl2 (工业制金属钠的方法)(19)Cl2+2NaOH=NaCl+NaClO+H2O(氯气的尾气处理原理)(20) SO2+2NaOH=Na2SO3+H2O(二氧化硫尾气的处理原理)二、镁及其化合物之间的转化(6)CO2MgO(5)O2(7)HCl (8)△(10)N2 (1)HCl (3) Ca(OH)2Mg3N2Mg MgCl2Mg(OH)2(11)H2O (2)通电(4)HCl(9)H2O、△涉及的化学方程式:(1)Mg+2HCl=MgCl2+H2 (典型的放热反应)(2) MgCl2Mg+Cl2 (工业上制取金属镁的方法)(3)MgCl2+Ca(OH)2=Mg(OH)2 +CaCl2(从海水中提取镁的第一步反应)(4) Mg(OH)2 +2HCl= MgCl2+2H2O(5) 2Mg+O22MgO(现象:耀眼的白光用途:提供光照条件)(6) 2Mg+CO22MgO+C(说明二氧化碳也可以支持燃烧)(7) MgO+2HCl=MgCl2+H2O(8) Mg(OH)2MgO+H2O(9) Mg+2H2O Mg(OH)2 +H2(2Na+2H2O=2NaOH+H2 剧烈反应Al+H2O不反应,利用三者与水反应的差异比较金属性强弱)(10) 3Mg+N2Mg3N2(说明氮气也可以支持燃烧)(11) Mg3N2+6H2O=3Mg(OH)2 +2NH3三、硫及其化合物之间的相互转化(16)O2(13)SO2Na2SO43(12) NaOH (5)O2 (6)H2OSO3(1)H2(2)O2(9)Na2SO3H2S S SO2H2SO4(3)O2(10)Cu(11)C(14)CaO H2SO3(19)H2SO4(18)Fe (17)Hg (18)O2CaCO3 (7)H2O (8)O2(15)O2CaSO423涉及到的化学方程式(1)S+H2H2S(2)S+O2SO2(现象:空气中-淡蓝色火焰;纯氧中-蓝紫色火焰) (3)2H2S+O2(不足) 2S+2H2O(4)2H2S+SO2=3S +2H2O(体现二氧化硫氧化性的)(5)2SO2+O22SO3(空气中催化剂可以为灰尘,工业上采用V2O5作为催化剂)(6)SO3+H2O=H2SO4(7)SO2+H2O=H2SO3 酸雨形成的两条途径(8)H2SO3+O2= H2SO4(9)Na2SO3+H2SO4Na2SO4+SO2 +H2O(实验室制SO2的方法,由于SO2的溶解度较大,所以使用Na2SO3固体和浓硫酸在加热条件下反应,体现硫酸的强酸性)(10)Cu+2H2SO4(浓) CuSO4+SO2 +2H2O(硫酸体现酸性和强氧化性)思考一:1、实验现象?2、如何检验产物(CuSO4和SO2))3、硫酸体现什么性?4、被还原和未被还原硫酸的物质的量之比为多少?5、含溶质2mol的浓硫酸与足量的铜反应,被还原的硫酸为多少?(11)C+2H2SO4(浓) CO2 2 +2H2O(硫酸体现强氧化性)思考二:1、如何设计实验依次检验出此反应的产物?2、蔗糖里加浓硫酸,再加少量水,不断的搅拌,现象?体现硫酸的什么性质?(12)SO2(少量)+2NaOH= Na2SO3+H2O(含二氧化硫尾气的处理方法)(13)Na2SO3+SO2+H2O=2NaHSO3(14)SO2+CaO CaSO3(15)2CaSO3+O2=2CaSO4 (钙基固硫原理,将二氧化硫最终变为石膏)(16)2Na2SO3+O2= 2Na2SO4思考三:1、暴露在空气中亚硫酸钠固体可能含有什么杂质?2、如何检验亚硫酸钠是否变质?3、如何设计定量测定已部分变质的亚硫酸钠固体的纯度?(17)S+Hg=HgS(实验室处理洒落水银的方法)(18)S+Fe Fe+2S 说明氯气的氧化性比硫单质强(3Cl2+2Fe2Fe+3Cl3)(19)FeS+H2SO4(稀)=FeSO4+H2S (实验室制备H2S的方法,体现硫酸的强酸性)(20)4FeS2+11O22Fe2O3+8SO2(2SO2+O22SO3 SO3+H2O=H2SO4))工业制硫酸的原理。
(完整版)各类有机物的转化关系图.doc

用于备课的资料各类有机物的转化关系图:1.常见官能团与性质官能团碳碳双键碳碳三键卤素醇羟基酚羟基醛基羰基羧基结构性质易加成、易氧化、易聚合易加成、易氧化、易聚合易取代 ( 如溴乙烷与 NaOH水溶液共热生成乙醇) 、易消去 ( 如(X=Cl 、 Br等 )溴乙烷与 NaOH醇溶液共热生成乙烯)易取代、易消去 ( 如乙醇在浓硫酸、 170℃条件下生成乙烯 ) 、易催化氧化 ( 如乙醇在酸性 K2Cr2O7溶液中被氧化为乙醛甚至乙酸 )极弱酸性 ( 酚羟基中的氢与 NaOH溶液反应 , 但酸性极弱 , 不能使指示剂变色 ) 、易氧化 ( 如无色的苯酚晶体易被空气中的氧气氧化为粉红色 ) 、显色反应 ( 如苯酚遇 FeCl3溶液呈紫色 ) 、苯酚遇浓溴水产生白色沉淀易氧化 ( 如乙醛与银氨溶液共热生成银镜)易还原 ( 如在Cu/Ag催化加热条件下还原为)酸性 ( 如乙酸的酸性强于碳酸, 乙酸与 NaOH溶液反应 ) 、易取代 ( 如乙酸与乙醇在浓硫酸、加热条件下发生酯化反应)易水解 ( 如乙酸乙酯在稀硫酸、加热条件下发生酸性水解, 酯基乙酸乙酯在 NaOH溶液、加热条件下发生碱性水解 )烷氧基如环氧乙烷在酸催化下与水一起加热生成乙二醇硝基还原 ( 如酸性条件下 , 硝基苯在铁粉催化下还原为苯胺) 2.有机反应类型与重要的有机反应反应类型重要的有机反应取代反应取代反应反应类型加成反应烷烃的卤代 :CH4+Cl 2CH3Cl+HCl烯烃的卤代 :卤代烃的水解 :CH3CH2Br+NaOH CH3CH2OH+NaBr皂化反应 :+3NaOH3C17H35COONa+酯化反应 : +CH OH +H O2 5 2糖类的水解 :C12H22O11+HOC6H12O6+C6H12O6蔗糖果糖葡萄糖2二肽的水解 :+H2O苯环上的卤代 :+Cl 2+HCl苯环上的硝化 :++H2O苯环上的磺化 :++H2O( 续表 )重要的有机反应烯烃的加成 :+HCl炔烃的加成 :+H2O苯环的加氢 :+3H2醇分子内脱水生成烯烃:C 2H5OH+H2O消去反应卤代烃脱 HX生成烯烃 :CH3CH2Br+NaOH+NaBr+H2O 单烯烃的加聚 :n加聚反应缩聚反应缩聚反应共轭二烯烃的加聚:( 此外 , 需要记住丁苯橡胶、氯丁橡胶的单体 )二元醇与二元酸之间的缩聚:n+nHOCH2CH2OH+2nH2O羟基酸之间的缩聚:+nH2 O氨基酸之间的缩聚:苯酚与 HCHO的缩聚 :n+nHCHO+nH2O氧化催化氧化 :2CH3 CH2OH+O22CH3CHO+2HO反应醛基与银氨溶液的反应:CH3CHO+2[Ag(NH3) 2 ]OH CH3COONH4+2Ag↓+3NH+H2O(注意配平 )醛基与新制氢氧化铜的反应:CH3CHO+2Cu(OH)+NaOH CH3COONa+Cu2↓ +3H2O醛基加氢 :CH3CHO+H2CH3CH2OH还原反应硝基还原为氨基:。
初中化学物质转化关系图
↗ Na2SO4 → BaSO4↓(白)
NaOH → Na2CO3 → CaCO3↓(白)
(变质)
↘ NaCl → AgCl↓(白)
4、含钙化合物的关系:
↙↗――――― ――↘↖ CaCO3→CaO→Ca(OH)2→CaCl2
↖ CO2 ↙
-可编辑-
精品教育
5、氧化钡、氢氧化钡与硫酸钡
↗BaCl2 → BaSO4↓(白)
精品教育
一、初中化学物质的转化关系
1、氧气、氧化物、酸、氢气、水
H2O
KMnO4↘ ↓↑ ↗CO、CO2
↗SO2
H2Sቤተ መጻሕፍቲ ባይዱ4
H2O2 → O2
→P2O5
H2O
↘MgO
HCl
KClO3↗ ↓ Fe3O4
↘Al2O3
2、碳与碳的化合物
+ Mg Al Zn Fe→ H2→
3、氢氧化钠、碳酸钠、氯化钠
+ CO2
BaO → Ba(OH)2
↗
↘ + CuSO4
↘Cu(OH)2↓(蓝)
6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵
CuO ↙↘ CuSO4.5H2O→CuSO4→ Cu
↗ CO2 Ca(HCO3)2 → CaCO3→CaO
↘ H2O
↗Na2CO3 NaHCO3 →CO2
↘H2O →
H2CO3
↗ NH3 → NH3.H2O NH4HCO3 → H2O
-可编辑-
精品教育
Fe Al
↙ FeCl3 ↖
Fe(OH)3
Fe2O3
↖Fe2(SO4)3↙
C CO H2 Mg Al
←――――→
O2 H2O
知识总结物质间的相互转化
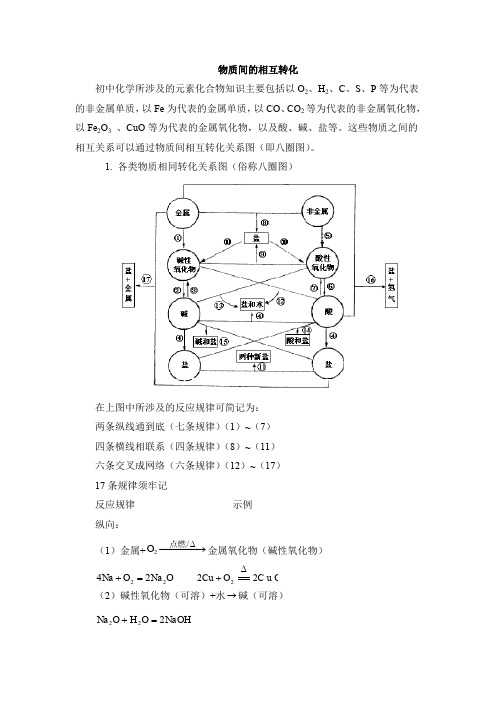
物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为:两条纵线通到底(七条规律)(1)~(7)四条横线相联系(四条规律)(8)~(11)六条交叉成网络(六条规律)(12)~(17)17条规律须牢记反应规律示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ C u O O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水 O H PO Na PO H NaOH 2434333+=+O H C u S O SO H OH Cu 244222)(+=+ (5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+ (6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232S i O O H S i O H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐 32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H(15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用:(1)可知某物质的性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见物质间的转化6、铝和铝的化合物7、钙的化合物间的转化关系8、九种碱之间的转化物质的转化参考答案1、铁和铁的化合物之间的转化关系① 3Fe + 2O23O4② Fe 3O 42 或Fe 3O 4 + 4H 22O 或Fe 3O 42↑*③ 4Fe + 3O 2 + xH 2O 2Fe 2O 3?xH 2O④ Fe 2O 32 或Fe 2O 3 + 3H 22O 或2Fe 2O 32↑ ⑤ Fe 2O 3 + 6HCl 2FeCl 3 + 3H 2O ⑥ Fe 2O 3 + 3H 2SO 4 Fe 2(SO 4)3 + 3H 2O ⑦ Fe 2(SO 4)3 + 6NaOH 2Fe(OH)3↓ + 3Na 2SO 4 ⑧ 2Fe(OH)3 + 3H 2SO 4 Fe 2(SO 4)3 + 6H 2O ⑨ Fe(OH)3 + 3HCl FeCl 3 + 3H 2O ⑩ FeCl 3 + 3NaOH 2Fe(OH)3 ↓ + 3NaCl32O 3 + 3H 2O Fe + 2HCl FeCl 2 + H 2↑ 2 + Zn Fe + ZnCl 2 或 3FeCl 2 + 2Al 3Fe + 2AlCl 3 或FeCl 2 + Mg Fe + MgCl 2 4 + Zn Fe + ZnSO 4 或 3FeSO 4 + 2Al 3Fe + Al 2(SO 4)3 或FeSO 4 + Mg Fe + MgSO 4 2SO 4 FeSO 4 + H 2↑ 2SO 4 FeSO 4 + H 2O FeO + 2HCl FeCl 2 + H 2O2 + 2NaOH Fe(OH)2↓ + 2NaCl 2 + 2HCl FeCl 2 + H 2O 4 + 2NaOH Fe(OH)2↓ + Na 2SO 4 2 + H 2SO 4FeSO 4 + 2H 2O 22O 2 或FeO + H 22O或2↑2、四种酸之间的转化 ① C + O 22 或2↑或3C + 2Fe 2O 32↑ ② 2C + O 2 ③ 2CO + O 22 或2 或3CO + Fe 2O 32 ④ CO 2 ⑤ CO 2 + H 2O H 2CO 3 ⑥ H 2CO 3 CO 2↑ + H 2O ⑦ 2H 22↑ +O 2↑ ⑧ 2H 2 +O 22O 或 H 22O 或 3H 2 + Fe 2O 32O *⑨ H 2 +Cl 2⑩ 6HCl + 2Al 2AlCl 3 + 3H 2↑ 或2HCl + Mg MgCl 2 + H 2↑ 或2HCl + Fe FeCl 2 + H 2↑ 或2HCl + ZnMgCl 2 + H 2↑2CO 3 2NaCl + CO 2↑ + H 2O 或2HCl + CaCO 3 CaCl 2 + CO 2↑ + H 2O 3 AgCl + HNO 33 + Na 2CO 3 2NaNO 3 + CO 2↑ + H 2O 或2HNO 3 + CaCO 3 Ca(NO 3)2 + CO 2↑ + H 2O 2SO4 + BaCl 2 BaSO 4 + 2HCl2SO 4 + Na 2CO 3Na 2SO 4 + CO 2↑ + H 2O2SO 4 + Ba(NO 3)2 BaSO 4↓ + 2HNO 3SO 3 + H 2O H 2SO 4 2SO 2 + O 23S + O 222 + H 2O H 2SO3 2SO 3 + O 2 2H 2SO 43、氧气的实验室制取和氧气的性质 ① 2H 2O 22O + O 2↑② 2KMnO 42MnO 4 + MnO 2 + O 2↑ ③ 2KClO 32↑ ④ 2C + O 2 ⑤ C + O 22 ⑥ S + O 22 ⑦ 4P + 5O 22O 5 ⑧ 2H 22↑ +O 2↑ ⑨ 2H 2 +O 22O ⑩ 3Fe + 2O 23O 42 2Al 2O3 (铝不易锈蚀的原因) 2 24、铜和铜的化合物 ① 2Cu + O 2 ② 2 或CuO + H 22O 或2↑ ③CuSO 4 + Fe Cu + FeSO 4 或CuSO 4 + Zn Cu + ZnSO 4 或CuSO 4 + Mg Cu +MgSO 4 或3CuSO 4 + 2Al3Cu + Al 2(SO 4)3④ CuCl 2 + Fe Cu + FeCl 2 或CuCl 2 + Zn Cu + ZnCl 2 或Cu Cl 2 + Mg Cu +Mg Cl 2 或3Cu Cl 2 + 2Al3Cu + 2Al Cl 3⑤ CuO + 2HCl CuCl 2 + H 2O ⑥ CuO + H 2SO 4CuSO 4 + H 2O⑦ Cu(OH)2 + H 2SO 4 CuSO 4 + 2H 2O ⑧ CuSO 4 + 2NaOH Cu(OH)2↓ + Na 2SO 4 或CuSO 4 + 2KOH Cu(OH)2↓ + K 2SO 4 或CuSO 4 + Ba(OH)2 Cu(OH)2↓ + BaSO 4↓*⑨ Cu(OH)22O⑩ Cu(O H)2 + 2HCl CuCl 2 + 2H 2O 2 + 2NaOH Cu(OH)2↓ + 2NaCl 或CuCl 2 + 2KOH Cu(OH)2↓ + 2KCl 或CuCl 2 + Ba(OH)2 Cu(OH)2↓ + BaCl 2 或CuCl 2 + Ca(OH)2 Cu(OH)2↓ + CaCl 25、镁和镁的化合物 ① 2Mg + O 2 ② Mg + HCl MgCl 2 + H 2 ↑ 或Mg + CuCl 2 MgCl 2 + Cu 或Mg + FeCl 2 MgCl 2 + Fe 或Mg + ZnCl 2 MgCl 2 + Zn 或3Mg + 2AlCl 3 3MgCl 2 + 2Al ③ Mg + H 2SO 4 MgSO 4 + H 2 或Mg + CuSO 4 MgSO 4 + Cu 或Mg + FeSO 4 MgSO 4 + Fe 或Mg + ZnSO 4MgSO 4+ Zn或3Mg + Al 2(SO 4)3 3MgSO 4 + 2Al ④ MgO + H 2SO 4 MgSO 4 + H 2O ⑤ MgO + 2HClMgCl 2 + H 2O⑥ MgCl 2 + 2NaOH Mg(OH)2↓ + 2NaCl 或MgCl 2 + 2KOH Mg(OH)2↓ + 2KCl 或MgCl 2 + Ba(OH)2 Mg(OH)2↓ + BaCl 2 或MgCl 2 + Ca(OH)2 Mg(OH)2↓ + CaCl 2 ⑦ Mg(OH)2 + 2HClMgCl 2 + 2H 2O*⑧ Mg(OH)22O⑨ Mg(OH)2 + H 2SO 4 MgSO 4 + 2H 2O ⑩ MgSO 4 + 2NaOH Mg(OH)2↓ + Na 2SO 4 或MgSO 4 + 2KOH Mg(OH)2↓ + K 2SO 4 或MgSO 4 + Ba(OH)2 Mg(OH)2↓ + BaSO 4↓六、铝和铝的化合物 ① 4Al + 3O 2 2Al 2O 3 (铝不易锈蚀的原因) ② 2Al + 6HCl 2AlCl 3 + 3H 2 ↑ 或2Al + 3CuCl 2 2AlCl 3 + 3Cu 或2Al + 3FeCl 2 2AlCl 3 +3Fe 或2Al + 3ZnCl 2 2AlCl 3 +3Zn ③ 2Al + 3H 2SO 4 Al 2(SO 4)3 + 3H 2 ↑ 或2Al + 3CuSO 4 Al 2(SO 4)3 + 3Cu 或2Al + 3FeSO 4 Al 2(SO 4)3 +3Fe 或2Al + 3ZnSO 4 Al 2(SO 4)3 +3Zn ④ Al 2O 3 + 3H 2SO 4 Al 2(SO 4)3 + 3H 2O ⑤ Al 2O 3 + 6HCl 2AlCl 3 + 3H 2O ⑥ AlCl 3 + 3NaOH Al(OH)3↓ + 3NaCl 或AlCl 3 + 3KOH Al(OH)3↓ + 3KCl或2AlCl 3+ 3Ba(OH)2 2Al(OH)3↓ + 3BaCl 2 或2AlCl 3 + 3Ca(OH)2 2Al(OH)3↓ + 3CaCl 2 ⑦ Al(OH)3 + 3HCl AlCl 3 + 3H 2O*⑧ 2Al(OH)32O 3 + 3H 2O⑨2Al(OH)3 +3H 2SO 4 Al 2(SO 4)3 + 6H 2O⑩Al 2(SO 4)3 + 6NaOH2Al(OH)3↓ + 3Na 2SO 4 或Al 2(SO 4)3 + 6KOH 2Al(OH)3↓ + 3K 2SO 4 或Al 2(SO 4)3+ 3Ba(OH)2 2Al(OH)3↓ + 3BaSO 4↓七、钙的化合物间的转化 2↑② CaO + H 2OCa(OH)2③ Ca(OH)2 + CO 2 CaCO 3↓ + H 2O 或Ca(OH)2 + Na 2CO 3 CaCO 3↓ + 2NaOH 或Ca(OH)2 + K 2CO 3CaCO 3↓ + 2KOH或Ca(OH)2 + (NH 4)2CO 3 CaCO 3↓ + 2H 2O + 2NH 3↑④ CaCl 2 + Na 2CO 3 CaCO 3↓ + 2NaCl 或CaCl 2 + K 2CO 3 CaCO 3↓ + 2KCl或CaCl 2 + (NH 4)2CO 3 CaCO 3↓ + 2NH 4Cl ⑤ CaCO 3 + 2HCl CaCl 2 + H 2O + CO 2↑ ⑥ Ca(OH)2 + 2HCl CaCl 2 + 2H 2O 或Ca(OH)2 + CuCl 2 CaCl 2 + Cu(OH)2↓ 或3Ca(OH)2 + 2FeCl 3 3CaCl 2 + 2Fe(OH)3↓ 或Ca(OH)2 + MgCl 2 CaCl 2 + Mg(OH)2↓ 或3Ca(OH)2 + 2AlCl 3 3CaCl 2 + 2Al(OH)3↓⑦ CaO + 2HCl CaCl 2 + H 2O八、九种碱之间的转化 ①Ba(OH)2 + K 2CO 3 BaSO 3↓ + 2KOH 或Ba(OH)2 + K 2SO 4 BaSO 4↓ + 2KOH ②Ca(OH)2 + K 2CO 3 CaCO 3↓ + 2KOH ③ Ba(OH)2 + Na 2SO 4 BaSO 4↓ + 2NaOH 或Ba(OH)2 + Na 2CO 3 BaCO 3↓ + 2NaOH ④ Ca(OH)2 + Na 2CO 3 CaCO 3↓ + 2NaOH ⑤ 2NaOH + CuCl 2 Cu(OH)2↓ + 2NaCl 或2NaOH + CuSO 4 Cu(OH)2↓ + Na 2SO 4 或2NaOH + Cu(NO 3)2Cu(OH)2↓ + 2NaNO 3⑥ 3NaOH + FeCl 3Fe(OH)3↓ + 3NaCl或6NaOH + Fe 2(SO 4)3 2Fe(OH)3↓ + 3Na 2SO 4 或3NaOH + Fe(NO 3)3Fe(OH)3↓ + 3NaNO 3 ⑦ 3NaOH + AlCl 3 Al(OH)3↓ + 3NaCl 或6NaOH +Al 2(SO 4)3 2Al(OH)3↓ + 3Na 2SO 4 或3NaOH + Al(NO 3)3 Al(OH)3↓ + 3NaNO 3 ⑧ 2NaOH + MgCl 2Mg(OH)2↓ + 2NaCl或2NaOH + MgSO 4Mg(OH)2↓ + Na 2SO 4 或2NaOH + Mg(NO 3)2 Mg(OH)2↓ + 2NaNO 3 ⑨Ba(OH)2 + (NH 4)2SO 4 BaSO 4↓ + 2NH 3↑ + 2H 2O 或Ba(OH)2 + (NH 4)2CO 3 BaCO 3↓ + 2NH 3↑ + 2H 2O 或Ba(OH)2 + 2NH 4Cl BaCl 2 + 2NH 3↑ + 2H 2O 或Ba(OH)2 + 2NH 4NO 3 Ba(NO 3)2 + 2NH 3↑ + 2H 2O ⑩2NaOH + (NH 4)2SO 4 Na 2SO 4 + 2NH 3↑ + 2H 2O 或2NaOH + (NH 4)2CO 3 Na 2CO 3 + 2NH 3↑ + 2H 2O或NaOH + NH 4Cl NaCl + NH 3↑ + H 2O 或NaOH + NH 4NO 3 NaNO 3 + NH 3↑ + H 2O 2 + (NH 4)2SO 4 CaSO 4 + 2NH 3↑ + 2H 2O 或Ca(OH)2 + (NH 4)2CO 3 CaCO 3↓ + 2NH 3↑ + 2H 2O 或Ca(OH)2 + 2NH 4Cl CaCl 2 + 2NH 3↑ + 2H 2O 或Ca(OH)2 + 2NH 4NO 3 Ca(NO 3)2 + 2NH 3↑ + 2H 2O 4)2SO 4 K 2SO 4 + 2NH 3↑ + 2H 2O 或2KOH + (NH 4)2CO 3 K 2CO 3 + 2NH 3↑ + 2H 2O或KOH + NH 4Cl KCl + NH 3↑ + H 2O 或KOH + NH 4NO 3 KNO 3 + NH 3↑ + H 2O? ? ? ? ?。
