物质转化关系图
物质转化关系图
高温
H2O+CO2
MgO
H2O ( 反 应
沸 Mg(OH)2
慢加)热
2、 2、C
Mg2N3
加水水解
铝及其化合物
HCl
Al
O2
NaOH
AlCl3
HCl
HCl
Al2O3
△
NaOH NaAlO2
NaOH
Al(OH)3
5. 铁及其化合物
Fe3O4
O2 F e
HCl O Fe2O
3
HCl FeC Cl2 F
物质转化关系图
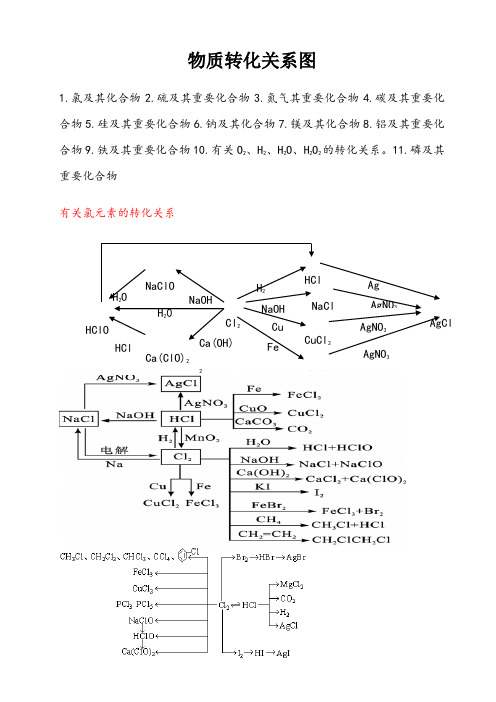
1.氯及其化合物 2.硫及其重要化合物 3.氮气其重要化合物 4.碳及其重要化 合物 5.硅及其重要化合物 6.钠及其化合物 7.镁及其化合物 8.铝及其重要化 合物 9.铁及其重要化合物 10.有关 O2、H2、H2O、H2O2 的转化关系。11.磷及其 重要化合物
有关氯元素的转化关系
HCl lF2eC e
l△3
NaOH HC H2O Hl Cl
Fe(OH H2O O2
F)e2 (OH
)3
10.有关 O2、H2、H2O、H2O2 的转化关系。
11.磷及其重要化合物
H20
Cu
Na2SO3 H2SO4
HClO3
2. 氮气其重要化合物
NH4HCO3
O2
NaOH
△ NH3 H2
放
NO O2
H2O
N2
电
HC Ca(OH)2
O2
lNH4Cl
Cu NO2 H20 HNO3
Cu
3. 碳及其重要化合物
硅及其重要化合物
SiCl4
CaSiO3
Cl H2
九级化学物质转化关系图

一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡1 / 32 /3 ↗BaCl 2 → BaSO 4↓(白)BaO → Ba(OH)2 ↗↘ + CuS O 4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO 2↙ ↘ Ca(HCO 3)2 → CaCO 3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2O NaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 2 8、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2CaCO 3 ⑸ ⑹ ⑺ ⑻CaCO3Na2CO3CO2CO2NaOHNa2CO3CO2O2H2ONaOH NH4ClNH3⑼⑽⑾⑿3 / 3。
高中化学 常见物质的相互转化思维导图

物质的相互转化和制备主要是指以氧气、氢气、碳、硫、磷等为代表的非金属单质,以铝、镁、锌、铁、铜为代表的金属单质,以一氧化碳、二氧化碳等为代表的非金属氧化物,以氧化铜、氧化铁等为代表的金属氧化物,以盐酸、硫酸、碳酸等为代表的酸,以氢氧化钠、氢氧化钙等为代表的碱,以氯化钠、碳酸钠、碳酸氢钠、碳酸钙等为代表的盐,等等物质之间的相互和制备.各类物质间的转化关系:(1)金属+金属氧化物(碱性氧化物)(2)碱性氧化物(可溶)+水碱(可溶)(3)碱(难溶)碱氧(难溶)+水(4)酸+碱盐+水;(5)非金属+非金属氧化物(酸性氧化物)(6)酸性氧化物(易溶)+水酸(易溶)(7)酸(易挥发/难溶)酸氧+水(易挥发/难溶)从纵向来看,金属碱性氧化物碱盐,其中金属元素相同。
非金属酸性氧化物酸(含氧酸)盐,其中非金属元素相同。
横向:(8)金属+非金属(无氧酸)盐(9)碱氧+酸氧(含氧酸)盐(10)含氧酸盐碱氧+酸氧(11)盐+盐两种新盐交叉:(12)酸+碱氧盐+水(13)碱+酸氧盐+水(14)酸+盐新酸+新盐;(15)碱+盐新碱+新盐(16)金属+酸盐+(17)金属+盐新盐+新金属(18)金属+盐新盐+新金属(置换反应)氢氧化钠与氢氧化钙的制备:(1)NaOH的制备方法一:Na2O+H2O==2NaOH方法二:Na2CO3+Ca(OH)2==CaCO3↓ +2NaOH (2)Ca(OH)2的制备方法:CaO+H2O==Ca(OH)2常见物质的相互转化:Na→Na2O→NaOH→Na2CO3C→CO→CO2→H2CO3Fe→Fe2O3→Fe2(SO4)3→Fe(OH)3→FeCl3S→SO2→SO3→H2SO4(单质硫不能直接转化为SO3)。
各类物质相同转化关系图
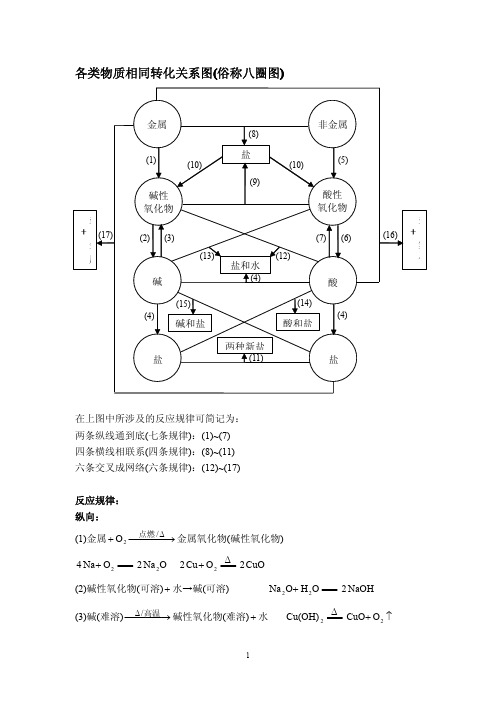
各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为:两条纵线通到底(七条规律):(1)~(7)四条横线相联系(四条规律):(8)~(11)六条交叉成网络(六条规律):(12)~(17)反应规律:纵向:(1)金属金属氧化物(碱性氧化物)⎯⎯⎯→⎯+∆/2O 点燃====+2O Na 4ONa 22ΔO Cu 22====+CuO2(2)碱性氧化物(可溶)水→碱(可溶)+====+O H O Na 22NaOH2(3)碱(难溶)碱性氧化物(难溶)水⎯⎯⎯→⎯∆高温/+ΔCu(OH)2====↑+2O CuO(4)酸碱→盐水++====+43PO H NaOH 3OH 3PO Na 243+====+422SO H Cu(OH)OH 2CuSO 24+(5)非金属非金属氧化物(酸性氧化物)⎯⎯→⎯+ 2O2O C ====+2CO2O 5P 4====+52O P 2(6)酸性氧化物(易溶)水→酸(易溶)+====+O H CO 2232CO H ====+O H 3O P 25243PO H 2(7)酸(易挥发/难溶)→酸性氧化物水(易挥发/难溶)+====32CO H ↑+22CO O H ΔSiO H 32====22SiO O H +从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属非金属→(无氧酸)盐+2Cl Na 2====+NaCl 2(9)碱氧酸氧→(含氧酸)盐+2SiO CaO ====+3CaSiO (10)含氧酸盐→碱氧酸氧+3CaCO ====↑+2CO CaO (11)盐盐→两种新盐+====+3AgNO NaCl ↓+AgCl NaNO 3交叉:(12)酸碱氧→盐水++====+CuO SO H 42O H CuSO 24+(13)碱酸氧→盐水++====+2CO NaOH 2OH CO Na 232+(14)酸+盐→新酸新盐+====+3242CO Na SO H 3242CO H SO Na +====32CO H ↑+22CO O H (15)碱盐→新碱新盐++====+4CuSO NaOH 2↓+242Cu(OH)SO Na (16)金属酸→盐+↑+2H ====+) (SO H Zn 42↑+24H ZnSO (17)金属盐→新盐新金属++====+4CuSO Zn 4ZnSO Cu +以上十七条规律的应用:(1)可知某物质的性质。
初中化学常见物质转化关系
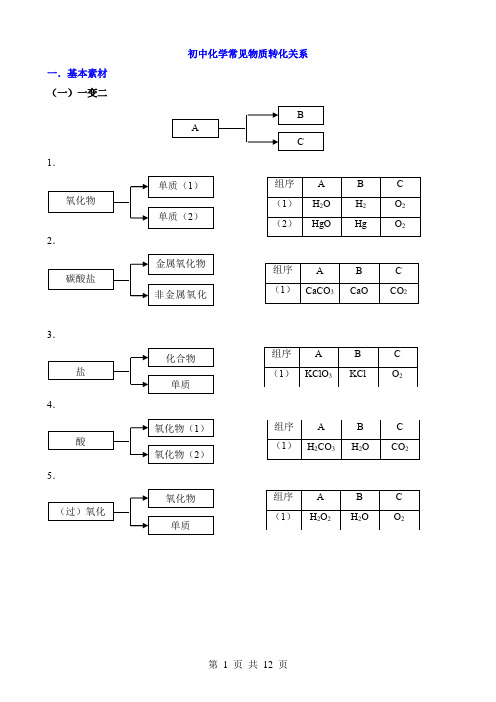
初中化学常见物质转化关系
一.基本素材 (一)一变二
1.
2.
3.
4.
5.
1.
2.
3.
4.
1.置换类
2.还原类
3.氧化类
4.氧化物、酸碱盐类
二.特定素材 (一)直线型互变
1.直线型“两点”互变(含同元素)
(1) (2
) (3)
(4)
(5) (6)
(7)
(8)
2.直线型“三点”互变
(1 (2
(3
(4
三.试题常用框图素材 (一)同元素变化 1.循环类三角形变化
2.指向类三角形变化
3.指向返回类三角型变化
4.循环返回类三角型变化
(二)异元素变化 指向型三角形变化
(三)四边形类变化 1.殊途同归
2. 循环
(四)杂类 1.一变三
2.“二”变“三”
3.二变三
四.六个“核心”变化
O 2、H 2 、H 2O 、CO 2、CO 和Na 2CO 3等六种物质,在中考推断题中是不可缺少的命题“元素”,相关变化列举如下。
(一).二氧化碳的变化
(二).水的变化
(三).氧气的变化
(四).一氧化碳的变化
(五).氢气的变化
(六).碳酸钠的变化。
酸碱盐物质转化关系图
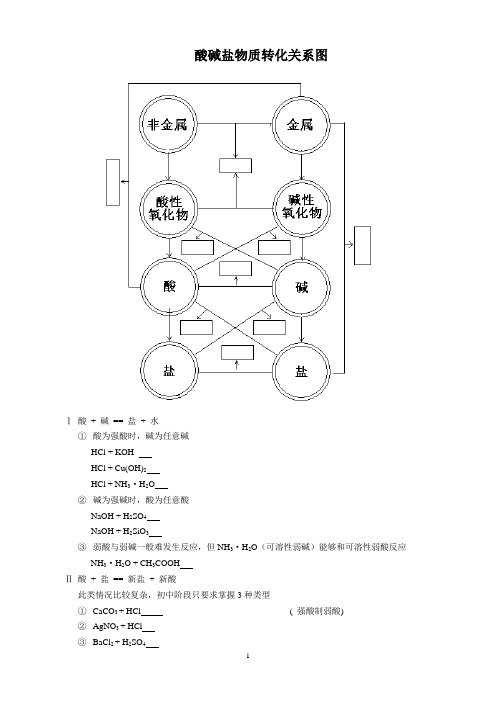
酸碱盐物质转化关系图
Ⅰ酸+ 碱== 盐+ 水
①酸为强酸时,碱为任意碱
HCl + KOH
HCl + Cu(OH)2
HCl + NH3·H2O
②碱为强碱时,酸为任意酸
NaOH + H2SO4
NaOH + H2SiO3
③弱酸与弱碱一般难发生反应,但NH3·H2O(可溶性弱碱)能够和可溶性弱酸反应
NH3·H2O + CH3COOH
Ⅱ酸+ 盐== 新盐+ 新酸
此类情况比较复杂,初中阶段只要求掌握3种类型
①CaCO3 + HCl ( 强酸制弱酸)
②AgNO3 + HCl
③BaCl2 + H2SO4
Ⅲ碱+ 盐== 新盐+ 新碱
反应条件:反应物均能溶于水,产物应有沉淀或气体生成
①NaOH + CuSO4
②NaOH + NH4Cl
Ⅳ盐+ 盐== 新盐+ 新盐
反应条件:反应物均能溶于水,产物至少有一种沉淀
①AgNO3 + NaCl
②BaCl2 + CuSO4
酸、碱、盐、氧化物、单质之间的转化关系
例:用七种方法制取MgCl2
Ⅰ.Mg + Cl2 ==== MgCl2①
Ⅱ.MgO + HCl ==== MgCl2 + H2O ②
Ⅲ.Mg(OH)2 +2HCl ==== MgCl2 +2H2O ④
Ⅳ.MgCO3+2HCl === MgCl2 +H2O+CO2↑⑥
Ⅴ.MgSO4 + BaCl2 === MgCl2 + BaSO4↓⑦
Ⅵ.Mg + CuCl2 ==== MgCl2 + Cu ⑧
Ⅶ.Mg + 2HCl ==== MgCl2 + H2↑⑨。
高三有机化学中有机物间相互转化关系图

一、有机物间相互转化关系二、能与溴水发生化学反响而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃〔烯烃、炔烃、二烯烃等〕⑵ 不饱和烃的衍生物〔烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等〕 ⑶ 石油产品〔裂化气、裂解气、裂化汽油等〕⑷ 含醛基的化合物〔醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等〕 ⑸ 天然橡胶〔聚异戊二烯〕 2、无机物:⑴ -2价的S 〔硫化氢及硫化物〕⑵ + 4价的S 〔二氧化硫、亚硫酸及亚硫酸盐〕 ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3+ 2FeBr 3 6FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 3 2FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2 ⑷ Zn 、Mg 等单质 如⑸ -1价的I 〔氢碘酸及碘化物〕变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O变色Mg + Br 2 === MgBr 2 〔其中亦有Mg 与H +、Mg 与HBrO 的反响〕△HBrO + Na2CO3 = NaBrO + NaHCO3三、能萃取溴而使溴水褪色的物质上层变无色的〔ρ>1〕:卤代烃〔CCl4、氯仿、溴苯等〕、CS2等;下层变无色的〔ρ<1〕:直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃〔如己烷等〕等四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴不饱和烃〔烯烃、炔烃、二烯烃等〕⑵不饱和烃的衍生物〔烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等〕⑶石油产品〔裂化气、裂解气、裂化汽油等〕⑷醇类物质〔乙醇等〕⑸含醛基的化合物〔醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等〕⑹天然橡胶〔聚异戊二烯〕⑺苯的同系物2、无机物:⑴氢卤酸及卤化物〔氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物〕⑵ + 2价的Fe〔亚铁盐及氢氧化亚铁〕⑶-2价的S〔硫化氢及硫化物〕⑷ + 4价的S〔二氧化硫、亚硫酸及亚硫酸盐〕⑸ 双氧水〔H 2O 2〕五、常见的各类有机物的官能团,构造特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 构造特点:键角为109°28′,空间正四面体分子。
必修物质转化关系图及相应化学方程式

必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)1、4 Na + O 2 === 2 Na 2O2、2 Na +O 2△Na 2O 23、2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑)4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) *5、2Na 2O 2 +2H 2O === 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑) *6、2 Na 2O 2 + 2 CO 2 === 2 Na 2CO 3+O 27、2 NaOH + CO 2 === Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O ) 8、NaOH + HCl === NaCl +H 2O (OH — + H += H 2O)9、Na 2CO 3+2HCl =2NaCl +CO 2↑+H 2O (CO -23+ 2H + = CO 2↑ + H 2O )10、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H + = CO 2↑ + H 2O )11、Na 2CO 3+CO 2+H 2O= 2 NaHCO 3 (CO 32— + CO 2 + H 2O= 2 HCO 3—)12、NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO -3+OH - = CO -23 + H 2O )2 NaHCO 3△Na 2CO 3+CO 2↑+H 2ONa 2O Na ①NaCl NaHCO 3Na 2CO 3NaOH Na 2O 2② ③ ④ ⑤ ⑥⑦ ⑧ ⑨⑩ ⑾ ⑿二、非金属氯及其化合物的相互转化(括号内写离子方程式)1、H 2 + Cl 2 点燃2HCl 2、2Na + Cl 2点燃2NaCl3、Cu + Cl 2点燃CuCl 24、2Fe + 3Cl 2点燃2FeCl 35、HCl +AgNO 3 = AgCl↓+HNO 3 (Cl -+Ag +=Ag Cl↓)6、NaCl +AgNO 3 = AgCl↓+NaNO 3 (Cl -+Ag +=AgCl↓)7、CuCl 2+2AgNO 3 = 2AgCl↓+Cu(NO 3)2 (Cl -+Ag +=AgCl↓)8、FeCl 3+3AgNO 3 = 3AgCl↓+Fe(NO 3)3 (Cl -+Ag +=AgCl↓)9、Cl 2 + 2NaOH = NaCl + NaClO + H 2O (Cl 2 + 2OH - = Cl - + ClO - + H 2O) 10、2Cl 2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H 2O(Cl 2 + 2OH - = Cl - + ClO - + H 2O)11、Cl 2 + H 2O = HCl + HClO (Cl 2 + H 2O = H ++Cl -+ HClO) 12、NaClO +HCl = NaCl + HClO (ClO - +H += HClO)2NaClO+H 2O+CO 2= Na 2CO 3+ 2HClO (2ClO -+H 2O+CO 2= CO 32-+ 2HClO) 13、Ca(ClO) 2+2HCl = CaCl 2 + 2HClO (ClO - +H += HClO)Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (Ca 2++2ClO -+H 2O+CO 2=CaCO+ 2HClO)14、2HClO 2HCl+O 2↑NaCl 23AgCl⑤ ⑥ ⑦ ⑧光照三、金属铝及其重要化合物的相互转化(括号内写离子方程式)1.4Al +3O 2点燃2Al 2O 3 2.2 Al (OH )3△Al 2O 3 +3H 2O3.2Al +6HCl==2AlCl 3+3H 2↑ ( 2Al +6H +==2 Al 3++3H 2↑) 4.2Al +2NaOH +2H 2O==2NaAlO 2+3H 2↑ (2 Al +2OH -+2H 2O =2AlO 2-+3 H 2↑)5.Al 2O 3+6HCl =2AlCl 3+3H 2O ( Al 2O 3+6H +=2Al 3++3H 2O ) 6. Al 2O 3+2NaOH =2Na AlO 2+H 2O (Al 2O 3+2OH -=2 AlO 2-+H 2O )7、Al (OH )3+3HCl =AlCl 3+3H 2O ( Al (OH )3+3H + = Al 3++3H 2O )8、Al (OH )3+NaOH =NaAlO 2+2H 2O ( Al (OH )3+OH - = AlO 2-+2H 2O )9、实验制取Al (OH )3: AlCl 3+3NH 3·H 2O = Al (OH )3↓+3NH 4Cl (Al 3++3 NH 3·H 2O = Al (OH )3 ↓+ 3NH 4+ )AlAl (OH )3NaAlO 2Al 23AlCl 3①②③④ ⑤ ⑥⑦ ⑧四、金属铁及其化合物的相互转化(括号内写离子方程式)1、3Fe +2O2 点燃Fe3O42、Fe+2HCl=FeCl2+H2↑(Fe+2H+=Fe2++H2↑)Fe+CuCl2=FeCl2+Cu (Fe+Cu2+=Fe2++Cu)3、FeO+2HCl=FeCl2+H2O(FeO+2H+=Fe2++H2O)4、Fe2O3+6HCl=2 FeCl3+3H2O (Fe2O3+6H+=2Fe2++3H2O)5、FeCl2+2NaOH =Fe(OH)2↓+2NaCl (Fe2++2OH-=Fe(OH) 2)↓6、Fe(OH)2 + 2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O)7、FeCl3+3NaOH =Fe(OH)3↓+3NaCl ( Fe3++3OH-=Fe(OH) 3↓)8、Fe(OH) 3+3HCl=FeCl3+3H2O (Fe(OH) 3+3H+=Fe3++3H2O)9、2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2 Fe3++2Cl—)10、属于化合反应的:Fe+2FeCl3 =3FeCl2(Fe +2 Fe3+=3 Fe2+) 印刷腐蚀电路板:Cu+2FeCl3 =CuCl2+2FeCl2 (Cu+2 Fe3+=Cu2++2 Fe2+)11、2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3①Fe3O4②23⑾⑿。
常见无机物间的转化关系(19张PPT)

本章热点专题
常见无机物间的转化关系
2.三角型转化关系
(1)铁三角: (2)碳三角: (3)铝三角: (4)氯三角:
(5)硅三角:
人教版化学
本章热点专题
常见无机物间的转化关系
3.交叉型转化关系 (1)硫及其重要化合物间的转化:
(2)氮及其重要化合物间的转化:
(3)钠及其重要化合物间的转化:
人教版化学
般有两种考查方式:一是给出一定的转化关系,分析满足给定
转化关系的物质,一般以选择题形式考查;二是结合无机框图 推断题考查,一般作为框图的一部分,通常是解答该题的突破
口。
人教版化学
本章热点专题
常见无机物间的转化关系
D D 1.直线型连续转化关系 A――→B――→C
(1)氧化还原反应型 O2 O2 O2 ①NH3( 或 N2) ――→ NO ――→ NO2 或 NH3 ――→ O2 N2――→NO
[答案] C
人教版化学
本章热点专题
常见无机物间的转化关系
[例2] 选项 化合物 Y W
(2011· 福建高考)下表各选项中,不能利用 ( )
置换反应通过Y得到W的一组化合物是
A
CO2 MgO
B Fe2O3 Al2O3
C
C2H5OH C2H5ONa
D
FeCl3 CuCl2
人教版化学
本章热点专题
常见无机物间的转化关系
O2 O2 O2 O2 ②H2S(或 S)――→SO2――→SO3 或 H2S――→S――→ SO2 O2 O2 C C ③C――→CO――→CO2 或 O2――→CO2――→CO
人教版化学
本章热点专题
常见无机物间的转化关系
初中化学物质转化关系图
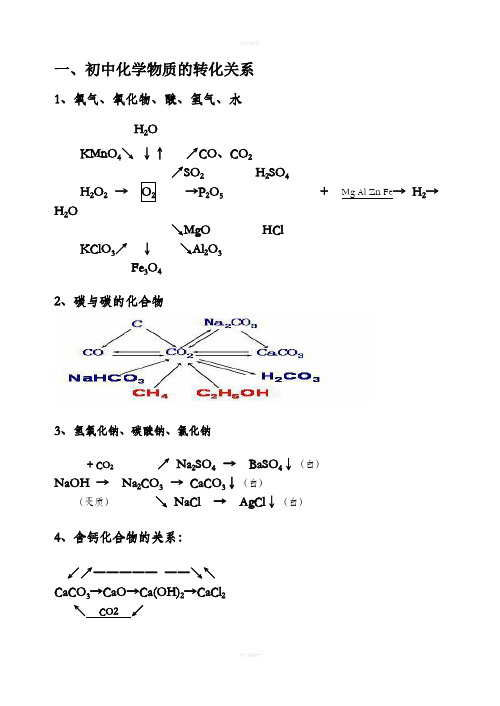
↗ Na2SO4 → BaSO4↓(白)
NaOH → Na2CO3 → CaCO3↓(白)
(变质)
↘ NaCl → AgCl↓(白)
4、含钙化合物的关系:
↙↗――――― ――↘↖ CaCO3→CaO→Ca(OH)2→CaCl2
↖ CO2 ↙
-可编辑-
精品教育
5、氧化钡、氢氧化钡与硫酸钡
↗BaCl2 → BaSO4↓(白)
精品教育
一、初中化学物质的转化关系
1、氧气、氧化物、酸、氢气、水
H2O
KMnO4↘ ↓↑ ↗CO、CO2
↗SO2
H2Sቤተ መጻሕፍቲ ባይዱ4
H2O2 → O2
→P2O5
H2O
↘MgO
HCl
KClO3↗ ↓ Fe3O4
↘Al2O3
2、碳与碳的化合物
+ Mg Al Zn Fe→ H2→
3、氢氧化钠、碳酸钠、氯化钠
+ CO2
BaO → Ba(OH)2
↗
↘ + CuSO4
↘Cu(OH)2↓(蓝)
6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵
CuO ↙↘ CuSO4.5H2O→CuSO4→ Cu
↗ CO2 Ca(HCO3)2 → CaCO3→CaO
↘ H2O
↗Na2CO3 NaHCO3 →CO2
↘H2O →
H2CO3
↗ NH3 → NH3.H2O NH4HCO3 → H2O
-可编辑-
精品教育
Fe Al
↙ FeCl3 ↖
Fe(OH)3
Fe2O3
↖Fe2(SO4)3↙
C CO H2 Mg Al
←――――→
O2 H2O
物质转化关系图

池 塘 水 域 物 质有 机 转 物 化的 关转 系化 图4
2004.03.26
——
池塘水域物质转化关系
池 塘 水 域 物 质 转 磷 化 的 转 关 化 系 图5
2004.03.26
——
池塘水域物质转化关系
池 塘 水 域 物 质 转 化 关 图6
2004.03.26
—— 氧 和 碳 酸 平 衡
池塘水域物质转化关系
池 塘 水 域 物 质硫 转与 化铁 的 关 转 系化 图2
2004.03.26
——
池塘水域物质转化关系
池 塘 水 域 物 质 转 化 关 系 图3
分泌 排泄
被摄食
光合作用
硝化 反硝化
2004.03.26
—— 生 物 间 的 转 化 及 影 响
池塘水域物质转化关系
硫化 反硫化 氨化 矿化 分泌絮凝
(2004/03/31)
2004.03.26 池塘水域物质转化关系
池塘水域物质转化关系图
——水化学总结
邢光敏
池塘水域物质转化关系总图
2004.03.26
池塘水域物质转化关系
池塘水域物质转化关系图 池塘水域物质转化关系图
2004.03.26
池塘水域物质转化关系图
池塘水域物质转化关系
池 塘 水 域 物 质 转 化 关 系 图1
2004.03.26
—— 氮 的 转 化 关 系
池塘水域物质转化关系
池 塘 水 域 物 质 转 化 关 系 图7
碱 度 盐 度 和 其 他 主 要 离 2004.03.26子
——
池塘水域物质转化关系
2004.03.26
池塘水域物质转化关系
水 质 评毒 价性 试 验 水 质 标 准 和
2020年初中常见物质的转化关系框图

或 Ca(OH) 2 + (NH 4)2CO 3
CaCO3↓+ 2H 2O + 2NH 3↑
④ CaCl 2 + Na2CO 3
CaCO3↓ + 2NaCl
六、铝和铝的化合物
或 CaCl 2 + K 2CO 3
CaCO3↓ + K2 Cl
① 4Al + 3O 2
2Al 2O3 (铝不易锈蚀的原因 )
八、九种碱之间的转化
① Ba(OH) 2 + K 2CO 3
Al(OH) 3↓ +3KCl
或 2AlCl 3+ 3Ba(OH) 2
2Al(OH) 3↓ +3BaCl 2
或 2AlCl 3 + 3Ca(OH) 2
2Al(OH) 3↓ +3CaCl2
⑦ Al(OH) 3 + 3HCl
AlCl 3 + 3H 2O
* ⑧ 2Al(OH) 3
Al 2O3 + 3H 2O
MgSO 4 + Cu
或 Mg + FeSO 4
MgSO 4 + Fe
或 Mg + ZnSO 4
MgSO 4+ Zn
或 3Mg + Al 2 (SO4)3
3MgSO 4+ 2Al
④ MgO + H 2SO4
MgSO 4 + H 2O
⑨ 2Al(OH) 3 +3H 2SO4
Al 2(SO4)3 + 6H 2O
CaCl 2 + H 2O
或 2Al + 3ZnSO 4 ④ Al 2O3 + 3H 2SO4
高三有机化学中有机物间相互转化关系图
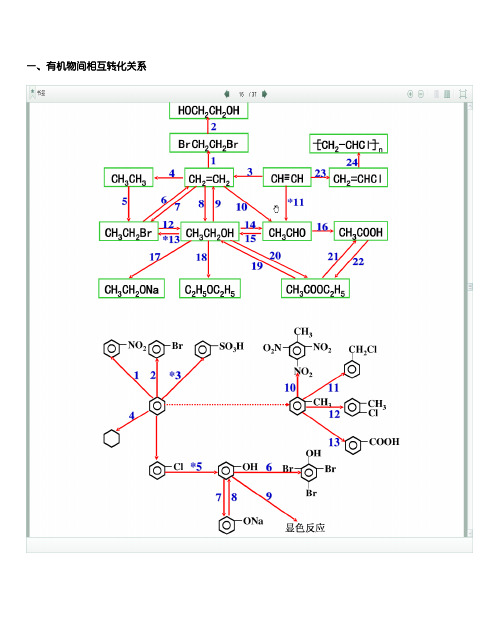
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应) △2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4 B) 结构特点:键角为109°28′,空间正四面体分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质转化关系图
1.氯及其化合物
2.硫及其重要化合物
3.氮气其重要化合物
4.碳及其重要化合物
5.硅及其重要化合物
6.钠及其化合物
7.镁及其化合物
8.铝及其重要化合物
9.铁及其重要化合物10.有关O2、H2、H2O、H2O2的转化关系。
11.磷及其重要化合物
有关氯元素的转化关系
NaClO
HClO
Cl2
HCl
NaCl
CuCl2
FeCl3
Ca(ClO)2
AgCl
H
2
NaOH
Cu
Fe
Ag
AgNO
3
AgNO
3
AgNO
3
H20
NaOH
Ca(OH)
2
HCl
H2O
光照
S SO 2
Na2SO3
Na2SO4
H2SO4
SO 3
H2SO3
O
2
O
2
H
2
H
2
Cu
HClO
3
NaOH NaOH Na2SO3
NH3N
2
NO NO2HNO3 NH4HCO3
NH3.H2O
4
放
电
O
2
H
2
H
2
O
2
Ca(OH)
2
HCl
△
H
2
O
NaOH
Cu
Cu
O
2
3.碳及其重要化合物
硅及其重要化合物4.钠及其化合物
Na
Na2O2NaOH Na2CO3NaHCO3
NaCl
Na2O
Si SiO2Na2SiO3H2SiO3
CaSiO3
SiF4
C
O2
CaCO3
HF
NaOH HCl
H2
SiCl4
Cl2
镁及其化合物
铝及其化合物
Mg
MgCl2
MgO
MgCO3Mg(HCO3)2
Mg(OH)2
Mg2N3
Cl2 HCl CuCl2
HCl
电解熔态
O2 CO2(点燃)
加水水解
N2(点燃)
H2O(反应慢)
加热
高温H2O+CO2
1、水中煮沸
Al Al(OH)3
NaAlO2
Al23
AlCl3
O
2△
HCl
NaOH
HCl
NaOH
HCl
NaOH
5.铁及其化合物
10.有关O2、H2、H2O、H2O2的转化关系。
11.磷及其重要化合物
HCl
HCl
O2
H2O
Fe
Fe3O4
FeO
Fe2O3
FeCl2
FeCl3
Fe(OH)2
Fe(OH)3
Cl2Fe
△
HCl
NaOH
H2O O2
HCl。
