任务3 锰矿石中锰含量的测定
高氯酸氧化-硫酸亚铁铵滴定法测定锰矿石中锰的条件试验

酸, 3 滴二苯胺磺 酸钠 指示 剂( 5 g / L ) , 用标准溶液滴 值能够满足从低含量样品到高含量样 品的测定要求 , 所以选择溶样介质为( 1 + 3 ) 的盐酸和磷酸混合溶剂。 定值稳定的紫色 即为终点。
1 _ 2 分 析 步骤
2 . 2 氧化剂 用量 的选 择 实验氧化
快速
准确
锰 在 自然界 分 布 广 泛 , 几 乎 各种 矿 石 和 硅 酸盐 加热时不时摇动( 防止生成偏磷酸 ) 直至样品分解完 的岩 石 中均含 有 锰 。锰是 钢 铁 工 业 中不 可 缺 少 的原 全 , 在 电 炉上 趁 热 滴 加 3~5 mL 浓 硝 酸 破 坏有 机 物 , 料; 锰 是 一 种 极 强 的还 原 剂 , 它 可 以从 钢 水 中吸 收全 时 时摇动溶液 , 待试样完全溶 解后 , 在不断摇动下 ,
G B W0 7 2 6 3 锰矿石 , 考虑到样 品种类不 同, 基体成分 硫 酸 亚 铁铵 标 准 溶 液 C( F e ) 一 0 . 0 2 m o l / L : 称 取 复杂 , 本 实 验 条件 选 择 的溶 剂是 盐 酸 和磷 酸 的组合 ,
8 . 0 g 硫酸亚铁铵溶于 1 L 5 %( 体积 比) 的硫酸 中, 过 同时用浓硝酸辅助溶矿 , 本文 只讨论盐酸和磷酸用 量 对样 品 的影 响 , 实 验结 果见 表1 。 滤后使用 , 贮存于棕色瓶中。
部 的氧 , 使 钢 中没 有氧化铁 , 成为无孔 的钢 锭 。其 加入 8 ~1 O 滴高氯酸 , 继续加热至小气泡 冒完 , 液面 次, 锰也是一种极好 的去硫剂 , 它可以将钢水中全部 平静 , 立即取下 , 冷至 6 0℃左右 , 在摇动下 , 加2 0— 的硫去掉 , 钢 中加入少量锰 就可 以大大增高钢 的机 3 0 m L 水, 取下 , 流水 冷却 至室 温 。用 硫 酸亚铁 铵 械性能 , 如延性 、 展性 、 韧性以及抗磨损能力 。锰钢 、 0 . 0 2 m o l / L 的标液滴定至淡紫色 , 加人 4 滴5 g / L 二苯 锰铁 以及锰 与铜 、 铝、 镍、 钴 等制成 的各种合金和锰 胺磺酸钠指示剂 , 继续滴定至亮绿色为终点。 同批 的化合物在工业上用途极 大。二 氧化硅 、 硫、 磷、 砷 带空 白校正, 计算公式 : , Y T , 等都是有 害杂质。我 队在南疆 阿克 陶县托吾恰克锰  ̄ o ( Mn ) / l O J T 丽 ' " V T ×1 0 0 多金属矿成分复杂 , 锰含量分布不均 , 主要含有锰 、 式中, f T 为1 mL 标 准滴 定溶 液相 当于被测 元 素 的 硅、 磷 等元 素 , 为准确快速的分析其 中的锰 , 本文选
锰矿石中锰含量的测

一阶微商法
1
将V对△E/△V作图,可得 到一呈峰状曲线,曲线 最高点由实验点连线外 推得到,其对应的体积 为滴定终点时标准滴定 溶液所消耗的体积Vep。
2
此法确定终点较准确,但 是手续繁琐。
E E2 E1 V V2 V1
二阶微商法(作图法)
以Δ2E/ΔV 2对V绘制曲线,此曲线最高点与最低点连线与横坐标
任务3 锰矿石中锰含量的测定
知识目标
1
能力目标
电位滴定法、惰性金属电极、 电位滴定终点的确定方法
● 能够准确判断电位滴定 的终点。
● 能够利用电位滴定法测 定锰矿石中锰含量
2
课程引入
问题:锰含量是锰矿石的技术指标之一,那么该如何测定呢?
➢原子吸收光谱法 ➢电位分析法 ➢分光光度法
引入电位滴定法测定锰矿石中锰含量
的交点即为滴定终点体积。
2 E V 2
E V 2
V2
E V 1
V1
二阶微商法(计算法)
➢采用下面的方法计算滴定终点
Vep V ( a • V ) ab
V—二阶微商为a时标准滴定溶液的体积,mL; a-二阶微商为零前的二级微商值; b-二阶微商为零后的二级微商值; ⊿V—由二级微商为a至二级微商为b时所加标准滴定溶液的体积,mL。
1. 研究饮用水的国建标准,确定能用电化学分析法测定的项目; 2. 写出各分析项目的分析方案; 3. 进行分析测试,并根据测定过程中出现的问题,继续优化方案; 4. 对分析结果进行分析,写出检测报告。
参照国家标准,测定饮用水 中pH、F-、Fe2+含量
作业:
知识点讲解
电位滴定法
定义: 是根据滴定过程中指示电极电位的突跃来确定滴定终
任务三锰矿石中锰含量的测定知识目标
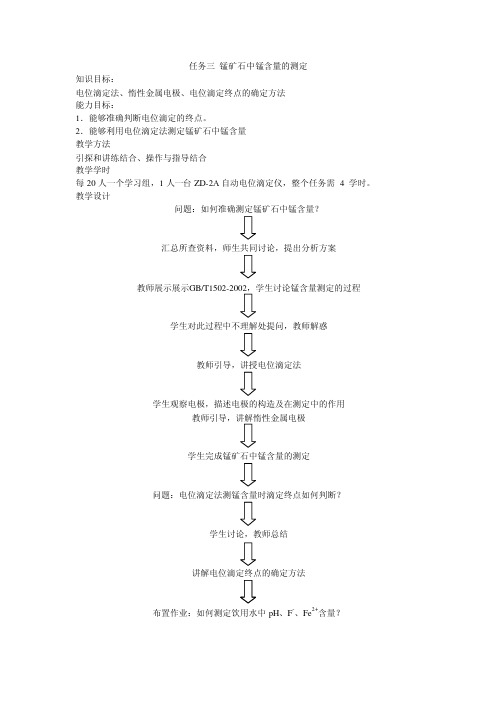
任务三锰矿石中锰含量的测定知识目标:电位滴定法、惰性金属电极、电位滴定终点的确定方法能力目标:1.能够准确判断电位滴定的终点。
2.能够利用电位滴定法测定锰矿石中锰含量教学方法引探和讲练结合、操作与指导结合教学学时每20人一个学习组,1人一台ZD-2A自动电位滴定仪,整个任务需 4 学时。
教学设计问题:如何准确测定锰矿石中锰含量?汇总所查资料,师生共同讨论,提出分析方案教师展示展示学生对此过程中不理解处提问,教师解惑教师引导,讲授电位滴定法学生观察电极,描述电极的构造及在测定中的作用学生完成锰矿石中锰含量的测定问题:电位滴定法测锰含量时滴定终点如何判断?学生讨论,教师总结讲解电位滴定终点的确定方法布置作业:如何测定饮用水中pH、F-、Fe2+含量?教案课程引入由问题引入教学:问题:锰含量是锰矿石的技术指标之一,那么该如何测定呢? 学生根据所查资料分组讨论并提出解决方案。
答案:原子吸收光谱法、电位分析法、分光光度法等。
比较优劣,引出本次课程的教学任务:“电位滴定法测定锰矿石中锰含量”展示GB/T1502-2002,学生分组讨论实验过程。
知识点讲解-1 Ø 电位滴定法 ² 定义:电位滴定法是利用滴定过程中指示电极电位的突跃来确定滴定终点的一种电化学容量分析方法。
² 比较电位滴定法与直接电位法和化学滴定法的区别 与化学滴定法的区别 定量参数不同 与直接电位法的区别确定滴定终点方法不同² 基本原理:开始滴定时,随着滴定剂的不断加入,待测离子与滴定剂之间发生化学反应,被测离子浓度发生相应的变化。
由于指示电极的电位与被测离子浓度有关,因此,指示电极的电位也相应发生变化。
在化学计量点附近,被测离子浓度发生突变,指示电极的电位也相应发生突变。
根据电池电动势的变化,可以判断滴定终点。
² 实验装置:指示电极:铂电极、参比电极:双液接甘汞电极、滴定管、酸度计、电磁搅拌器、搅拌子² 滴定方法:组装仪器装置后,将滴定剂装入滴定管,调节好零点,准确移取一定量试液于滴定池中,插入电极,开启电磁搅拌器和直流毫伏计,读取初始电动势(或pH )后开始滴定。
改进的硝酸铵氧化法测定锰矿石中锰含量

D O I : 1 0 . 1 6 2 0 6 / j . c n k i . 6 5 — 1 1 3 6 A g . 2 0 1 5 . 0 5 . 0 2 2
色 金 属
5 7
改进的硝酸铵氧化法测定锰矿石中锰含量
刘化 静
( 新疆 维吾 尔 自治 区有 色地 质勘 查局 7 0 4 队 哈密 8 3 9 0 0 0 )
,ห้องสมุดไป่ตู้
期, 并且获得了较高的测量精密度和准确度。
却8 ~ 1 0 后立 即加人 2 . 0 ~ 3 . 0 g 硝酸铵固体并不断摇
动, 使 二 价锰 完全 氧化 , 用 吸耳 球将 瓶 内黄 棕 色烟 吹 尽, 冷却至 6 0 ~ 7 0℃后 , 加入 4 0 m L( 5 + 9 5 ) H: S O , 充
p= ( 1 )
磷酸溶样 , 当加 热 至 液 面 平 静 且 磷 酸 烟 刚 起 时 是 硝 酸 铵 氧化 力 最 强之 时 , 磷 酸 是 三价 锰很 好 的稳定 剂 ,
5 8
新 疆 有 色 金 属
第5 期
锰 是 钢 铁 工 业 生 产 不 可 缺 少 的 原料 , 在 钢 中加
式 中: e 为重铬酸钾标准溶 的浓度 , m o l / L ;
2 0 . 0 0 为重 铬 酸钾 标 准溶 液 的体 积 , mL ; 5 4 . 9 4 为 锰 的 摩尔 质 量 , g /m 。 l ; V 为滴 定 所 消耗 硫 酸亚 铁 铵标 准
橙黄色消失 , 滴加 2滴 N 一 苯代邻氨基苯 甲酸指示剂 按G B / T 1 5 0 6 — 2 0 0 2中硫酸 溶样 进行 试验 , 结 果证 溶液 , 继 续 滴定 至亮 绿 色 即为 终 点 , 3份 溶 液 所 消 耗 明 , 由于硫 酸 冒烟 时 间计 时 的起 点 和放 置 时 间不 易 硫 酸亚铁 铵标 准滴定液 的极差值不超过 0 . 0 5 m L 取 掌 握 , 可 造成 分 析 结果 有 较 大误 差 。采 用 硝 酸 和磷 其平均值 。 酸 共 同溶 样 , 但 为 将 硝 酸 赶 尽 需 将 温 度 加 热 至 按 式( 1 ) 计算硫酸亚铁铵标准滴定液相当于锰 的 3 0 0℃, 但磷 酸 冒烟 温度 为 2 2 0℃左 右 , 这样 就 造成 焦 质量 浓度 ( g / m L) : 磷 酸 盐 的析 出 , 造 成结 果 偏 低 , 经试验表 明, 直 接用
EDTA配位滴定法测定锰矿石中锰含量

EDTA 配位滴定法测定锰矿石中锰含量一.实验原理在碱性溶液中,试样中的Mn 2+易被氧化成Mn 4+而形成MnO(OH)2 沉淀。
当溶液中有辅助配位剂(如三乙醇胺或酒石酸钾钠)存在时, 于碱性溶液中Mn 2+被空气氧化成Mn 3+而不生成沉淀。
在Fe 3+、Al 3+、TiO 2+、Mn 2+、Ca 2+、Mg 2+等离子共存的试样溶液中, 用EDTA 配位滴定Mn 2+的原理是: 在溶液中加入三乙醇胺掩蔽Fe 3+、Al 3+、TiO 2+;调整溶液pH 值, Mn 2+被空气氧化成Mn 3+, 并与三乙醇胺生成Mn 3+- TEA 绿色配合物;然后在pH=10 时加入足够量的氟化铵,使Ca 2+、Mg 2+生成相应的氟化物沉淀;再加盐酸羟胺将Mn 3+- TEA 配合物中的Mn 3+还原成Mn 2+,以K-B 为指示剂,用EDTA 标准滴定溶液进行滴定。
其反应式为: 2222Mn H Y MnY 2H +--++=+二、试剂:1、氟化铵溶液( 250g/L);2、三乙醇胺(1+2);量取300Ml 三乙醇胺,用水稀释至1000ML ,摇匀。
3、氨水(1+1);4、氨水-氯化铵缓冲溶液( pH=10);称取26.7克氯化铵,溶于水中,加36ML 氨水,稀释至1000ML 。
5、盐酸羟胺(100g/L);6、酸性铬蓝K- 萘酚绿B 混合指示剂7、EDTA 标准滴定溶液( 0.04mol /L)。
三、分析步骤:称取风干试样0.2000g(准确至0.0001g),于250ML 锥形瓶中,加1+9硫酸溶液10ML ,在低温下分解式样,至冒白烟为止,取下冷却,加蒸馏水150ML ,加入10ml 三乙醇胺( 1+2) , 用氨水( 1+1) 调整溶液pH 值至近10后, 加入25ml 氨—氯化铵缓冲溶液( pH=10) , 搅拌,加入35ml 氟化铵溶液( 250g/L) , 放置2~3min, 再加入10ML 盐酸羟胺(100g/L),搅拌使其溶解,加入适量的K-B 混合指示剂,溶液呈酒红色,立即用0.015mol /LEDTA 标准滴定溶液滴定至纯蓝色。
矿石中锰含量的测定

矿石中锰含量的测定好嘞,今天咱们聊聊矿石里那位“隐形大佬”——锰。
别看它藏在矿石里,名气不如铁、铜那么响亮,实际上它对工业的作用可大着呢。
你想啊,从不锈钢到电池,锰可都大显身手。
今天咱们就来谈谈怎么测定矿石中的锰含量,说起来,这事儿虽然不复杂,但要是你不小心,搞不好就像打麻将打成了个四暗刻,简直是麻烦事一大堆。
你得知道,矿石中锰的含量往往不是个明摆着的数字。
矿石里杂七杂八的东西多着呢,锰常常是隐藏在一堆矿物质里面,想要准确找出它的“真面目”,得靠一番技术手段。
而最常用的办法,就是那种酸性滴定法。
你可别小看了这滴定法,它可不是小孩子过家家的玩意儿,是有真本事的。
简单来说,就是通过反应酸和锰,然后滴一点滴一点地加,直到反应完成,就能看出锰含量有多少。
具体操作起来嘛,首先你得取一小块矿石,谁让你是一个矿石侦探呢,得小心翼翼地把它磨成粉。
磨粉这活儿,绝对是手工活儿,不能急,得耐得住性子。
毕竟一开始大家都没见过这么大个矿石,这一磨,那可就“化作灰烬”了。
磨好了粉末,你得把它放到烧杯里,加入一些酸,通常是硫酸,别问为什么,就是这酸比较适合把矿石里的锰分离出来。
酸放进去后,得小火慢慢加热,就像是做个慢炖锅的菜,千万不能急。
加热的同时,酸会和矿石中的锰发生反应,生成溶液。
这个时候,你需要的是一个叫做“氧化还原滴定”的方法。
想象一下,就像你拿着一个看不见的放大镜,聚焦在那滴滴答答的液体变化上。
当你开始滴加标准溶液,液体的颜色会发生变化,这就意味着反应差不多了。
直到颜色变到你想要的那一刻,你就可以把滴定量记录下来,接下来用公式算出锰的含量。
有些人可能会觉得,这样的操作是不是太麻烦了?其实不然,虽然步骤多,搞得像是科学实验室,但好处是,结果精准,锰含量一目了然。
说实话,矿石中锰的测定就像是你去买衣服,试了很多次,最后找到最合适的那一款。
看起来步骤繁琐,实际做起来,就是一个手艺活,讲究的是细心和耐心。
不过,话说回来,锰虽然对工业很重要,但也不能掉以轻心,咱们得防范那些高含量的锰矿石带来的潜在风险。
锰含量的测定实验报告

锰含量的测定实验报告
《锰含量的测定实验报告》
实验目的:通过实验测定样品中锰的含量,掌握锰含量的测定方法和技术。
实验原理:本实验采用重量法测定锰的含量。
首先将样品溶解,然后加入适量的碱性溶液,使得锰转化为氢氧化锰沉淀,再用硝酸将沉淀溶解,最后用氨水和氯化铵将锰转化为氯化锰沉淀,经过过滤、洗涤、干燥、烧灼等步骤,最终得到锰的氧化物。
通过称量原样品和得到的锰的氧化物的质量差值,计算出锰的含量。
实验步骤:
1. 取适量的样品,称量记录其质量。
2. 将样品溶解,加入适量的碱性溶液,生成氢氧化锰沉淀。
3. 用硝酸将氢氧化锰溶解,生成氯化锰溶液。
4. 加入氨水和氯化铵,生成氯化锰沉淀。
5. 过滤、洗涤、干燥、烧灼,得到锰的氧化物。
6. 称量得到的锰的氧化物的质量。
7. 计算锰的含量。
实验结果:经过实验测定,得到样品中锰的含量为X%。
实验结论:本实验采用的重量法测定锰的含量方法准确可靠,得到的结果具有一定的参考价值。
实验中遇到的问题和改进措施:在实验过程中,可能会遇到溶解不完全、沉淀损失、干燥不彻底等问题,需要加强操作技巧,严格控制实验条件,以确保实验结果的准确性和可靠性。
通过本次实验,我们对锰含量的测定方法和技术有了更深入的了解,为今后的实验和研究工作提供了重要的参考和指导。
X射线荧光光谱法快速测定锰矿石中Mn的含量

X射线荧光光谱法快速测定锰矿石中Mn的含量作者:胡珂来源:《中国化工贸易·中旬刊》2017年第09期摘要:关于锰矿石成分的分析方法通常采用原地质矿产部行业规范《岩石矿石分析规程》中的《锰及锰矿石分析规程》。
该规程介绍的是采用化学分析方法,用酸溶法或碱熔法分解试样后,先用氧化剂将锰氧化至较高的价态,然后用还原剂滴定。
硫酸亚铁铵滴定法是分析锰矿石中Mn元素最常用的方法,作为氧化剂的过硫酸铵,过量时必须煮沸破坏。
煮沸时间过短,过硫酸铵分解不完全,使分析结果偏高;若煮沸时间过长,则高锰酸分解,导致分析结果偏低。
因此该方法操作过程不好控制,分析流程长,成本高,劳动强度大,远远不能满足快速测定的需求。
随着X射线荧光光谱(XRF)分析技术的快速发展,用X射线荧光光谱法测定矿石中金属元素含量的技术得到广泛应用,其快速、准确、简单、经济的特点越来越受到分析工作者和生产企业的重视。
关键词:X射线荧光光谱法;锰;锰矿石近年来,测量不确定度的评定在理化检验中越来越受到重视。
一份完整的分析报告除了给出测定结果,还应列出其不确定度,以使报告使用者了解结果的可靠性,同时也使检测结果与其他方法的检测结果具有可比性。
本文对X射线荧光光谱法测定锰矿石中Mn元素含量的测量不确定度进行评定,分析测量不确定度来源并进行分量评定,计算合成标准不确定度和扩展不确定度,最后完成不确定度报告。
1 实验部分1.1 仪器和测量条件仪器ASIOX型X射线荧光光谱仪(荷兰帕纳科X射线分析仪器公司),最大功率4.0kW,最大电压60kV,最大电流120mA,端窗铑靶X光管,SuperQ5。
O软件;ZHY-401A型压样机(北京众和创业科技发展有限公司),最大压力40t。
仪器测量条件:元素Mn的Kα分析线;分光晶体LiF200;准直器300μm;流气探测器;电压60kV;电流60mA。
1.2 样品制备用粉碎机和磨矿机将样品磨细至-0.074mm,在105℃烘干2h后置于干燥器中备用。
锰矿石中锰含量的测定

书山有路勤为径,学海无涯苦作舟锰矿石中锰含量的测定1.方法提要试样经磷酸分解,在有硝酸银存在的磷酸溶液中用过硫酸铵将Mn2+氧化成Mn7+。
用二苯胺磺酸钠作指示剂,用硫酸亚铁铵标准溶液滴定。
钒、铬含量高的样品采用碱熔,水浸取之后,加乙醇还原沉淀锰,过滤分离钒、铬。
本法适用于一般试样中ω(Cr2O3)/10-2>0.5 的测定。
2.试剂2·1.过硫酸铵,分析纯。
2·2.磷酸(p1.69g/mL),分析纯。
2·3.硫酸(p1.84g/mL),分析纯。
2·4.二苯胺磺酸钠指示剂:称取0.08g 二苯胺磺酸钠溶于100mL 硫酸(5+95)中。
2·5.硫酸锰溶液:称取2g 硫酸锰溶于100mL 水中。
2·6.硝酸银溶液:称取1g 硝酸银溶于100mL 水中。
2·7.硫酸亚铁铵标准溶液的配制:称取7.1g 硫酸亚铁铵溶于1000mL 硫酸(5+95),混匀。
此溶液为C[(NH4)2Fe(SO4)2•6H2O]=0.01791mol/L。
2·8.重铬酸钾标准溶液:称取105℃干燥过的重铬酸钾(基准)0.8880g 于250mL 烧杯中,用水溶解,移入1000mL 容量瓶中,用水稀释至刻度,混匀。
此溶液为C(1/6K2Cr2O6)=0.01791mol/L。
2·9.硫酸亚铁铵标准溶液的标定:分取30.00mL 的重铬酸钾标准溶液于250mL 锥形瓶中,加入15mL 硫酸、10mL 磷酸,用水稀释至120mL 左右,摇匀,冷却至室温,加入0.08%二苯胺磺酸钠2mL,以欲标定的硫酸亚铁铵溶液滴定至红紫色变为浅绿色为终点。
若硫酸亚铁铵溶液不等于30.00mL,则运用稀释定律调整至消耗体积为30.00mL,并作平行标定予以确认。
3.分析步骤称取0.5000g(视含量而定)在105℃烘2h 的试样于300mL 三角瓶中,加15mL 硫酸、10mL 磷酸,置于高温电炉上于300~360℃加热溶解完全(冒三氧化硫浓烟),取下冷却,用水稀释至120mL左右。
自动电位滴定仪测定锰矿石中全锰量

自动电位滴定仪测定锰矿石中全锰量马德起;韩娟;胡德新;武素茹;王永芳【摘要】样品经盐酸、磷酸、硝酸、高氯酸加热溶解后,以硫酸亚铁铵为标准溶液为滴定液,采用自动电位滴定仪测定全锰量.经过对5个有证标准样品进行测试,全锰量测定的平均值与认定值的误差在0.015%~0.145%之间,标准差为0.074%,t检验值为0.366.选取主要进口国含量不同的样品进行全锰量的测定,并进行方法对比,其允许差符合标准GB/T 1506-2002规定.本法具有较高灵敏度和准确度,可用于大批量锰矿石的日常检测.%The sample was dissolved in hydrochloric acid, phosphoric acid, nitric acid and perchloric acid by heating. The content of total manganese was determined by automatic potentiometric titrator. Five certified reference materials were tested. The errors between average determination value and certified value of total manganese content were in the range of 0. 015 %-0. 145%. The standard deviation was 0. 074% and the t test value was 0. 366. Various samples with difference total manganese contents from main import countries were selected for the determination of total manganese. The method comparison was conducted, and the admissible error complied with rules in GB/T 1506-2002. This method had high sensitivity and accuracy, and it could be used for the routing inspection of large numbers of manganese ores.【期刊名称】《冶金分析》【年(卷),期】2012(032)008【总页数】5页(P70-74)【关键词】全锰量;锰矿石;自动电位滴定仪【作者】马德起;韩娟;胡德新;武素茹;王永芳【作者单位】天津出入境检验检疫局,天津300456;天津出入境检验检疫局,天津300456;天津出入境检验检疫局,天津300456;天津出入境检验检疫局,天津300456;天津出入境检验检疫局,天津300456【正文语种】中文【中图分类】O657.15锰是钢铁工业和化学工业不可缺少的原料,作为最大的锰系铁合金生产国,我国锰矿资源远远不能满足国内需求,每年必须进口数百万吨的锰矿石与国内的贫锰矿搭配使用[1]。
火焰原子吸收光谱法测定矿石中锰的含量

第 32卷 第 3 期 2017年 6 月
资源信息与工程
Vol.32 M)3 June 2017
发展中必须可少的一项技术。 根 据 相 关 研 究 分 析 显 示 ,原 子 吸 收 光 谱 法 目 前 可 测
绘 制 :取 6 只 100 m L容量瓶分别加人0.0,2.0,5.0,10.0, 20.0,30.0[p (Mn) = 10 pg/mL] 的 标 准 溶 液 ,各加 HCl
等 各 个 行 业 中 得 到 了 广 泛 应 用 。锰 属 于 是 黑 色 金 属 元 素 ,具 有 易 原 子 化 、低 沸 点 的 特 点 ,火 焰 原 子 吸 收 光 谱 测 定 方
法适用性较强,测量结果精度高。本文首先分析了火焰原子吸收光谱法原理、应 用 情 况 ,然后用具体的试验验证了
火焰原子吸收光谱法测定矿石中锰的含量的有效性。
关 键 词 :火焰原子吸收光谱法;矿 石 ;锰
P 中 图 分 类 号 : 575
: 文 献 标 识 码 A
文 章 编 号 :2096-2339(2017)03-0095-02
锰是一种重要的过渡元素金属,在 钢 铁 业 、冶 金 业 、 化工业 、电子业中的应用均十分广泛。 目前,锰的测定方 法众 多 ,如:容量法、光 度 法 、等 离 子 质 谱 法 、原子吸收光 谱 法 等 ,其中铋酸钠容量法操作复杂、成 本 高 ,光度法适 用于中低含量锰测定,电感耦合等离子质谱法设备昂贵、 不 易 推 广 ,原子吸收光谱法操作简单、测定敏感 度 高 ,是 当 前 较 为 适 宜 的 一 种 测 量 方 法 ,加 强 其 研 究 具 有 重 要 意 义 。本文以矿石中锰的含量为测定目标,通过具体试验 分析了火焰原子吸收光谱法应用效果。
自动电位滴定测定锰矿石中锰的方法研究

锰 矿是 工 业 产 业重 要 的基 础性 大 宗 原料 矿 产 ,
幅度 增加 , 矿产 品检 验 检 疫 行业 迫切 需 要 开 展 多批
中 国的 电解 锰 产 量 占 了全 世 界 的 9 5 % 。锰 还 是 钢 最基 本 的元 素 , 是 对 钢及 其 钢 材 性 能 产 生重 要 影 响
程度高、 方 法稳健 , 适 用 于冶炼 企 业、 港 口商检 等行 业 , 具有推 广 价值 。
关 键词 : 锰 矿石 ; 锰 ;自动 电位 滴 定 ;氧化 还原 滴定
中图分 类号 : P 5 7 8 . 1 ;O 6 1 4 . 7 1 1 ;0 6 5 7 . 1 ;0 6 5 5 . 2 3 文献标 识 码 :B
配使用 … 。2 0 1 1 年 全 国各 口岸 进 1 5锰 矿 石 约 1 3 5 0
等 。x射 线荧光 光谱 法分 析 锰含 量 时 由于锰 矿 的高 湿存 水 , 熔制玻 璃 片时要 求 操作 者 具备 很 高 的经 验 , 否则很容易产 生气泡 , 而且需要 配备 多个水 平 的标 准 样品 , 另外检测成 本较高 。手工 电位滴 定法操 作手 续 繁杂 , 无 法移植 到 自动 电位滴定 仪上 。手工 目视滴定
电位 滴定仪 先 用硫 酸 亚铁 铵标 准 溶液 对 预 先 移取 的 重铬 酸 钾 标 准溶 液 和标
定 空 白溶 液 分别进行 氧 化还 原 滴定 , 用铂 复合 电极指 示 , 计 算 得 到硫 酸 亚铁
铵 标 准溶 液 浓度 , 再 对样 品 空 白溶 液 和样 品溶 液进 行 氧 化 还原 滴定 , 得 到样
来, 进 口贸易商 不 断 拓展 海 外 市 场 , 缅甸 、 印度 尼 西
原子吸收测定矿石中锰的含量

原子吸收测定矿石中锰的含量锰为一种过渡金属,质坚而脆。
在固态状态时它以四种同素异形体存在。
在空气中易氧化,生成褐色的氧化物覆盖层.锰在地壳中大量存在,平均含量约为0.1%,其含量之大在已知元素中占第15位,在重金属中锰仅次于铁而居第二位。
其多以化合物形式广泛分布于自然界中。
在本文研究中,笔者使用多种酸组合熔解矿石中的锰,原子吸收仪分析矿石锰含量,通过该方法测得其相对标准偏差为0.20%~0.56%,试验回收率为97.90%~98.71%间,实验结果满意。
标签:原子吸收法矿石锰含量在现代工业中,锰及其化合物应用于国民经济的各个领域。
其中钢铁工业是最重要的领域,用锰量占90%~95%,是高炉炼铁过程中的一种有益元素[1]。
其余5%~10%的锰用于其他工业领域,如化学工业、轻工业、建材工业、国防工业、电子工业,以及环境保护和农牧业,等等[2]。
总之,锰在国民经济中具有十分重要的战略地位。
1我国锰矿储量及利用我国有记载的陆地锰矿产出地(矿床、矿点、矿化点)约840 余处,已在24 个省、市、自治区发现并勘查了锰矿。
据统计,截止2005 年,我国已查明锰矿产地295 处,累计探明锰矿资源/储量7 亿余吨,其中储量/基础储量2 亿余吨,资源量5 亿余吨。
近年来,我国锰矿石采选冶技术进步,对改善我国锰矿资源格局开始产生积极影响:一是锰产品深加工技术进步扩展了锰产品品种及品质;二是锰矿石选矿技术进步,降低了对矿石品位、品质的要求,增加了可利用资源量;三是锰矿山采矿技术进步,使原来一些难以开采矿体,可以采出。
2锰含量的分析方法2.1测定常量锰的滴定法硫酸铵法即试样经硝酸-磷酸混合酸溶解后,在硝酸银存在下,用过硫酸铵将锰氧化成高锰酸,以N-苯代邻氨基苯甲酸为指示剂,用硫酸亚铁铵标准溶液滴定[4]。
硝酸铵法即试样经酸溶解,在微冒磷酸烟的状态下,用硝酸铵将锰定量的氧化为三价,以N-苯代邻氨基苯甲酸为指示剂,用硫酸亚铁铵标准溶液滴定锰。
硫酸亚铁铵滴定法测定锰矿石中锰量探讨

硫酸亚铁铵滴定法测定锰矿石中锰量探讨作者:孙波杨明春钟静来源:《新教育时代》2015年第20期摘要:锰矿试样经盐酸、氢氟酸、磷酸溶解后滴加硝酸破坏其中的碳及有机物,在磷酸介质中,加入硝酸铵将锰氧化成三价,以稀硫酸溶解盐类,用硫酸亚铁铵标准滴定液滴定,测定的锰量与标准值吻合,相对标准偏差小于0.1%,该方法用于不同含量标准样品的测定,准确度和精密度较高。
关键词:硫酸亚铁铵滴定法锰矿石中锰量一、前言在高炉冶炼中,原料中加入适量的锰矿,会增加渣铁流动性,一般情况下是做洗炉料来用。
它用来做洗炉料用较萤石相对温和,对高炉炉衬的影响相对较小,因此攀钢钒开展用锰矿进行洗炉试验。
锰矿石中锰量不仅是质量验收的关键指标,而且对高炉生产有指导作用,因此,准确测定其含量十分必要。
锰矿中锰的测定方法一般采用滴定法,其氧化方式有过硫酸铵法[1][2][3][4]、硝酸铵法、高氯酸法[5]等。
过硫酸铵法需消除铬干扰,流程长;高氯酸氧化稳定性较好,但其属易燃易爆危险化学药品;硝酸铵法速度相对较快、使用相对安全。
因此,本报告选择硝酸铵法。
硝酸铵法氧化的介质、氧化剂量、氧化温度是本法关键和难点,其操作不易掌握,难以获得准确一致的结果,本报告通过大量的试验,选择了最佳氧化介质、氧化温度控制方法等关键条件,建立了硝酸铵氧化滴定法测定锰矿的方法,该法快速准确,满足锰矿的验收检验。
二、实验部分1.试剂和材料硝酸(ρ约1.42 g/mL); 盐酸(ρ约1.19 g/mL); 磷酸(ρ约1.69 g/mL); 氢氟酸(ρ约1.13 g/mL);5 ;硫酸 ;硫酸(1+4),(5+95); 硝酸铵,AR; N-苯基代邻氨基苯甲酸指示剂(2 g/L);重铬酸钾标准溶液(0.05000 mol/L);硫酸亚铁铵标准溶液(约0.04 mol/L),标定如下:移取三份25.00 mL重铬酸钾标准溶液,分别置于250 mL三角瓶中,加入40 mL硫酸(1+4),5 mL磷酸,混匀。
锰矿中锰含量的测定

锰矿中锰含量的测定作者:赵丽敏来源:《赤峰学院学报·自然科学版》 2011年第4期赵丽敏(赤峰学院化学系,内蒙古赤峰 024000)摘要:本实验主要目的是探索一种测定锰矿中锰含量的一种方法.这种方法主要是甲基百里香酚兰做络合剂做指示剂,用EDTA滴定锰,从而测定出锰的含量.首先用稀硫酸溶解试样,使用pH计调pH值,加入指示剂,滴定至终点.但是这种方法很难确定终点,通过探索加入另一种物质来改变这种状况,在探索中证实了钴有这种能力,pH值必须控制在5.8到6.5左右.加入钴之后终点很好确定,还有另外两种方法可测定锰的含量,以铬黑T为指示剂用CaCO3进行返滴定和以钙指示剂为指示剂用CaCO3进行返滴定.通过比较用甲基百里香酚兰络合剂做指示剂用EDTA滴定锰的含量的方法的准确度较高.关键词:锰;甲基百里香酚兰络合剂;EDTA络合滴定;Co2+-EDTA中图分类号:P575 文献标识码:A 文章编号:1673-260X(2011)04-0029-031 关于锰的介绍锰是自然界分布较广的一种元素,约占地壳重量的0.085%,它主要以氧化物形式存在.锰是银灰色金属,元素符号Mn,原子序数25,原子量54.94,比重7.4g/cm3,熔点1250摄氏度,是一种难熔的重金属.在自然界中锰有Ⅱ、Ⅲ、Ⅳ及Ⅶ价态,其中以Ⅱ和Ⅳ价态最为常见.锰在空气中非常容易氧化.在加热条件下,粉状的锰与氯、溴、磷、硫、硅及碳元素都可以化合.锰在地球岩石圈中以及硅酸盐相的陨石中表现有强烈的亲石性质,但在岩石圈上部则有强烈的亲氧性质,锰与铁在岩石圈中以及陨石中虽有许多相似的化学性质,但锰并不亲铁.2 实验原理锰矿的主要成分是二氧化锰,其主要杂质是铁.因此在测锰的含量时主要考虑铁的影响.在溶解试样时,先进行酸洗,但是考虑到二价锰的损失,加入少许过氧化氢,抑制二价锰的溶解损失.洗完之后加入还原剂草酸钠,再加稀硫酸,加热溶解.测定时,首先制备EDTA溶液,用碳酸钙标定EDTA溶液,EDTA溶液应当保存在聚氯乙烯瓶或硬质玻璃瓶中,若贮存于软质玻璃瓶中,会不断溶解玻璃瓶中的Ca2+形成CaY2-使EDTA浓度不断降低.用CaCO3标定EDTA时,通常使用钙指示剂指示终点,用NaOH控制溶液pH为12~13,其变色原理为:滴定前 Ca+In(蓝色)=CaIn(红色)滴定中 Ca+Y=CaY终点时 CaIn(红色)+Y=CaY+In(蓝色)然后以甲基百里香酚兰络合剂做指示剂在pH=5.9~6.5之间用EDTA标准溶液滴定Mn2+.具体做法是:取一定体积的试样溶液于锥形瓶中,加入2~3滴指示剂,2滴Co2+-EDTA溶液,用六亚甲基四胺溶液调pH=5.9~6.5,以EDTA标准溶液滴定.其变色原理为:滴定前 Mn2++CoEDTA=MnEDTA+Co2+Co+In(黄色)=CoIn(蓝色)滴定中 Mn+Y=MnY终点时 EDTA+CoIn(蓝色)=CoEDTA+In(黄色)以钙指示剂为指示剂进行返滴定的原理,首先取一定体积的试样溶液于锥形瓶中,然后加入过量的EDTA标准溶液,用六亚甲基四胺溶液调pH=5.9~6.5,静置一会儿等过量的EDTA标准溶液与锰进行反应,反应为:Mn+Y= MnY.再用NaOH溶液控制pH值在12~13之间,将剩余的EDTA标准溶液用CaCO3返滴定.其变色原理为:滴定前滴定前指示剂在溶液中呈游离状态,溶液颜色为指示剂颜色,蓝色.滴定中 Ca+Y=CaY终点时 Ca+In(蓝色)=CaIn(红色)以EBT为指示剂进行返滴定的原理,首先取一定体积的试样溶液于锥形瓶中,然后加入过量的EDTA标准溶液,用六亚甲基四胺溶液调PH=5.9~6.5,静置一会儿等过量的EDTA标准溶液与锰进行反应,反应为:Mn+Y=MnY.然后用氨水将溶液的PH值调制9~10左右,然后加入一定体积的NH3·H2O-NH4Cl冲溶液,剩余的EDTA标准溶液用CaCO3返滴定,其变色原理为:滴定前滴定前指示剂在溶液中呈游离状态,溶液颜色为指示剂颜色,蓝色.滴定中 Ca+Y=CaY终点时 Ca+In(蓝色)=CaIn(红色)3 实验试剂及仪器试剂:甲基百里香酚兰络合剂[6],乙二胺四乙酸二钠,HCl溶液1:1,钙指示剂,1g钙指示剂与100gNaCl混合磨匀,NaOH溶液40g·L-1,六亚甲基四胺溶液200g·L-1,六亚甲基四胺缓冲溶液,分析纯MnO2,化学纯MnO2,Na2C2O4(s)分析纯;H2SO4溶液3mol·L-1,软锰矿试样,CaCO3固体,NH3·H2O-NH4CI缓冲溶液;邻二氮菲溶液,30%H2O2溶液,MnSO4固体,NaAc-HAc缓冲溶液,NaAc固体.仪器:PH酸度计,50mL,100mL,250mL,500mL的容量瓶,500mL的试剂瓶;500mL的烧杯;250mL锥形瓶;表面皿;电热套;聚乙烯瓶.4 实验步骤4.1 溶液的配制4.1.1 0.020mol·L-1EDTA溶液的配制[2]称取4.0g乙二胺四乙酸二钠(Na2H2Y.2H2O)于500mL的烧杯中,加200mL水,温热使其溶解完全,转入至聚乙烯瓶中,用水稀释至500mL,摇匀,备用.4.1.2 1:1 HCl溶液的配制用10mL量筒量取5mL浓HCl,慢慢加入蒸馏水至10mL,静置一段时间备用.4.1.3 0.020mol·L-1钙标准溶液的配制准确称取110℃干燥过的CaCO3 0.50-0.55g,置于250mL烧杯中,用少量水润湿,盖上表面皿,慢慢滴加1:1 HCl溶液5mL使其溶解,加少量水稀释,定量转移至250mL容量瓶中,用水稀释至刻度,摇匀,计算其准确浓度.4.1.4 40g·L-1 NaOH溶液的配制称取2g NaOH固体于100mL烧杯中,加少量水溶解,然后加水稀释至50mL备用.4.1.5 3mol·L-1 H2SO4溶液的配制将167mL的18mol·L-1 H2SO4溶液慢慢加到含835mL蒸馏水的容量瓶中.4.1.6 试样的溶液的配制准确称取0.9~1g化学纯MnO2,置于250mL锥形瓶中.根据MnO2的含量称取含量较理论值计量多一点的Na2C2O4,置于上述锥形瓶中,再加入30mL3mol·L-1 H2SO4溶液30mL和水20mL.在锥形瓶上盖上表面皿,在电热套上控温加热,直至不在放出二氧化碳气体为止,且无黑色颗粒残渣为止.以水稀释锥形瓶内壁及表面皿,将溶液转入容量瓶中稀释至250mL.备用.4.1.7 由分析纯MnO2制备Mn2+溶液准确称取0.9~1g分析纯MnO2,置于250mL锥形瓶中.根据MnO2的含量称取含量较理论值计量多一点的Na2C2O4,置于上述锥形瓶中,再加入30mL3mol·L-1 H2SO4溶液30mL和水20mL.在锥形瓶上盖上表面皿,在电热套上控温加热,直至不在放出二氧化碳气体为止,且无黑色颗粒残渣为止.以水稀释锥形瓶内壁及表面皿,将溶液转入容量瓶中稀释至250mL.备用.4.1.8 200g·L-1六亚甲基四胺溶液的配制准确称取100g六亚甲基四胺溶液与250mL烧杯中,加200mL蒸馏水溶解,然后转移到500mL的试剂瓶中,加蒸馏水至刻度,摇匀,备用.4.1.9 NH3·H2O-NH4CI缓冲溶液的配制准确称取NH4CI 27g置于250mL烧杯,加100mL蒸馏水溶解,然后加浓氨水31.5mL,然后转移到500mL的试剂瓶中,加蒸馏水至刻度,摇匀,备用.4.1.10 NaAc-HAc缓冲溶液的配制准确称取NaAc 41.5g至于250烧杯,加100mL蒸馏水溶解,然后加冰醋酸60mL,然后转移到500mL的试剂瓶中,加蒸馏水至刻度,摇匀,备用.4.2 CaCO3为基准物标定EDTA溶液的浓度移取20.00mL钙标准溶液于250mL锥形瓶中,加5mL 40g·L-1 NaOH溶液及少量钙指示剂,摇匀后,用EDTA溶液滴定至由酒红色恰变为纯蓝色,即为终点.平行做三份,计算EDTA标准溶液的浓度.4.3 分析纯试样中的Mn的含量的测定4.3.1 用甲基百里香酚兰络合剂做指示剂进行滴定用10mL移液管准确移取10mLMn2+溶液,加入200g·L-1六亚甲基四胺溶液调制pH=5.9—6.4左右,然后加入甲基百里香酚兰络合剂,滴入一滴Co2+-EDTA溶液,用EDTA标准溶液滴定至颜色由蓝色恰变为黄色为止,即为终点.平行测定三份,计算出锰的含量.4.3.2 用EBT做指示剂返滴定首先用10mL移液管准确移取10mLMn2+溶液,加入200g·L-1六亚甲基四胺溶液调制PH=5.9~6.4左右,然后加入10mLEDTA标准溶液,摇匀,静置一会儿,加入5mL浓NH3·H2O,再加入10mLNH3·H2O-NH4CI缓冲溶液,控制PH值在9~10左右滴入一滴EBT溶液,用CaCO3溶液滴定至溶液由蓝色恰变为酒红色为止,即为终点.平行测定三份,计算出锰的含量.4.3.3 用钙指示剂做指示剂返滴定首先用10mL移液管准确移取10mL Mn2+溶液,加入200g·L-1六亚甲基四胺溶液调制PH=5.9~6.4左右,然后加入10mLEDTA标准溶液,摇匀,静置一会儿,加入5mL 40g·L-1 NaOH溶液,加入钙指示剂,用CaCO3溶液滴定至溶液由蓝色恰变为紫红色为止,即为终点.平行测定三份,计算出锰的含量.4.4 试样的Mn的含量的测定用10mL移液管准确移取10mL Mn2+溶液,加入200g·L-1六亚甲基四胺溶液调制pH=5.9~6.4左右,然后加入甲基百里香酚兰络合剂,滴入一滴Co2+-EDTA溶液,用EDTA标准溶液滴定至颜色由蓝色恰变为黄色为止,即为终点.平行测定三份,计算出锰的含量.5 实验数据记录与处理5.1 CaCO3为基准物标定EDTA溶液的浓度的数据处理5.2分析纯MnO2中的Mn的含量的测定数据处理.5.2.1甲基百里香酚兰络合剂做指示剂5.2.2用钙指示剂做指示剂返滴定数据处理5.2.3 用EBT做指示剂返滴定数据处理5.3试样的Mn的含量的测定数据处理6 方法的讨论与分析6.1 实验方法的选择根据本次试验中测定分析纯二氧化锰中锰的含量所运用的三种方法来看,用甲基百里香酚兰络合剂做指示剂的方法灵敏度和准确度比较高.但是在用甲基百里香酚兰络合剂做指示剂时,必须加入Co2+-EDTA溶液否则终点很难确定,变色不灵敏.当加入Co2+-EDTA溶液时终点变色非常灵敏.此法比返滴定法的终点都好确定,但是具体的原因尚未确定,有怠于进一步探索.6.2 实验条件的选择溶液的pH值在5.9和6.5之间时测定效果最好,pH值太大锰会沉淀,太小指示剂不稳定.调pH值时最好用六亚甲基四胺溶液,试样溶液是强酸性溶液,但是当加入强碱性溶液时,在酸碱中和的过程中还伴随着Mn的氧化,会将二价的锰氧化成二氧化锰,给最终的测定带来误差.NaAc是弱碱,它也可以用来调PH值,但是因为NaAc-HAc缓冲溶液的缓冲在PH值在4.4左右[3],实验前后溶液的PH值变化差大,而且小于5.9使终点提前,带来实验误差.参考文献:〔1〕林顺增,叶子斌,苏世花,朱明慧,陈樟几,张启卫.Journal of Sanming College.三明高等专科学校学报.〔2〕〔4〕华中师范大学,东北师范大学,陕西师范大学,北京师范大学.分析化学实验.高等教育出版社出版,2006.〔3〕武汉大学.分析化学.高等教育出版社出版,2006.〔5〕吉林冶金研究所.金属与矿物原料分析手册.吉林人民出版社出版,1978.〔6〕广东省冶金地质实验研究所.矿石分析与常用仪器.1973.。
锰矿石中锰含量测定方法确认与应用

2.1 样品分解使用的介质选择 试样的分解介质可选择磷酸、盐酸—磷酸—硝
酸、硫酸—磷酸—硝酸。以图标为依据开展了样品 分解介质和条件的确认实验[6],由于锰矿试样中含 有有机物、硫化物及其他还原物质,因此,本法选择 盐酸—磷酸—硝酸介质分解试样。 2.2 样品分解冒烟时间的影响
按样品分析步骤对有证标准物质(GBW07264) 进行分解,加热至冒 SO3浓白烟时开始计时,再加热 不同时间后取下,后续按分析步骤进行锰含量测定, 结果见图 1。
52
中 国 锰 业
第 39卷
T1 =C[(NH4)2Fe(SO4)2·6H2O]×0.05494
(2)
式(1)~(2)中:C[(NH4)2Fe(SO4)2·6H2O] 为硫酸亚铁铵溶液的浓度,mol/L;C(1/6K2Cr2O7) 为重铬酸钾标准溶液的浓度,mol/L;V为移取重铬
酸钾标准溶液的体积,mL;V1 为标定消耗硫酸亚铁 铵溶液的体积,mL;V0 为空白标定 消耗硫 酸亚 铁 铵 溶液的体积,mL;T1 为硫酸亚铁铵溶液对锰的滴定 度,g/mL;0.05494为 锰 的 毫 摩 尔 质 量,g/(m·
由图 1可 知:在 实 验 条 件 下 样 品 分 解 冒 烟 时 间对锰测定 结 果 有 影 响,主 要 是 时 间 过 长 容 易 析
(,+)
(*+5 $%$ $%& '%$ '%& (%) (%& *+$ *%& ,%$ ,%& !"#
图 3 加入不同量的高氯酸的对锰测定结果影响
由图 3可知:高氯酸量超过 1.0mL后结果偏
54
中 国 锰 业
第 39卷
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
认知电极
铂电极
电极表达式:Pt︱Fe3+,Fe2+ 25℃时电极电位:
Fe
3
/ Fe2
Fe3 / Fe2
( Fe3 ) 0.0592lg ( Fe2 )
性质:只作为氧化剂和还原剂进行电子交换的场所,并不参加电 极反应。 使用注意事项:将铂电极浸入热的w(HNO3)=10%硝酸溶液中数 分钟,取出,用水冲洗干净,蒸镏水冲洗,置电极架上。
测定过程
电位滴定装置的安装 打开电位滴定仪电源开关,预热20min。 磷矿石处理 试样的分解 残渣的处理 样品溶液的滴定 移取100.00mL 样品溶液于盛有250mL焦磷酸钠溶液的 500mL烧杯中,加入时不断搅拌,用盐酸(1+4)调节 溶液的pH为7.0。 在电位滴定仪上,滴加高锰酸钾溶液,滴定至电位滴 定仪上发生明显电位突变即为终点。
坐标的交点即为滴定
终点体积。
E E 2 E V 2 V 1 2 V V2 V1
二阶微商法(计算法)
采用下面的方法计算滴定终点
a Vep V ( V ) a b
V—二阶微商为a时标准滴定溶液的体积,mL; a-二阶微商为零前的二级微商值; b-二阶微商为零后的二级微商值; ⊿V—由二级微商为a至二级微商为b时所加标准滴定溶液的体积,mL。
任务3
锰矿石中锰含量的测定
知识目标
电位滴定法、惰性金属电极、电判断电位滴定的终点。 能够利用电位滴定法测定锰矿石中锰含量
课程引入
问题:锰含量是锰矿石的技术指标之一,那么该如何测定呢?
原子吸收光谱法
电位分析法
分光光度法
引入电位滴定法测定锰矿石中锰含量
练习
以Pt电极为指示电极,饱和甘汞电极为参比电极, 利用c(1/5KMnO4)=0.1000mol/L的高锰酸钾标准溶液 滴定某含Fe2+的溶液,滴定中所获得部分E-V数据见 表8-4(见P232)所列。试确定滴定终点时所消耗标 准滴定溶液的体积。
拓展项目
利用电位分析法对饮用水的相关性能进行检测, 并写出分析方案。 要求: (1)研究饮用水的国建标准,确定能用电化学分析 法测定的项目; (2)写出各分析项目的分析方案; (3)进行分析测试,并根据测定过程中出现的问题, 继续优化方案; (4)对分析结果进行分析,写出检测报告。
学生实验
要求每位学生独立完成测定,合理安排时间。 滴定时,应注意溶液pH的调节,可用pH计或 溴百里酚蓝指示剂检查。 残渣处理后,应一并并入主液中。 测定前应处理好电极。
问题:滴定终点如何判断?
电位滴定终点的确定方法
E-V曲线法
记录每次滴定时的 滴定剂用量( V )和相 应的电动势数值( E ) ,绘制E~V曲线,此 曲线上的拐点对应的 体积即为滴定终点时 所耗标准滴定溶液的 体积。 E-V曲线法简单,但准确性稍差。
知识点讲解
电位滴定法 定义: 是根据滴定过程中指示电极电位的突跃来确定滴
定终点的一种滴定分析方法。
比较电位滴定法与直接电位法和化学滴定法的区别
与化学滴定法的区别 与直接电位法的区别 定量参数不同 确定滴定终点方法不同
电位滴定法
实验装置
指示电极:铂电极 参比电极:双液接甘汞电极 滴定管 酸度计 电磁搅拌器 搅拌子
一阶微商法
将V对△E/△V作图,可
得到一呈峰状曲线,曲线 最高点由实验点连线外推 得到,其对应的体积为滴
定终点时标准滴定溶液所
消耗的体积Vep。
此法确定终点较准确,但是手续繁琐。
E E2 E1 V V2 V1
二阶微商法(作图法)
以Δ2E/ΔV 2对V绘 制曲线,此曲线最高 点与最低点连线与横
作业:
参照国家标准,测定饮用水中pH、F-、Fe2+含量
