基于 Orbitrap GC-MS 的非靶向代谢组学
GC-MS非靶标代谢组分析

百泰派克生物科技
GC-MS非靶标代谢组分析
代谢组学是一种全面的代谢分析方法,能以无偏见的方式同时分析广泛的代谢物类别。
代谢组学方法可分为靶向和非靶向两种。
靶向代谢组学是指对一组选定的代谢物(例如氨基酸、脂质、糖和/或脂肪酸)进行定量测量,以研究特定的代谢途径
或验证使用非靶向代谢分析确定的生物标志物。
相比之下,非靶向代谢组学方法涉及代谢组的全局分析,旨在快速可靠地识别特定生理状态的小分子生物标志物,与靶向代谢组学相比,非靶向代谢组学通常可提供更多信息。
GC-MS非靶标代谢组学通过气相色谱-质谱联用技术对生物体液、组织和细胞中的
所有小分子代谢物进行综合分析,检测实验组和对照组中所有小分子代谢物的动态变化,旨在寻找生物体受外界刺激前后体内有显著变化的代谢物,揭示这些代谢物与生理病变之间的关系,为了解各种生物过程的信号通路以及小分子代谢物的调节作用提供了理论依据,广泛用于识别癌症生物标志物和调节肿瘤进展的代谢物研究。
百泰派克生物科技基于Thermo公司的Q Exactive和AB公司的Q TOF 5600质谱平台,推出GC/MS非靶向代谢组学分析服务技术包裹,基于之前发表的文献建立了多种样品处理的技术平台,您只需要将您的实验目的告诉我们并将您的样品寄给我们,我们会负责项目后续所有事宜,包括样品准处理、质谱分析、质谱原始数据分析、生物信息学分析。
uplc-ms的非靶向代谢组学方法

非靶向代谢组学方法是一种用于发现并分析生物体内所有代谢产物的方法。
其中,uplc-ms(超高效液相色谱-质谱联用)技术被广泛应用于非靶向代谢组学研究中,因其高灵敏度、高分辨率和高通量的特点而备受青睐。
本文将重点介绍uplc-ms的非靶向代谢组学方法,包括样品处理、色谱分离、质谱检测、数据处理等各个方面。
1. 样品处理在非靶向代谢组学研究中,样品处理是非常关键的一步。
经典的样品处理方法包括蛋白沉淀、溶剂提取和衍生化等。
对于不同类型的生物样品,比如血浆、尿液、组织、细胞等,都需要选择合适的样品处理方法来提取代谢产物。
2. 色谱分离uplc-ms技术的另一个关键步骤是色谱分离。
通过超高效液相色谱技术,可以对样品中的代谢产物进行高效、快速的分离。
色谱柱的选择、流动相的配制、梯度 elution等因素都会影响色谱分离的效果,因此需要进行精心的设计和优化。
3. 质谱检测uplc-ms技术的核心是质谱检测。
通过质谱仪器的高灵敏度、高分辨率和高质谱质量的特点,可以对样品中的代谢产物进行快速、准确的检测和分析。
质谱仪器的参数设置、离子扫描模式的选择、质谱图的解释等都是影响质谱检测结果的重要因素。
4. 数据处理完成了样品处理、色谱分离和质谱检测后,还需要对得到的海量数据进行处理和分析。
包括峰识别、质谱图的定量和定性分析、多变量统计分析等,都需要借助专业的数据分析软件和统计学方法来完成。
总结uplc-ms的非靶向代谢组学方法在生物医学、药物研发、环境科学等领域都有着广泛的应用前景。
通过精心设计各个步骤,结合先进的仪器设备和专业的数据处理技术,可以更全面、更深入地揭示生物体内代谢变化的规律,为疾病诊断、药物研发等提供有力支持。
希望uplc-ms的非靶向代谢组学方法在未来能够得到更广泛的推广和应用。
uplc-ms的非靶向代谢组学方法在生物医学、药物研发、环境科学等领域的广泛应用中,为科研工作者提供了强大的工具和技术支持。
非靶代谢组

非靶代谢组引言非靶代谢组(non-targeted metabolomics)是一种高通量的代谢组学技术,可以在不预先设定特定分子进行分析的情况下,综合地鉴定和定量生物体内的代谢物。
与靶向代谢组学不同,非靶代谢组学无需事先确定分析目标,而是通过大规模筛查样本中的代谢产物,以发现新的代谢通路和生物标志物。
本文将对非靶代谢组的原理、应用领域、技术流程和数据分析进行详细介绍,并讨论其在医学、生物学和食品科学等领域的潜在应用。
原理非靶代谢组学主要基于质谱(mass spectrometry)技术,结合色谱(chromatography)和核磁共振(nuclear magnetic resonance)等方法,实现对样本中代谢物的全面分析。
非靶代谢组学的分析流程包括样品制备、仪器检测和数据分析三个关键步骤。
首先,对样品进行适当处理,如提取、去蛋白和衍生化等,以增强代谢物的检测和分析能力。
然后,使用质谱等仪器对样品进行分析,将代谢物的质量-电荷比(m/z)和相对丰度信息记录下来。
最后,通过数据预处理、特征选择和统计分析等方法,对非靶代谢组学数据进行解析和解释。
应用领域非靶代谢组学在医学、生物学和食品科学等领域有着广泛的应用。
医学非靶代谢组学可以用于发现新的生物标志物,以辅助疾病诊断和预后评估。
通过比较病例组和正常对照组的代谢组学数据,可以鉴定与疾病相关的代谢异常,从而为疾病的早期诊断和治疗提供依据。
例如,非靶代谢组学已被应用于癌症、糖尿病和心血管疾病等多种疾病的研究中,帮助揭示其潜在的代谢机制。
生物学非靶代谢组学可以揭示生物体内代谢网络的复杂性和动态性,帮助解析代谢通路和代谢互作网络。
通过对不同生理状态下的代谢物进行分析,可以揭示代谢通路的变化规律,并研究其与生物学功能和调控的关联。
此外,非靶代谢组学还可以用于研究植物代谢物的合成、植物应答环境胁迫的机制等。
食品科学非靶代谢组学可以用于食品质量和安全的评估。
非靶向代谢组学,你想知道的都在这里
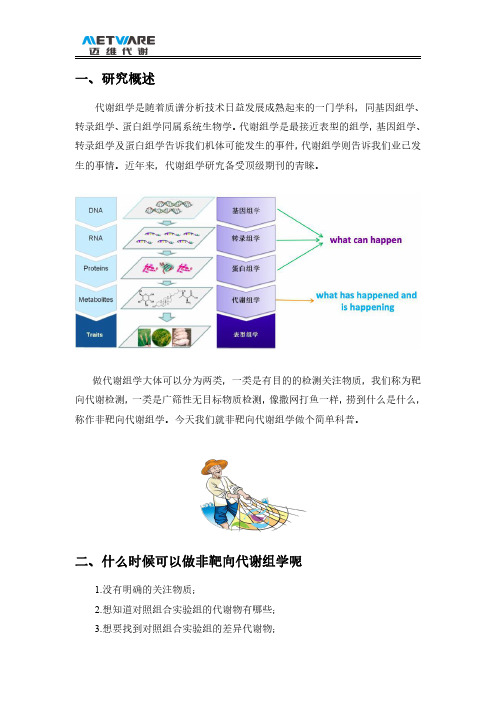
一、研究概述代谢组学是随着质谱分析技术日益发展成熟起来的一门学科,同基因组学、转录组学、蛋白组学同属系统生物学。
代谢组学是最接近表型的组学,基因组学、转录组学及蛋白组学告诉我们机体可能发生的事件,代谢组学则告诉我们业已发生的事情。
近年来,代谢组学研究备受顶级期刊的青睐。
做代谢组学大体可以分为两类,一类是有目的的检测关注物质,我们称为靶向代谢检测,一类是广筛性无目标物质检测,像撒网打鱼一样,捞到什么是什么,称作非靶向代谢组学。
今天我们就非靶向代谢组学做个简单科普。
二、什么时候可以做非靶向代谢组学呢1.没有明确的关注物质;2.想知道对照组合实验组的代谢物有哪些;3.想要找到对照组合实验组的差异代谢物;5.寻找疾病biomarker。
三、非靶向代谢组学的流程非靶向代谢组学使用的技术平台是LC-MS,用高效液相色谱作为分离系统,高分辨率质谱作为检测系统的一种串联分析平台。
其检测流程是是实验设计——样本收集——代谢物提取——代谢物检测——质谱数据采集——定性定量分析。
非靶流程如下图:四、非靶代谢组学做的好不好由什么决定非靶向代谢组学希望能够最大程度上体现生物样品体系中总的代谢物信息,筛选到的物质数越多越好;尽可能地去定性和定量(相对)所有的代谢物,准确度越高越好,这取决于多种因素,例如仪器、数据预处理及鉴定、生信分析手段。
仪器决定我们检测的灵敏度是多少、检测到物质峰有多少,数据库决定我们坚定出的物质是否准确、全面,生信分析手段决定我们面对从庞大的数据中获得想要的信息,怎样把我们找到的信息表达出来。
下面我们就从仪器、数据库、生信分析手段方法看一下如何做好非靶代谢组学。
仪器做代谢组学的仪器平台大体分为三种:核磁共振(NMR)、气质联用(GC-MS)、液质联用(LC-MS)。
它们各有优缺点,适合不同情境使用。
比如核磁共振可以做无创检测,如果你想检测活体小鼠的代谢情况,就可以选核磁共振,但是这种方法的灵敏度很低,不适合与灵敏度需求高的情境。
non-target_metabolomics_analysis_概述及解释说明

non-target metabolomics analysis 概述及解释说明1. 引言1.1 概述在生物学和医学领域中,代谢组学是一项重要的研究方法,旨在揭示生物体内代谢过程的整体状态以及与特定疾病之间的关联。
传统的代谢组学分析通常基于目标化合物检测,即预先选择需要检测的代谢产物进行定量分析。
然而,非目标代谢组学分析则更加全面地搜寻和识别样本中存在的所有代谢产物,从而将观察范围扩展到未知化合物和低丰度的代谢物。
1.2 文章结构本文将从以下几个方面对非目标代谢组学分析进行全面介绍:首先,在第2部分中我们会定义非目标代谢组学分析并探讨其技术原理;接着,在第3部分我们会详细阐述非目标代谢组学分析的步骤和方法,包括样本准备、色谱-质谱联用技术以及数据处理与分析平台;然后,在第4部分中我们会探讨非目标代谢组学分析的优势和挑战;最后,在第5部分我们将总结主要发现和贡献,并展望未来的研究方向和应用前景。
1.3 目的本文旨在提供关于非目标代谢组学分析的全面概述,以帮助读者了解该领域的基本原理、方法和应用。
同时,我们也希望通过探讨非目标代谢组学分析的优势和挑战,引起对该技术在生物医学研究中发展和应用的兴趣。
通过本文的阅读,读者将能够深入了解非目标代谢组学分析及其在揭示代谢调控机制和疾病诊断等方面的潜力。
2. 非目标代谢组学分析:2.1 定义:非目标代谢组学分析是一种无需预设目标分子的高通量代谢物筛选方法。
与传统的目标代谢分析相比,非目标代谢组学分析可以全面地检测样品中的代谢产物,并帮助我们了解生物系统在不同条件下的整体代谢状态。
2.2 技术原理:非目标代谢组学分析主要依靠色谱-质谱联用技术(LC-MS/MS)进行实验。
首先,通过样品准备步骤,包括样品提取和预处理,将样品中的代谢产物提取出来并准备好进行分析。
接下来,将提取出的化合物通过液相色谱(LC)进行分离,并将其引入质谱仪进行检测和质量鉴定。
最后,利用数据库以及专门开发的数据处理与分析平台对获得的数据进行解析和解释。
非靶和靶向 代谢组学;转录;蛋白组学;宏基因组学

非靶和靶向代谢组学、转录组学、蛋白组学和宏基因组学是近年来在生物医学领域中备受关注的研究方向。
这些研究方法和技术不仅为生命科学领域的研究提供了新的视角和手段,也为疾病的筛查、诊断和治疗提供了新的思路和途径。
本文将分别就这四个研究领域进行介绍,分析其在生物医学领域中的应用和发展前景。
一、非靶和靶向代谢组学1. 非靶代谢组学是指在没有预设代谢产物的假设下,全面分析生物样本中的所有代谢产物。
该技术通过质谱和核磁共振等方法对生物样本中的代谢产物进行检测和分析,从而揭示生物体内的代谢组成和代谢途径。
非靶代谢组学已被广泛应用于疾病的早期诊断、疾病机制的研究和药物的研发等领域,展现出了巨大的应用潜力。
2. 靶向代谢组学则是一种有目的地筛选和分析特定代谢产物的方法。
通过这种技术,研究者可以有针对性地对某些代谢物进行深入研究,从而更好地理解其在疾病发生发展中的作用机制。
靶向代谢组学在肿瘤研究、心血管疾病研究等方面取得了重要进展。
二、转录组学1. 转录组学是一种全面研究生物体内全部转录本的方法。
通过高通量测序技术,研究者可以获得生物样本中所有mRNA的序列信息,从而全面了解生物体内基因的表达情况和调控网络。
转录组学已被广泛应用于肿瘤、免疫系统疾病等领域,为疾病的诊断和治疗提供了重要参考。
2. 近年来,单细胞转录组学技术的发展为转录组学研究带来了新的突破。
该技术能够从单个细胞中获得转录组信息,揭示不同细胞类型和状态下的转录差异,为细胞分化、疾病发生发展等提供了重要线索。
三、蛋白组学1. 蛋白组学是一种全面研究生物体内全部蛋白质的方法。
通过质谱等技术,研究者可以了解生物样本中所有蛋白质的种类、表达水平和修饰情况,从而全面了解蛋白质在生物体内的功能和调控机制。
蛋白组学已被广泛应用于肿瘤标志物的发现、药物靶点的筛选等研究领域。
2. 磷酸化、甲基化等蛋白质修饰的研究成果为蛋白组学研究带来了新的发展方向。
研究者可以通过蛋白组学技术对这些蛋白质修饰进行深入研究,从而揭示它们在疾病发生发展中的作用机制。
非靶向代谢组学结果解读

非靶ห้องสมุดไป่ตู้代谢组学的结果解读主要包括以下几个方面:
1.代谢物识别:对非靶向代谢组学结果进行代谢物的识别和鉴定。这是分析代谢组学数据的首要步骤,需要使用质谱分析技术和数据库匹配等方法,确定代谢物的化学结构和分子式。
4.生物标志物筛选:利用差异分析和通路分析的结果,鉴定出具有临床应用潜力的生物标志物,为疾病的早期诊断和治疗提供有力支持。
总之,非靶向代谢组学结果的解读需要综合运用多种分析方法和技术手段,从不同层面和角度进行分析,从而揭示代谢物变化的生物学意义。
2.差异分析:比较不同样本之间代谢物的含量差异,找出具有显著性差异的代谢物,以及这些代谢物的生物学功能和代谢途径。通过这种方式可以发现不同生理状态或疾病状态下代谢物的变化规律,为进一步的研究提供线索。
3.通路分析:将代谢物按照代谢途径进行分类,分析不同代谢途径的变化趋势,以及这些代谢途径与生物学过程的关系。通过这种方式可以揭示代谢物变化背后的生物学机制,为进一步的研究提供理论基础。
代谢组学非靶向物质鉴定

代谢组学非靶向物质鉴定
代谢组学是一种对生物体内代谢产物进行系统分析的技术,其中包括对非靶向物质的鉴定。
非靶向代谢组学是一种不针对特定代谢产物进行分析的方法,它可以检测到生物体内所有的代谢产物,并对其进行定性和定量分析。
在非靶向代谢组学中,代谢产物的鉴定是一个关键步骤。
通常,代谢产物的鉴定是通过将未知代谢产物的质谱数据与已知代谢产物的数据库进行比对来实现的。
这种方法称为“谱库检索”,它可以根据未知代谢产物的质谱数据与数据库中已知代谢产物的质谱数据进行比对,从而确定未知代谢产物的身份。
然而,由于生物体内代谢产物的数量庞大,且许多代谢产物的结构相似,因此单纯依靠谱库检索往往难以准确鉴定代谢产物。
因此,在非靶向代谢组学中,还需要结合其他技术来提高代谢产物的鉴定准确性。
其中一种常用的技术是“多级质谱”,它可以将代谢产物的质谱数据分解成多个碎片离子的质谱数据,从而提供更多的结构信息。
此外,还可以结合化学结构分析、同位素标记等技术来进一步提高代谢产物的鉴定准确性。
总之,非靶向代谢组学中的代谢产物鉴定是一个复杂的过程,需要结合多种技术和方法来提高准确性。
随着技术的不断发展和完善,代谢产物的鉴定准确性将会不断提高,为生物医学研究提供更有力的支持。
非靶向代谢组学的研究内容

非靶向代谢组学的研究内容非靶向代谢组学是一种新型的研究方法,它提供了可以探索有机体中生物体代谢状态的新思路。
它是以前代谢组学方法的基础上发展起来的,主要通过发现细胞代谢变化的分子特征,可以将有机体的代谢变化描绘出来,帮助我们深入理解生物体的代谢机理和代谢调控机制。
非靶向代谢组学研究对于系统性了解有机体内一系列代谢变化是很有必要的,它可以更全面准确地反映不同环境和遗传突变等因素对有机体代谢状态的影响。
与传统的定量方法(如液相色谱-质谱联用)相比,非靶向代谢组学可以检测较大范围的代谢产物,这可以更全面更准确地反映有机体代谢的变化。
它也可以发现新的代谢物,增加我们对代谢调控机理的认识。
此外,非靶向代谢组学研究也可以帮助我们发现新的生物标志物,如可以用来识别、诊断及监测特定疾病的生物标志物,可以帮助改善疾病治疗的质量。
它也可以用于研究药物对生物体代谢的影响以及药物中毒、代谢紊乱等药物副作用,帮助我们更准确地评价药物的安全性。
另外,非靶向代谢组学也可以用于研究生物体对环境变化的响应机制,可以帮助我们了解有机体如何应对温度变化,空气污染,营养摄入不均衡等环境因素的影响。
它也可以用来研究减排剂转化的代谢机制,让我们更好地理解污染物的毒性机制,找到更有效的减排技术。
在总结,非靶向代谢组学技术在今天已经成为系统性研究有机体代谢状态和变化特点的重要手段,它不仅可以用于评价药物的安全性,还可以用于研究药物的药效,以及有机体对外界环境变化的响应机制,也可以用于研究减排剂的代谢机制,帮助我们发现新的生物标志物,增加我们对有机体内部代谢调控机制的认知。
由于非靶向代谢组学的研究领域十分广泛,正在探索着越来越多的有用信息,为未来有机体研究和治疗带来了希望。
非靶标代谢组学

非靶标代谢组学
“非靶标代谢组学”(Non-targetedMetabolomics)是一个研究方法,用于揭示分子斑块的化学体系统,它以多种代谢物为目标,以全谱学习的方式进行代谢物鉴定,以便探讨未知的代谢反应和调控机制。
它以测定,调控和表征样品中的全部成分为主要目标。
二、非靶标代谢组学的优点
1、它具有很强的普遍性: 它可以用于有机物、无机物和生物样品的分析。
2、它可以发现复杂样品中的新分子种类,这些分子种类可能在现有的靶标方法中被忽略。
3、它可以探索那些尚未知晓的代谢反应机制,并可以为病理生理、分子生物学等研究领域提供支持。
4、它可以收集大量的有效数据,它可以为研究者提供大数据量的资源,这些数据可以用于细胞生物学及其临床应用的研究。
三、非靶标代谢组学的应用
非靶标代谢组学在健康与疾病相关的研究中发挥了重要作用。
它可以帮助研究者深入探究不具现象学意义的生物样品中的代谢物。
比如,它可以被用来解析癌症和神经疾病细胞中的代谢组学。
它可以帮助研究者探讨健康和疾病发生发展过程中参与的代谢物,并可以将这些代谢物作为诊断和治疗疾病的潜在靶点。
同时,非靶标代谢组学也可以用来研究食物的加工和营养学角度。
它可以帮助研究者深入了解食物的成分组成,以及其对人类健康的影响。
基于非靶向代谢组学的老年胃癌患者术前衰弱与代谢综合征代谢特征研究

㊃论 著㊃D O I :10.3969/j.i s s n .1672-9455.2024.04.002基于非靶向代谢组学的老年胃癌患者术前衰弱与代谢综合征代谢特征研究*蒋小曼1,2,郭银宁1,缪雪怡1,徐 婷1,徐欣怡1,3,陈 丽4,季明辉1,许 勤1ә1.南京医科大学护理学院,江苏南京211166;2.浙江大学医学院附属第一医院胃肠外科,浙江杭州310003;3.昆士兰科技大学健康学院,澳大利亚昆士兰4702;4.南京医科大学第一附属医院/江苏省人民医院普外科,江苏南京211166摘 要:目的 基于非靶向代谢组学技术探讨老年胃癌患者术前衰弱与代谢综合征(M e t S )的差异代谢物及代谢通路㊂方法 收集非衰弱非M e t S 胃癌患者25例作为对照组,单纯衰弱组胃癌患者10例作为衰弱组;单纯合并M e t S 的胃癌患者13例作为M e t S 组,衰弱合并M e t S 组胃癌患者10例作为合并组㊂采用超高效液相色谱-质谱联用非靶向代谢组学技术测量血浆代谢物水平,采用主成分分析法㊁正交偏最小二乘法-模式识别分析法㊁聚类分析及代谢通路注释进行多元统计分析㊂结果 基于非靶向代谢组学技术鉴定出了125种差异代谢物,包括氨基酸㊁甘油磷脂㊁鞘脂㊁脂肪酸㊁糖类㊁核苷及核苷酸㊁酸性化合物等类别㊂与对照组比较,M e t S组㊁衰弱组㊁合并组分别存在41㊁32㊁52种差异代谢物㊂其中M e t S 组以脂质代谢物明显升高为特征;衰弱组以氨基酸及多数甘油磷脂类代谢物明显下降,且脂肪酸类及植物鞘氨醇明显升高为特征;合并组以核苷酸类代谢物及酸性化合物明显升高为特征㊂丙氨酸㊁天门冬氨酸㊁谷氨酸代谢途径在衰弱组中明显富集,甘油磷脂代谢途径在合并组中明显富集㊂结论 单纯衰弱㊁单纯合并M e t S 以及衰弱合并M e t S 的老年胃癌患者存在不同的代谢特征,其中衰弱的老年胃癌患者氨基酸与甘油磷脂类代谢物均明显下降,需重视脂肪与蛋白质全面补充,M e t S 合并衰弱患者存在氨基酸㊁脂质㊁核苷酸㊁酸性化合物等多类代谢物异常,可能与肿瘤相关代谢紊乱有关㊂关键词:衰弱; 代谢综合征; 老年人; 胃癌; 非靶向代谢组学中图法分类号:R 735.2文献标志码:A文章编号:1672-9455(2024)04-0437-07M e t a b o l i c c h a r a c t e r i s t i c s o f p r e o p e r a t i v e f r a i l t y a n d m e t a b o l i c s y n d r o m e a m o n g ol d e r p a t i e n t s w i t h g a s t r i c c a n c e r b a s e d o n n o n -t a r ge t e d m e t a b o l o m i c *J I A N G X i a o m a n 1,2,G U O Y i n n i n g 1,M I A O X u e y i 1,X U T i n g 1,X U X i n yi 1,3,C H E N L i 4,J I M i n gh u i 1,X U Q i n 1ә1.S c h o o l o f N u r s i n g ,N a n j i n g M e d i c a l U n i v e r s i t y ,N a n j i n g ,J i a n g s u 211166,C h i n a ;2.D e p a r t m e n t o f G a s t r o i n t e s t i n a l S u r g e r y ,t h e F i r s t A f f i l i a t e d H o s p i t a l o f Z h e j i a n g U n i v e r s i t y S c h o o l o f Me d i c i n e ,H a n g z h o u ,Z h e j i a n g 310003,C h i n a ;3.F a c u l t y of H e a l t h ,Q u e e n s l a n d U n i v e r s i t y o f T e c h n o l og y ,Q u e e s l a n d 4702,A u s t r a l i a ;4.D e p a r t m e n t o f G e n e r a l S u r g e r y ,t h e F i r s t A f f i l i a t e d H o s p i t a l o fN a n j i n g M e d i c a l U n i v e r s i t y /J i a n s u P r o v i n c i a l P e o p l e 's H o s p i t a l ,N a n j i n g ,J i a n g s u 211166,C h i n a A b s t r a c t :O b je c t i v e T o i n v e s t i g a t e t h e d if f e r e n t i a l m e t a b o l i t e s a n d m e t a b o l i c p a t h w a y s b e t w e e n p r e o p e r -a t i v e f r a i l t y a n d m e t a b o l i c s y n d r o m e (M e t S )i n e l d e r l y p a t i e n t s w i t hg a s t r i c c a n c e r b a s e d o n n o n -t a r ge t e d m e t a b o l o m i c s t e c h n i q u e s .M e t h o d s A t o t a l of 25p a t i e n t s w i t h n o n -f r a i l t y an d n o n -M e t S w e r e c o l l e c t e d a s c o n t r o l g r o u p ,10p a t i e n t s w i t h f r a i l t y a l o n e a s d e b i l i t a t e d g r o u p,13p a t i e n t s w i t h M e t S a l o n e i n t h e M e t S g r o u p a n d 10p a t i e n t s w i t h f r a i l t y c o m b i n e d w i t h M e t S i n t h e c o m b i n e d g r o u p .T h e p l a s m a m e t a b o l i t e c o n t e n t w a s m e a s u r e d b y U l t r a H i g h P e r f o r m a n c e L i q u i d C h r o m a t o g r a p h y -Q E x a c t i v e O r b i t r a p -M a s s S p e c t r o m e t r yn o n -t a r g e t e d m e t a b o l o m i c t e c h n i q u e ,a n d m u l t i v a r i a t e s t a t i s t i c a l a n a l y s i s w a s p e r f o r m e d b y p r i n c i p a l c o m po -n e n t a n a l y s i s ,o r t h o g o n a l p a r t i a l l e a s t s q u a r e s d i s c r i m i n a n t a n a l y s i s ,c l u s t e r a n a l y s i s a n d m e t a b o l i c p a t h w a ya n n o t a t i o n .R e s u l t s A t o t a l o f 125d i f f e r e n t m e t ab o l i t e s i nc l ud i n g a m i n o a c i d s ,g l y ce r o p h o s p h o l i p i d s ,s p h i n go -l i p i d s ,f a t t y a c i d s ,s u g a r s ,n u c l e o s i d e s a n d n u c l e o t i d e s ,a c i d c o m p o u n d s w e r e i d e n t i f i e d b a s e d o n n o n -t a r ge t e d m e t a b o l o m i c s t e c h n i q u e s .C o m p a r e d w i t h t h e c o n t r o l g r o u p,t h e r e w e r e 41,32a n d 52d i f f e r e n t m e t a b o l i t e s i n ㊃734㊃检验医学与临床2024年2月第21卷第4期 L a b M e d C l i n ,F e b r u a r y 2024,V o l .21,N o .4*基金项目:国家自然科学基金面上项目(82073407);江苏高校优势学科建设工程项目 护理学 [苏政办发(2018)87号)]㊂ 作者简介:蒋小曼,女,硕士研究生,主要从事消化道肿瘤患者围术期营养代谢管理研究㊂ ә 通信作者,E -m a i l :q i n x u @n j m u .e d u .c n ㊂ 网络首发 h t t p://k n s .c n k i .n e t /k c m s /d e t a i l /50.1167.R.20240204.1017.002.h t m l (2024-02-06)t h e M e t S g r o u p,t h e d e b i l i t a t e d g r o u p a n d t h e c o m b i n e d g r o u p r e s p e c t i v e l y.L i p i d m e t a b o l i t e s i n c r e a s e d s i g n i f i-c a n t l y i n t h e M e t S g r o u p.I n t h e d e b i l i t a t e d g r o u p,a m i n o a c i d m e t a b o l i t e s a n d m o s t g l y c e r o l p h o s p h o l i p i d s d e-c r e a s e d s i g n i f i c a n t l y,a n d f a t t y a c i d s a n d s p h i n g o s i n e i n c r e a s e d s i g n i f i c a n t l y.T h e c o m b i n e d g r o u p w a s c h a r a c-t e r i z e d b y s i g n i f i c a n t l y i n c r e a s e d l e v e l s o f n u c l e o t i d e m e t a b o l i t e s a n d a c i d i c c o m p o u n d s.T h e m e t a b o l i c p a t h-w a y s o f a l a n i n e,a s p a r t a t e a n d g l u t a m a t e w e r e o b v i o u s l y e n r i c h e d i n t h e d e b i l i t a t e d g r o u p,a n d g l y c e r o p h o s p h o-l i p i d m e t a b o l i c p a t h w a y w a s o b v i o u s l y e n r i c h e d i n t h e c o m b i n e d g r o u p.C o n c l u s i o n T h e r e a r e d i f f e r e n t m e t a-b o l i c c h a r a c t e r i s t i c s i n p a t i e n t s w i t h M e t S,f r a i l t y a n d M e t S c o m b i n e d w i t h f r a i l t y.I n p a t i e n t s w i t h f r a i l t y,a-m i n o a c i d s a n d g l y c e r o p h o s p h o l i p i d m e t a b o l i t e s d e c r e a s e d s i g n i f i c a n t l y,a n d c o m p r e h e n s i v e s u p p l e m e n t a t i o n o f f a t a n d p r o t e i n s h o u l d b e e m p h a s i z e d.I n p a t i e n t s w i t h M e t S c o m b i n e d w i t h f r a i l t y,t h e r e a r e a b n o r m a l m e t a b-o l i t e s o f a m i n o a c i d s,l i p i d s,n u c l e o t i d e s,a c i d i c c o m p o u n d s a n d o t h e r t y p e s o f m e t a b o l i t e s,w h i c h m a y b e r e l a t-e d t o t u m o r-r e l a t e d m e t a b o l i c d i s o r d e r s.K e y w o r d s:f r a i l t y; m e t a b o l i c s y n d r o m e;o l d p e o p l e;g a s t r i c c a n c e r;n o n-t a r g e t e d m e t a b o l o m i c衰弱与代谢综合征(M e t S)均是常见的老年人健康问题,可作为疾病负担加剧癌症患者不良预后的发生㊂既往研究显示,二者在发病机制层面可能存在密切联系[1],然而现阶段衰弱机制尚不明确,研究显示衰弱的发生机制可能涉及内分泌失调㊁炎症反应增强㊁免疫功能障碍㊁代谢失衡㊁氧化应激损伤等多个系统的病理生理过程,并且各系统间相互关联[2]㊂另外,癌症本身就是一种代谢性疾病,肿瘤细胞可改变代谢途径,造成代谢重编程,使机体处于特异性的代谢状态,并形成有别于正常细胞与其周围组织的微环境[3-4]㊂在此状态下,衰弱所形成的代谢特征及与M e t S老年胃癌患者的间的联系尚不明确㊂代谢组学可以对机体小分子代谢物进行全面分析,从而反映基因组和环境在个体水平上相互作用的最终结果,在癌症患者的健康管理中具有重要价值[5]㊂因此,本研究基于非靶向代谢组学检测技术分析衰弱及M e t S代谢特征,以及潜在作用途径,阐明其对监测术前营养代谢水平㊁确定干预靶点及制订精准衰弱管理方案的意义㊂1资料与方法1.1一般资料选取2021年8月至2022年8月南京医科大学第一附属医院/江苏省人民医院普外科胃外病区收治的58例胃癌老年患者为研究对象㊂(1)纳入标准:①年龄为65~80岁的老年人[6];②经胃镜与C T检查确诊为胃癌,初次接受胃癌根治术;③神志清楚,能进行简单书面及语言交流㊂(2)排除标准:①因严重躯体疾病㊁认知障碍或精神疾病无法配合完成研究;②患严重传染性疾病;③合并其他部位肿瘤;④存在严重心脑血管疾病,肝㊁肾及肺功能不全;⑤体内安装有金属医疗器械;⑥服用影响身体成分测量的药物;⑦术前接受过新辅助治疗[7]㊂根据诊断,以非衰弱非M e t S的胃癌患者25例作为对照组,单纯衰弱胃癌患者10例作为衰弱组;单纯合并M e t S的胃癌患者13例作为M e t S组,衰弱合并M e t S的胃癌患者10例作为合并组㊂采用F r i e d衰弱表型量表进行衰弱测量[8],采用‘中国2型糖尿病防治指南(2020年版)“[9]作为M e t S诊断标准㊂所有研究对象自愿配合参加本研究,并签订知情同意书,本研究经南京医科大学伦理审查委员会审查批准[批件号:南医大伦审(2022) 746号],且在中国临床试验注册中心进行注册(注册号:C h i C T R2200060615)㊂1.2仪器与试剂主要仪器包括高分辨质谱仪(QE x a c t i v e HF X,T h e r m o F i s h e r S c i e n t i f i c)㊁超高压液相色谱仪(V a n q u i s h,T h e r m o F i s h e r S c i e n t i f i c)㊁离心机(H e r a e u s F r e s c o17,T h e r m o F i s h e r S c i e n t i f i c)㊁天平(B S A124S-C W,S a r t o r i u s)㊁超声仪(P S-60A L,深圳雷德邦)㊂主要试剂包括甲醇㊁乙腈㊁乙酸铵㊁氨水㊁超纯水等㊂1.3方法1.3.1资料收集采集患者年龄㊁性别㊁体质量指数(B M I)㊁合并症情况㊁服用药物数量(多重用药定义为同时服用ȡ4种药物)[10]㊁营养风险筛查量表2002 (N R S2002)[11]㊁吸烟史㊁饮酒史㊁T NM肿瘤分期㊁腰围等临床资料㊂1.3.2标本采集及预处理嘱患者禁食12h后于清晨空腹状态下采集肘正中静脉外周血5m L,置于含抗凝剂乙二胺四乙酸(E D T A)的采血管中,混匀血液和抗凝剂,然后以4ħ,1300ˑg离心力离心10 m i n分离血清, 80ħ冷冻保存标本㊂检测时室温解冻,移取100μL标本至E P管中,加入400μL提取液[甲醇ʒ乙腈=1ʒ1(V/V),含同位素标记内标混合物],振荡混匀后离心(4ħ,12000r/m i n,15m i n),取上清液于进样瓶中上机检测㊂所有标本另取等量上清液混合成Q C样品上机检测㊂1.3.3血浆样品分析条件使用超高效液相色谱仪,通过W a t e r s A C Q U I T Y U P L C B E H A m i d e(2.1 mmˑ100mm,1.7μm)液相色谱柱对目标化合物进行色谱分离㊂液相色谱A相为水相,含25mm o l/L 乙酸铵和25mm o l/L氨水,B相为乙腈㊂样品盘温度:4ħ;进样体积:2μL㊂高分辨质谱仪能够在控制软件(X c a l i b u r,T h e r m o)控制下进行一级㊁二级质谱数据采集㊂详细参数如下:护套气流量30A r b,辅助气流量25A r b,毛细管温度350ħ,全m s分辨率㊃834㊃检验医学与临床2024年2月第21卷第4期 L a b M e d C l i n,F e b r u a r y2024,V o l.21,N o.4120000,m s /m s 分辨率7500,碰撞能量N C E 模式10/30/60,喷雾电压3.6k V (+)或 3.2k V ()㊂1.4 统计学处理 采用S P S S 26.0统计软件进行数据处理及统计分析㊂符合正态分布的计量资料以x ʃs 表示,多组间比较采用方差分析;计数资料以频数或百分率表示,组间比较采用χ2检验㊂以P <0.05为差异有统计学意义㊂代谢组检测原始数据经P r o t e o W i z a r d 软件转成m z X M L 格式后,使用R 程序包(内核为X C M S )进行峰识别㊁峰提取㊁峰对齐和积分等处理,然后与B i o t r e e D B (V 2.1)自建二级质谱数据库匹配进行物质注释,采用偏离值过滤㊁缺失值过滤㊁缺失值填补㊁数据标准化处理等方式对原始数据进行预处理㊂使用S I M C A 软件(V 16.0.2,S a r t o r i u sS t e d i m 数据分析公司,瑞典)进行主成分分析(P C A )及正交偏最小二乘法-模式识别分析(O P L S -D A )㊂以变量投影重要度(V I P )>1.0且P <0.05为标准筛选差异代谢物,基于京都基因与基因组百科全书(K E G G )数据库进行差异代谢物代谢通路注释,并对差异代谢物所在通路进行综合分析,进一步筛选出与代谢物相关性最高的关键通路㊂2 结 果2.1 各组基线资料比较 衰弱组年龄明显大于对照组,差异有统计学意义(P <0.05);M e t S 组与合并组的B M I 及合并症发生率明显高于对照组,差异有统计学意义(P <0.05);各组其他基线资料比较,差异无统计学意义(P >0.05)㊂见表1㊂2.2 多元统计分析结果 P C A 结果显示,M e t S 组与对照组㊁衰弱组与对照组㊁合并组与对照组的x 变量的解释性(R 2X )分别为0.501㊁0.526㊁0.520,表明各组的预测率可达50.1%㊁52.6%㊁52.0%,并且3组模型的主成分个数均为6,各组间均存在明显生物学代谢差异,见图1a ㊁b ㊁c ㊂在此基础上,进行O P L S -D A ,结果显示3组两样本间分离良好,代谢物轮廓存在明显区别,见图2a ㊁b ㊁c ㊂M e t S 组与对照组㊁衰弱组与对照组㊁合并组与对照组的拟合度(R 2Y )及预测度(Q 2)分别为0.953与0.109㊁0.922与0.193㊁0.891与0.185㊂2.3 组间差异代谢物筛选 本研究使用的卡值标准为t 检验的P <0.05且O P L S -D A 模型第一主成分的V I P >1.0㊂根据代谢物的二级质谱碎片信息对化合物进行定性后筛选各组正负离子模式下全部差异代谢物㊂与对照组比较,M e t S 组共检测出41种具有明显差异的代谢产物,主要涉及氨基酸类(7个)㊁脂质类(甘油磷脂类9个㊁鞘脂类1个㊁脂肪酸类6个)及糖类(6个),除多数脂质代谢物明显上调外,其他代谢物多数明显下调㊂衰弱组患者共检测出32种具有明显差异的代谢产物,主要涉及氨基酸类(5个)与脂质类(甘油磷脂类10个㊁鞘脂类1个㊁脂肪酸类6个),其中植物鞘氨醇等鞘脂类代谢物及花生四烯酸㊁琥珀酸半醛㊁肉豆蔻酸㊁α-亚麻酸㊁10E ,12Z -亚油酸5种脂肪酸类代谢物明显上调,精氨酰丙氨酸㊁N -乙酰缬氨酸㊁D -瓜氨酸㊁L -缬氨酸㊁L -天冬酰胺等5种氨基酸及大多数甘油磷脂类代谢物整体明显下调㊂合并组患者共检测出52种具有明显差异的代谢产物,涉及氨基酸类(9个)㊁脂质类(甘油磷脂类5个㊁鞘脂类3个㊁脂肪酸类5个)㊁核苷及核苷酸类(7个)㊁糖类(2个)及酸性化合物类(6个)等,其中假尿苷㊁N -乙酰胞嘧啶核苷㊁乳清酸核苷等5种核苷酸及多巴胺-3-O -硫酸盐等4种酸性化合物明显上调㊂植物鞘氨醇明显升高是衰弱组与合并组的共同特征㊂根据V I P 值排序,各组前10种代谢物见表2~4㊂表1 各组基线资料比较[x ʃs 或n (%)]组别n年龄(岁)B M I(k g/m 2)性别(女)合并症多重用药N R S 2002ȡ3分吸烟史饮酒史T N M Ⅲ期对照组2566.76ʃ5.1622.88ʃ2.107(28.0)10(40.0)1(4.0)7(28.0)12(48.0)10(40.0)9(36.0)衰弱组1073.30ʃ5.94*22.48ʃ2.004(40.0)7(70.0)0(0.0)2(20.0)4(40.0)5(50.0)5(50.0)M e t S 组1367.08ʃ4.8925.15ʃ3.15*4(30.8)13(100.0)*3(23.1)3(23.1)6(46.2)8(61.5)4(30.8)合并组1068.90ʃ6.3326.33ʃ3.33*5(50.0)9(90.0)*1(10.0)2(20.0)4(40.0)4(40.0)7(70.0) 注:与对照组比较,*P <0.05㊂注:a 为M e t S 组与对照组;b 为衰弱组与对照组;c 为合并组与对照组;A 为对照组;B 为M e t S 组;C 为衰弱组;D 为合并组;P C 1为主成分1;P C 2为主成分2㊂图1 P C A 图㊃934㊃检验医学与临床2024年2月第21卷第4期 L a b M e d C l i n ,F e b r u a r y 2024,V o l .21,N o .42.4 差异代谢物的代谢通路分析 将筛选出的差异代谢物导入K E G G 代谢通路数据库进行代谢通路富集分析,以I m p a c t >0.1且P <0.05为标准,筛选3组差异性代谢通路㊂与对照组比较,M e t S 组无明显代谢途径,衰弱组差异代谢物主要涉及丙氨酸㊁天门冬氨酸和谷氨酸代谢途径,合并组差异代谢物主要涉及甘油磷脂代谢途径,见表5㊂注:a 为M e t S 组与对照组;b 为衰弱组与对照组;c 为合并组与对照组;A 为对照组;B 为M e t S 组;C 为衰弱组;D 为合并组;t [1]O 为正交主成分得分;t [1]P 为第一主成分的预测主成分得分㊂图2 O P L S -D A 得分散点图表2 M e t S 组与对照组的差异代谢物信息M S 2名称M S 2分中文名称V I P差异倍数PR i b o t h ym i d i n e 0.9771844625-甲基尿甙2.8752355980.8530993520.001134499L ys o P C (20:3(5Z ,8Z ,11Z ))0.431478462甘油磷脂类2.6173799751.3162265430.003088506S u c r o s e0.987960154蔗糖2.5050828560.2940775550.0092852672-M e t h y l gl u t a r i c a c i d 0.8686397692-甲基戊二酸2.4929297280.8800900960.000744468P C (22:5(4Z ,7Z ,10Z ,13Z ,16Z )/18:0)0.761099923甘油磷脂类2.4308029591.1974632850.010332442P C (22:2(13Z ,16Z )/16:1(9Z ))0.814371846甘油磷脂类2.4194025771.3722344680.003903413β-A l a n i n e 1.000000000β-丙氨酸2.3878469251.1910572450.011582586O r o t i d i n e0.755108923乳清酸核苷2.3857764001.2853977540.004340145P C (P -18:1(11Z )/14:0)0.724108077甘油磷脂类2.3733490520.6726785820.0092379892-b e n z yl b u t a n e d i o i c a c i d 0.671941538α-苄基丁二酸2.3096475680.6017090130.021099278表3 衰弱组与对照组的差异代谢物信息M S 2名称M S 2分中文名称V I P差异倍数PP h y t o s p h i n g o s i n e 0.454496692植物鞘氨醇3.6575342411.2943239764.96942ˑ10-5E t h y l b e n z e n e 0.999986538乙基苯2.9333138070.7791382283.49882ˑ10-5A r g i n yl -A l a n i n e 0.538666308精氨酰-丙氨酸2.6372623630.6708075349.32837ˑ10-5b e t a -D -G l uc o s a m i n e 0.479228462β-D -氨基葡萄糖2.5235296621.7067885450.0405522112,3-D i m e t h y l -2-c y c l o h e x e n -1-o n e 0.583867615酮类2.4269920740.7450059710.003652162N -A c e t yl v a l i n e 0.523245077N -乙酰-D L -缬氨酸2.4257567670.5480965776.01189E -05A l p h a -d i m o r ph e c o l i c a c i d 0.979338000脂肪酸类2.4228249910.5918280420.01624548A r a c h i d o n i c a c i d0.626860308花生四烯酸2.417838571.4488713310.006223154D -C i t r u l l i n e0.996183538D -瓜氨酸2.3540912350.7380504590.014028588S u c c i n i c a c i d s e m i a l d e h yd e 0.973268385琥珀酸半醛2.3107307571.4149796130.045517081表4 合并组与对照组的差异代谢物信息M S 2名称M S 2分中文名称V I P差异倍数P2-A m i n o a c e t o p h e n o n e 1.000000000芳香类化合物2.9618045132.1969074220.015884556A l p h a -N -P h e n y l a c e t y l -L -g l u t a m i n e 0.999461308α-N -苯乙酰基-L -谷氨酰胺2.9227374652.9285942660.015713599A r g i n yl -A l a n i n e 0.538666308精氨酰丙氨酸2.8707195410.5778067670.000093284P s e u d o u r i d i n e 0.761171308假尿苷2.6547583981.2094684190.010376872㊃044㊃检验医学与临床2024年2月第21卷第4期 L a b M e d C l i n ,F e b r u a r y 2024,V o l .21,N o .4续表4合并组与对照组的差异代谢物信息M S2名称M S2分中文名称V I P差异倍数PN-M e t h y l n i c o t i n a m i d e0.695534769N-甲基烟酰胺2.5965653500.4361873880.023415222 D o p a m i n e3-O-s u l f a t e0.583639154多巴胺-3-O-硫酸盐2.5083484821.4745594600.045180328 C h o l i n e1.000000000胆碱2.4857580300.8746595130.004134701 N4-A c e t y l c y t i d i n e0.990193846N-乙酰胞嘧啶核苷2.4857517261.4589211220.001565543 N-A c e t y l-L-a l a n i n e0.907531231N-乙酰-L-丙氨酸2.4628962661.1450115180.020139388 B i l i v e r d i n0.981282462胆绿素2.4451973020.4899045040.003203639表5各组关键代谢途径及代谢物组别路径H i t s I m p a c t R a w P M e t S组果糖与甘露糖代谢山梨醇㊁甘露醇0.008870.0076735半乳糖代谢山梨醇0.000000.1134500乙醛酸盐和二羧酸盐代谢乙醇酸0.006860.1368100花生四烯酸代谢花生四烯酸0.216690.1671500衰弱组丙氨酸㊁天门冬氨酸和谷氨酸代谢L-天冬氨酸㊁琥珀酸半醛0.102560.0069520维生素B6代谢吡多胺㊁琥珀酸半醛0.000000.0121920生物素代谢生物素0.203250.0579490丁酸甲酯代谢琥珀酸半醛0.033430.1962000-L-古洛糖酸-γ-内酯0.090140.2180500花生四烯酸代谢途径琥珀酸半醛0.216690.2883000合并组甘油磷脂代谢胆碱㊁乙醇胺磷酸酯㊁甘油磷酰胆碱0.102340.0037066鞘脂代谢植物鞘氨醇㊁乙醇胺磷酸酯0.012880.0175530谷胱甘肽代谢谷胱甘肽0.237430.2735200淀粉和蔗糖代谢海藻糖0.009440.3439500卟啉和叶绿素代谢胆绿素0.018440.5880900注:-为无数据㊂3讨论本研究以非衰弱非M e t S老年胃癌患者为对照组,基于非靶向超高效液相色谱-质谱联用技术探究了衰弱组㊁M e t S组与合并组的差异代谢物及代谢通路㊂结果显示,与对照组比较,M e t S组以甘油磷脂类等脂质代谢物明显升高为特征;衰弱组以D-瓜氨酸㊁L-缬氨酸㊁L-天冬酰胺等氨基酸代谢物及多数甘油磷脂明显下降,且肉豆蔻酸㊁α-亚麻酸等脂肪酸及植物鞘氨醇明显升高为特征;合并组以假尿苷㊁N-乙酰胞嘧啶核苷㊁乳清酸核苷等核苷酸类代谢物及多种酸性化合物明显升高为特征㊂丙氨酸㊁天门冬氨酸和谷氨酸代谢途径在衰弱组中明显富集,甘油磷脂代谢途径在合并组中明显富集㊂氨基酸代谢是蛋白质分解的中心内容,在肿瘤微环境中免疫细胞激活和功能发挥中也有重要作用[12]㊂与对照组比较,衰弱组精氨酰丙氨酸㊁N-乙酰缬氨酸㊁D-瓜氨酸㊁L-缬氨酸㊁L-天冬酰胺这5种氨基酸类物质全部明显下降,除了与衰弱过程中肌肉质量或力量减少外有关[13],N E P A L等[14]发现D-瓜氨酸㊁L-缬氨酸㊁L-天冬酰胺是与衰老相关的代谢物,提示衰弱与衰老之间可能存在相同的代谢物与调节通路㊂国外研究者基于欧洲M e t a b o F r a i l项目对衰弱合并糖尿病人群及衰弱对照人群进行了37种氨基酸靶向测定,揭示了老年糖尿病衰弱患者的特异性氨基酸代谢特征[15]㊂合并组产生明显代谢变化的谷氨酰胺[16]㊁谷胱甘肽[17]㊁N-乙酰-L-丙氨酸[18]㊁正缬氨酸[19]㊁(S)-β-氨基异丁酸[20]等氨基酸类物质已被发现与肿瘤发生㊁发展㊁治疗及预后密切相关,因此,未来研究可关注衰弱及M e t S人群肿瘤相关代谢差异,揭示其氨基酸代谢模式㊂脂质代谢重编程是肿瘤代谢的重要特征之一,肿瘤细胞能够增加脂肪酸的摄取和氧化以产生能量和脂质积累,并且脂肪酸代谢异常可影响肿瘤发生㊁发展[21-22]㊂尽管衰弱组多数甘油磷脂类代谢物明显下调,但植物鞘氨醇这一鞘脂类代谢物明显升高,这也是衰弱组与合并组的共同特征㊂动物实验研究结果显示植物鞘氨醇与大鼠衰老存在正相关关系[23],提示衰弱组与合并组在衰老层面的代谢关联㊂此外, R A T T R A Y等[24]基于英国老龄化队列研究对1191㊃144㊃检验医学与临床2024年2月第21卷第4期 L a b M e d C l i n,F e b r u a r y2024,V o l.21,N o.4例人群进行血清非靶向分析,提出在衰弱状态下机体整体脂质发生改变,与衰弱相关的肉碱水平降低可能是细胞脂质代谢恶化的潜在迹象㊂代谢通路分析结果显示,合并组甘油磷脂代谢途径明显富集,尽管从临床诊断或评估指标层面合并组同时具备了衰弱与M e t S的特征,但其脂肪代谢特征不同于其他两组,研究者需关注此组人群细胞脂质代谢情况,基于前瞻性研究验证其预后㊂核苷酸代谢被认为是肿瘤发生和肿瘤细胞复制的最关键环节[25]㊂研究显示,肿瘤组织合成D N A和R N A的聚合酶活性较正常组织高,核苷酸合成增加且分解减少,因此,在癌症状态下核苷酸代谢物上调以满足肿瘤细胞不受控制和快速的自我增殖需求[26-27]㊂假尿苷[28]及N-乙酰胞嘧啶核苷[29]水平上调㊁5-甲基胞嘧啶[30]水平下调等合并组产生的核苷酸类代谢物质变化已被发现与癌症诊断㊁肿瘤侵袭转移㊁治疗及预后密切相关,这预示了合并组代谢异常受肿瘤细胞本身影响更大,后续需进一步关注肿瘤相关临床指标及治疗预后㊂另外,机体内酸碱平衡失调也是造成代谢差异的重要因素,例如酸性环境会增强泛酸介导的蛋白质降解途径并减弱肌肉生物合成相关信号通路,最终导致肌肉蛋白分解增加[31-32]㊂其中,酸中毒是肿瘤组织代谢环境的基本特征之一,表现为细胞内碱性和细胞外酸性的微环境[3]㊂本研究结果显示,合并组区别于其他组的代谢特征之一为多种酸性化合物明显升高,这可能与合并组患者较高的肿瘤分期有关㊂酸性细胞外环境可增加胆固醇合成酶的表达,有助于肿瘤细胞生长,并降低肿瘤患者生存率,因此,通过调节肿瘤微环境以改善肿瘤患者预后也是进行代谢调控的重要方式之一[33]㊂本研究结果显示,与对照组比较,衰弱组丙氨酸㊁天门冬氨酸和谷氨酸代谢途径明显富集,合并组甘油磷脂代谢途径明显富集㊂A N G I O N I等[34]基于MA P T研究数据进行了二次分析,区分了年龄相关衰弱与疾病相关衰弱的临床特征,并提出需根据具体特征采取不同的衰弱预防和管理策略㊂这提示尽管现有的评估工具可明确区分衰弱与非衰弱,但只能识别已发生的临床表现,不能反映衰弱相关的病理㊁生理过程,而相同的表型所对应的病因及疾病发展机制不同,即使给予同样的干预措施,所得效果也有所差异㊂未来可探索氨基酸或脂肪代谢调节对年龄相关衰弱与疾病相关衰弱人群衰弱发生㊁发展的作用,并制订特异性的代谢调节措施㊂然而值得注意的是,O P L S-D A得到的R2Y表示模型的可解释性,R2Y>0.5说明所建模型有效性高, Q2表示模型的可预测性,Q2>0.45说明模型对于后续样本的预测结果合理,可做出有意义预测㊂在本研究中,3组R2Y均大于0.5,但Q2值较低,说明所建模型有效性较高,可解释各组两样本间的代谢物差异现象,但若有新的数据参与构建模型,对其分组准确度的可预测性较低㊂这可能与本研究所纳入样本较少㊁研究场所单一有关㊂综上所述,衰弱的老年胃癌患者以氨基酸与甘油磷脂类代谢物明显下调㊁脂肪酸类代谢物明显上调为特征,合并M e t S的老年胃癌患者以脂质类代谢物明显上调为特征㊂衰弱合并M e t S患者存在氨基酸㊁脂质㊁核苷酸㊁酸性化合物等多类代谢物异常,可能与肿瘤相关代谢紊乱有关㊂未来研究者需关注相同衰弱表型下所对应的不同病因及疾病发展机制,给予针对性㊁靶向性的衰弱干预措施㊂然而本研究所纳入的样本较少,数据预测性不足,推广性有限,未来仍需要基于大样本血液检测数据对本研究结果进行验证㊂参考文献[1]蒋小曼,丁玲玉,朱涵菲,等.老年人衰弱与代谢综合征关系的研究进展[J].实用老年医学,2022,36(10):1054-1057.[2]WA N G J,MA XW E L L C A,Y U F.B i o l o g i c a l p r o c e s s e sa n db i o m a r k e r s r e l a t e d t o f r a i l t y i n o l d e r a d u l t s:a s t a t e-o f-t h e-sc i e n c e l i t e r a t u r e r e v i e w[J].B i o l R e s N u r s,2019, 21(1):80-106.[3]曹晓雪,宋光.胃癌的肿瘤微环境研究进展[J].现代生物医学进展,2014,14(31):6177-6179.[4]高红梅,杨仕仪.肿瘤氨基酸代谢研究进展[J].解放军医药杂志,2021,33(8):112-116.[5]S C HM I D T D R,P A T E L R,K I R S C H D G,e t a l.M e t a b o-l o m i c s i n c a n c e r r e s e a r c h a n d e m e r g i n g a p p l i c a t i o n s i n c l i n i c a l o n c o l o g y[J].C A C a n c e r J C l i n,2021,71(4):333-358.[6]J I A N G X,X U X,D I N G L,e t a l.T h e a s s o c i a t i o n b e t w e e nm e t a b o l i c s y n d r o m e a n d p r e s e n c e o f f r a i l t y:a s y s t e m a t i c r e v i e w a n d m e t a-a n a l y s i s[J].E u r G e r i a t r M e d,2022,13(5):1047-1056.[7]X U X Y,J I A N G X M,X U Q,e t a l.S k e l e t a l m u s c l ec h a n g ed u r i n g ne o a d j u v a n t t h e r a p y a n d i t s i m p a c t o np r o g n o s i s i n p a t i e n t s w i t h g a s t r o i n t e s t i n a l c a n c e r s:a s y s-t e m a t i c r e v i e w a n d M e t a-a n a l y s i s[J].F r o n t O n c o l,2022, 12:892935.[8]F R I E D L P,T A N G E N C M,WA L S T O N J,e t a l.F r a i l t yi n o l d e r a d u l t s:e v i d e n c e f o r a p h e n o t y p e[J].J G e r o n t o l AB i o l S c i M e d S c i,2001,56(3):M146-M156.[9]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2020年版)[J].中华内分泌代谢杂志,2021,37(4):311-398.[10]B A HA T G,T U F A N F,B A HA T Z,e t a l.C o m o r b i d i t i e s,p o l y p h a r m a c y,f u n c t i o n a l i t y a n d n u t r i t i o n a l s t a t u s i n T u r k i s h c o mm u n i t y-d w e l l i n g f e m a l e e l d e r l y[J].A g i n gC l i n E x p R e s,2014,26(3):255-259.[11]K O N D R U P J,R A S MU S S E N H H,HAM B E R G O,e t a l.㊃244㊃检验医学与临床2024年2月第21卷第4期 L a b M e d C l i n,F e b r u a r y2024,V o l.21,N o.4N u t r i t i o n a l r i s k s c r e e n i n g(N R S2002):a n e w m e t h o db a s e d o n a n a n a l y s i s o fc o n t r o l l ed c l i n i c a l t r i a l s[J].C l i nN u t r,2003,22(3):321-336.[12]Q I U H,S HA O N,L I U J,e t a l.A m i n o a c i d m e t a b o l i s m i n t u m o r:n e w s h i n e i n t h e f o g?[J].C l i n N u t r,2023,42(8):1521-1530.[13]C A L V A N I R,P I C C A A,MA R I N I F,e t a l.A d i s t i n c t p a t-t e r n o f c i r c u l a t i n g a m i n o a c i d s c h a r a c t e r i z e s o l d e r p e r s o n s w i t h p h y s i c a l f r a i l t y a n d s a r c o p e n i a:r e s u l t s f r o m t h e b i o-s p h e r e s t u d y[J].N u t r i e n t s,2018,10(11):1691. [14]N E P A L M,MA C,X I E G,e t a l.F a n c o n i A n e m i a c o m p l e-m e n t a t i o n g r o u p C p r o t e i n i n m e t a b o l i c d i s o r d e r s[J].A g-i n g(A l b a n y N Y),2018,10(6):1506-1522.[15]C A L V A N I R,R O D R I G U E Z-MAÑA S L,P I C C A A,e ta l.I d e n t i f i c a t i o n o f a c i r c u l a t i n g a m i n o a c i d s i g n a t u r e i nf r a i l o l d e r p e r s o n s w i t h t y p e2d i a b e t e s m e l l i t u s:r e s u l t sf r o m t h e m e t a b o f r a i l s t u d y[J].N u t r i e n t s,2020,12(1):199.[16]徐晓霞,朱华,杨志.肿瘤谷氨酰胺代谢变化及诊疗新靶点[J].中华肿瘤防治杂志,2019,26(17):1306-1310.[17]杨凤娟,谭宁,张天禹,等.谷胱甘肽在肿瘤细胞发生铁死亡过程中的作用研究[J].世界华人消化杂志,2021,29(15):901-907.[18]L V J,J I A H,MO M,e t a l.C h a n g e s o f s e r u m m e t a b o l i t e s l e v e l s d u r i n g n e o a d j u v a n t c h e m o r a d i a t i o n a n d p r e d i c t i o n o f t h e p a t h o l o g i c a l r e s p o n s e i n l o c a l l y a d v a n c e d r e c t a lc a n c e r[J].M e t a b o l o m i c s,2022,18(12):99.[19]C O K E R O O,L I U C,WU W K,e t a l.A l t e r e d g u t m e t a b-o l i t e s a n d m i c r o b i o t a i n t e r a c t i o n s a r e i m p l i c a t e d i n c o l o r-e c t a l c a r c i n o g e n e s i s a n d c a n b e n o n-i n v a s i v e d i a g n o s t i c b i-o m a r k e r s[J].M i c r o b i o m e,2022,10(1):35.[20]P I N F,B O N E WA L D L F,B O N E T T O A.R o l e o f m y o k-i n e s a n d o s t e o k i n e s i n c a n c e r c a c h e x i a[J].E x p B i o l M e d(M a y w o o d),2021,246(19):2118-2127.[21]B R O A D F I E L D L A,P A N E A A,T A L E B I A,e t a l.L i p i dm e t a b o l i s m i n c a n c e r:n e w p e r s p e c t i v e s a n d e m e r g i n g m e c h a n i s m s[J].D e v C e l l,2021,56(10):1363-1393. [22]覃艳春,莫春梅,蒋锐沅,等.脂质代谢与肿瘤关系的作用机制研究进展[J].中华中医药学刊,2020,38(11):158-163.[23]F U C,WA N G T,WA N G Y,e t a l.M e t a b o n o m i c s s t u d y o ft h e p r o t e c t i v e e f f e c t s o f g r e e n t e a p o l y p h e n o l s o n a g i n g r a t s i n d u c e d b y d-g a l a c t o s e[J].J P h a r m B i o m e d A n a l, 2011,55(5):1067-1074.[24]R A T T R A Y N J,T R I V E D I D K,X U Y,e t a l.M e t a b o l i cd y s re g u l a t i o n i n v i t a m i n E a n d c a r n i t i n e s h u t t l e e n e r g ym e c h a n i s m s a s s o c i a t e w i t h h u m a n f r a i l t y[J].N a t C o m-m u n,2019,10(1):5027.[25]WU H L,G O N G Y,J I P,e t a l.T a r g e t i n g n u c l e o t i d e m e-t a b o l i s m:a p r o m i s i n g a p p r o a c h t o e n h a n c e c a n c e r i mm u-n o t h e r a p y[J].J H e m a t o l O n c o l,2022,15(1):45. [26]苑小星.嘌呤核苷酸代谢与恶性肿瘤关系的研究进展[J].癌症进展,2019,17(21):2498-2501. [27]F E N G X,MA D,Z HA O J,e t a l.UHMK1p r o m o t e s g a s-t r i c c a n c e r p r o g r e s s i o n t h r o u g h r e p r o g r a mm i n g n u c l e o-t i d e m e t a b o l i s m[J].E m b o J,2020,39(5):e102541.[28]C E R N E C K I S J,C U I Q,H E C,e t a l.D e c o d i n g p s e u d o u r i-d i n e:a ne m e r g i n g t a r g e tf o r t h e r a p e u t i c d e v e l o p m e n t[J].T r e n d s P h a r m a c o l S c i,2022,43(6):522-535.[29]Y U X M,L I S J,Y A O Z T,e t a l.N4-a c e t y l c y t i d i n e m o d i-f i c a t i o n o f l n c R N A C T C-490G23.2p r o m o t e s c a n c e r m e-t a s t a s i s t h r o ughi n t e r a c t i n g w i t h P T B P1t o i n c r e a s e C D44a l t e r n a t i v e s p l i c i n g[J].O n c o g e n e,2023,42(14):1101-1116.[30]张松泽,肖樟生,杨飞标.5-甲基胞嘧啶5-羟甲基胞嘧啶在女性甲状腺乳头状癌组织中的表达及与T E T蛋白的关系[J].中国妇幼保健,2022,37(23):4499-4502.[31]MA R KWO R T H J F,C AM E R O N-S M I T H D.A r a c h i d o n-i c a c i d s u p p l e m e n t a t i o n e n h a n c e s i n v i t r o s k e l e t a l m u s c l e c e l l g r o w t h v i a a C O X-2-d e p e n d e n t p a t h w a y[J].A m JP h y s i o l C e l l P h y s i o l,2013,304(1):C56-C67. [32]陈璐,高威.肿瘤酸性微环境的形成机制及其对肿瘤进展的影响[J].肿瘤,2019,39(2):140-145.[33]蒙霞.靶向肿瘤酸性微环境的抗肿瘤策略研究[D].南京:南京大学,2021.[34]A N G I O N I D,MA C A R O N T,T A K E D A C,e t a l.C a n w ed i s t i n g u i s h a g e-re l a t e df r a i l t y f r o m f r a i l t y r e l a t e d t o d i s-e a s e s?D a t af r o m t h e MA P T s t u d y[J].J N u t r H e a l t hA g i n g,2020,24(10):1144-1151.(收稿日期:2023-07-19修回日期:2023-12-05)(上接第436页)K O O I J S.e t a l.S i m p l i f i e d d i a g n o s t i c m a n a g e m e n t o f s u s-p e c t e d p u l m o n a r y e m b o l i s m(t h e Y E A R S s t u d y):a p r o-s p e c t i v e,m u l t i c e n t e r,c o h o r t s t u d y[J].L a n c e t,2017,390 (10091):289-297.[17]K E A R O N C,D E W I T K,P A R P I A S,e t a l.D i a g n o s i s o fp u l m o n a r y e m b o l i s m w i t h D-d i m e r a d j u s t e d t o c l i n i c a l p r o b a b i l i t y[J].N E n g l J M e d,2019,381(22):2125-2134.[18]S O L B E R G R,G L A S S G.A d j u s t i n g D-d i m e r c u t o f f s:b r i e f l i t e r a t u r e s u mm a r y a n d i s s u e s i n c l i n i c a l u s e[J].A m JE m e r g M e d,2018,36(11):2105-2107.[19]N A V A N A N D A N N,S T E I N J,M I S T R Y R D.P u l m o n a r ye m b o l i s m i n c h i l d r e n[J].P e d i a t r E m e r g C a r e,2019,35(2):143-151.[20]P E D E R S E N J,H E D E G A A R D E R,S I MO N S E N U,e ta l.C u r r e n t a n d f u t u r e t r e a t m e n t s f o r p e r s i s t e n t p u l m o n a-r y h y p e r t e n s i o n i n t h e n e w b o r n[J].B a s i c C l i n P h a r m a c o l T o x i c o l,2018,123(4):392-406.(收稿日期:2023-05-06修回日期:2023-12-12)㊃344㊃检验医学与临床2024年2月第21卷第4期 L a b M e d C l i n,F e b r u a r y2024,V o l.21,N o.4。
靶向和非靶向代谢组学解析

由于靶向代谢组学关注有限种类的代谢物,所以数据分析比非靶向代谢组学更为简单和直接。使用的方法和数据库和非靶向代谢组学相似,但是对于某类代谢组,有特定的数据库,如针对糖类和脂质组的LipidMaps和LipidBank等数据库。
图2. 靶向代谢组学分析流程。
由于两Байду номын сангаас代谢组学方法各有优缺点,非靶向代谢组学无偏差,全面系统反应生命体代谢组特征,但是重复性较差且线性范围有限;而靶向代谢组学的重复性和敏感性有显著提高,代谢物确证简单,线性范围宽,但是需要有预先的知识背景,是一种有偏向的代谢组分析方法。因此在实际应用中,两者常常结合使用,共同发挥作用。
二者各有优缺点经常结合使用用于差异代谢产物的发现和精准定量对后续代谢分子标志物进行深入的研究和分析这在食品鉴定疾病研究动物模型验证生物标志物发现疾病诊断药物研发药物筛选药物评估临床研究植物代谢研究微生物代谢研究中发挥重要作用
靶向和非靶向代谢组学解析
什么是代谢组学?
代谢是生物体内所有生化反应的总成,是生命体维持生命的物质基础,也是研究生命活动的重要基础。代谢组学是研究生命在内、外环境影响下的内源代谢活动,包括对代谢产物种类、数量及其变化规律的检测和分析,从而研究集体生命活动发生和发展的本质。与其他组学相比,代谢组学具有多种优势:
靶向代谢组学
靶向代谢组学相对于非靶向代谢组学更有针对性,将关注点放在了几个或者几类与生物学事件相关的代谢物上,比如脂质组学、糖组学。
1.样本采集和处理
靶向代谢组学根据靶向组学关注的对象,针对性的采集样本。比如进行脂质组学时,选用对脂质有较好溶解能力的溶剂。靶向代谢物的定量是基于在标准品的定量标准曲线上的,所以需要准备优质的标准品。
代谢通路分析:常见的代谢组学通路数据库包括HMDB、KEGG、Reactome、BioCyc、MetaCyc等数据库,可以利用这些数据库进行代谢通路和互作网络分析。
代谢组学实验中应该如何做选择?

代谢组学实验中应该如何做选择?展开全文在代谢组学实验中,我们会遇到很多需要我们做出选择的情况,比如样本检测时选择GC-MS还是LC-MS、LC-MS检测时是选择full scan还是DDA或DIA?这些选择有一些需要根据自己的实验情况进行选择,有一些则没有一定之规,只要做到有据可循即可。
那这篇文章就简单的总结一下在代谢组学实验中需要我们做出选择的情况。
因为我的专业侧重质谱分析,所以侧重点可能会偏向样本检测方面。
质谱仪如何选择?“我们这里有xxx质谱仪,请问能否开展代谢组学实验?”之前收到过类似的问题,这类问题主要还是关于质谱仪的选择。
对于LC-MS而言,要开展非靶向代谢组学,必须要有高分辨质谱仪如TOF、Orbitrap等等,因为非靶向代谢组学是以发现为目的的,所以需要尽可能多的检测到存在于生物样本中的化合物,分辨率越高的质谱才能保证检测到的化合物越多。
当然也要在分辨率和扫描之间做好平衡,现在都高分辨质谱仪都提供了多种分辨率可供选择,同时也会给出不同应用场景下的推荐值。
在样本检测时,选择GC-MS还是LC-MS?首先要知道两者有什么不同,两种技术最大的区别在于所监测到的化合物的类型(分子量、极性等)不一样。
由于仪器的特性使得GC-MS检测的质量范围通常在600以下,而LC-MS检测的质量范围可以很高,通常我们选择1000或者1500以下。
所以如果实验中要检测的化合物为脂肪酸、氨基酸等物质,可以选择使用GC-MS,当然也要配合适当的样本前处理;如果除了检测分子量较低的物质之外,还需要检测胆碱、磷脂类等物质,则需要使用LC-MS。
GC-MS检测相对容易标准化,另外化合物的鉴定相对容易,加上标准品数据的长期积累使得鉴定的结果更加可靠,这也可能是一些公司在非靶向代谢组学实验中只提供GC-MS检测的原因。
在获取原始数据时,选择full scan还是DDA或者DIA?首先要搞清楚这几种扫描模式的区别,full scan用来获取化合物的一级质谱信息,DDA或者DIA是用来获取化合物的碎片信息,这几种扫描模式可以独立使用,也可以组合使用,了解到这一点之后就可以根据实验的需要来选择合适的采集模式。
基于非靶向代谢组学分析不同发酵方式马铃薯泡菜代谢物

基于非靶向代谢组学分析不同发酵方式马铃薯泡菜代谢物陈冬菊;刘琨毅;何二平;杨双鹤;杜欢;杨艳丽;吴荣书;董霞【期刊名称】《食品研究与开发》【年(卷),期】2024(45)12【摘要】以马铃薯为原料,采用四菌组合的泡菜益生菌菌粉接种发酵马铃薯泡菜,自然发酵马铃薯泡菜作对照,并利用超高效液相色谱⁃串联质谱技术对马铃薯泡菜进行非靶向代谢组学研究。
以差异倍数≥2或≤0.5且P<0.05作为筛选标准进行差异代谢物筛选,结果表明,新鲜原料(XX)和接种发酵5 d(JZD5)、XX和自然发酵5d(ZRD5)、ZRD5和JZD5分别筛选到511、525、105种差异代谢物。
XX和JZD5以及ZRD5的主要差异代谢为D⁃鸟氨酸、L⁃鸟氨酸、4⁃羧苯基甘氨、甘氨酰⁃苯丙氨酸、L⁃酪氨酸⁃L⁃丝氨酸、三羰基丙酸、2⁃氨基⁃4⁃氧戊酸等生物活性物质以及小肽,马铃薯泡菜的营养价值得到提高,同时还赋予其独特的风味。
ZRD5和JZDR5中的主要差异代谢化合物有6⁃氨基己酸、DL⁃亮氨酸、茶氨酸、异柠檬酸等,这些差异代谢化合物赋予马铃薯生物活性成分和滋味成分,JZD5中还含有相对含量较高的糖醇类、有机酸类化合物,形成其优于自然发酵马铃薯泡菜的滋味品质。
此外,ABC转运蛋白、乙醛酸和二羧酸代谢、嘌呤代谢、辅因子的生物合成等相关代谢途径在马铃薯发酵泡菜品质形成过程中发挥重要作用。
【总页数】9页(P135-143)【作者】陈冬菊;刘琨毅;何二平;杨双鹤;杜欢;杨艳丽;吴荣书;董霞【作者单位】云南农业大学食品科学技术学院;宜宾职业技术学院五粮液技术与食品工程学院;澄江老仓醋食品科技有限公司;云南农业大学植物保护学院【正文语种】中文【中图分类】TS2【相关文献】1.基于UPLC-Q-orbitrap-MS的非靶向代谢组学用于不同橄榄品种差异代谢物分析2.基于非靶向代谢组学的焙焦油莎豆粕精酿啤酒主发酵期代谢物变化研究3.基于非靶向代谢组学分析杜仲金花茶发酵过程中代谢物的特征4.基于非靶向代谢组学分析辣木叶发酵前后营养物质及代谢物变化5.基于非靶向代谢组学分析不同包装方式预制烤鱼代谢物的差异因版权原因,仅展示原文概要,查看原文内容请购买。
非靶向代谢组学

非靶向代谢组学
非靶向代谢组学是一种研究生物体内代谢组成和变化的方法,它不需要事先确定目标物质,而是对整个生物体进行全面组学分析,从而获徖大量有关生物体代谢组成和变化的信息。
非靶向代谢组学主要包括质谱和气相色谱等技术,可以用于研究生物体的代谢物组成、代谢途径、代谢网络等方面。
非靶向代谢组学在药物发现、疾病诊断、营养学等领域具有重要的应用前景。
非靶向代谢组学的应用非常广泛,它可以用于研究各种生物体的代谢特征,如细胞、组织、细胞培养和动物体等。
这些研究可以帮助我们了解生物体内代谢网络的构建和运作机制,并为药物研发、疾病诊断和预防提供重要的理论基础。
非靶向代谢组学技术主要有两种,一种是质谱技术,如质谱图谱,可以用来确定生物样品中的代谢物;另一种是气相色谱技术,如气相色谱-质谱(GC-MS)和气相色谱-红外光谱(GC-IR)等。
非靶向代谢组学技术在研究中有两种研究方法,一种是定性研究,即对生物样品中的代谢物进行鉴定,另一种是定量研究,即对生物样品中的代谢物进行测定。
非靶向代谢组学技术的应用越来越广泛,在药物研发、疾病诊断、营养学等领域具有重要的应用前景。
刺梨不同提取物的非靶向代谢组学比较与分析

刺梨不同提取物的非靶向代谢组学比较与分析刘含;郭银萍;穆兴燕;刘晓燕;岑顺友【期刊名称】《食品与发酵工业》【年(卷),期】2024(50)2【摘要】该文采用超高效液相色谱-高分辨质谱技术(ultra high performance liquid chromatography high resolution mass spectrometry,UPLC-HRMS)对刺梨不同提取物进行非靶向定性解析,通过数据库确认注释并鉴定代谢物,在二级质谱信息下共鉴定出316种代谢物。
运用多元统计方法进行刺梨不同提取物数据分析并筛选出差异代谢物。
主成分分析结果表明,刺梨不同提取物存在代谢物差异。
依据正交偏最小二乘法判别分析模型的变量重要性投影(variable importance projection value,VIP,VIP>1.3)值、P<0.01和差异倍数(fold change,FC,FC≥3和FC≤0.1)可筛选出49种显著差异代谢物。
通过MBRole 2.0通路分析功能,发现有11条代谢途径。
其中类黄酮生物合成途径最为显著,共计4个代谢物参与类黄酮生物合成代谢通路。
该文基于非靶向代谢组学分析表明,刺梨不同提取物之间的代谢物有一定差异,为进一步研究其功能提供了数据支持。
【总页数】9页(P312-320)【作者】刘含;郭银萍;穆兴燕;刘晓燕;岑顺友【作者单位】贵阳学院食品与制药工程学院;贵州省果品加工工程技术研究中心;贵州宏财聚农投资有限责任公司【正文语种】中文【中图分类】R28【相关文献】1.非靶向代谢组学对赤霞珠果皮不同砧穗组合差异代谢物的分析2.基于UPLC-Q-orbitrap-MS的非靶向代谢组学用于不同橄榄品种差异代谢物分析3.不同产地杜仲雄花的非靶向代谢组学比较与分析4.基于非靶向代谢组学的红花大金元不同生育期烟叶代谢图谱差异分析5.关中奶山羊发情期不同时段宫颈阴道粘液非靶向代谢组学比较分析研究因版权原因,仅展示原文概要,查看原文内容请购买。
基于UPLC-MS非靶向代谢组学分析不同年龄双峰驼肉代谢物差异

基于UPLC-MS非靶向代谢组学分析不同年龄双峰驼肉代谢物差异斯仁达来;TUYATSETSEG Jambal;BANZRAGCH Maizul;明亮;何静;吉日木图【期刊名称】《食品科学》【年(卷),期】2024(45)4【摘要】基于超高效液相色谱-质谱联用的非靶向代谢组学方法探究不同年龄组驼肉代谢物的差异及变化规律。
结果表明,在3个年龄组(3~4、6~7岁和9~10岁,分别以I、II和III组表示)骆驼背最长肌中共鉴定出显著差异代谢物710种;在I vs II组显著差异代谢物有78个,其中I组上调47个,II组上调31个;在II vs III组显著差异代谢物有49个,其中II组上调18个,III组上调31个;在I vs III组显著差异代谢物有65个,其中I组上调29个,III组上调36个。
京都基因与基因组百科全书通路分析结果表明,差异代谢物主要富集到蛋白质和氨基酸代谢、脂肪酸、维生素和矿物质代谢等相关通路,说明不同生长阶段骆驼中各营养素的消化代谢均有差异。
I组中的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)(尤其n-6 PUFA、n-3 PUFA)含量和PUFA/不饱和脂肪酸值均显著高于III组,这主要与相关代谢通路上的花生四烯酸、亚油酸和13-L-过氧化氢油酸浓度的显著上调有关;同时L-亮氨酸、L-缬氨酸、L-谷氨酰胺等差异代谢物可以作为不同年龄驼肉品质差异的潜在标记物。
【总页数】10页(P154-163)【作者】斯仁达来;TUYATSETSEG Jambal;BANZRAGCH Maizul;明亮;何静;吉日木图【作者单位】内蒙古农业大学食品科学与工程学院;中蒙生物高分子应用研究联合实验室;蒙古科技大学;内蒙古中哈骆驼研究院【正文语种】中文【中图分类】TS252.1【相关文献】1.非靶向代谢组学对赤霞珠果皮不同砧穗组合差异代谢物的分析2.基于UPLC-Q-orbitrap-MS的非靶向代谢组学用于不同橄榄品种差异代谢物分析3.基于UPLC-MS非靶向代谢组学分析大鲵肉冷藏过程中代谢物的变化4.基于非靶向代谢组学分析不同地区羊肉代谢物的差异5.基于非靶向代谢组学的平菇子实体发育过程中菌丝体差异代谢物分析因版权原因,仅展示原文概要,查看原文内容请购买。
非靶向代谢组学结果

非靶向代谢组学结果1 非靶向代谢组学及其研究非靶向代谢组学(nontargeted metabolomics)是一门研究和认识宿主细胞及器官内各种生物分子物质性状的综合性学科,它以细胞内的细胞代谢活动,细胞水平及组织水平上的代谢产物为主要研究对象。
该学科将一系列高分子无机、有机以及混合物质综合考虑,包括:挥发性有机物(VOCs)、氨基酸、糖类、脂类、蛋白质、酶、DNA、RNA、矿质质等无数不同的物质。
2 非靶向代谢组学的应用非靶向代谢组学在探究宿主物种的器官系统及疾病的发病机理及进行新药的开发方面具有重要意义。
它可以帮助人们更好地理解和快速确定物种身体内所有有机物质及元素的组成结构及其变化规律,从而更好地研究宿主系统及疾病的发病机制以及新药的开发。
非靶向代谢组学在慢性疾病的诊断、评价患者的个体病理、治疗的结果评估方面有重要的应用,也可以用于健康风险评估、精准医疗、新药的研发和监测用药副反应等方面。
3 非靶向代谢组学的处理及分析在非靶向代谢组学的实验处理及分析中,采集和分离实验样本,涉及样本前处理、样本分注、浓度测定、色谱或层析分离等,然后使用光谱或质谱技术进行定性和定量分析,最后用质谱重组或质谱组学分析、系统生物学数据分析等技术对分离的物质进行表征和解读。
4 非靶向代谢组学结果非靶向代谢组学分析可以检测和鉴定出样本中的大量元素及生物分子,获取各种生物分子及代谢产物在体内变化概况,以及生物大分子在组织和细胞水平等中发生的变化情况,有助于探究机体各种生物分子及代谢产物的基因表达水平以及它们之间黏附分布等有关过程和活动规律,可以更直接准确地反映宿主物种的代谢情况和活动情况,为疾病的病因分析及药物的研发奠定基础。
基于非靶向代谢组学探究扁柏精油对赤拟谷盗的作用机制

基于非靶向代谢组学探究扁柏精油对赤拟谷盗的作用机制
张莉睿;张宇;贺艳萍;戴煌;毕洁
【期刊名称】《河南工业大学学报(自然科学版)》
【年(卷),期】2024(45)2
【摘要】扁柏精油对赤拟谷盗具有较强控制作用,通过非靶向代谢组学技术从代谢层面探究其对赤拟谷盗的影响。
利用LC-MS技术分析扁柏精油处理后的赤拟谷盗与对照组代谢物的差异。
扁柏精油能够影响赤拟谷盗的代谢过程,共鉴定出262个
差异代谢物(上调230个,下调32个),主要涉及氨基酸类相关化合物、萜类化合物、生物碱、苯丙酸类、聚酮化合物、脂肪酸相关化合物和黄酮类化合物。
这些差异代谢物在35条KEGG代谢途径(包括氨基酸代谢、脂代谢、碳水化合物代谢、辅因
子和维生素代谢、信号转导等)中显著富集。
本研究为进一步认识扁柏精油对赤拟
谷盗的潜在代谢影响提供了依据,并为开发更有效的昆虫控制策略奠定了基础。
【总页数】9页(P114-122)
【作者】张莉睿;张宇;贺艳萍;戴煌;毕洁
【作者单位】武汉轻工大学食品科学与工程学院
【正文语种】中文
【中图分类】S433.5
【相关文献】
1.基于非靶向代谢组学与转录组学探究氨基酸缓解甘草酸苷致大鼠假性醛固酮增多症的分子机制
2.基于非靶向代谢组学探讨射干麻黄汤治疗哮喘的作用机制
3.基于
非靶向代谢组学探究寒、热体质大鼠整体代谢特征4.基于血清非靶向代谢组学的过敏性紫癜儿童血热妄行证和风热伤络证作用机制5.基于非靶向代谢组学和肠道菌群探究经典名方泻白散对过敏性哮喘大鼠的保护作用
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高亮区域中峰强度随时间的变化。
BP: 218.10272 @ 5.44E+008
化合物发现阶段 Q Exactive GC 系统获取了每个样品的全扫描色谱图(图 2)。 该系统在较宽的动态范围内采集不同浓度水平代谢物的全扫描 色谱图,不会丢失任何精确质量数信息。使用自动峰选取(结 合使用 XCMS 和 MzMatch.R)功能提取每个 EI 峰簇。在该步 骤中,已检测到 1193 个明显峰簇并进行了初步定量,强度阈 值为 100,000。已解卷积峰簇的示例见图 3。
仪器和方法设置
样品制备 从各个大鼠腿部肌肉组织切片取样,以时间顺序增加进行尸检 及采样。采用氯仿/甲醇/水(1:3:1)提取经匀质的组织切片中 的代谢物,在冰块下孵育 1 小时。蛋白质和 DNA 进行离心沉 淀。去除上清液,贮藏在 -80 ℃ 条件下备用。
2 样品衍生化 移取 200 µL 提取液至 1.5 mL 硼硅玻璃小瓶中,加盖 9 mm 螺 丝盖。然后,将样品置于 Thermo Scientific™ Reacti-Vap™ 蒸 发器中,在 30 ℃ 条件下以低流速氮气流干燥 60 min。以下所 有衍生化步骤均采用 Thermo Scientific™ TriPlus™ RSH 自动 样品处理器进行。 加入 20 µL 20 mg/mL(w/v)甲氧基胺盐酸盐的吡啶溶液至 每个干燥小瓶中。将小瓶涡旋 10 秒并在 30 ℃ 条件下孵育 60 min。甲氧基化步骤完成以后,加入 30 µL MSTFA +1% TMCS(N-甲基-N-(三甲基硅基)三氟乙酰胺+1%三甲基氯 硅烷)的混合液,进一步涡旋 30 秒。将小瓶置于 45 ℃ 条件 下孵育 60 min 进行硅烷化。将样品冷却至室温以备进样。
基峰质量数 RT
最大强度
T0
T1
T2
T3
T0:T0
T1:T0
T2:T0
T3:T0
219.1100 10.71 507930367 1.0 2.7 3.4 4.5
1.000
0.008
0.000
0.003
232.1184 11.78 291673570 1.0 1.5 1.6 2.1
1.000
0.043
GC-MS 分析 所有实验均采用 Thermo Scientific™ Q Exactive™ GC 组合型 四极杆 Orbitrap 质谱仪进行。采用 TriPlus RSH 自动进样器 进样,采用 Thermo Scientific™ TRACE™ 1310 GC 色谱仪和 Thermo Scientific™ TraceGOLD™ TG-5SilMS 15 m × 0.25 mm I.D. × 0.25 µm 薄膜毛细管柱(P/N: 26096-1301)进行 色谱分离。仪器参数的其他详细信息见表 1 和表 2。
关键词
法医学;代谢组学;多变量统计分析;Q Exactive GC 系统
引言
代谢组学旨在表征和定量生物系统中的完整小分子代谢通路或 代谢物组。代谢物组包含小分子多元混合物(包括氨基酸、糖 和磷酸糖、生物胺和脂质)。非靶向代谢组学极具挑战性,因 为其要求定性和定量上百个不同种类化合物,而有关这些代谢 物的经验知识有限。因此,有必要使用一个既可以以非靶向的 方式灵敏检测特定分子,又可以提供精确质量数信息,用于确 认未知物并对其进行结构解析的检测系统。
图 6. 分解数据的 PLS-DA 模型。该模型为有监督多变量分析,将高维数据(例如,大量强度不同的代谢物)折叠为涵盖数据集中主要变化的几种主 成分。在本例中,X 轴是主成分 1,Y 轴是主成分 2。注意,本项研究对样品进行了适当聚类,每个群组聚集在一起,T0 已明显与其他群组分开。
0.06
● W*c [2]
T0 T1 T2 T3 30
20
10
t [2]
0
-10
-20
-30
-40 -80
-60
-40
-20
0
20
40
60
t [1]
R2ⅹ [1] = 0.385
R2ⅹ [2] = 0.127
E11ipse: Hote11ing's T2 (95%)
SIMCA 13.0-31/03/2015 11:47:15(UTC-1)
P 值(T 检验)
4.00E+008
2.00E+008
0.00E+000 16.92232 16.97232
17.02232
17.07232 17.12232 17.17232
图 3. 已解卷积峰簇被推断识别为酪氨酸。
17.22232
T0/T3
强度比
图 4. 发生显著性变化代谢物的火山图。每个代谢物以深蓝色菱形表示。 强度比(X 轴)是指 T0/T3 时代谢物的倍数变化,Y 轴显示代谢物的 P 值。因此,右上方和左上角的代谢物是倍数变化最大且最具有统计学意 义的代谢物。
1.000
0.015
0.001
0.026
156.1203 16.88 1169362271 1.0 3.6 3.9 5.1
1.000
0.000
0.000
0.007
5
使用 SIMCA 软件进行多变量统计分析。5将结论数据转化为更为直观的对数值,将 Y 类别设为各时间点,生成数据的偏最小二乘 判别分析(PLS-DA)模型。该软件生成分数图和载荷图,以显示沿着主成分每个时间点的聚类和分离(图 6)情况。从本次分析 可知,死亡后立即取样的样品(RAT_T0)聚集在一起,与已分解的大鼠样品(T1–T3)具有显著性差异。从 T1–T3 样品中可以观 察到分组聚类和持续分解。X 或 Y 轴上的位移表示某一代谢物对分数图中样品群组之间分离的作用大小。在本例中,X 轴将 T0 与 T1–3 分开,Y 轴将 T1、T2 和 T3 分开(图 6)。载荷图上的每个蓝点表示每个已检测到的含 EI 碎片离子簇的代谢物(图 7)。
本项研究展示了新型 Thermo Scientific™ Orbitrap™ GC-MS 完整非靶向代谢组学工作流程,检测了大鼠模型中的生物标记 物,以判定其死亡时间。死亡时间(PMI)推断是法医调查中 一项最关键也是最困难的任务,尤其当尸体温度与周围环境温 度到平衡后。由于当前用于确定 PMI 的方法不精确性且以 目视检查尸体为主。因此,建立一种实验方法,使用耐用生物 标志物推断死亡时间可辅助法医调查。
定量阶段 首先使用单变量统计方法分析结果。使用 Student's t 检验对比 每个时间点和时间零点。将每个代谢物的平均 T0 强度设为 1, 倍数变化显示为 1 的倍数值,以方便对比强度明显不同的代谢 物(图 4 和图 5)。已检测到 272 个代谢物的平均强度发生显 著性变化(P 值小于 0.05),包含已检测峰簇的定量矩阵示例 见表 3。
表 3. 已检测峰簇的定量矩阵。基峰(峰簇中强度最大的峰)、保留时间(RT)和检测到的最大强度见第 1–3 列。将 T0 的强度归一化为 1,其他 时间点的强度与 T0 强度相比并视情况以不同颜色显示,见第 4–7 列。第 8–11 列包含每项比值的 T 检验 P 值。
T 检验: T 检验: T 检验: T 检验:
0.04
0.02
W*c [2]
0.055
0.030
232.1184 12.41 941914122 1.0 5.9 8.5 11.0
1.000
0.013
0.001
0.002
156.0840 15.32 1163630714 1.0 2.1 1.9 2.0
1.000
0.019
0.008
0.021
174.1128 16.18 203636192 1.0 2.5 3.2 5.0
结果和结论
将八只大鼠尸体置于室温下四天。每日提取肌肉组织进行分 析,共检测 16 个样品中代谢物浓度的变化以分析尸体分解程 度。对样品进行随机分析以减小系统误差。代谢组学优化后的 分析流程见图 1。
表 1. GC 温度程序
TRACE 1310 GC 参数
进样量(µL)
1.0
衬管
单锥形(P/N 453A1345)
气相色谱质谱联用仪(GC-MS)基于其自身的优点经常用于 代谢组学分析,尤其是其色谱分辨率、重现性、峰容量和便于 使用的质谱库。GC为非靶向代谢组学中生物标志物的发现提 供了卓越的色谱分离能力,但是,由于目前缺乏高端质谱仪的 支持,从而限制了提供用于分析复杂样品(例如,哺乳动物的 肌肉组织)的动态范围、精确质量数和扫描速度。鉴于大部分 重要代谢物的极性特征,必须将其衍生化,以使其有效挥发, 从而确保得到良好的色谱分离。代谢组学分析尤其是临床代谢 组学要求高通量和先进的自动化技术。
AN 10457_C_GCMSMS_201508Y
基于 Orbitrap GC-MS 的非靶向代谢组学
Stefan Weidt,2 Bogusia Pesko,2 Cristian Cojocariu,1 Paul Silcock,1 Richard J. Burchmore,2 and Karl Burgess2 1Thermo Fisher Scienti c, Runcorn, UK 2Glasgow Polyomics, University of Glasgow, Glasgow, UK
数据处理
数据分析流程首先使用 MSConvert(ProteoWizard 套件1的一 部分)将原始数据文件转换为 MzXML 文件。使用 XCMS 包2 和 centWave 算法提取峰。已检测到的峰以 PeakML 格式输出, 然后使用 MzMatch.R 包对已检测到的峰进行后处理(过滤每 组重复进样的最低检测值、相对标准偏差和对 EI 碎片组进行分 组的相关性匹配)。3生成的文本文件输出使用 IDEOM 软件4 进 行单变量统计处理,使用 SIMCA™ 13.0.35 进行多变量统计处 理。使用 Thermo Scientific 解卷积软件进行峰簇识别和解析。
