pH标准缓冲溶液(pH6.86)
标准缓冲液pH值与温度对照表

常用蛋白质分子量标准参照物
高分子量标准参照 蛋白质 肌球蛋白 β-半乳糖苷酶 磷酸化酶B 牛血清清蛋白 过氧化氢酶 醛缩酶 中分子量标准参物 低分子量标准参照 Mr Mr 蛋白质 97 400 212 000 磷酸化酶B 66 200 116 000 牛血清清蛋白 55 000 97 400 谷氨酸脱氢酶 42 700 66 200 卵清蛋白 40 000 57 000 醛缩酶 31 000 40 000 碳酸酐酶 21 500 大豆胰蛋白酶抑制剂 14 400 溶菌酶 蛋白质 碳酸酐酶 大豆胰蛋白酶制剂 马心肌球蛋白 溶菌酶 肌球蛋白(F1) 肌球蛋白(F2) 肌球蛋白(F3) Mr 31 000 21 500 16 900 14 400 8 100 6 200 2 500
(四)凝胶过滤层析介质的技术数据
凝胶过滤介质 名称 分离范围 Superdex 30 Superdex 75 Superdex200 Superose 6 Superose 12 Sephacryl S-100 HR Sephacryl S-200 HR Sephacryl S-300 HR Sephacryl S-400 HR Sepharose 6 Fast Flow Sepharose 4 Fast Flow Sepharose 2B Sepharose 4B Sepharose 6B Sepharose CL-2B Sepharose CL-4B Sepharose CL-6B 45~165 60000~20×105 10000~4×106 45~165 颗粒 大小 (μm) 24~44 <10000 24~44 3000~70000 24~44 3 000 10000~600000 20~40 20~40 5000~5×106 25~75 1000~300000 1000~ 100000 25~75 5000~250000 10000~1.5×106 20000~8×106 10000~4×106 60000~20×106 70000~40×106 60000~20×106 10000~4×106 70000~40×106 45~165 45~165 60~200 25~75 25~75 平均90 平均90 60~200 特性/应用 肽类、寡糖、小蛋白等 重组蛋白、细胞色素 单抗、大蛋白 蛋白、肽类、多糖、核酸 蛋白、肽类、寡糖、多糖 肽类、小蛋白 蛋白,如清蛋白 蛋白、抗体 多糖、具延伸结构的大分 子如蛋白多糖、脂质体 巨大分子 巨大分子如重组乙型肝 炎表面抗原 pH稳定性工作 耐压(Mpa) 最 快 流速 (cm/h) 0.3 100 3~12 0.3 100 3~12 0.3 100 3~12 0.4 30 3~12 0.7 30 3~12 0.2 20~39 3~11 3~11 3~11 3~11 2~12 2~12 4~9 0.2 0.2 0.2 0.1 0.1 0.004 0.008 0.02 0.005 20~39 20~39 20~39 300 250 10 11.5 14 15
pH标准缓冲溶液(pH=4.00)

pH 标准缓冲溶液(pH=4.00)简介:pH 标准溶液的pH 值是已知的,并达到规定的准确度,其pH 值有良好的复现性和稳定性,具有较大的缓冲容量,较小的稀释值和较小的温度系数。
该pH 标准缓冲溶液常用于酸度计的定位和斜率校准,其准确度范围在±0.01pH 。
组成:操作步骤(三点校准通用,仅供参考):1、 将pH 电极在纯水中清洗干净并甩干。
2、 用温度计测量pH 标准缓冲溶液的温度,并将pH 计的温度值调整准确。
自动温度pH 计无需该步骤。
3、 定位校正:将pH 电极浸入pH 标准缓冲溶液(pH=6.86)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的6.86,再显示pH 校准数值,表示pH6.86的校准完成。
4、 斜率校准Ⅰ: 取出pH 电极,用纯水清洗干净并甩干。
将pH 电极浸入pH 标准缓冲溶液(pH=4.00)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的4.00,再显示pH 校准数值,表示pH4.00的校准完成。
完成校准后会自动显示电极在该线性段的斜率百分比(如显示99%)。
5、 斜率校准Ⅱ: 取出pH 电极,用纯水清洗干净并甩干。
将pH 电极浸入pH 标准缓冲溶液(pH=9.18)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的9.18,再显示pH 校准数值,表示pH9.18的校准完成。
完成校准后会自动显示电极在该线性段的斜率百分比(如显示98%)。
注意事项:1、 如果每次的使用量很小,可以适当分装后再使用,尤其以pH 标准缓冲溶液(pH=9.18)较易失效。
2、 显示pH 校准数值时,pH 值会随温度不同而不同,例如在定位校正中,25℃时显示6.86,15℃时就显示6.90。
3、 根据pH 等温测量原理,被测溶液的温度与校准溶液的温度越接近,其测量的准确度就越高。
ph标准缓冲溶液的配制

ph标准缓冲溶液的配制pH标准缓冲溶液的配制。
在化学实验和生物实验中,pH标准缓冲溶液是一种非常重要的试剂,它可以帮助我们在实验中精确控制溶液的酸碱度,保证实验结果的准确性。
本文将介绍pH标准缓冲溶液的配制方法,希望能对大家有所帮助。
首先,我们需要准备一些基本的试剂和设备,包括具有精确刻度的容量瓶、天平、蒸馏水、pH计、标准物质等。
在进行配制之前,务必保证所有试剂和设备的清洁和干燥,以免影响实验结果。
接下来,我们以配制pH=7的磷酸盐缓冲溶液为例,介绍具体的步骤。
首先,我们需要称取适量的二氢磷酸二氢盐和磷酸二氢钾,按照一定的摩尔比例加入到容量瓶中。
在称取试剂的过程中,要尽量保证称取的准确性,可以使用天平进行称量。
然后,我们需要加入适量的蒸馏水,将二氢磷酸二氢盐和磷酸二氢钾溶解,直到溶液均匀透明。
在溶解的过程中,可以使用磁力搅拌器进行搅拌,以加快溶解的速度。
接着,我们需要使用pH计检测溶液的酸碱度,调节溶液的pH值至7。
在调节pH值的过程中,可以逐渐加入少量的盐酸或氢氧化钠溶液,直到达到所需的pH 值。
在调节pH值的过程中,要小心操作,避免溶液的pH值超出目标范围。
最后,我们需要用蒸馏水将容量瓶中的溶液加至刻度线,摇匀后即可得到pH=7的磷酸盐缓冲溶液。
在配制完成后,可以使用标准物质进行校准,以确保配制的缓冲溶液的准确性和稳定性。
除了pH=7的磷酸盐缓冲溶液,我们还可以根据实际需要,配制其他pH值的缓冲溶液,具体的配制方法类似,只需根据不同的酸碱对配比不同。
在配制其他pH值的缓冲溶液时,需要注意选择合适的酸碱对,以及保证溶液的准确性和稳定性。
总之,pH标准缓冲溶液的配制是一项重要的实验技术,它需要我们严格按照配制方法操作,保证试剂的准确性和稳定性。
只有在配制过程中严格控制各个步骤,才能得到准确可靠的缓冲溶液,为实验结果的准确性提供保障。
希望本文的介绍能对大家有所帮助,谢谢阅读!。
电位滴定法测定食醋中醋酸的含量[详实参考]
![电位滴定法测定食醋中醋酸的含量[详实参考]](https://img.taocdn.com/s3/m/417901a8a58da0116c1749cd.png)
电位滴定法测定食醋中醋酸的含量一、实验目的1 通过醋酸的电位滴定,掌握电位滴定的基本操作、PH的变化及指示剂的选择。
2 学习食用醋中醋酸含量的测定方法。
二、实验原理食用醋的主要酸性物质是醋酸(HAC),此外还含有少量其他的弱酸。
醋酸的解离常数Ka=1.8×10-5,用NaOH标准溶液滴定醋酸,化学计量点的PH为8.7,可选用酚酞作指示剂,滴定终点时溶液由无色变为微红色。
两者的反应方程式为:HAc + NaOH = NaAc + H2O。
然而在本实验滴定过程中,由于食用醋的棕色无法使用合适的指示剂来观察滴定终点,所以它的滴定终点用酸度计来测量。
本实验选用邻苯二甲酸氢钾(KHP)作为基准试剂来标定氢氧化钠溶液的浓度。
邻苯二甲酸氢钾纯度高、稳定、不吸水、而且有较大的摩尔质量。
标定时可用酚酞作指示剂三、主要试剂和仪器1 仪器:pHS-2C型酸度计、天平、电子分析天平、电磁搅拌器、容量瓶(150ml)、锥形瓶(250ml)、吸量管(5.0ml ,25ml)、碱式滴定管、烧杯(250ml)、量筒(50ml)2 试剂:NaOH、KHC8H4O4基准物质、食用醋、酚酞、去离子水四、实验内容和步骤1 酸度计的安装与校正(1)开机预热30min,连接复合电极,安排好滴定管和酸度计的位置(2)用标准缓冲溶液校准仪器(测定前要开动搅拌器):将搅拌棒放入标准缓冲溶液中,把电极插入溶液中使玻璃球完全浸没在溶液中,开动搅拌器,注意观察磁棒不要碰到电极。
(3)pH6.86标准缓冲溶液定位:先将斜率旋钮顺时针调到最大,调节pHl量程至6,按下读数开关,将定位旋钮调至pH至标准缓冲溶液pH值。
(4)pH9.18标准缓冲溶液调斜率:调节pH量程至8,按下读数开关,将斜率旋钮调至pH至标准缓冲溶液pH值。
(5)pH6.86标准缓冲溶液定位:再调节pH量程至6,按下开关读数,将定位旋钮调至pH至标准缓冲溶液pH值。
注意事项:以上校正完成后,定位和斜率旋钮位置不能在变动!○1在将电极插入待测溶液前,要用蒸馏水冲洗干净,用滤纸吸干水分,再放入溶液中○2测定应在搅拌的情况下进行○3测定前必须根据测量pH范围选择合适的量程2 粗配氢氧化钠溶液用天平称量2.00克氢氧化钠于100ml烧杯中,加蒸馏水溶解,搅拌,可加热加速溶解。
实验2 缓冲溶液的配制与pH值的测定

实验2 缓冲溶液的配制与pH 值的测定一、实验目的1、理解缓冲溶液的定义及其特点。
2、理解缓冲溶液的缓冲原理。
3、掌握溶液的粗略配制方法和缓冲溶液的配制方法。
3、学习pH 计的使用方法。
二、实验原理在共轭酸碱对组成的混合溶液中加入少量强酸或强碱,溶液的pH 值基本上无变化,这种具有保持溶液pH 值相对稳定性能的溶液称为缓冲溶液。
缓冲溶液的特点是在适度范围内既能抗酸、又能抗碱,抵抗适度稀释或浓缩。
常见的缓冲体系有:HAc-NaAc 、NH 3-NH 4Cl 、Na 2B 4O 7·10H 2O-Na 2CO 3、KH 2PO 4- Na 2HPO 4等。
对于弱酸HB 及其共轭碱B -组成的缓冲溶液:对于弱碱B 及其共轭酸BH +组成的缓冲溶液:一般配制缓冲溶液时,常使c b =c a ,此时缓冲容量最大,缓冲能力最强。
三、实验用品 1、仪器PB-10酸度计、电子天平(常数双杰JJ600)b ac cHB pKa pH B c HB c HB pKa pH B c HB c Ka H c B O H O H HB lg )()()(lg)()()()(32-=-==+⇔+--+-+θθθab bc c pK pOH lg-=θ2、器材5mL量筒(1个)、10mL量筒(1个)、50mL烧杯(10个)、标签纸、玻璃棒(1根)3、试剂浓氨水(28%)、NHCl(s)、冰醋酸(99%)、NaAc(s)、KCl(3mol·L-1)4标准缓冲溶液(pH6.86;pH4.01)四、实验内容1、溶液的粗略配制Cl溶液的配制(1)0.1mol·L-1NH4Cl,倒入50mL带有刻度的用精度为0.01g的电子天平称取0.27g 固体NH4洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。
(2)0.1mol·L-1氨水溶液的配制用5mL量筒量取0.38mL浓氨水(28%),倒入50mL带有刻度的洁净烧杯中,加入少量去离子水搅拌使其完全溶解后,用去离子水稀释至刻度,贴上标签,备用。
pH计校准方法和标准缓冲液配置

pH计校准方法和标准缓冲液配置本文分享pH计校准所需工具、标准缓冲液配置方法,以及pH计校准方法、步骤及开展pH计校准工作的注意事项。
掌握这些pH计校准技能,对仪表人用好酸度计实惠多多。
pH计的应定期检定校准,使精密度和准确度符合要求。
怎么校准,或者说是怎样校正酸度计。
以下是昌晖仪表制造有限公司整理出来的资料。
有直接用配置好的标准缓冲液校准,有的需要自己配置标准缓冲液再校准,下面就看看这两种不同的前提,相同的校准方法步骤,供需要的朋友参考。
pH计校准所需工具/原料标准缓冲液(应选择与供试液pH值接近的标准缓冲液),目前标准溶液有7种,在我国一般使用以下3种溶液:(pH值在25时)①邻苯二甲酸氢钾(KHC8H4O4)4.003pH;0.05M②混合磷酸盐(Na2HPO4):磷酸二氢钾和磷酸氢二钠混合盐溶液6.864 pH;0.025M③硼砂(Na2B4O7·10H2O)9.182 pH:0.01M这三种标准缓冲液的配置方法如下:①pH4,邻苯二甲酸氢钾标准缓冲液精密称取在115±5干燥2-3小时的邻苯二甲酸氢钾[KHC8H4O4]10.12g,加水使溶解并稀释至1000ml。
②pH7,磷酸盐标准缓冲液(pH7.4)精密称取在115±5干燥2-3小时的无水磷酸氢二钠4.303g与磷酸二氢钾1.179g,加水使溶解并稀释至1000ml。
另补充:磷酸盐标准缓冲液(pH6.8)精密称取在115±5干燥2-3小时的无水磷酸氢二钠3.533g与磷酸二氢钾3.387g,加水使溶解并稀释至1000ml。
③pH9,硼砂标准缓冲液精密称取硼砂[Na2B4O7·10H2O]3.80g(注意:避免风化),加水使溶解并稀释至1000ml,置聚乙烯塑料瓶中,密塞,避免与空气中二氧化碳接触。
pH计校准步骤/方法1、实验室使用的pH计校准方法①常用的实验室PH计仪器校正时,要把仪器的斜率调到最大,并拨开电极上部的橡胶塞,使小孔露出,否则在进行校正时,会产生负压,泞致溶液不能正常进行离子交换,会使测量数据不准确。
十标准缓冲液pH值对照参考表
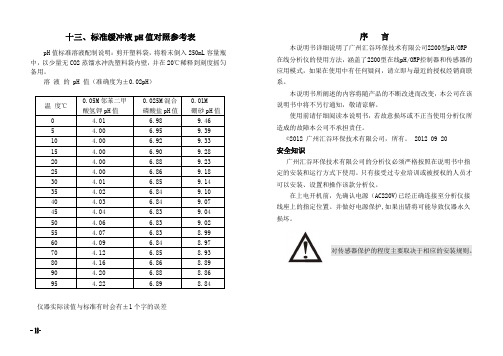
十三、标准缓冲液pH值对照参考表pH值标准溶液配制说明:剪开塑料袋,将粉末倒入250mL容量瓶中,以少量无CO2蒸馏水冲洗塑料袋内壁,并在20℃稀释到刻度摇匀备用。
溶液的 pH 值(准确度为±0.02pH)温度℃0.05M邻苯二甲酸氢钾pH值0.025M混合磷酸盐pH值0.01M硼砂pH值0 4.01 6.98 9.465 4.00 6.95 9.3910 4.00 6.92 9.3315 4.00 6.90 9.2820 4.00 6.88 9.2325 4.00 6.86 9.1830 4.01 6.85 9.1435 4.02 6.84 9.1040 4.03 6.84 9.0745 4.04 6.83 9.0450 4.06 6.83 9.0255 4.07 6.83 8.9960 4.09 6.84 8.9770 4.12 6.85 8.9380 4.16 6.86 8.8990 4.20 6.88 8.8695 4.22 6.89 8.84 仪器实际读值与标准有时会有±1个字的误差序言本说明书详细说明了广州汇谷环保技术有限公司2200型pH/ORP在线分析仪的使用方法,涵盖了2200型在线pH/ORP控制器和传感器的应用模式,如果在使用中有任何疑问,请立即与最近的授权经销商联系。
本说明书所阐述的内容将随产品的不断改进而改变,本公司在该说明书中将不另行通知,敬请谅解。
使用前请仔细阅读本说明书,若故意损坏或不正当使用分析仪所造成的故障本公司不承担责任。
©2012 广州汇谷环保技术有限公司,所有。
2012 09 20安全知识广州汇谷环保技术有限公司的分析仪必须严格按照在说明书中指定的安装和运行方式下使用。
只有接受过专业培训或被授权的人员才可以安装、设置和操作该款分析仪。
在上电开机前,先确认电源(AC220V)已经正确连接至分析仪接线座上的指定位置。
并做好电源保护,如果出错将可能导致仪器永久损坏。
检测pH计准不准

测ph计准不准?唯一可靠和最简单的方法就是以ph标准缓冲溶液来进行检定。
取三个ph标准缓冲溶液:ph6.86、ph4.00、ph9.18(最好是新鲜配制并且温度相同),以ph6.86进行定位校准,以ph4.00进行斜率校准,然后测试ph9.18看ph计是否准确,是否合格立见分晓。
如果精度不合格,还可以进一步判断是ph计有问题还是PH电极有问题。
当ph电极玷污导致性能下降或不能使用时,请按以下方式清洗后再校正,有可能使ph电极得以恢复,否则请购买新的ph电极:1.用0.1mol/L HCl 或HNO浸泡半小时,然后再用贮存液浸泡1小时。
2.电极沉积物的清洗:2-1.蛋白质:用1%胃蛋白酶的盐酸溶液(HCl浓度为0.1mol/L)浸泡15分钟,或用10%的次氯酸钠溶液浸泡5分钟。
2-2.无机物:用0.1mol/L的EDTA溶液浸泡15分钟。
2-3.脂肪及油:用温和的洗涤剂或甲醇溶液清洗。
3.清洗之后凉干,检查内充液的量(若太少请填充),再把ph电极放入贮存液中至少1小时。
4.若没有贮存液可在200mL(pH=7缓冲溶液)溶液中加入1gKCl摇匀后暂时使用。
1. 在线ph计变送器屏幕出现“E.rr”?答:P H超出量程范围。
可能:指示电极接线断开。
2. 在线ph计变送器的数字胡乱跳动,与水质不符?答:可能指示参比接线处漏电,尝试用无水酒精擦拭接线端子,并保持接线处湿度满足技术要求。
3. 在线P H变送器无控制信号输出?答:检查屏幕是否处在正常模式。
4. 感觉在线变送器测量值不准?答:将在线ph计电极取出按说明书清洗并校正,如在ph计校准过程中无法校正,请尝试更换电极。
5. 电极反应较慢?答:当温度较低时,电极内阻增大,反应会较慢。
当球泡被脏物覆盖, 液接界被脏物堵塞,反应会变慢,请尝试清洗电极。
6. 电极放入任何溶液中P H不变?答:电极球泡已破裂,需更换电极。
电极与仪器接线处脱落,请检查。
电极电缆内部断裂,请更换或送回修理。
pH标准缓冲溶液(pH=9.18)

pH 标准缓冲溶液(pH=9.18)简介:pH 标准溶液的pH 值是已知的,并达到规定的准确度,其pH 值有良好的复现性和稳定性,具有较大的缓冲容量,较小的稀释值和较小的温度系数。
该pH 标准缓冲溶液常用于酸度计的定位和斜率校准,其准确度范围在±0.01pH 。
pH 标准缓冲溶液(pH=9.18)是特指在25℃下,pH=9.18。
组成:操作步骤(三点校准通用,仅供参考):1、 将pH 电极在纯水中清洗干净并甩干。
2、 用温度计测量pH 标准缓冲溶液的温度,并将pH 计的温度值调整准确。
自动温度pH 计无需该步骤。
3、 定位校正:将pH 电极浸入pH 标准缓冲溶液(pH=6.86)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的6.86,再显示pH 校准数值,表示pH6.86的校准完成。
4、 斜率校准Ⅰ: 取出pH 电极,用纯水清洗干净并甩干。
将pH 电极浸入pH 标准缓冲溶液(pH=4.00)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的4.00,再显示pH 校准数值,表示pH4.00的校准完成。
完成校准后会自动显示电极在该线性段的斜率百分比(如显示99%)。
5、 斜率校准Ⅱ: 取出pH 电极,用纯水清洗干净并甩干。
将pH 电极浸入pH 标准缓冲溶液(pH=9.18)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的9.18,再显示pH 校准数值,表示pH9.18的校准完成。
完成校准后会自动显示电极在该线性段的斜率百分比(如显示98%)。
注意事项:1、 如果每次的使用量很小,可以适当分装后再使用,尤其以pH 标准缓冲溶液(pH=9.18)较易失效。
2、 显示pH 校准数值时,pH 值会随温度不同而不同,例如在定位校正中,25℃时显示6.86,15℃时就显示6.90。
编号 名称OR0003 OR0003 OR0003 StoragepH 标准缓冲溶液(pH=9.18) 50ml100ml500ml4℃使用说明书1份3、根据pH等温测量原理,被测溶液的温度与校准溶液的温度越接近,其测量的准确度就越高。
如何判断您的PH计测定的pH值是否准确

如何判断您的PH计测定的pH值是否准确?如何判断您的PH计测定的pH值是否准确?有人以工作经验来判断,有人以PH试纸来判断,也有人以过去使用的PH计来判断,有人以自来水或蒸馏水来判断,这些都是不可靠的。
其实,唯一可靠和最简单的方法就是以PH标准缓冲溶液来来进行检定。
这是唯一的检测标准。
第一个方法:取三个标准缓冲溶液:PH6.86、PH4.00、PH9.18(最好是新鲜配制并且温度相同),以PH6.86F进行定位校准,以PH4.00进行斜率校准,然后测试PH9.18,PH计是否准确,是否合格立见分晓.如果精度不合格还可以进一步判断是PH计有问题还是PH电极有问题。
第二个方法:(1)电极极洗净并甩干,浸入PH6.86或PH7.00标准溶液中,温度补偿旋钮置于溶液温度处。
待示值稳定后,调节定位旋钮使仪器示值为标准溶液的PHs值。
(2)取出电极洗净并甩干,浸入第二种标准溶液。
待示值稳定后,调节仪器斜率旋钮,使仪器的示值为第二种标准溶液的PHs值。
(3)电极极洗净并甩干,再浸入PH6.86或PH7.00标准溶液中,如果误差超过0.02PH,则重复第(1),(2)步聚。
直至在二种标准溶液中不需要调节旋钮都能显示正确的PHs值。
(4)取出电极洗净并甩干,将PH温度补偿旋钮调节至样品温度,将电极浸入样品溶液,晃动后静止放置,显示稳定后读数。
电化学分析技术利用物质的电化学性质,测定化学电池的电位、电流或电量的变化进行分析的方法称为电化学分析法。
电化学分析法有多种,如测定原电池电动势以求物质含量的分析方法称为电位法(potential method)或电位分析法;通过对电阻的测定以求物质含量的分析法称为电导法;而借助某些物理量的突变作为滴定分析终点的指示,则称为电容量分析法等。
电位分析法是利用电极电位和浓度之间的关系来确定物质含量的分析方法,表示电极电位的基本公式是能斯特方程式。
由于单个电极电位的绝对值无法测量,在大多数情况下,电位法是基于测量原电池的电动势,构成电池的两个电极,一个电极的电位随待测离子浓度而变化,能指示待测离子浓度,称为指示电极;另一个电极的电位则不受试液组成变化的影响,具有较恒定的数值,称为参比电极。
pH标准缓冲溶液(pH=6.86)

pH 标准缓冲溶液(pH=6.86)简介:pH 标准溶液的pH 值是已知的,并达到规定的准确度,其pH 值有良好的复现性和稳定性,具有较大的缓冲容量,较小的稀释值和较小的温度系数。
该pH 标准缓冲溶液常用于酸度计的定位和斜率校准,其准确度范围在±0.01pH 。
pH 标准缓冲溶液(pH=6.86)是特指在25℃下,pH=6.86。
组成:操作步骤(三点校准通用,仅供参考):1、 将pH 电极在纯水中清洗干净并甩干。
2、 用温度计测量pH 标准缓冲溶液的温度,并将pH 计的温度值调整准确。
自动温度pH 计无需该步骤。
3、 定位校正:将pH 电极浸入pH 标准缓冲溶液(pH=6.86)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的6.86,再显示pH 校准数值,表示pH6.86的校准完成。
4、 斜率校准Ⅰ: 取出pH 电极,用纯水清洗干净并甩干。
将pH 电极浸入pH 标准缓冲溶液(pH=4.00)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的4.00,再显示pH 校准数值,表示pH4.00的校准完成。
完成校准后会自动显示电极在该线性段的斜率百分比(如显示99%)。
5、 斜率校准Ⅱ: 取出pH 电极,用纯水清洗干净并甩干。
将pH 电极浸入pH 标准缓冲溶液(pH=9.18)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的9.18,再显示pH 校准数值,表示pH9.18的校准完成。
完成校准后会自动显示电极在该线性段的斜率百分比(如显示98%)。
注意事项:1、 如果每次的使用量很小,可以适当分装后再使用,尤其以pH 标准缓冲溶液(pH=9.18)较易失效。
2、 显示pH 校准数值时,pH 值会随温度不同而不同,例如在定位校正中,25℃时显示6.86,15℃时就显示6.90。
编号 名称OR0002 OR0002 OR0002 StoragepH 标准缓冲溶液(pH=6.86) 50ml100ml500ml4℃使用说明书1份3、根据pH等温测量原理,被测溶液的温度与校准溶液的温度越接近,其测量的准确度就越高。
电极校正方法

PH/OD电极校正方法步骤如下(仅供
参考)
PH点击校正:
在PH点击校正方面我们采用了先进的两点自动矫正法,
第一步:在第一点,把PH电极放入6.86的标准缓冲溶液中,在“第一次采集P H值”处输入标准值6.86,待当前电压稳定或是趋于稳定后,点击“第一步确认”(此时测的电压与当前电压差值不大于0.01时数值可信),记录数值
第二步:在第二点,把PH电极放入4.00(酸性发酵)或9.18(碱性发酵)的标准溶液中,在“第二次采集P H值”处输入标准值4.00或9.18,待当前电压稳定或趋于稳定后点击“第二步确认”(此时测的电压与当前电压差值不大于0.01时数值可信)记录数
值
第三步:点击“第三步:计算“新的斜率和零位通过程序自动计算完成。
将校正好的PH电极重新放入PH为6.86的标准缓冲液中检测电极是否准确,如不准确重复上述步骤直到电极准确为止。
DO电极校正
在DO电极校正方面我们采用先进的两点矫正法
第一步:先在“第一点D O设定然后把D O”电极放入饱和的亚硫酸钠溶液中(温度与发酵液温度一致),待当前电压稳定或趋于稳定后点击“第一步确认”(此时当前电压与测的电压差值不大于0.01认为数值可信)记录数值
第二步:把DO电极放入饱和的湿润的空气中我们采取将电极包入用蒸馏水完全润湿的纸巾中(最好空气温度与发酵温度一
致)在“第二点D O设定值处输入100”,待电压稳定或趋于稳定后电极“第二步确认”(此时当前电压与测的电压差值不大于0.01是认为数值可信)记录数值
第三步:点击“第三部:计算”系统会自动计算出新的斜率和零位点,把DO电极放入饱和的亚硫酸溶液中检测电极是否校正准确,如果不准确重复上述步骤直到准确位置。
常用PH缓冲溶液
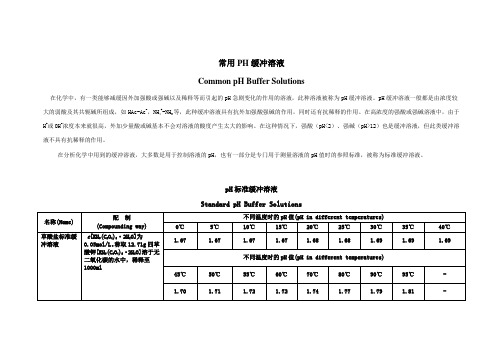
常用PH缓冲溶液
Common pH Buffer Solutions
在化学中,有一类能够减缓因外加强酸或强碱以及稀释等而引起的pH急剧变化的作用的溶液,此种溶液被称为pH缓冲溶液。
pH缓冲溶液一般都是由浓度较大的弱酸及其共轭碱所组成,如HAc-Ac-,NH4+-NH3等,此种缓冲溶液具有抗外加强酸强碱的作用,同时还有抗稀释的作用。
在高浓度的强酸或强碱溶液中,由于H+或OH-浓度本来就很高,外加少量酸或碱基本不会对溶液的酸度产生太大的影响。
在这种情况下,强酸(pH<2)、强碱(pH>12)也是缓冲溶液,但此类缓冲溶液不具有抗稀释的作用。
在分析化学中用到的缓冲溶液,大多数是用于控制溶液的pH,也有一部分是专门用于测量溶液的pH值时的参照标准,被称为标准缓冲溶液。
pH标准缓冲溶液
Standard pH Buffer Solutions
注:为保证pH值的准确度,上述标准缓冲溶液必须使用pH基准试剂配制。
常用pH缓冲溶液的配制和pH值
Preparation and pH Values of Common pH Buffer Solutions
B液:0.2mol/L碳酸钠溶液(21.2g无水碳酸钠,加水溶解,稀释至1L)以上两溶液按不同比例混合即可得到不同pH值的缓冲溶液
pH A的体积 B的体积水的体积
8.0 88.8 11.2mL 100
9.0 63.0 37.0mL 100
10.0 29.1 70.9mL 100
11.0 3.5 96.5mL 100。
标准溶液配制和标定要点

1、氢氧化钠标准滴定溶液1.1配制称取110 g氢氧化钠,溶于100 ml无二氧化碳的水中,摇匀,注人聚乙烯容器中,密闭放置至溶液清亮。
按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1 000MI,摇匀。
表11.2 标定按表 2 的规定称取于 105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30 s。
同时做空白试验。
表2氢氧化钠标准滴定溶液的浓度〔c(NaOH)],数值以摩尔每升(mol/ L)表示,按式(1)计算:m×1000c(NaOH)= -------------( V1-V2)M式中 :m—邻苯二甲酸氢钾的质量的准确数值,单位为克(9);V1 —氢氧化钠溶液的体积的数值,单位为毫升(mL);V2 一空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL);M一邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)【M(KHC8H4O4)= 204.22 】2、硫酸标准滴定溶液2.1配制按表3的规定量取硫酸,缓缓注人1 000 mL水中,冷却,摇匀。
表32.2标定按表4的规定称取于270℃—300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50m l.水中,加5甲基红—亚甲基蓝指示剂(或滴澳甲酚绿一甲基红指示液),用配制好的硫酸溶液滴定至溶液由绿色变为紫色(绿色变为暗红色),煮沸2 min,冷却后继续滴定至溶液再呈紫色(暗红色)。
同时做空白试验。
表4硫酸标准滴定溶液的浓度[c(1/2H2SO4)],数值以摩尔每升(mol/L)表示m×1000c(1/2H2SO4)= -------------( V1-V2)M式中:m—无水碳酸钠的质量的准确数值,单位为克(g);V1—硫酸溶液的体积的数值,单位为毫升(mL) ;V2—空白试验硫酸溶液的体积的数值,单位为毫升(mL) ;M—无水碳酸钠的摩尔质量的数值,单位为克每摩尔(g/mol)[M(1/2Na2CO3 )=52.994]3、氯化钠标准溶液(1ml含1mg氯离子):称取基准试剂或者优级纯的3-4g氯化钠置于瓷坩埚内,于高温炉内升温至500度灼烧10分钟,然后放入干燥器内冷却至室温,然后准确称取1.649g氯化钠,先溶于少量除盐水,然后在容量瓶中稀释至1000ml。
pH标准缓冲溶液

缓冲液-介绍1)缓冲溶液作用原理和pH值当往某些溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用,称为缓冲作用,这样的溶液叫做缓冲溶液。
弱酸及其盐的混合溶液(如HAc与NaAc),弱碱及其盐的混合溶液(如NH3·H2O与NH4Cl)等都是缓冲溶液。
由弱酸HA及其盐NaA所组成的缓冲溶液对酸的缓冲作用,是由于溶液中存在足够量的碱A-的缘故。
当向这种溶液中加入一定量的强酸时,H 离子基本上被A-离子消耗:所以溶液的pH值几乎不变;当加入一定量强碱时,溶液中存在的弱酸HA消耗OH-离子而阻碍pH的变化。
缓冲液-能力2)缓冲溶液的缓冲能力在缓冲溶液中加入少量强酸或强碱,其溶液pH值变化不大,但若加入酸,碱的量多时,缓冲溶液就失去了它的缓冲作用。
这说明它的缓冲能力是有一定限度的。
缓冲溶液的缓冲能力与组成缓冲溶液的组分浓度有关。
0.1mol·L-1HAc和0.1mol· L-1NaAc组成的缓冲溶液,比0.01mol·L-1HAc和0.01mol·L-1NaAc的缓冲溶液缓冲能力大。
关于这一点通过计算便可证实。
但缓冲溶液组分的浓度不能太大,否则,不能忽视离子间的作用。
组成缓冲溶液的两组分的比值不为1∶1时,缓冲作用减小,缓冲能力降低,当c(盐)/c (酸)为1∶1时△pH最小,缓冲能力大。
不论对于酸或碱都有较大的缓冲作用。
缓冲溶液的pH值可用下式计算:此时缓冲能力大。
缓冲组分的比值离1∶1愈远,缓冲能力愈小,甚至不能起缓冲作用。
对于任何缓冲体系,存在有效缓冲范围,这个范围大致在pKaφ(或pKbφ)两侧各一个pH单位之内。
弱酸及其盐(弱酸及其共轭碱)体系pH=pKaφ±1弱碱及其盐(弱碱及其共轭酸)体系pOH=pKbφ±1例如HAc的pKaφ为4.76,所以用HAc和NaAc适宜于配制pH为3.76~5.76的缓冲溶液,在这个范围内有较大的缓冲作用。
pH校正液配制方法

标准缓冲溶液的配制
1、苯二甲酸氢钾缓冲溶液
称取在温度110°C干燥箱烘干的分析纯苯二甲酸氢钾(KHC8H4O4)10.21克,溶于蒸馏水中,并稀释至1升,此溶液的PH值为4.01(25°C)。
2、磷酸型缓冲溶液
称取在温度110°C干燥箱烘干二小时的分析纯磷酸二氢钾(KH2PO4)3.40克和分析纯磷酸氢二钠(Nn2HPO4)3.55克,溶于脱除CO2 的蒸馏水中,并稀释至1升,此溶液的PH值为6.86(25°C)。
3、硼酸钠缓冲溶液
称取3.81克分析纯硼酸钠(Na2B4O7?10H2O),溶于1升脱除CO2的蒸馏水中,此溶液的PH值为9.18(25°C)。
缓冲溶液储于硬质玻璃瓶或塑料瓶中,能稳定1~2个月
刚从网上查到的,可惜没有试剂还得去买。
可怜啊,公司什么都没有拿什么去开展实验真是的
三种PH校正液的配置:
4.00 邻苯二甲酸氢钾 0.05M
6.86 混合磷酸盐 0.025M
9.18 四硼酸钠 0.01M。
煤质化验仪器测量PH值和MV值的方法

煤炭化验煤炭化验厂家煤质化验仪器是煤炭质检室仪器设备的总称,包括酸度计、量热仪、分光度计、测硫仪等,以下介绍下酸度计测量PH值和MV值的方法。
(一)pH值的测定1 在测定溶液pH值时,将pH电极,参比电极,和电源分别插入相应的插座中.将功能开关拨止pH位置.2 仪器接通电源预热30分钟(预热时间越长越稳定)后,将所有电极插入pH6.86标准缓冲溶液(第一种)中,平衡一段时间(主要考虑电极电位的平衡),待遇读数稳定后,调节定位调节器,使仪器显示6.86.3用蒸馏水冲洗电极并用吸水纸擦干后,插入pH4.01标准缓冲溶液(第二种)中,待遇读数稳定后,调节斜率调节器,使仪器显示4.01.仪器就校正完毕.为了保证精度建议以上2,3两个标定步骤重复一,二次.一旦仪器校正完毕,"定位"和"斜率"调节器不得有任何变动.4 用蒸馏水冲洗电极并用吸水纸擦干后,插入样品溶液中进行测量.若测定偏碱性的溶液时,应用pH6.86标准缓冲溶液(第一种)和pH9.18标准缓冲溶液(第二种)来校正仪器.为了保证pH值的测量精度要求每次使用前必须用标准溶液加于校正.注意校正时标准溶液的温度与状态(静止还是流动)和被测液的温度与状态要应尽量一致.在使用过程中,遇到下列情况时仪器必须重新标定:①换用新电极;②"定位"或"斜率"调节器变动过.(二)mV测定1 在测定溶液ORP(Eh)时,将铂电极和饱和甘汞电极和电源分别插入相应的插座中.2 将功能开关拨止mV位置.3 将电极插入被测溶液中,即可进行测定.五仪器的维护与注意事项1 仪器的输入端(包括玻璃电极插座与插头)必须保持干燥清洁.2 新玻璃pH电极或长期干储存的电极,在使用前应在pH浸泡液中浸泡24小时后才能使用. 3pH电极在停用时,就将电极的敏感部分浸泡在pH浸泡液中.这对改善电极响应迟钝和延长电极寿命是非常有利的. pH浸泡液的正确配制方法:取pH4.00缓冲剂(250mL)包,溶于250mL纯水中,再加入56克分析纯KCl,适当加热,搅拌至完全溶解即成.4 在使用复合电极时,溶液一定要超过电极头部的陶瓷孔.电极头部若沾污可用医用棉花轻擦5 玻璃pH电极和甘汞电极在使用时,必须注意内电极与球泡之间及参比电极内陶瓷蕊附近是否有气泡存在,如有必须除了.6 用标准溶液标定时,首先要保证标准缓冲溶液的精度,否则将引起严重的测量误差.标准溶液可自行配制,但最好用国家传递的标准缓冲溶液.7 忌用浓硫酸或铬酸洗液洗涤电极的敏感部分.不可在无水或脱水的液体(如四氯化碳,浓洒精)中浸泡电极.不可在碱性或氟化物的体系,粘土及其它胶体溶液中放置时间过长,以致响应迟钝.8 常温电极一般在5-60℃温度范围内使用.如果在低于5℃或高于60℃时使用,请分别选用特殊的低温电极或高温电极.(三)酸度计的功能与特点该煤质化验仪器用于测量悬浮于水或透明液体中不溶性颗粒物质所产生的光的散射程度,并能定量表征这些悬浮颗粒物质的含量。
如何校正ph检测笔

鉴于很多朋友都不知道如何校正ph检测笔,现总结详细校正步骤如下:
1、分开把6.86标准校正液和4.01标准校正液导入两个干净的容器中。
2、先将电极端插入ph6.86标准缓冲溶液中,如果显示数值出现偏差,请用小螺丝刀调整仪
器上端电池盒旁的调节螺钉,轻微旋动,直至达到显示标准数值。
3、再将仪器插入ph4.01标准缓冲溶液中进行校正,如果显示数值出现偏差,且将仪器上端
的电池盒轻轻取出,用小螺丝刀调节仪器内线路板上端的调节螺钉,轻微旋动,直至达到显示标准数值,校正完毕取出仪器进行清洗并用滤纸吸干。
4、再将仪器插入ph6.86校正液或者ph7.00标准缓冲溶液中,再一次进行标定。
显示标准
数值,校正完毕。
如想了解更多相关信息请关注正大仪器。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pH 标准缓冲溶液(pH=6.86)
简介:
pH 标准溶液的pH 值是已知的,并达到规定的准确度,其pH 值有良好的复现性和稳定性,具有较大的缓冲容量,较小的稀释值和较小的温度系数。
该pH 标准缓冲溶液常用于酸度计的定位和斜率校准,其准确度范围在±0.01pH 。
pH 标准缓冲溶液(pH=6.86)是特
指在25℃下,pH=6.86。
组成:
操作步骤(三点校准通用,仅供参考):
1、 将pH 电极在纯水中清洗干净并甩干。
2、 用温度计测量pH 标准缓冲溶液的温度,并将pH 计的温度值调整准确。
自动温度pH 计
无需该步骤。
3、 定位校正:将pH 电极浸入pH 标准缓冲溶液(pH=6.86)中,稍微搅动后静止放置,待测量
值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的6.86,再显示pH 校准数值,表示pH6.86的校准完成。
4、 斜率校准Ⅰ: 取出pH 电极,用纯水清洗干净并甩干。
将pH 电极浸入pH 标准缓冲溶液
(pH=4.00)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的4.00,再显示pH 校准数值,表示pH4.00的校准完成。
完成校准后会自动显示电极在该线性段的斜率百分比(如显示99%)。
注意事项:
1、 如果每次的使用量很小,可以适当分装后再使用,尤其以pH 标准缓冲溶液(pH=9.18)
较易失效。
2、 显示pH 校准数值时,pH 值会随温度不同而不同,例如在定位校正中,25℃时显示6.86,
15℃时就显示6.90。
3、 根据pH 等温测量原理,被测溶液的温度与校准溶液的温度越接近,其测量的准确度就越高。
4、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:12个月有效。
编号 名称
OR0002 OR0002 OR0002 Storage
pH 标准缓冲溶液(pH=6.86) 50ml
100ml
500ml
4℃
使用说明书
1份
附录:不同温度下,pH标准缓冲溶液对应的pH值。
pH4.00 pH6.86 pH9.18
5℃ 4.00 6.95 9.39
10℃ 4.00 6.92 9.33
15℃ 4.00 6.90 9.28
20℃ 4.00 6.88 9.23
25℃ 4.00 6.86 9.18
30℃ 4.01 6.85 9.14
35℃ 4.02 6.84 9.11
40℃ 4.03 6.84 9.07
45℃ 4.04 6.83 9.04
50℃ 4.06 6.83 9.02
55℃ 4.07 6.83 8.99
60℃ 4.09 6.84 8.97
相关:
编号名称
DC0032 Masson三色染色液
DF0135 多聚甲醛溶液(4% PFA)
NH0043 SSC缓冲液(20×,pH7.0)
NR0001 DEPC处理水(0.1%)
OR0002 pH标准缓冲溶液(pH=6.86)
PT0013 考马斯亮蓝快速染色液
PW0111 Super ECL Plus超敏发光液
TC1243 甘油三脂(TG)检测试剂盒(GPO-PAP单试剂比色法)。
