pH标准缓冲溶液及常用pH缓冲溶液的配制
常用缓冲溶液的配制及PH计校正溶液配置方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L )242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )9.巴比妥钠-盐酸缓冲液(18℃)10.Tris–盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100三羟甲基氨基甲烷(Tris )HOCH2 CH2OH CHOCH2 NH2分子量=121.14;0. 1M 溶液为12.114克/升。
常用pH缓冲液缓冲液缓冲范围
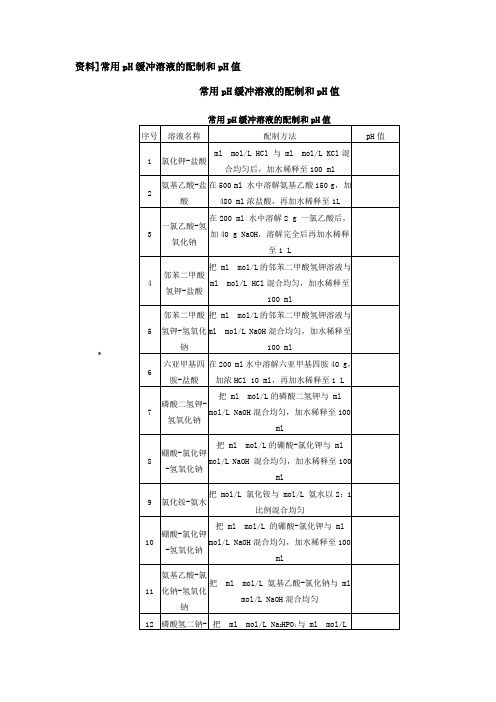
资料]常用pH缓冲溶液的配制和pH值•常用pH缓冲溶液的配制和pH值一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在~之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.),用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,.)(或者Na2HPO4·2H2O )用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
•(三)L PB液Na2HPO4·2H2O分子量= L溶液含L。
Na2HPO4·12H2O分子量= L溶液含L。
NaH2PO4·H2O分子量= L溶液含L。
NaH2PO4·2H2O分子量= L溶液含L。
(四)L PB缓冲液L Na2HPO4·2 H2O溶液LNa2HPO4·12 H2O溶液含LLNaH2PO4·H2O溶液含LNaH2PO4·2 H2O溶液含L欲配L PB缓冲液则在L PB缓冲液的基础上加H2O稀释1倍即可。
ph缓冲溶液的配制方法

ph缓冲溶液的配制方法PH缓冲溶液是指在一定范围内,具有缓冲pH值的溶液,适用于化学、生物、医药等各个领域的实验和应用。
在实验中,通常需要制备一定浓度和pH值的缓冲溶液,以保证实验结果的准确性和可重复性。
本文将介绍几种常见的缓冲溶液配制方法。
一、磷酸缓冲液(PBS)磷酸缓冲液是一种常用的生物化学实验缓冲液,可以用于细胞培养、酶活性测定、免疫学实验等等。
其配制方法如下:1. 准备250ml坐标瓶,称取1.37g Na2HPO4·12H2O和0.26g KH2PO4。
3. 将两个溶液混合,加入NaCl使溶液最终重量达到250g,调节pH值至7.4-7.6,如果pH值过低,可加入1M NaOH调节,反之加入1M HCl。
二、三氯醋酸缓冲液(TCA)三氯醋酸缓冲液是一种酸性缓冲液,适用于蛋白质的沉淀和提取等实验。
其配制方法如下:1. 准备250ml坐标瓶,在其中加入11.9g三氯乙酸,加入去离子水至250ml。
2. 调节溶液pH值至2.0-2.5,可使用无水HCl或NaOH来调节pH值。
3. 再加入去离子水,使溶液最终体积达到500ml,并根据需要添加NaCl和KCl等。
五、TRIS缓冲液TRIS缓冲液是一种常用的生化和细胞学实验用缓冲液,其缓冲范围在7.0~9.2之间。
其配制方法如下:1. 准备500ml坐标瓶,称取12.11g Tris-Base。
3. 在室温下缓慢加入0.1M HCl溶液,同时使用pH计监测溶液pH值,当pH值达到所需值时停止加入。
4. 将溶液体积补至500ml,并调节pH值。
可根据实验需要调节缓冲液中的NaCl或其他化学物质的浓度。
以上就是几种常见缓冲溶液的配制方法,需要注意的是在配制过程中,一定要严格按照实验要求和操作规程进行,以获得准确的实验结果。
同时,制备的缓冲液要遵循使用前检测pH值、滤过消毒等规定操作,以保证实验的可重复性和安全性。
常用缓冲溶液配制方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量 = 358.14,0.2 mol/L 溶液为71.628克/升。
NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4,配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。
经常使用pH缓冲溶液的配制和pH值
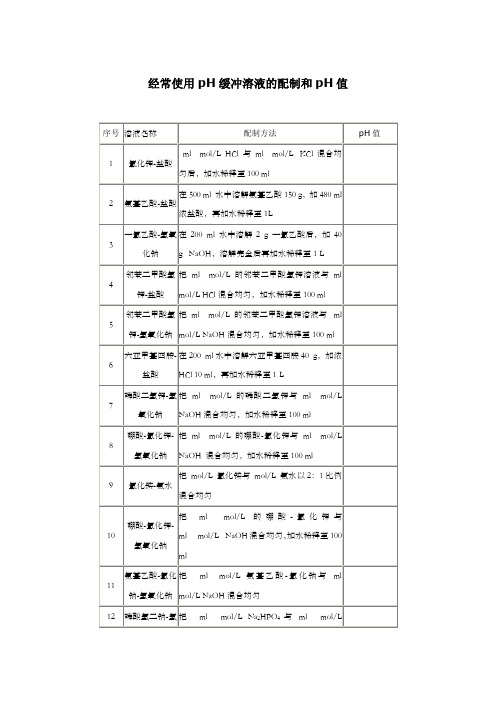
经常使用pH缓冲溶液的配制和pH值一、经常使用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量 试剂分为优级纯(保证试剂,Guaranteed reagent ,G .R .)、分析试剂(Antalytical reagent ,A .R .)化学纯(Chemical pure ,C .P .)和实验试剂(Laboratory reagent ,L .R .)等等。
工业用的化学试剂,杂质较多,只在个别情形下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精准。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH 在~之间才可应用,在组织培育等特殊用途时应注意此项要求,配制一样化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应当即除菌处置(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)(1/15)Mol/L 磷酸缓冲液1.1/15Mol/L 磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH 2PO 4,A .R .),用蒸馏水溶解后,倾入1 000ml 容量瓶内,再稀释至刻度(1 000ml )。
2.1/15Mol/L 磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na 2HPO 4,.)(或Na 2HPO 4·2H 2O )用蒸馏水溶解后,放入1 000ml 容量瓶内,再加蒸馏水稀释至刻度(1 000ml )。
3.按附表的比例,配制成不同pH 值的缓冲溶液。
附表1 磷酸盐缓冲液配制法(单位:毫升)(三)L PB 液附表2 LPB 液配制法Na 2HPO 4·2H 2O 分子量= L 溶液含L 。
Na 2HPO 4·12H 2O 分子量= L 溶液含L 。
NaH 2PO 4·H 2O 分子量= L 溶液含L 。
NaH 2PO 4·2H 2O 分子量= L 溶液含L 。
(四)L PB 缓冲液附表3 L PB 缓冲液配制法L Na 2HPO 4·2 H 2O 溶液L Na 2HPO 4·12 H 2O 溶液含L LNaH 2PO 4·H 2O 溶液含L NaH 2PO 4·2 H 2O 溶液含L欲配L PB 缓冲液那么在L PB 缓冲液的基础上加H 2O 稀释1倍即可。
常用pH缓冲溶液的配制和pH值
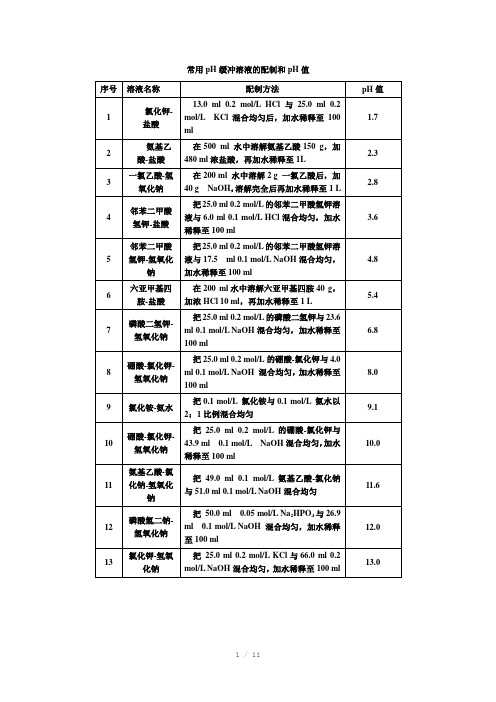
常用pH缓冲溶液的配制和pH值25℃下0.1mol/l磷酸钾缓冲液的配制来源:互联网作者:未知发布时间:2006-09-25你会看到这个提示,那是因为你的系统无法识别某栏目的模型信息,或者你新建模型后,没为这个模型设计单独的模板。
不同模型的文档浏览页的模板为:article_模型名字标识.htm 如“article_article.htm”,更多的信息你可以在频道模型管理的地方查看。
3.磷酸氢二钠-柠檬酸缓冲液pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml2.2 0.40 19.6 5.2 10.72 9.282.4 1.24 18.76 5.4 11.15 8.852.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.783.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.53 4.2 8.28 11.72 7.2 17.39 2.61 4.48.82 11.18 7.4 18.17 1.834.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.855.0 10.30 9.70 8.0 19.45 0.55Na2HPO4分子量=141.98 0.2M溶液含28.40g/LNa2HPO4·2H2O分子量=178.05 0.2M溶液含35.61g/LC6H8O7·H2O分子量=210.14 0.1M溶液含21.01g/L4.柠檬酸-氢氧化钠-盐酸缓冲液回复人:leeping,▲(******************.cn)时间:2006-3-292楼9:02:44 编辑pH 钠离子浓度/M 柠檬酸C6H8O7·H2O/g 氢氧化钠NaOH/g 浓盐酸HCl/ml 终体积/L2.2 0.20 210 84 160 103.1 0.20 210 83 116 103.3 0.20 210 83 106 104.3 0.20 210 83 45 105.3 0.35 245 144 68 105.8 0.45 285 186 105 106.5 0.38 266 156 126 10使用时可以每升中加入1g酚,若最后pH有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
常用缓冲溶液的配制和PH计校正溶液配置方法

常用缓冲溶液的配制和P H计校正溶液配置方法精选文档TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(L)X毫升 mol/L甘氨酸+Y毫升 mol/L HCI,再加水稀释至200毫升甘氨酸分子量 = , mol/L甘氨酸溶液含克/升。
2.邻苯二甲酸–盐酸缓冲液( mol/L)X毫升 mol/L邻苯二甲酸氢钾 + mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = , mol/L邻苯二甲酸氢溶液含克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量 = , mol/L溶液为克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液含克/升。
C 4H2O7·H2O分子量 = , mol/L溶液为克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液( mol/L)柠檬酸C 6H 8O 7·H 2O :分子量, mol/L 溶液为克/升。
柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量, mol/L 溶液为克/毫升。
6.乙酸–乙酸钠缓冲液( mol/L )Na 2Ac·3H 2O 分子量 = , mol/L 溶液为克/升。
7.磷酸盐缓冲液(1)磷酸氢二钠–磷酸二氢钠缓冲液()Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
Na2HPO4·12H2O分子量 = , mol/L溶液为克/升。
Na2HPO4·2H2O分子量 = , mol/L溶液为克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)1M溶液为克/升。
Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
pH标准缓冲溶液及常用pH缓冲溶液的配制
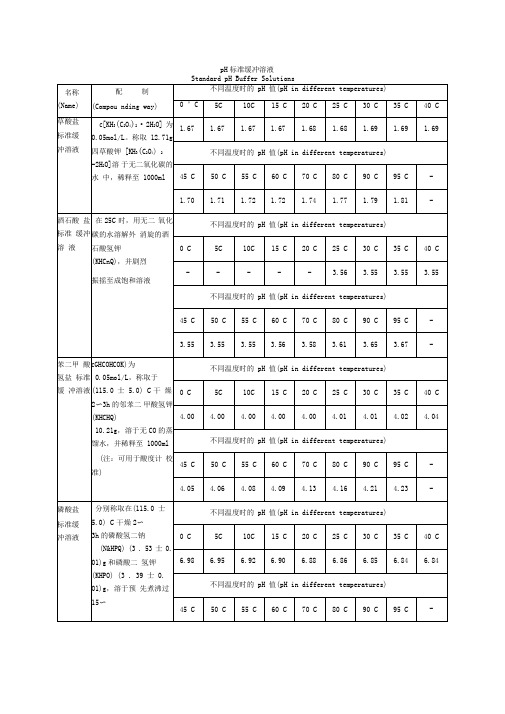
1.67
1.67
1.67
1.68
1.68
1.69
1.69
1.69
不同温度时的pH值(pH in different temperatures)
45C
50C
55C
60C
70C
80C
90C
95C
-
1.70
1.71
1.72
1.72
1.74
1.77
1.79
1.81
-
酒石酸 盐标准 缓冲溶 液
在25C时,用无二 氧化碳的水溶解外 消旋的酒石酸氢钾
把50.0 ml0.05 mol/L NaHPO与26.9 ml0.1
mol/L NaOH混合均匀,加水稀释至100ml
12.0
13
氯化钾-氢氧化钠
把25.0 ml 0.2 mol/L KCl与66.0 ml 0.2 mol/L NaOH
混合均匀,加水稀释至100ml
13.0
酸,再加水稀释至1L
2.3
3
一氯乙酸-氢氧化钠
在200ml水中溶解2g一氯乙酸后,加40gNaOH
溶解完全后再加水稀释至1L
2.8
4
邻苯二甲酸氢钾-盐酸
把25.0 ml 0.2 mol/L的邻苯二甲酸氢钾溶液与6.0 ml
0.1 mol/L HCl混合均匀,加水稀释至100ml
3.6
5
邻苯二甲酸氢钾-氢氧
不同温度时的pH值(pH in different temperatures)
0 °C
5C
10C
15C
20C
25C
30C
35C
40C
9.46
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
55℃
60℃
70℃
80℃
90℃
95℃
-
11.84
11.71
11.57
11.45
-
-
-
-
-
注:为保证pH值的准确度,上述标准缓冲溶液必须使用pH基准试剂配制。
常用pH缓冲溶液的配制和pH值
Preparation and pH Values of Common pH Buffer Solutions
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
-
-
-
-
-
3.56
3.55
3.55
3.55
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
3.55
把25.0 ml 0.2mol/L的邻苯二甲酸氢钾溶液与17.5 ml 0.1mol/LNaOH混合均匀,加水稀释至100 ml
4.8
6
六亚甲基四胺-盐酸
在200 ml水中溶解六亚甲基四胺40 g,加浓HCl10 ml,再加水稀释至1 L
5.4
7
磷酸二氢钾-氢氧化钠
把25.0 ml 0.2mol/L的磷酸二氢钾与23.6 ml 0.1mol/LNaOH混合均匀,加水稀释至100 ml
6.89
-
硼酸盐标准缓冲溶液
c(Na2B4O7·10H2O)称取硼砂(Na2B4O7·10H2O)(3.80± 0.01)g(注意:不能烘!),溶于预先煮沸过 15~30min并迅速冷却的蒸馏水中,并稀释至1000ml。置聚乙烯塑料瓶中密闭保存。存放时要防止空气中的CO2的进入(注:可用于酸度计校准)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
6.98
6.95
6.92
6.90
6.88
6.86
6.85
6.84
6.84
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
6.83
6.83
6.83
6.84
6.85
6.86
6.88
4.23
-
磷酸盐标准缓冲溶液
分别称取在(115.0±5.0)℃干燥2~3h的磷酸氢二钠(Na2HPO4)(3.53±0.01)g和磷酸二氢钾(KH2PO4) (3.39±0.01)g,溶于预先煮沸过15~30min并迅速冷却的蒸馏水中,并稀释至1000ml(注:可用于酸度计校准)
不同温度时的pH值(pH in different temperatures)
70℃
80℃
90℃
95℃
-
9.04
9.01
8.99
8.96
8.92
8.89
8.85
8.83
-
氢氧化钙标准缓冲溶液
在25℃,用无二氧化碳的蒸馏水制备氢氧化钙的饱和溶液。氢氧化钙溶液的浓度c[1/2Ca(OH)2]应在(0.0400~0.0412)mol/L。氢氧化钙溶液的浓度可以酚红为指示剂,用盐酸标准溶液[c(HCl)=0.1mol/L]滴定测出。存放时要防止空气中的二氧化碳的进入。出现混浊应弃去重新配制
1.67
1.67
1.67
1.67
1.68
1.68
1.69
1.69
1.69
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
1.70
1.711.721. Nhomakorabea21.74
1.77
1.79
1.81
-
酒石酸盐标准缓冲溶液
在25℃时,用无二氧化碳的水溶解外消旋的酒石酸氢钾(KHC4H4O6),并剧烈振摇至成饱和溶液
3.55
3.55
3.56
3.58
3.61
3.65
3.67
-
苯二甲酸氢盐标准缓冲溶液
c(C6H4CO2HCO2K)为0.05mol/L,称取于(115.0±5.0)℃干燥 2~3h的邻苯二甲酸氢钾(KHC8H4O4)10.21g,溶于无CO2的蒸馏水,并稀释至1000ml
(注:可用于酸度计校准)
不同温度时的pH值(pH in different temperatures)
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
13.42
13.21
13.00
12.81
12.63
12.45
12.30
12.14
11.98
不同温度时的pH值(pH in different temperatures)
45℃
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
9.46
9.40
9.33
9.27
9.22
9.18
9.14
9.10
9.06
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
6.8
8
硼酸-氯化钾-氢氧化钠
把25.0 ml 0.2mol/L的硼酸-氯化钾与4.0 ml 0.1mol/LNaOH混合均匀,加水稀释至100 ml
8.0
9
氯化铵-氨水
把0.1mol/L 氯化铵与0.1mol/L 氨水以2:1比例混合均匀
9.1
10
硼酸-氯化钾-氢氧化钠
把25.0 ml 0.2mol/L 的硼酸-氯化钾与43.9 ml 0.1mol/LNaOH混合均匀,加水稀释至100 ml
12.0
13
氯化钾-氢氧化钠
把 25.0 ml 0.2mol/LKCl与66.0 ml 0.2mol/LNaOH混合均匀,加水稀释至100 ml
13.0
10.0
11
氨基乙酸-氯化钠-氢氧化钠
把 49.0 ml 0.1mol/L 氨基乙酸-氯化钠与51.0 ml 0.1mol/LNaOH混合均匀
11.6
12
磷酸氢二钠-氢氧化钠
把 50.0 ml 0.05mol/L Na2HPO4与26.9 ml 0.1mol/LNaOH混合均匀,加水稀释至100 ml
pH标准缓冲溶液
Standard pH Buffer Solutions
名称(Name)
配 制
(Compounding way)
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
草酸盐标准缓冲溶液
c[KH3(C2O4)2·2H2O]为0.05mol/L。称取12.71g四草酸钾[KH3(C2O4)2·2H2O]溶于无二氧化碳的水中,稀释至1000ml
2.3
3
一氯乙酸-氢氧化钠
在200 ml 水中溶解2 g一氯乙酸后,加40 gNaOH,溶解完全后再加水稀释至1 L
2.8
4
邻苯二甲酸氢钾-盐酸
把25.0 ml 0.2mol/L的邻苯二甲酸氢钾溶液与6.0 ml 0.1mol/LHCl混合均匀,加水稀释至100 ml
3.6
5
邻苯二甲酸氢钾-氢氧化钠
序号(No.)
溶液名称
(Solution name)
配制方法
(Preparation)
pH值
(pH value)
1
氯化钾-盐酸
13.0 ml 0.2mol/LHCl与25.0 ml 0.2mol/LKCl混合均匀后,加水稀释至100 ml
1.7
2
氨基乙酸-盐酸
在500 ml 水中溶解氨基乙酸150 g,加480 ml浓盐酸,再加水稀释至1L
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
4.00
4.00
4.00
4.00
4.00
4.01
4.01
4.02
4.04
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
4.05
4.06
4.08
4.09
4.13
4.16
4.21
