缓冲溶液的配制及pH值的测定
缓冲溶液的配制实验报告

一、实验目的1. 学习并掌握缓冲溶液的配制方法。
2. 了解缓冲溶液的性质及其在化学实验中的应用。
3. 熟悉酸碱指示剂的使用方法。
4. 提高实验操作技能。
二、实验原理缓冲溶液是由弱酸及其共轭碱或弱碱及其共轭酸组成的溶液,具有一定的pH值稳定性。
在加入少量强酸或强碱时,缓冲溶液的pH值变化较小,因此常用于调节溶液的pH值。
缓冲溶液的pH值可用Henderson-Hasselbalch方程计算:pH = pKa + log([A-]/[HA])其中,pKa为弱酸的酸解离常数,[A-]为共轭碱的浓度,[HA]为弱酸的浓度。
三、实验材料与仪器材料:1. 0.1 mol/L HCl溶液2. 0.1 mol/L NaOH溶液3. 0.1 mol/L CH3COOH溶液4. 0.1 mol/L NaCH3COO溶液5. 甲基橙指示剂6. 酚酞指示剂7. pH计仪器:1. 烧杯2. 移液管3. 滴定管4. 电子天平5. 恒温水浴锅四、实验步骤1. 配制醋酸-醋酸钠缓冲溶液:a. 用移液管准确量取25.0 mL 0.1 mol/L CH3COOH溶液,转移至烧杯中。
b. 用移液管准确量取25.0 mL 0.1 mol/L NaCH3COO溶液,转移至烧杯中。
c. 将混合溶液用蒸馏水定容至100 mL,搅拌均匀。
2. 测定缓冲溶液的pH值:a. 将缓冲溶液用pH计测定pH值。
b. 重复测定三次,取平均值。
3. 测定缓冲溶液的缓冲容量:a. 在另一支烧杯中加入25.0 mL 0.1 mol/L CH3COOH溶液。
b. 加入2-3滴甲基橙指示剂,观察颜色变化。
c. 用0.1 mol/L NaOH溶液滴定至溶液颜色由黄色变为橙色,记录消耗的NaOH 体积。
d. 重复滴定三次,取平均值。
五、实验结果与讨论1. 缓冲溶液的pH值:通过实验测定,醋酸-醋酸钠缓冲溶液的pH值为4.75,与理论计算值4.74基本相符。
2. 缓冲溶液的缓冲容量:通过实验测定,醋酸-醋酸钠缓冲溶液的缓冲容量为6.7 mmol。
常用缓冲溶液的配制及PH计校正溶液配置方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1mol/L 溶液为29.41克/毫升。
6.乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
(2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L )242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )9.巴比妥钠-盐酸缓冲液(18℃)10.Tris–盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100三羟甲基氨基甲烷(Tris )HOCH2 CH2OH CHOCH2 NH2分子量=121.14;0. 1M 溶液为12.114克/升。
常用pH缓冲溶液的配制和pH值

(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入 1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O11.87g)用蒸馏水溶解后,放入 1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
附表1 磷酸盐缓冲液配制法(单位:毫升)pH 1/15Mol/L Na2HPO4 1/15Mol/L KH2PO4 pH 1/15Mol/L N a2HPO4 1/15Mol/L KH2PO45.8 8.0 92.0 7.1 66.6 23.45.9 9.9 90.1 7.2 72.0 28.06.0 12.2 87.8 7.3 76.8 23.26.1 15.3 84.77.3 80.8 19.26.2 18.6 81.47.5 84.1 15.96.3 22.4 77.6 7.6 87.0 13.06.4 26.7 73.37.7 89.4 10.66.5 31.8 68.27.8 91.58.56.6 37.5 62.5 7.9 93.2 6.86.7 43.5 56.5 8.8 94.7 5.36.8 49.6 50.4 8.1 95.8 4.26.9 55.4 44.6 8.2 97.0 3.07.0 61.1 38.9 8.4 98.0 2.0(三)0.15Mol/L PB液附表2 0.15Mol/LPB液配制法pH 0.15Mol/L Na2HPO4(ml)0.15Mol/L NaH2PO4(ml)6.4 26.5 73.56.6 37.5 62.57.0 61.0 39.07.2 72.0 28.07.4 81.0 19.07.6 87.0 13.0Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
常用pH缓冲溶液的配制和pH值

(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
附表1 磷酸盐缓冲液配制法(单位:毫升)pH 1/15Mol/L Na2HPO4 1/15Mol/L KH2PO4 pH 1/15Mol/L Na2HPO4 1/15Mol/L KH2PO45.8 8.0 92.0 7.1 66.6 23.45.9 9.9 90.1 7.2 72.0 28.06.0 12.2 87.8 7.3 76.8 23.26.1 15.3 84.77.3 80.8 19.26.2 18.6 81.47.5 84.1 15.96.3 22.4 77.6 7.6 87.0 13.06.4 26.7 73.37.7 89.4 10.66.5 31.8 68.27.8 91.58.56.6 37.5 62.5 7.9 93.2 6.86.7 43.5 56.5 8.8 94.7 5.36.8 49.6 50.4 8.1 95.8 4.26.9 55.4 44.6 8.2 97.0 3.07.0 61.1 38.9 8.4 98.0 2.0(三)0.15Mol/L PB液附表2 0.15Mol/LPB液配制法pH 0.15Mol/L Na2HPO4(ml) 0.15Mol/L NaH2PO4(ml)6.4 26.5 73.56.6 37.5 62.56.8 49.0 51.07.2 72.0 28.07.4 81.0 19.07.6 87.0 13.0Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
缓冲溶液的配制及ph值的测定

缓冲溶液的基本概念
缓冲溶液是一种能够抵抗外来 少量强酸或强碱的加入,或者 抵抗稀释时pH值变化的溶液
。
缓冲溶液通常由弱酸及其盐 、弱碱及其盐或多元弱酸(
碱)的酸式盐组成。
缓冲溶液的pH值主要取决于 其共轭酸(碱)的Ka(KB)
清洗和整理
实验结束后,清洗并整理实验器材,确保 清洁无残留。
实验注意事项
试剂纯度
确保所使用的试剂纯度符合实验要求,以 减小误差。
温度影响
注意温度对缓冲溶液和pH计的影响,尽 量在恒温条件下进行实验。
仪器校准
实验前确保pH计已经校准,以保证测量 的准确性。
避免污染
避免缓冲溶液和其他试剂被污染,特别是 在取样和测量过程中。
pH值的测方法
总结词
pH值的测定方法包括酸度计法、试纸 法、滴定法等。
详细描述
酸度计法是一种常用的测定pH值的方法,通过电 位法测量溶液的pH值。试纸法是将溶液滴在专门 的pH试纸上来测定pH值,操作简便但精度较低。 滴定法是通过滴加已知浓度的酸或碱来测定未知溶 液的pH值,需要较高的实验技能和操作技巧。
04
实验操作与注意事项
实验操作流程
准备试剂和器材
根据实验需求,准备所需试剂和器材,如 磷酸氢二钠、磷酸二氢钠、氯化钠、pH计
等。
pH值测定
使用pH计,将缓冲溶液倒入样品杯中,等 待pH计读数稳定后记录pH值。
配制缓冲溶液
按照所需的浓度和体积,计算所需的磷酸 氢二钠和磷酸二氢钠的量,将它们混合并 溶解于水中。
值和缓冲盐的浓度。
02
缓冲溶液的配制
缓冲溶液的配制实验报告

缓冲溶液的配制实验报告缓冲溶液的配制实验报告一、引言缓冲溶液是一种能够维持溶液pH值相对稳定的溶液,它在许多化学和生物学实验中起着重要的作用。
本实验旨在通过配制缓冲溶液的实验操作,探究缓冲溶液的原理和应用。
二、实验目的1. 了解缓冲溶液的基本原理;2. 学会配制不同pH值的缓冲溶液;3. 掌握使用pH计测定溶液pH值的方法。
三、实验原理缓冲溶液的原理基于酸碱中和反应。
当酸和碱的物质摩尔比例为1:1时,溶液的pH值相对稳定。
这是因为当酸性物质向溶液中释放H+离子时,碱性物质会捕获这些H+离子,从而保持溶液pH值的稳定。
四、实验步骤1. 准备所需实验器材和试剂:烧杯、移液管、搅拌棒、pH计、酸和碱溶液;2. 根据实验要求,选择合适的酸和碱溶液,准备不同浓度的缓冲溶液;3. 在烧杯中加入适量的酸溶液,并使用pH计测定其初始pH值;4. 慢慢滴加碱溶液到酸溶液中,同时用搅拌棒搅拌均匀;5. 每滴加一滴碱溶液后,使用pH计测定溶液的pH值,直到达到目标pH值;6. 记录实验数据,并进行分析。
五、实验结果与分析通过实验操作,我们成功地配制出了pH值为4、6和8的缓冲溶液。
在实验过程中,我们观察到随着碱溶液的滴加,溶液的pH值逐渐升高,直到达到目标pH值。
这表明缓冲溶液能够在一定范围内维持溶液的酸碱度。
六、实验讨论在实验中,我们选择了醋酸和氢氧化钠作为酸和碱溶液。
醋酸是一种弱酸,能够释放少量的H+离子,而氢氧化钠是一种强碱,能够捕获这些H+离子。
通过调整酸和碱的摩尔比例,我们能够控制缓冲溶液的pH值。
在实验过程中,我们使用了pH计来测定溶液的pH值。
pH计是一种能够测量溶液酸碱度的仪器,它通过测量溶液中的H+离子浓度来确定pH值。
在实验中,我们注意到pH计的测量结果可能会受到其他因素的干扰,如温度和电极的质量。
因此,在实验中我们需要保持一定的实验条件,以确保测量结果的准确性。
七、实验总结通过本次实验,我们深入了解了缓冲溶液的原理和应用。
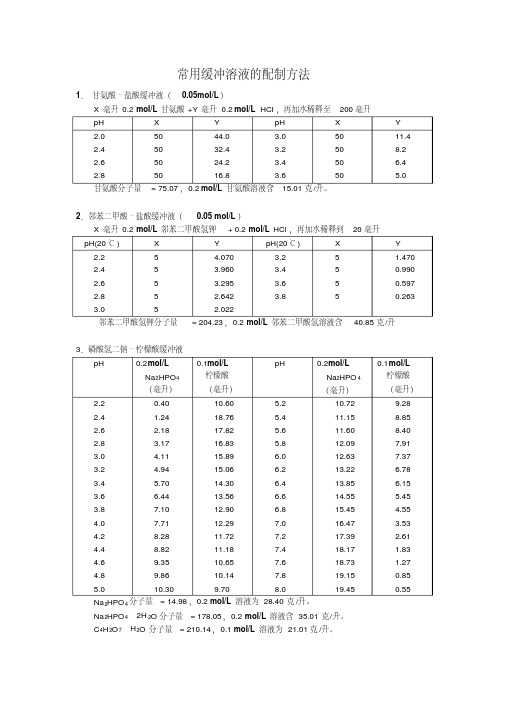
常用缓冲溶液的配制和PH计校正溶液配置方法
3.5
6.5
7.6
1.5
8.5
8.4
4.5
5.5
7.8
2.0
8.0
8.7
6.0
4.0
8.0
3.0
7.0
9.0
8.0
2.0
硼砂 Na2B4O7·H 2O,分子量 =381.43;0.05M 溶液( =0.2M 硼酸根)含 19.07 克 / 升。
硼酸 H 2BO 3,分子量 =61.84,0.2M 溶液为 12.37 克 /升。
5
2.365
8.0
5
Y (毫升) 2.963 3.500 3.950 4.280 4.520 4.680
9.巴比妥钠 - 盐酸缓冲液( 18℃)
pH
0.04M 巴比妥 0.2V 盐酸
pH
钠溶液
0.04M 巴 比 0.2N 盐酸 (毫 妥钠溶液 ( 毫 升 )
6.8
100
18.4
8.4
7.0
100
17.8
10.0
90.0
7.1
67.0
33.0
6.0
12.3
87.7
7.2
72.0
28.0
6.1
15.0
85.0
7.3
77.0
23.0
6.2
18.5
81.5
7.4
81.0
19.0
6.3
22.5
77.5
7.5
84.0
16.0
6.4
26.5
73.5
7.6
87.0
13.0
6.5
31.5
68.5
7.7
89.5
缓冲溶液的配制与PH值的 测定

实验5 缓冲溶液的配制与pH 值的测定1.实验目的(1) 了解缓冲溶液的配制原来及缓冲溶液的性质; (2) 掌握溶液配制的基本实验方法,学习pH 值的使用方法2. 实验原理① 基本概念:在一定程度上能抵抗外加少量酸、碱或稀释,而保持溶液pH 值基本不变的作用称为缓冲作用。
具有缓冲作用的溶液称为缓冲溶液。
② 缓冲溶液组成及计算公式:缓冲溶液一般是由共轭酸碱对组成的,例如弱酸和弱酸盐,或弱碱和弱碱盐。
如果缓冲溶液由弱酸和弱酸盐 (例如HAc-NaAc)组成,则③缓冲溶液性质:a.抗酸/碱,抗稀释作用 因为缓冲溶液中具有抗酸成分和抗碱成分,所以加入少量强酸或强碱,其pH 值基本上是不变的。
稀释缓冲溶液时,酸和碱的浓度比值不改变,适当稀释不影响其pH 值。
b.缓冲容量 缓冲容量是衡量缓冲溶液缓冲能力大小的尺度。
缓冲容量的大小与缓冲组分浓度和缓冲组分的比值有关。
缓冲组分浓度越大,缓冲容量越大;缓冲组分比值为 11 时,缓冲容量最大。
3. 实验仪器与试剂pHS -3C 酸度计,试管,量筒(100mL ,10mL),烧杯(100mL ,50mL),吸量管(10mL)等。
标准缓冲溶液,pH=9.18标准缓冲溶液,精密pH 试纸,吸水纸等。
4.实验步骤缓冲溶液的配制与pH 值的测定 pH=9.18标准缓冲溶液配制pH =p K a -lg c a c s≈K aHAc —c a csc H +按照下表,通过计算配制pH值的缓冲溶液,然后用精密pH试纸和pH计分别测定它们的pH值。
比较理论计算值与两种测定方法实验值是否相符(溶液留作后面实验用)。
表1 缓冲溶液的配制与pH值的测定⑵缓冲溶液的性质表2 缓冲溶液的性质5. 注意事项⑴.实验室安全问题。
⑵.缓冲溶液的配制要注意精确度。
⑶.了解pH计的正确使用方法,注意电极的保护。
6. 思考题(1)为什么缓冲溶液具有缓冲作用?(2)NaHCO3溶液是否具有缓冲作用,为什么?(3)用pH计测定溶液pH值时,已经标定的仪器,“定位”调节是否可以改变位置,为什么?。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pH=9.18的标准缓冲溶液中,调节斜率。 5.用蒸馏水清洗电极,用滤纸擦干,浸入被测溶液中,屏
幕上的读数即为被测溶液的pH值。
三、实验步骤
1.各缓冲溶液的配制及pH值的测定。 a.36%醋酸18mL+0.5mol/L醋酸钠溶液40mL,混匀,
和银—氯化银电极之间的电动势也随着发生变化,而电动 势变化关系符合下面公式:
△ E = 59.16× 273 t ×△pH
298
式中: △E—电动势的变化量(mV); (pH=-lgαH+(标准缓冲溶液)和pH=-lgαH+(未知溶液)
之差) △ pH—溶液pH值的变化量; t—被测溶液的温度(℃)。
=
电离度为:
[H ]2 c [H ]
已电离分子数 = 总分子数 100
[H ] =c
100
当α < 5 %时,或c/Ka > 500时,c – [H+] ≈ c ,则有:
Ka =
[H ]2 c
2020/1/15
pH计测量原理
• pH = -lgαH+ • 当被测溶液氢离子活度发生变化时,复合电极中玻璃电极
无机及分析化学实验
缓冲溶液的配制及pH值的测定 醋酸离解度和离解常数的测定
、实验目的
• 掌握酸度计的使用方法 • 学会配制缓冲溶液 • 掌握醋酸离解度和离解常数的测定方法
二、实验原理
• 缓冲溶液一般是由浓度较大的弱酸及其共轭碱 组成,这类缓冲溶液除了具有抗外加强酸强碱 的作用外,还有抗稀释的作用。
并与实验测量值对比。
仪器结构-正面图
数显窗 斜率旋钮 温度补偿旋钮
定位旋钮
仪器结构-背面图
复合 电极
pH/mV选 择开关
参比电极 接线柱
保险丝
电源 插座
开关 电源
电极架的结构
电极架 复合玻璃电极 弹片
电极架座
酸度计的使用方法
1.仪器预热30min。 2.调节温度旋钮至室温。 3.用蒸馏水清洗电极,用滤纸擦干,再将其浸入pH=6.86
醋酸溶液浓度的测定 NaOH+HAc=NaAc+H2O
CHAc
V C NaOH NaOH 25.00
醋酸电离度及电离常数的测定
HAc 起始浓度 c 平衡浓度 [HAc]
H + Ac 00 [H ] [Ac ]
2020/1/15
电离常数表达式为:
Ka
=
[H ] [Ac ] [ HAc ]
测其pH值。 b.0.5mol/L六次甲基四胺溶液100mL+6mol/L盐酸溶
液5mL,混匀,测其pH值。 c.0.5mol/L氯化铵溶液40ml+浓氨水7.5mL,混匀,
测其pH值。
2.醋酸离解常数的测定 a.0.1mol/L氢氧化钠溶液的配制和标定 b.0.1mol/L醋酸溶液的配制和标定 c.配制不同浓度的醋酸溶液 用移液管分别移取上述0.1mol/L醋酸标准溶液25mL、
装醋酸溶液的小烧杯应用被测液润洗三次。 每次将电极浸入不同的溶液中之前,一定要用
蒸馏水清洗,并用滤纸擦干。
六、思考题
• 1.测定pH时,为什么要按从稀到浓的次序进行? • 2.改变所测醋酸溶液的浓度或温度,测电离度和电离
常数有无变化 若有变化,会有怎样的变化? • 3.试对本实验中配制的缓冲溶液pH值进行理论计算,
10mL、5mL置于50mL容量瓶中,定容。 d.测定上述不同浓度的醋酸溶液的pH值。
四、数据处理
已电离分子数 = 总分子数 100
[H ] =c
100
Ka =
[H ]2 c
溶液编 号
C mol·L–1
pH
[H+] mol·L–1
α
1
2
3
4
电离平衡常数K 测定值 平均值
五、注意事项
测定不同浓度醋酸溶液的pH值时,应按由稀到 浓的顺序来测定。
