《金属及其化合物》化学方程式总结
第三章金属及其化合物 3.1.2铝与氢氧化钠溶液的反应、物质的量在化学方程式计算中的应用含解析

第2课时铝与氢氧化钠溶液的反应物质的量在化学方程式计算中的应用1.铝与盐酸的反应现象:铝片逐渐溶解,试管中产生无色气泡;点燃的木条放在试管口时发出爆鸣声.化学方程式:2Al+6HCl===2AlCl3+3H2↑离子方程式:2Al+6H+===2Al3++3H2↑2.铝与氢氧化钠溶液的反应现象:铝片逐渐溶解,试管中产生无色气泡;点燃的木条放在试管口时发出爆鸣声。
化学方程式:2Al+2NaOH+2H2O错误!2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O===2AlO-,2+3H2↑铝既能与盐酸反应,又能与NaOH溶液反应,都产生氢气(或H2)。
H2+Cl2错误!2HCl错误! 1 ∶ 1 ∶2错误! 1 ∶ 1 ∶2错误!错误!∶错误!∶错误!物质的量之比1 mol ∶ 1 mol ∶2 mol错误!1体积∶1体积∶2体积(1)结论:化学方程式中的化学计量数之比等于其物质的量之比,等于微粒个数之比,等于气体的体积之比.(2)应注意的问题①任何一种反应物,只有实际参加反应的纯物质的量才能根据化学方程式计算,过量部分不参与化学方程式的计算。
②化学方程式的书写要正确。
③列比例式时要符合“左右量相当,上下单位同”的原则.4.物质的量与各物理量之间的关系(1)图示关系:(2)计算公式:①n=mM;②n=错误!;③n=错误!;④n=c·V(溶液)(时间20分钟,满分30分)知识点一铝与氢氧化钠溶液的反应1.下列金属既能与稀盐酸反应,又能与NaOH溶液反应的是()A.Mg B.AlC.Fe D.Cu答案:B解析:Al既能与稀盐酸反应,又能与NaOH溶液反应;Mg、Fe只能与稀盐酸反应;Cu既不与稀盐酸反应,也不与NaOH溶液反应.2.下列关于铝与氢氧化钠溶液反应的说法错误的是( )A.铝失去电子,作还原剂B.产生的气体是氢气C.NaOH与H2O作氧化剂D.溶液中铝元素的存在形式是AlO错误!答案:C解析:反应中铝失去电子,铝元素由0价升高到+3价,故铝是还原剂,A项正确;铝与氢氧化钠溶液反应生成NaAlO2和H2,B项正确;铝与氢氧化钠溶液的反应中,水作氧化剂,C项错误;溶液中铝元素以AlO错误!的形式存在,D项正确。
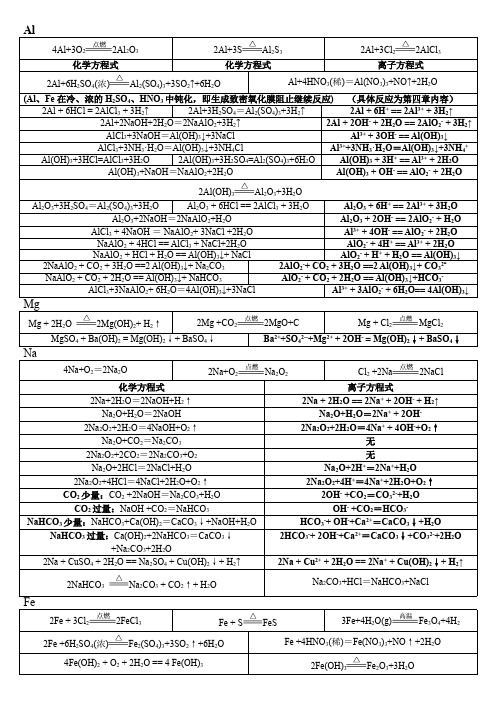
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
铁及其化合物的化学方程式和离子方程式答案

铁及其化合物的化学方程式和离子方程式答案铁及其化合物的化学方程式和离子方程式总结铁是一种常见的金属元素,它在不同条件下可以与氧气、氯气、硫、水蒸气等反应。
其中,铁在氧气中燃烧的化学方程式为3Fe+2O2→2Fe3O4,而在氯气中燃烧的方程式为2Fe+3Cl2→2FeCl3.此外,常温条件下铁锈的形成是由4Fe+3O2+2H2O→2Fe2O3·H2O引起的。
氧化亚铁是铁的一种氧化物,它也可以与一氧化碳、铝粉等物质发生反应。
例如,氧化亚铁在空气中加热会发生6FeO +O2→2Fe3O4的反应,而与一氧化碳高温反应的方程式为FeO+CO→Fe+CO2.此外,氧化亚铁与铝粉在高温下反应的方程式为3FeO+2Al→Al2O3+3Fe。
铁和硫的共热反应的方程式为Fe+S→FeS,而铁和水蒸气在高温条件下反应的方程式为3Fe+4H2O→Fe3O4+4H2.铁还可以与稀硫酸、浓硫酸、稀硝酸、浓硝酸等酸性物质反应,生成不同的产物和离子。
例如,铁与稀硫酸反应的方程式为Fe+H2SO4→FeSO4+H2↑,而少量的铁与浓硝酸共热的方程式为Fe+6HNO3(浓)→Fe(NO3)3+3NO2↑+3H2O。
需要注意的是,有些段落中出现了格式错误和明显有问题的内容,需要删除或修改。
例如,第10段中的化学方程式和离子方程式之间的符号错误,需要进行修改。
铁的化学性质1.氢氧化亚铁与浓硫酸反应,生成二价铁离子和二氧化硫气体,反应式为:2Fe(OH)2 + 4H2SO4 → Fe2+ + 2H2O +4SO2↑。
2.氢氧化亚铁与浓硝酸反应,生成二价铁离子和一氧化氮气体,反应式为:Fe(OH)2 + 4HNO3 → Fe2+ + 2NO↑ + 3H2O。
3.氢氧化亚铁与稀硝酸反应,生成二价铁离子和一氧化氮气体,反应式为:3Fe(OH)2 + 10HNO3 → 3Fe2+ + 2NO↑ +8H2O。
4.氢氧化亚铁在空气中被氧化,生成三价铁离子和水,反应式为:4Fe(OH)2 + O2 + 2H2O → 4Fe3+ + 4OH^-。
专题06 金属及其化合物(讲)(学生版)

8.Na-K合金常温下呈液态,是原子反应堆的导热剂。
9.铝是活泼金属,但铝抗腐蚀性相当强,因为铝表面生成一层致密的氧化物薄膜。由于Al2O3的熔点高于Al的熔点,故在酒精灯上加热铝箔直至熔化,发现熔化的铝并不滴落。
10.铝热反应不仅仅是单质铝与Fe2O3反应,还包含制取其他难熔金属的反应,由于铝热剂是混合物,故铝热反应不能用于工业上冶炼铁。注意铝热反应是中学化学中唯一一类金属单质与金属氧化物在高温条件下的置换反应。
11.并不是Al与所有金属氧化物均能组成铝热剂,该金属氧化物对应的金属活泼性应比铝弱。
12.Al2O3、Al(OH)3与NaOH溶液的反应常用于物质的分离提纯。Al(OH)3不溶于氨水,所以实验室常用铝盐和氨水来制备Al(OH)3。
核心素养
宏观辨识与微观探析科学态度与社会责任
高频考点一金属单质的性质
1.常见金属的主要性质
(1)钠及其化合物
①等物质的量的金属钠被氧化成Na2O和Na2O2时转移的电子数相同。
②钠与酸反应时,先与酸反应,酸不足再与水反应。
③钠与盐的溶液反应:钠不能置换出溶液中的金属,钠直接与水反应,反应后的碱再与溶液中的其他物质反应。
和水的反应
与冷水剧
烈反应
与沸水缓
慢反应
高温与水
蒸气反应
—
不跟水反应
生成碱和氢气
生成氧化
物和氢气
和酸的
反应
剧烈反应
反应逐渐减缓
—
不能置换稀酸中的氢
与非氧化性酸反应放出H2;与浓硫酸、浓硝酸及稀硝酸反应,不放出H2,一般产物为:盐+水+成酸元素的低价化合物
高中必修金属和非金属化学方程式总结

高中必修金属和非金属化学方程式总结LELE was finally revised on the morning of December 16, 2020金属及其化合物一、钠和钠的化合物1、钠与水反应:2Na+2H 2O =2NaOH+H 2↑2Na+2H 2O =2Na ++2OH -+H 2↑2、钠与氧气反应:①常温反应4Na+O 2=2Na 2O②点燃或加热2Na+O 2=Na 2O 23、钠与盐酸等酸反应:2Na+2HCl=2NaCl+H 2↑2Na+2H +=2Na ++H 2↑4、钠与氯气的反应:2Na+Cl 22NaCl5、钠与硫的反应:22S6、钠与碱溶液的反应实际上是与钠跟水的反应7、钠与盐溶液的反应①NaCl 溶液:实际上与水反应,反应的化学方程式:2Na+2H 2O =2NaOH+H 2↑②CuSO4溶液:2Na+CuSO 4+2H 2O=Cu(OH)2↓+H 2↑+Na 2SO 4 ③NaHSO 4溶液:2Na+2NaHSO 4=2Na 2SO 4+H 2↑④通常钠不能从盐溶液中置换出金属:若盐为熔融状态,钠可以置换出较不活泼的金属,如:4Na+TiCl44NaCl+Ti8、金属钠露置在空气中的变化过程4Na+O2=2Na2ONa2O+H2O=2NaOH2NaOH+CO2=Na2CO3+H2O9、氧化钠和水的反应:Na2O+H2O=2NaOH10、氧化钠和盐酸的反应:Na2O+2HCl=2NaCl+H2O11、氧化钠和二氧化碳的反应:Na2O+CO2=Na2CO312、过氧化钠和水的反应:2Na2O2+2H2O=4NaOH+O2↑13、过氧化钠和二氧化碳的反应:2Na2O2+2CO2=2Na2CO3+O214、过氧化钠和盐酸的反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑15、氧化钠和过氧化钠转化:2Na2O+O22O216、碳酸钠和盐酸反应:①Na2CO3+HCl=NaHCO3+NaCl②Na2CO3+2HCl=2NaCl+H2O+CO2↑17、碳酸钠和氢氧化钙反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH18、碳酸钠和可溶性盐反应:Na2CO3+CaCl2=CaCO3↓+2NaCl Na2CO3+BaCl2=BaCO3↓+2NaCl19、碳酸氢钠和盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑20、碳酸氢钠和氢氧化钠、氢氧化钙反应:NaOH=Na2CO3+H2O2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O21、碳酸氢钠和盐反应:NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑22、碳酸氢钠受热分解:2NaHCO323+H2O+CO2↑23、碳酸氢钠和碳酸钠转化:Na 2CO 3+H 2O+CO 2=2NaHCO 32NaHCO 3=Na 2CO 3+H 2O+CO 2↑ NaHCO 3+NaOH =Na 2CO 3+H 2O24、碳酸氢钠制法:NH3+NaCl+H 2O+CO 2=NaHCO 3↓+NH4Cl 二、铝和铝的化合物1、铝与氧气反应:4Al+3O 22O32、铝与盐酸等酸的反应:2Al+6HCl =2AlCl3+3H 23、铝与氢氧化钠溶液的反应:2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑4、氧化铝和盐酸反应:Al 2O 3+6HCl=2AlCl 3+3H 2O5、氧化铝和氢氧化钠反应:Al 2O 3+2NaOH =2NaAlO 2+H 2O 6、氢氧化铝制备:Al 3++3NH3H 2O =Al (OH )3↓+3NH4+7、氢氧化铝和酸的反应:Al (OH )3+3HCl =AlCl 3+3H 2O8、氢氧化铝和氢氧化钠的反应:Al (OH )3+NaOH =NaAlO 2+2H 2O氢氧化铝不稳定性:2Al (OH )323+3H 2O 三、铁和铁的化合物1、铁与氧气反应:2342、铁与水蒸气反应:3Fe+4H 2O (g )342↑ 3、铁与盐酸等酸反应:Fe+2HCl =FeCl 2+H 2↑4、铁的氧化物分别与酸反应:FeO+2H +=Fe 2++H 2OFe 2O 3+6H +=2Fe 3++3H 2OFe 3O 4+8H +=Fe 2++2Fe 3++4H 2O5、铁的氧化物与还原剂反应:Fe x O y +yCOFe+yCO 26、铁的氢氧化物与盐酸等酸反应:Fe (OH )2+2HCl =FeCl2+2H 2O Fe (OH )3+3HCl =FeCl 3+3H 2O7、铁的氢氧化物制备:FeSO 4+2NaOH =Fe (OH )2↓+Na 2SO 4FeCl 3+3NaOH =Fe (OH )3↓+3NaCl8、转化:4Fe (OH )2+O 2+2H 2O =4Fe (OH )39、受热分解:2Fe (OH )3Fe 2O 3+3H 2O10、Fe 3+的检验:Fe 3++3SCN -=Fe(SCN)3(血红色)11、氧化性:2Fe 3++Fe =3Fe 2+2Fe 3++Cu =2Fe 2++Cu 2+12、还原性:2Fe 2++Cl2=2Fe 3++2Cl -四、硅及其化合物1、硅与氧气、氟、氯气、碳反应:2=SiO 2Si+2F 2=SiF 4Si+2Cl 2=SiCl 4Si+C =SiC2、硅与氢氟酸、氢氧化钠反应:Si+4HF =SiF 4↑+2H 2↑Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑3、二氧化硅与氢氟酸反应:SiO 2+4HF =SiF 4↑+2H 2O4、二氧化硅与碱性氧化物反应:SiO 2+CaOCaSiO 35、二氧化硅与碱反应:SiO 2+2=Na 2SiO 3+H2O6、二氧化硅与碳反应:SiO 2↑7、碳酸钙反应: SiO 2+Na 2CO 323+CO 2↑SiO 2+CaCO 3CaSiO 3+CO 2↑8、硅酸和氢氧化钠反应:H 2SiO 3+2NaOH =Na 2SiO 3+2H 2O9、硅酸受热分解:H 2SiO 32+H 2O10、硅酸钠与酸反应:Na 2SiO 3+2HCl =2NaCl+H 2SiO 3(胶体)Na 2SiO 3+H 2O+CO 2=H 2SiO 3(胶体)+Na 2CO 3 Na 2SiO 3+2H 2O+2CO 2=H 2SiO 3(胶体)+2NaHCO 3 五、氯1、氯气与金属反应:Cl 2+2Na 2+Cu =23Cl 2+2Fe =2FeCl 32、氯气与非金属反应:Cl 223、氯气、氟与水的反应:Cl2+H2O=HCl+HClO2HClO=2HCl+O2↑2F2+2H2O=4H F+O24、氯气与碱反应:Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O5、漂白液、漂白粉、漂白精长期露置空气中会发生反应:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO2NaClO+H2O+CO2=Na2CO3+2HClO2↑6、氯离子检验:先在被检验液中加稀硝酸酸化,再加硝酸银溶液,如产生白色沉淀可判断原溶液中含氯离子Ag++Cl-=AgCl↓7、卤素单质间置换:Cl2+2Br-=2Cl-+Br2Cl2+2I-=2Cl-+I2Br2+2I-=2Br-+I2六、硫和氮1、二氧化硫和水反应:SO2+H2O=H2SO32、二氧化硫和氧化钙反应:SO2+CaO=CaSO33、二氧化硫和氢氧化钠反应:SO2(少)+2NaOH=Na2SO3+H2OSO2(过)+NaOH=NaHSO34、二氧化硫和盐反应SO2(少)+2NaHCO3=Na2SO3+H2O+2CO2SO2(过)+NaHCO3=NaHSO3+CO25、二氧化硫和硫化氢反应:SO2+2H2S=3S↓+2H2O6、二氧化硫和卤素单质水溶液反应:SO2+X2+2H2O=H2SO4+2HX(X=Cl、Br、I,F除外)7、二氧化硫能被氧气氧化:2SO238SO3+H2O=H2SO4SO3+CaO=CaSO4SO3+NaOH=Na2SO49、氮气和氧气反应:N2+O2=2NO10、一氧化氮与氧气反应:2NO+O2=2NO211、二氧化氮与水反应:3NO2+H2O=3HNO3+NO12、氮的氧化物溶于水的有关计算:3NO2+H2O=3HNO3+NO 2NO+O2=2NO24NO2+O2+2H2O=4HNO34NO+3O2+2H2O=4HNO3七、氨硝酸硫酸1、氨:N2+3H2=2NH3(反应条件是高温高压和催化剂)2、氨与水的反应NH3+H2O=NH3H2O(可逆)3、氨水不稳定:NH3H2O=↑+H2O4、氨与HCl等酸的反应NH3+HCl=NH4Cl2NH3+H2SO4=(NH4)2SO4NH3+HNO3=NH4NO3NH3+H2O+CO2=NH4HCO3 5铵盐受热分解:NH4Cl3↑+HCl↑NH4HCO3=NH3↑+H2O↑+CO2↑6氨的催化氧化:4NH3+5O24NO+6H2O(条件是催化剂和加热)7氨的制法:2NH4Cl+Ca(OH)2=l2+2NH3↑+2H2O。
元素(金属、非金属)及其化合物化学方程式

金属及其化合物1、钠放置在空气中 4Na + O2 = 2Na2O2、钠在空气中燃烧(黄色的火焰)2Na + O2 Na2O2(淡黄色固体)3、铝箔被氧气氧化 4Al + 3O2 △2O34、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2NaOH + H2↑【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】5、高温下铁与水反应 3Fe + 4H2O(g) 高温Fe3O4 + 4H26、铝片与稀盐酸反应 2Al + 6HCl = 2AlCl3 + 3H2↑【2Al + 6H+ = 2Al3+ +3H2↑】7、铝与氢氧化钠溶液反应(实际是钠和水反应) 2Al + 2NaOH + 2H2O = 2NaAlO2(偏铝酸钠) + 3H2↑【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O = 4NaOH + O2↑【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】9、过氧化钠可用在呼吸面具和潜水艇中作为【供氧剂】,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O210、苏打(纯碱)与盐酸反应 Na2CO3 +2HCl=2NaCl+H2O +CO2↑【 CO32- + 2H+ = H2O + CO2↑】11、小苏打(碳酸氢钠)溶液与盐酸反应 NaHCO3 + HCl= NaCl+H2O +CO2↑【HCO3- + H+ = H2O + CO2↑】12、小苏打受热分解 2NaHCO3△Na2CO3 + H2O +CO2 ↑13、小苏打和氢氧化钠溶液溶液反应NaHCO3+NaOH= Na2CO3 + H2O 【HCO3-+ OH - = H2O + CO32- 】14、氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH ===2NaAlO2 +H2O 【Al2O3 + 2OH - === 2AlO2- + H2O】15、氧化铝溶于硫酸Al2O3+ 3H2SO4==Al2(SO4)3+3H2O 【Al2O3 +6H+ = 2Al3+ +3H2O】16、硫酸铝溶液中滴加过量氨水Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】17、氢氧化铝中加盐酸 Al(OH)3 + 3HCl = AlCl3 + 3H2O 【Al(OH)3 + 3H+ = Al3+ + 3H2O】18、Al(OH)3与NaOH溶液反应: Al(OH)3 + NaOH NaAlO2 +2H2O【Al(OH)3 + OH - = AlO2- +2H2O】19、氢氧化铝受热分解 2Al(OH)3△Al2O3+3H2O20、铁与盐酸反应 Fe + 2HCl = FeCl2 + H2↑【Fe + 2H+ = Fe2+ + H2↑】21、氧化铁溶于盐酸中 Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O 【Fe 2O 3 + 6H + = 2Fe 3++ 3H 2O 】 22、氧化亚铁溶于盐酸中 FeO + 2HCl = FeCl 2 + H 2O 【FeO + 2H += Fe 2++ H 2O 】 23、氯化铁溶液中滴入氢氧化钠溶液 FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl【Fe 3++ 3OH - = Fe(OH)3 ↓(红褐色沉淀)】 24、硫酸亚铁溶液中滴加氢氧化钠溶液Fe SO 4+ 2NaOH = Fe(OH)2↓+ Na 2SO 4 【Fe 2++ 2OH - = Fe(OH)2 ↓(白色沉淀)】25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀) 4Fe(OH)2 + O 2 +2H 2O = 4Fe(OH)3 26、氢氧化铁受热分解 2Fe(OH)3△Fe 2O 3+3H 2O27、氯化亚铁溶液中通入氯气 2FeCl 2 + Cl 2 = 2FeCl 3 【2Fe 2++ Cl 2 = 2Fe 3++ 2Cl - 】 28、氯化铁溶液中加入铁粉2FeCl 3 + Fe =3FeCl 2 【2Fe 3++ Fe =3Fe 2+】非金属及其化合物1、硅及其化合物的转化关系※ ①SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)※ ②SiO 2+2NaOH = Na 2SiO 3+H 2O( SiO 2+2OH -= SiO 32-+H 2O )※ ③Na 2SiO 3+2HCl = H 2SiO 3(胶体)+2NaCl ( SiO 32-+2H += H 2SiO 3(胶体))④ SiO 2+CaO 高温 CaSiO 32、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3②Cu +Cl 2 点燃CuCl 2③2FeCl 3+Cu = 2FeCl 2+CuCl 2(2Fe 3++Cu = 2Fe 2++Cu 2+)④H 2+Cl 2 2HCl ※⑤MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2O(MnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2O) ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑(不稳定性)(Cl 2+H 2O = H ++Cl -+HclO) (2HClO 2H ++2Cl -+O 2↑)※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O (工业制漂白粉) Ca(ClO)2+CO 2+H 2O = CaCO 3↓+2HClO(漂白原理)3、硫及其化合物的转化关系Na 2SiO 3 SiF 4 SiO 2 H 2SiO 3CaSiO 3 ① ② ③④ CuCl 2 HClO HCl Cl 2 FeCl 3 NaClO Ca(ClO)2 ① ② ③④ ⑤ ⑥ ⑦ ⑧ ⑨点燃或光照 光照光照①S +O 2 点燃 SO 2 ※②SO 2+O 2 催化剂 加热 2SO 3③SO 3+H 2O = H 2SO 4(工业制硫酸) ④SO 2+H 2O H 2SO 3⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O(SO 2+Ca 2++2OH -=CaSO 3↓+H 2O )⑥SO 3+CaO = CaSO 4 或 SO 3+Ca(OH)2 = CaSO 4+H 2O※⑦Cu+2H 2SO 4(浓) △ CuSO 4+SO 2↑+2H 2O ※⑧C +2H 2SO 4(浓) △CO 2↑+2SO 2↑+2H 2O4、氮及其化合物的转化关系※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2 ※③3NO 2+H 2O = 2HNO 3+NO ( 3NO 2+H 2O =2H ++2NO 3-+NO)※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O (Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O)※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂高温高压 2NH 3 (3Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O ) (工业制氨气)⑦NH 3+HCl = NH 4Cl NH 4HCO 3 △NH 3↑+H 2O+CO 2↑(铵盐受热易分解)⑧NH 4Cl△NH 3↑+HCl ↑(水溶液中)( NH 3+H += NH 4+) ⑧NH 4Cl +NaOH △ NaCl+NH 3↑+H 2O (NH 4++OH-△NH 3↑+H 2O) ※⑧2NH 4Cl +2Ca(OH)2 △ CaCl 2+2NH 3↑+2H 2O⑨4NH 3+5O 2 催化剂△ 4NO +6H 2OSO 42 3 CaSO 3 4① ⑨ ⑧⑦ ⑥ ④ ③ N 2 NH 3 NH 4Cl NO 3② ③高温或放电。
高三化学金属及其化合物化学方程式大全

高三化学金属及其化合物化学方程式大全在高三化学的学习中,金属及其化合物的化学方程式是非常重要的知识点。
熟练掌握这些方程式,对于理解化学反应的本质、解决化学问题以及在考试中取得好成绩都具有关键作用。
下面我们就来一起梳理一下常见的金属及其化合物的化学方程式。
一、钠及其化合物1、钠与氧气反应常温下:4Na + O₂= 2Na₂O加热时:2Na + O₂= Na₂O₂2、钠与水反应2Na + 2H₂O = 2NaOH + H₂↑3、钠与盐酸反应2Na + 2HCl = 2NaCl + H₂↑4、钠在空气中燃烧2Na + Cl₂= 2NaCl5、氧化钠与水反应Na₂O + H₂O = 2NaOH6、过氧化钠与水反应2Na₂O₂+ 2H₂O = 4NaOH + O₂↑7、过氧化钠与二氧化碳反应2Na₂O₂+ 2CO₂= 2Na₂CO₃+ O₂8、碳酸钠与盐酸反应Na₂CO₃+ 2HCl = 2NaCl + H₂O + CO₂↑9、碳酸氢钠与盐酸反应NaHCO₃+ HCl = NaCl + H₂O + CO₂↑10、碳酸氢钠受热分解2NaHCO₃= Na₂CO₃+ H₂O + CO₂↑11、碳酸钠溶液中通入二氧化碳Na₂CO₃+ H₂O + CO₂= 2NaHCO₃二、铝及其化合物1、铝与氧气反应4Al + 3O₂= 2Al₂O₃2、铝与盐酸反应2Al + 6HCl = 2AlCl₃+ 3H₂↑3、铝与氢氧化钠溶液反应2Al + 2NaOH + 2H₂O = 2NaAlO₂+ 3H₂↑4、氧化铝与盐酸反应Al₂O₃+ 6HCl = 2AlCl₃+ 3H₂O5、氧化铝与氢氧化钠溶液反应Al₂O₃+ 2NaOH = 2NaAlO₂+ H₂O6、氢氧化铝与盐酸反应Al(OH)₃+ 3HCl = AlCl₃+ 3H₂O7、氢氧化铝与氢氧化钠溶液反应Al(OH)₃+ NaOH = NaAlO₂+ 2H₂O8、实验室制取氢氧化铝AlCl₃+ 3NH₃·H₂O = Al(OH)₃↓ + 3NH₄Cl9、偏铝酸钠溶液中通入二氧化碳(少量)2NaAlO₂+ CO₂+ 3H₂O = 2Al(OH)₃↓ + Na₂CO₃偏铝酸钠溶液中通入二氧化碳(过量)NaAlO₂+ CO₂+ 2H₂O = Al(OH)₃↓ + NaHCO₃三、铁及其化合物1、铁与氧气反应3Fe + 2O₂= Fe₃O₄2、铁与盐酸反应Fe + 2HCl = FeCl₂+ H₂↑3、铁与硫酸铜溶液反应Fe + CuSO₄= FeSO₄+ Cu4、氧化亚铁与盐酸反应FeO + 2HCl = FeCl₂+ H₂O5、氧化铁与盐酸反应Fe₂O₃+ 6HCl = 2FeCl₃+ 3H₂O6、四氧化三铁与盐酸反应Fe₃O₄+ 8HCl = FeCl₂+ 2FeCl₃+ 4H₂O 7、氯化亚铁溶液中通入氯气2FeCl₂+ Cl₂= 2FeCl₃8、氯化铁溶液中加入铁粉2FeCl₃+ Fe = 3FeCl₂9、氯化铁溶液中加入铜粉2FeCl₃+ Cu = 2FeCl₂+ CuCl₂10、氢氧化亚铁在空气中被氧化4Fe(OH)₂+ O₂+ 2H₂O = 4Fe(OH)₃11、氢氧化铁受热分解2Fe(OH)₃= Fe₂O₃+ 3H₂O四、铜及其化合物1、铜在空气中加热2Cu + O₂= 2CuO2、铜与硝酸反应(浓硝酸)Cu + 4HNO₃(浓) = Cu(NO₃)₂+ 2NO₂↑ + 2H₂O (稀硝酸)3Cu + 8HNO₃(稀) = 3Cu(NO₃)₂+2NO↑ + 4H₂O 3、氧化铜与盐酸反应CuO + 2HCl = CuCl₂+ H₂O4、氢氧化铜受热分解Cu(OH)₂= CuO + H₂O5、硫酸铜溶液与氢氧化钠溶液反应CuSO₄+ 2NaOH = Cu(OH)₂↓ + Na₂SO₄掌握这些金属及其化合物的化学方程式,不仅需要死记硬背,更要理解反应的本质和规律。
金属及其化合物化学方程式汇总

.必修一金属及其化合物化学方程式一、金属钠及其化合物1、钠在空气中(1)钠块在空气中变暗:2Na +O2=Na2O(白色固体)(钠长时间露置在空气中最终变为碳酸钠)(2)在空气中加热4Na+2O2 =2Na2O2(淡黄色固体)现象:钠融化成小球,然后剧烈燃烧,产生黄色火焰,生成淡黄色固体(3)2Na2O+O2=2Na2O22、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2NaOH +H2↑2Na +2H2O =2Na++2OH-+H2↑3、钠与盐溶液反应(先水后盐)(1)与氯化钠溶液:本质上就是与水反应(2)与硫酸铜溶液:2Na +2H2O =2NaOH +H2↑2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4总:2Na +2H2O + CuSO4=Cu(OH)2↓+ Na2SO4+H2↑2Na +2H2O+ Cu2+ =Cu(OH)2↓+H2↑+ 2Na+(3)与氯化铁溶液:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na+ +3H2↑4、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O =4NaOH +O2 ↑2Na2O2+2H2O =4Na++4OH -+O2↑现象:产生大量气泡,带火星的木条复燃,试管外壁发热,滴加酚酞后溶液变红(振荡后褪色)碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH Na2O +H2O =2Na++2OH -5、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+2CO2=2Na2CO3+O2碱性氧化物Na2O与二氧化碳的反应Na2O+CO2===Na2CO36、过氧化钠与盐酸的反应2Na2O2+4HCl =4NaCl +2H2O+O2 ↑2Na2O2+4H+=4Na++2H2O+O2↑碱性氧化物Na2O与盐酸的反应Na2O +2HCl =2NaCl +H2O Na2O +2H+=2Na++H2O7、氢氧化钠(1)与酸性氧化物反应a向NaOH中通入少量CO2:2NaOH+ CO2 (少量)== Na2CO3 + H2OOH -+CO2 (少量)= CO32-+H2Ob 继续向该溶液中通入CO2:Na2CO3+H2O +CO2=2NaHCO3CO32-+H2O +CO2=2HCO3-c向NaOH中通入过量CO2:NaOH+ CO2(过量)== NaHCO3a+bOH -+CO2 (过量)= HCO3-d向Ca(OH)2中通入少量CO2:CO2+Ca(OH)2(过量)===CaCO3↓+H2OCa2++ 2OH -+CO2 (少量)= CaCO3↓+H2Oe继续向该溶液中通入CO2:CaCO3+H2O +CO2=Ca(HCO3)2CaCO3+H2O +CO2=Ca2++ 2HCO3-f向Ca(OH)2中通入过量CO2:2CO2(过量)+Ca(OH)2===Ca(HCO3)2 d+eOH -+CO2 (过量)= HCO3-CaCl2不与CO2反应:因为一般情况下弱酸不能制强酸8、苏打(纯碱)与盐酸反应(根据滴加顺序不同,现象不同,所以可以鉴别盐酸和碳酸氢钠)①向盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O+CO2↑CO32-+2H+=H2O +CO2↑现象:立即有气泡产生②纯碱溶液中滴加盐酸,至过量△△.Na2CO3+HCl =NaHCO3+NaCl CO32-+H+ =HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑现象:先无明显现象,然后有气泡产生9、碳酸氢钠和盐酸反应(无论是向碳酸氢钠中滴加稀盐酸还是向盐酸中滴加碳酸氢钠,现象均为:立即有气泡产生)NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑10、碳酸钠与Ca(OH)2反应:Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓CO32-+Ca2+ = CaCO3↓11、碳酸氢钠与碱反应(1)与NaOH反应:NaHCO3 + NaOH== Na2CO3 + H2OHCO3-+OH -=H2O +CO32-(2)与Ca(OH)2反应Ca(OH)2 + NaHCO3(少)==CaCO3↓+ H2O+ NaOHCa2+ +OH -+HCO3-(少)==CaCO3↓+ H2OCa(OH)2 + 2NaHCO3(多)== CaCO3↓ + 2H2O+Na2CO3Ca2+ +2OH -+2HCO3-(多)== CaCO3↓ + 2H2O+CO32-12、碳酸钠与某些盐反应Na2CO3+CaCl 2== CaCO3↓+2NaCl CO32-+Ca2+ = CaCO3↓NaHCO3+CaCl 2== 不反应(可用于鉴别碳酸钠和碳酸氢钠)13、小苏打受热分解2NaHCO3=Na2CO3+H2O +CO2↑14、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=H2O +CO32-(若是溶液中反应有离子方程式)二、铝及其化合物1、与非金属4Al + 3O2 = 2Al2O32Al+3Cl2 == 2AlCl32Al + 3S == Al2S32、铝片与稀盐酸反应2Al +6HCl =2AlCl3 +3H2↑2Al +6H+=2Al3++3H2↑3 、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2+3H2↑2Al +2OH-+2H2O =2AlO2-+3H2↑4、与盐溶液反应:置换出较不活泼的金属单质2Al+3CuSO4 ==Al2(SO4 )3+3Cu 2Al+3Cu2+ = 2Al3++3Cu5、与水不反应:6、Al2O3(两性氧化物)(1)与强酸反应Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+ = 2Al3++3H2O(2)与强碱反应Al2O3+2NaOH = 2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O7. Al(OH)3(两性氢氧化物)(1)Al(OH)3的制备:可溶性铝盐和氨水Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+(2)与强酸反应Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O (3)与强碱反应Al(OH)3+NaOH =NaAlO2+2 H2O Al(OH)3+OH-=AlO2-+2 H2O (4)加热分解2Al(OH)3△Al2O3 + 3H2O8、Al3+(1)少量强碱:AlCl3+3NaOH===Al(OH)3↓+3N aCl Al3++3OH-=Al(OH)3↓(2)过量强碱:AlCl3+4NaOH===NaAlO2 +3NaCl+2 H2OAl3++4OH-=AlO2-+2 H2O9、AlO2-(1)少量HCl:NaAlO2 +HCl+H2O=NaCl+Al(OH)3↓AlO2-+H++H2O=Al(OH)3↓(2)继续向该溶液中加入盐酸:Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O△点燃△.(3)过量HCl:NaAlO2+4HCl=NaCl+AlCl3+2H2O AlO2-+4H+=Al3++2 H2O(4)通入少量CO2CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(5)通入过量CO2CO2+NaAlO2+2H2O=Al(OH)3↓+Na HCO3 (工业制取氢氧化铝)CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-10、KA1(SO4)2 (净水剂)(1)使硫酸根恰好沉淀完全: KA1(SO4)2+2Ba(OH)2==2BaSO4↓+KAlO2Al3++4OH-+2Ba2++2SO42-==2BaSO4↓+AlO2-(2)使铝离子恰好沉淀完全: 2KA1(SO4)2+3Ba(OH)2==2Al(OH)3↓+3BaSO4↓+K2SO42Al3++ 3 SO42- + 6OH—+ 3Ba2+==3Ba SO4↓+ 2Al(OH)3↓(3)净水原理:Al3++3H2O=== Al(OH)3(胶体)+3 H+11、相互滴加顺序不同而现象不同的几组反应:(可用于鉴别)①:AlCl3+ NaOH ②:NaAlO2 + HCl ③:Na2CO3+ HCl (NaHSO4)三、铁及铁的化合物1、铁的冶炼: 3CO+ Fe2O3== 2Fe+ 3CO22、与非金属:(1)2Fe + 3Cl2 === 2FeCl3(2)3 Fe + 2O2=== Fe3O4(3)Fe + S === FeS3、与水蒸气:3 Fe + 4 H2O(g) ====Fe3O4+ 4 H24、与非氧化性酸:Fe + 2 HCl === FeCl2+ H2↑Fe + 2 H+ == Fe2++ H2↑5、与盐:Fe + CuSO4 == FeSO4+Cu Fe + Cu2+===Fe2+ + Cu6、与碱不反应:7、铁的氧化物FeO(黑色)、Fe2O3(红棕色,俗名铁红)、Fe3O4(磁性氧化铁,黑色晶体)(1)FeO + 2 HCl === FeCl2 + H2O(非氧化性酸,不变价;遇HNO3变价,下同)FeO + 2 H+ == Fe2+ + H2O(2)Fe2O3 + 6HCl ===2 FeCl3 + 3 H2OFe2O3 + 6 H+ ===2 Fe3+ + 3 H2O(3)Fe3O4+ 8 HCl ===2 FeCl3 + FeCl2 + 4 H2OFe3O4+ 8 H+ === 2 Fe3+ +Fe2+ + 4 H2O用途:作油漆的颜料,炼铁的原料8、铁的氢氧化物(Fe(OH)2,Fe(OH)3)(1)制备:A:FeSO4 + 2 NaOH = Fe(OH)2↓+ Na 2SO4Fe2+ + 2 OH—= Fe(OH)2↓B:3NH3 .H2O + FeCl3 ==== Fe(OH)3↓+ 3 NH4CIFe3+ + 3NH3 .H2O =Fe(OH)3↓+ 3 NH4+(2)氢氧化亚铁不稳定性:4 Fe(OH)2 + O2 + 2 H2O= 4 Fe(OH)3(3)氢氧化铁不稳定性:2Fe(OH)3 ==== Fe2O3 + 3H2O(4)与酸:Fe(OH)3+ 3HCl ====FeCl3+ 3 H2O Fe(OH)3+ 3 H+ === Fe3+ + 3 H2O Fe(OH)2+ 2 HCl ==== FeCI2+ 2 H2O(非氧化性酸,不变价;遇HNO3变价)Fe(OH)2 + 2 H+ == Fe2+ + 2H2O9、Fe2+盐(还原性离子,易被氧化,保存需加少量Fe粉及相应酸)(1)与氯气:2FeCl2 + Cl2 = 2 FeCl3 2Fe2+ + Cl2 === 2Fe3+ + 2 CI—(2)FeSO4溶液和H2O2:2Fe2+ + H2O2 + 2H+== 2Fe3+ + 2H2O(3)FeSO4溶液和酸性KMnO4溶液:5 Fe2+ + MnO4—+8 H+=== Mn 2++ 4H2O+ 5Fe3+(4)FeSO4溶液在空气中变质:4Fe2+ + O2 + 4 H+=== 4Fe3+ + 2H2O10、Fe3+盐(氧化性离子,易被还原. 易水解,保存需加少量相应酸抑制水解.)(1) 2 FeCl3 + Fe =3 FeCl22Fe3+ + Fe === 3 Fe2+(2)2 FeCl3+ Cu === 2FeCl2+ CuCl22Fe3+ + Cu ==2Fe2++ Cu2+(3)Fe3+的检验:FeCl3 + 3 KSCN == 3 KCI+ Fe(SCN)3Fe3+ + 3SCN— === Fe(SCN)3(4)用途:净水剂Fe3+ +3 H2O=== Fe(OH)3(胶体)+ 3 H+高温点燃点燃△高温△.。
鲁科版高中化学选修三金属及其化合物重要方程式汇总

金属及其化合物重要方程式汇总(一)钠及其化合物1.刚切开钠的断面很快变暗:化学方程式:;2.钠在空气中燃烧:化学方程式:;3.过量钠投入稀盐酸中:化学方程式:①;②;离子方程式:①;②;4.钠投入硫酸铜溶液中:化学方程式:;离子方程式:;5.氧化钠受热氧化:化学方程式:;6.氧化钠与二氧化碳:化学方程式:;7.氧化钠投入水中:化学方程式:;离子方程式:;8.氧化钠投入稀盐酸中:化学方程式:;离子方程式:;9.过氧化钠投入水中:化学方程式:;离子方程式:;10.呼吸面具中常用过氧化钠做供氧剂的原因:化学方程式:;11.向碳酸钠溶液中滴入几滴澄清石灰水:化学方程式:;离子方程式:;12.向碳酸钠溶液中滴入几滴氯化钡溶液:化学方程式:;离子方程式:;13.除去碳酸氢钠溶液中混有的少量碳酸钠:化学方程式:;离子方程式:;14.除去碳酸钠固体中混有的少量碳酸氢钠:化学方程式:;15.碳酸氢钠溶液与稀盐酸:化学方程式:;离子方程式:;16.碳酸氢钠溶液与烧碱:化学方程式:;离子方程式:;17.碳酸钠溶液与醋酸(CH3COOH)溶液:化学方程式:;离子方程式:;18.用大理石与稀盐酸制取二氧化碳:化学方程式:;离子方程式:;19.氢氧化钡溶液和稀硫酸:化学方程式:;离子方程式:;20.氢氧化钡溶液和硫酸铜溶液:化学方程式:;离子方程式:;21.向烧碱溶液中通入少量二氧化碳:化学方程式:;离子方程式:;22.向烧碱溶液中通入过量二氧化碳:化学方程式:;离子方程式:;23.向纯碱溶液中滴加几滴稀盐酸:化学方程式:;离子方程式:;24.向稀盐酸中滴加几滴纯碱溶液:化学方程式:;离子方程式:;25.碳酸氢钠与足量氢氧化钙溶液:离子方程式:26.碳酸氢钠与少量氢氧化钙溶液:离子方程式:(二)铝及其化合物1.表面被氧化的铝片溶于过量氢氧化钠溶液:化学方程式:①;②;离子方程式:①;②;2.表面被氧化的铝片溶于过量稀盐酸:化学方程式:①;②;离子方程式:①;②;3.制备氢氧化铝(1)往氯化铝溶液中加过量氨水:离子方程式:;(2)往偏铝酸钠溶液中通过量二氧化碳:离子方程式:;4.氢氧化铝受热分解:化学方程式:;5.铝盐的性质往氯化铝溶液中逐滴滴加烧碱溶液,先产生白色胶状沉淀,后沉淀逐渐溶解,最后得到无色透明溶液。
人教版高中化学必修一第三章金属及其化合物-知识点总结

高一化学金属及其化合物知识点总结1 .元素的存在形式有两种:游离态和化合态。
(1 )钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。
(2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。
2.金属单质的用途:(1 )利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。
(2)镁条燃烧发出耀眼的白光,用来做照明弹。
(3)利用铝的良好导电性,做导线。
利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。
3.金属化合物的用途:(1 )过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。
(2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。
(3)明矾做净水剂。
4.金属的分类:(1 )根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。
(2)根据密度分类:密度大于4.5g/cm3的金属是重金属:如铁、铜、铅、银,密度小于4.5g/cm3 的金属是轻金属:如钠、镁、铝。
5.氧化物的分类:二元化合物,其中一种元素是氧元素,并且氧元素呈负二价的化合物是氧化物。
1 )氧化物(根据氧化物中非氧元素的种类)分为金属氧化物和非金属氧化物。
2)金属氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
3)非金属氧化物分为酸性氧化物、不成盐氧化物。
4)氧化物(根据氧化物是否与碱或酸反应生成盐)分为成盐氧化物和不成盐氧化物(CO 、NO)。
(5)成盐氧化物分为酸性氧化物、碱性氧化物、两性氧化物。
(6)酸性氧化物分为高价态的金属氧化物(Mn2O7)和非金属氧化物(CO2)。
03铁、铜及其化合物-【化学方程式】高考重要化学方程式汇总

②过量锌:2Fe3++3Zn 2Fe+3Zn2+
(4)与KI溶液反应
①化学反应:2KI+2FeCl3 2FeCl2+I2+2KCl
②离子反应:2Fe3++2I- 2Fe2++I2(FeI3不存在的原因)
③反应现象:溶液颜色变化不明显,产生紫黑色沉淀
(5)与H2S反应
(3)与C反应
①FeO:2FeO+C 2Fe+CO2↑
②Fe3O4:Fe3O4+2C 3Fe+2CO2↑
③Fe2O3:2Fe2O3+3C 4Fe+3CO2↑
(4)与Al反应(铝热反应)
①FeO:2Al+3FeO 3Fe+Al2O3
②Fe3O4:8Al+3Fe3O4 9Fe+4Al2O3
③Fe2O3:2Al+Fe2O3 2Fe+Al2O3
(1)与H2反应
①FeO:FeO+H2 Fe+H2O
②Fe3O4:Fe3O4+4H2 3Fe+4H2O
③Fe2O3:Fe2O3+3H2 2Fe+3H2O
(2)与CO反应
①FeO:FeO+CO Fe+CO2
②Fe3O4:Fe3O4+4CO 3Fe+4CO2
③Fe2O3:Fe2O3+3CO 2Fe+3CO2(高炉炼铁的主反应)
知识点8硫酸铜的性质
1.与强碱溶液反应
(1)离子反应:Cu2++2OH- Cu(OH)2↓
高中无机化学化学方程式总结

高中化学元素化合物化方程式汇总(一)金属及其化合物一、钠及其化合物(37)1.钠与氧气常温反应:4Na+O2=2Na2O(白色)2.钠与氧气加热反应:2Na+O2≜Na2O2(淡黄色)3.钠和水反应:2Na+2H2O=2NaOH+H2↑(2Na+2H2O=2Na++2OH-+H2↑)4.钠与硫酸铜溶液反应:{2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4(不能置换出金属,先水后盐的原则)5.钠与盐酸反应:2Na+2HCl=2NaCl+H2↑(2Na+ 2H+=2Na++H2↑)6.钠与氯气反应:2Na+Cl2点燃→2NaCl(白烟)7.钠与硫反应:2Na+S=Na2S8.氢化钠与水反应:NaH(s)+H2O=NaOH+H2↑9.氧化钠与水反应:Na2O+H2O=2NaOH10.氧化钠与二氧化碳反应:Na2O+CO2=Na2CO311.氧化钠与盐酸溶液反应:Na2O+2HCl=2NaCl+H2O12.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑13.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O214.过氧化钠与盐酸溶液反应:2Na2O2+4HCl=4NaCl +2H2O+O2↑15.过氧化钠与氢气反应(“白吃”):Na2O2+H2氧气→2NaOH16.过氧化钠与一氧化碳反应(“白吃”):Na2O2+CO= Na2CO317.氢氧化钠与二氧化碳1:1反应:NaOH +CO2 =NaHCO318.氢氧化钠与二氧化碳2:1反应:2NaOH+CO2=Na2CO3+H2O19.氢氧化钠与二氧化碳反应(1:1与1:2总方):5NaOH+4CO2=3 NaHCO3+Na2CO3+H2O20.碳酸钠与水反应:CO32-+ H2O⇔HCO3-+OH-21.碳酸钠与少量酸反应:CO32-+H+= HCO3-22.碳酸钠与酸(1:1)反应:CO32-+H+= HCO3-23.碳酸钠与酸(1:2)反应:CO32-+2H+=H2O+CO2↑24.碳酸钠与氢氧化钠溶液反应:——25.碳酸钠与石灰水反应:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓(CO32-+Ca2+=CaCO3↓)26.碳酸钠与氯化钡溶液反应:Na2CO3+BaCl2=2NaCl+BaCO3↓(CO32-+Ba2+=BaCO3↓)27.碳酸钠与二氧化碳反应:Na2CO3 +CO2+H2O =2NaHCO3↓28.碳酸氢钠与水反应:HCO3-+ H2O⇔H2CO3+OH-29.碳酸氢钠与盐酸溶液反应:NaHCO3+HCl=NaCl+H2O+CO2↑(HCO3-+H+=H2O+CO2↑)30.碳酸氢钠与氢氧化钠溶液反应:NaHCO3+NaOH=Na2CO3+H2O(HCO3-+OH-=CO32-+H2O)31.少量碳酸氢钠与石灰水反应:NaHCO3+ Ca(OH)2= NaOH+ CaCO3↓+H2O32.过量碳酸氢钠与石灰水反应:2NaHCO3+ Ca(OH)2= Na2CO3+ CaCO3↓+2H2O33.碳酸氢钠与氯化钡溶液反应:——34.碳酸氢钠与二氧化碳反应:——35.碳酸氢钠受热分解:2NaHCO3≜Na2CO3+H2O+CO2↑36.侯德榜制碱法:NaCl+H2O+NH3+CO2=NH4Cl+NaHCO3↓37.钠长期放在空气中的反应:Na+O2=Na2O+H2O→NaOH(固)+H2O→NaOH(液)+CO2→Na2CO3·10H2O→Na2CO3二、铝及其化合物(22)38.铝与水常温反应:2Al+6H2O= 2Al(OH)3+3H2↑39.铝与氧气加热反应:4Al+3O2≜2Al2O340.铝与氯气加热反应:2Al+3Cl2点燃→2AlCl341.铝与硫加热反应:2Al+3S≜Al2S342.铝与三氧化二铁反应:2Al+Fe2O3高温→2Fe+Al2O343.三硫化二铝与水:Al2S3+6H2O=2Al(OH)3↓+3H2S↓44.铝与盐酸溶液反应:2Al+6HCl=2AlCl3+3H2↑(2Al+6H+=2Al3++3H2↑)45.铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2Al+2OH-+2H2O=2AlO2-+3H2↑)46.铝与稀硝酸溶液的钝化反应:Al+4HNO3(稀) =Al(NO3)3 + NO↑+ 2H2O47.铝离子与偏铝酸根反应:Al3++3AlO2-+6H2O= 4Al(OH)3↓48.铝离子与氢氧根(1:3)反应:Al3++3OH-=Al(OH)3↓49.铝离子与氢氧根(1:4)反应:Al3++4OH-=AlO2-+2H2O50.铝离子与水反应:Al3++ H2O= Al(OH)3↓(胶体)+3H+51.偏铝酸根与酸(1:1)反应:AlO2-+H++H2O= Al(OH)3↓52.偏铝酸根与酸(1:4)反应:AlO2-+4H+= Al3++2H2O53.氧化铝与盐酸溶液反应:Al2O3+6HCl=2AlCl3+3H2O (Al2O3+6H+=2Al3++3H2O)54.氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O(Al2O3+2OH-=2AlO2-+H2O)55.氢氧化铝与酸反应:Al(OH)3+3H+=Al3++3H2O56.氢氧化铝与碱反应:Al(OH)3+OH-=AlO2-+2H2O57.氢氧化铝的制备方法1:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4[Al23++3NH3·H2O=Al(OH)3↓+3NH4+]58.氢氧化铝的制备方法2:AlO2-+CO2+2H2O= Al(OH)3↓+ HCO3-2AlO2-+CO2+3H2O= 2Al(OH)3↓+ CO32-59.氢氧化铝受热分解:2Al(OH)3≜Al2O3+3H2O三、镁及其化合物(11)60.镁与氧气反应:2Mg+O2点燃→2MgO61.镁与二氧化碳反应:2Mg+CO2点燃→2MgO+C62.镁与氮气反应:3Mg+N2点燃→Mg3N263.二氮化三镁与水反应:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑64.镁与水反应:Mg+2H2O≜Mg(OH)2+H2↑65.镁与酸反应:Mg+2H+=Mg2++H2↑66.氧化镁与酸反应:MgO+2H+=Mg2++H2O67.镁离子与碱反应(氢氧化镁的制备):Mg2++2OH-=Mg(OH)2↓68.镁离子与氨水反应(氢氧化镁的制备):Mg2++2 NH3·H2O=Mg(OH)2↓+ 2NH4+69.氢氧化镁与酸反应:Mg(OH)2+2H+=Mg2++2H2O70.氢氧化镁受热分解:Mg(OH)2≜MgO+H2O四、铁及其化合物(24)71.铁与氧气反应:3Fe+2O2点燃→Fe3O472.铁与氯气反应:2Fe+3Cl2点燃→FeCl3(棕色烟)73.铁与硫反应:Fe+S≜FeS74.铁与酸反应:Fe+2H+=Fe2++H2↑75.铁与稀硝酸反应:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O76.铁与硝酸铁反应:Fe+ Fe(NO3)3=3Fe(NO3)277.过量铁与稀硝酸反应:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O注:序号为75、76是二次反应,77为这个二次反应的总方。
第三章 金属及其化合物化学方程式(四)铜及其化合物

第三章金属及其化合物化学方程式(四)铜及其化合物1、铜分别与O2、Cl2、S、I2反应化学反应方程式:2Cu+O22CuO(黑色固体)Cu+Cl2CuCl2(棕黄色烟)2Cu+S Cu2S(黑色固体) 2Cu+I22CuI2、铜和浓硫酸反应化学方程式:Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O3.铜和浓硝酸反应化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O4.铜和稀硝酸反应化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2N O↑+4H2O;离子方程式: 3Cu+8H++2NO3-= 3Cu2++2N O↑+4H2O5、铜与硝酸银溶液反应化学方程式:Cu+2AgNO3===Cu(NO3)2+2Ag离子方程式:Cu+2Ag+===Cu2++2Ag6、氯化铁溶液腐蚀印刷电路板化学方程式:Cu+2FeCl3=CuCl2+2FeCl2离子方程式:Cu+2Fe3+=Cu2++2Fe2+7、铜在空气中生锈化学方程式:2Cu+O2+H2O+CO2=Cu2(OH)2CO3。
8、Cu2(OH)2CO3(碱式碳酸铜、铜绿、孔雀石)受热分解化学方程式:Cu2(OH)2CO32CuO + H2O+ CO2↑9、碱式碳酸铜溶于盐酸化学方程式:Cu2(OH)2CO3+4HCl= 2Cu Cl2+3H2O+ CO2↑10、Cu2O在非氧化性酸中,不稳定,发生歧化反应化学方程式:Cu2O+H2SO4=CuSO4+Cu+H2O离子方程式:Cu2O+2H+=Cu2++Cu+H2O11、Cu2O溶于稀硝酸化学方程式: 3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O 离子方程式:3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O12、Cu2S溶于稀硝酸化学方程式:3Cu2S +16HNO3(稀)=6Cu(NO3)2+3S+4NO↑+8H2O离子方程式:3Cu2S +16H++4NO3-=6Cu2++3S+4NO↑+8H2O13、CuS溶于稀硝酸化学方程式:3CuS + 8HNO3(稀)= 3S+3Cu(NO3)2+2NO↑+4H2O)离子方程式:3CuS +8H++2NO3- =3Cu2++3S +2NO↑+4H2O14、氧化铜氧化氨气化学方程式:3CuO+2NH33Cu+N2+3H2O15、氧化铜受热10000C以上分解化学方程式:4CuO 2Cu2O +O2↑16、SO2通入氯化铜溶液中反应离子方程式:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-17、将铜粉加入氯化铜溶液中反应离子方程式:Cu2++2Cl-+Cu= CuCl↓18、将KI溶液加入到氯化铜溶液中反应离子方程式:2Cu2++4l-= 2Cul↓+ l219、氢氧化铜溶于强酸离子方程式:Cu(OH)2+2H+=Cu2++2H2O20、氢氧化铜溶于氨水离子方程式:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++ 2OH-+4H2O21、氢氧化铜受热分解化学方程式:Cu(OH)2 CuO+ H2O。
高中化学方程式汇总

化学方程式及离子方程式总汇一·钠及其化合物有关反应方程式一与金属钠有关的反应方程式1.钠与氧气在常温下反应:4Na+O2===2Na2O.钠在氧气中燃烧:2Na+O2点燃===Na2O22.钠在氯气中燃烧:2Na+Cl2点燃===2NaCl3.钠与硫粉研磨发生轻微爆炸:2Na+S研磨===Na2S4.钠与水反应:2Na+2H2O===2NaOH+H2↑ 2Na+2H2O===2Na++2OH-+H2↑5.钠与稀盐酸反应:2Na+2HCl===2NaCl+H2↑ 2Na+2H+===2Na++H2↑6.钠与CuSO4溶液反应:Na+CuSO4+2H2O===Na2SO4+CuOH2↓+H2↑Na+Cu2++2H2O===2Na++CuOH2↓+H2↑二与钠的氧化物有关的反应方程式与水反应:Na2O2+2H2O===4NaOH+O2↑ Na2O2+2H2O===4Na++4OH-+O2↑与CO2反应:2Na2O2+2CO2===Na2CO3+O2与稀盐酸反应:2Na2O2+4HCl===4NaCl+2H2O+O2↑ 2Na2O2+4H+===4Na++2H2O+O2↑与水反应:Na2O+H2O===2NaOH与CO2反应:Na2O+CO2===Na2CO3与SO2反应::Na2O+SO2===Na2SO3与稀盐酸反应:Na2O+2HCl===2NaCl+H2O Na2O+2H+===2Na++H2O二·铁及其化合物有关反应方程式一与金属铁有关的反应方程式1.铁在氯气中燃烧:2Fe+3Cl2点燃===2Fe2Cl32.铁在氧气中燃烧:3Fe+3O2点燃===Fe3O43.铁与硫粉反应:Fe+S∆===FeS4.铁与水蒸气反应:3Fe+4H2Og高温===Fe3O4+4H2↑5.铁与稀硫酸反应:Fe+H2SO4===FeSO4+H2↑ Fe+2H+===Fe2++H2↑6.铁与CuSO4溶液反应:Fe+CuSO4===FeSO4+Cu Fe+Cu2+===Fe2++Cu7.少量铁与稀硝酸反应:Fe+4HNO3===FeNO33+NO↑+2H2OFe+4H++NO3-===Fe3++NO↑+2H2O8.过量铁与稀硝酸反应:3Fe+8HNO3===3FeNO32+2NO↑+4H2O3Fe+8H++2NO3-===3Fe2++2NO↑+4H2O二与铁的氧化物有关的反应方程式与稀盐酸反应:FeO+2HCl===FeCl2+H2O FeO+2H+===Fe2++H2O与稀盐酸反应:Fe2O3+6HCl===2FeCl3+3H2O Fe2O3+6H+===2Fe3++3H2O与稀盐酸反应:Fe3O4+8HCl===FeCl2+2FeCl3+4H2O Fe3O4+8H+===Fe2++2Fe3++4H2O 与稀硝酸反应:3FeO+10HNO3===3FeNO33+NO↑+5H2O3FeO+10H++NO3-===3Fe3++NO↑+5H2O与稀硝酸反应:3Fe3O4+28H++NO3-===9Fe3++NO↑+14H2O与酸性KMnO4溶液反应:5FeO+18H++MnO4-===5Fe3++Mn2++9H2O与酸性KMnO4溶液反应:5FeO+48H++MnO4-===15Fe3++Mn2++24H2O三与铁的氢氧化物有关的反应方程式OH3与稀盐酸反应:FeOH3+3HCl===FeCl3+3H2OFeOH3+3H+===Fe3++3H2OOH2与稀盐酸反应:FeOH2+2HCl===FeCl2+2H2O FeOH2+2H+===Fe2++2H2OOH2与稀硝酸反应:FeOH2+10HNO3===3FeNO33+NO↑+8H2OFeOH2+10H++NO3-===3Fe3++NO↑+8H2OOH2在空气中久置:4FeOH2+O2+2H2O===4FeOH3OH3受热分解:2FeOH3∆===Fe2O3+3H2O四与亚铁盐或铁盐有关的反应方程式溶液与氯气反应:2FeCl2+Cl2===2FeCl3 2Fe2++Cl2===2Fe3++2Cl-溶液与稀硝酸反应:3FeCl2+4HNO3===3FeNO33+NO↑+2H2OFeCl2+4H++NO3-===3Fe3++NO↑+2H2O溶液与酸性KMnO4溶液反应:5Fe2++8H++MnO4-===5Fe3++Mn2++4H2O溶液与铁粉反应:2FeCl3+Fe===3FeCl2 2Fe3++Fe===3Fe2+溶液与铜粉反应:2FeCl3+Cu===2FeCl2+CuCl2 2Fe3++Cu===2Fe2++Cu2+溶液与H2S气体反应:H2S+2FeCl3===2FeCl2+S↓+2HCl 2Fe3++H2S===Fe2++S↓+2H+溶液与SO2气体反应:SO2+2FeCl3+2H2O===H2SO4+2FeCl2+2HCl2Fe3++SO2+2H2O===2Fe2++4H++SO42-溶液与KSCN溶液反应:FeCl3+3KSCN===FeSCN3+3KCl Fe3++3SCN-===FeSCN39.将饱和FeCl3溶液滴加到沸水中制取FeOH3胶体:Fe3++3H2O∆===FeOH3胶体+H+三·铝及其化合物有关反应方程式一与铝单质有关的反应方程式1.铝在氧气中燃烧:4Al+3O2点燃===2Al2O32.铝在氯气中燃烧:2Al+3Cl2点燃===2Al2Cl33.铝与Fe2O3反应:2Al+Fe2O3高温===Al2O3+2Fe4.铝与稀硫酸反应:2Al+3H2SO4===Al2SO43+3H2↑ 2Al+6H+===2Al3++3H2↑5.铝与NaOH溶液反应:2Al+2NaOH+6H2O===2NaAlOH4+3H2↑2Al+2OH-+6H2O===2AlOH4-+3H2↑二与氧化铝有关的反应方程式与稀硫酸反应:Al2O3+3H2SO4===Al2SO43+3H2O Al2O3+6H+===2Al3++3H2O与NaOH溶液反应:Al2O3+2NaOH+3H2O===2NaAlOH4 Al2O3+2OH-+3H2O===2AlOH4-熔融电解制备金属铝:2Al2O3电解===4Al+3O2↑三与氢氧化铝有关的反应方程式OH3与稀盐酸反应:AlOH3+3HCl===Al Cl3+3H2O AlOH3+3H+===Al3++3H2O OH3与NaOH溶液反应:AlOH3+NaOH===NaAlOH4 AlOH3+OH-===AlOH4-OH3受热分解:2AlOH3∆===Al2O3+3H2O四与铝盐有关的反应方程式与少量NaOH溶液反应:AlCl3+3NaOH===AlOH3↓+3NaClAl3++3OH-===AlOH3↓.AlCl3与过量NaOH溶液反应:AlCl3+4NaOH===NaAlOH4+3NaClAl3++4OH-===AlOH4-与过量的氨水反应:Al3++3NH3·H2O===AlOH3↓+3NH4+与NaHCO3溶液反应:Al3++3HCO3-===AlOH3↓+3CO2五与四羟基合铝酸盐有关的反应方程式AlOH4溶液与少量稀盐酸反应:NaAlOH4+HCl===AlOH3↓+NaCl+H2OAlOH4-+H+===AlOH3↓+H2O.NaAlOH4溶液与过量稀盐酸反应:NaAlOH4+4HCl=== AlCl3+NaCl+4H2OAlOH4-+4H+===Al3++4H2OAlOH4溶液与少量CO2反应:2NaAlOH4+CO2===2AlOH3↓+Na2CO3+H2O2AlOH4-+CO2===2AlOH3↓+CO32-+H2O.NaAlOH4溶液与过量CO2反应:NaAlOH4+CO2===AlOH3↓+NaHCO3AlOH4-+CO2===AlOH3↓+HCO3- AlOH4溶液与AlCl3溶液反应:3AlOH4-+Al3+===4AlOH3↓四·镁及其化合物有关反应方程式一与镁单质有关的反应方程式1.镁在氧气中燃烧:2Mg+O2点燃===2MgO2.镁在氧气中燃烧:Mg+Cl2点燃===MgCl23.镁与沸水反应:Mg+2H2O∆===MgOH2+H2↑4.镁在CO2中燃烧:Mg+CO2点燃===2MgO+C5.镁与稀硫酸反应:Mg+H2SO4===Mg SO4+H2↑ Mg+2H+===Mg2++H2↑.镁与浓硫酸反应:Mg+2H2SO4===Mg SO4+SO2↑+2H2O Mg+4H++SO42-===Mg2++SO2↑+2H2O6.镁与稀硝酸反应:3Mg+8HNO3===3MgNO32+2NO↑+4H2O 3Mg+8H++2NO3-===3Mg2++2NO↑+4H2O7.镁与CuSO4溶液反应:Mg+Cu2+===Mg2++Cu二与氧化镁有关的反应方程式与稀盐酸反应:MgO+2HCl===MgCl2+H2OMgO+2H+===Mg2++H2O三与氢氧化镁有关的反应方程式OH2与稀盐酸反应:MgOH2+2HCl===MgCl2+2H2O MgOH2+2H+===Mg2++2H2OOH2受热分解:MgOH2∆===MgO+H2O四与镁盐有关的反应方程式与NaOH溶液反应:MgCl2+2NaOH===MgOH2↓+2NaCl2 Mg2++2OH-===MgOH2↓与氨水反应:MgCl2+2NH3·H2O===MgOH2↓+2NH4Cl Mg2++2NH3·H2O===MgOH2↓+2NH4+五·铜及其化合物有关反应方程式一与铜单质有关的反应方程式1.铜与氧气反应:2Cu+O2∆===2CuO2.铜在氯气中燃烧:Cu+Cl2点燃===CuCl23.铜与硫粉共热反应:2Cu+S∆===Cu2S4.铜在潮湿空气中锈蚀变为铜绿:2Cu+O2+H2O+CO2===Cu2OH2CO35.铜与浓硫酸反应:Cu+2H2SO4∆===Cu SO4+SO2↑+2H2O6.铜与浓硝酸反应:Cu+4HNO3===CuNO32+2NO2↑+2H2O Cu+4H++2NO3-===Cu2++2NO2↑+2H2O.铜与稀硝酸反应:3Cu+8HNO3===3CuNO32+2NO↑+4H2O 3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O7.铜与AgNO3溶液反应:Cu+2AgNO3===CuNO32+Ag Cu+2Ag+===Cu2++Ag8.铜与FeCl3溶液反应:Cu+2FeCl3===2FeCl2+CuCl2 Cu+2Fe3+===2Fe2++Cu2+二与氧化铜有关的反应方程式与氢气共热反应:CuO+H2∆===Cu+H2O与铝粉共热反应:3CuO+2Al∆===3Cu+Al2O3与CO共热反应:CuO+CO∆===Cu+CO2与稀硫酸反应:Cu+H2SO4===Cu SO4+H2O三与氢氧化铜有关的反应方程式OH2与稀硫酸反应:CuOH2+H2SO4===Cu SO4+2H2OOH2受热分解:CuOH2∆===CuO+H2O四与铜盐有关的反应方程式与NaOH溶液反应:CuCl2+2NaOH===CuOH2↓+2NaCl Cu2++2OH-===CuOH2↓溶液与H2S气体反应:CuSO4+H2S===CuS↓+H2SO4Cu2++H2S===CuS↓+2H+溶液与铁粉反应:CuCl2+Fe===Cu+FeCl2 Cu2++Fe===Cu+Fe2+六·氯及其化合物有关反应方程式一与氯气有关的反应方程式1.铁丝在氯气中燃烧:2Fe+3Cl2点燃===2FeCl32.铜丝在氯气中燃烧:Cu+Cl2点燃===CuCl23.氢气在氯气中燃烧:H2+Cl2点燃===CuCl24.红磷在少量氯气中燃烧:2P+3Cl2点燃===2PCl3.红磷在过量氯气中燃烧:2P+5Cl2点燃===2PCl55.氯气与水反应:Cl2+H2O===HCl+HClO Cl2+H2O===H++Cl-+HClO6.氯水与SO2反应:Cl2+SO2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O===4H++2Cl-+SO42-7.氯气与NaOH溶液反应:Cl2+2NaOH===NaCl+NaClO+H2O Cl2+2OH-===Cl-+ClO-+H2O8.氯气与澄清石灰水反应:2Cl2+2CaOH2===CaCl2+CaClO2+2H2O Cl2+2OH-===Cl-+ClO-+H2O9.氯气与KI溶液反应:Cl2+2KI===2KCl+I2 Cl2+2I-===2Cl-+I210.氯气与NaBr溶液反应:Cl2+2NaBr===2NaCl+Br2 Cl2+2Br-===2Cl-+Br211.氯气与Na2S溶液反应:Cl2+Na2S===2NaCl+S↓ Cl2+S2-===2Cl-+S↓12.氯气与FeCl2溶液反应:Cl2+2FeCl2===2FeCl3 Cl2+2Fe2+===2Fe3++2Cl-13.氯气与Na2SO3溶液反应:Cl2+Na2SO3+H2O===Na2SO4+2HCl Cl2+SO32-+H2O===SO42-+2H++2Cl-二与含氯化合物有关的反应方程式1.稀盐酸与AgNO3溶液反应:HCl+AgNO3===AgCl↓+HNO3 Ag++Cl-===AgCl↓2.稀盐酸与铁粉溶液反应:2HCl+Fe===FeCl2+H2↑ 2H++Fe===Fe2++H2↑3.稀盐酸与NaHCO3溶液反应:HCl+NaHCO3===NaCl+H2O+CO2↑ H++HCO3-===H2O+CO2↑与少量稀盐酸溶液反应:Na2CO3+HCl===NaCl+NaHCO3 CO32-+H+===HCO3-.Na2CO3与过量稀盐酸溶液反应:Na2CO3+2HCl===2NaCl+H2O+CO2↑ CO32-+2H+===H2O+CO2↑ 5.稀盐酸与CaClO2溶液反应:2HCl+CaClO2===CaCl2+2HClO H++ClO-===HClOClO2溶液与少量CO2反应:CaClO2+CO2+H2O===CaCO3↓+2HClOCa2++2ClO-+CO2+H2O===CaCO3↓+2HClO.CaClO2溶液与过量CO2反应:CaClO2+2CO2+2H2O===CaHCO32+2HClOClO-+CO2+H2O===HCO3-+HClO七·溴及其化合物有关反应方程式一与溴单质有关的反应方程式1.溴与铁粉反应:3Br2+2Fe===2FeBr32.溴与NaOH溶液反应:Br2+2NaOH===NaBr+NaBrO+H2O Br2+2OH-===Br-+BrO-+H2O3.溴与氢硫酸反应:Br2+H2S===2HBr+S↓ Br2+H2S===2H++2Br-+S↓4.溴水与SO2反应:Br2+SO2+2H2O===H2SO4+2HBr Br2+SO2+2H2O===2Br-+SO42-+4H+5.溴与Na2SO3溶液反应:Br2+Na2SO3+H2O===Na2SO4+2HBr Br2+SO32-+H2O===2Br-+SO42-+2H+二与溴化物有关的反应方程式溶液与氯气反应:2NaBr+Cl2===2NaCl+Br2 2Br-+Cl2===2Cl-+Br2溶液与AgNO3溶液反应:NaBr+AgNO3===AgBr↓+NaNO3 Br-+Ag+===AgBr↓八·碘及其化合物有关反应方程式一与碘单质有关的反应方程式1.碘与铁粉反应:Fe+I2=== FeI22.碘与氢硫酸溶液反应:I2+H2S===2HI+S↓ I2+H2S===2H++2I-+S↓3.碘水与SO2反应:I2++SO2+2H2O===H2SO4+2HI I2++SO2+2H2O===2I-+SO42-+4H+4.碘与亚硫酸钠溶液反应:I2+Na2SO3+H2O===Na2SO4+2HI I2+SO32-+H2O===2I-+SO42-+2H+二与碘化物有关的反应方程式溶液与氯气反应:2NaI+Cl2===2NaCl+I2 2I-+Cl2===2Cl-+I2溶液与溴水反应:NaI+Br2===2NaBr+I2 2I-+Br2===2Br-+I2溶液与AgNO3溶液反应:NaI+AgNO3===AgI↓+NaNO3 I-+Ag+===AgI↓九·碳及其化合物有关反应方程式一与碳单质有关的反应方程式1.碳在氧气中燃烧:2C+O2少量点燃===2CO C+O2足量点燃===CO22.碳与CO2在高温下反应:C+CO2高温===2CO3.碳与水蒸气在高温下反应:C+H2O高温===CO+H2水煤气4.碳与SiO2在高温下反应:2C+SiO2高温===Si+2CO↑5.碳与CuO在高温下反应:C+2CuO高温===2Cu+CO2↑6.碳与Fe2O3在高温下反应:3C+2Fe2O3高温===4Fe+3CO2↑7.碳与浓硫酸在加热时反应:C+2H2SO4∆===CO2↑+2SO2↑+2H2O8.碳与浓硝酸在加热时反应:C+4HNO3∆===CO2↑+4NO2↑+2H2O二与碳的氧化物有关的反应方程式在氧气中燃烧:2CO+O2点燃===2CO2与Fe2O3在高温下反应:3CO+Fe2O3高温===2Fe+3CO2与CuO在高温下反应:CO+CuO高温===Cu+CO2与Na2O反应:CO2+Na2O===Na2CO3与Na2O2反应:2CO2+2Na2O2===2Na2CO3+O2与Na2CO3溶液反应:Na2CO3+CO2+H2O===2NaHCO3 CO32-+CO2+H2O===2HCO3-7.少量CO2与澄清石灰水反应:CO2+CaOH2===CaCO3↓+H2O CO2+Ca2++2OH-===CaCO3↓+H2O .过量CO2与澄清石灰水反应:2CO2+CaOH2===CaHCO32 CO2+OH-===HCO3-8.少量CO2与Na2SiO3溶液反应:CO2+H2O+Na2SiO3===H2SiO3↓+Na2CO3CO2+H2O+SiO32-===H2SiO3↓+CO32-.过量CO2与Na2SiO3溶液反应:2CO2+2H2O+Na2SiO3===H2SiO3↓+2NaHCO32CO2+2H2O+SiO32-===H2SiO3↓+2HCO3-9.少量CO2与NaAlOH4溶液反应:CO2+2NaAlOH4===2AlOH3↓+Na2CO3+H2OCO2+2AlOH4-===2AlOH3↓+CO32-+H2O.过量CO2与NaAlOH4溶液反应:CO2+NaAlOH4===AlOH3↓+NaHCO3CO2+AlOH4-===AlOH3↓+HCO3-三与碳酸盐有关的反应方程式溶液与过量醋酸溶液反应:Na2CO3+2CH3COOH===2NaCH3COO+H2O+CO2↑CO32-+2CH3COOH===2CH3COO-+H2O+CO2↑与过量醋酸溶液反应:CaCO3+2CH3COOH===CaCH3COO2+H2O+CO2↑CaCO3+2CH3COOH===Ca2++2CH3COO-+H2O+CO2↑溶液与澄清石灰水反应:Na2CO3+CaOH2===CaCO3↓+2NaOH CO32-+Ca2+===CaCO3↓溶液与BaCl2溶液反应:Na2CO3+BaCl2===BaCO3↓+2NaCl CO32-+Ba2+===BaCO3↓溶液与过量SO2反应:Na2CO3+2SO2+H2O===2NaHSO3+CO2CO32-+2SO2+H2O===2HSO3-+CO2溶液与醋酸溶液反应:NaHCO3+CH3COOH===NaCH3COO+H2O+CO2↑HCO3-+CH3COOH===CH3COO-+H2O+CO2↑溶液与NaOH溶液反应:NaHCO3+NaOH===Na2CO3+H2O HCO3-+OH-===CO32-+H2O 溶液与少量澄清石灰水反应:2NaHCO3+CaOH2===CaCO3↓+Na2CO3+H2O.NaHCO3溶液与过量澄清石灰水反应:NaHCO3+CaOH2===CaCO3↓+NaOH+H2O加热分解:2NaHCO3∆===Na2CO3+H2O+CO2↑十·氮及其化合物有关反应方程式一与N2有关的反应方程式1.镁条在N2中燃烧:N2+3Mg点燃===Ng3N22.工业上合成氨:N2+3H2=====2NH3与O2在放电时反应:N2+O2放电===2NO二与NO有关的反应方程式与O2反应:2NO+O2===2NO2与水反应:3NO2+H2O===2HNO3+NO与NaOH溶液反应:2NO2+2NaOH===NaNO2+NaNO3+H2O 2NO2+2OH-===NO2-+NO3-+H2O 、NO2混合气体与NaOH溶液反应:NO+NO2+2NaOH===2NaNO2+H2ONO+NO2+2OH-===2NO2-+H2O 三与NH3有关的反应方程式与O2催化氧化反应:4NH3+5O2催化剂===4NO+6H2O2.少量NH3与氯气反应:2NH3+3Cl2===6HCl+N2 .过量NH3与氯气反应:8NH3+3Cl2===6NH4Cl+N2与水反应:NH3+H2O===NH3·H2O===NH4++OH-与CuO反应:2NH3+ 3CuO∆===3Cu+N2+3H2O与浓盐酸反应:NH3+HCl===NH4Cl白烟与浓硝酸反应:NH3+HNO3===NH4NO3白烟与浓硫酸反应:2NH3+H2SO4===NH42SO4四与硝酸有关的反应方程式1.硝酸见光或受热分解:4HNO3受热或见光======4N O2↑+O2↑+2H2O2.铜与浓硝酸反应:Cu+4HNO3===CuNO32+2NO2↑+2H2O Cu+4H++2NO3-===Cu2++2NO2↑+2H2O3.铜与稀硝酸反应:3Cu+8HNO3===3CuNO32+2NO↑+4H2O 3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O4.碳与浓硝酸反应:C+4HNO3∆===CO2↑+4NO2↑+2H2O5.硫与浓硝酸反应:S+6HNO3∆===H2SO4+6NO2↑+2H2O与稀硝酸反应:3FeO+10HNO3===3FeNO33+NO↑+5H2O3FeO+10HNO3===3FeNO33+NO↑+5H2O 与稀硝酸反应:3SO2+2HNO3+2H2O===2NO↑+3H2SO43SO2+2NO3-+2H2O===2NO↑+4H++3SO42-OH2与稀硝酸反应:3FeOH2+10HNO3===3FeNO33+NO↑+8H2O 3FeOH2+10H++NO3-===3Fe3++NO↑+8H2O 与稀硝酸反应:3FeCl2+4HNO3===3FeNO33+NO↑+2H2O3Fe2++4H++NO3-===3Fe3++NO↑+2H2O 与稀硝酸反应:3Na2S+8HNO3===2NO↑+3S↓+4H2O3S2-+8H++2NO3-===2NO↑+3S↓+4H2O 与稀硝酸反应:3Na2SO3+2HNO3===3Na2SO4+2NO↑+H2O3SO32-+2H++2NO3-===3SO42-+2NO↑+H2O 五与铵盐有关的反应方程式加热分解:NH3HCO3∆===NH3↑+H2O+CO2↑加热分解:NH4Cl∆===NH3↑+HCl↑固体与消石灰加热反应:2NH4Cl+CaOH2∆===CaCl2+2NH3↑+2H2O溶液与NaOH溶液反应:NH4Cl+NaOH===NH3·H2O+NaCl NH4++OH-===NH3·H2O溶液与过量NaOH溶液加热时反应:NH3HCO3+2NaOH∆===NH3↑+Na2CO3+2H2ONH4++HCO3-+2OH-∆===NH3↑+CO32-+2H2O十一·硫及其化合物有关反应方程式一与硫单质有关的反应方程式1.硫粉与铁粉加热反应:S+Fe∆===FeS2.硫粉与铜粉加热反应:S+Cu∆===CuS3.硫与氢气加热反应:S+H2∆===H2S4.硫在氧气中燃烧:S+O2点燃===SO25.硫与浓硝酸加热反应:S+6HNO3∆===H2SO4+6NO2↑+2H2O6.硫与浓硫酸加热反应:S+2H2SO4∆===3S O2↑+2H2O7.硫与NaOH溶液加热反应:3S+6NaOH∆===2Na2S+Na2SO3+3H2O3S+6OH-∆===2S2-+SO32-+3H2O二与SO2有关的反应方程式与氧气反应:2SO2+O2===2SO3与氯水反应:SO2+Cl2+2H2O===H2SO4+2HCl SO2+Cl2+2H2O===4H++SO42-+Cl-与水反应:SO2+H2O===H2SO3与CaO反应:SO2+CaO∆===CaSO35.少量SO2与澄清石灰水反应:SO2+CaOH2===CaSO3↓+H2O.过量SO2与澄清石灰水反应:2SO2+CaOH2===CaHSO32 SO2+OH-===HSO3-与稀硝酸反应:3SO2+2HNO3+2H2O===2NO↑+3H2SO43SO2+2NO3-+2H2O===2NO↑+4H++3SO42-与FeCl3溶液反应:SO2+2FeCl3+2H2O===H2SO4+2FeCl2+2HClSO2+2Fe3++2H2O===4H++SO42-+2Fe2+与酸性KMnO4溶液反应:5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO45SO2+2MnO4-+2H2O===5SO42-+2Mn2++4H+与H2S反应:SO2+2H2S===3S↓+2H2O与H2O2溶液反应:SO2+H2O2===H2SO4三与硫化物有关的反应方程式在氧气中燃烧:2H2S+5O2过量点燃===4SO2+2H2O 2H2S+O2少量点燃===4S+2H2O与氯气反应:H2S+Cl2===S+2HCl与SO2反应:SO2+2H2S===3S↓+2H2O与稀硝酸反应:3H2S+2HNO3===4H2O+3S↓+2NO↑3H2S+NO3-+2H++2H2O===4H2O+3S↓+2NO↑与FeCl3溶液反应:H2S+2FeCl3===2FeCl2+S↓+2HCl 2Fe3++H2S===Fe2++S↓+2H+与稀硫酸反应:FeS+H2SO4===H2S↑+FeSO4 FeS+2H+===H2S↑+Fe2+与稀硝酸反应:FeS+4HNO3===FeNO33+S↓+NO↑+2H2OFeS+4H++NO3-===Fe3++S↓+NO↑+2H2O四与浓硫酸有关的反应方程式1.氨气与浓硫酸反应:2NH3+H2SO4===NH42SO4与浓硫酸反应:H2S+H2SO4===S↓+SO2↑+2H2O与浓硫酸反应:2HI+H2SO4===I2+SO2↑+2H2O4.铜与浓硫酸加热反应:Cu+2H2SO4∆===Cu SO4+SO2↑+2H2O5.铁与浓硫酸加热反应:2Fe+6H2SO4∆===Fe2SO4+3SO2↑+6H2O6.锌与浓硫酸常温下反应:Zn+2H2SO4===Zn SO4+SO2↑+2H2O7.碳与浓硫酸加热反应:C+2H2SO4∆===CO2↑+2SO2↑+2H2O8.硫与浓硫酸加热反应:S+2H2SO4∆===3S O2↑+2H2O粉末与浓硫酸反应:Na2SO3+H2SO4===Na2SO4+SO2↑+H2O五与硫酸盐有关的反应方程式溶液与BaOH2溶液反应:CuSO4+BaOH2===CuOH2↓+BaSO4↓溶液与BaOH2溶液混合呈中性:2H++SO42-+2OH-+Ba2+===BaSO4↓+2H2O.向NaHSO4溶液中滴加BaOH2溶液至SO42-沉淀完全:H++SO42-+OH-+Ba2+===BaSO4↓+H2O 十二·硅及其化合物有关反应方程式一与硅单质有关的反应方程式1.硅与氧气反应:Si+O2∆===SiO22.硅与氯气反应:Si+2Cl2∆===SiCl43.硅与碳反应:Si+C∆===SiC4.硅与氢氟酸反应:Si+4HF===SiF4↑+2H2↑5.硅与NaOH溶液反应:Si+2NaOH+H2O===Na2SiO3+2H2↑Si+2OH-+H2O===SiO32-+2H2↑二与SiO2有关的反应方程式与碳反应:SiO2+2C∆===Si+2CO↑与CaO反应:SiO2+CaO高温===CaSiO3与氢氟酸反应:SiO2+4HI===SiF4↑+2H2O与NaOH溶液反应:SiO2+2NaOH===Na2SiO3+H2O SiO2+2OH-===SiO32-+H2O与Na2CO3高温反应:SiO2+Na2CO3高温===Na2SiO3+CO2↑与CaCO3高温反应:SiO2+CaCO3高温===CaSiO3+CO2↑三与硅酸盐有关的反应方程式溶液与少量CO2反应:Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3SiO32-+CO2+H2O===H2SiO3↓+CO32-溶液与过量CO2反应:Na2SiO3+2CO2+2H2O===H2SiO3↓+2NaHCO3 SiO32-+2CO2+2H2O===H2SiO3↓+2HCO3-。
金属及其化合物化学方程式

★☆钠及其重要化合物☆★一、金属钠1.钠与氧气反应常温:4Na + O2 = 2Na2O (白色)点燃:2Na + O2Na2O2(淡黄色)或:2Na + O2Na2O2 (淡黄色) 2.钠与氯气反应2Na + Cl22NaCl(剧烈燃烧,大量白烟)3.钠与硫的反应2Na + S = Na2S (直接化合,甚至爆炸)4.钠与熔融盐(如TiCl4)的反应:4Na + TiCl44NaCl + Ti5.钠与水的反应2Na + 2H2O = 2NaOH + H2↑2Na + 2H2O = 2Na++2OH- + H2↑6.钠与盐酸的反应2Na + 2HCl = 2NaCl + H2↑2Na + 2H+ = 2Na+ + H2↑7.钠与硫酸铜等盐溶液的反应2Na +2H2O = 2NaOH + H2↑2NaOH+CuSO4 = Cu(OH)2↓+ Na2SO4总反应:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑二、氧化钠—碱性氧化物:能与酸反应生成盐和水的氧化物1.碱性氧化物+水→碱(碱可溶才易反应)Na2O + H2O = 2NaOHNa2O + H2O = 2Na+ + 2OH-2.碱性氧化物+酸性氧化物→盐Na2O + CO2 = Na2CO33.碱性氧化物+酸→盐+水Na2O + 2HCl = 2NaCl + H2ONa2O + 2H+ = 2Na+ + H2O三、过氧化钠—不是碱性氧化物1.过氧化钠与水反应2Na2O2 + 2H2O = 4NaOH + O2↑2Na2O2 + 2H2O = 4Na++4OH- + O2↑2.过氧化钠与二氧化碳反应2Na2O2 + 2CO2 = 2Na2CO3 + O23.过氧化钠与酸反应2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑2Na2O2 + 4H+ = 4Na+ + 2H2O + O2↑四、碳酸钠(纯碱、苏打)1.碳酸钠与酸的反应⑴碳酸钠溶液分别与少量盐酸、足量盐酸反应Na 2CO 3 + HCl = Na HCO 3 + NaClCO 32- + H + = HCO 3-Na 2CO 3 + 2HCl = 2NaCl +CO 2↑+ H 2OCO 32- + 2H + = CO 2↑+ H 2O⑵碳酸钠溶液与足量醋酸反应Na 2CO 3+2CH 3COOH=2CH 3COONa+CO 2↑+H 2OCO 32-+2CH 3COOH=2CH 3COO -+CO 2↑+H 2O ⑶碳酸钠溶液中通入二氧化碳气体Na 2CO 3 + H 2O + CO 2 = 2NaHCO 3CO 32- + H 2O + CO 2 = 2HCO 3-过量..CO 2通入饱和..Na 2CO 3溶液:析出NaHCO 3晶体.. *Na 2CO 3 + H 2O + CO 2 = 2NaHCO 3↓2Na ++CO 32- + H 2O + CO 2 = 2NaHCO 3↓ ⑷***碳酸钠溶液中通入二氧化碳气体*Na 2CO 3 + SO 2 = Na 2SO 3 + CO 2↑*Na 2CO 3 + H 2O + 2SO 2 = 2NaHSO 3 + CO 2↑2.碳酸钠与某些盐(CaCl 2、BaCl 2、AgNO 3、NaHSO 4)的反应Na 2CO 3+ CaCl 2=CaCO 3↓+2NaClCO 32-+ Ca 2+=CaCO 3↓Na 2CO 3+ 2AgNO 3=Ag 2CO 3↓+2NaNO 3CO 32-+ 2Ag +=Ag 2CO 3↓*Na 2CO 3+ 2NaHSO 4=2Na 2SO 4+CO 2↑+H 2O CO 32-+ 2H +=CO 2↑+H 2O3.碳酸钠溶液与某些碱[Ca(OH)2、Ba(OH)2]溶液的反应Na 2CO 3+ Ca(OH)2=CaCO 3↓+2NaOHCO 32-+ Ca 2+=CaCO 3↓Na 2CO 3+ Ba(OH)2=BaCO 3↓+2NaOHCO 32-+ Ba 2+=BaCO 3↓五、碳酸氢钠(小苏打)1.碳酸氢钠受热分解2NaHCO 3Na 2CO 3+H 2O+CO 2↑2.碳酸氢钠分别与盐酸、醋酸的反应NaHCO 3 + HCl = NaCl+CO 2↑+ H 2OHCO 3-+H+ =CO 2↑+H 2ONaHCO 3+CH 3COOH=CH 3COONa+CO 2↑+H 2O HCO 3-+CH 3COOH=CH 3COO -+CO 2↑+H 2O3.用饱和..NaHCO 3溶液除去CO 2中混有的SO 2气体:*2NaHCO 3 + SO 2 = Na 2SO 3 + 2CO 2↑+H 2O4.碳酸氢钠溶液与某些碱的反应NaHCO 3 + NaOH = Na 2CO 3 + H 2OHCO 3-+OH-=CO 32-+H 2O*** NaHCO3溶液与Ca(OH)2溶液的反应:*a.足量NaHCO3溶液与少量澄清石灰水时:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O *b.少量NaHCO3溶液与足量澄清石灰水时:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2OHCO3-+Ca2++OH-=CaCO3↓+2H2O5.碳酸氢钠与某些盐的反应NaHCO3 + NaHSO4 = Na2SO4 + CO2↑+H2OHCO3-+H+=CO2↑+H2O六、氢氧化钠(烧碱、火碱、苛性钠)1.氢氧化钠与酸性氧化物(CO2、SO2)的反应2NaOH + CO2 = Na2CO3 + H2O2OH- + CO2 = CO32- + H2ONa2CO3 + H2O + CO2 = 2NaHCO3CO32-+ H2O + CO2 = 2HCO3-总反应:NaOH + CO2 = NaHCO3OH- + CO2 = HCO3-2.氢氧化钠分别与盐酸、醋酸的反应NaOH +HCl =NaCl+ H2OOH-+H+=H2ONaOH + CH3COOH = CH3COONa+H2OOH- + CH3COOH = CH3COO-+H2O3.氢氧化钠与某些盐的反应2NaOH+CuSO4=Na2SO4+ Cu(OH)2↓2OH-+Cu2+=Cu(OH)2↓*** NaOH溶液与Ca(HCO3)2溶液的反应:*a.少量NaOH溶液与足量Ca(HCO3)2溶液时:Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-=CaCO3↓+H2O*b.足量NaOH溶液与少量Ca(HCO3)2溶液时:Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O七、氯化钠1.氯化钠与某些盐的反应NaCl+AgNO3=AgCl↓+ NaNO3Cl-+Ag+=AgCl↓2.氯化钠固体与浓硫酸反应NaCl + H2SO4(浓)NaHSO4+HCl↑2NaCl + H2SO4(浓)Na2SO4+2HCl↑3.电解熔融的氯化钠2NaCl(熔融)2Na+Cl2↑1.镁与氧气反应2Mg + O22MgO(耀眼白光、大量白烟)2.镁与氯气反应Mg + Cl2MgCl23.镁与氮气反应3Mg + N2Mg3N24.镁与CO2反应2Mg + CO22MgO +C5.镁与H2O反应(与冷水很缓慢、与沸水较迅速反应)Mg + 2H2O = Mg(OH)2 +H2↑6.镁与盐酸反应Mg + 2HCl =MgCl2 +H2↑Mg + 2H+=Mg2+ +H2↑7.镁与某些盐的反应Mg + CuCl2 = MgCl2 + CuMg + Cu2+ = Mg2+ + Cu8.氧化镁与酸反应MgO + 2HCl =MgCl2 + H2OMgO + 2H+=Mg2+ + H2O9.氢氧化镁与酸反应Mg(OH)2 + 2HCl =MgCl2 + 2H2OMg(OH)2 + 2H+=Mg2+ + 2H2O10.氢氧化镁受热分解Mg(OH)2MgO + H2O11.氯化镁与碱反应⑴氯化镁溶液与氢氧化钠溶液反应MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaClMg2+ + 2OH- = Mg(OH)2↓⑵氯化镁溶液与氨水反应MgCl2 + 2NH3·H2O = Mg(OH)2↓+ 2NH4Cl Mg2+ + 2NH3·H2O = Mg(OH)2↓+ 2NH4+ 12.氯化镁与某些盐(Na2CO3)的反应MgCl2 + Na2CO3 = MgCO3↓+ 2NaClMg2+ + CO32- = MgCO3↓13.电解熔融的氯化镁MgCl2(熔融)Mg+Cl2↑一、金属铝1.铝与氧气反应4Al + 3O22Al2O32.铝与氯气反应2Al + 3Cl22AlCl33.铝与硫的反应2Al + 3S Al2S34.铝热反应2Al+Fe2O3Al2O3+2Fe(剧烈反应,火星四射,有红热的熔融物生成)5.铝与强酸的反应2Al + 6HCl = 2AlCl3 + 3H2↑2Al + 6H+ = 2Al3+ + 3H2↑6.铝与强碱的反应2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑或:2Al+2NaOH+6H2O = 2Na[Al(OH)4] + 3H2↑2Al+2OH-+6H2O = 2[Al(OH)4]- + 3H2↑四羟基合铝酸钠7.铝与某些盐的反应2Al + 3CuSO4 = Al2(SO4)3 + 3Cu2Al + 3Cu2+ = 2Al3+ + 3Cu二、氧化铝1.与强酸反应:Al2O3+6HCl=2AlCl3+3H2OAl2O3+6H+=2Al3++3H2O2.与强碱反应:Al2O3+2NaOH=2NaAlO2+H2OAl2O3+2OH-=2AlO2-+H2O三、氢氧化铝1.Al(OH)3的两性:①与强酸反应:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②与强碱反应:Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH-=AlO2-+2H2O2.Al(OH)3的不稳定性: 受热易分解2Al(OH)3Al2O3+3H2O四、氯化铝1.氯化铝溶液与氢氧化钠溶液反应氢氧化钠不足时:AlCl3+3NaOH = Al(OH)3↓+3NaClAl3++3OH- = Al(OH)3↓氢氧化钠过量后:Al(OH)3+NaOH = NaAlO2+2H2OAl(OH)3+OH- = AlO2-+2H2O☆总反应:AlCl3+4NaOH = NaAlO2+3NaCl +2H2OAl3++4OH- = AlO2-+2H2O2.氯化铝溶液与氨水反应AlCl3+3NH3·H2O=Al(OH)3↓+ 3NH4ClAl3++3NH3·H2O=Al(OH)3↓+ 3NH4+3.氯化铝溶液与偏铝酸钠溶液反应3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl3AlO2-+Al3++6H2O=4Al(OH)3↓五、偏铝酸钠1.偏铝酸钠溶液与盐酸的反应盐酸不足时:NaAlO2+HCl+H2O=Al(OH)3↓+NaClAlO2-+H++H2O=Al(OH)3↓盐酸过量后:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O☆总反应:NaAlO2+4HCl=AlCl3+NaCl +2H2OAlO2-+4H+=Al3++2H2O2.偏铝酸钠溶液与CO2的反应NaAlO2溶液中通入少量CO2气体:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-NaAlO2溶液中通入过量CO2气体:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-3.偏铝酸钠溶液与氯化铝溶液的反应3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl3AlO2-+Al3++6H2O=4Al(OH)3↓六、硫酸铝钾—KAl(SO4)2——复盐明矾:KAl(SO4)2·12H2O(十二水合硫酸铝钾)明矾净水:溶于水时产生Al(OH)3胶体,能吸附水中悬浮的杂质而沉淀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属及其化合物化学方程式
1、钠放置在空气中4Na + O2 = 2Na2O
2、钠在空气中燃烧(黄色的火焰)2Na + O2Na2O2(淡黄色固体)
4Li + O2△2Li2O
3、铝箔被氧气氧化4Al + 3O2 △2Al2O3
4、钠与水反应(浮、熔、游、响、红)
2Na + 2H2O = 2NaOH + H2↑
【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】
5、高温下铁与水反应3Fe + 4H2O(g) 高温Fe3O4 + 4H2
6、铝片与稀盐酸反应
2Al + 6HCl = 2AlCl3 + 3H2↑【2Al + 6H+ = 2Al3+ +3H2↑】
7、铝与氢氧化钠溶液反应
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】
8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)
2Na2O2 + 2H2O = 4NaOH + O2↑
【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】
9、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
10、苏打(纯碱)与盐酸反应Na2CO3 +2HCl=2NaCl+H2O +CO2↑
【CO32- + 2H+ = H2O + CO2↑】
11、小苏打溶液与盐酸反应NaHCO3 + HCl= NaCl+H2O +CO2↑
【HCO3- + H+ = H2O + CO2↑】
12、小苏打受热分解2NaHCO3△Na2CO3 + H2O +CO2 ↑
13、氢氧化钠溶液和碳酸氢钠溶液反应
NaHCO3+NaOH= Na2CO3 + H2O
【HCO3-+ OH - = H2O + CO32- 】
14、氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH ===2NaAlO2 +H2O
【Al2O3 + 2OH - === 2AlO2- + H2O】
15、氧化铝溶于硫酸Al2O3+ 3H2SO4==Al2(SO4)3+3H2O
【Al2O3 +6H+ = 2Al3+ +3H2O】
16、硫酸铝溶液中滴加过量氨水
Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4
【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】
17、氢氧化铝中加盐酸Al(OH)3 + 3HCl = AlCl3 + 3H2O
【Al(OH)3 + 3H+ = Al3+ + 3H2O】
18、Al(OH)3与NaOH溶液反应:
Al(OH)3 + NaOH NaAlO2 +2H2O
【Al(OH)3 + OH- = AlO2- +2H2O】
19、氢氧化铝受热分解2Al(OH)3△2O3+3H2O
20、铁与盐酸反应Fe + 2HCl = FeCl2 + H2↑
【Fe + 2H+ = Fe2+ + H2↑】
21、氧化铁溶于盐酸中Fe2O3 + 6HCl = 2FeCl3 + 3H2O
【Fe2O3 + 6H+ = 2Fe3+ + 3H2O】
22、氧化亚铁溶于盐酸中FeO + 2HCl = FeCl2 + H2O
【FeO + 2H+ = Fe2+ + H2O】
23、氯化铁溶液中滴入氢氧化钠溶液(红褐色沉淀)
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
【Fe3+ + 3OH - = Fe(OH)3↓(红褐色沉淀)】
24、硫酸亚铁溶液中滴加氢氧化钠溶液
Fe SO4+ 2NaOH = Fe(OH)2↓+ Na2SO4
【Fe2+ + 2OH - = Fe(OH)2↓(白色沉淀)】
25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀)4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3
26、氢氧化铁受热分解2Fe(OH)3△Fe2O3+3H2O
27、氯化亚铁溶液中通入氯气2FeCl2 + Cl2 = 2FeCl3
【2Fe2+ + Cl2 = 2Fe3+ + 2Cl-】
28、氯化铁溶液中加入铁粉
2FeCl3 + Fe =3FeCl2
【2Fe3+ + Fe =3Fe2+】。
