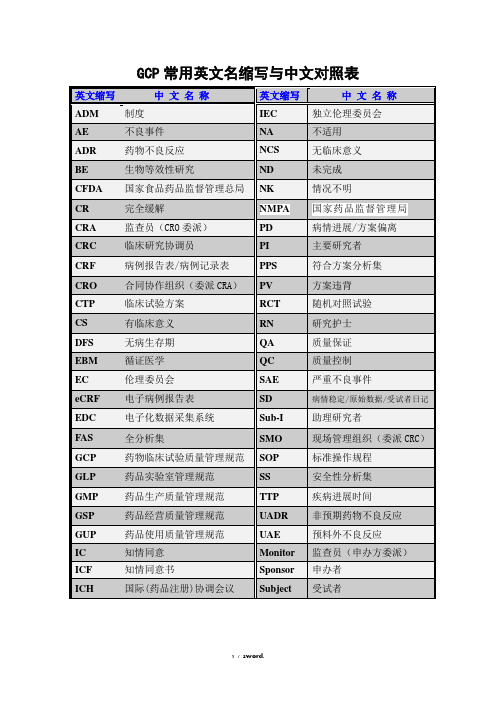
GCP常用英文名缩写与中文对照表
临床试验英语词汇

临床试验英语词汇-CAL-FENGHAI.-(YICAI)-Company One1专业术语、缩略语中英对照表缩略语英文全称中文全称ABE Average Bioequivalence 平均生物等效性AC Active control 阳性对照ADE Adverse Drug Event 药物不良事件ADR Adverse Drug Reaction 药物不良反应AE Adverse Event 不良事件AI Assistant Investigator 助理研究者ALB Albumin 白蛋白ALD Approximate Lethal Dose 近似致死剂量ALP Alkaline phosphatase 碱性磷酸酶ALT Alanine aminotransferase 丙氨酸转氨酶ANDA Abbreviated New Drug Application 简化新药申请ANOVA Analysis of variance 方差分析AST Aspartate aminotransferase 天冬氨酸转氨酶ATR Attenuated total reflection 衰减全反射法BA Bioavailability 生物利用度BE Bioequivalence 生物等效性BMI Body Mass Index 体质指数BUN Blood urea nitrogen 血尿素氮CATD Computer-assisted trial design 计算机辅助试验设计CDER Center of Drug Evaluation and Research 药品评价和研究中心CFR Code of Federal Regulation 美国联邦法规CI Co-Investigator 合作研究者CI Confidence Interval 可信区间COI Coordinating Investigator 协调研究者CRC Clinical Research Coordinator 临床研究协调者CRF Case Report/Record Form 病历报告表/病例记录表CRO Contract Research Organization 合同研究组织CSA Clinical Study Application 临床研究申请CTA Clinical Trial Application 临床试验申请CTP Clinical Trial Protocol 临床试验方案CTR Clinical Trial Report 临床试验报告CTX Clinical Trial Exemption 临床试验免责CHMP Committee for Medicinal 人用药委会Products for Human UseDSC Differential scanning 差示扫描热量计DSMB Data Safety and monitoring Board 数据安全及监控委员会EDC Electronic Data Capture 电子数据采集系统EDP Electronic Data Processing 电子数据处理系统EWP Europe Working Party 欧洲工作组FDA Food and Drug Administration 美国食品与药品管理局FR Final Report 总结报告GCP Good Clinical Practice 药物临床试验质量管理规范GCP Good Laboratory Practice 药物非临床试验质量管理规范GLU Glucose 葡萄糖GMP Good Manufacturing Practice 药品生产质量管理规范HEV Health economic evaluation 健康经济学评价IB Investigator’s Brochure研究者手册IBE IndividualBioequivalence 个体生物等效性IC Informed Consent 知情同意ICF Informed Consent Form 知情同意书ICH International Conference on Harmonization 国际协调会议IDM Independent Data Monitoring 独立数据监察IDMC Independent Data Monitoring Committee 独立数据监察委员会IEC Independent Ethics Committee 独立伦理委员会IND Investigational New Drug 新药临床研究IRB Institutional Review Board 机构审查委员会ITT Intention-to –treat 意向性分析IVD In Vitro Diagnostic 体外诊断IVRS Interactive Voice Response System 互动语音应答系统LD50 Medial lethal dose 半数致死剂量LLOQ Lower Limit of quantitation 定量下限LOCF Last observation carry forward 最接近一次观察的结转LOQ Limit of Quantitation 检测限MA Marketing Approval/Authorization 上市许可证MCA Medicines Control Agency 英国药品监督局MHW Ministry of Health and Welfare 日本卫生福利部MRT Mean residence time 平均滞留时间MTD Maximum Tolerated Dose 最大耐受剂量ND Not detectable 无法定量NDA New Drug Application 新药申请NEC New Drug Entity 新化学实体NIH National Institutes of Health 国家卫生研究所(美国)NMR Nuclear Magnetic Resonance 核磁共振PD Pharmacodynamics 药效动力学PI Principal Investigator 主要研究者PK Pharmacokinetics 药物动力学PL Product License 产品许可证PMA Pre-market Approval (Application) 上市前许可(申请)PP Per protocol 符合方案集PSI Statisticians in the Pharmaceutical Industry 制药业统计学家协会QA Quality Assurance 质量保证QAU Quality Assurance Unit 质量保证部门QC Quality Control 质量控制QWP Quality Working Party 质量工作组RA Regulatory Authorities 监督管理部门REV Revision 修订SA Site Assessment 现场评估SAE Serious Adverse Event 严重不良事件SAP Statistical Analysis Plan 统计分析计划SAR Serious Adverse Reaction 严重不良反应SD Source Data/Document 原始数据/文件SD Subject Diary 受试者日记SDV Source Data Verification 原始数据核准SEL Subject Enrollment Log 受试者入选表SFDA State Food and Drug Administration 国家食品药品监督管理局SI Sponsor-Investigator 申办研究者SI Sub-investigator 助理研究者SIC Subject Identification Code 受试者识别代码SOP Standard Operating Procedure 标准操作规程SPL Study Personnel List 研究人员名单SSL Subject Screening Log 受试者筛选表T&R Test and Reference Product 受试和参比试剂T-BIL Total Bilirubin 总胆红素T-CHO Total Cholesterol 总胆固醇TG Thromboglobulin 血小板球蛋白Tmax Time of maximum concentration 达峰时间TP Total proteinum 总蛋白UAE Unexpected Adverse Event 预料外不良事件WHO World Health Organization 世界卫生组织WHO- WHO International Conference WHO 国际药品管理当局会议ICDR A of Drug Regulatory AuthoritiesAberrant result 异常结果Absorption phase 吸收相Absorption 吸收Accuracy 准确度Accurate 精密度Administer 给药Amendment修正案Approval 批准Assess 估计Audit Report 稽查报告Audit 稽查Auditor 稽查员Analytical run/batch:分析批Benefit 获益Bias 偏性,偏倚Bioequivalence 生物等效Biosimilar /Follow-on biologics 生物仿制药Blank Control 空白对照Blind codes 编制盲底Blind review 盲态检查 /盲态审核Blinding method 盲法Blinding/masking 盲法/设盲Block size 每段的长度Block 层 /分段BCS 生物药剂学分类系统Carryover effect 延滞效应Case history 病历Clinical equivalence 临床等效性Clinical study 临床研究Clinical Trial Report 临床试验报告Comparison 对照Compensation 补偿,赔偿金Compliance 依从性Concomitant 伴随的Conduct 行为Confidence level 置信水平Consistency test 一致性检验Contract/ agreement 协议/合同Control group 对照组Coordinating Committee 协调委员会Crossover design 交叉设计Cross-over Study 交叉研究Cure 痊愈Data management 数据管理Descriptive statistical analysis 描述性统计分析Dichotomies 二分类Dispense 分布Diviation 偏差Documentation 记录/文件Dosage forms 剂型Dose dumping 剂量倾卸(药物迅速释放入血而达到危险浓度)Dose-reaction relation 剂量-反应关系Double blinding 双盲Double dummy 双模Drop out 脱落Effectiveness 疗效Elimination phase 消除相Emergency envelope 应急信件Enantiomers 对映体End point 终点Endpoint criteria/ measurement 终点指标Enterohepatic recycling 肠肝循环Essential Documentation 必需文件Ethical 伦理的Ethics committee 伦理委员会Evaluate 评估Exclusion Criteria 排除标准Excretion 排泄Expedite 促进Extrapolated 外推的Essentially similar product:基本相似药物Factorial design 析因设计Failure 无效,失败Finacing 财务,资金Final point 终点First pass metabolism 首过代谢Fixed-dose procedure 固定剂量法Full analysis set 全分析集GC-FTIR 气相色谱-傅利叶红外联用GC-MS 气相色谱-质谱联用Generic drug 通用名药Gene mutation 基因突变Genotoxicity tests 生殖毒性试验Global assessment variable 全局评价变量Group sequential design 成组序贯设计Hypothesis test 假设检验Highly permeable:高渗透性Highly soluble:高溶解度Highly variable drug:高变异性药物Highly:Variable Drug 高变异性药物HVDP:高变异药物制剂Identification 鉴别,身份证Improvement 好转In vitro 体外In vivo 体内Inclusion Criteria 入选表准Information Gathering 信息收集Initial Meeting 启动会议Inspection 检察/视察Institution Inspection 机构检察Instruction 指令,说明Integrity 完整,正直Intercurrent 中间发生的,间发的Inter-individual variability 个体间变异性Interim analysis 期中分析Investigational Product 试验药物Investigator 研究者Involve 引起,包括IR 红外吸收光谱Innovator Product:原创药Ka 吸收速率常LC-MS 液相色谱-质谱联用logarithmic transformation 对数转换Logic check 逻辑检查Lost of follow up 失访Mask 面具,掩饰Matched pair 匹配配对Metabolism 代谢Missing value 缺失值Mixed effect model 混合效应模式Modified release products 改良释放剂型Monitor 监查员Monitoring Plan 监察计划Monitoring Report 监察报告MS-MS 质谱-质谱联用Multi-center Trial 多中心试验Negative 阴性,否定的Non-clinical Study 非临床研究Non-inferiority 非劣效性Non-Linear Pharmacokinetics 非线性药代动力学Non-parametric statistics 非参数统计方法NTID:窄治疗指数制剂Obedience 依从性Open-blinding 非盲Open-label 非盲Original Medical Record 原始医疗记录Outcome Assessment 结果评价Outcome measurement 结果指标Outlier 离群值OIP 经口服吸收药物Parallel group design 平行组设计Parameter estimation 参数估计Parametric statistics 参数统计方法Patient file 病人档案Patient History 病历Per protocol, PP 符合方案集Permeability 渗透性Pharmacodynamic characteristics 药效学特征Pharmacokinetic characteristics 药代学特征Placebo Control 安慰剂对照Placebo 安慰剂Polytomies 多分类Post-dosing postures 给药后坐姿Potential 潜在的Power 检验效能Precision 精密度Preclinical Study 临床前研究Precursor 母体前体Premature 过早的,早发Primary endpoint 主要终点Primary variable 主要变量Prodrug 药物前体Protocol amendment 方案补正Protocol Amendments 修正案Protocol 试验方案Quality Control Sample:质控样品Rapidly dissolving:快速溶出Racemates 外消旋物Randomization 随机 /随机化Range check 范围检Rating scale 量表Recruit 招募,新会员Replication 可重复Retrieval 取回,补修Revise 修正Risk 风险Run in 准备期Safety evaluation 安全性评价Safety set 安全性评价的数据集Sample Size 样本量、样本大小Sampling schedules 采血计划Scale of ordered categorical ratings 有序分类指标Secondary variable 次要变量Sequence 试验次序Seriousness 严重性Severity 严重程度Significant level 检验水准Simple randomization 简单随机Single Blinding 单盲Site audit 试验机构稽查Solubility 溶解度Specificity 特异性Specify 叙述,说明Sponsor-investigator 申办研究者Standard curve 标准曲线Statistical model 统计模型Statistical tables 统计分析表Steady state 稳态Storage 储存Stratified 分层Study Audit 研究稽查Study Site 研究中心Subgroup 亚组Sub-investigator 助理研究者Subject Enrollment Log 受试者入选表Subject Enrollment 受试者入选Subject Identification Code List 受试者识别代码表Subject Recruitment 受试者招募Subject Screening Log 受试者筛选表Subject 受试者Submit 交付,委托Superiority 检验Supplemental 增补的Supra-bioavailability 超生物利用度(试验药的生物利用度大于对照药)Survival analysis 生存分析System Audit 系统稽查SmPC:药品说明书Standard Sample:标准样品Target variable 目标变量Treatment group 试验组Trial error 试验误差Trial Initial Meeting 试验启动会议Trial Master File 试验总档案Trial Objective 试验目的Trial site 试验场所Triple Blinding 三盲Two one-side test 双单侧检验Therapeutic equivalence:治疗等效性Un-blinding 破盲/揭盲Verify 查证、核实Visual analogy scale 直观类比打分法Vulnerable subject 弱势受试者Wash-out Period 洗脱期Well-being 福利,健康Withdraw 撤回,取消药代动力学参数Ae(0-t):给药到t时尿中排泄的累计原形药。
临床试验术语英汉对照
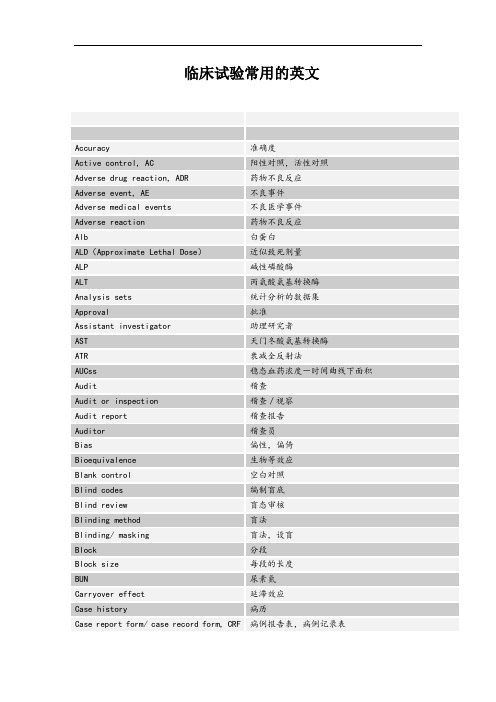
临床试验常用的英文Accuracy准确度Active control, AC阳性对照,活性对照Adverse drug reaction, ADR药物不良反应Adverse event, AE不良事件Adverse medical events不良医学事件Adverse reaction药物不良反应Alb白蛋白ALD(Approximate Lethal Dose)近似致死剂量ALP碱性磷酸酶ALT丙氨酸氨基转换酶Analysis sets统计分析的数据集Approval批准Assistant investigator助理研究者AST天门冬酸氨基转换酶ATR衰减全反射法AUCss稳态血药浓度-时间曲线下面积Audit稽查Audit or inspection稽查/视察Audit report稽查报告Auditor稽查员Bias偏性,偏倚Bioequivalence生物等效应Blank control空白对照Blind codes编制盲底Blind review盲态审核Blinding method盲法Blinding/ masking盲法,设盲Block分段Block size每段的长度BUN尿素氮Carryover effect延滞效应Case history病历Case report form/ case record form, CRF病例报告表,病例记录表Categorical variable分类变量Cav平均浓度CL清除率Clinical equivalence临床等效应Clinical study临床研究Clinical study report临床试验的总结报告Clinical trial临床试验Clinical trial application, CTA临床试验申请Clinical trial exemption, CTX临床试验免责Clinical trial protocol, CTP临床试验方案Clinical trial/ study report临床试验报告C max峰浓度Co-investigator合作研究者Comparison对照Compliance依从性Composite variable复合变量Computer-assisted trial design, CATD计算机辅助试验设计Confidence interval可信区间Confidence level置信水平Consistency test一致性检验Contract research organization, CRO合同研究组织Contract/ agreement协议/合同Control group对照组Coordinating committee协调委员会Crea肌酐CRF(case report form)病例报告表Crossover design交叉设计Cross-over study交叉研究Css稳浓度Cure痊愈Data management数据管理Database建立数据库Descriptive statistical analysis描述性统计分析DF波动系统Dichotomies二分类Diviation偏差Documentation记录/文件Dose-reaction relation剂量-反应关系Double blinding双盲Double dummy双模拟Double dummy technique双盲双模拟技术Double-blinding双盲Drop out脱落Effectiveness疗效Electronic data capture, EDC电子数据采集系统Electronic data processing, EDP电子数据处理系统Emergency envelope应急信件End point终点Endpoint criteria/ measurement终点指标Equivalence等效性Essential documentation必须文件Ethics committee伦理委员会Excellent显效Exclusion criteria排除标准Factorial design析因设计Failure无效,失败Final point终点Fixed-dose procedure固定剂量法Forced titration强制滴定Full analysis set全分析集GC-FTIR气相色谱-傅利叶红外联用GC-MS气相色谱-质谱联用Generic drug通用名药Global assessment variable全局评价变量GLU血糖Good clinical practice, GCP药物临床试验质量管理规范Good manufacture practice, GMP药品生产质量管理规范药物非临床研究质量管理规范Good non-clinical laboratory practice,GLPGroup sequential design成组序贯设计Hypothesis test假设检验International Conference of Harmonization, ICH人用药品注册技术要求国际技术协调会,国际协调会议Improvement好转Inclusion criteria入选标准Independent ethics committee, IEC独立伦理委员会Information consent form, ICF知情同意书Information gathering信息收集Informed consent, IC知情同意Initial meeting启动会议Inspection视察/检查Institution inspection机构检查Institution review board, IBR机构审查委员会Intention to treat意向治疗(-- 临床领域)Intention-to –treat, ITT意向性分析(-统计学)Interim analysis期中分析Investigator研究者Investigator’s brochure, IB研究者手册IR红外吸收光谱Ka吸收速率常Last observation carry forward, LOCF最接近一次观察的结转LC-MS液相色谱-质谱联用LD50半数致死剂量Logic check逻辑检查LOQ (Limit of Quantitation)定量限LOCF, Last observation carry forward最近一次观察的结转Lost of follow up失访Marketing approval/ authorization上市许可证Matched pair匹配配对Missing value缺失值Mixed effect model混合效应模式Monitor监查员Monitoring监查Monitoring report监查报告MRT平均滞留时间MTD(Maximum Tolerated Dose)最大耐受剂量Multi-center trial多中心试验New chemical entity, NCE新化学实体New drug application, NDA新药申请NMR核磁共振谱Non-clinical study非临床研究Non-inferiority非劣效性Non-parametric statistics非参数统计方法Obedience依从性ODR旋光光谱Open-blinding非盲Open-label非盲Optional titration随意滴定Original medical record原始医疗记录Outcome结果Outcome assessment结果指标评价Outcome measurement结果指标Outlier离群值Parallel group design平行组设计Parameter estimation参数估计Parametric statistics参数统计方法Patient file病人档案Patient history病历Per protocol, PP符合方案集Placebo安慰剂Placebo control安慰剂对照Polytomies多分类Power检验效能Precision精密度Preclinical study临床前研究Primary endpoint主要终点Primary variable主要变量Principal investigator主要研究者Principle investigator, PI主要研究者Product license, PL产品许可证Protocol试验方案Protocol amendment方案补正Quality assurance unit, QAU质量保证部门Quality assurance, QA质量保证Quality control, QC质量控制Query list, query form应用疑问表Randomization随机化Range check范围检查Rating scale量表Regulatory authorities, RA监督管理部门Replication可重复RSD日内和日间相对标准差Run in准备期Safety evaluation安全性评价Safety set安全性评价的数据集Sample size样本量,样本大小Scale of ordered categorical ratings有序分类指标Secondary variable次要变量Sequence试验次序Serious adverse event, SAE严重不良事件Serious adverse reaction, SAR严重不良反应Seriousness严重性Severity严重程度Significant level检验水准Simple randomization简单随机Single-blinding单盲Site audit试验机构稽查Source data verification, SDV原始数据核准Source data, SD原始数据Source document, SD原始文件Specificity特异性Sponsor申办者Sponsor-investigator申办研究者Standard curve标准曲线Standard operating procedure, SOP标准操作规程Statistic统计量Statistical analysis plan, SAP统计分析计划Statistical model统计模型Statistical tables统计分析表Stratified分层Study audit研究稽查Subgroup亚组Sub-investigator助理研究者Subject受试者Subject diary受试者日记Subject enrollment受试者入选Subject enrollment log受试者入选表Subject identification code, SIC受试者识别代码Subject recruitment受试者招募Subject screening log受试者筛选表Superiority检验Survival analysis生存分析SXRD单晶X-射线衍射System audit系统稽查T1/2消除半衰期Target variable目标变量T-BIL总胆红素T-CHO总胆固醇TG热重分析TLC、HPLC制备色谱T max峰时间TP总蛋白Transformation变量变换Treatment group试验组Trial error试验误差Trial master file试验总档案Trial objective试验目的Trial site试验场所Triple blinding三盲Two one-side test双单侧检验Unblinding揭盲Unexpected adverse event, UAE预料外不良事件UV-VIS紫外-可见吸收光谱Variability变异Variable变量Visual analogy scale直观类比打分法Visual check人工检查Vulnerable subject弱势受试者Wash-out period洗脱期Well-being福利,健康。
GCP资料-药物临床试验英文词汇及缩写
Contract/ agreement
协议/合同
Control group
对照组
Coordinating committee
协调委员会
Crea
肌酐
CRF(case report form)
病例报告表
Crossover design
交叉设计
Cross-over Study
交叉研究
Css
稳浓度
药物临床试验英文缩写
缩略语
英文全称
中文全称
ADE
Adverse Drug Event
药物不良事件
ADR
Adverse Drug Reaction
药物不良反应
AE
Adverse Event
不良事件
AI
Assistant Investigator
助理研究者
BMI
Body Mass Index
体质指数
CI
Excellent
显效
Exclusion criteria
排除标准
Factorial design
析因设计
Failure
无效 失败
Final point
终点
Fixed-dose procedure
固定剂量法
Forced titration
强制滴定
Full analysis set
全分析集
GC-FTIR
临床试验报告
DSMB
Data Safety and monitoringBoard
数据安全及监控委员会
EDC
Electronic Data Capture
电子数据采集系统
EDP
GCP常用英文名缩写与中文对照表#(精选.)
(National Medical Products Administration)
最新文件仅供参考已改成word文本。方便更改
GCP常用英文名缩写与中文对照表
英文缩写
中文名称
英文缩写
中文名称
ADM
制度
IEC
独立伦理委员会
AE
不良事件
NA
不适用
ADR
药物不良反应
NCS
无临床意义
BE
生物等效性研究
ND
未完成
CFDA
国家食品药品监督管理总局
NK
情况不明
CR
完全缓解
NMPA
国家药品监督管理局
CRA
监查员(CRO委派)
PD
病情进展/方案偏离
CRC
临床研究协调员
PI
主要研究者
CRF
病例报告表/病例记录表
PPS
符合方案分析集
CRO
合同协作组织(委派CRA)
PV
方案违背
CTP
临床试验方案
RCT
随机对照试验
CS
有临床意义
RN
研究护士
DFS
无病生存期
QA
质量保证
EBM
循证医学
QC
质量控制EC伦理委会SAE严重不良事件
eCRF
电子病例报告表
SD
GUP
药品使用质量管理规范
UAE
预料外不良反应
IC
知情同意
Monitor
监查员(申办方委派)
ICF
知情同意书
Sponsor
申办者
ICH
国际(药品注册)协调会议
临床试验缩略语中英文对照

ALB 白蛋白
ALT 丙氨酸氨基转移酶
AST 天门冬氨酸氨基转移酶
ATP 三磷酸腺苷
AUC 血浆药物浓度-时间曲线下面积BP 血压
bid 每日两次
BUN 尿素氮
CK-MB 肌酸激酶
Cr 肌酐
CR 完全缓解
CRF 病例报告表
CL/F 口服给药后血浆中的系统清除率Cmax 峰浓度
DBIL 直接胆红素
dL 分升
DLT 剂量限制毒性
EC 伦理委员会
EGFR 表皮生长因子受体
GCP 临床试验规范
GGT 谷氨酰转移酶
Hb 血红蛋白
HED 人体等效剂量
HR 心率
IB 研究者手册
IBIL 间接胆红素
INR 国际标准化值
ITT 治疗意图
IU 国际单位
LVEF 左心室射血分数
MTD 最大耐受药物剂量
NCI-CTC 国立癌症研究所通用毒性标准NSCLC 非小细胞肺癌
NOAEL 未见毒性反应的剂量
ORR 客观有效率
PFS 无进展生存期
PR 部分缓解
PK 药代动力学
qd 每日一次
SAE 严重不良事件
SAP 统计分析计划
TBIL 总胆红素
TP 总蛋白
TSH 促甲状腺激素
TKIs 酪氨酸激酶抑制剂Tmax 达峰时间
T1/2 血浆消除半衰期UNL 正常值上限WBC 白细胞计数。
临床试验常用术语缩写

专业术语缩略语英文全称中文全称ADE Adverse Drug Event 药物不良事件 ADR Adverse Drug Reaction 药物不良反应AE Adverse Event 不良事件 AI Assistant Investigator 助理研究者BMI Body Mass Index 体质指数 CI Co-investigator 合作研究者COI Coordinating Investigator 协调研究者CRA Clinical Research Associate临床监查员(临床监察员)CRC Clinical Research Coordinator 临床研究协调者 CRF Case Report Form 病历报告表CRO Contract Research Organization 合同研究组织 ECRF 电子化病历报告表CSA Clinical Study Application 临床研究申请 CTA Clinical Trial Application 临床试验申请CTX Clinical Trial Exemption 临床试验免责 CTP Clinical Trial Protocol 临床试验方案CTR Clinical Trial Report 临床试验报告DSMB Data Safety and monitoring Board 数据安全及监控委员会EDC Electronic Data Capture 电子数据采集系统EDP Electronic Data Processing 电子数据处理系统FDA Food and Drug Administration 美国食品与药品管理局 FR Final Report 总结报告GCP Good Clinical Practice 药物临床试验质量管理规范GLP Good Laboratory Practice 药物非临床试验质量管理规GMP Good Manufacturing Practice 药品生产质量管理规范IB Investigator’s Brochure研究者手册 IC Informed Consent 知情同意ICF Informed Consent Form 知情同意书 ECG Electrocardiogram心电图ICH International Conference on Harmonization 国际协调会IDM Independent Data Monitoring 独立数据监察IDMC Independent Data Monitoring Committee 独立数据监察委员会IEC Independent Ethics Committee 独立伦理委员会IND Investigational New Drug 新药临床研究 IRB Institutional Review Board 机构审查委员会IVD In Vitro Diagnostic 体外诊断 MA Marketing Approval/Authorization 上市许可证IVRS Interactive Voice Response System 互动语音应答系统MCA Medicines Control Agency 英国药品监督局MHW Ministry of Health and Welfare 日本卫生福利部 NDA New Drug Application 新药申请NEC New Drug Entity 新化学实体 NIH National Institutes of Health 国家卫生研究所(美国)PI Principal Investigator 主要研究者 PL Product License 产品许可证PMA Pre-market Approval (Application) 上市前许可(申请)PSI Statisticians in the Pharmaceutical Industry 制药业统计学家协会QA Quality Assurance 质量保证 QC Quality Control 质量控制RA Regulatory Authorities 监督管理部门 SA Site Assessment 现场评估SAE Serious Adverse Event 严重不良事件 SAP Statistical Analysis Plan 统计分析计划SAR Serious Adverse Reaction 严重不良反应 SD Source Data/Document 原始数据 /文件SD Subject Diary 受试者日记 Subject identification code (SIC)受试者识别代码SFDA State Food and Drug Administration 国家食品药品监督管理局SDV Source Data Verification 原始数据核准 SEL Subject Enrollment Log 受试者入选表SI Sub-investigator 助理研究者 SI Sponsor-Investigator 申办研究者SIC Subject Identification Code 受试者识别代码 pd pharmacodynamics药物效应动力学SOP Standard Operating Procedure 标准操作规程 pk pharmacokinetics药物代谢动力学SPL Study Personnel List 研究人员名单 SSL Subject Screening Log 受试者筛选表T&R Test and Reference Product 受试和参比试剂UAE Unexpected Adverse Event 预料外不良事件WHO World Health Organization 世界卫生组织 Active Control 阳性对照、活性对照WHO-ICDRA WHO International Conference of Drug Regulatory Authorities WHO国际药品管理当局会议 Unexpected adverse event (UAE)预料外不良事件Audit 稽查 Audit Report 稽查报告 Auditor 稽查员 Blank Control 空白对照Blinding/masking 盲法 /设盲 Case History 病历 Clinical study 临床研究Clinical Trial 临床试验Clinical Trial Report 临床试验报告Compliance 依从性Coordinating Committee 协调委员会 Cross-over Study 交叉研究 Double Blinding 双盲Endpoint Criteria/measurement 终点指标 Essential Documentation 必需文件Exclusion Criteria 排除标准Inclusion Criteria 入选表准Information Gathering 信息收集Initial Meeting 启动会议 Inspection 检察 /视察 Institution Inspection 机构检察Investigational Product 试验药物 Investigator 研究者 Monitor 监查员(监察员)Monitoring 监查(监察) Monitoring Plan 监查计划(监察计划)Monitoring Report 监查报告(监察报告) Multi-center Trial 多中心试验Non-clinical Study 非临床研究 Original Medical Record 原始医疗记录Outcome Assessment 结果评价 Patient File 病人档案 Patient History 病历Placebo 安慰剂 Placebo Control 安慰剂对照 Preclinical Study 临床前研究Protocol 试验方案 Protocol Amendments 修正案 Randomization 随机Reference Product 参比制剂 Sample Size 样本量、样本大小 Seriousness 严重性Severity 严重程度 Single Blinding 单盲 Sponsor 申办者Study Audit 研究稽查 Subject 受试者 Subject Enrollment 受试者入选Subject Enrollment Log 受试者入选表 Subject Identification Code List 受试者识别代码表 Subject Recruitment 受试者招募 Subject Screening Log 受试者筛选表System Audit 系统稽查 Study Site 研究中心 Test Product 受试制剂Trial Initial Meeting 试验启动会议 Trial Master File 试验总档案 Wash-out 洗脱Trial Objective 试验目的 Triple Blinding 三盲 Wash-out Period 洗脱期Alb白蛋白 ALD(Approximate Lethal Dose)近似致死剂量 ALP碱性磷酸酶Alpha spending function消耗函数 ALT丙氨酸氨基转换酶 Approval批准Analysis sets统计分析的数据集 Approval批准 ATR衰减全反射法Assistant investigator助理研究者 AST天门冬酸氨基转换酶AUCss稳态血药浓度-时间曲线下面积 Standard operating procedure (SOP)标准操作规程Case report form/ case record form(CRF)病例报告表病例记录表Clinical trial application (CTA)临床试验申请 Clinical trial exemption (CTX)临床试验免责Clinical trial protocol (CTP)临床试验方案 Contract research organization (CRO)合同研究组织Computer-assisted trial design (CATD)计算机辅助试验设计 Source data (SD)原始数据Electronic data capture (EDC)电子数据采集系统 Source data verification (SDV)原始数据核准Electronic data processing (EDP)电子数据处理系统 Subject enrollment log受试者入选表Institution review board (IBR)机构审查委员会 Intention-to –treat (ITT)意向性分析(-统计学)Interactive voice response system (IVRS)互动式语音应答系统Investigator’s brochure (IB)研究者手册 Maximum Tolerated Dose (MTD)最大耐受剂量Principle investigator (PI)主要研究者 Product license (PL)产品许可证Serious adverse event (SAE)严重不良事件 Serious adverse reaction (SAR)严重不良反应。
临床试验常用的英文缩写

专业术语缩略语英文全称中文全称DCF data clarification form 数据澄清表,用于纸质querySDV source data verification 原始数据核对ADE Adverse Drug Event 药物不良事件ADR Adverse Drug Reaction 药物不良反应AE Adverse Event 不良事件AI Assistant Investigator 助理研究者BMI Body Mass Index 体质指数CI Co-investigator 合作研究者COI Coordinating Investigator 协调研究者CRA Clinical Research Associate 临床监查员(临床监察员)CRC Clinical Research Coordinator 临床研究协调者CRF Case Report Form 病历报告表CRO Contract Research Organization 合同研究组织CSA Clinical Study Application 临床研究申请CTA Clinical Trial Application 临床试验申请CTX Clinical Trial Exemption 临床试验免责CTP Clinical Trial Protocol 临床试验方案CTR Clinical Trial Report 临床试验报告DSMB Data Safety and monitoring Board 数据安全及监控委员会EDC Electronic Data Capture 电子数据采集系统EDP Electronic Data Processing 电子数据处理系统FDA Food and Drug Administration 美国食品与药品管理局FR Final Report 总结报告GCP Good Clinical Practice 药物临床试验质量管理规范GLP Good Laboratory Practice 药物非临床试验质量管理规范GMP Good Manufacturing Practice 药品生产质量管理规范IB Investigator’s Brochure研究者手册IC Informed Consent 知情同意ICF Informed Consent Form 知情同意书ICH International Conference on Harmonization 国际协调会议IDM Independent Data Monitoring 独立数据监察IDMC Independent Data Monitoring Committee 独立数据监察委员会IEC Independent Ethics Committee 独立伦理委员会IND Investigational New Drug 新药临床研究IRB Institutional Review Board 机构审查委员会IVD In Vitro Diagnostic 体外诊断IVRS Interactive Voice Response System 互动语音应答系统MA Marketing Approval/Authorization 上市许可证MCA Medicines Control Agency 英国药品监督局MHW Ministry of Health and Welfare 日本卫生福利部NDA New Drug Application 新药申请NEC New Drug Entity 新化学实体NIH National Institutes of Health 国家卫生研究所(美国)PI Principal Investigator 主要研究者PL Product License 产品许可证PMA Pre-market Approval (Application) 上市前许可(申请)PSI Statisticians in the Pharmaceutical Industry 制药业统计学家协会QA Quality Assurance 质量保证QC Quality Control 质量控制RA Regulatory Authorities 监督管理部门SA Site Assessment 现场评估SAE Serious Adverse Event 严重不良事件SAP Statistical Analysis Plan 统计分析计划SAR Serious Adverse Reaction 严重不良反应SD Source Data/Document 原始数据/文件SD Subject Diary 受试者日记SFDA State Food and Drug Administration 国家食品药品监督管理局SDV Source Data Verification 原始数据核准SEL Subject Enrollment Log 受试者入选表SI Sub-investigator 助理研究者SI Sponsor-Investigator 申办研究者SIC Subject Identification Code 受试者识别代码SOP Standard Operating Procedure 标准操作规程SPL Study Personnel List 研究人员名单SSL Subject Screening Log 受试者筛选表T&R Test and Reference Product 受试和参比试剂UAE Unexpected Adverse Event 预料外不良事件WHO World Health Organization 世界卫生组织WHO-ICDRA WHO International Conference of Drug Regulatory Authorities WHO国际药品管理当局会议Active Control 阳性对照、活性对照Audit 稽查Audit Report 稽查报告Auditor 稽查员Blank Control 空白对照Blinding/masking 盲法/设盲Case History 病历Clinical study 临床研究Clinical Trial 临床试验Clinical Trial Report 临床试验报告Compliance 依从性Coordinating Committee 协调委员会Cross-over Study 交叉研究Double Blinding 双盲Endpoint Criteria/measurement 终点指标Essential Documentation 必需文件Exclusion Criteria 排除标准Inclusion Criteria 入选表准Information Gathering 信息收集Initial Meeting 启动会议Inspection 检察/视察Institution Inspection 机构检察Investigational Product 试验药物Investigator 研究者Monitor 监查员(监察员)Monitoring 监查(监察)Monitoring Plan 监查计划(监察计划) Monitoring Report 监查报告(监察报告) Multi-center Trial 多中心试验Non-clinical Study 非临床研究Original Medical Record 原始医疗记录Outcome Assessment 结果评价Patient File 病人档案Patient History 病历Placebo 安慰剂Placebo Control 安慰剂对照Preclinical Study 临床前研究Protocol 试验方案Protocol Amendments 修正案Randomization 随机Reference Product 参比制剂Sample Size 样本量、样本大小 Seriousness 严重性Severity 严重程度Single Blinding 单盲Sponsor 申办者Study Audit 研究稽查Subject 受试者Subject Enrollment 受试者入选Subject Enrollment Log 受试者入选表Subject Identification Code List 受试者识别代码表 Subject Recruitment 受试者招募Study Site 研究中心Subject Screening Log 受试者筛选表System Audit 系统稽查Test Product 受试制剂Trial Initial Meeting 试验启动会议Trial Master File 试验总档案Trial Objective 试验目的Triple Blinding 三盲Wash-out 洗脱Wash-out Period 洗脱期。
临床试验常用英文缩写及注释参考

临床试验常用英文缩写及注释参考1. IRB:Institutional Review Board,研究机构审评委员会。
负责审核和批准医学研究,确保受试者的权益得到保障。
2. CRA:Clinical Research Associate,临床研究助理。
负责临床试验的执行和监督,协助研究者完成各项任务。
3. SAE:Serious Adverse Event,严重不良事件。
临床试验期间发生的任何导致死亡、危及生命、重要器官功能或功能衰竭等严重后果的事件。
4. SPC:Summary Safety Profile,汇总安全性摘要。
临床试验结束后,对试验期间发生的不良事件进行汇总和分析,以评估试验的安全性。
5. ECG:Electrocardiogram,心电图。
用于监测心血管系统状况,评估药物对心脏的影响。
6. TDM:Therapeutic Drug Monitoring,治疗药物监测。
用于评估药物在患者体内的浓度,以指导临床用药。
7. IRN:Interim Analysis,中期分析。
在临床试验中期对数据进行分析,评估试验的效果和可行性。
8. RCT:Randomized Controlled Trial,随机对照试验。
一种常见的临床试验设计方法,将受试者随机分为试验组和对照组,比较试验药物和安慰剂或常规治疗的效果。
9. MTD:Maximum Tolerated Dose,最大耐受剂量。
在临床试验中,找到能够使大多数受试者耐受的最大药物剂量。
10. DLT:Dose-Limiting Toxicity,剂量限制毒性。
在临床试验中,观察到任何可能导致严重不适或威胁生命的副作用,被认为是继续增加剂量的限制条件。
11. PP population:入选患者群体。
在临床试验中,指符合入选标准并完成试验的患者群体。
12. OMP:Observational Medical Outcomes Project,观察性医学项目。
临床试验常用的英文缩写

专业术语缩略语英文全称中文全称DCF data clarification form 数据澄清表,用于纸质query SDV source data verification 原始数据核对ADE Adverse Drug Event 药物不良事件ADR Adverse Drug Reaction 药物不良反应AE Adverse Event 不良事件AI Assistant Investigator 助理研究者BMI Body Mass Index 体质指数CI Co-investigator 合作研究者COI Coordinating Investigator 协调研究者CRA Clinical Research Associate 临床监查员(临床监察员)CRC Clinical Research Coordinator 临床研究协调者CRF Case Report Form 病历报告表CRO Contract Research Organization 合同研究组织CSA Clinical Study Application 临床研究申请CTA Clinical Trial Application 临床试验申请CTX Clinical Trial Exemption 临床试验免责CTP Clinical Trial Protocol 临床试验方案CTR Clinical Trial Report 临床试验报告DSMB Data Safety and monitoring Board 数据安全及监控委员会EDC Electronic Data Capture 电子数据采集系统EDP Electronic Data Processing 电子数据处理系统FDA Food and Drug Administration 美国食品与药品管理局FR Final Report 总结报告GCP Good Clinical Practice 药物临床试验质量管理规范GLP Good Laboratory Practice 药物非临床试验质量管理规范GMP Good Manufacturing Practice 药品生产质量管理规范IB Investigator’s Brochure研究者手册IC Informed Consent 知情同意ICF Informed Consent Form 知情同意书ICH International Conference on Harmonization 国际协调会议IDM Independent Data Monitoring 独立数据监察IDMC Independent Data Monitoring Committee 独立数据监察委员会IEC Independent Ethics Committee 独立伦理委员会IND Investigational New Drug 新药临床研究IRB Institutional Review Board 机构审查委员会IVD In Vitro Diagnostic 体外诊断IVRS Interactive Voice Response System 互动语音应答系统MA Marketing Approval/Authorization 上市许可证MCA Medicines Control Agency 英国药品监督局MHW Ministry of Health and Welfare 日本卫生福利部NDA New Drug Application 新药申请NEC New Drug Entity 新化学实体NIH National Institutes of Health 国家卫生研究所(美国)PI Principal Investigator 主要研究者PL Product License 产品许可证PMA Pre-market Approval (Application) 上市前许可(申请)PSI Statisticians in the Pharmaceutical Industry 制药业统计学家协会QA Quality Assurance 质量保证QC Quality Control 质量控制RA Regulatory Authorities 监督管理部门SA Site Assessment 现场评估SAE Serious Adverse Event 严重不良事件SAP Statistical Analysis Plan 统计分析计划SAR Serious Adverse Reaction 严重不良反应SD Source Data/Document 原始数据/文件SD Subject Diary 受试者日记SFDA State Food and Drug Administration 国家食品药品监督管理局SDV Source Data Verification 原始数据核准SEL Subject Enrollment Log 受试者入选表SI Sub-investigator 助理研究者SI Sponsor-Investigator 申办研究者SIC Subject Identification Code 受试者识别代码SOP Standard Operating Procedure 标准操作规程SPL Study Personnel List 研究人员名单SSL Subject Screening Log 受试者筛选表T&R Test and Reference Product 受试和参比试剂UAE Unexpected Adverse Event 预料外不良事件WHO World Health Organization 世界卫生组织WHO-ICDRA WHO International Conference of Drug Regulatory Authorities WHO国际药品管理当局会议Active Control 阳性对照、活性对照Audit 稽查Audit Report 稽查报告Auditor 稽查员Blank Control 空白对照Blinding/masking 盲法/设盲Case History 病历Clinical study 临床研究Clinical Trial 临床试验Clinical Trial Report 临床试验报告Compliance 依从性Coordinating Committee 协调委员会Cross-over Study 交叉研究Double Blinding 双盲Endpoint Criteria/measurement 终点指标Essential Documentation 必需文件Exclusion Criteria 排除标准Inclusion Criteria 入选表准Information Gathering 信息收集Initial Meeting 启动会议Inspection 检察/视察Institution Inspection 机构检察Investigational Product 试验药物Investigator 研究者Monitor 监查员(监察员)Monitoring 监查(监察)Monitoring Plan 监查计划(监察计划) Monitoring Report 监查报告(监察报告) Multi-center Trial 多中心试验Non-clinical Study 非临床研究Original Medical Record 原始医疗记录Outcome Assessment 结果评价Patient File 病人档案Patient History 病历Placebo 安慰剂Placebo Control 安慰剂对照Preclinical Study 临床前研究Protocol 试验方案Protocol Amendments 修正案Randomization 随机Reference Product 参比制剂Sample Size 样本量、样本大小Seriousness 严重性Severity 严重程度Single Blinding 单盲Sponsor 申办者Study Audit 研究稽查Subject 受试者Subject Enrollment 受试者入选Subject Enrollment Log 受试者入选表Subject Identification Code List 受试者识别代码表 Subject Recruitment 受试者招募Study Site 研究中心Subject Screening Log 受试者筛选表System Audit 系统稽查Test Product 受试制剂Trial Initial Meeting 试验启动会议Trial Master File 试验总档案Trial Objective 试验目的Triple Blinding 三盲Wash-out 洗脱Wash-out Period 洗脱期。
临床试验常用的英文缩写【范本模板】

专业术语缩略语英文全称中文全称DCF data clarification form 数据澄清表,用于纸质query SDV source data verification 原始数据核对ADE Adverse Drug Event 药物不良事件ADR Adverse Drug Reaction 药物不良反应AE Adverse Event 不良事件AI Assistant Investigator 助理研究者BMI Body Mass Index 体质指数CI Co—investigator 合作研究者COI Coordinating Investigator 协调研究者CRA Clinical Research Associate 临床监查员(临床监察员)CRC Clinical Research Coordinator 临床研究协调者CRF Case Report Form 病历报告表CRO Contract Research Organization 合同研究组织CSA Clinical Study Application 临床研究申请CTA Clinical Trial Application 临床试验申请CTX Clinical Trial Exemption 临床试验免责CTP Clinical Trial Protocol 临床试验方案CTR Clinical Trial Report 临床试验报告DSMB Data Safety and monitoring Board 数据安全及监控委员会EDC Electronic Data Capture 电子数据采集系统EDP Electronic Data Processing 电子数据处理系统FDA Food and Drug Administration 美国食品与药品管理局FR Final Report 总结报告GCP Good Clinical Practice 药物临床试验质量管理规范GLP Good Laboratory Practice 药物非临床试验质量管理规范GMP Good Manufacturing Practice 药品生产质量管理规范IB Investigator's Brochure 研究者手册IC Informed Consent 知情同意ICF Informed Consent Form 知情同意书ICH International Conference on Harmonization 国际协调会议IDM Independent Data Monitoring 独立数据监察IDMC Independent Data Monitoring Committee 独立数据监察委员会IEC Independent Ethics Committee 独立伦理委员会IND Investigational New Drug 新药临床研究IRB Institutional Review Board 机构审查委员会IVD In Vitro Diagnostic 体外诊断IVRS Interactive Voice Response System 互动语音应答系统MA Marketing Approval/Authorization 上市许可证MCA Medicines Control Agency 英国药品监督局MHW Ministry of Health and Welfare 日本卫生福利部NDA New Drug Application 新药申请NEC New Drug Entity 新化学实体NIH National Institutes of Health 国家卫生研究所(美国)PI Principal Investigator 主要研究者PL Product License 产品许可证PMA Pre-market Approval (Application) 上市前许可(申请)PSI Statisticians in the Pharmaceutical Industry 制药业统计学家协会QA Quality Assurance 质量保证QC Quality Control 质量控制RA Regulatory Authorities 监督管理部门SA Site Assessment 现场评估SAE Serious Adverse Event 严重不良事件SAP Statistical Analysis Plan 统计分析计划SAR Serious Adverse Reaction 严重不良反应SD Source Data/Document 原始数据/文件SD Subject Diary 受试者日记SFDA State Food and Drug Administration 国家食品药品监督管理局SDV Source Data Verification 原始数据核准SEL Subject Enrollment Log 受试者入选表SI Sub-investigator 助理研究者SI Sponsor-Investigator 申办研究者SIC Subject Identification Code 受试者识别代码SOP Standard Operating Procedure 标准操作规程SPL Study Personnel List 研究人员名单SSL Subject Screening Log 受试者筛选表T&R Test and Reference Product 受试和参比试剂UAE Unexpected Adverse Event 预料外不良事件WHO World Health Organization 世界卫生组织WHO—ICDRA WHO International Conference of Drug Regulatory Authorities WHO国际药品管理当局会议Active Control 阳性对照、活性对照Audit 稽查Audit Report 稽查报告Auditor 稽查员Blank Control 空白对照Blinding/masking 盲法/设盲Case History 病历Clinical study 临床研究Clinical Trial 临床试验Clinical Trial Report 临床试验报告Compliance 依从性Coordinating Committee 协调委员会Cross—over Study 交叉研究Double Blinding 双盲Endpoint Criteria/measurement 终点指标Essential Documentation 必需文件Exclusion Criteria 排除标准Inclusion Criteria 入选表准Information Gathering 信息收集Initial Meeting 启动会议Inspection 检察/视察Institution Inspection 机构检察Investigational Product 试验药物Investigator 研究者Monitor 监查员(监察员)Monitoring 监查(监察)Monitoring Plan 监查计划(监察计划)Monitoring Report 监查报告(监察报告)Multi-center Trial 多中心试验Non—clinical Study 非临床研究Original Medical Record 原始医疗记录Outcome Assessment 结果评价Patient File 病人档案Patient History 病历Placebo 安慰剂Placebo Control 安慰剂对照Preclinical Study 临床前研究Protocol 试验方案Protocol Amendments 修正案Randomization 随机Reference Product 参比制剂Sample Size 样本量、样本大小 Seriousness 严重性Severity 严重程度Single Blinding 单盲Sponsor 申办者Study Audit 研究稽查Subject 受试者Subject Enrollment 受试者入选Subject Enrollment Log 受试者入选表Subject Identification Code List 受试者识别代码表 Subject Recruitment 受试者招募Study Site 研究中心Subject Screening Log 受试者筛选表System Audit 系统稽查Test Product 受试制剂Trial Initial Meeting 试验启动会议Trial Master File 试验总档案Trial Objective 试验目的Triple Blinding 三盲Wash-out 洗脱Wash-out Period 洗脱期。
GCP资料-药物临床试验英文词汇及缩写

双模拟
Double dummy technique
双盲双模拟技术
Drop out
脱落
DSC
差示扫描热量计
Effectiveness
疗效
Electronic data capture EDC
电子数据采集系统
Electronic data processing EDP
电子数据处理系统
病例报告表病例记录表
Categorical variable
分类变量
Cav
平均浓度
CD
圆二色谱
CL
清除率
Clinical equivalence
临床等效应
Clinical study
临床研究
Clinical study report
临床试验的总结报告
Clinical trial
临床试验
Clinical trial application CTA
独立数据监察委员会
IEC
Independent Ethics Committee
独立伦理委员会
IND
Investigational New Drug
新药临床研究
IRB
Institutional Review Board
机构审查委员会
IVD
In Vitro Diagnostic
体外诊断
IVRS
Interactive Voice Response System
CSA
Clinical Study Application
临床研究申请
CTA
Clinical Trial Application
临床试验申请
GCP常用英文名缩写与中文对照表

(National Medical Products Administration)
病情稳定/原始数据/受试者日记
EDC
电子化数据采集系统
Sub-I
助理研究者
FAS
全分析集
SMO
现场管理组织(委派CRC)
GCP
药物临床试验质量管理规范
SOP
标准操作规程
GLP
药品实验室管理规范
SS
安全性分析集
GMP
药品生产质量管理规范
TTP
疾病进展时间
GSP
药品经营质量管理规范
UADR
非预期药物不良反应
GCP常用英文名缩写与中文对照表
英文缩写
中文名称
英文缩写
中文名称
ADM
制度
IEC
独立伦理委员会
AE
不良事件
NA
不适用
ADR
药物不良反应
NCS
无临床意义
BE
生物等效性研究
ND
未完成
CFDA
国家食品药品监督管理总局
NK
情况不明
CR
完全缓解
NMPA
国家药品监督管理局
CRA
监查员(CRO委派)
PD
病情进展/方案偏离
CRC
临床研究协调员
PI
主要研究者
CRF
病例报告表/病例记录表
PPS
符合方案分析集
CRO
合同协作组织(委派CRA)
PV
方案违背
CTP
临床试验方案
RCT
随机对照试验
CS
有临床意义
RN
研究护士
临床试验常用术语缩写【范本模板】

专业术语缩略语英文全称中文全称ADE Adverse Drug Event 药物不良事件ADR Adverse Drug Reaction 药物不良反应AE Adverse Event 不良事件AI Assistant Investigator 助理研究者BMI Body Mass Index 体质指数CI Co-investigator 合作研究者COI Coordinating Investigator 协调研究者CRA Clinical Research Associate临床监查员(临床监察员)CRC Clinical Research Coordinator 临床研究协调者CRF Case Report Form 病历报告表CRO Contract Research Organization 合同研究组织ECRF 电子化病历报告表CSA Clinical Study Application 临床研究申请CTA Clinical Trial Application 临床试验申请CTX Clinical Trial Exemption 临床试验免责CTP Clinical Trial Protocol 临床试验方案CTR Clinical Trial Report 临床试验报告DSMB Data Safety and monitoring Board 数据安全及监控委员会EDC Electronic Data Capture 电子数据采集系统EDP Electronic Data Processing 电子数据处理系统FDA Food and Drug Administration 美国食品与药品管理局FR Final Report 总结报告GCP Good Clinical Practice 药物临床试验质量管理规范GLP Good Laboratory Practice 药物非临床试验质量管理规GMP Good Manufacturing Practice 药品生产质量管理规范IB Investigator's Brochure研究者手册IC Informed Consent 知情同意ICF Informed Consent Form 知情同意书ECG Electrocardiogram心电图ICH International Conference on Harmonization 国际协调会IDM Independent Data Monitoring 独立数据监察IDMC Independent Data Monitoring Committee 独立数据监察委员会IEC Independent Ethics Committee 独立伦理委员会IND Investigational New Drug 新药临床研究IRB Institutional Review Board 机构审查委员会IVD In Vitro Diagnostic 体外诊断MA Marketing Approval/Authorization 上市许可证IVRS Interactive Voice Response System 互动语音应答系统MCA Medicines Control Agency 英国药品监督局MHW Ministry of Health and Welfare 日本卫生福利部NDA New Drug Application 新药申请NEC New Drug Entity 新化学实体NIH National Institutes of Health 国家卫生研究所(美国) PI Principal Investigator 主要研究者PL Product License 产品许可证PMA Pre—market Approval (Application) 上市前许可(申请)PSI Statisticians in the Pharmaceutical Industry 制药业统计学家协会QA Quality Assurance 质量保证QC Quality Control 质量控制RA Regulatory Authorities 监督管理部门SA Site Assessment 现场评估SAE Serious Adverse Event 严重不良事件SAP Statistical Analysis Plan 统计分析计划SAR Serious Adverse Reaction 严重不良反应SD Source Data/Document 原始数据/文件SD Subject Diary 受试者日记Subject identification code (SIC)受试者识别代码SFDA State Food and Drug Administration 国家食品药品监督管理局SDV Source Data Verification 原始数据核准SEL Subject Enrollment Log 受试者入选表SI Sub-investigator 助理研究者SI Sponsor—Investigator 申办研究者SIC Subject Identification Code 受试者识别代码pd pharmacodynamics药物效应动力学SOP Standard Operating Procedure 标准操作规程pk pharmacokinetics药物代谢动力学SPL Study Personnel List 研究人员名单SSL Subject Screening Log 受试者筛选表T&R Test and Reference Product 受试和参比试剂UAE Unexpected Adverse Event 预料外不良事件WHO World Health Organization 世界卫生组织Active Control 阳性对照、活性对照WHO—ICDRA WHO International Conference of Drug Regulatory Authorities WHO国际药品管理当局会议Unexpected adverse event (UAE)预料外不良事件Audit 稽查Audit Report 稽查报告Auditor 稽查员Blank Control 空白对照Blinding/masking 盲法/设盲Case History 病历Clinical study 临床研究Clinical Trial 临床试验Clinical Trial Report 临床试验报告Compliance 依从性Coordinating Committee 协调委员会Cross-over Study 交叉研究Double Blinding 双盲Endpoint Criteria/measurement 终点指标Essential Documentation 必需文件Exclusion Criteria 排除标准Inclusion Criteria 入选表准Information Gathering 信息收集Initial Meeting 启动会议Inspection 检察/视察Institution Inspection 机构检察Investigational Product 试验药物Investigator 研究者Monitor 监查员(监察员) Monitoring 监查(监察) Monitoring Plan 监查计划(监察计划)Monitoring Report 监查报告(监察报告) Multi—center Trial 多中心试验Non—clinical Study 非临床研究Original Medical Record 原始医疗记录Outcome Assessment 结果评价Patient File 病人档案Patient History 病历Placebo 安慰剂Placebo Control 安慰剂对照Preclinical Study 临床前研究Protocol 试验方案Protocol Amendments 修正案Randomization 随机Reference Product 参比制剂Sample Size 样本量、样本大小Seriousness 严重性Severity 严重程度Single Blinding 单盲Sponsor 申办者Study Audit 研究稽查Subject 受试者Subject Enrollment 受试者入选Subject Enrollment Log 受试者入选表Subject Identification Code List 受试者识别代码表Subject Recruitment 受试者招募Subject Screening Log 受试者筛选表System Audit 系统稽查Study Site 研究中心Test Product 受试制剂Trial Initial Meeting 试验启动会议Trial Master File 试验总档案Wash-out 洗脱Trial Objective 试验目的Triple Blinding 三盲Wash-out Period 洗脱期Alb白蛋白ALD(Approximate Lethal Dose)近似致死剂量ALP碱性磷酸酶Alpha spending function消耗函数ALT丙氨酸氨基转换酶Approval批准Analysis sets统计分析的数据集Approval批准ATR衰减全反射法Assistant investigator助理研究者AST天门冬酸氨基转换酶AUCss稳态血药浓度-时间曲线下面积Standard operating procedure (SOP)标准操作规程Case report form/ case record form(CRF)病例报告表病例记录表Clinical trial application (CTA)临床试验申请Clinical trial exemption (CTX)临床试验免责Clinical trial protocol (CTP)临床试验方案Contract research organization (CRO)合同研究组织Computer—assisted trial design (CATD)计算机辅助试验设计Source data (SD)原始数据Electronic data capture (EDC)电子数据采集系统Source data verification (SDV)原始数据核准Electronic data processing (EDP)电子数据处理系统Subject enrollment log受试者入选表Institution review board (IBR)机构审查委员会Intention-to –treat (ITT)意向性分析(-统计学)Interactive voice response system (IVRS)互动式语音应答系统Investigator’s brochure (IB)研究者手册Maximum Tolerated Dose (MTD)最大耐受剂量Principle investigator (PI)主要研究者Product license (PL)产品许可证Serious adverse event (SAE)严重不良事件Serious adverse reaction (SAR)严重不良反应。
GCP常见英文缩写

GCP常见英文缩写GCP常见英文缩写缩略语英文全称中文全称ADE Adverse Drug Event 药物不良事件ADR Adverse Drug Reaction 药物不良反应AE Adverse Event 不良事件AI Assistant Investigator 助理研究者BMI Body Mass Index 体质指数CI Co-investigator 合作研究者COI Coordinating Investigator 协调研究者CRA Clinical Research Associate 临床监查员(临床监察员)CRC Clinical Research Coordinator 临床研究协调者CRF Case Report Form 病历报告表CRO Contract Research Organization 合同研究组织CSA Clinical Study Application 临床研究申请CSA Clinical Study Agreement 临床研究协议CTA Clinical Trial Application 临床试验申请CTX Clinical Trial Exemption 临床试验免责CTP Clinical Trial Protocol 临床试验方案CTR Clinical Trial Report 临床试验报告DSMB Data Safety and monitoring Board 数据安全及监控委员会EDC Electronic Data Capture 电子数据采集系统EDP Electronic Data Processing 电子数据处理系统FA Financial Agreement 财务协议FDA Food and Drug Administration 美国食品与药品管理局FR Final Report 总结报告GCP Good Clinical Practice 药物临床试验质量管理规范GLP Good Laboratory Practice 药物非临床试验质量管理规范GMP Good Manufacturing Practice 药品生产质量管理规范IB Investigator’s Brochure研究者手册IC Informed Consent 知情同意ICF Informed Consent Form 知情同意书ICH International Conference on Harmonization 国际协调会议IDM Independent Data Monitoring 独立数据监察IDMC Independent Data Monitoring Committee 独立数据监察委员会IEC Independent Ethics Committee 独立伦理委员会IND Investigational New Drug 新药临床研究IRB Institutional Review Board 机构审查委员会IVD In Vitro Diagnostic 体外诊断IVRS Interactive Voice Response System 互动语音应答系统MA Marketing Approval/Authorization 上市许可证MCA Medicines Control Agency 英国药品监督局MHW Ministry of Health and Welfare 日本卫生福利部NK Not know CRF中药用剂量或时间不明ND Not detected CRF中未查或漏查NDA New Drug Application 新药申请NEC New Drug Entity 新化学实体NIH National Institutes of Health 国家卫生研究所(美国)PI Principal Investigator 主要研究者PL Product License 产品许可证PMA Pre-market Approval (Application) 上市前许可(申请)PSI Statisticians in the Pharmaceutical Industry 制药业统计学家协会QA Quality Assurance 质量保证QC Quality Control 质量控制RA Regulatory Authorities 监督管理部门SA Site Assessment 现场评估SAE Serious Adverse Event 严重不良事件SAP Statistical Analysis Plan 统计分析计划SAR Serious Adverse Reaction 严重不良反应SD Source Data/Document 原始数据/文件SD Subject Diary 受试者日记SFDA State Food and Drug Administration 国家食品药品监督管理局SDV Source Data Verification 原始数据核准SEL Subject Enrollment Log 受试者入选表SI Sub-investigator 助理研究者SI Sponsor-Investigator 申办研究者SIC Subject Identification Code 受试者识别代码SOP Standard Operating Procedure 标准操作规程SPL Study Personnel List 研究人员名单SSL Subject Screening Log 受试者筛选表T&R Test and Reference Product 受试和参比试剂UAE Unexpected Adverse Event 预料外不良事件WHO World Health Organization 世界卫生组织WHO-ICDRA WHO International Conference of Drug Regulatory Authorities WHO国际药品管理当局会议Active Control 阳性对照、活性对照Audit 稽查Audit Report 稽查报告Auditor 稽查员Blank Control 空白对照Blinding/masking 盲法/设盲Case History 病历Clinical study 临床研究Clinical Trial 临床试验Clinical Trial Report 临床试验报告Compliance 依从性Coordinating Committee 协调委员会Cross-over Study 交叉研究Double Blinding 双盲Endpoint Criteria/measurement 终点指标Essential Documentation 必需文件Exclusion Criteria 排除标准Inclusion Criteria 入选表准Information Gathering 信息收集Initial Meeting 启动会议Inspection 检察/视察Institution Inspection 机构检察Investigational Product 试验药物Investigator 研究者Monitor 监查员(监察员)Monitoring 监查(监察)Monitoring Plan 监查计划(监察计划)Monitoring Report 监查报告(监察报告)Multi-center Trial 多中心试验Non-clinical Study 非临床研究Original Medical Record 原始医疗记录Outcome Assessment 结果评价Patient File 病人档案Patient History 病历Placebo 安慰剂Placebo Control 安慰剂对照Preclinical Study 临床前研究Protocol 试验方案Protocol Amendments 修正案Randomization 随机Reference Product 参比制剂Sample Size 样本量、样本大小Seriousness 严重性Severity 严重程度Single Blinding 单盲Sponsor 申办者Study Audit 研究稽查Subject 受试者Subject Enrollment 受试者入选Subject Enrollment Log 受试者入选表Subject Identification Code List 受试者识别代码表Subject Recruitment 受试者招募Study Site 研究中心Subject Screening Log 受试者筛选表System Audit 系统稽查Test Product 受试制剂Trial Initial Meeting 试验启动会议Trial Master File 试验总档案Trial Objective 试验目的Triple Blinding 三盲Wash-out 洗脱Wash-out Period 洗脱期。
临床试验常用的英文缩略语

临床试验常用的英文缩略语(全免费)TP: time-to-progression 疾病进展时间SAE: severity Adverse Event严重不良事件AE:Adverse Event不良事件SOP: Standard Operating Procedure标准操作规程CRF: Case Report form病例报告表DLT:剂量限制毒性MTD:最大耐受剂量KPS: Karnofsky Performance Status行为状态评分CR:complete response完全缓解PR:partial response部分缓解SD:病情稳定PD:progressive disease病情进展CTC:常用药物毒性标准IEC: independent ethics committee 独立伦理委员会IRB : institutional review board 伦理委员会CRA:临床研究助理CRO: Contract Research Organization合同研究组织DFS: Disease Free Survival无病生存期OS:(Overall Survival)总生存时间IC:Informed consent知情同意ADR: Adverse Drug Reaction不良反应GAP:Good Agricultural Practice 中药材种植管理规范GCP:Good Clinical Practice 药物临床试验质量管理规范GLP:Good Laboratory Practice 药品实验室管理规范GMP:Good Manufacturing Practice 药品生产质量管理规范GSP:Good Supply Practice 药品经营质量管理规范GUP:Good Use Practice 药品使用质量管理规范PI :Principal investigator主要研究者CI:Co-inveatigator合作研究者SI :Sub-investigator助理研究者COI :Coordinating investigtor协调研究者DGMP:医疗器械生产质量管理规范ICF:Informed consent form知情同意书RCT : randomized controlled trial, 随机对照试验NRCCT:non-randomized concurrent controlled trial, 非随机同期对照试验EBM: evidence-based medicine循证医学RCD:randomized cross-over disgn随机交*对照试验HCT:historial control trial, 历史对照研究RECIST:Response Evaluation Criteria In Solid Tumors. 实体瘤疗效反应的评价标准QC: Quality Control质量控制UADR: Unexpected Adverse Drug Reaction,非预期药物不良反应代表含义: 指对所有与有关的要求、GCP及现行管理法规的遵从。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
EDC
电子化数据采集系统
Sub-I
助理研究者
FAS
全分析集
SMO
现场管理组织(委派CRC)
GCP
药物临床试验质量管理规范
SOP
标准操作规程
GLP
药品实验室管理规范
SS
安全性分析集
GMP
药品生产质量管理规范
UADR
非预期药物不良反应
GUP
药品使用质量管理规范
UAE
预料外不良反应
IC
知情同意
Monitor
监查员(申办方委派)
ICF
知情同意书
Sponsor
申办者
ICH
国际(药品注册)协调会议
Subject
受试者
国家药品监督管理局名称演变
1998年-2003年SDA
2003年-2013年SFDA
2013年2018年CFDA国家食品药品监督管理总局
CRC
临床研究协调员
PI
主要研究者
CRF
病例报告表/病例记录表
PPS
符合方案分析集
CRO
合同协作组织(委派CRA)
PV
方案违背
CTP
临床试验方案
RCT
随机对照试验
CS
有临床意义
RN
研究护士
DFS
无病生存期
QA
质量保证
EBM
循证医学
QC
质量控制
EC
伦理委员会
SAE
严重不良事件
eCRF
电子病例报告表
SD
GCP常用英文名缩写与中文对照表
英文缩写
中文名称
英文缩写
中文名称
ADM
制度
IEC
独立伦理委员会
AE
不良事件
NA
不适用
ADR
药物不良反应
NCS
无临床意义
BE
生物等效性研究
ND
未完成
CFDA
国家食品药品监督管理总局
NK
情况不明
CR
完全缓解
NMPA
国家药品监督管理局
CRA
监查员(CRO委派)
PD
病情进展/方案偏离
2018年8月至今NMPA国家药品监督管理局
(National Medical Products Administration)
