蛋白质的元素组成
蛋白质的元素组成

一、蛋白质的元素组成蛋白质是一类含氮有机化合物,除含有碳、氢、氧外,还有氮和少量的硫。
某些蛋白质还含有其他一些元素,主要是磷、铁、碘、锌和铜等。
各种蛋白质的含氮量很接近,平均为16%。
按照蛋白质的组成,可以分为1.简单蛋白(simple protein) :又称为单纯蛋白质;这类蛋白质只含由α-氨基酸组成的肽链,不含其它成分。
(1)清蛋白和球蛋白:albumin and globulin广泛存在于动物组织中。
清蛋白易溶于水,球蛋白微溶于水,易溶于稀酸中。
(2)谷蛋白(glutelin)和醇溶谷蛋白(prolamin):植物蛋白,不溶于水,易溶于稀酸、稀碱中,后者可溶于70-80%乙醇中。
(3)精蛋白和组蛋白:碱性蛋白质,存在与细胞核中。
(4)硬蛋白:存在于各种软骨、腱、毛、发、丝等组织中,分为角蛋白、胶原蛋白、弹性蛋白和丝蛋白。
2.结合蛋白(conjugated protein):由简单蛋白与其它非蛋白成分结合而成(1)色蛋白:由简单蛋白与色素物质结合而成。
如血红蛋白、叶绿蛋白和细胞色素等。
(2)糖蛋白:由简单蛋白与糖类物质组成。
如细胞膜中的糖蛋白等。
(3)脂蛋白:由简单蛋白与脂类结合而成。
如血清α-,β-脂蛋白等。
(4)核蛋白:由简单蛋白与核酸结合而成。
如细胞核中的核糖核蛋白等。
(5)色蛋白:由简单蛋白与色素结合而成。
如血红素、过氧化氢酶、细胞色素c等。
(6)磷蛋白:由简单蛋白质和磷酸组成。
如胃蛋白酶、酪蛋白、角蛋白、弹性蛋白、丝心蛋白等。
依据蛋白质的营养价值分类:按照蛋白质含的必需氨基酸的种类、数量、比例可分为完全蛋白、半完全蛋白和不完全蛋白。
1.完全蛋白:必需氨基酸的种类齐全、数量充足、比例恰当。
2.半完全蛋白:必需氨基酸的种类齐全、但有的氨基酸数量不足、比例不恰当。
3.不完全蛋白:必需氨基酸的种类不全。
蛋白质的功能一、构成和修复组织;二、调节生理功能;三、供给机体热能。
氨基酸为L-α-氨基酸(L-α-amino acid),其结构通式如下:必需氨基酸的定义、种类氨基酸模式(amino acid pattern):某种蛋白质中各种必需氨基酸的构成比例。
生化第一章蛋白质的结构和功能
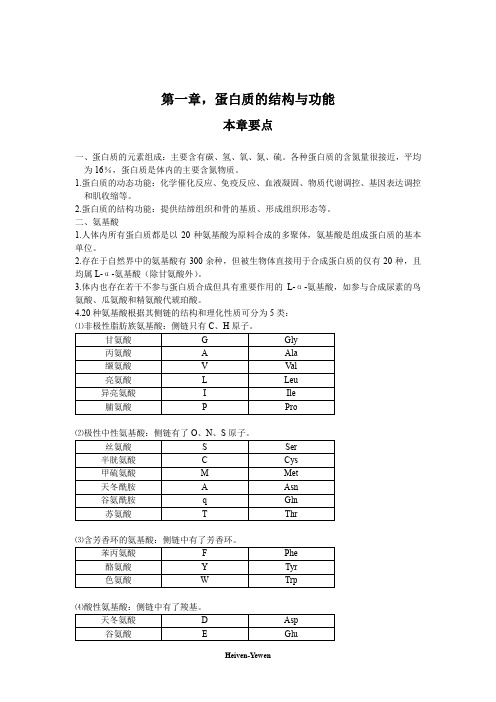
第一章,蛋白质的结构与功能本章要点一、蛋白质的元素组成:主要含有碳、氢、氧、氮、硫。
各种蛋白质的含氮量很接近,平均为16%,蛋白质是体内的主要含氮物质。
1.蛋白质的动态功能:化学催化反应、免疫反应、血液凝固、物质代谢调控、基因表达调控和肌收缩等。
2.蛋白质的结构功能:提供结缔组织和骨的基质、形成组织形态等。
二、氨基酸1.人体内所有蛋白质都是以20种氨基酸为原料合成的多聚体,氨基酸是组成蛋白质的基本单位。
2.存在于自然界中的氨基酸有300余种,但被生物体直接用于合成蛋白质的仅有20种,且均属L-α-氨基酸(除甘氨酸外)。
3.体内也存在若干不参与蛋白质合成但具有重要作用的L-α-氨基酸,如参与合成尿素的鸟氨酸、瓜氨酸和精氨酸代琥珀酸。
4.20种氨基酸根据其侧链的结构和理化性质可分为5类:⑴非极性脂肪族氨基酸:侧链只有C、H原子。
⑶含芳香环的氨基酸:侧链中有了芳香环。
⑷酸性氨基酸:侧链中有了羧基。
芳香族氨基酸中苯基的疏水性较强,酚基和吲哚基在一定条件下可解离;酸性氨基酸的侧链都含有羧基;而碱性氨基酸的侧链分别含有氨基、胍基或咪唑基。
5.20种氨基酸具有共同或特异的理化性质:⑴氨基酸具有两性解离的性质。
①所有氨基酸都含有碱性的α-氨基和酸性的α-羧基,可在酸性溶液中与质子(H+)结合呈带正电荷的阳离子(),也可在碱性溶液中与(OH-)结合,失去质子变成带负电荷的阴离子()。
②氨基酸是一种两性电解质,具有两性解离的特性。
③在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
④取兼性离子两边的pK值的平均值,即为此氨基酸的pI值:pI=1/2(pK1+pK2)⑵含共轭双键的氨基酸具有紫外线吸收性质①含有共轭双键的色氨酸、酪氨酸的最大吸收峰在280nm波长附近。
②由于大多数蛋白质含有酪氨酸和色氨酸残基,所以测定蛋白质溶液280nm的光吸收值,是分析溶液中蛋白质含量的快速简便的方法。
蛋白质主要由哪些元素组成

二、蛋白质的性质
3.变性
*由蛋白质变性引起的蛋白质凝结是不 可逆的,其使蛋白质的性质变化;
*蛋白质变性凝结后丧失可溶性,还失 去生理活性。
1.为什么医院用高温蒸煮,照射紫外线, 喷洒苯酚溶液,在伤口处涂抹酒精的方 法来杀菌?
2.为什么生物实验室用甲醛溶液保存标 本?
3.为什么在农业上用波尔多液(由硫酸 铜,生石灰和水制成)来消灭害虫?
1、重要的营养物质——生命的物质基础 2、工业上的应用 ①纺织工业——蚕丝、羊毛 ②皮革工业——动物毛皮经鞣制后作原料 ③感光材料工业——动物胶(白明胶)是
制感光材料的片基 ④塑料工业——制酪素塑料
酶-生物活性(生物催化作用)的蛋白质。 特点: 1.条件温和,不需加热.(体温和中性条件) 2.高度的专一性. 3.高效性.比普通催化剂高107-1013倍
二、蛋白质的性质
4.颜色反应 蛋白质可以和许多试剂发生特殊的
颜色反应.如某些蛋白质(分子里含有苯 环)跟浓硝酸作用产生黄色.
*注意:颜色反应可用于鉴别蛋白质. *此外,蛋白质灼烧产生烧焦羽5.水解反应:蛋白质在酸、碱或酶的催化 下,最终水解成氨基酸。
三、蛋白质的用途—课本P202
二、蛋白质的性质
12..蛋盐白析质:演的示两性-NH2的碱性、-COOH的酸性 溶a.液鸡-蛋-观清察蛋现白象溶-液有+饱沉和淀(析NH出4)2SO4或Na2SO4 b.在所得沉淀中加蒸馏水--观察现象-沉 淀消失
蛋白质在浓无机盐溶液中因胶体凝聚而析 出,叫做盐析。盐析是可逆的,表示如下:
采用多次盐析法,可以分离和提纯蛋白质
练习
●下式表示某蛋白质分子结构的一部分, 用箭头和(A)、(B)、(C)、(D) 标出分子中不同的化学键。当蛋白质水 解时,断裂( )
蛋白质思考题答案

《蛋白质》思考题二、判断题1、蛋白质主要是由C、H、O和N四种元素组成。
√2、蛋白质元素组成的特点是含氮量比较接近,平均为6.25%。
3、氨基酸有D型和L型两种构型,故组成蛋白质的氨基酸也有D型和L型。
4、丙氨酸和苯丙氨酸各自都有一个氨基和一个羧基,所以它们的等电点是相同的。
5、组成蛋白质的所有氨基酸都含有手性碳原子。
6、维持蛋白质二级结构的主要次级键是二硫键。
7、组成蛋白质的氨基酸只有20种。
8、所有α-氨基酸都与茚三酮发生反应呈蓝紫色。
9、蛋白质的四级结构是指各亚基间以共价键相连聚合而成,有一定空间结构的聚合体。
10、蛋白质的分子结构决定它的生物学活性。
√11、蛋白质都具有四级结构。
12、蛋白质的等电点可以有很多个,而等离子点只有一个。
√13、蛋白质分子净电荷为零时的溶液pH值是该蛋白质的等电点。
√14、人体体液中很多蛋白质的等电点在pH=5、0左右,所以这些蛋白质在体液中主要以负离子形式存在。
√15、分子量相同的蛋白质在电场中泳动的速度也相同。
16、蛋白质溶液稳定的主要因素是蛋白质分子表面可以形成水化膜,并在偏离等电点时带有相同电荷。
√17、用透析方法可以分离提纯蛋白质,其原理是蛋白质分子可以透过半透膜。
18、蛋白质都能发生双缩脲反应. √19、蛋白质变性后会沉淀,沉淀的蛋白质也一定已变性。
20、食物蛋白经加热变性后,一级结构被破坏,肽键断裂,故而更易被人体所吸收。
三、填空题1、组成蛋白质的编码氨基酸主要有 20 种,它们除甘氨酸外都是 L 型α-氨基酸。
其中酸性氨基酸有 Glu 和 Asp ,碱性氨基酸有 Lys 、 Arg 和His 。
2、测得某生物样品含蛋白质12、5g该样品中含氮 2 g。
3、组成蛋白质的氨基酸中含有巯基的氨基酸是 Cys 。
4、肽键是蛋白质一级结构的主键,维持蛋白质空间结构的副键有离子键、氢键、范德华力、疏水键、二硫键。
5、蛋白质二级结构主要有α- 螺旋和β- 折叠两种形状,维持其稳定结构的副键是氢键。
第二节 生命活动的主要承担者——蛋白质

第二节生命活动的主要承担者——蛋白质一、蛋白质元素组成:(1)都含C、H、O、N(2)有的还有P、S、Fe、Zn、Cu、B、Mn、I等(3)一般含S,原因-s-s-,含S氨基酸、起始密码中的甲硫氨酸含有硫,另外半胱氨酸含有硫元素二、蛋白质的含量(1)蛋白质占细胞占鲜重7-10%(2)干重50%以上,是含量最多的有机物(3)因分子量大——高分子化合物三、蛋白质的基本单位(单体)——氨基酸基本单位(单体)——高分子化合物(多聚体)1、种类(1)组成生物体的氨基酸:约20种(已经发现的)(2)必需8种:人体必须从外界环境(食物)中摄取,自身不能转化形成。
有:甲硫氨酸、苯丙氨酸、亮氨酸、异亮氨酸、苏氨酸、赖氨酸、色氨酸、缬氨酸(婴儿多一个:组氨酸)(3)非必需氨基酸:自身可以合成的氨基酸2、通式C2H4O2N-R(分子量——74+R)3、特点(1)每种α氨基酸至少都含有一个氨基(-NH2)和一个羧基(-COOH),并且都有一个氨基(-NH2)和一个羧基(-COOH)连在同一碳原子上;(2)各种氨基酸的区别在于R基的不同。
R基决定氨基酸的种类和理化性质。
(3)例:甘氨酸—(—H),丙氨酸-(-CH3),缬氨酸-( -CH-(CH3)2 ),亮氨酸--(-CH2-CH-(CH3)2 )四、蛋白质的化学结构1、脱水缩合(1)定义:脱水缩合(只针对蛋白质形成过程):一个氨基酸分子的羧基(-COOH)和另一个氨基酸分子的氨基(-NH2)相连接,形成肽键,同时脱去一分子的水的结合方式。
(2)过程(3)广义的脱水缩合,小分子合成大分子过程中,形成水的反应,如:多糖和核酸的形成等也脱水(4)形成肽键的羧基(-COOH)和氨基(-NH2)均不来自R基(5)场所:核糖体(翻译过程——条件:酶、20种氨基酸、ATP、mRAN、tRNA)2、肽链(1)定义:由多个氨基酸分子脱水缩合而成,含有多个肽键的化合物,叫多肽(含几个氨基酸就叫几肽)。
蛋白质的分子组成

蛋白质的分子组成
(一)蛋白质的元素组成及特点
蛋白质主要由碳、氢、氧、氮等元素组成。
氮最恒定平均为16%(计算题)。
(二)蛋白质的基本结构
组成蛋白质的基本结构:氨基酸,共有20种,均为L-α-氨基酸(甘氨酸除外,因不含手性碳原子)。
(三)氨基酸的分类
1.非极性脂肪族氨基酸7种(脯氨酸、亮氨酸、异亮氨酸、缬氨酸、丙氨酸、甘氨酸和甲硫氨酸、)
2.极性中性氨基酸5种(苏氨酸、天冬酰胺、丝氨酸、半胱氨酸和谷氨酰胺)
3.含芳香环氨基酸3种(酪色苯)
4.酸性氨基酸2种(天冬氨酸和谷氨酸)
5.碱性氨基酸3种(赖氨酸、精氨酸和组氨酸)
记忆:冬天(天冬氨酸)的谷(谷氨酸)子是酸的,
捡(碱性氨基酸)来(赖氨酸)精(精氨酸)煮(组氨酸)。
蛋白质所含元素

蛋白质所含元素蛋白质是人类和其他生物体的重要组成部分,它们是有机分子中的主要成分,也是构成生物细胞的主要成分。
蛋白质由氨基酸残基组成,这些残基又由碳、氢、氧、氮和其他元素组成。
因此,要了解蛋白质所含元素,首先要了解蛋白质的构成。
一、蛋白质的构成蛋白质是由一系列氨基酸残基组成的复杂有机物。
每一种氨基酸残基又由碳、氢、氧、氮和其他元素组成。
根据氨基酸残基的结构,氨基酸可以分为20种不同的类别,例如谷氨酸、苏氨酸、缬氨酸等,它们分别具有不同的结构特征和功能。
二、蛋白质所含元素除了碳、氢、氧、氮四种元素外,蛋白质中还含有硫、氯、磷、硒、钙、镁、铝等多种元素。
这些元素具有不同的生物学功能,如硫可以改变蛋白质的构象和功能,钙在蛋白质结构中具有重要作用;硒可以参与蛋白质的活化,而铝则可以调节蛋白质的表达。
而磷则可以参与蛋白质的结合反应,氯则可以调节蛋白质的稳定性。
三、蛋白质的功能蛋白质具有多种功能,它们可以参与细胞的代谢,还可以参与细胞的生长和分裂,还可以参与细胞的信号传导,以及可以参与细胞的免疫应答。
此外,蛋白质还可以参与细胞的膜质结构建设,以及参与细胞器的构建,从而实现细胞的功能。
四、蛋白质缺乏如果身体缺乏蛋白质,会导致身体发生严重的疾病,如贫血、肌营养不良症、儿童发育迟缓等。
此外,蛋白质缺乏还会导致免疫功能下降,从而使人们容易患上感染性疾病。
五、蛋白质的补充为了预防蛋白质缺乏,人们可以通过补充蛋白质来改善身体健康。
蛋白质可以通过食物的方式进行补充,例如牛奶、鸡蛋、豆类、肉类等富含蛋白质。
此外,人们也可以通过食用蛋白质补充剂,如蛋白粉、氨基酸等,来补充蛋白质。
总结蛋白质是生物体的重要组成部分,它们是有机分子的主要成分,也是构成生物细胞的主要成分,是维持生命活动的重要物质。
蛋白质是由一系列氨基酸残基组成,这些残基又由碳、氢、氧、氮和其他元素组成。
蛋白质具有多种功能,但是如果身体缺乏蛋白质,会导致身体发生严重的疾病,所以为了预防蛋白质缺乏,人们可以通过补充蛋白质来改善身体健康。
蛋白质元素组成的特点

蛋白质元素组成的特点蛋白质是生命体内最重要的有机物之一,由氢、碳、氧、氮和少量的硫组成。
它们是由氨基酸单元连接在一起形成的聚合物,具有复杂的三维空间结构。
蛋白质在生物体中扮演着多种多样的重要角色,包括结构支持、酶催化、信号传递、运输和免疫响应等。
首先,蛋白质的元素组成特点之一是含有氮。
氮是蛋白质中唯一的非碳水化合物元素,这使得蛋白质比其他生物分子更加复杂和多样化。
氮原子是构成氨基酸的基本成分,它们通过肽键连接在一起形成多肽链。
氮原子的存在使得蛋白质能够形成独特的结构和功能,例如螺旋、折叠和结构域。
其次,蛋白质的元素组成特点之二是含有硫。
硫是蛋白质中的一个重要元素,它参与了二硫键的形成。
二硫键是蛋白质结构中非常重要的化学键,它能够稳定蛋白质的立体结构。
二硫键在蛋白质的折叠、稳定和功能中起着至关重要的作用。
例如,二硫键可以稳定蛋白质的螺旋和折叠结构,使蛋白质具有特定的功能和特性。
此外,蛋白质的元素组成特点之三是含有氧、碳和氢。
氧、碳和氢是构成蛋白质骨架的基本元素。
碳原子通过共价键连接氢和氧原子,形成蛋白质的主要结构单元,氨基酸。
氧原子参与了氨基酸侧链的形成,这决定了蛋白质的特定功能和稳定性。
碳和氢原子在蛋白质的骨架中起着支撑和稳定的作用。
此外,蛋白质的元素组成特点之四是含有磷。
虽然磷在大多数蛋白质中的含量很少,但在一些特定的蛋白质中,如磷酸化蛋白质,磷起着关键的功能作用。
磷酸基团的存在可以调节蛋白质的结构和功能,影响其与其他分子的结合和相互作用。
综上所述,蛋白质的元素组成特点是含有氢、碳、氧、氮和少量的硫和磷。
这些元素的存在赋予了蛋白质复杂的结构和多样化的功能。
蛋白质的元素组成是其特异性结构和功能的基础,对于维持生物体的正常功能以及各种生物学过程至关重要。
蛋白质的各元素比例

蛋白质的各元素比例蛋白质是构成人体组织的重要营养物质,其含有的各种元素比例对于人体健康和生理功能发挥起着重要作用。
蛋白质是由氮、碳、氢、氧和硫等元素组成的大分子化合物,其中氮元素是蛋白质中独有的元素,也是区分蛋白质与碳水化合物和脂肪的重要特征。
在蛋白质的元素比例中,氮元素的含量是非常关键的。
蛋白质中氮元素的比例通常在16%-18%左右,这也是蛋白质相对于碳水化合物和脂肪的一个显著特征。
氮元素在蛋白质中扮演着重要的角色,它是蛋白质中氨基酸的组成元素,通过氨基酸的连接形成蛋白质的分子结构,氮元素的含量也可以反映蛋白质的质量和含量。
除氮元素外,碳、氢和氧元素在蛋白质中的比例也是不可忽视的。
碳元素是蛋白质中的主要元素之一,其含量占据了蛋白质分子的大部分,是构成蛋白质分子骨架的重要组成元素。
氢元素在蛋白质中的含量也较高,主要是构成蛋白质分子中的氨基基团的组成元素。
氧元素的含量相对较低,但是也是蛋白质分子中的重要元素,参与蛋白质分子的氧化还原反应和结构稳定性的维持。
此外,硫元素在蛋白质中的含量也是非常重要的。
硫元素主要存在于蛋白质的硫氨基酸中,是蛋白质中的一个重要元素,参与蛋白质的立体构象和功能性质的维持。
硫元素的含量也可以反映蛋白质的含硫氨基酸的质量和含量,对蛋白质的生物活性和生理功能具有重要的影响。
总的来说,蛋白质的各元素比例是蛋白质分子的重要特征,氮元素的含量是蛋白质的独有标志,碳、氢、氧和硫等元素的比例也是蛋白质质量和功能的重要指标。
了解蛋白质的各元素比例,有助于我们更深入地理解蛋白质的结构和功能,为合理膳食和营养摄入提供科学依据。
因此,保持蛋白质的合理比例,对于维持人体健康和促进生长发育是非常重要的。
蛋白质元素组成的特点

蛋白质元素组成的特点
蛋白质是由氨基酸按照一定的序列组成的大分子,其化学元素组成主要包括碳、氢、氧、氮等元素。
其中,氮是蛋白质元素组成的主要特点之一,与其它有机化合物(如糖类、脂类等)相比,蛋白质的含氮量更高,通常达到15%以上。
此外,蛋白质还含有一定量的硫、磷、铁、镁等元素,这些元素对蛋白质的结构和功能有着重要的影响。
在人体内,蛋白质是组成人体细胞、组织和器官的重要基础物质,其元素组成的特点直接影响着其生物学功能。
- 1 -。
蛋白质分子的元素组成特点是

蛋白质分子的元素组成特点是
特点是一切蛋白质都含氮元素,且各种蛋白质的含氮量很接近,平均为16%。
蛋白质是以氨基酸为基本单位构成的生物高分子。
蛋白质分子上氨基酸的序列和由此形成的立体结构构成了蛋白质结构的多样性。
所有的蛋白质都含有碳(50-60%)、氢(6-8%)、氧(19-24%)、氮(13-19%);大多数蛋白质含有硫(4%以下);有些蛋白质含有磷;少数蛋白质含有金属元素(如铁、铜、锌、锰等);个别蛋白质含有碘。
蛋白质是组成人体一切细胞、组织的重要成分。
机体所有重要的组成部分都需要有蛋白质的参与。
一般说,蛋白质约占人体全部质量的18%,最重要的还是其与生命现象有关。
蛋白质占人体重量的16%-20%,即一个60kg重的成年人其体内约有蛋白质9.6-12kg。
人体内蛋白质的种类很多,性质、功能各异,但都是由20多种氨基酸按不同比例组合而成的,并在体内不断进行代谢与更新。
含氮量计算蛋白质含量

含氮量计算蛋白质含量
蛋白质是三大供能营养素之一,接下里我们先系统的了解一下蛋白质。
蛋白质的组成元素主要有:碳、氢、氧、氮、硫,有些还含有磷、铁、碘、锰、锌等元素。
含量分别为:碳50~55%、氢6.7~7.3%、氧19~24%、氮13~19%、硫0~4%。
脂肪和碳水化合物只含有碳、氢、氧,不含氮,所以蛋白质是氮元素的唯一来源。
蛋白质含量的计算
氮元素来源于蛋白质,只要测定了含氮量,就可以测出蛋白质的大致含量:
蛋白质的含量=样品中的含氮量*氮折算成蛋白质的折算系数
不同食物蛋白质中的含氮量是有差别的,所以折算系数有差别,比如:小麦的折算系数是
5.83,大米的是5.95,玉米
6.25、花生5.46、鸡蛋6.25、肉类和鱼类6.25、乳及乳制品为
6.38等等。
我们知道蛋白质的含氮量为13~19%,则折算系数为(100/百分比)5.26~7.69,由于大多数蛋白质的含氮量非常接近,平均约为16%,所以每克氮相当于6.25g蛋白质,即折算系数为6.25。
那么,
蛋白质含量=含氮量*6.25。
这就是获得某种食物中蛋白质含量的方法,即去测定氮元素的含量,然后乘上6.25,即可达到蛋白质的大致含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)、极性而不带电荷(亲水性)侧链
(3)、正电荷侧链的碱性AAs
(4)、负电荷酸性AAs
二、蛋白质的结构(Protein structures):
三、蛋白质的分类(Protein classification)
(一)、单纯蛋白质(Simple proteins)
(二)、结合蛋白质(Conjugated proteins)
二、特点: (一)。变性作用仅涉及蛋白质的二,三,四级结构的变化,并不包括一级结构肽链的破裂。 变性时蛋白质中氢键,盐键及疏水键作用等遭受破坏不再呈折叠构象,肽键主链的共价键并 未打断 (二)。变性时蛋白质性质也发生了变化 1. 降低溶解度,改变对水的结合能力。 2. 发生凝结,形成不可逆凝胶。 3. 易被E水解。 4. 丧失生物活性。 5. 粘度增加不能形成结晶。 (三)。分为可逆变性:当变性因素解除以后,蛋白质可恢复原状,称为复性(温和条件)
(2).疏松聚集的蛋白质颗粒形成的凝胶不透明,缺乏弹性,形成对脱水收缩(Shrinking)和渗漏 (leaking)很为敏感的不稳定凝胶。卵清蛋白 五.织构化(Texturization) (一).作用 1.许多食物中蛋白质为构成其结构和质地的基础 2.用作肉类的代用品或填充物: 形成具有咀嚼性和良好持水性的薄膜或纤维状 3.动物蛋白质'重织构化' (Retexturization)或重整 (二).方法: (1).热凝固和薄膜形成: (2).纤维的形成: (3).热塑性挤压: 六.面团的形成(Rough form) 小麦胚乳中面筋蛋白质: 当有水存在时,在室温下混合和揉捏,能够形成强内聚力和粘弹性糊 状物或面团,再通过发酵,焙烤制成面包 1.其他成分影响 淀粉颗粒,戊聚糖,极性和非极性脂类,可溶性蛋白质 2.形成过程: 面筋蛋白质 (1).主要成分: 麦醇溶蛋白和麦谷蛋白 a.中性水溶液中不易溶解: 可解离 AAs 含量低 b.吸水能力和粘着性质: 含大量(33%以上)谷氨酰胺和羟基 AAs,易于形成氢键。极性 AAs 存 在 c.内聚-粘合性:蛋白质分子的聚集、脂类,糖脂相结合的疏水作用 d.形成大量的二硫交联键 (2).过程: 面粉+水-->混合,揉捏--->面筋蛋白质定向排列,部分伸展(疏水作用、二硫交联键的形成)立 体具粘弹性的三维网络-->截留淀粉颗粒和其它成分 面包改良剂: 溴酸盐(氧化剂) 增加韧性和弹性 焙烤不会引起面筋蛋白质的再变性,释放出水分被糊化的淀粉粒所吸收 含 40-50%水,柔软 可溶性小麦蛋白质(清蛋白,球蛋白)焙烤时发生变性和部分胶凝,有利于面包屑的凝结 (3)作用: 麦醇溶蛋白: 延伸性。过度膨胀易破裂,可渗透面筋膜,不能保留CO2发生塌陷 麦谷蛋白: 粘弹性。度粘结,抑制发酵过程被截留CO2气泡膨胀,面团鼓起,面包心中存在空气 泡 七.乳化性质(Emulsifying properties) 蛋白质吸附在分散油滴和连续水相之间的界面上,能使液滴产生耐凝集性的物理和流变性质 (稠度,粘度和弹性-刚性)。氨基酸的侧链也可能发生电离,可产生有利于乳状液稳定性的静 电排斥力 1.蛋白质在食品乳胶体中的稳定作用 许多食品属于乳胶体(牛奶,冰激凌,黄油,干酪) 天然乳胶体靠脂肪球'膜'来稳定 2.影响因素 (1).溶解度与乳状液稳定性正相关,不溶解的蛋白质对乳化作用影响很小 (2).pH 对蛋白质乳化性质因蛋白质有所不同
或凝胶(包括蛋白质)的流速增加时,它们的粘度系数降低。
原因:朝着流动方向的分子或颗粒的表观直径减小
(1).分子朝着流动方向逐渐定向,使得摩擦阻力降低
(2).蛋白质的水合球朝着流动方向变形 (3).氢键和其它弱键的断裂会使蛋白质的聚集体和网络结构解离 弱键的断裂是缓慢发生的。当停止剪切处理,可能(或者不能)重新形成原来的聚集体或网络结 构. 触变性: 不能 如果恢复原来的状态,粘度系数的降低是可逆的 3.蛋白质体系的粘度和稠度是流体食品的主要功能性质 四.胶凝作用(Gelation) (一). 概述 1.概念:蛋白质溶液分散程度的降低 (1).蛋白质的缔合(Association): 亚基或分子水平上发生的变化 (2).聚合(Polymerization)或凝集反应(Aggregation): 较大复合物的形成 (3).沉淀作用(Precipitation): 由于溶解度全部或部分丧失而引起的一切凝集反应 (4).絮凝(Flocculation): 没有变性时的无序凝集反应,因为链间静电排斥力的降低而引起的 (5).凝结作用(Coagulation): 在变性无序凝集反应中,当蛋白质间相互作用超过蛋白质和溶剂
蛋白质发生变性凝聚
(4).时间
(5).离子强度: 离子的种类和浓度。水,盐和 AAs 侧链间竞争性结合
低盐浓度时,蛋白质水合作用增加。盐溶
高盐浓度时,水盐间相互作用超过水-蛋白质间相互作用,引起蛋白质脱水。盐析
(6).其他成分的存在
3.蛋白质吸附和保持水的能力对各种食品的质地性质起着重要作用
二.溶解度(Solubility)
不可逆变性:比较强烈条件下(高温,强酸,强碱等) 分子量小比分子量大易变性,蛋白质中二硫交联键破坏后不易复性 三、引起变性的因素: 1. 物理因素: ①. 热变性 ②.低温变性 ③.机械处理和揉捏或滚动面包或其它面团 ④.Pro 的界面形成 ⑤.液压 ⑥.辐射 2. 化学因素 1 介质PH 2 金属:过渡金属Cu, Fe, Hg, Ag等作用巯基,Ca2+、、、Mg2+等为组成部分 3 有机溶剂:变性剂 4 有机化合物水溶液: 表面活性剂 十二烷基硫酸钠 破坏疏水作用,促使蛋白质伸展
蛋白质→眎→胨→多肽→二肽→氨基酸
四.蛋白质的分类
1. 化学组成
(1).单纯蛋白质:仅含有AAs
(2).结合蛋白质:由AAs和其他非蛋白质化合物所组成
(3).衍生蛋白质:用化学或酶学方法得到的化合物
2. 功能
(1).结构蛋白质:角蛋白,胶原蛋白,弹性蛋白
(2).有生物活性的蛋白质:酶,激素,免疫球蛋白
2、受环境因素影响
(1).蛋白质的浓度: 总水吸附率随蛋白质浓度的增加而增加
(2).PH: 影响蛋白质的电离作用和净电荷量。等电点时蛋白质间相互作用达到最大缔合,收缩
蛋白质表现出最小的水合作用和膨胀力 (图 4-1)
(3).温度: 蛋白质结合水的能力一般随温度的升高而降低,因为降低了氢键的键合力,加热时
(1) 疏水相互作用(高温时增强) (2) 静电相互作用(与Ca2+或其它二价离子桥接) (3) 氢键键合(因冷却而增强) (4) 二硫键等 2、蛋白质网络的形成 (1).蛋白质溶液浓度高:更易产生胶凝作用 (2).共价二硫交联键的形成: 热不可逆胶凝 β-乳球蛋白
约 30℃ (3).氢键形成: 白明胶 凝结――熔化反复循环 3.有些种类不同的蛋白质放在一起加热也可形成凝胶。蛋白质与多糖胶凝剂作用 带正电荷的明胶与带负电荷海藻酸盐或果胶酸盐非专一性离子间相互作用 带正电荷酪蛋白胶束存在于卡拉胶的凝胶中 4.许多凝胶以一种高度膨胀(敞开)和水合结构的形式存在 每 g 蛋白质约含水 10g 以上,食品中其他成分可被截留在蛋白质的网络中 甚至高达 98% 5.特点: 凝集作用与变性相比较缓慢 (1).聚集作用前,部分伸展的多肽可更好地自身取向,有利于形成有序,均匀,光滑,粘稠,高度膨 胀,高度弹性,透明,对脱水收缩渗出保持稳定的凝胶。明胶
(三)、衍生蛋白质(Derived proteins)
1. 一级衍生物:酪蛋白
2. 二级衍生物:眎(Proteoses) 胨(Peptones)和肽(Peptides)
第三节 蛋白质的变性作用
一、定义:
当蛋白质用化学因素(酸,碱,浓盐溶液,有机溶剂)或物理因素(加热及辐射)等处理时,
会不同程度地改变其构象,这个过程称为变性
有些蛋白质在等电点时具有良好的乳化性质(明胶,卵清蛋白等) 其它蛋白质在非等电点 pH 时,乳化性质更好(大豆蛋白,酪蛋白,乳清蛋白等) (3).加热通常降低吸附在界面的蛋白质膜的粘度和硬度,会降低乳状液的稳定性 具有高度水合的界面蛋白质膜的胶凝作用,能提高表面粘度和硬度,并使乳状液稳定 (4).添加小分子的表面活性剂: 稳定性不利 降低蛋白质膜的硬度并减弱蛋白质保留在界面上的作用力 八.发泡性质(Forming) 1.食品泡沫: 气泡在连续的液相或含可溶性表面活性剂的半固相中形成的分散体系,有弹性 的薄液体层连续相将气泡分开、液体膜或半固体膜分开。气泡的直径从 1μm 到几厘米不等 典型泡沫食品: 蛋白酥皮,蛋糕,搅打奶油,冰淇淋,啤酒泡沫等 2.要求: (1).含有大量的气体(低密度) (2).在气相和连续液相间有较大的表面积 (3).溶质的浓度在表面较高大 (4).壁薄能胀大 (5).有可反射的光,看起来不透明 3.泡沫剂:
还原剂 (半胱氨酸,β-巯基乙醇)还原二硫交联键 四、应用
第四节 蛋白质在食品中的功能性质 定义: 是指那些对食品需宜特性有利的蛋白质的物理、化学性质 (表 4-2) 分类: 1.水合性质: 取决于蛋白质-水的相互作用:水的吸附、保留性、湿润性、膨胀性、粘合性、
分散性等 2.与蛋白质-蛋白质相互作用有关的性质:控制沉淀、胶凝、蛋白质的面团等 3.表面性质: 蛋白质表面张力、乳化性质、起泡特性等 这三类性质又是相互关联的 一、水合性质(Hydration properties) 1.概述 蛋白质在溶液中的构象主要取决于它和水之间的相互作用,大多数食品是水合固态体系,蛋白 质从干燥状态开始逐渐水合顺序:
