最全最实用的电极电势表
标准电极电势表非常全-nb的电极电势

标准电极电势表非常全-nb的电极电势标准电极电势表非常全 nb 的电极电势在化学的世界里,标准电极电势表是一个极其重要的工具。
它就像是一张化学世界的地图,为我们指引着各种化学反应的方向和可能性。
今天,咱们就来深入探讨一下这个非常全且厉害的标准电极电势表中的电极电势。
首先,咱们得明白啥是电极电势。
简单来说,电极电势就是衡量一个电极在特定条件下得失电子能力的物理量。
想象一下,每个电极就像是一个“战士”,而电极电势就是这个战士的“战斗力数值”。
数值越大,说明这个电极在反应中得电子的能力越强,也就越容易发生还原反应;数值越小,失电子的能力越强,越容易发生氧化反应。
那标准电极电势又是怎么来的呢?这可不是随便拍拍脑袋就定下来的。
科学家们通过一系列精心设计的实验,在标准状态下(通常是指温度为298K,压强为100kPa,溶液浓度为1mol/L 等等)测量得到的。
这些实验条件的统一,保证了数据的可比性和可靠性。
标准电极电势表那可是相当丰富和全面。
从常见的金属电极,像铁、铜、锌,到一些不太常见但在特定领域非常重要的元素,比如钨、钼等等,都能在表中找到它们对应的电极电势值。
比如说,咱们熟悉的锌和铜。
锌的标准电极电势相对较小,为-076 伏,这意味着锌在反应中更容易失去电子,被氧化成锌离子。
而铜的标准电极电势是+034 伏,它得电子的能力相对较强,更容易被还原成铜单质。
当把锌片和铜片放在一起,再加上合适的电解质溶液,就构成了一个简单的原电池。
锌片不断溶解,失去电子,而铜离子在铜片上得到电子,被还原成铜单质,这就是电池能够产生电流的原理。
再来说说一些不太常见但同样重要的电极电势。
比如氢电极,它的标准电极电势被定义为 0 伏,这就像是一个基准点,其他电极的电势都是相对于它来确定的。
还有像氟气和氧气这样的气体电极,它们的电极电势也都在标准电极电势表中有明确的记录。
标准电极电势表的应用那可真是广泛。
在电化学领域,它是设计电池、电解池等装置的重要依据。
标准电极电势表
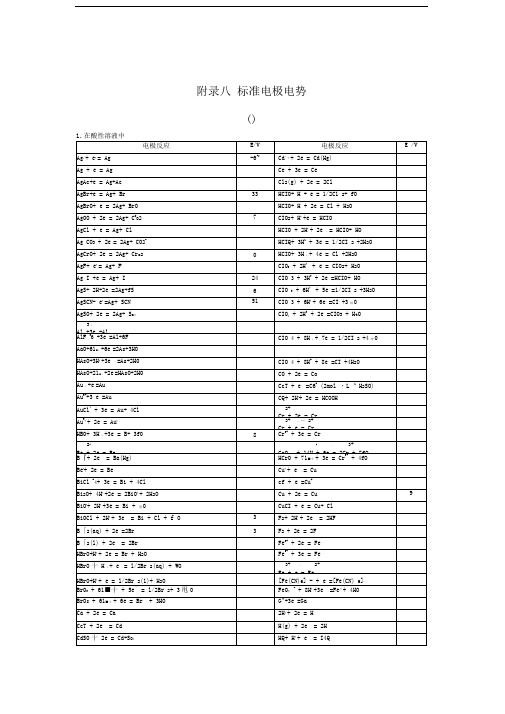
3十—
Al +3e =Al
AlF36+3e =Al+6F
CIO4+8H十+7e=1/2CI2+4冲0
AaO+61■十+6e—=2As+3HO
HAsO+3H++3e—=As+2H0
CIO4+8H++8e—=CI—+4H2O
HAsO+21■十+2e—=HAsO+2HO
CO+2e=Co
Au十+e—=Au
CcT+e一=C6+(2mol・L—1H2SO)
Au3++3 e—=Au
CQ+2H++2e—=HCOOH
AuCl4+3e=Au+ 4Cl
2+—
Cr+2e=Cr
Au3++2e—=Au+
3+—―2+
Cr+e=Cr
HBO+3H十+3e—=B+ 3f0
8
Cr3++3e—=Cr
HCIO+ H+2e=Cl+H2O
AgOO+2e=2Ag+C2o2
7
CIO2+H++e=HCIO
AgCl+e=Ag+Cl
HCIO+2H++2e一=HCIO+ HO
Ag CO3+2e「=2Ag+ CO2-
HCIQ+3H1+3e=1/2CI2+2H2O
标准电极电势表非常全-nb的电极电势

标准电极电势表非常全-nb的电极电势标准电极电势表非常全 nb 的电极电势在化学的世界里,标准电极电势表是一个极其重要的工具。
它就像是一张地图,为我们指引着电化学反应的方向和可能性。
对于化学学习者和研究者来说,深入理解标准电极电势表是掌握电化学知识的关键。
首先,让我们来了解一下什么是标准电极电势。
简单来说,标准电极电势是指在标准状态下(通常是指温度为 29815K,压强为 100kPa,溶液中离子浓度为 1mol/L 等),某一电极与标准氢电极组成原电池时所测得的电势差。
这个概念可能有点抽象,但想象一下电池的正负极,电极电势就类似于正负极之间的“电压差”。
标准电极电势表的作用可不容小觑。
它能够帮助我们判断氧化还原反应的方向。
如果一个氧化还原反应中,氧化剂对应的电极电势高于还原剂对应的电极电势,那么反应就能够自发进行。
反之,如果氧化剂的电极电势低于还原剂的电极电势,反应则不能自发进行。
这就像是一场“电势的较量”,高电势的一方占据优势,推动反应向前进行。
而且,通过标准电极电势表,我们还可以计算出电池的电动势。
电池的电动势等于正极的电极电势减去负极的电极电势。
知道了电动势,就能了解电池能够提供的电能大小,这对于设计和优化电池性能至关重要。
那么,这个“非常全 nb 的电极电势”表到底都包含了哪些内容呢?它涵盖了各种各样的元素和化合物的电极电势数据。
从常见的金属如铁、铜、锌,到一些不太常见但在特定领域有重要应用的元素,都能在表中找到它们对应的电极电势值。
比如说,铜离子/铜电极的标准电极电势为+034 V,这意味着在标准状态下,铜离子得到电子变成铜单质的趋势相对较强。
而锌离子/锌电极的标准电极电势为-076 V,说明锌单质失去电子变成锌离子相对容易。
再比如,氯离子/氯气电极的标准电极电势为+136 V,这表示氯离子要变成氯气需要较高的能量输入,或者说氯气具有较强的氧化性。
这些具体的数值为我们进行化学计算和分析提供了坚实的基础。
最新最全最实用电极电势表

标准电极电势表环境:摄氏25度,1标准大气压,离子浓度1摩尔/升,采用氢电极最全最实用电极电势表由xsm18倾情制作,转载请注明来源:/xsm18/homePbSO4(+2)/Pb PbSO4+2e-=Pb+SO42--0.3588PbBr2(+2)/Pb PbBr2+2e-=Pb+2Br--0.284Co2+/Co Co2++2e-=Co-0.28H3PO4/H3PO3H3PO4+2H++2e-=H3PO3+H2O-0.276PbCl2(+2)/Pb PbI2+2e-=Pb+2I--0.2675Ni2+/Ni Ni2++2e-=Ni-0.257CO2/HCOOH(甲酸)CO2(g)+2H++2e-=HCOOH(aq)-0.199CuI(+1)/Cu CuI+e-=Cu+I-0.1852AgI(+1)/Ag AgI+e-=Ag+I-0.15224Sn2+/Sn Sn2++2e-=Sn-0.1375Pb2+/Pb Pb2++2e-=Pb-0.1262C4+/C2+CO2(g)+2H++2e-=CO+H2O-0.12P/PH3P(白磷)+3H++3e-=PH3(g)-0.063气体(g)Hg2I2(+1)/Hg Hg2I2+2e-=2Hg+2I--0.0405Fe3+/Fe Fe3++3e-=Fe-0.037Ag2S(+1)/Ag Ag2S+2H++2e-=2Ag+H2S-0.0366H+/H22H++2e-=H20.00CuBr(+1)/Cu CuBr+e-=Cu+Br-0.033AgBr(+1)/Ag AgBr+e-=Ag+Br-0.07133Si/SiH4Si+4H++4e-=SiH40.102C(石墨)/CH4C+4H++4e-=CH40.1316CuCl(+1)/Cu CuCl+e-=Cu+Cl-0.137Hg2Br2(+1)/Hg Hg2Br2+2e-=2Hg+2Br-0.13923S/H2S(aq)S+2H++2e-=H2S(aq)0.142水溶液Sn4+/Sn2+Sn4++2e-=Sn2+0.151Cu2+/Cu+Cu2++e-=Cu+0.153S6+/S4+SO42-+4H++2e-=H2SO3+H2O0.172AgCl(+1)/Ag AgCl+e-=Ag+Cl-0.2223As3+/As(亚砷酸)HAsO2(aq)+3H++3e-=As+2H2O0.2476HAsO2.H2O Hg2Cl2/Hg Hg2Cl2+2e-=2Hg+2Cl-0.268Bi3+/Bi Bi3++3e-=Bi0.308Cu2+/Cu Cu2++2e-=Cu0.337AgIO3/Ag AgIO3+e-=Ag+IO3-0.354S6+/S SO42-+8H++6e-=S+4H2O0.3572Ag2CrO4/Ag Ag2CrO4+2e-=2Ag+CrO42-0.447铬酸银S4+/S H2SO3+4H++4e-=S+3H2O0.449Ag2C2O4/Ag Ag2C2O4+2e-=2Ag+C2O42-0.4647草酸银Cu+/Cu Cu++e-=Cu0.521I2/I-I2+2e-=2I-0.5355AgBrO3/Ag AgBrO3+e-=Ag+BrO3-0.546As5+/As3+H3AsO4(aq)+2H++2e-=HAsO2+2H2O0.56水溶液AgNO2/Ag AgNO2+e-=Ag+NO2-0.564Te4+/Te TeO2+4H++4e-=Te+2H2O0.593Hg2SO4/Hg Hg2SO4+2e-=2Hg+SO42-0.614Ag2SO4/Ag Ag2SO4+2e-=2Ag+SO42-0.654Pt4+(氯铂酸)/Pt2+[PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68O2/O-O2+2H++2e-=H2O20.695Pt2+/Pt(二氯化铂)[PtCl4]2-+2e-=Pt+4Cl-0.73Se4+/Se H2SeO3+4H++4e-=Se+3H2O0.74Fe3+/Fe2+Fe3++e-=Fe2+0.771AgF/Ag AgF+e-=Ag+F-0.779Hg+/Hg Hg22++2e-=2Hg0.788Ag+/Ag Ag++e-=Ag0.7991N5+/N4+(硝酸)2NO3-+4H++2e-=N2O4(g)+2H2O0.803气体(g) Hg2+/Hg Hg2++2e-=Hg(lq)0.853液态(水银) Si4+(石英)/Si SiO2+4H++4e-=Si+2H2O0.857Hg2+/Hg+2Hg2++2e-=Hg22+0.92N5+/N3+(亚硝酸)NO3-+3H++2e-=HNO2+H2O0.934Pd2+/Pd Pd2++2e-=Pd0.951N5+/N2+NO3-+4H++3e-=NO+2H2O0.957Au3+/Au(三溴化金)AuBr2-+e-=Au+2Br-0.959N3+/2+HNO2+H++e-=NO+H2O0.983Au3+/Au(三氯化金)[AuCl4]-+3e-=Au+4Cl- 1.002Te6+/Te4+H6TeO6+2H++2e-=TeO2+4H2O 1.02N4+/N2+N2O4+4H++4e-=2NO+2H2O 1.03Pt4+/Pt PtO2+4H++4e-=Pt+2H2O 1.045Br2(lq)/Br-Br2(lq)+2e-=2Br- 1.0652液溴(lq)N4+/N3+N2O4+2H++2e-=2HNO2 1.07Br2(aq)/Br-Br2(aq)+2e-=2Br- 1.087水溶液(aq) Se6+/Se4+SeO42-+4H++2e-=H2SeO3+H2O 1.151Cl5+/Cl4+ClO3-+2H++e-=ClO2+H2O 1.152O2/H2O(g)O2+4H++4e-=2H2O(g) 1.185水蒸汽(g) Pt2+/Pt Pt2++2e-=Pt 1.188Cl7+/Cl5+ClO4-+2H++2e-=ClO3-+H2O 1.189I5+/I22IO3-+12H++10e-=I2(s)+6H2O 1.195碘单质(s) Cl5+/Cl3+ClO3-+3H++2e-=HClO2+H2O 1.21Mn4+/Mn2+MnO2+4H++2e-=Mn2++2H2O 1.224O2/H2O(液态水)O2+4H++4e-=2H2O 1.229常温水S+(S2Cl2)/S S2Cl2+2e-=2S+2Cl- 1.23Fe3O4/Fe2+Fe3O4+8H++2e-=3Fe2++4H2O 1.23Tl3+/Tl+T13++2e-=Tl+ 1.25注4Cl4+/Cl3+ClO2+H++e-=HClO2 1.277N3+/N+2HNO2(aq)+4H++4e-=N2O(g)+3H2O 1.297Cr6+/Cr3+Cr2O72-+14H++6e-=2Cr3++7H2O 1.33重铬酸根Br+/Br-HBrO+H++2e-=Br-+H2O 1.331Cr6+/Cr3+HCrO4-+7H++3e-=Cr3++4H2O 1.35铬酸根Cl2/Cl-Cl2(g)+2e-=2Cl- 1.358(g)氯气Au2O3(+3)/Au Au2O3+6H++6e-=2Au+3H2O 1.36Cl7+/Cl-ClO4-+8H++8e-=Cl-+4H2O 1.388Cl7+/Cl2ClO4-+8H++7e-=1/2Cl2+4H2O 1.392Au3+/Au+Au3++2e-=Au+ 1.41Br5+/Br-BrO3-+6H++6e-=Br-+3H2O 1.424I+/I22HIO+2H++2e-=I2+2H2O 1.439Cl5+/Cl-ClO3-+6H++6e-=Cl-+3H2O 1.451Pb4+/Pb2+PbO2+4H++2e-=Pb2++2H2O 1.455Cl5+/Cl2ClO3-+6H++5e-=1/2Cl2+3H2O 1.47CrO2(+4)/Cr3+CrO2+4H++e-=Cr3++2H2O 1.48二氧化铬Cl+/Cl-HClO+H++2e-=Cl-+H2O 1.482Au3+/Au Au3++3e-=Au 1.498Mn7+/Mn2+MnO4-+8H++5e-=Mn2++4H2O 1.507Cl4+/Cl-ClO2+4H++5e-=Cl-+2H2O 1.511Br5+/Br2BrO3-+6H++5e-=l/2Br2+3H2O 1.52Mn3+/Mn2+Mn3++e-=Mn2+ 1.5415注5Cl3+/Cl-HClO2+3H++4e-=Cl-+2H2O 1.57N2+/N+2NO+2H++2e-=N2O+H2O 1.59Br+/Br2HBrO+H++e-=l/2Br2(aq)+H2O 1.595I7+/I5+H5IO6+H++2e-=IO3-+3H2O 1.603注6Cl+/Cl2HClO+H++e-=1/2Cl2+H2O 1.611Cl3+/Cl2HClO2+3H++2e-=1/2Cl2+2H2O 1.628Cl3+/Cl+HClO2+2H++2e-=HClO+H2O 1.645Ni4+/Ni2+NiO2+4H++2e-=Ni2++2H2O 1.678Mn7+/Mn4+MnO4-+4H++3e-=MnO2+2H2O 1.68注7Pb4+/Pb2+PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.69Au+/Au Au++e-=Au 1.691Ce4+/Ce3+Ce4++e-=Ce3+ 1.74注8Br7+/Br5+BrO4-+2H++2e-=BrO3-+H2O 1.763注9N+/N2N2O+2H++2e-=N2+H2O 1.766O-(H2O2)/O2-(H2O)H2O2+2H++2e-=2H2O 1.776NiO42-/NiO2NiO42-+4H++2e-=NiO2+2H2O 1.8Co3+/Co2+Co3++e-=Co2+ 1.808Co3+/Co2+Co3++e-=Co2+ 1.83稀硫酸中Co3+/Co2+Co3++e-=Co2+ 1.92稀高氯酸Ag2+/Ag+Ag2++e-=Ag+ 1.93稀硝酸Ag2+/Ag+Ag2++e-=Ag+ 1.98稀硫酸Ag2+/Ag+Ag2++e-=Ag+ 2.0稀高氯酸S2O82-/SO42-S2O82-+2e-=2SO42- 2.01Bi5+/Bi3+BiO3-+2H++2e-=Bi3++H2O 2.03铋酸盐O3/O2-O3+2H++2e-=O2+H2O 2.076XeO3/Xe XeO3+6H++6e-=Xe+3H2O 2.1最全最实用电极电势表由xsm18倾情制作,转载请注明来源:/xsm18/home注释1:碱族和从钙开始的碱土元素均和水发生反应,其电极电势数值为理论计算值注释2:铈元素(Ce)属于镧系元素,有稳定的+3,+4价,+3价有很强的还原性,+4有很强的氧化性,该元素有很好的代表性。
标准电极电势(精)

-2.925
-2.924
-2.923
-2.90
-2.87
-2.714
-2.375
-2.07
-1.66
-1.182
-0.763
-0.74
-0.69
-0.49
-0.48
-0.44
-0.277 -0.246 -0.152 -0.136 -0.126 -0.036 -0.02 0.000 +0.071 +0.08 +0.141 +0.154 +0.159 +0.17 +0.2223 +0.2676 +0.337 +0.36 +0.37
O2 + 4H+ + 4e ?2H2O
Cr2O72- + 14H+ + 6e ?2Cr3+ + 7H2O Cl2 + 2e ?2Cl-
BrO3- + 6H+ + 6e ?Br- + 3H2O
ClO3- + 6H+ + 6e ?Cl- + 3H2O
PbO2 + 4H+ + 2e ?Pb2+ + 2H2O
-1.405
-1.26
-1.216
-1.21
-1.04
-0.909
-0.8277
-0.67
-0.66
-0.66
-0.56
-0.447
-0.224
-0.09 -0.076 -0.05 +0.01 +0.09 +0.1 +0.26 +0.33 +0.373 +0.401 +0.49 +0.54 +0.56 +0.564 +0.588 +0.61 +0.62 +0.76 +0.88
最新最全最实用电极电势表
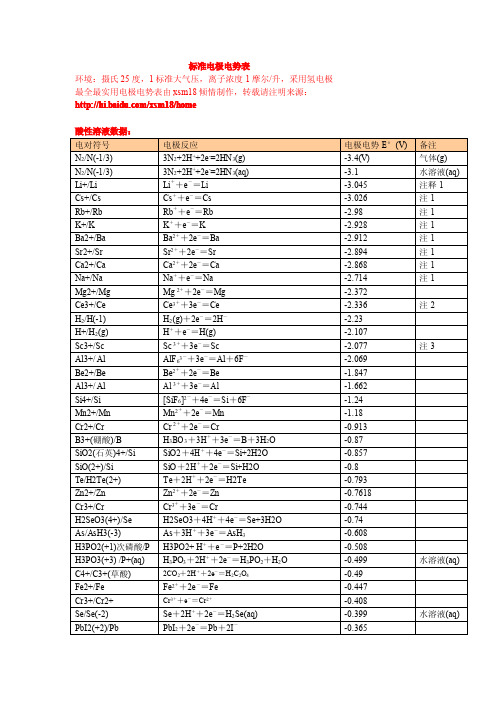
标准电极电势表环境:摄氏25度,1标准大气压,离子浓度1摩尔/升,采用氢电极最全最实用电极电势表由xsm18倾情制作,转载请注明来源:/xsm18/homePbSO4(+2)/Pb PbSO4+2e-=Pb+SO42--0.3588PbBr2(+2)/Pb PbBr2+2e-=Pb+2Br--0.284Co2+/Co Co2++2e-=Co-0.28H3PO4/H3PO3H3PO4+2H++2e-=H3PO3+H2O-0.276PbCl2(+2)/Pb PbI2+2e-=Pb+2I--0.2675Ni2+/Ni Ni2++2e-=Ni-0.257CO2/HCOOH(甲酸)CO2(g)+2H++2e-=HCOOH(aq)-0.199CuI(+1)/Cu CuI+e-=Cu+I-0.1852AgI(+1)/Ag AgI+e-=Ag+I-0.15224Sn2+/Sn Sn2++2e-=Sn-0.1375Pb2+/Pb Pb2++2e-=Pb-0.1262C4+/C2+CO2(g)+2H++2e-=CO+H2O-0.12P/PH3P(白磷)+3H++3e-=PH3(g)-0.063气体(g)Hg2I2(+1)/Hg Hg2I2+2e-=2Hg+2I--0.0405Fe3+/Fe Fe3++3e-=Fe-0.037Ag2S(+1)/Ag Ag2S+2H++2e-=2Ag+H2S-0.0366H+/H22H++2e-=H20.00CuBr(+1)/Cu CuBr+e-=Cu+Br-0.033AgBr(+1)/Ag AgBr+e-=Ag+Br-0.07133Si/SiH4Si+4H++4e-=SiH40.102C(石墨)/CH4C+4H++4e-=CH40.1316CuCl(+1)/Cu CuCl+e-=Cu+Cl-0.137Hg2Br2(+1)/Hg Hg2Br2+2e-=2Hg+2Br-0.13923S/H2S(aq)S+2H++2e-=H2S(aq)0.142水溶液Sn4+/Sn2+Sn4++2e-=Sn2+0.151Cu2+/Cu+Cu2++e-=Cu+0.153S6+/S4+SO42-+4H++2e-=H2SO3+H2O0.172AgCl(+1)/Ag AgCl+e-=Ag+Cl-0.2223As3+/As(亚砷酸)HAsO2(aq)+3H++3e-=As+2H2O0.2476HAsO2.H2O Hg2Cl2/Hg Hg2Cl2+2e-=2Hg+2Cl-0.268Bi3+/Bi Bi3++3e-=Bi0.308Cu2+/Cu Cu2++2e-=Cu0.337AgIO3/Ag AgIO3+e-=Ag+IO3-0.354S6+/S SO42-+8H++6e-=S+4H2O0.3572Ag2CrO4/Ag Ag2CrO4+2e-=2Ag+CrO42-0.447铬酸银S4+/S H2SO3+4H++4e-=S+3H2O0.449Ag2C2O4/Ag Ag2C2O4+2e-=2Ag+C2O42-0.4647草酸银Cu+/Cu Cu++e-=Cu0.521I2/I-I2+2e-=2I-0.5355AgBrO3/Ag AgBrO3+e-=Ag+BrO3-0.546As5+/As3+H3AsO4(aq)+2H++2e-=HAsO2+2H2O0.56水溶液AgNO2/Ag AgNO2+e-=Ag+NO2-0.564Te4+/Te TeO2+4H++4e-=Te+2H2O0.593Hg2SO4/Hg Hg2SO4+2e-=2Hg+SO42-0.614Ag2SO4/Ag Ag2SO4+2e-=2Ag+SO42-0.654Pt4+(氯铂酸)/Pt2+[PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68O2/O-O2+2H++2e-=H2O20.695Pt2+/Pt(二氯化铂)[PtCl4]2-+2e-=Pt+4Cl-0.73Se4+/Se H2SeO3+4H++4e-=Se+3H2O0.74Fe3+/Fe2+Fe3++e-=Fe2+0.771AgF/Ag AgF+e-=Ag+F-0.779Hg+/Hg Hg22++2e-=2Hg0.788Ag+/Ag Ag++e-=Ag0.7991N5+/N4+(硝酸)2NO3-+4H++2e-=N2O4(g)+2H2O0.803气体(g) Hg2+/Hg Hg2++2e-=Hg(lq)0.853液态(水银) Si4+(石英)/Si SiO2+4H++4e-=Si+2H2O0.857Hg2+/Hg+2Hg2++2e-=Hg22+0.92N5+/N3+(亚硝酸)NO3-+3H++2e-=HNO2+H2O0.934Pd2+/Pd Pd2++2e-=Pd0.951N5+/N2+NO3-+4H++3e-=NO+2H2O0.957Au3+/Au(三溴化金)AuBr2-+e-=Au+2Br-0.959N3+/2+HNO2+H++e-=NO+H2O0.983Au3+/Au(三氯化金)[AuCl4]-+3e-=Au+4Cl- 1.002Te6+/Te4+H6TeO6+2H++2e-=TeO2+4H2O 1.02N4+/N2+N2O4+4H++4e-=2NO+2H2O 1.03Pt4+/Pt PtO2+4H++4e-=Pt+2H2O 1.045Br2(lq)/Br-Br2(lq)+2e-=2Br- 1.0652液溴(lq)N4+/N3+N2O4+2H++2e-=2HNO2 1.07Br2(aq)/Br-Br2(aq)+2e-=2Br- 1.087水溶液(aq) Se6+/Se4+SeO42-+4H++2e-=H2SeO3+H2O 1.151Cl5+/Cl4+ClO3-+2H++e-=ClO2+H2O 1.152O2/H2O(g)O2+4H++4e-=2H2O(g) 1.185水蒸汽(g) Pt2+/Pt Pt2++2e-=Pt 1.188Cl7+/Cl5+ClO4-+2H++2e-=ClO3-+H2O 1.189I5+/I22IO3-+12H++10e-=I2(s)+6H2O 1.195碘单质(s) Cl5+/Cl3+ClO3-+3H++2e-=HClO2+H2O 1.21Mn4+/Mn2+MnO2+4H++2e-=Mn2++2H2O 1.224O2/H2O(液态水)O2+4H++4e-=2H2O 1.229常温水S+(S2Cl2)/S S2Cl2+2e-=2S+2Cl- 1.23Fe3O4/Fe2+Fe3O4+8H++2e-=3Fe2++4H2O 1.23Tl3+/Tl+T13++2e-=Tl+ 1.25注4Cl4+/Cl3+ClO2+H++e-=HClO2 1.277N3+/N+2HNO2(aq)+4H++4e-=N2O(g)+3H2O 1.297Cr6+/Cr3+Cr2O72-+14H++6e-=2Cr3++7H2O 1.33重铬酸根Br+/Br-HBrO+H++2e-=Br-+H2O 1.331Cr6+/Cr3+HCrO4-+7H++3e-=Cr3++4H2O 1.35铬酸根Cl2/Cl-Cl2(g)+2e-=2Cl- 1.358(g)氯气Au2O3(+3)/Au Au2O3+6H++6e-=2Au+3H2O 1.36Cl7+/Cl-ClO4-+8H++8e-=Cl-+4H2O 1.388Cl7+/Cl2ClO4-+8H++7e-=1/2Cl2+4H2O 1.392Au3+/Au+Au3++2e-=Au+ 1.41Br5+/Br-BrO3-+6H++6e-=Br-+3H2O 1.424I+/I22HIO+2H++2e-=I2+2H2O 1.439Cl5+/Cl-ClO3-+6H++6e-=Cl-+3H2O 1.451Pb4+/Pb2+PbO2+4H++2e-=Pb2++2H2O 1.455Cl5+/Cl2ClO3-+6H++5e-=1/2Cl2+3H2O 1.47CrO2(+4)/Cr3+CrO2+4H++e-=Cr3++2H2O 1.48二氧化铬Cl+/Cl-HClO+H++2e-=Cl-+H2O 1.482Au3+/Au Au3++3e-=Au 1.498Mn7+/Mn2+MnO4-+8H++5e-=Mn2++4H2O 1.507Cl4+/Cl-ClO2+4H++5e-=Cl-+2H2O 1.511Br5+/Br2BrO3-+6H++5e-=l/2Br2+3H2O 1.52Mn3+/Mn2+Mn3++e-=Mn2+ 1.5415注5Cl3+/Cl-HClO2+3H++4e-=Cl-+2H2O 1.57N2+/N+2NO+2H++2e-=N2O+H2O 1.59Br+/Br2HBrO+H++e-=l/2Br2(aq)+H2O 1.595I7+/I5+H5IO6+H++2e-=IO3-+3H2O 1.603注6Cl+/Cl2HClO+H++e-=1/2Cl2+H2O 1.611Cl3+/Cl2HClO2+3H++2e-=1/2Cl2+2H2O 1.628Cl3+/Cl+HClO2+2H++2e-=HClO+H2O 1.645Ni4+/Ni2+NiO2+4H++2e-=Ni2++2H2O 1.678Mn7+/Mn4+MnO4-+4H++3e-=MnO2+2H2O 1.68注7Pb4+/Pb2+PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.69Au+/Au Au++e-=Au 1.691Ce4+/Ce3+Ce4++e-=Ce3+ 1.74注8Br7+/Br5+BrO4-+2H++2e-=BrO3-+H2O 1.763注9N+/N2N2O+2H++2e-=N2+H2O 1.766O-(H2O2)/O2-(H2O)H2O2+2H++2e-=2H2O 1.776NiO42-/NiO2NiO42-+4H++2e-=NiO2+2H2O 1.8Co3+/Co2+Co3++e-=Co2+ 1.808Co3+/Co2+Co3++e-=Co2+ 1.83稀硫酸中Co3+/Co2+Co3++e-=Co2+ 1.92稀高氯酸Ag2+/Ag+Ag2++e-=Ag+ 1.93稀硝酸Ag2+/Ag+Ag2++e-=Ag+ 1.98稀硫酸Ag2+/Ag+Ag2++e-=Ag+ 2.0稀高氯酸S2O82-/SO42-S2O82-+2e-=2SO42- 2.01Bi5+/Bi3+BiO3-+2H++2e-=Bi3++H2O 2.03铋酸盐O3/O2-O3+2H++2e-=O2+H2O 2.076XeO3/Xe XeO3+6H++6e-=Xe+3H2O 2.1最全最实用电极电势表由xsm18倾情制作,转载请注明来源:/xsm18/home注释1:碱族和从钙开始的碱土元素均和水发生反应,其电极电势数值为理论计算值注释2:铈元素(Ce)属于镧系元素,有稳定的+3,+4价,+3价有很强的还原性,+4有很强的氧化性,该元素有很好的代表性。
标准电极电势表非常全-nb的电极电势

标准电极电势表非常全-nb的电极电势标准电极电势表非常全 nb 的电极电势在化学的世界里,标准电极电势表是一个极其重要的工具,它就像是一张地图,指引着我们在电化学的领域中探索和前行。
今天,咱们就来深入聊聊这张神秘而又实用的“地图”——标准电极电势表,特别是其中那些令人瞩目的“nb 的电极电势”。
首先,咱们得搞清楚啥是标准电极电势。
简单来说,标准电极电势就是在标准状态下(通常是指温度为 29815K,压强为 100kPa,溶液中各物质的浓度为 1mol/L),某一电极与标准氢电极组成原电池时所测得的电势差。
这个概念听起来可能有点复杂,但其实就是用来衡量一个电极在特定条件下得失电子的能力。
那标准电极电势表有啥用呢?这用处可大了去了!它可以帮助我们判断氧化还原反应进行的方向和限度。
比如说,如果一个氧化还原反应中,氧化剂的标准电极电势大于还原剂的标准电极电势,那么这个反应就能自发进行。
而且,通过标准电极电势表,我们还能计算出电池的电动势,从而了解电池的性能和能量转化效率。
接下来,咱们重点聊聊那些“nb 的电极电势”。
在标准电极电势表中,有一些电极电势的值特别突出,具有重要的意义。
比如说,氟气和氟离子组成的电极,其标准电极电势高达 287V,这意味着氟气具有极强的氧化性,是一种非常强大的氧化剂。
再比如,锂金属和锂离子组成的电极,其标准电极电势为-304V,这表明锂在电池领域有着独特的地位,因为它具有很低的电极电势,能够提供较高的电压。
这些“nb 的电极电势”在实际应用中发挥着关键作用。
以锂为例,由于其低电极电势的特性,锂离子电池在现代电子设备和电动汽车中得到了广泛的应用。
锂离子电池能够提供高能量密度,使得我们的手机、笔记本电脑等设备能够长时间运行,电动汽车也能够行驶更远的距离。
而氟气的强氧化性则在化学合成和工业生产中有重要用途。
它可以用于制备一些难以通过其他方法得到的化合物,提高生产效率和产品质量。
标准电极电势表中的数据并不是一成不变的。
(完整版)标准电极电势表(非常全)
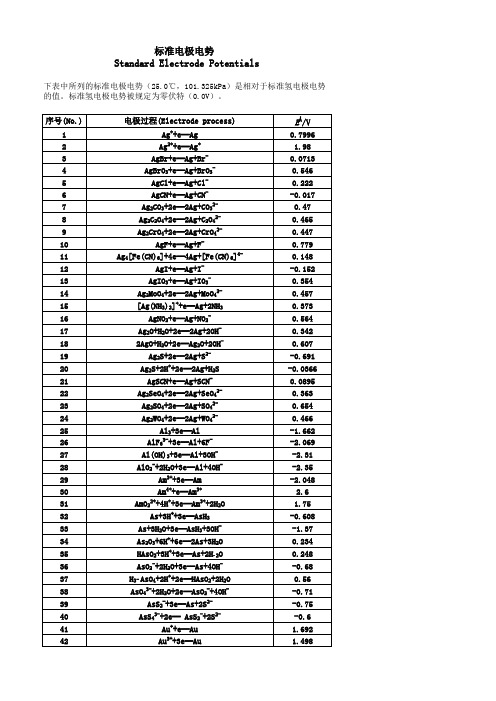
标准电极电势Standard Electrode Potentials下表中所列的标准电极电势(25.0℃,101.325kPa)是相对于标准氢电极电势的值。
标准氢电极电势被规定为零伏特(0.0V)。
序号(No.)电极过程(Electrode process)EÅ/V 1Ag++e═Ag0.79962Ag2++e═Ag+ 1.983AgBr+e═Ag+Br-0.07134AgBrO3+e═Ag+BrO3-0.5465AgCl+e═Ag+Cl-0.2226AgCN+e═Ag+CN--0.0177Ag2CO3+2e═2Ag+CO32-0.478Ag2C2O4+2e═2Ag+C2O42-0.4659Ag2CrO4+2e═2Ag+CrO42-0.44710AgF+e═Ag+F-0.77911Ag4[Fe(CN)6]+4e═4Ag+[Fe(CN)6]4-0.14812AgI+e═Ag+I--0.152 13AgIO3+e═Ag+IO3-0.35414Ag2MoO4+2e═2Ag+MoO42-0.45715[Ag(NH3)2]++e═Ag+2NH30.37316AgNO2+e═Ag+NO2-0.56417Ag2O+H2O+2e═2Ag+2OH-0.342182AgO+H2O+2e═Ag2O+2OH-0.60719Ag2S+2e═2Ag+S2--0.691 20Ag2S+2H++2e═2Ag+H2S-0.0366 21AgSCN+e═Ag+SCN-0.0895 22Ag2SeO4+2e═2Ag+SeO42-0.36323Ag2SO4+2e═2Ag+SO42-0.65424Ag2WO4+2e═2Ag+WO42-0.46625Al3+3e═Al-1.662 26AlF63-+3e═Al+6F--2.069 27Al(OH)3+3e═Al+3OH--2.3128AlO2-+2H2O+3e═Al+4OH--2.3529Am3++3e═Am-2.048 30Am4++e═Am3+ 2.631AmO22++4H++3e═Am3++2H2O 1.7532As+3H++3e═AsH3-0.608 33As+3H2O+3e═AsH3+3OH--1.3734As2O3+6H++6e═2As+3H2O0.23435HAsO2+3H++3e═As+2H2O0.24836AsO2-+2H2O+3e═As+4OH--0.6837H3AsO4+2H++2e═HAsO2+2H2O0.5638AsO43-+2H2O+2e═AsO2-+4OH--0.7139AsS2-+3e═As+2S2--0.7540AsS43-+2e═ AsS2-+2S2--0.641Au++e═Au 1.69242Au3++3e═Au 1.49843Au3++2e═Au+ 1.401 44AuBr2-+e═Au+2Br-0.959 45AuBr4-+3e═Au+4Br-0.854 46AuCl2-+e═Au+2Cl- 1.15 47AuCl4-+3e═Au+4Cl- 1.002 48AuI+e═Au+I-0.5 49Au(SCN)4-+3e═Au+4SCN-0.66 50Au(OH)3+3H++3e═Au+3H2O 1.45 51BF4-+3e═B+4F--1.04 52H2BO3-+H2O+3e═B+4OH--1.79 53B(OH)3+7H++8e═BH4-+3H2O-0.0481 54Ba2++2e═Ba-2.912 55Ba(OH)2+2e═Ba+2OH--2.99 56Be2++2e═Be-1.847 57Be2O32-+3H2O+4e═2Be+6OH--2.63 58Bi++e═Bi0.5 59Bi3++3e═Bi0.308 60BiCl4-+3e═Bi+4Cl-0.16 61BiOCl+2H++3e═Bi+Cl-+H2O0.16 62Bi2O3+3H2O+6e═2Bi+6OH--0.46 63Bi2O4+4H++2e═2BiO++2H2O 1.593 64Bi2O4+H2O+2e═ Bi2O3+2OH-0.56 65Br2(水溶液,aq)+2e═2Br- 1.087 66Br2(液体)+2e═2Br- 1.066 67BrO-+H2O+2e═Br-+2OH0.761 68BrO3-+6H++6e═Br-+3H2O 1.423 69BrO3-+3H2O+6e═Br-+6OH-0.61 702BrO3-+12H++10e═Br2+6H2O 1.482 71HBrO+H++2e═Br-+H2O 1.331 722HBrO+2H++2e═Br2(水溶液,aq)+2H2O 1.574 73CH3OH+2H++2e═CH4+H2O0.59 74HCHO+2H++2e═CH3OH0.19 75CH3COOH+2H++2e═CH3CHO+H2O-0.12 76(CN)2+2H++2e═2HCN0.373 77(CNS)2+2e═2CNS-0.77 78CO2+2H++2e═CO+H2O-0.12 79CO2+2H++2e═HCOOH-0.199 80Ca2++2e═Ca-2.868 81Ca(OH)2+2e═Ca+2OH--3.02 82Cd2++2e═Cd-0.403 83Cd2++2e═Cd(Hg)-0.352 84Cd(CN)42-+2e═Cd+4CN--1.09 85CdO+H2O+2e═Cd+2OH--0.783 86CdS+2e═Cd+S2--1.17 87CdSO4+2e═Cd+SO42--0.246 88Ce3++3e═Ce-2.336 89Ce3++3e═Ce(Hg)-1.437 90CeO2+4H++e═Ce3++2H2O 1.4 91Cl2(气体)+2e═2Cl- 1.35892ClO-+H2O+2e═Cl-+2OH-0.89 93HClO+H++2e═Cl-+H2O 1.482 942HClO+2H++2e═Cl2+2H2O 1.611 95ClO2-+2H2O+4e═Cl-+4OH-0.76 962ClO3-+12H++10e═Cl2+6H2O 1.47 97ClO3-+6H++6e═Cl-+3H2O 1.451 98ClO3-+3H2O+6e═Cl-+6OH-0.62 99ClO4-+8H++8e═Cl-+4H2O 1.38 1002ClO4-+16H++14e═Cl2+8H2O 1.39 101Cm3++3e═Cm-2.04 102Co2++2e═Co-0.28 103[Co(NH3)6]3++e═[Co(NH3)6]2+0.108 104[Co(NH3)6]2++2e═Co+6NH3-0.43 105Co(OH)2+2e═Co+2OH--0.73 106Co(OH)3+e═Co(OH)2+OH-0.17 107Cr2++2e═Cr-0.913 108Cr3++e═Cr2+-0.407 109Cr3++3e═Cr-0.744 110[Cr(CN)6]3-+e═[Cr(CN)6]4--1.28 111Cr(OH)3+3e═Cr+3OH--1.48 112Cr2O72-+14H++6e═2Cr3++7H2O 1.232 113CrO2-+2H2O+3e═Cr+4OH--1.2 114HCrO4-+7H++3e═Cr3++4H2O 1.35 115CrO42-+4H2O+3e═Cr(OH)3+5OH--0.13 116Cs++e═Cs-2.92 117Cu++e═Cu0.521 118Cu2++2e═Cu0.342 119Cu2++2e═Cu(Hg)0.345 120Cu2++Br-+e═CuBr0.66 121Cu2++Cl-+e═CuCl0.57 122Cu2++I-+e═CuI0.86 123Cu2++2CN-+e═[Cu(CN)2]- 1.103 124CuBr2-+e═Cu+2Br-0.05 125CuCl2-+e═Cu+2Cl-0.19 126CuI2-+e═Cu+2I-0 127Cu2O+H2O+2e═2Cu+2OH--0.36 128Cu(OH)2+2e═Cu+2OH--0.222 1292Cu(OH)2+2e═Cu2O+2OH-+H2O-0.08 130CuS+2e═Cu+S2--0.7 131CuSCN+e═Cu+SCN--0.27 132Dy2++2e═Dy-2.2 133Dy3++3e═Dy-2.295 134Er2++2e═Er-2 135Er3++3e═Er-2.331 136Es2++2e═Es-2.23 137Es3++3e═Es-1.91 138Eu2++2e═Eu-2.812 139Eu3++3e═Eu-1.991 140F2+2H++2e═2HF 3.053190IO3-+2H2O+4e═IO-+4OH-0.15 191IO3-+3H2O+6e═I-+6OH-0.26 1922IO3-+6H2O+10e═I2+12OH-0.21 193H5IO6+H++2e═IO3-+3H2O 1.601 194In++e═In-0.14 195In3++3e═In-0.338 196In(OH)3+3e═In+3OH--0.99 197Ir3++3e═Ir 1.156 198IrBr62-+e═ IrBr63-0.99 199IrCl62-+e═IrCl63-0.867 200K++e═K-2.931 201La3++3e═La-2.379 202La(OH)3+3e═La+3OH--2.9 203Li++e═Li-3.04 204Lr3++3e═Lr-1.96 205Lu3++3e═Lu-2.28 206Md2++2e═Md-2.4 207Md3++3e═Md-1.65 208Mg2++2e═Mg-2.372 209Mg(OH)2+2e═Mg+2OH--2.69 210Mn2++2e═Mn-1.185 211Mn3++3e═Mn 1.542 212MnO2+4H++2e═Mn2++2H2O 1.224 213MnO4-+4H++3e═MnO2+2H2O 1.679 214MnO4-+8H++5e═Mn2++4H2O 1.507 215MnO4-+2H2O+3e═MnO2+4OH-0.595 216Mn(OH)2+2e═Mn+2OH--1.56 217Mo3++3e═Mo-0.2 218MoO42-+4H2O+6e═Mo+8OH--1.05 219N2+2H2O+6H++6e═2NH4OH0.092 2202NH3OH++H++2e═N2H5++2H2O 1.42 2212NO+H2O+2e═N2O+2OH-0.76 2222HNO2+4H++4e═N2O+3H2O 1.297 223NO3-+3H++2e═HNO2+H2O0.934 224NO3-+H2O+2e═NO2-+2OH-0.01 2252NO3-+2H2O+2e═N2O4+4OH--0.85 226Na++e═Na-2.713 227Nb3++3e═Nb-1.099 228NbO2+4H++4e═Nb+2H2O-0.69 229Nb2O5+10H++10e═2Nb+5H2O-0.644 230Nd2++2e═Nd-2.1 231Nd3++3e═Nd-2.323 232Ni2++2e═Ni-0.257 233NiCO3+2e═Ni+CO32--0.45 234Ni(OH)2+2e═Ni+2OH--0.72 235NiO2+4H++2e═Ni2++2H2O 1.678 236No2++2e═No-2.5 237No3++3e═No-1.2 238Np3++3e═Np-1.856239NpO2+H2O+H++e═Np(OH)3-0.962 240O2+4H++4e═2H2O 1.229 241O2+2H2O+4e═4OH-0.401 242O3+H2O+2e═O2+2OH- 1.24 243Os2++2e═Os0.85 244OsCl63-+e═Os2++6Cl-0.4 245OsO2+2H2O+4e═Os+4OH--0.15 246OsO4+8H++8e═Os+4H2O0.838 247OsO4+4H++4e═OsO2+2H2O 1.02 248P+3H2O+3e═PH3(g)+3OH--0.87 249H2PO2-+e═P+2OH--1.82 250H3PO3+2H++2e═H3PO2+H2O-0.499 251H3PO3+3H++3e═P+3H2O-0.454 252H3PO4+2H++2e═H3PO3+H2O--0.276 253PO43-+2H2O+2e═HPO32-+3OH--1.05 254Pa3++3e═Pa-1.34 255Pa4++4e═Pa-1.49 256Pb2++2e═Pb-0.126 257Pb2++2e═Pb(Hg)-0.121 258PbBr2+2e═Pb+2Br--0.284 259PbCl2+2e═Pb+2Cl--0.268 260PbCO3+2e═Pb+CO32--0.506 261PbF2+2e═Pb+2F--0.344 262PbI2+2e═Pb+2I--0.365 263PbO+H2O+2e═Pb+2OH--0.58 264PbO+4H++2e═Pb+H2O0.25 265PbO2+4H++2e═Pb2+2H2O 1.455 266HPbO2-+H2O+2e═Pb+3OH--0.537 267PbO2+SO42-+4H++2e═PbSO4+2H2O 1.691 268PbSO4+2e═Pb+SO42--0.359 269Pd2++2e═Pd0.915 270PdBr42-+2e═Pd+4Br-0.6 271PdO2+H2O+2e═PdO+2OH-0.73 272Pd(OH)2+2e═Pd+2OH-0.07 273Pm2++2e═Pm-2.2 274Pm3++3e═Pm-2.3 275Po4++4e═Po0.76 276Pr2++2e═Pr-2 277Pr3++3e═Pr-2.353 278Pt2++2e═Pt 1.18 279[PtCl6]2-+2e═[PtCl4]2-+2Cl-0.68 280Pt(OH)2+2e═Pt+2OH-0.14 281PtO2+4H++4e═Pt+2H2O1 282PtS+2e═Pt+S2--0.83 283Pu3++3e═Pu-2.031 284Pu5++e═Pu4+ 1.099 285Ra2++2e═Ra-2.8 286Rb++e═Rb-2.98 287Re3++3e═Re0.3337Th4++4e═Th-1.899 338Ti2++2e═Ti-1.63 339Ti3++3e═Ti-1.37 340TiO2+4H++2e═Ti2++2H2O-0.502 341TiO2++2H++e═Ti3++H2O0.1 342Tl++e═Tl-0.336 343Tl3++3e═Tl0.741 344Tl3++Cl-+2e═TlCl 1.36 345TlBr+e═Tl+Br--0.658 346TlCl+e═Tl+Cl--0.557 347TlI+e═Tl+I--0.752 348Tl2O3+3H2O+4e═2Tl++6OH-0.02 349TlOH+e═Tl+OH--0.34 350Tl2SO4+2e═2Tl+SO42--0.436 351Tm2++2e═Tm-2.4 352Tm3++3e═Tm-2.319 353U3++3e═U-1.798 354UO2+4H++4e═U+2H2O-1.4 355UO2++4H++e═U4++2H2O0.612 356UO22++4H++6e═U+2H2O-1.444 357V2++2e═V-1.175 358VO2++2H++e═V3++H2O0.337 359VO2++2H++e═VO2++H2O0.991 360VO2++4H++2e═V3++2H2O0.668 361V2O5+10H++10e═2V+5H2O-0.242 362W3++3e═W0.1 363WO3+6H++6e═W+3H2O-0.09 364W2O5+2H++2e═2WO2+H2O-0.031 365Y3++3e═Y-2.372 366Yb2++2e═Yb-2.76 367Yb3++3e═Yb-2.19 368Zn2++2e═Zn-0.7618 369Zn2++2e═Zn(Hg)-0.7628 370Zn(OH)2+2e═Zn+2OH--1.249 371ZnS+2e═Zn+S2--1.4 372ZnSO4+2e═Zn(Hg)+SO42--0.799。
标准电极电势表(全)
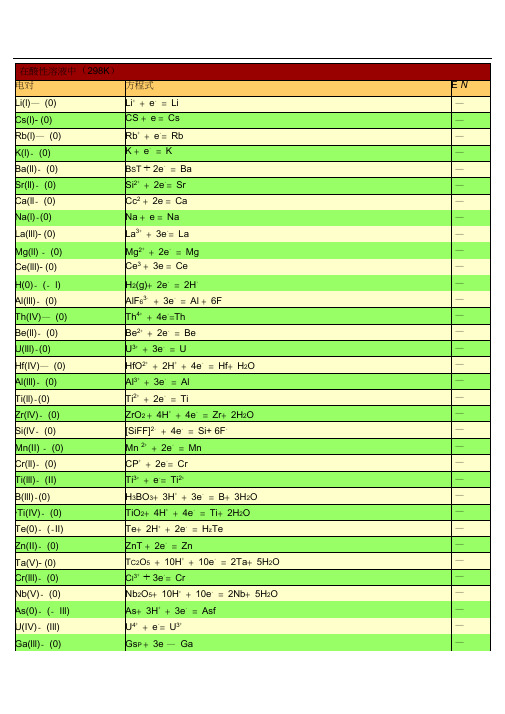
电对
方程式
EN
Li(l)—(0)
Li++e-=Li
—
Cs(l)-(0)
CS+e=Cs
—
Rb(l)—(0)
Rb++e-=Rb
—
K(l)-(0)
K+e-=K
—
Ba(ll)-(0)
BsT+2e-=Ba
—
Sr(ll)-(0)
Si2++2e-=Sr
—
Ca(ll-(0)
Cc2+2e=Ca
TeQ+4H++4e—=Te+2H2O
U(V)—(IV)
UQ++4H++e—=U4++2H2O
**Hg(II)—(I)
2HgC2+2e—=Hg?Cb+2C「
Pt(IV)—(II)
[PtC6]2-+2e—=[PtC4]2-+2C「
O(0)—(—I)
O2+2H+2e=H2O2
Pt(II)—(0)
[PtCl4]2-+2e—=Pt+4C「
—
ln (lll)-(0)
In3++3e-=In
—
Tl(l)-(0)
Tl++e-=Tl
—
Co(ll)- (0)
Cc?+2e=Co
—
P(V)-(lll)
H3PO4+2H++2e-=H3PO3+H2O
—
Pb(ll)-(0)
PbC2+2e-=Pb+2C-
标准电极电势表全.docx

在酸性溶液中 (298K)电对Li(I)- (0)Cs(I)-(0) Rb(I)-(0)K(I)- (0)Ba(II)- (0) Sr(II)-(0) Ca(II)- (0) Na(I)-(0)La(III)- (0) Mg(II)-(0) Ce(III)-(0) H(0)-(- I) Al(III)- (0) Th(IV)-(0) Be(II)- (0)U(III)-(0)Hf(IV)-(0)Al(III)- (0)Ti(II)-(0)Zr(IV)- (0) Si(IV)- (0) Mn(II) -(0) Cr(II)-(0)Ti(III)- (II)B(III)-(0)*T i(IV)-(0) Te(0)- (-II) Zn(II)- (0) Ta(V)- (0) Cr(III)- (0) Nb(V)-(0) As(0)- (-III) U(IV)-(III) Ga(III)-(0)方程式 E /V Li++ e-=Li-+-= Cs-Cs +eRb++e-= Rb-K++e-=K-Ba2++ 2e-=Ba-Sr2++2e-= Sr-Ca2++ 2e-= Ca-Na++e-=Na-La3++3e-= La-Mg2++2e-=Mg-Ce3++ 3e-=Ce-2-=2H--H (g)+2e63-+3e-=Al+6F--AlFTh4++ 4e-=Th-Be2++ 2e-=Be-U3++3e-=U-HfO2++2H++ 4e-=Hf+ H2O-Al3++3e-= Al-Ti2++2e-=Ti-2++4e-=Zr+ 2H2O-ZrO+ 4H62-+4e-=Si+6F--[SiF ]Mn 2++2e-=Mn-Cr2++2e-= Cr-Ti3++e-=Ti2+=B+3H2-33++3e-O-H BO +3H2++ 4e-=Ti+2H2O-TiO +4H++2e-=H2-Te+2H TeZn2++ 2e-= Zn-25++10e-=2Ta+5H2-Ta O+10H OCr3++3e-= Cr-Nb2O5+l0H++10e-=2Nb+ 5H2 O-As+3H++3e-=AsH3-U4++e-=U3+-Ga3++ 3e-=Ga-P(I)- (0)P(III)-(I)*C(IV)- (III) Fe(II)-(0) Cr(III)- (II) Cd(II)- (0) Se(0)- (-II) Pb(II)- (0) Eu(III)-(II) Pb(II)- (0) In(III)- (0) Tl(I)-(0)Co(II)- (0) P(V)-(III) Pb(II)- (0) Ni (II)- (0) V(III)-(II) Ge(IV)-(0) Ag(I)-(0) Sn(II)- (0) Pb(II)- (0)*C(IV)- (II) P(0)-(- III) Hg(I)- (0) Fe(III)-(0) H(I)- (0) Ag(I)-(0) S -(II)*T i(IV)-(III) S(0)-(- II) Sn(IV)-(II) Sb(III)-(0) Cu(II)- (I) Bi(III)-(0) S(VI)-(IV) Sb(III)-(0)32+-=P+ 2H2O-H PO +H33++2e-=H32+2-H PO +2H PO H O++2e-= H2 2 4-2CO+2H C OFe2++2e-= Fe-Cr3++e-=Cr2+-Cd2++ 2e-=Cd-++ 2e-=H2-Se+2H Se(aq)2---=Pb+2IPbI +2eEu3+-+-+ e=Eu24-= Pb+SO42--PbSO+2eIn3++3e-= In-+-=Tl-Tl + eCo2++ 2e-=Co-H3PO4+2H++2e-=H3PO3+ H2O-PbCl2+2e-=Pb+2Cl--Ni2++2e-= Ni-V3++e-=V2 +-23++ 4e-=Ge+ 3H2O-H GeO+4HAgI+ e-=Ag+I--Sn2++ 2e-= Sn-Pb2++ 2e-=Pb-2++2e-=CO+H2-CO (g)+ 2H OP(white)+ 3H++3e-=PH3(g)-Hg2 I2+ 2e-=2Hg+2I--Fe3++3e-= Fe-2H++2e-= H2--AgBr+ e =Ag+BrS4O62-+ 2e-=2S2O32-TiO2++2H++e-=Ti3++H2OS+++2e-=H2S(aq)2H4+-2+Sn+ 2e = Sn23++ 6e-=2Sb+3H2Sb O +6H OCu2++e-=Cu+++3e-= Bi+Cl-+H2BiOCl+2H OSO42-+4H++ 2e-=H2SO3+H2OSbO++2H++3e-= Sb+H2O-(0) -=Ag + Cl-Ag(I)AgCl +e-2++3e -=As + 2H 2OAs(III)(0) HAsO +3HHg(I)- (0)22-= 2Hg +2Cl-( 饱和KCl)Hg Cl +2eBi(III)- (0)BiO ++ 2H + +3e -=Bi + H 2OU(VI)-(IV)22++4H ++2e -=U 4++2H 2UOO- (III) 2HCNO +2H++2e-= (CN)2+ 2C(IV)2H OV(IV)-(III)2+ +2H + +e - =V 3+ +H2VOO-2 +-+ 2e =CuCu(II)(0)Cu--+-(0)4 +8H +7e =Re +4H 2ORe(VII) ReO- (0) 24-= 2Ag +CrO 42-Ag(I)Ag CrO +2e- 2 3 ++ 4e -=S +3H 2OS(IV) (0)H SO +4H-(0)++e -= CuCu(I)Cu=2I -I(0) - -I) 2-( I +2e I(0)- (-I) I 3 -+ 2e - =3I -As(V)- (III) H 3AsO 4 +2H + +2e -= HAsO 2+2H 2O Sb(V)- (III) Sb 2O 5+6H ++ 4e - =2SbO ++ 3H 2O Te(IV)-(0) TeO 2+ 4H + +4e -=Te +2H 2OU(V)-(IV)UO 2++4H ++e -=U4++2H 2O**H g(II)- (I)2HgCl + 2e-=Hg 2Cl 2+ 2Cl-Pt(IV)- (II) 6 2-+ 2e -=[PtCl 4 ]2-+ 2Cl -[PtCl ] + +2e - =H 2 2 O(0)-(-I)2O +2H OPt(II)-(0) 4 2-+ 2e-=Pt +4Cl -[PtCl ]* S e(IV)-(0)H 2SeO 3+4H + +4e -= Se +3H 2O Fe(III)-(II)Fe 3++e-=Fe 2+-(0) 22++2e -=2HgHg(I)Hg-(0) ++e -= AgAg(I)Ag- 4++8e -= Os +4H 2Os(VIII) (0) OsO +8HO-3-+ 4H ++2e -=N 24+ 2 N(V) (IV) 2NOO 2H O -(0)2++ 2e -=HgHg(II)HgSi(IV)- (0)2++4e -=Si +2H 2(quartz)SiO + 4HO-(I)2++ I -+e -= CuICu(II) Cu+4e -=H 2-(I)2 + 2 2+2N(III) 2HNO + 4H N O 2H OHg(II)- (I) 2Hg 2+ +2e -= Hg 22+N(V)-(III) 3 -+3H + +2e -= HNO 2+ 2 NOH O Pd(II)- (0) Pd 2++ 2e -=PdN(V)-(II)NO 3 -+4H ++3e -= NO + 2H 2ON(III)-(II)2 + +e -=NO +H 2 OHNO +HI(I)-(-I) HIO +H + +2e - =I -+H 2 OV(V)-(IV)2+ +2H + +e - =VO 2++H 2VOO-++-2++ 3H 24+2H +e =VOV(V) (IV)V(OH)O-(0)4-+3e -= Au + 4Cl -Au(III)[AuCl ] + +2e -= TeO 2+ 2- (IV)66Te(VI) H TeO +2H 4H O-(II)2 4+ +4e - =2NO +2H 2 N(IV) N O +4HO-2 4+-(III)2H +2e =2HNO 2N(IV) N O +- --+--3 +6H+6e=I +3H 2I(V) (I) IOOBr(0)-(-I) 2- =2Br-Br (aq)+2eSe(VI)-(IV)42-+ 4H ++2e -= H 23+ 2 SeOSeO H O-- +-=ClO 2+2(IV) 3 +2H+ eCl(V)ClOH O - (0)2+ +2e -= PtPt(II)PtCl(VII)-(V) ClO 4- +2H ++ 2e -= ClO 3- +H 2OI(V)- (0) 2IO 3- +12H + +10e - =I 2+6H 2OCl(V)-(III) - +3H ++ 2e -= HClO +H 2O ClO 32 Mn(IV)-(II)++ 2e -=Mn 2++2HMnO 2+4H2O--II) 2++4e -=2H 2O(0) (O +4HOTl(III)- (I) T13++ 2e -= Tl +Cl(IV)- (III)2 + +e -=HClO 2 ClO +H +4e - =N 2N(III)-(I)2+ +22HNO + 4HO 3H O ** C r(VI)- (III)Cr 2O 72- +14H + +6e -= 2Cr 3 ++ 7H 2O Br(I)-(- I)HBrO +H ++ 2e -=Br -+H 2OCr(VI)-(III)HCrO 4- +7H ++3e -= Cr 3++4H 2OCl(0)-(-I)Cl 2(g)+2e - =2Cl -Cl(VII)-(- I)4- +8H + + 8e -= Cl -+ 4H 2OClO--+8H+ - = 1/2Cl 2+2(0)4+ 7eCl(VII) ClO4H OAu(III)-(I) Au 3++ 2e - =Au +- --+--+3H 2I)3 +6H+ 6e =BrBr(V) ( BrOOI(I) - (0)++2e -= I 2+22HIO +2H2H O-+6H +--Cl(V)-(-I) 3+ 6e= Cl + 3H 2OClOPb(IV)-(II)2++2e -= Pb 2++2H 2PbO +4H O- (0) 3- +6H + + 5e -= 1/2Cl 2+ 2Cl(V)ClO+ 2e - =Cl - +H 23H O- -I)+Cl(I) ( HClO +HO Br(V)-(0) BrO 3- +6H ++ 5e -=l/2Br 2+3H 2O Au(III)-(0)Au 3++ 3e - =AuMn(VII)- (II) MnO -+ +5e - = Mn 2 ++4H 2O4 +8HMn(III) -(II) Mn 3++e-= Mn 2+Cl(III)- (-I)2++ 4e -=Cl -+2H 2OHClO +3HBr(I) - (0)++ e -=l/2Br 2 (aq) + 2HBrO +HH ON(II) -(I)2NO +++2e -=N 2+ 22HO H O-(V)5 6++ 2e -=IO 3-+ 3H 2OI(VII) H IO +H- (0)++ e -=1/2Cl 2+ 2Cl(I)HClO +HH O2+-=HClO +H 2Cl(III)- (I)+ 2eHClO +2HO2+-+Ni(IV)-(II)4H +2e=Ni 2+2H 2ONiO+--+ +3e - = MnO 2+ 2Mn(VII) (IV)MnO 4 +4H2H O-242-+4H++ 2e -= PbSO 4+2 Pb(IV) (II) PbO +SO2H O-(0)++e -=AuAu(I)AuCe(IV)-(III) Ce 4++ e -=Ce 3+N(I)- (0)N 2O +2H ++ 2e - =N 2+ H 2OO( - - - H 2O 2++ +2e -=2HI) ( II)2H 2O-3 +-+-(II)+ e=Co 2·1H 2SO 4)Co(III) Co(2mol LAg(II)- (I)Ag 2++ e -=Ag +2 2- + - 2-S(VII)- (VI) 82e=2SO4S O +2e - =O 2+O(0)-(-II) 3 + 2O +2H H OO(II)-(-II)2++4e -= H 2+-F O +2HO 2FFe(VI)-(III)42-+ 8H ++3e -= Fe 3++4H 2FeO+ 2e - =H 2OO(0)-(-II)+O(g)+2H OF(0)-(- I)F 2+2e - =2F -F 2+2H ++ 2e - =2HF2 在碱性溶液中 (298K)电对方程式E / V- (0) 2-=Ca + 2OH --Ca(II)Ca(OH)+ 2e-(0) 2- =Ba + 2OH-- Ba(II)Ba(OH)+ 2e-(0)3-= La +3OH--La(III)La(OH)+3eSr(II)-(0) 2 2-= Sr +2OH -+8H 2-Sr(OH) ·8H O + 2eOMg(II)-(0)2-=Mg +2OH --Mg(OH)+2e- =2Be +6OH --(0)2 32-+ 3H 2 +-Be(II) Be OO 4eHf(IV) -(0)2 2- =Hf + 4OH - -HfO(OH) +H O +4e--- -(0) 232= Zr +4OHZr(IV)H ZrO +H O +4e=Al + OH-Al(III)- (0) 23-+ H 2+--H AlOO 3e-2----(0)2 +e=P +2OHP(I) H PO-2- +H 2+---(0)33e =B +4OHB(III) H BO O- (0)32-+2H 2 + 3e -= P + 5OH - -P(III) HPO O- (0)32-+ 3H 2 + - =Si +6OH --Si(IV) SiO O 4e -= H 2 - +3OH --(I)32-+2H 2 + 2e2-P(III) HPO O POMn(II) -(0) 2 - =Mn + 2OH --Mn(OH)+2eCr(III)- (0)3-= Cr +3OH--Cr(OH) +3e*-42 ----(0)+2e = Zn +4CNZn(II) [Zn(CN) ]-2---(0)=Zn +2OHZn(II) Zn(OH) + 2e2-+H 2+---Ga(III)-(0)3 2e = Ga + 4OHH GaOO- (0)22- +2H 2 + 2e -= Zn +4OH --Zn(II) ZnO O- 2 -+ 2H 2 + - =Cr +4OH --Cr(III)(0)CrOO3eTe(0)- (-I) Te + 2e -=Te2-- P(V)-(III)3 -+ 2H+ - =HPO 2-+3OH--PO 4 2O 2e3*Zn(II)-(0) [Zn(NH 3) 4] 2+ +2e-=Zn +4NH-3*W(VI)-(0)WO4 2-+4H + -=W +8OH--2O6e*Ge(IV)- (0)HGeO 3 -+ 2H 2O + 4e -=Ge +5OH ---(II)6 2-+2e -= HSnO 2-+H 2+--Sn(IV) [Sn(OH) ]O 3OHS(VI)-(IV) 42-+H 2+-=SO 32-+2OH--SOO 2eSe(0)- (-II)- 2--Se + 2e =Se-=Sn + 3OH -Sn(II)- (0)2-+H 2+-HSnOO2eP(0)-(- III)2-=PH 3+--P +3H O +3e(g)3OHN(V)-(IV) 2NO 3 -+2H 2 O +2e - =N 2O 4+4OH --H(I)- (0) 2H 2O +2e -=H 2+2OH --Cd(II)- (0) 2 -=Cd(Hg)+2OH --Cd(OH)+ 2eCo(II)- (0) 2 - =Co + 2OH --Co(OH)+ 2eNi(II)-(0)2-= Ni +2OH--Ni(OH) +2eAs(V)- (III)43-+2H 2 +-=AsO 2 -+4OH--AsOO2e- (0)2 -=2Ag +S2--Ag(I) Ag S + 2e- (0) 2 -+ 2H 2 + - =As + 4OH--As(III) AsOO 3e- (0)2-+ 2H 2 + - =Sb + 4OH --Sb(III) SbO O 3e =ReO 2+*-4 -+ 2H 2+- -- Re(VII)(IV)ReO -+ H 2 O 3e 4OH*-(III)3+-=SbO 2-+2OH --Sb(V) SbOO2e =Re + 8OH --4-+ 4H 2+ --Re(VII) (0)ReOO 7e 32- +6OH -*S(IV)- (II) 2SO 3 2-+3H 2+-=S 2-O 4eOTe(IV)-(0) TeO 3 2-+3H +4e -= Te +6OH --2OFe(III)-(II)3 -=Fe(OH)2+-Fe(OH)+ eOHS(0)-(- II) S +2e - =S 2-- (0)2 3 2 -= 2Bi + 6OH-Bi(III) Bi O +3H O +6e-+H 2+ --N(III)-(II)2 e =NO +2OHNOO*Co(II)-C(0)3 62++2e -=Co +6NH 3[Co(NH ) ]=Se +6OH--(0)32-+3H 2+-Se(IV) SeOO 4e- (0) 2 2 -=2Cu +2OH-Cu(I)Cu O +H O +2eTl(I)-(0)--Tl(OH)+ e =Tl + OH*-2 ---(0)+e = Ag +2CNAg(I) [Ag(CN) ]- (0)2 - =Cu + 2OH -Cu(II) Cu(OH)+ 2e- (III)42-+4H 2+-=Cr(OH)3+-Cr(VI) CrOO3e5OH*- (0)3 2++ e -=Cu +2NH 3Cu(I) [Cu(NH ) ] - =HO 2-+ OH -- -I)22O(0) ( O + H O +2e- (0)-=Ag + CN -Ag(I) AgCN +eN(V)-(III) NO 3-+H 2O + 2e -=NO 2-+2OH --(IV) SeO 4 2-+H + -= SeO 2-+ 2OH -Se(VI) 2O 2e 3- (0)Pd(OH)2+ - =Pd + 2OH -Pd(II) 2e4 2--2-S(II,V)-(II) 6+2e=2S2 3S OOHg(II)- (0)2 -=Hg +2OH-HgO + H O +2e- (II)3 63++e -= [Co(NH 3) 6 ]2 +Co(III) [Co(NH ) ]- (0) 2 -= Pt +2OH-Pt(II) Pt(OH) +2e- (II)3-=Co(OH)2 +-Co(III) Co(OH)+ eOH-(II)PbO 2+H 2O +2e -= PbO +2OH -Pb(IV) =I - +6OH -- -I)-+ 3H 2+-I(V) ( IO 3 3- +H 2 O 6e =ClO 2- +2OH --(III)+-Cl(V) ClO O 2e- (0)2 2-= 2Ag +2OH -Ag(I) Ag O +H O +2eFe(III)-(II)63- +e -=[Fe(CN)6 4-[Fe(CN) ]]-- +H 2 +-- -(V) 4 2e =ClO 3+2OH Cl(VII) ClO O*- (0) 3 2 ] ++ e -=Ag +2NH 3Ag(I) [Ag(NH )- - II) 2 2 - =4OH -O(0) ( O + 2H O +4eI(I) - ( - I) - +H 2 + - =I - +2OH -IO O 2e* N i(IV)-(II)NiO 2+2H 2O +2e - =Ni(OH)2+ 2OH -Mn(VII)- (VI) MnO 4- +e -= MnO 42-Mn(VII)- (IV)MnO 4-+2H 2 +-= MnO 2 +-O 3e4OHMn(VI) -(IV)2-+ 2H 2+-=MnO 2+-MnO 4 O 2e4OHAg(II)- (I)2AgO +H 2O + 2e - =Ag 2O +2OH ---------------- -I)3-+ 3H 2 +-=Br - +6OH-Br(V) ( BrOO 6e--- +3H 2 + ---( I)3 6e = Cl + 6OHCl(V) ClOO-- +H 2 +-- -(I) 2 2e =ClO +2OHCl(III)ClOO-3----(V) 62 +2e= IO 3+3OHI(VII)H IO- - I)2-+2H 2+ 4e -= Cl -+ 4OH -Cl(III) ( ClOOBr(I) - -I)-+H 2 +-= Br - +2OH-( BrO O 2e- -I)- +H 2+-= Cl -+ 2OH -Cl(I) ( ClOO 2e*-2--(III)= ClO 2Cl(IV) ClO (g)+e-=O 2- -II) 3 2+-O(0) ( O + H O +2e2OH。
标准电极电势表非常全-nb的电极电势

标准电极电势表非常全-nb的电极电势标准电极电势表非常全 nb 的电极电势在化学的世界里,标准电极电势表就像是一张藏宝图,指引着我们探索各种化学反应的可能性和方向。
它是一个极其重要的工具,对于理解和预测氧化还原反应的发生、进行化学电池的设计以及许多其他化学过程都有着不可替代的作用。
首先,咱们来聊聊什么是标准电极电势。
简单来说,标准电极电势就是在标准状态下(通常是指温度为 298K,压强为 100kPa,溶液中离子浓度为 1mol/L 等特定条件),某一电极与标准氢电极组成原电池时所测得的电势差。
这个概念听起来可能有点抽象,但想象一下,它就像是给每个电极赋予了一个“能量值”,通过比较这些“能量值”,我们就能知道在特定条件下,哪个电极更容易失去电子发生氧化反应,哪个电极更容易得到电子发生还原反应。
标准电极电势表中包含了各种各样的电极。
比如说,常见的金属电极,像铜、锌、铁等。
以铜锌原电池为例,锌电极的标准电极电势相对较低,所以在这个原电池中,锌更容易失去电子,发生氧化反应;而铜电极的标准电极电势较高,更容易得到电子,发生还原反应。
正是由于这种电势差的存在,电子才会从锌电极流向铜电极,从而产生电流,实现了化学能向电能的转化。
除了金属电极,还有一些非金属电极也在标准电极电势表中占有一席之地。
比如氯电极、氧电极等。
这些非金属电极的标准电极电势对于理解一些涉及到非金属元素的氧化还原反应非常关键。
那么,标准电极电势表到底有什么用呢?首先,它可以帮助我们判断一个氧化还原反应是否能够自发进行。
如果一个氧化还原反应中,氧化剂所对应的电极电势大于还原剂所对应的电极电势,那么这个反应在给定条件下就能够自发进行。
这就像是一场“能量竞赛”,高电势的一方总是更有优势,能够推动反应向前进行。
其次,标准电极电势表对于设计化学电池至关重要。
在设计电池时,我们需要选择合适的电极材料,使得它们之间的电势差足够大,从而能够产生较大的电压和电流。
标准电极电势表
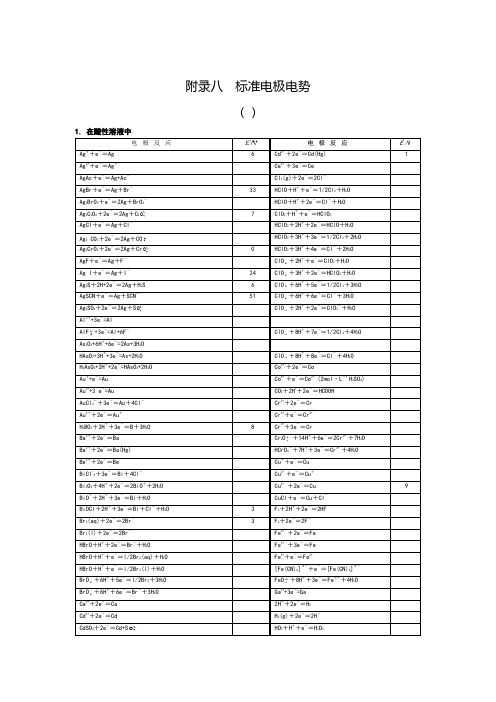
Ni(OH)2+2e-=Ni+2OH-
Cr +2H2O+3e-=Cr+4OH-
NiO2+2H2O+2e-=Ni(OH)2+2OH-
Cr +4H2O+3e-=Cr(OH)3+5OH-
O2+H2O+2e-=HO2-+OH-
Cr(OH)3+3e-=Cr+3OH-
51
ClO +6H++6e-=Cl-+3H2O
Ag2SO4+2e-=2Ag+S
ClO +2H++2e-=ClO3-+H2O
Al3++3e-=Al
AlF +3e-=Al+6F-
ClO +8H++7e-=1/2Cl2+4H2O
As2O3+6H++6e-=2As+3H2O
HAsO2+3H++3e-=As+2H2O
Ba(OH)2+2e-=Ba+2OH-
IO3-+2H2O+4e-=IO-+4OH-
Be2 +3H2O+4e-=2Be+6OH-
IO3-+3H2O+6e-=I-+6OH-
Bi2O3+3H2O+6e-=2Bi+6OH-
Ir2O3+3H2O+6e-=2Ir+6OH-
BrO-+H2O+2e-=Br-+2OH-
O2+2H2O+2e-=H2O2+2OH-
Cu2+2CN-+e-=[Cu(CN)2]-
O2+2H2O+4e-=4OH-
[Cu(CN)2]-+e-=Cu+2CN-
O3+H2O+2e-=O2+2OH-
Cu2O+H2O+2e-=2Cu+2OH-
HO2-+H2O+2e-=3OH-
电极反应
E?/V
电极反应
E?/V?
3
标准电极电势表非常全-nb的电极电势

标准电极电势表非常全-nb的电极电势标准电极电势表非常全 nb 的电极电势在化学的领域中,标准电极电势表是一项极其重要的工具。
它为我们理解和研究各种氧化还原反应提供了关键的参考依据。
今天,咱们就来深入探讨一下这个“非常全 nb 的电极电势”。
首先,咱们得搞清楚啥是电极电势。
简单来说,电极电势就是在特定条件下,一个电极与标准氢电极相比所具有的电势差。
这就好比在一场比赛中,每个选手都有自己的得分,而标准氢电极就像是那个基准分,其他电极的电势就是相对于这个基准分的差值。
那标准电极电势表到底有啥用呢?这用处可大了去了!它能帮助我们判断氧化还原反应的方向。
比如说,如果一个氧化还原反应中,氧化剂对应的电极电势高于还原剂对应的电极电势,那么这个反应就能自发进行。
就好像一个强大的选手总能战胜相对弱小的对手一样。
而且,通过标准电极电势表,我们还能计算出电池的电动势。
电池的电动势对于电池的性能和应用可是至关重要的。
知道了电动势,我们就能更好地设计和优化电池,让它们在各种设备中发挥更大的作用。
再来说说这个“非常全”的标准电极电势表。
它涵盖了各种各样的元素和化合物的电极电势数据。
从常见的金属元素,像铁、铜、锌,到一些不太常见但在特定领域非常重要的元素,都能在这个表中找到它们对应的电极电势。
比如说,铜离子和铜单质之间的电极电势,在很多涉及铜的化学反应和工业过程中都有着重要的意义。
通过标准电极电势表,我们能清楚地知道在什么条件下,铜会被氧化成铜离子,或者铜离子会被还原成铜单质。
再比如,对于一些复杂的有机化合物,标准电极电势表也能提供它们在特定条件下的电极电势信息。
这对于研究有机化学反应的机理和开发新的有机合成方法都有着不可或缺的作用。
不过,要使用标准电极电势表,还得注意一些问题。
首先,这些数据都是在标准条件下测定的,也就是温度为 298K、压力为 100kPa、溶液浓度为 1mol/L 等等。
但在实际情况中,条件往往会有所不同,这时候就需要根据能斯特方程对电极电势进行修正。
最全最实用的电极电势表

最全最实用的电极电势表新年快到了想写一篇化学方面的文章作为总结吧,但是要查很多资料,事情也多,拖到现在。
其实这个电极电势,标准电极电势表,我读化学的时候就比较感兴趣,因为可以用它来判断元素和化合物在标准状况下氧化性,还原性的强弱,当时有些地方是不懂的,比如g,s都是什么意思,那个氟的标准电极电势是怎么来的,老师没有多讲,只是让我们记住常用的氧化剂,还原剂的电极电势数值就行了。
电极电势表,许多化学书,包括网上,有很多的,当然数据来源不同,数值有差别也是正常的,不能说谁对谁错。
我自己动手做个电极电势表,我的目的是实用,元素周期表118个元素,化合物更是成千上万,我们不可能一个一个去记住,知道常见的即可;有些数据化学家那里也是没有的。
另外既然标题有这个“最”字,就要满足学生,以及化学爱好者的愿望,比如目前最强的氧化剂是什么,最强的还原剂是什么,最实用的氧化剂是什么,等等;对于有异议的给予说明。
我列出的电极电势表将去除不常用的氧化剂和还原剂;对于零度以下不能存在的不在列出,比如二氟化二氧,虽然它在零下100度就有极强的氧化能力,如:在零下100度将钚迅速氧化到+6价,而氟,三氟化氯常温,甚至加热也不能将钚氧化到+6价氟只能将钚氧化到+4价,+6价需要700摄氏度,用强紫外线照射才能发生反应;将氙氧化到+6价,氟需要加压加热。
但它在零下95度就会显著分解,零下57度迅速分解完。
大家只要知道它即使在极低温下氧化性也比氟强即可关于自由基,只列出羟基自由基OH-,其他象OF,XeF,KrF自由基,这些都属于很少见,瞬间存在的东西,这几个自由基的氧化性以KrF最强,XeF最弱,我看到有些化学书籍上说XeF自由基的电极电势数值为3.4,这个数值应该是估计值,XeF 在普通条件下是不存在的,只是在加热或者强光照射合成二氟化氙,四氟化氙,六氟化氙的时候瞬间存在。
羟基自由基这个是常见的自由基,水溶液里就有。
如果把XeF列上,那么氦离子也可以列上。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
最全最实用的电极电势表新年快到了想写一篇化学方面的文章作为总结吧,但是要查很多资料,事情也多,拖到现在。
其实这个电极电势,标准电极电势表,我读化学的时候就比较感兴趣,因为可以用它来判断元素和化合物在标准状况下氧化性,还原性的强弱,当时有些地方是不懂的,比如g,s都是什么意思,那个氟的标准电极电势是怎么来的,老师没有多讲,只是让我们记住常用的氧化剂,还原剂的电极电势数值就行了。
电极电势表,许多化学书,包括网上,有很多的,当然数据来源不同,数值有差别也是正常的,不能说谁对谁错。
我自己动手做个电极电势表,我的目的是实用,元素周期表118个元素,化合物更是成千上万,我们不可能一个一个去记住,知道常见的即可;有些数据化学家那里也是没有的。
另外既然标题有这个“最”字,就要满足学生,以及化学爱好者的愿望,比如目前最强的氧化剂是什么,最强的还原剂是什么,最实用的氧化剂是什么,等等;对于有异议的给予说明。
我列出的电极电势表将去除不常用的氧化剂和还原剂;对于零度以下不能存在的不在列出,比如二氟化二氧,虽然它在零下100度就有极强的氧化能力,如:在零下100度将钚迅速氧化到+6价,而氟,三氟化氯常温,甚至加热也不能将钚氧化到+6价氟只能将钚氧化到+4价,+6价需要700摄氏度,用强紫外线照射才能发生反应;将氙氧化到+6价,氟需要加压加热。
但它在零下95度就会显著分解,零下57度迅速分解完。
大家只要知道它即使在极低温下氧化性也比氟强即可关于自由基,只列出羟基自由基OH-,其他象OF,XeF,KrF自由基,这些都属于很少见,瞬间存在的东西,这几个自由基的氧化性以KrF最强,XeF最弱,我看到有些化学书籍上说XeF自由基的电极电势数值为3.4,这个数值应该是估计值,XeF 在普通条件下是不存在的,只是在加热或者强光照射合成二氟化氙,四氟化氙,六氟化氙的时候瞬间存在。
羟基自由基这个是常见的自由基,水溶液里就有。
如果把XeF列上,那么氦离子也可以列上。
大家知道α粒子实际就是氦原子失去两个电子的原子核,就是He2+,在做物理实验,大气层的电离层都常常碰到,它不算是罕见的吧。
He2+可不得了,它的电极电势观测数值约9V,什么,氟,氧,氯,溴,在它面前都是不堪一击,它可以把任何一种元素电离氧化。
可以认为α粒子(He2+)是自然界存在的氧化性最强的物质。
当然,人工造出来的不算,你用电流把氟原子的电子剥光,它肯定比氦离子强,把氯原子的电子剥光则它又比氟强。
大家去看看那个氦合氢离子的解释就知道了有多么变态,那是氦原子核夺走了氢的电子,但还差一个电子,也就是HeH+.当然,普通情况下,氦离子是不存在的,只有在实验室和电离层中才出现。
待续...关于四分子氧O4,这个属于有异议的东西,另外普通条件下它也是不存在的。
它的氧化性到底有多强,还是等化学家研究清楚再说,我也没有查到相关资料,对于氧元素大家掌握氧气和臭氧即可。
对于金属和非金属的高价氟化物,我只列出具有代表性的,不要问我什么六氟化铬,三氟化银,三氟化铜什么的,太多了。
大家只要知道高价金属,非金属氟化物,都具有很强的氧化性,是强氧化剂和氟化剂。
我会列出六氟化铂,三氟化钴的推算数值对于卤族元素互化物,列出大家问的多的三氟化氯,另外考试题中出现了三氟化溴。
大家了解,互化物的氧化性,活泼性介于组成互化物的两个元素之间。
关于放射性元素,卤族元素的砹(At)的化合物也有较强的氧化性,由于有放射性不在列出,其电极电势数值不高于1.6;锕系元素的镅,锔有不稳定的+4价;Am(镅)4+/3+电极电势数值约2.3(有的书中为2.62),强于臭氧和高铁酸盐;有极强的氧化性;而Cm(锔)4+/3+的电极电势数值(观测估计值)约3.2,比氟还强。
+4价的锔只能在固体中存在。
由于它们均有放射性,没有实际用处,不在列出。
镧系元素中镨(Pr),钕,钕(Nd),铽(Tb),镝(Dy),存在很不稳定的+4价,均为极强的氧化剂;Pr4+/Pr3+,电极电势数值约2.9(新数据为3.2),与氟相当或者略强;Nd4+/Nd3+,约5.0(实验观测数值);Tb4+/Tb3+,约3.1;Dy4+/Dy3+,约5.2(实验观测数值)。
象锕系的+4价锔,镧系的+4价镨,+4价的铽等,可以通过氟或者二氟化氪等在特殊条件下氧化得到。
并且需要特殊的络合剂来降低其电极电势,比如用磷钨酸,硼钨酸,硅钨酸盐在氟或者强氟化剂作用下制取了+4价的化合物。
它们只能以复盐的形式存在且为固态,不能直接和氟构成。
如:七氟钕三铯(Cs3NdF7),其中钕为+4价。
它们的存在形式为复盐,且在络合作用下,虽然还为+4价,但已经失去了原来极强的氧化性,所以不在列出。
可以理解成,理论上它们的+4价氧化性极强,比氟还强,但不能以正常方式稳定存在,没有实际意义。
这里说明一下,化学中的络合反应是很常见,也是很有用的。
它可以形成正常途径不能合成的化合物,反应产生的络合物也叫配合物。
例如:硫氰化铁Fe(SCN)3,硫酸铜铵[Cu(NH3)4]SO4等。
中学阶段典型的络合反应就是王水和黄金的反应:Au+HNO3+4HCl=H[AuCl4]+NO?+2H2O反应的产物氯金酸H[AuCl4]就是络合物,也可以叫配合物。
这个反应的原理,想必大家都知道了。
单一的硝酸,盐酸是不和金,铂反应的。
可是酸性条件下的硝酸根离子(NO3-)是一种很强的氧化剂,它可以溶解极微量的金(Au),而盐酸提供的氯离子(Cl-)则可以与溶液中的金离子(Au3+)发生络合反应,形成四氯合金离子([AuCl4]-)(铂是生成了六氯合铂离子,对应氯铂酸),使金离子在氯离子的配位作用下减少,降低了金离子的电势,反应平衡移动,这样金原子就可以进一步被溶解了。
其实硝酸根的氧化性并没有增加,只是盐酸提供的氯离子增强了金、铂等金属原子的还原性。
同样,铜和热浓盐酸缓慢反应(稀盐酸不行)也是典型的络合反应:2Cu+4HCl(热浓)==2H[CuCl2]+H2?2H[CuCl2]也是一个典型的络合物。
这个反应的关键是溶液中要有足够的氯离子,而氯离子有络合作用,浓度越大,络合作用越强。
在氯离子的络合作用下铜的电极电势变小了,小于了氢,自然被盐酸中的氢离子氧化了。
络合反应,中学阶段不要求掌握,否则会和一些中学教科书上的观点发生冲突。
这样得到的电极电势数据,仍然是比较传统的,但很有实际意义,很有用处的关于电极电势和标准电极电势的说明,它们的定义,原来我就不多说了,化学教材以及网上都有。
我这里只是补充一下:1.标准电极电势都是在298K(25摄氏度),组成电极的离子(在水溶液中)浓度为1摩尔/升;气体压力为1个大气压,即约100KPa。
简单的说标准电极电势是在25摄氏度,离子浓度为1摩尔/升,一个标准大气压的环境下测出来的,不符合这个定义的,都不算标准电极电势。
其符号是:这个符号我在电脑上打不出来,就截图吧。
例如,在标准环境下,实验室中用电位表测得标准氢电极和标准锌电极组成的原电池电动势为:0.7628伏特(V),则Zn2+/Zn电对的标准电极电势为:请大家原谅我的懒惰,这些符号在电脑上打出来太痛苦了......2.对于某些和水明显反应的物质,不能直接测量,要通过热力学数据间接来计算标准电极电势,比如钾,钙,钠,还有氟,它们的电极电势,严格来说都不是标准电极电势,都是间接计算出来的,而不是在实验室测出来的。
3.计算电极电势,标准电极电势,通常用的是氢电极,除非有说明。
标准电极电势是相对值,是该电极同氢电极之间的电动势,而不是该电极与其溶液间电位差的绝对值。
4.标准电极电势随温度变化,但变化不是很明显,因而象一些在20度,甚至零度得到的电极电势,也可以算是标准电极电势吧,但温度也不能相差过大。
比如二氟化二氧在零下100度,参与反应,实验观察估算值在3V以上,明显强于氟和三氟化氯,但零下100度,和摄氏25度相差遥远,因而这个数值只能是非标准电极电势。
同样在加上光照,加热,高温条件下得到的电位数值,也不是标准电极电势。
5.标准电极电势受溶液离子浓度影响很大,比如稀硫酸中+6价的硫的标准电极电势为0.17,但浓硫酸其电极电势观测数值,甚至能达到1.2V,所以浓硫酸可以氧化氢碘酸,氢溴酸,稀硫酸却不行。
稀硝酸标准电极电势约0.96,浓硝酸电极电势数值可以达到约1.3,所以稀硝酸只能氧化氢碘酸,不能氧化氢溴酸,而浓硝酸可以氧化氢溴酸,甚至能将碘氧化成碘酸。
但不能氧化盐酸。
硒酸中+6价的硒标准电极电势约1.15,当硒酸的浓度超过50%的时候,其电极电势实验观察数值已经超过1.3,和氯/氯离子的标准电极电势1.358基本相当,所以可以和浓盐酸反应,将氯离子氧化成氯气,当浓度达到99%的时候,硒酸的观测电极电势约1.45,所以硒酸越浓,和盐酸反应的越快,70%以上浓度的浓硒酸在加热到170度的时候,甚至可以将金氧化,生成硒酸金,这时候其观测电位已经超过了1.5,浓度更大的甚至接近1.6V,超过了Au3+/Au的电极电势1.50,自然将金氧化。
这和王水氧化金铂的原理是不同的。
6.电极电势受酸碱浓度影响较大,许多氧化剂,还原剂在酸性,中性,碱性,强酸性,弱酸性环境下测得的电极电势数值是不同的。
如:臭氧在酸性环境,中性环境下,标准电极电势为2.076V,在碱性环境下则为1.24V,差别较大再如:重铬酸钾,铬酸根在酸性环境下,其电极电势数值为1.33,这是在强酸(常用稀硫酸)环境中测试的,把硫酸换成醋酸,经过测试计算,其电极电势降低到了约0.9。
象重铬酸钾这样的,氧化剂在酸性环境中使用,酸性越强,氧化性越强。
7.如果反应生成了沉淀物,则对电极电势也有较大影响例如:银离子/银(Ag+/Ag),其标准电极电势约0.799当银离子碰到氯离子则会产生氯化银沉淀,这时候银离子的电极电势发生了变化,实验测算数值为0.221V,明显变小了银离子和溴离子结合产生的溴化银溶解度更小,于是测算出来的电极电势数值也更小,为,0.071,和氢的电极电势差不多至于和碘离子结合产生的碘化银沉淀,银离子的电极电势数值甚至变成了负数,为-0.152也就是说,如果反应产生了沉淀物,沉淀物溶解度约小,则该离子的电极电势越小,氧化性越弱,还原性越强8.溶液中有络合物(配合物)生成时,其电极电势也有明显变化。
如那个钴,大家知道3价钴有强氧化性,在酸性环境中标准i电极电势Co3+/Co2+约1.83,可是当它和氨水生成络合物,其标准电极电势迅速降低到0.058,和CO化合成的络合物,Co3+的电极电势更是变成了负数,约-0.4大家在应用电极电势来做题的时候,要注意:1.查表得到的数值是标准电极电势数值(极个别不是);如果在非标准情况下比较氧化剂,还原剂的强弱,需要用奈斯特(有的书翻译成能斯特)方程来计算,中学阶段不要求掌握。
