15第10章分析化学中常用的分离和富集方法及小结分析
分析化学中常用的分离和富集方法

分析化学中常用的分离和富集方法1.蒸馏法:蒸馏是根据溶液中各组分的沸点差异来进行分离的方法。
通过加热混合液体使其汽化,然后再冷凝收集汽化物,从而分离不同沸点的组分。
蒸馏法适用于溶液中的挥发性组分富集和纯化。
2.萃取法:萃取是利用两种或多种不相溶液体的亲和性差异将待分析的组分从混合体系中转移到单一溶剂中的分离方法。
常见的有液液萃取和固相萃取。
萃取法适用于挥发性差异较小的物质分离。
3.结晶法:结晶是根据物质在溶液中的溶解度差异来进行分离的方法。
通过逐渐降低溶解度使其中一种或几种溶质结晶出来,从而实现分离和富集。
结晶法适用于固体组分富集和纯化。
4.洗涤法:洗涤是通过溶解或稀释洗涤剂来将带有目标分子的样品与杂质分离的方法。
洗涤法适用于固态、液态和气态混合物中分离和富集。
5.离子交换法:离子交换是通过离子交换树脂的吸附作用来分离和富集组分的方法。
树脂上的离子可与溶液中的离子发生交换,从而实现目标组分的富集。
离子交换法适用于溶液中离子的分离和富集。
6.气相色谱法:气相色谱是一种利用气相色谱柱对待分析物进行分离的方法。
根据化合物在不同固定相上的吸附特性差异进行分离和富集。
气相色谱法适用于气态和挥发性物质的分离和富集。
7.液相色谱法:液相色谱是一种利用液相色谱柱对待分析物进行分离的方法。
根据待分析物在流动相和固定相之间的分配系数差异进行分离和富集。
液相色谱法适用于液态和溶液中的分离和富集。
8.电泳法:电泳是一种利用电场对待分析物进行分离和富集的方法。
根据待分析物在电场中的迁移速度差异来分离和富集。
电泳法适用于溶液中离子和带电粒子的分离和富集。
以上是常见的分离和富集方法,每一种方法在不同场合的适应性和分离效果各有差异。
在实际应用中,需要根据具体情况选择合适的方法。
不同的分析问题可能需要结合多种方法的优势来达到理想的分析结果。
第章分析化学中常用的分离富集方法

第章分析化学中常用的分离富集方法分析化学是研究物质成分和性质的科学,分析化学中常常需要进行分离和富集样品中的目标组分以便进行后续的定性与定量分析。
在分析化学中,常用的分离富集方法包括溶剂提取法、固相萃取法、离子交换法、凝胶过滤法等。
以下将对这些方法进行详细介绍。
1.溶剂提取法溶剂提取法是利用目标组分在水相和有机相之间的分配系数差异将目标组分从样品中分离出来的方法。
该方法常用于富集有机物、金属离子等。
常用的溶剂包括正己烷、乙酸乙酯、乙酸纳等。
溶剂提取法具有操作简便、富集效果好的特点,但需要注意溶剂的选择和体积比的控制。
2.固相萃取法固相萃取法是利用固态吸附剂或吸附剂包裹在固态材料上,通过吸附目标物质来实现分离和富集的方法。
该方法常用于富集挥发性有机物、农药、药物等。
常用的吸附剂有活性炭、硅胶、聚酯、聚乙烯等。
固相萃取法具有操作简便、富集效果好的特点,但需要注意吸附剂的选择和样品前处理的步骤。
3.离子交换法离子交换法是利用离子交换树脂将样品中的离子按照离子交换性质进行分离和富集的方法。
离子交换树脂是一种具有交换离子基团的吸附剂,可以选择性地吸附目标离子。
离子交换法常用于富集金属离子、阴离子、阳离子等。
常用的离子交换树脂有强阴离子交换树脂、强阳离子交换树脂、弱阴离子交换树脂等。
离子交换法具有选择性好、重现性好的特点,但需要注意树脂的选择和样品的处理方法。
4.凝胶过滤法凝胶过滤法是利用凝胶材料的孔隙大小将大分子与小分子进行分离和富集的方法。
凝胶过滤法常用于分离大分子如蛋白质、DNA等。
常用的凝胶材料有琼脂糖、聚丙烯酰胺凝胶等。
凝胶过滤法具有操作简便、选择性好的特点,但需要注意凝胶材料的选择和样品前处理的步骤。
以上是分析化学中常用的分离富集方法,不同的方法适用于不同的目标组分和样品类型。
在进行分析前,需要根据样品的特性和分析要求选择合适的分离富集方法,并进行合理的样品前处理步骤,以确保分析结果的准确性和可靠性。
分析化学中常用分离富集方法

分析化学中常用分离富集方法在分析化学中,常用的分离富集方法有溶剂萃取、吸附、离子交换、凝胶渗透层析、电动毛细管层析等。
这些方法根据分析样品的性质以及分离纯化的目的选择合适的方法。
下面将对这些方法进行详细介绍。
溶剂萃取是一种常用的分离富集方法,它基于溶液中不同物质的相溶性差异。
一般来说,溶液中的物质可以根据其分配系数(即溶于有机溶剂相对于水溶液中浓度比值)在两个不同的相中分散。
通过调整溶液的pH、温度或添加其他化学试剂,可以改变物质在两个相中的分配系数,从而实现分离富集功能。
溶剂萃取适用于分离大分子有机化合物、脂肪酸、金属离子等。
吸附是一种以吸附剂与待分离物质之间的吸附作用为基础的分离方法。
吸附剂可以是固体(如硅胶、活性炭、分子筛)或液体(如活性炭糊剂、萃取液)。
吸附分离原理包括亲和性吸附、离子交换吸附等。
亲和性吸附是通过亲和剂和待测物之间的特异性相互作用实现分离,如抗体-抗原、酶-底物、核酸-亲和基团的结合。
离子交换吸附是利用固定在吸附剂上的离子官能团与溶液中的离子发生相互作用实现分离,如阳离子交换剂、阴离子交换剂。
离子交换是利用带电荷的树脂与待分离物质之间的吸附-解吸作用,实现分离富集的方法。
树脂具有氧阴离子或聚合物等功能基团,它们可以与离子相互作用形成络合物,通过控制pH、离子浓度等参数的变化,实现离子交换和分离。
离子交换常用于水样中稀释度高的金属离子分离、无机阴阳离子的分离等。
凝胶渗透层析:是一种以凝胶为固定相进行分析的方法。
凝胶是由网状三维网络结构构成的,分子可以在凝胶孔隙中进行渗透和扩散。
样品进入凝胶后,分子的速率取决于其分子尺寸,较大的分子会被凝胶阻滞在孔隙中,而较小的分子则能够通过孔隙。
通过调节凝胶孔隙的大小和形状,可以实现对分子大小的选择性分离。
电动毛细管层析(CE)是近年来发展起来的一种高效分离富集方法。
它利用毛细管内的电细胞电动力学作用,使待分离物质在电场作用下,根据体积、电荷、形状等特性进行分离。
分析化学中常用的分离和富集方法

分析化学中常用的分离和富集方法分析化学作为一门研究物质组成和性质的科学,其中常用的分离和富集方法起着至关重要的作用。
分离和富集方法可以将需要分析的目标物质从复杂的混合物中分离出来,提高分析的灵敏度和准确度。
本文将介绍常用的分析化学分离和富集方法,包括溶剂萃取、固相萃取、薄层板法和气相色谱。
溶剂萃取是一种常见的分离和富集方法。
它基于物质在不同溶剂中的溶解度差异来实现分离。
常用的溶剂包括醚类、酯类和芳烃类。
溶剂萃取可以根据目标物质的亲水性或疏水性进行选择,有效地将目标物质从样品中富集。
例如,对于水样中的有机污染物分析,可以使用非极性的有机溶剂进行富集,如二氯甲烷、正己烷等。
溶剂萃取方法操作简便,成本较低,已广泛应用于环境监测和食品安全等领域。
固相萃取是一种利用固相吸附材料对目标物质进行富集的方法。
固相萃取通常以固相萃取柱或固相萃取膜的形式存在。
固相萃取材料多为具有特定化学性质的固体材料,如聚苯乙烯、聚二氟乙烯、硅胶等。
富集过程中,样品通过固相萃取材料,目标物质被吸附在固相上,其他杂质被去除,从而实现分离和富集。
固相萃取方法具有选择性好、灵敏度高的特点,广泛应用于环境、生物医药、食品和化学等行业的样品前处理中。
薄层板法是一种常用的分析化学分离技术,广泛应用于天然产物和化学成分分析中。
薄层板法利用了化学物质在不同极性固体支持物上的吸附和分配性质。
分离过程中,样品溶液在薄层板上扩展,不同成分因溶液中的分配系数不同而在薄层板上分离出来。
随后,可以通过显色剂、紫外灯或其他检测手段进行成分的定性分析或定量测定。
薄层板法操作简单、迅速,结果直观,已成为化学分析中不可或缺的手段之一。
气相色谱是一种基于物质在气相中分配系数的分离技术,被广泛应用于挥发性有机物的分析。
在气相色谱中,样品经过蒸发器的加热,被气体载气(如氮气或氦气)带入色谱柱进行分离。
色谱柱内填充有具有特定性质的固体或液体填料,目标物质通过填充物与载气发生相互作用,从而实现分离。
分析化学中的分离与富集方法

分析化学中的分离与富集方法
1.蒸馏法:根据不同物质的沸点差异进行分离和富集。
常用的蒸馏方
法有常压蒸馏、减压蒸馏、水蒸气蒸馏等。
2.萃取法:利用两种或多种溶剂相互不溶的特性,将目标物质从混合
物中转移到溶剂中,从而达到分离和富集的目的。
典型的例子有固-液萃
取和液-液萃取。
3.变温结晶法:根据不同物质溶解度随温度变化的规律,通过调节温
度使目标物质结晶,从而将其与其他组分分离。
4.气相色谱法:利用物质在固定相和流动相之间的分配系数差异,以
气态物质的流动为介质,将目标物质从混合物中分离并富集。
1.沉淀法:通过在混合物中加入沉淀剂,使得目标物质与沉淀剂反应
生成不溶性沉淀,从而分离富集目标物质。
这种方法常用于分离金属离子。
2.化学还原法:通过还原剂将目标物质转化为不溶性化合物,从而使
其与混合物分离。
例如,将有机污染物还原为不溶性沉淀。
3.化学萃取法:利用目标物质与萃取剂之间的化学反应进行分离。
例如,萃取剂选择性地与目标物质发生络合反应,形成可溶性络合物,从而
将其与其他组分分离。
4.吸附分离法:通过吸附剂对目标物质的选择性吸附将其从混合物中
分离。
主要有固相萃取、层析和磁性吸附等方法。
以上仅是分析化学中常用的一些分离与富集方法,实际应用中还有很
多其他方法,如超临界流体萃取、电分离、膜分离等。
在实际的分析过程
中,要根据混合物的性质和目标物质的特点选择合适的方法,并合理优化条件,以提高分离效果和分析结果的准确性。
分析化学中常用的分离和富集方法及小结

3. 其它无机沉淀剂
H2SO4,H3PO4,HF or NH4F,HCl
稀HCl:Ag Hg22+ Pb→白↓( Ⅰ组阳离子)
HCl
AgCl,Hg2Cl2,PbCl2
NH3
溶于热水
Ag(NH3)2+ Pb(OH)2 HgNH2Cl(白)+Hg(黑)
13
(白)
灰黑
无机沉淀剂: 易产生共沉淀, 选择性不高; 应首先沉淀微量组分.
UO22+,Al3+,Sn4+,Bi3+等。
21
无机共沉淀剂选择性差, 干扰下一步测定。
2、有机共沉淀剂(选择性高,应用广)
丹宁,辛可宁,动物胶等,可灼烧除去。
例1:分离微量H2WO4
HNO3介质中, H2WO4-辛可宁。
带负电胶粒,
不易凝聚
胶体凝聚
例2:分离微量cd
R h C B 2 4 d (IR)2 h CB 2 4 d I
氢氧化物:NaOH、NH3 硫化物:H2S 有机沉淀剂:H2C2O4,丁二酮肟
分
离子交换分离
阳离子交换树脂 阴离子交换树脂
气液分离:挥发和蒸馏 克氏定氮法,Cl2预氧化I-法
离
螯合物萃取
萃取分离 离子缔合物萃取
方 液液分离
法
膜分离
三元络合物萃取 支撑型液膜 乳状液型液膜
生物膜
气固分离——超临界流体萃取
离子)(氨水沉淀分离法中常加入大量NH4+盐,其作 用是什么?)
10
3 控制pH=5-6
① ZnO悬浊液法
高价离子Fe3+,Al3+,Cr3+,Th4+等定量↓ ቤተ መጻሕፍቲ ባይዱi2+,Co2+,Mn2+,Mg2+,Ca2+,Sr2+不↓
分析化学中常用的分离和富集方法
3 溶于CHCl3
亲水 水合离子的正电性被中 和,亲水的水分子被疏 水有机大分子取代
疏水
8-羟基喹啉
萃取剂
CHCl3
溶剂
3.反萃取
Back extraction
萃取的反过程(将组分从有机溶液中萃取到水溶液中)
如:8-羟基喹啉铝螯合物中加入1mol/L HCl
12
4. 分配系数与分配比 分配系数 partition coefficient HA (w) HA (o)
常用分离方法
沉淀分离法 溶剂萃取分离法
Precipitation Solvent extraction Ion exchange
离子交换分离法
色谱分离法
挥发和蒸馏分离法
Chromatography
Volatilization and distillation
11.3沉淀分离与富集 ——依据溶度积分硫酸盐、卤化物、磷酸盐等 有机沉淀剂:草酸、铜铁试剂、铜试剂、丁二酮肟、苦杏仁酸等
例如常见阳离子的两酸两碱分离
分组 组试剂 Ⅰ HCl Ag Hg (I) (Pb) Ⅱ H2SO4 Ca Sr Ba Pb Ⅲ NH4Cl - NH3 Ⅳ NaOH Ⅴ 可溶组* Na K Zn NH4+
萃取分离法 在含有被分离物质的水溶液中,加入 萃取剂和与水不相混溶的有机溶剂,
震荡,利用物质在两相中的分配不同
的性质,使一些组分进入有机相中, 使另一些组分仍留在水相中,从而达
到分离的目的。
梨形分液漏斗
例:I2的萃取
11.4.1 萃取分离的基本原理
1. 萃取分离的依据 hydrophilic 物质 hydrophobic 亲水性 离子型化合物 极性
分析化学_分析化学中常用的分离和富集方法

分析化学_分析化学中常用的分离和富集方法分析化学是研究物质的组成、结构和性质的一门学科。
在分析化学中,为了检测和测定分析对象中微量或痕量的目标物质,常常需要使用分离和富集方法,以提高目标物质的检测灵敏度。
1.搅拌萃取:搅拌萃取是一种常见的分离和富集方法。
通过将样品与其中一种有机溶剂反复搅拌混合,使目标物质从水相转移到有机相中,从而实现分离和富集。
该方法适用于目标物质在水相和有机相之间有较大的分配系数差异的情况。
2.相间萃取:相间萃取是指根据目标物质在两相中的分配差异进行分离和富集的方法。
常见的相间萃取方法包括液液萃取、固相微萃取和液相萃取等。
相间萃取通常需要将样品与萃取剂反复摇匀并分离两相,以实现目标物质的富集。
3.固相萃取:固相萃取是指使用固定在固相萃取柱或固相萃取膜上的吸附剂来对目标物质进行分离和富集的方法。
固相萃取方法具有操作简单、富集效果好、适用范围广等优点,常用于分析化学中的前处理过程。
4.蒸馏:蒸馏是指通过加热使液体汽化,然后冷凝收集汽化液体的方法。
蒸馏可以实现液体的分离和富集,适用于目标物质在样品中的浓度较低且需高度富集的情况。
5.色谱分离:色谱分离是一种基于目标物质在不同相之间的分配差异进行分离的方法。
常用的色谱分离方法包括气相色谱、液相色谱、固相色谱等。
色谱分离方法具有分辨率高、重复性好、操作简便等优点,广泛应用于分析化学中。
6.气相萃取:气相萃取是指利用气相萃取装置将目标物质从固体、液体或气体中分离和富集的方法。
气相萃取主要通过溶剂的蒸发和再冷凝,将目标物质从样品中富集到溶剂中,然后通过蒸发或其他方法将溶剂去除,得到目标物质。
7.凝胶电泳:凝胶电泳是一种基于目标物质的电荷、大小或形状差异进行分离和富集的方法。
常见的凝胶电泳方法包括聚丙烯酰胺凝胶电泳、聚丙烯酰胺梯度凝胶电泳等。
凝胶电泳方法具有分辨率高、富集效果好等优点,适用于复杂样品的分析。
总之,分析化学中常用的分离和富集方法有搅拌萃取、相间萃取、固相萃取、蒸馏、色谱分离、气相萃取和凝胶电泳等。
分析化学中常用的分离和富集方法

第8章 分析化学中常用的分离和富集方法8.1 概述分离和富集是定量分析化学的重要组成部分。
当分析对象中的共存物质对测定有干扰时,如果采用控制反应条件、掩蔽等方法仍不能消除其干扰时,就要将其分离,然后测定;当待测组分含量低、测定方法灵敏度不足够高时,就要先将微量待测组分富集,然后测定。
分离过程往往也是富集过程。
对分离的要求是分离必须完全,即干扰组分减少到不再干扰的程度;而被测组分在分离过程中的损失要小至可忽略不计的程度。
被测组分在分离过程中的损失,可用回收率来衡量。
1. 回收率(R ) 其定义为:%100⨯==分离前待测组分的质量分离后待测组分的质量R对质量分数为1%以上的待测组分,一般要求R >99.9%;对质量分数为0.01%~1%的待测组分,要求R >99%;质量分数小于0.01%的痕量组分要求R 为90%~95%。
例1. 含有钴与镍离子的混合溶液中,钴与镍的质量均为20.0mg ,用离子交换法分离钴镍后,溶液中余下的钴为0.20mg ,而镍为19.0mg,钴镍的回收率分别为多少?解:%0.10.2020.0 %,0.950.200.19Co Ni ====R R2. 分离因子S A/B分离因子S B/A 等于干扰组分B 的回收率与待测组分A 的回收率的比,可用来表示干扰组分B 与待测组分A 的分离程度。
%100/⨯=ABA B R R SB 的回收率越低,A 的回收率越高,分离因子越小,则A 与B 之间的分离就越完全,干扰消除越彻底。
8.2 沉淀分离法沉淀分离法是一种经典的分离方法,它是利用沉淀反应选择性地沉淀某些离子,而与可溶性的离子分离。
沉淀分离法的主要依据是溶度积原理。
沉淀分离法的主要类型如下表。
8.2.1常量组分的沉淀分离1. 氢氧化物沉淀分离大多数金属离子都能生成氢氧化物沉淀,各种氢氧化物沉淀的溶解度有很大的差别。
因此可以通过控制酸度,改变溶液中的[OH-],以达到选择沉淀分离的目的。
分析化学中的分离与富集方法

试液+有机溶剂
振荡
在萃取过程中,A(水) 当分配达到平衡时:
静置 A(有机)
有机相 水相
[A](有) K 分配系数 [A] D
(水)
当溶质A在两相中存在多种形态时,则使用另一参数
分
配D比 A A在 在
有 水
机 相
相 中
的C 总 (浓 有度 ) 的C 总 ( A 浓 水度 )
A
分析化学中的分离与富集方法
溶剂萃取分离法பைடு நூலகம்理及相关参数 离子交换分离法原理
分析化学中的分离与富集方法
样品采集 Sampling
1
问题提出 Formulation
Question
???
结果报告 Writing Reports
8
样品制备 Sample Preparation
2
定量分析过程
数据分析
Calculating & Estimating
(3) 利用有机共沉淀剂进行共沉淀分离。
分析化学中的分离与富集方法
共沉淀分离
利用吸附作用:
(利用非晶形沉淀,表面积大,吸附组分沉淀)
Cu中微量Al (Fe(OH)3)
铜中的微量铝,氨水不能使铝沉淀分离,若加入适量的 Fe3+离子,则在加入氨水后,利用生成的Fe(OH)3作载体 可使微量Al(OH)3共沉淀而分离。
本题计算结果还表明,尽管两组的分离因数相 同并且高达1000,但一组的分离效果好,二组 的分离效果不好,说明评价物质间的分离效果不 能孤立地看β,即两物质的分配比D的比值,还 要看各自的分配比D的大小。当β固定后,D是决 定E的主要因素。 分析化学中的分离与富集方法
2. 溶剂萃取分离法(2)
分析化学中常用的分离富集方法

分析化学中常用的分离富集方法1.蒸馏法:蒸馏法是一种基于物质沸点差异的分离富集方法。
通过加热混合物,使成分具有不同沸点的组分分别转化为气态和液态,然后通过冷凝收集液态成分,从而实现分离。
蒸馏法广泛应用于分离液体的混合物,例如石油的分离和酒精的纯化。
2.萃取法:萃取法是一种基于物质在不同相中的分配系数差异的分离富集方法。
它通过萃取剂与混合物中其中一成分发生作用,将其从混合物中提取出来。
常用的萃取剂包括有机溶剂、水和金属络合剂等。
萃取法广泛应用于固体、液体或气体的分离富集,例如从矿石中提取金属离子、从天然产物中提取天然色素等。
3.结晶法:结晶法是一种基于物质在溶液中溶解度差异的分离富集方法。
通过逐渐降低溶液中的溶质浓度,使其超过饱和度,从而导致溶质结晶出来。
结晶法广泛应用于分离纯化固体物质,例如提取药物原料和脱盐。
4.吸附法:吸附法是一种基于物质在固体吸附剂表面吸附能力差异的分离富集方法。
通过将混合物与吸附剂接触,利用其表面活性或化学反应特性,将目标成分吸附在吸附剂上,然后通过洗脱、干燥等步骤分离目标成分。
常用的吸附剂包括硅胶、活性炭和分子筛等。
吸附法广泛应用于气体和溶液的分离富集,例如气体的净化和水处理。
5.色谱法:色谱法是一种基于物质在固相或液相载体上移动速度差异的分离富集方法。
它利用混合物成分在固定相和流动相之间相互作用的差异,通过在柱上或薄层上移动,分离各个组分。
常用的色谱法包括气相色谱法、液相色谱法和薄层色谱法等。
色谱法广泛应用于有机化合物和生物大分子的分离分析,例如对复杂的混合物进行定性和定量分析。
除了上述常用的分离富集方法,还有一些其他的方法如离子交换法、电泳法、过滤法等。
这些方法在不同的应用领域具有独特的优势和适用性。
分析化学中的分离富集方法是实现样品预处理、纯化和定性定量分析的基础,对于提高分析的准确性和灵敏度具有重要意义。
分析化学中常用的分离富集方法和原理及应用

知识目标
²熟悉气态分离法、沉淀与过滤分离、 萃取分离法、离子交换分离法、色谱分离、 电分离法、气浮分离法、膜分离原理及应用。
能力目标
²了解气态分离法、沉淀与过滤分离、 萃取分离法、离子交换分离法、色谱分离、 电分离法、气浮分离法、膜分离简单操作。
10.1 方法概述
例如无水乙醇的制备,水和乙醇形成共沸物(95%乙醇),b.p.=78.15℃ 加入苯形成另一共沸物(苯74%,乙醇18.5%,水7.5%) b.p.=65℃ 在65℃蒸馏, 除去水, 在68℃苯和乙醇形成共沸物(苯67.6%,乙醇32.4%) 在68℃蒸馏直到温度升高,在78.5℃能获得纯乙醇。
e 萃取蒸馏(extractive distillation)
卤化物沉淀
氟化稀土和与Mg(II), Ca(II), Sr(II), Th(IV)氟化物沉淀, 冰晶石法沉淀铝 在pH=4.5 Al(III)与NaF生成(NaAlF6) 沉淀分离Al(III),与Fe(III),Cr(III),Ni(II),V(V)Mo(VI)等分离
硫化物沉淀
控制酸度,溶液中[S2-]不同,根据溶度积,在不同酸度析出硫化物沉淀, As2S3, 12M HCl; HgS,7.5M HCl; CuS, 7.0M HCl; CdS, 0.7M HCl; PbS, 0.35M HCl; ZnS, 0.02M HCl; FeS, 0.0001M HCl; MnS,0.00008 M HCl
例由氢化苯(80.1℃)生成环己烷(80.8℃)时,一般的蒸馏不能分离,加入苯胺 (184℃)与苯形成络合物,在比苯高的温度沸腾,从而分离环己烷
11.3 沉淀分离
1 常量组分的沉淀分离 氢氧化物沉淀
常用的分离和富集方法1试说明定量分离在定量分析中的重要

第十章常用的分离和富集方法1.试说明定量分离在定量分析中的重要作用。
答:在实际的分析工作中,遇到的样品往往含有各种组分,当进行测定时常常彼此发生干扰。
不仅影响分析结果的准确度,甚至无法进行测定,为了消除干扰,较简单的方法是控制分析条件或采用适当的掩蔽剂,但在有些情况下,这些方法并不能消除干扰,因此必须把被测元素与干扰组分分离以后才能进行测定。
所以,定量分离是分析化学的主要内容之一。
2.何谓回收率?在回收工作中对回收率要求如何?答:回收率是用来表示分离效果的物理量,回收率越大,分离效果越好,一般要求R A>90~95%即可。
3.何谓分离率?在分析工作中对分离率的要求如何?答:分离率表示干扰组分B与待测组分A的分离程度,用表示S B/A,S B/A越小,则R B越小,则A与B之间的分离就越完全,干扰就消除的越彻底。
通常,对常量待测组分和常量干扰组分,分离率应在0.1%以下;但对微量待测组分和常量干扰组分,则要求分离率小于10-4%。
4.有机沉淀剂和有机共沉淀剂有什么优点。
答:优点:具有较高的选择性,沉淀的溶解度小,沉淀作用比较完全,而且得到的沉淀较纯净。
沉淀通过灼烧即可除去沉淀剂而留下待测定的元素。
5.何谓分配系数、分配比?二者在什么情况下相等?答:分配系数:是表示在萃取过程中,物质进入有机溶剂的相对大小。
分配比:是该物质在有机溶剂中存在的各种形式的浓度之和与在水中各存在形式的浓度之和的比值,表示该物质在两相中的分配情况。
当溶质在两相中仅存在一种形态时,二者相等。
6.为什么在进行螯合物萃取时控制溶液的酸度十分重要?答:在萃取过程中,溶液的酸度越小,则被萃取的物质分配比越大,越有利于萃取,但酸度过低则可能引起金属离子的水解,或其他干扰反应发生,应根据不同的金属离子控制适宜的酸度。
7.解释下列各概念:交联度,交换容量,比移值。
答:交联度:在合成离子交换树脂的过程中,将链状聚合物分子相互连接而形成网状结构的过程中,将链状聚合物分子连接而成网状结构的过程称为交联。
分析化学课件常用的分离和富集方法

膜分离
膜分离是一种利用不同物质在薄膜中的传输特性进行分离的方法。它具有操 作简便、能耗低等优点,被广泛应用于水处理和生物医药等领域。
总结
通过本课件的学习,你已经了解了分析化学中常用的分离和富集方法。这些 方法在实际应用中具有重要的意义,帮助我们更好地理解和解决化学问题。
分析化学课件常用的分离 和富集方法
在分析化学课程中,分离和富集方法是非常重要的。本课件将介绍几种常用 的分离和富集方法,帮助你更好地理解和应用这些技术。
蒸馏
蒸馏是一种通过利用不同组分的沸点差异来分离混合物的方法。它可以用于纯化液体样品,去除杂质,以及分离可 挥发性组分。
萃取
萃取是一种使用溶剂来从混合物中分离出目标物质的方法。该方法广泛应用 于有机合成、化学分析和环境监测等领域。
色谱分离
色谱分离是一种基于样品分子的物理化学特性差异进行分离的方法。它可以 用来分离和鉴定复杂混合物中的各种成分。
浓缩
浓缩是一种将稀溶液中的目标物质转化为较小体积的方法。它可以用于提高 目标物质的检测灵敏度和纯度。
萃取富集
萃取富集是一种将目标物质从大量样中富集到较小体积的方法。它常用于分析样品预处理和提取罕见成分。
分析化学中常用的分离和富集方法

几种产生气体的方法
a.直接加热
b.强酸置换弱酸(强碱置换弱碱) c.氧化(燃烧) d.还原,Ge,Sn,P,As,Sb,S等用还原剂还原,成为氢化物挥发 e.卤化,飞铬(CrO2Cl2),飞硅(SiF4)
2、升华:固体物质不经液态就变成气态的过程。例如碘、干冰、樟脑、
砷、硫磺等。
3、蒸馏:在一定温度下使较易挥发的组分从固体或液体中变为气体
谢谢观赏!
பைடு நூலகம்
被分离富集。
几种蒸馏技术:常压蒸馏、水蒸气蒸馏、减压和真空蒸馏、共沸蒸馏、
萃取蒸馏
二、沉淀与过滤分离
对于被沉淀物质,可分为常量和微量组分。
1、常量组分的分离与沉淀:无机物沉淀和有机试剂——金属络合
物沉淀 无机物沉淀:氢氧化物沉淀(NaOH法,氨水--铵盐缓冲法,ZnO悬 浊液法,有机碱法)、硫酸盐沉淀、卤化物沉淀、硫化物沉淀、磷 酸盐沉淀
分析化学中常用的分离和 富集方法
——化学一班李浩男
目录 一、气态分离法 二、沉淀与过滤分离 三、电分离法
一、气态分离法
定义:液体或固体试样中被分离的组分以气体的形式分离出去,包括蒸 发、蒸馏、升华、气体发生等方法。 1、挥发:挥发是固体或液体全部或部分转化为气体的过程。 注意:蒸发和升华不属于挥发,固体和液体直接气化,无化学反应和新物 质生成。
有机试剂——金属络合物沉淀:草酸、铜铁试剂、铜试剂、丁二肟(与Ni
形成红色络合物沉淀)、苦杏仁酸、四苯硼酸钠(与钾生成沉 淀)
2、痕量组分富集和共沉淀分离
共沉淀分离法又叫载体沉淀法或共沉淀捕集法,是富集微量元素的有效方
法。
无机共沉淀剂:难溶氢氧化物、硫化物、硫酸盐和磷酸盐、单质、利用混
晶进行共沉淀
化学中常用的分离和富集方法

分析化学中常用的分离和富集方法1.在分析化学中,为什么要进行分离富集?分离时对常量和微量组分的回收率要求如何?答:在定量分析,对于一些无法通过控制分析条件或采用掩蔽法来消除干扰,以及现有分析方法灵敏度达不到要求的低浓度组分测定,必须采用分离富集方法。
换句话说,分离方法在定量分析中可以达到消除干扰和富集效果,保证分析结果的准确性,扩大分析应用范围。
在一般情况下,对常量组分的回收率要求大于99.9%,而对于微量组分的回收率要求大于99%。
样品组分含量越低,对回收率要求也降低。
2.常用哪些方法进行氢氧化物沉淀分离?举例说明。
答:在氢氧化物沉淀分离中,沉淀的形成与溶液中的[OH-]有直接关系。
因此,采用控制溶液中酸度可使某些金属离子彼此分离。
在实际工作中,通常采用不同的氢氧化物沉淀剂控制氢氧化物沉淀分离方法。
常用的沉淀剂有:a 氢氧化钠:NaOH是强碱,用于分离两性元素(如Al3+,Zn2+,Cr3+)与非两性元素,两性元素的含氧酸阴离子形态在溶液中,而其他非两性元素则生成氢氧化物胶状沉淀。
b 氨水法:采用NH4Cl-NH3缓冲溶液(pH8-9),可使高价金属离子与大部分一、二金属离子分离。
c 有机碱法:可形成不同pH的缓冲体系控制分离,如pH5-6六亚甲基胺-HCl缓冲液,常用于Mn2+,Co2+,Ni2+,Cu2+,Zn2+,Cd2+与Al3+,Fe3+,Ti(IV)等的分离。
d ZnO悬浊液法等:这一类悬浊液可控制溶液的pH值,如ZnO悬浊液的pH值约为6,可用于某些氢氧化物沉淀分离。
3.某矿样溶液含Fe3+,A13+,Ca2+,Mg2+,Mn2+,Cr3+,Cu2+和Zn2+等离子,加入NH4C1和氨水后,哪些离子以什么形式存在于溶液中?哪些离子以什么方式存在于沉淀中?分离是否完全?答:NH4Cl与NH3构成缓冲液,pH在8-9间,因此溶液中有Ca2+,Mg2+,,Cu(NH3)42-、Zn(NH3)42+等离子和少量Mn2+,而沉淀中有Fe(OH)3,Al(OH)3和Cr(OH)3和少量Mn(OH)2沉淀。
分析化学中常用的分离和富集方法

分析化学中常用的分离和富集方法要求:了解分析化学中常用的分离方法;理解萃取分离法的基本原理、萃取条件的选择及主要的萃取体系;掌握分配比、分配系数和萃取率的计算;掌握各种色谱法分离的机理。
了解一些新的分离富集方法。
一、概述在分析中对分离的要求是,干扰组分应减少到不再干扰被测组分的测定,被测组分在分离过程中损失要小到可以忽略不计。
后者常用回收率来衡量。
%100⨯=原来所含待测组分质量质量分离后待测的待测组分回收率回收率越高越好,不同体系对回收率的要求不一。
二、沉淀分离法沉淀分离法是一种经典的分离方法,它是利用沉淀反应有选择地沉淀某些离子,而其他离子则留在溶液中,从而达到分离的目的。
常用方法有:常量组分的沉淀分离(氢氧化物沉淀分离:氢氧化钠法、氨水法、有机碱法、ZnO 悬浊液法;硫化物沉淀分离;利用有机沉淀剂进行分离;其他无机沉淀剂),痕量组分共沉淀分离和富集(无机共沉淀剂;有机共沉淀剂)。
三、挥发和蒸馏分离法挥发和蒸馏分离法是利用物质的挥发性的差异进行分离的一种方法,可以用于除去干扰组分,也可以使被测组分定量分出后再测定。
在无机物中,具有挥发性的物质并不多,因此这种方法选择性较高。
四、液—液萃取分离法1.萃取分离的原理:利用与水不相混溶的有机溶剂同试液一起震荡,一些组分进入有机相,另一些留在水相中,达到分离富集的目的。
2. 分配比和分配系数3. 萃取百分比%100⨯=被萃取物质的总量的总量被萃取物质在有机相中E即%100/00000⨯+=+=V V D D V C V C V C E w ww[] [::]D organic w aterO O D w wA A A c K D K A c D ==分配系数分配比ww V DV V m m +⋅=001若用0V (mL )溶剂,萃取n 次,水相中剩余被萃取物为m n (g ),则DV DV V m m nw w n )]/([00+=,查表得出同量的萃取剂,分几次萃取的效率比一次萃取的效率高,但增加萃取次数会影响工作效率。
常用的富集和分离方法

分析化学中常用的分离和富集方法分离和富集在分析化学中占有十分的地位。
分离是消除干扰最根本最彻底的方法,富集是微量组分分析和痕量组分分析中因分析方法和分析仪器的灵敏度所限而能保证分析结果具有较高准确度的常用基本方法。
因此分离和富集是分析化学中极具活力的一个重要领域。
是各种分析方法中必不可少的重要步骤。
本章重点介绍沉淀分离、溶剂萃取分离法、色谱分离法和离子交换分离法,简介超临界流体萃取分离法和毛细管电泳分离法,本章是重点掌握各种方法的原理、特点及应用。
第一节概述如何评价分离方法的分离效果,可用回收率和分离因素来衡量一、回收率待测组分A的回收率R A为Q A100%式中,Q°为样品中A的总量、Q为分离后所测得的量。
R\越大,分离效果越好。
在实际工作中,对于含量1%以上的常量组分,回收率应在99%以上,对于微量组分,回收率为95%甚至更低一些也是允许的。
第二节沉淀分离法沉淀分离法是一种经典的分离方法,它是利用沉淀反应有选择性地沉淀某些离子,而其它离子则留于溶液中,从而达到分离的目的,沉淀分离法的主要依据是溶度积原理,以下讨论几种重要的沉淀分离法。
一、常量组分的沉淀分离(一)氢氧化物沉淀分离大多数金属离子都能生成氢氧化物沉淀,氢氧化物沉淀的形式溶液中的[OH] 有直接关系。
由于各种氢氧化物沉淀的溶度积有很大差别,因此可以通过控制酸度使某些金属离子相互分离。
常用的沉淀剂有:(1) 氢氧化钠(2) 氨水法(3) 有机碱法(4)Z n O悬浊液法( 二) 硫化物沉淀分离硫化物沉淀分离是根据各种硫化物的溶度积相差比较大的特点,通过控制溶液的酸度来控制硫离子浓度,而使金属离相互分离。
( 三) 其它无机沉淀剂①硫酸2+ 2+ 2+ 2+ 2+用于ca、S、B、R、R a等金属离子的分离。
②HF或NHF用于C a2、S r2、M g2、Th(IV) 、稀土金属离子的分离。
③磷酸用于Zr(IV) 、Hf(IV) 、Th(IV) 、B13等金属离子的分离。
分析化学的分离和富集

分析化学的分离和富集分离和富集技术在分析测试中是非常重要的。
因为分析样品绝大多数是复杂的混合物,无论是进行定性还是定量分析,一个好的分离或富集方法,是确保分析质量的前提。
随着现代科学技术和生产的发展,分离理论和技术已发展成为一门独立的学科——分离科学。
在分析化学中,分离和富集有以下方面的作用:(1)获得纯物质在分析测试工作中需要纯物质,如基准物、分光光度和色谱法的标准物,有一些可从相关的部门或供应商处获得,有的则需要自行纯化制备。
为了确定未知的混合物的组成,常常需要将样品用各种分离手段,得到其中各单一的化合物,进而用红外光谱、核磁共振、质谱等方法来确定其结构。
(2)消除干扰物质当样品中的干扰物质用控制酸度、加入掩蔽剂等手段仍然不能满足消除干扰的要求时,就必须采取分离的方法排除干扰,提高方法的准确度。
(3)富集微量及痕量待测组分当待测的痕量组分的含量低于测定方法的检测限时,需要用富集方法将痕量组分从大量基体物质中集中到一个较小体积的溶液中,以提高检测灵敏度。
一、沉淀和共沉淀分离法沉淀分离法是向样品溶液中加入沉淀剂,依据生成物溶解度的差别,使其中某些组分生成沉淀,达到与其它组分分离的目的。
沉淀分离法是一种经典的分离方法,其优点是操作简单,易于掌握,在常量分析中应用广泛。
共沉淀现象在称量分析和沉淀分离法中,是应当避的。
但在一定条件下,又可以利用共沉淀使痕量组分定量地转入沉淀中,来分离和富集微痕量组分,称为共沉淀分离法。
1.无机沉淀剂分离法一些金属的氢氧化物、硫化物、碳酸盐、草酸盐、硫酸盐、磷酸盐和卤化物溶解度较小,可被用于沉淀分离。
其中以氢氧化物沉淀法和硫化物沉淀法用得较多。
2.有机沉淀剂分离法有机沉淀剂与金属离子形成的沉淀有三种类型,即螯合物沉淀、缔合物沉淀和三元配合物沉淀。
有机沉淀剂生成的沉淀物溶解度小、分子量大、易于过滤和洗净,沉淀反应有较好的选择性。
共沉淀分离法在重量分析中,由于共沉淀现象,使沉淀不纯,影响分析结果的准确度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
10.2 气态分离法 P340~P343自学
将液体或固体试样中的待测成分以气体形式分离 出去的方法。
包括:挥发法 升华I2 蒸馏
6
10.3 沉淀分离法——据溶度积分步沉淀原理
11.3.1 氢氧化物沉淀分离法
1、NaOH( pH≥12)—分离两性与非两性元素 两性元素:Pb2+,Zn2+,Al3+,Cr3+,Aslll,v,Snll,lv,Sb3+不↓ Ag+,Hg22+,Hg2+,Bi3+,Cd2+,Fe3+,Fe2+,Co2+,Ni2+,Mn2+, Ti(Ⅳ),Mg2+,稀土等定量↓ CNaOH大时,部分Ba2+,Sr2+,Ca2+↓, Cu2+部分 Cu O22 蛋白质的分离-调pH至等电点
黑
褐
黄
橙红
棕黄
→ MmSn↓(Ⅰ,Ⅱ组阳离子)
12
2. (NH3-NH4Cl)+TAA,△
Ⅰ,Ⅱ,Ⅲ组阳离子↓ Fe3+,Fe2+,Co2+,Ni2+,Zn2+,Mn2+→MmSn↓
As,Sb,Sn(Ⅳ)的 MS 溶于过量Na2S中
黑
白肉
Al3+,Cr3+→Al(OH)3↓,Cr(OH)3↓
白
灰绿
11
10.3.2 硫化物沉淀分离法
分离某些重金属离子
沉淀剂:硫代乙酰胺(TAA) 控制酸度以控制S2-浓度
TAA
H+ 中→H2S NH3 中→(NH4)2S
OH-中→S2-
1. 0.2mol.L-1HCl+TAA,△(90℃)
Ag+,Pb2+,Hg22+,Hg2+, Cu2+, Bi3+, Cd2+,As(Ⅲ,Ⅴ),Sb(Ⅲ,Ⅴ),Sn(Ⅱ,Ⅳ)
1
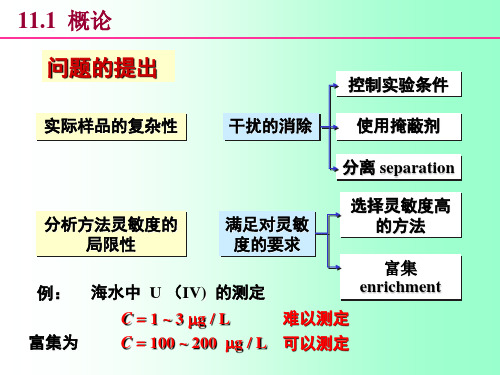
10.1 概述
定量分析过程:取样→溶样→消除干扰 → 测定 → 计算 控制实验条件 方法 掩蔽 分离
考虑方法的灵敏度
例:海水中 U (IV) 的测定
富集痕量组分 enrichment
C=1~2μg U(Ⅵ) / L 不易测量
富集: C = 200 ~ 400 g / L 可准确测定
2
固液分离
沉淀分离 固相萃取
3. 其它无机沉淀剂
H2SO4,H3PO4,HF or NH4F,HCl
稀HCl:Ag Hg22+ Pb→白↓( Ⅰ组阳离子)
HCl
AgCl,Hg2Cl2,PbCl2
NH3
溶于热水
Ag(NH3)2+ Pb(OH)2 HgNH2Cl(白)+Hg(黑)
13
(白)
灰黑
无机沉淀剂: 易产生共沉淀, 选择性不高; 应首先沉淀微量组分.
促进胶体↓凝聚并减少沉淀对杂质的吸附
沉淀经灼烧可除去铵离子
9
Al3+ Co2+
NH3-NH4Cl pH=8-9
Al(OH)3
Co(NH3 )62 [O]
Co(NH3 )36
加NH4+作用:①控制pH=8-9,防止Mg(OH)2↓,减 少Al(OH)3溶解②促进胶体↓凝聚(电解质)并减少沉 淀对杂质的吸附(抗衡离子)(沉淀经灼烧可除去铵
常量组分(>1%)回收率应>99.9%
微量组分(0.01%-1%)回收率应>99%
痕量组分(<0.01%)回收率应> 90%-95%
4
例1:PbS作共沉淀载体,富集海水中的Au(Au 0.2μg.L-1 10L)富集后的Au为1.7 μg,回收 率?
回收率= 1.7 100%=85% 0.210
5
氢氧化物:NaOH、NH3 硫化物:H2S 有机沉淀剂:H2C2O4,丁二酮肟
分
离子交换分离
阳离子交换树脂 阴离子交换树脂
气液分离:挥发和蒸馏 克氏定氮法,Cl2预氧化I-法
离
螯合物萃取
萃取分离 离子缔合物萃取
方 液液分离
法
膜分离
三元络合物萃取 支撑型液膜 乳状液型液膜
生物膜
气固分离——超临界流体萃取
其他分离方法:萃淋树脂、螯合树脂、浮选、色谱分离法 3
色谱分离法:气相色谱法,液相色谱法、电泳分析法
1、对分离的要求
干扰组分减少至不再干扰被测组分的测定
待测组分有效回收
分离的意义:消除干扰、富集微量待测组分
2、分离效果:回 收率 R =分 离原后来测的得量的量 1 0 0 %
回收率越高越好
(10-1)
答: Mn(OH)2部分沉淀,Mn将分别存在于沉淀与溶液 中。Mn不干扰Fe3+、Al3+ 测定,但却干扰Ca2+、Mg2+ 测定(EDTA络合滴定)。 应使Mn完全处于沉淀中,可同时加H2O2氧化Mn2+为 Mn(Ⅳ)——MnO(OH)2 ↓
第十章 分析化学中常用的分离和富集方法 Methods for Separation and Enrichment (Concentrate)
10.1 概述 10.2 气态分离法 Gas 10.3 沉淀分离法 Precipitation 10.4 萃取分离法 extraction 10.5 离子交换法 Ion exchange 10.6 色谱分离法Chromatography
7
“小体积沉淀法”:即在尽量小的体积和尽量大的浓度时,同 时加入大量无干扰作用的盐,使生成的沉淀含水量少,结构 紧密,以减少对待测组分or干扰组分的吸附。
NaOH 大量+而不吸附Al3+
8
2、 NH3-NH4Cl (pH=8-9)
分离氨络离子:Ag+,Cu2+,Cd2+,Co2+,Ni2+,Zn2+
高价金属离子: Hg2+,Al3+,Fe3+,Cr3+,Bi3+,Sb(Ⅳ), Sn4+,Ti4+,Zr(Ⅳ),Hf(Ⅳ),Th4+,V(Ⅴ),Nb(Ⅴ),Ta(Ⅴ), Be2+等定量M(OH)n↓ Ba2+,Sr2+,Ca2+,Mg2+,K+,Na+等不↓
Pb2+,Mn2+,Fe2+部分沉淀 加NH4作用 使pH=8~9,防止Mg(OH)2↓和Al(OH)3溶解
练习:
分析岩石中的Fe3+、Al3+、Ca2+、Mg2+、Mn2+等组分, 为将Fe3+、Al3+与Ca2+、Mg2+分离,常使用NH3-NH4Cl 体系,这时Mn将留在何处?若以EDTA 滴定法测定 Al3+、Fe3+以及Ca2+、Mg2+,让Mn留在沉淀中还是溶 液中为好?如何才能达到此目的?
14
离子)(氨水沉淀分离法中常加入大量NH4+盐,其作 用是什么?)
10
3 控制pH=5-6
① ZnO悬浊液法
高价离子Fe3+,Al3+,Cr3+,Th4+等定量↓ Ni2+,Co2+,Mn2+,Mg2+,Ca2+,Sr2+不↓
② 有机碱及其共轭酸缓冲溶液
(CH2)6N4- (CH2)6N4H+;吡啶等 Al3+,Fe3+,Ti(Ⅳ),Th(Ⅳ)等→M(OH)n↓ Mn2+,Co2+,Ni2+,Zn2+,Cd2+不↓
