元素分析作业
《原子结构与元素性质》作业设计方案

《原子结构与元素性质》作业设计方案一、作业目标1、帮助学生深入理解原子结构的基本概念,包括原子核、电子层、电子亚层、电子自旋等。
2、使学生能够掌握元素周期表的结构和规律,理解元素周期律的本质。
3、培养学生运用原子结构理论解释元素性质的能力,如原子半径、电离能、电负性等。
4、提高学生的逻辑思维能力和分析问题、解决问题的能力。
二、作业内容1、基础知识巩固(1)绘制原子结构示意图:选择 1-20 号元素中的 10 个元素,让学生画出它们的原子结构示意图,标明原子核、电子层、每层的电子数。
(2)元素周期表填空:给出一份空白的元素周期表,要求学生填写前 20 号元素的元素符号、名称、原子序数、相对原子质量。
(3)电子排布式书写:写出10 个常见元素(如钠、镁、铝、硅等)的电子排布式。
2、概念理解与应用(1)解释原子半径变化规律:让学生根据原子结构理论,解释同一周期和同一主族元素原子半径的变化规律,并举例说明。
(2)分析电离能变化趋势:给出一些元素的电离能数据,要求学生分析同一周期和同一主族元素电离能的变化趋势,并解释原因。
(3)比较电负性大小:给出几组元素,让学生比较它们的电负性大小,并说明判断依据。
3、拓展与探究(1)探究元素性质的周期性变化:选择一种元素性质(如金属性、非金属性),让学生查阅资料,分析其在元素周期表中的周期性变化规律,并举例说明。
(2)预测未知元素的性质:假设发现了一种新元素,其原子序数为 118,让学生根据元素周期律预测其可能的性质,如原子半径、主要化合价等。
4、实际应用(1)材料分析:提供一些关于材料科学的资料,介绍不同元素在材料中的作用,要求学生根据原子结构和元素性质的知识,解释为什么这些元素具有特定的作用。
(2)化学实验设计:设计一个实验,验证元素的金属性或非金属性强弱,要求学生写出实验原理、实验步骤、预期现象和结论。
三、作业形式1、书面作业(1)完成上述基础知识巩固、概念理解与应用的题目,以书面形式提交。
新教材高考化学一轮复习元素周期表 元素周期律作业

课时作业15元素周期表元素周期律一、单项选择题(本题包括6个小题,每小题只有1个选项符合题意)1.硒是人体必需的微量元素,如图是硒在周期表中的信息,关于硒元素的说法错误的是()A.位于第四周期B.质量数为34C.原子最外层有6个电子D.相对原子质量为78.962.下列说法正确的是()A.元素周期表每一周期元素原子的最外层电子排布均是从n s1过渡到n s2n p6B.所有的非金属元素都分布在p区C.原子核外电子排布式为1s1的原子与原子核外电子排布式为1s22s1的原子的化学性质相同D.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,所以统称为过渡金属元素3. B和Al为同族元素,下列说法错误的是()A.BF3和AlF3都可以与F-形成配位键B.H3BO3为三元酸,Al(OH)3呈两性C.共价键的方向性使晶体B有脆性,原子层的相对滑动使金属Al有延展性D.B和Al分别与N形成的共价晶体,均具有较高硬度和熔点4.如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是()A.y轴表示的可能是第一电离能B.y轴表示的可能是电负性C.y轴表示的可能是原子半径D.y轴表示的可能是形成基态离子转移的电子数5.元素周期表是安置元素的一座“大厦”,已知原子的下列结构或性质,能确定其在周期表中的“单元号和房间号”即位置的是()A.某元素原子的第二电子层电子轨道表示式为B.某元素在某种化合物中的化合价为+4C.某元素的原子最外层上电子数为6D.某元素的原子价层电子排布式为5s25p16.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。
下列说法正确的是()A.基态Fe2+与Fe3+中未成对的电子数之比为6∶5B.同一周期中,第一电离能:I1(B)>I1(Be)>I1(Li)C.第一电离能:I1(Li)>I1(Na),原因是Na的电子层数多,原子半径大D.Co位于元素周期表中的ds区二、不定项选择题(本题包括4个小题,每小题有1个或2个选项符合题意)7.下列说法不正确的是()A.某价电子排布式为4f75d16s2的基态原子,该元素位于周期表中第六周期第ⅢB族B.在元素周期表中,s区、d区和ds区的元素都是金属元素C.当碳原子的核外电子排布由转变为时,释放能量,由激发态转化成基态D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或88.现有三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。
《平面构成形式作业设计方案》

《平面构成形式》作业设计方案一、课程背景《平面构成形式》是一门专注于探讨平面构成原理、设计规律和艺术表现的课程。
通过进修本课程,学生将能够掌握平面构成的基本观点和技巧,提高审美能力和设计水平,为将来的设计工作打下坚实的基础。
二、课程目标1. 理解平面构成的基本原理和设计规律;2. 掌握平面构成形式的基本技巧和方法;3. 提高审美能力,培养独立思考和创新设计的能力;4. 培养团队合作和沟通能力,提高综合素质。
三、作业设计方案1. 作业一:平面构成元素分析要求学生选择一幅具有代表性的平面作品,对其进行构成元素的分析。
包括构图方式、色彩运用、形式结构等方面的分析,以及作者的设计意图和表现手法。
学生需要通过文字描述和图示展示自己的分析结果,同时提出自己的见解和思考。
2. 作业二:平面构成形式设计要求学生根据所学知识和技巧,设计一幅具有奇特构成形式的平面作品。
可以选择主题自由,但要求在构图、色彩、形式等方面体现出对平面构成原理的理解和运用。
学生需要提交设计草图和最终成品,并附上设计说明和反思。
3. 作业三:团队合作项目要求学生分组合作,设计一幅大型平面作品,展示团队的合作能力和创造力。
每位学生承担特定的任务和角色,共同完成作品的构思、设计和制作。
作品可以是海报、展板、宣传册等形式,要求体现出团队成员的个性和风格,同时保持整体的统一性和协调性。
四、评判标准1. 作业一:平面构成元素分析评分要点包括分析深度、逻辑性和观点奇特性。
学生需要准确把握作品的构成因素,理清其之间的干系,提出合理的见解和思考。
分析结果需要结合图示,清晰明了。
2. 作业二:平面构成形式设计评分要点包括构图创意、色彩运用和形式表达。
学生需要展现出奇特的设计风格和创意思维,同时运用所学技巧和原理,使作品具有艺术感和表现力。
设计说明和反思也是评分的重要依据。
3. 作业三:团队合作项目评分要点包括团队协作、作品质量和展示效果。
团队成员需要密切合作,分工明确,共同完成作品的设计和制作。
高中化学鲁科版必修2作业:元素周期表的应用-卤素单质化学性质的相似性和递变性 Word版含解析

卤素单质化学性质的相似性和递变性1.通过分析元素周期表的结构和各元素性质的变化趋势,下列关于砹(原子序数为85)及其化合物的叙述中肯定不正确的是()A.砹与氢气较难发生反应B.相同条件下砹化氢比碘化氢稳定C.相同条件下砹化氢比碘化氢易分解D.砹元素位于第六周期2.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是()A.与氢气化合的能力:At2>I2B.砹在常温下为白色固体C.砹原子的最外电子层上有7个电子D.砹能从氯化钠溶液中置换出氯3.若能发现第117号元素X,它的原子结构与卤族元素相似,电子排布有7个电子层,且最外层有7个电子。
下列叙述中正确的是()A.X元素的气态氢化物的化学式为HX,在常温下很稳定B.其单质带有金属光泽,具有强氧化性,可与碘化钾发生置换反应生成单质碘C.其单质的分子式为X2,易溶于有机溶剂D.AgX是一种有色的易溶于水的化合物4.下列说法正确的是()A.氟、氯、溴原子的最外层电子数都是7,次外层电子数都是8B.由HF、HCl、HBr、HI酸性增强,可知氟、氯、溴、碘非金属性增强C.氟、氯、溴、碘的非金属性逐渐减弱是因为它们的电子层数逐渐增大D.砹是原子序数最大的卤族元素,它易溶于水,难溶于四氯化碳5.卤族元素碘的原子半径较大,可能呈现一定的金属性。
下列事实中最能够说明这个结论的是()A.单质碘能与氢氧化钠溶液反应B.已经制得ICl、IBr等卤素互化物C.单质碘易溶于碘化钾等碘化物溶液,形成I离子D.已经制得I (NO3)3、I (ClO4)3·2H2O等含I3+的离子化合物6.下列有关卤族元素的叙述不正确的是()A.卤素单质从F2到I2,颜色加深,熔点沸点升高B.卤素从氯到碘,最高价氧化物对应水化物的酸性减弱C.卤素从氟到碘,卤化氢水溶液酸性增强D.随着核电荷数的增加,卤素单质的氧化性增强7.下列关于卤族元素的叙述中,正确的是()A.随着原子序数的增加,元素的非金属性逐渐增强B.随着原子序数的减小,单质的氧化性逐渐增强C.通常呈黄绿色的也是氧化性最强的D.易升华的也是相对分子质量最大的8.下列说法中,不符合第ⅦA族元素性质特征的是()A.从上到下元素的非金属性增强B.易形成-1价离子C.最高价氧化物的水化物显酸性(氟除外)D.从上到下氢化物的稳定性依次减弱9.卤族元素按氟、氯、溴、碘的顺序,下列叙述正确的是() A.单质的颜色逐渐加深B.气态氢化物的稳定性逐渐增强C.与氢气反应越来越容易D.单质的熔、沸点逐渐降低10.随着卤素原子半径的增大,下列递变规律正确的是() A.单质的熔沸点逐渐降低B.卤素离子的还原性逐渐增强C.气态氢化物稳定性逐渐增强D.与氢气反应越来越容易11.卤族元素随原子核电荷数的增加,下列叙述不正确的是() A.原子半径依次增大B.元素的非金属性依次减弱C.单质的氧化性依次减弱D.氢化物的稳定性依次增强12.下列关于卤族元素的比较中,错误的是()A.气态氢化物的稳定性:HF>HCl>HBr>HIB.单质的氧化性:F2>Cl2>Br2>I2C.离子的还原性:F->Cl->Br->I-D.元素的非金属性:F>Cl>Br>I13.下列关于卤族元素的比较中,不正确的是()A.卤族元素的原子半径:F<Cl<Br<IB.单质的沸点:F2<Cl2<Br2<I2C.单质与氢气化合的难易:F2>Cl2>Br2>I2D.氢卤酸的酸性:HF>HCl>HBr>HI14.下列关于卤化氢的说法中不正确的是()A.卤素原子序数越大,其氢化物越稳定B.卤素原子序数越大,其氢化物越不稳定C.卤化氢稳定性的顺序为HF>HCl>HBr>HID.卤素单质与氢气越难反应,生成的氢化物越不稳定15.关于卤素单质(X2)的下列叙述中正确的是()A.都能与氢气化合发生爆炸B.都能与水剧烈反应C.都能与钠反应生成NaXD.都能与铁反应生成FeX316.关于卤素的下列叙述正确的是()A.卤素只能以化合态存在于自然界中B.卤素单质都能与水剧烈反应,生成氢卤酸和次卤酸C.卤素单质越活泼,其熔点、沸点就越高D.卤素是典型的非金属元素,它们不能与其他非金属元素化合17.下列关于卤素(用X表示)的叙述正确的是()A .卤素单质与水反应的通式为X2+H2O HX+HXOB.卤化氢都易溶于水,其水溶液都是强酸C.卤素单质都有颜色,都有毒D.卤素最高价含氧酸的通式为HXO418.卤素单质能与金属卤化物溶液反应,下列说法中不正确的是()A.该反应为置换反应B.有单质生成C.有卤素单质生成D.可能有氧气生成19.若用X代表氟、氯、溴、碘四种卤素,下列属于它们共性反应的是()A .X2+H2O HX+HXOB .X2+H22HXC .2Fe+3X22FeX3D .X2+2NaOH NaX+NaXO+H2O20.关于卤族元素的下列说法正确的是()A.所有卤族元素的微粒都易得电子B.和氟同一主族的元素都是非金属元素C.化合物中卤族元素都显负价D.卤族元素原子的原子半径从上到下逐渐减小21.氟、氯、溴、碘四种元素,下列有关它们的性质递变规律的说法,不正确的是() A.单质的密度依次增大B.单质的熔点和沸点依次升高C.氯气可从碘化钾溶液中置换出碘D.溴单质可从氯化钠溶液中置换出氯22.往碘化钾溶液中先加入氯水,再加入四氯化碳振荡,静置后出现分层,下层呈() A.橙红色B.紫红色C.无色D.深褐色23.甲、乙、丙三种溶液各含有一种X-(X-为Cl-,Br-,I-),向甲中加淀粉溶液和新制的氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。
元素分析报告

元素分析报告
本报告旨在对样品中的元素进行分析,以便了解其成分和性质。
通过仔细的实
验和数据处理,我们得出了以下结论。
首先,我们对样品进行了取样和前处理,确保取得的样品具有代表性。
接着,
我们使用了多种分析方法,包括原子吸收光谱、质谱和电子显微镜等,对样品中的元素进行了全面的分析。
在分析过程中,我们发现样品中含有丰富的金属元素,包括铁、铜、铝等。
这
些金属元素的含量较高,说明样品可能是一种金属合金或矿石。
此外,我们还发现样品中含有少量的非金属元素,如硫、氧等。
这些非金属元素的存在可能会影响样品的性质和用途。
在对样品进行定量分析时,我们发现样品中的元素含量符合国家标准和行业要求,没有超出允许范围。
这表明样品的质量较好,可以满足相关生产和应用的要求。
综合分析结果,我们认为样品中的元素含量均匀分布,没有出现局部富集或稀
释现象。
这为样品的加工和利用提供了良好的基础。
在分析过程中,我们还发现了一些与样品相关的问题和隐患,需要进一步的研
究和解决。
例如,样品中可能存在微量的有害元素,需要加强环境保护和安全管理措施。
此外,样品的成分和结构可能会受到一些外部因素的影响,需要进行更深入的研究和分析。
综上所述,本报告对样品中的元素进行了全面的分析和评估,得出了一些重要
的结论和建议。
我们将继续深入研究,为相关领域的发展和应用提供更多的支持和帮助。
感谢各位专家和同事的支持和帮助,也希望本报告的内容能够对相关领域的研究和实践有所启发和促进。
我们将继续努力,为科学研究和技术创新做出更大的贡献。
谢谢!。
钢材(元素测定)化学分析方法作业指导书

钢材化学分析方法1.总则1.1.本细作适用于生铁、碳素钢、合金钢、不锈钢等钢材的化学元素含量的测定。
1.2.本细则依据国标GB223《钢铁及合金化学分析方法》编写。
1.3.钢样的制备1.3.1.化学分析用试样样屑采用钻头钻取(钻头直径应尽可能的大),对于小断面钢材钻头直径不应小于16mm,对大断面钢材钻头直径不应小于12mm。
1.3.2.制取样屑时,不得用水、油或其它润滑剂,并去除钢材表面的氧化层和脏物。
钻取样屑应尽可能成细颗粒状,钻取深度达钢材厚度的2/3处。
1.3.3.钻取的样屑应混合均匀,用试样袋装好,试样袋编写上试样编号、材质规格、分析项目。
2.碳硫元素联合测定方法2.1.适用范围本方法采用GB/T 223.69-2008《钢铁及合金碳含量的测定管式炉内燃烧后气体容量法》和GB/T223.68-1997《管式炉内燃烧后碘酸钾滴定法测定硫含量》两个标准编写。
测定范围:C:0.02~1.50%(减少称量可扩大至0.02—6.00%)S:0.003%—0.100%。
适用于生铁、碳素钢、合金钢和不锈钢的碳硫含量的联合测定。
2.2.仪器与试剂2.2.1.仪器:TP-CS2C型碳硫高速分析仪;电炉:0~1600℃/±10℃氧气瓶和氧气减压阀等。
2.2.2.各种溶液的配制:1、各种溶液的配制:(1)水准瓶溶液:1000mL蒸馏水中加入10ml浓硫酸。
(2)储气瓶溶液:1000ml蒸馏水中加入300~400g氢氧化钾。
(3)滴定瓶碘溶液(A溶液):用天平称取2g碘,置于烧杯中,加少量蒸镏水,称碘化钾20g分批加入,使碘全部溶解。
淀粉吸收液(B溶液):用天平称取2g可溶性淀粉,加入100mL煮沸的蒸镏水中,继续煮沸2—3分钟后冷却取下.将A、B两种溶液混合,用蒸镏水稀释至5000ml,摇匀。
2.3.试验程序:2.3.1.检查仪器各连接部位是否连接正确。
接通电源。
铁、碳钢及低合金钢试样,升温至1250℃左右,不锈钢、高合金钢、高温合金及精密合金升温至1300~1350℃。
植物灰分常量元素分析

坩埚使用口诀
• • • 炉;半开门,先灰化。 关炉门,定炉温;灼烧至,重量恒。
容量瓶的使用
• 容量瓶专定容,其它场合不要用。 • 混匀方法:体积半时先摇动,定到刻度颠 倒混。 • 拿瓶要点:一只手指拿上颈,另只手指托 下面。
十三周
• 十三、十四周:尿素和铵太氮肥总含氮量 的测定 • 十五周、十六周:过磷酸钙中有效磷的测 定 • 十七周:化肥分析小结 • 十八周:考试
考试参考题目
• • • • 植物灰分中常量元素的定性 常用化肥的定性分析 未知植物中钙镁含量的测定 尿素和氨态化肥中全氮含量的测定(甲醛 法、蒸馏滴定法)
常用仪器及试剂
• • • • • • • 高温电炉(马弗炉)烘箱 坩埚 坩埚钳 托盘天平 电子天平 容量瓶 烧杯 硝酸(1:1) 双氧水(a%=30%) 100g/L硝酸铵溶液
坩埚
• 准备坩埚(灰化容器) 目前常有的坩埚:石英坩 埚;素瓷坩埚;白金坩埚;不锈钢坩埚 • 素瓷坩埚在实验室常用,它的物理性质和化学性 质和石英相同,耐高温,内壁光滑可以用热酸洗 涤,价格低,对碱性敏感。下面我们谈到的坩埚 都是素瓷坩埚。 • 坩埚→ (1:4)盐酸煮沸洗净→降至200℃→放 入干燥室内冷却到室温→称重(空坩埚)
第十一周实验安排
• • • • • • 周二下午2点半开始上课地点6-408 上课内容: 植物分析实验总结 肥料分析(请预习课本中相关章节) 植物分析实验心得交流(王海军、林涛) 作业:提交一份植物样品分析的综合报告
第十二周安排
• 周一A组同学:化肥的定性分析(周二交) • 周二B组同学:化肥的定性分析(周三交) 参看附件1 预习尿素和铵太氮肥总含氮量的测定(蒸馏 滴定、甲醛法)
操作步骤
• • 1. 2. 3. 4. 5. 6. 样品处理(干燥、粉碎) 灰分测定 坩埚恒重 称量样品 碳化 高温灰化 降温冷却 恒重
《元素周期表的应用》 作业设计方案

《元素周期表的应用》作业设计方案一、作业目标1、使学生深入理解元素周期表的结构和规律,包括周期、族、原子序数、原子半径、化合价等重要概念。
2、培养学生运用元素周期表预测元素性质、推断化学反应的能力。
3、增强学生对化学元素之间的系统性和规律性的认识,提高学生的逻辑思维能力。
4、激发学生对化学学科的兴趣,培养学生自主学习和探究的精神。
二、作业内容1、基础知识巩固(1)让学生绘制元素周期表的简略图,并标注出周期、族、主族和副族的位置。
(2)写出前 20 号元素的元素符号、名称、原子序数、核外电子排布式,并指出它们在周期表中的位置。
2、性质规律探究(1)比较同一周期从左到右元素的原子半径、金属性和非金属性的变化规律,并举例说明。
(2)比较同一主族从上到下元素的最高价氧化物对应水化物的酸性或碱性的变化规律,并解释原因。
3、元素推断给出一些元素的性质描述或相关化学反应,让学生推断出这些元素在周期表中的位置和名称。
例如:“某元素的最高价氧化物对应水化物是一种强酸,该元素的原子序数小于 20,试推断该元素。
”4、实际应用分析(1)让学生查阅资料,了解元素周期表在材料科学、生命科学、环境科学等领域的应用,并撰写一篇简短的报告。
(2)分析元素周期表对寻找新型材料和药物的指导作用,举例说明。
5、拓展创新(1)假设元素周期表中新增了一个周期,让学生根据已有的规律推测可能出现的新元素的性质。
(2)设计一个基于元素周期表的游戏或谜题,如元素拼图、元素密码等,让学生在游戏中巩固知识。
三、作业形式1、书面作业包括填空题、简答题、计算题等,用于巩固学生对元素周期表基本概念和规律的理解。
2、实践作业(1)实验探究:通过实验探究某些元素化合物的性质,验证元素周期表中的规律。
(2)调查研究:让学生进行社会调查,了解元素周期表在实际生活中的应用。
3、小组作业(1)组织学生分组讨论元素周期表中的疑难问题,共同完成作业任务。
(2)开展小组竞赛,如元素周期表知识竞赛,激发学生的学习积极性。
《主题一 第二节 元素周期律》作业设计方案

《元素周期律》作业设计方案(第一课时)一、作业目标本次作业旨在帮助学生理解和掌握元素周期律的基本概念和规律,加深对周期表的理解,并能够应用周期律分析元素性质与原子结构的关系。
二、作业内容1. 完成周期表填写:学生需根据所学知识,在指定的表格中填写出所学到的元素,按照原子序数、元素符号、元素名称、原子核外电子排布等信息进行填写,并标出金属元素、非金属元素等类别。
2. 元素性质分析:学生需根据周期表和元素周期律,分析不同周期、不同主族元素的性质变化规律,例如金属性、非金属性、氧化性、还原性等方面的变化。
3. 实验操作:学生需根据所学实验知识,进行相关的实验操作,例如对不同金属进行性质测试、对不同非金属元素进行性质验证等,并记录实验结果。
4. 周期律应用:学生需根据所学知识,应用周期律分析元素周期表的结构,理解元素周期表的变化规律,并能够根据规律预测未知元素的性质。
三、作业要求1. 作业内容需真实、完整、无误;2. 分析过程需有理有据,符合逻辑;3. 实验操作需按照实验室安全规范进行,记录真实实验结果;4. 按时提交作业,字数不少于XX字。
四、作业评价1. 作业完成情况:根据学生提交的作业,评价其是否完成了所有任务,是否按照要求进行分析和实验操作;2. 知识掌握情况:根据学生分析过程的准确性和完整性,评价其对元素周期律和周期表的理解程度;3. 技能应用情况:根据学生应用周期律分析元素周期表的能力和实验操作能力,评价其技能水平;4. 其他:对学生遇到的困难和问题给予指导和帮助,鼓励积极思考和探索。
五、作业反馈教师将定期对学生的作业进行反馈和指导,对存在的问题进行讲解和分析,同时收集学生的问题和建议,不断改进教学方法和手段。
学生也可以通过反馈部分向教师提出自己的疑问和困惑,寻求帮助和指导。
作业设计方案(第二课时)一、作业目标1. 复习并掌握元素周期律的内容和意义。
2. 理解元素周期律在化学学习中的应用。
3. 提高学生对周期律的理解和运用能力。
高中化学1.4.2元素分析和相对分子质量的测定课时作业新人教版选修5
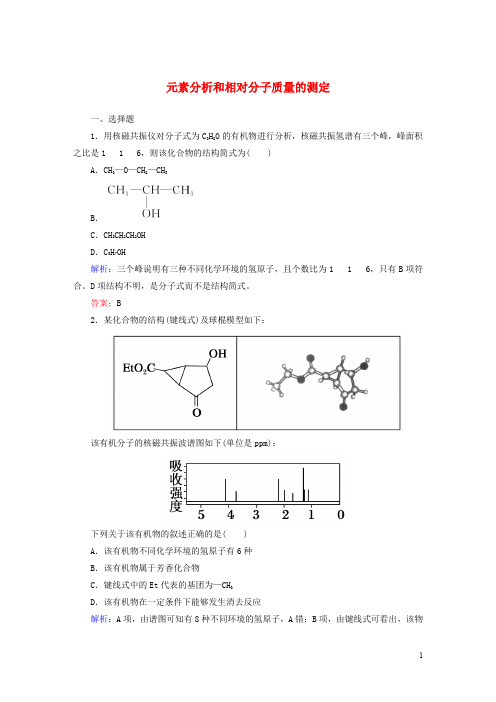
元素分析和相对分子质量的测定一、选择题1.用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有三个峰,峰面积之比是116,则该化合物的结构简式为( )A.CH3—O—CH2—CH3B.C.CH3CH2CH2OHD.C3H7OH解析:三个峰说明有三种不同化学环境的氢原子,且个数比为116,只有B项符合。
D项结构不明,是分子式而不是结构简式。
答案:B2.某化合物的结构(键线式)及球棍模型如下:该有机分子的核磁共振波谱图如下(单位是ppm):下列关于该有机物的叙述正确的是( )A.该有机物不同化学环境的氢原子有6种B.该有机物属于芳香化合物C.键线式中的Et代表的基团为—CH3D.该有机物在一定条件下能够发生消去反应解析:A项,由谱图可知有8种不同环境的氢原子,A错;B项,由键线式可看出,该物质中无苯环,不属于芳香化合物,B错;C项,Et为—CH2CH3,C错。
答案:D3.已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是( )A.由红外光谱可知,该有机物中至少有三种不同的化学键B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子C.仅由核磁共振氢谱无法得知其分子中的氢原子总数D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3解析:由A的红外光谱知A中有—OH,由A的核磁共振氢谱知A中有3种氢原子,故若A的化学式为C2H6O,则其结构简式为CH3CH2OH。
答案:D4.已知某有机物A的核磁共振氢谱如下图所示,下列说法中,错误的是( )A.若A的分子式为C3H6O2,则其结构简式为CH3COOCH3B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为12 3C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数D.若A的化学式为C3H6O2,则其同分异构体有三种解析:由核磁共振氢谱可知,其分子中含有三种不同化学环境的氢原子,峰的面积之比等于其原子个数之比,但不能确定具体个数,故B、C正确;由A的分子式C3H6O2可知,其同分异构体有3种:CH3COOCH3、CH3CH2COOH、HCOOCH2CH3。
2021届高考化学二轮复习元素及其化合物作业

元素及其化合物1.(2020浙江7月选考,2分)Ca 3SiO 5是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是A.可发生反应:Ca 3SiO 5+4NH 4ClCaSiO 3+2CaCl 2+4NH 3↑+2H 2O B.具有吸水性,需要密封保存C.能与SO 2反应生成新盐D.与足量盐酸作用,所得固体产物主要为SiO 21.D 本题考查元素化合物知识,考查的化学学科核心素养是证据推理与模型认知。
加热时氯化铵分解生成HCl 和氨气,HCl 与Ca 3SiO 5反应得到硅酸钙、氯化钙和水,A 项正确;水泥吸水会变硬,需密封保存,B 项正确;Ca 3SiO 5能与二氧化硫反应得到亚硫酸钙,C 项正确;由上述分析可知,Ca 3SiO 5与足量盐酸反应得不到二氧化硅,D 项错误。
2.(2020全国卷Ⅱ,6分)二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如图所示。
下列叙述错误的是A.海水酸化能引起HC O 3-浓度增大、C O 32−浓度减小B.海水酸化能促进CaCO 3的溶解,导致珊瑚礁减少C.CO 2能引起海水酸化,其原理为HC O 3-H ++C O 32− D.使用太阳能、氢能等新能源可改善珊瑚的生存环境2.C 本题考查CO 2与海洋环境的关系,考查的核心素养是宏观辨识与微观探析。
根据图示可知CO 2的过量排放,能导致海水中CO 2+H 2OH 2CO 3H ++HC O 3-平衡右移;H +又能与珊瑚礁溶解生成的C O 32−结合生成HC O 3-,促使CaCO 3Ca 2++C O 32−平衡右移,从而使珊瑚礁减少。
结合上述分析可知海水酸化,海水中H +和HC O 3-的浓度均增大,使海水中C O 32−的浓度减小,A 项正确;H +可结合珊瑚礁溶解产生的C O 32−,故能促进CaCO 3的溶解,使珊瑚礁减少,B 项正确;CO 2引起海水酸化的原理为CO 2+H 2O H 2CO 3H ++HC O 3-,C 项错误;使用太阳能、氢能等新能源,能有效减少CO 2的排放,利于改善珊瑚的生存环境,D 项正确。
3.3元素同步分层作业(培优篇)—九年级化学人教版上册

(培优篇)2021-2022学年上学期初中化学人教新版九年级同步分层作业3.3元素一.选择题(共4小题)1.图a是两种元素在元素周期表中的信息,图b是氟元素的原子结构示意图。
下列说法正确的是( )A.图a“钠”方框右上角横线上应填写N AB.图b方框横线上的数字是8C.氟元素属于金属元素D.11号元素与9号元素可以形成化学式为NaF的化合物2.如图是元素周期表的一部分(X元素信息不全),下列说法正确的是( )A.碳元素的质子数是6B.X表示N2C.碳的相对原子质量是12.01gD.质子数由大到小的顺序为C>X>O3.稀土有“工业维生素”的美誉。
铼是所有稀土中含量最少的稀有元素。
比钻石还要珍贵,在航空领域作用极大。
铼在元素周期表中的信息及原子结构示意图如图所示,下列说法中错误的是( )A.铼原子核内有75个质子B.铼元素的相对原子质量是186.2gC.铼元素位于元素周期表中第六周期D.铼元素在化学反应中易失去电子4.近日,山西省科技重大专项项目“煤炭伴生稀有金属锂镓提取技术研究”通过专家验收。
如图是与镓有关的信息,下列表述错误的是( )A.“?”的数值为31B.镓的元素名称是GaC.镓离子的符号是Ga3+D.镓原子核外有4个电子层二.填空题(共5小题)5.如图是元素周期表的一部分,A、B、C、D代表四种不同的元素。
(1)分别写出B、C代表的元素的符号:B 、C 。
(2)D原子的质子数为 ,A的离子符号为 。
6.元素周期表是学习和研究化学的重要工具。
下表为元素周期表的一部分,请回答下列问题:(1)上表中的“22.99”表示 。
(2)写出13号元素和17号元素形成化合物的化学式 。
(3)某粒子的结构示意图为,该粒子的符号是 。
7.如图是元素周期表中1~18号元素的相关信息,请认真分析并回答下列问题。
(1)原子序数为5的元素的名称是 ,它位于元素周期表中第 周期。
(2)在化学反应中,原子序数为16的元素的原子容易 (填“得到”或“失去”)电子,所形成的粒子的符号是 。
有机化合物的元素定性分析

【仪器与药品】
• 仪器: 1、称量天平 2、100ml烧杯、25×200试管、
10×100试管、 15×150试管 3、酒精灯
【仪器与药品】
药品:
1、蔗糖 2、CuO(干燥粉末)、金属钠、无水碳酸钠 3、 10%NaOH 、5%FeCl3、饱和FeSO4 4、 Ba(OH)2饱和液、10%HAc、 10%H2SO4、 、Pb(Ac)2试纸、 95%乙醇
【实验原理】
1.碳氢的检定: 有机物+CuO(粉末)强 热 CO2+H2O Ba(OH)2+CO2→BaCO3↓+H2O
含有氢则氧化成水,冷却在管壁上,或 用白色无水CuSO4粉末检验,它与水作用 生成蓝色CuSO4·5H2O
有机物(含有C、H、O、N、S、X)+Na
(单质) 强 热
共熔
NaCN 、 Na2S NaCNS 、 NaX
2、在滤纸上切取金属钠时,粘在滤纸上的微 小钠碎粒应如何处理?
3、鉴定卤素时,若试样还有硫和氮,用硝酸 酸化再煮沸,可能有什么气体放出?应如 何正确处理?
• 作业:2、3
感谢您的阅读! 为 了 便于学习和使用,本 文档下载后内容可随意修 改调整及打印 , 欢 迎 下 载 !
• 2I-+Cl2→2Cl-+I2 (CCl4层紫色) • I2+5CL2+6H2O→2IO3-+12H++10Cl• 2Br-+Cl2→2Cl-+Br2 (CCl4层出现棕色)
④Cl-的检验(有N、S、Br、I、共存时):煮 沸酸性试液+AgNO3,所有AgX沉淀下来,再 加大量氨水并滤去不容物,将滤液酸化后加 入AgNO3,有白色沉淀表明有氯。
《平面构成基础知识作业设计方案》

《平面构成基础知识》作业设计方案一、设计背景《平面构成基础知识》是设计类专业中的重要课程之一,通过进修该课程,学生可以掌握平面构成的基本观点、原理和技巧,为今后的设计实践奠定坚实的基础。
为了帮助学生更好地掌握课程内容,提高他们的进修兴趣和能力,设计了以下作业方案。
二、作业目标1. 熟悉平面构成的基本观点和原理。
2. 掌握平面构成的常用技巧和方法。
3. 提高学生的设计能力和审美水平。
三、作业内容1. 作业一:平面构成元素分析要求学生选择一幅图片,对其中的平面构成元素进行分析,包括线条、形状、色彩、纹理等,分析其构成原理和表现效果,并撰写一份分析报告。
2. 作业二:平面构成实践要求学生设计一幅具有平面构成特点的作品,可以是海报、广告、画册封面等,要求注重构图、色彩搭配和视觉效果,体现课程所学的平面构成技巧和原理。
3. 作业三:平面构成案例分析要求学生选择一则广告、海报或包装设计作品,对其进行分析,探讨其中所运用的平面构成技巧和方法,总结其成功的地方,并提出自己的改进建议。
四、作业要求1. 作业要求书面表达清晰、逻辑性强,要有明确的论点和论据支持。
2. 作业要求注重实践性,学生可以结合自己的设计实践经验进行分析和总结。
3. 作业要求峻厉按照要求完成,不得抄袭他人作品或资料。
五、作业评判标准1. 内容完备性:是否涵盖了平面构成的基本观点、原理和技巧。
2. 分析深度:是否对所选图片或作品进行了深入的分析和探讨。
3. 创意性:是否能够体现学生的设计能力和审美水平。
4. 表达能力:书面表达是否清晰、准确、逻辑性强。
六、作业提交方式学生需按时完成作业,并通过线上平台提交,作业截止日期为课程结束前一周。
任何迟交或抄袭行为将被峻厉处理。
七、作业批改与反馈作业将由专业教师进行批改和评分,学生将获得详细的评语和建议,以便提高他们的进修水平宁能力。
同时,教师将定期组织作业讨论和交流,增进学生之间的进修互动和交流。
通过以上设计方案的实施,置信学生们将更好地掌握《平面构成基础知识》,提高自己的设计能力和审美水平,为未来的设计实践奠定坚实的基础。
五元素化学分析作业指导书

山东龙光银河杆塔有限公司液压牛头刨床操作规程文件编号:Q/版本号 A修订次 0分发号持有人受控状态批准:刘京伟审核:王夕峰编写:马国亮液压牛头刨床操作规程1、启动机床电动机和油泵,必须事先检查电气线路和接地线路是否良好,有无漏电、损坏情况;然后再检查各种手柄、手轮和捏手,使之符合要求位置,方可启动。
初试车和久停后重新启用机床时,应事先点动按钮,检查电机转后必须与其指示箭头相符。
2、凡扳下开停手柄至“1”位启动滑枕时,事先应转动检查变级手轮,必须使之准确到位,否则不得任意开车!3、机床正式工作前,应启动滑枕在1极工作速度下空运转3~5分钟,以观察电动机油泵运转及其噪声和滑枕运行及其导轨润滑是否正常,并按润滑标牌所示对其各润滑点浇注润滑油。
4、操作手轮、转换滑枕各级速度时,必须先将开停手柄板至“0”位,令滑枕停车后才能进行。
变级手轮操作需迅速和准确到位,切忌在中间位置停滞!5、压力表开关捏手,除调试观察示压时需要转动外,在机床运行中,应始终处于“0”位关闭状态,不得无故开用,以免损坏压力表。
6、停用自动抬刀时间超过四小时以上,再行启用时,需先拧松管接头螺母并启动滑枕行复运行数次,排除油管中的气体,以保证抬刀动作正常。
7、必须限制滑枕的行程长度不得少于150mm。
加工短小工件时,应采用多件组合装卡加工的方法,充分发挥机床的有效行程,以提高生产率。
8、垂向快移或进给移动横梁和工作台时,均需事先松开左、右短压板螺母和前支架上的两个紧固螺母。
其垂向移动距离不得超越标牌所示的上、下位置极限,工作台垂向快移至所需位置后,如需进行横向进给加工时,应分别拧紧左、右短压板螺母和前支架上的两个紧固螺母。
当进行重切削加工时,还需在前支架上安装支撑销轴并用方头螺栓顶撑工作台底面。
9、刀架回转一定角度使用时,必须注意调整前后挡铁位置,使滑枕行程尽可能处在前端位置,并严格限制行程长度不超过850mm,以免刀架撞击床身导轨。
10、机床超负荷使用时,除滑枕Ⅰ级工作速度有最大工作压力保护外,其余各级速度应严格限制其工作压力,不的超过。
《第三单元课题3元素》作业设计方案-初中化学人教版九年级上册

《元素》作业设计方案(第一课时)一、作业目标本次《元素》第一课时的作业设计旨在使学生能够:1. 理解元素的概念,并能识别常见的元素符号。
2. 掌握元素周期表的基本结构和排列规律。
3. 通过实践活动,增强对元素性质和应用的了解。
二、作业内容1. 理论知识巩固学生需完成《元素》相关概念和理论的学习,包括元素的定义、分类、元素周期表的构成等。
并熟记前20号元素的符号及基本性质。
2. 元素周期表学习学生需仔细研究元素周期表,理解元素的排列顺序和周期性规律,尝试找出不同元素间的关系和规律。
3. 实践活动(1)绘制元素周期表的一部分,标出前20号元素的符号和部分性质。
(2)查阅资料,了解至少五种常见元素的性质及其在日常生活中的应用。
(3)以小组形式进行元素知识竞答,可以是线上或线下进行,内容涵盖所学元素的性质和用途等。
三、作业要求1. 理论知识巩固部分要求学生在课本上做好笔记,并能够流利地复述元素的基本概念。
2. 元素周期表学习部分要求学生能够准确无误地指出元素的相对位置,并能够解释其排列的规律。
3. 实践活动部分要求学生认真完成,尤其是对元素性质和应用部分的调研,需有详细的记录和心得体会。
小组竞答需有明确的分工和记录,体现团队合作精神。
四、作业评价作业评价将根据以下标准进行:(1)理论知识的掌握程度;(2)周期表绘制的准确性和完整性;(3)对元素性质和应用的调研深度和广度;(4)小组竞答的参与度和正确率。
教师将根据学生的完成情况进行评分,并给出相应的建议和指导。
五、作业反馈教师将在收到作业后进行详细批改,对优秀的学生给予表扬和鼓励,对存在问题的部分给予指导和帮助。
同时,教师会将学生的共性问题进行总结,并在课堂上进行讲解。
学生也需根据教师的反馈,对自己的学习情况进行反思和总结,以便更好地掌握《元素》这一章节的知识。
附加说明:除了本次作业,学生需注重与同学的交流和合作,尤其是在小组竞答环节,应体现出良好的团队合作精神。
《元素与物质的分类》 作业设计方案

《元素与物质的分类》作业设计方案一、作业设计目标1、帮助学生深入理解元素的概念,包括元素的定义、性质和在物质中的存在形式。
2、使学生掌握物质分类的方法,能够清晰地区分纯净物和混合物、单质和化合物、无机物和有机物等。
3、培养学生运用元素和物质分类的知识解决实际问题的能力。
4、提高学生观察、分析和归纳总结的思维能力。
二、作业设计原则1、基础性原则作业内容要涵盖元素与物质分类的基础知识,确保学生能够巩固课堂所学。
2、层次性原则根据学生的学习能力和水平,设计不同难度层次的作业,满足不同层次学生的需求。
3、趣味性原则通过设置有趣的情境或问题,激发学生的学习兴趣,提高作业完成的积极性。
4、开放性原则鼓励学生从不同角度思考问题,培养学生的创新思维和发散思维。
三、作业内容(一)基础知识巩固1、请写出 20 种常见元素的名称和符号。
2、下列物质中,属于纯净物的是(),属于混合物的是()。
氧气糖水二氧化碳空气蒸馏水3、写出下列物质的化学式,并指出它们属于单质还是化合物。
铁水氦气氯化钠(二)知识应用1、请根据元素组成对下列物质进行分类:酒精(C₂H₅OH)甲烷(CH₄)葡萄糖(C₆H₁₂O₆)尿素CO(NH₂)₂2、生活中常见的下列物质,属于有机物的是(),属于无机物的是()。
塑料食盐食用油大理石(三)拓展提升1、查阅资料,了解元素周期表的发展历程,并写一篇简短的介绍。
2、探究某种新型材料的组成元素,并尝试对其进行分类。
(四)实践作业1、整理自己家中的物品,按照物质的分类方法进行归类。
2、参观当地的化工厂或实验室,了解物质分类在实际生产中的应用,并撰写一篇参观报告。
四、作业形式1、书面作业包括填空题、选择题、简答题等,以巩固学生的基础知识和基本概念。
2、探究作业通过查阅资料、实验探究等方式,培养学生的自主学习能力和探究精神。
3、实践作业让学生将所学知识应用到实际生活中,增强学生对知识的理解和运用能力。
五、作业评价1、评价方式采用教师评价、学生自评和互评相结合的方式。
灰分元素分析测定

• Fe:取一滴灰分提取液滴于载玻片一段,取一滴 1剂%,F观eC察l3溶红液色与产另物一的端出,现每,段判都断加Fe入元一素滴的5有%无硫。氰化钾试
• S:取一滴灰分提取液滴于载玻片一端,取一滴 1%MgSO4溶液滴于另一端,每滴都加入一滴10%BaCl2试 剂,盖上盖玻片,在显微镜下观察比较结晶颜色和形状, 判断S元素的有无。
• Ca:取一滴灰分提取液滴于载玻片一端,取一滴 5%CaCl2溶液与另一端,每段都加入一滴10%H2SO4试剂, 在酒精灯上略加热,盖上盖玻片,在显微镜下观察比较结 晶的颜色和形状,判断Ca元素的有无。
• 五、结论与讨论
• 比较标准和灰分加入反应试剂后的反应, 判断灰分中相应元素的有无。
• 六、作业 • 记录每种元素的特征性反应。
LOGO
Than
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学与环境科学学院分析化学 20144015016 骆洪伟元素分析的原理及仪器介绍一、元素分析的基本原理1.有机元素定义有机元素通常是指在有机化合物中分布较广和较为常见的元素,如碳(C)、氢(H)、氧(O)、氮(N)、硫(S)等元素。
2.元素分析仪测定的原理待测样品在高温条件下,经氧气的氧化与复合催化剂的共同作用,使待测样品发生氧化燃烧与还原反应,被测样品组份转化为气态物质(CO2, H2O,N2与SO2),并在载气的推动下,进入分离检测单元。
分离单元采用色谱法原理,利用气相色谱柱,将被测样品的混合组份CO2, H2O, N2与SO2载入到色谱柱中。
由于这些组份在色谱柱中流出的时间不同(即不同的保留时间),从而使混合组份按照N,C H,S的顺序被分离,被分离出的单组份气体,通过热导检测器分析测量,不同组份的气体在热导检测器中的导热系数不同,从而使仪器针对不同组份产生出不同的读取数值,并通过与标准样品比对分析达到定量分析的目的。
3.有机元素分析仪上常用检测方法主要有:示差热导法、反应气相色谱法、电量法和电导法。
二、Vario ELⅢ型元素分析仪介绍1.Function of the vario EL 仪器的功能The elementary analyzer vario EL is a fully automatic instrument for a speedy and quantitative determination of CHNOS. Depending on the purchased equipment , the instrument can-in different operation modes-determine the following elements simultaneously from one sample weigh-in: CHNS, CNS, CHN, CN, N, and S.元素分析仪vario EL是一个快速的,用于C、H、N、O、S定量测定的全自动仪器。
根据购买的设备,仪器能有不同的操作模式,从同一个样品称量中同时测定一些元素:CHNS,CNS,CHN,CN,N,和S。
The suitability of the vario EL analyzer for the element analysisdepends on the controllable combustibility of the samples or sample quantities.对元素分析来说,vario EL分析仪的适应性根据样品可控制的燃烧性和样品的量。
2.General Measuring Principle 通用测量原理The elementary analyzer vario EL works according to the principle of catalytic tube combustion in an oxygenated CO2 atmosphere and high temperatures. The combustion gases are freed from foreign gases (for instance volatile halogen). The desired measuring components are separated from each other with the help of specific adsorption columns and determined in succession with a thermal conductivity detector (TCD). Helium (He) serves as flushing and carrier gas.元素分析仪vario EL工作原理是根据在氧化的CO2气氛中和高温下接触反应的试管燃烧原理工作的。
燃烧气不含杂质气体(例如挥发性的卤素)。
需测量部分在特殊吸附柱和热导仪(TCD)连续测定的帮助下彼此分离。
氦(He)用于冲洗和载气。
3.Analysis 分析The automatic control of the analysis procedure is accomplished through the software and the sample specific nitrogen dosing is allocated through index numbers (O2-Index 1-5) to the appropriate sample matrix. The oxygen dosing can be regulated by the operator .分析程序的自动控制是通过软件完成的,样品特殊氮的是通过指数(O2指数1-5)分配到适合的样品矩阵。
加氧量能由操作者控制。
We will now explain the timely and functional course of an analysis. With the help of illustrations 4.1 and the figures/letters in brackets, it is possible to follow the location of the described process. Illustration 4.1 shows the simplified flow diagram of the CHNS mode, since all three possible adsorption columns (SO2, H2O, CO2) are built in. Depending on the mode of operation, only the adsorption columns of the elements to be determined are built into the gas line. To makeit clear, the adsorption columns should not be seen as bridged.我们将说明一个分析的适时的和功能的过程。
在图示4.1和括弧中的数字或字母的帮助下,能理解所描述过程的位置。
由于所有3个吸附管都是内置的(SO2, H2O, CO2),图示4.1显示了CHNS模式的简化的流程图。
根据操作模式,只有要被测定的元素吸附柱才能列入气体路线里面。
为了使它更清楚,吸附柱不应被看作为过渡。
图4.1 : vario EL (CHNS模式)的流程图LegendV2 valves for 6 ash crucible 灰坩埚7 reduction tube 还原管V3 desorption path SO2用于解吸附SO2通道的阀V4 O2-input valve O2输入阀8 drying tubes 干燥管V7 He-input valve He输入阀9 gas control insert 气体控制插入V8 valves for 10 flow controller, measuring side流量控制器,测量方面V9 desorption path H2O 11 detector (TCD) 热导仪用于解吸附H2O通道的阀A SO2-adsorption columnSO2吸附柱12 throttle, reference side 节流阀,参考方面B H2O-adsorption columnH2O吸附柱13 drying tube, reference gas 干燥管,参考气体C CO2-adsorption columnCO2吸附柱14 gauge, gas inlet pressure 量表,气体入口压力1 Carousel旋转式进样盘15 flowmeter for O2 and He 用于O2和He的流量表2 ball valve 球阀16 gas cleaning tube 气体清洁试管3 combustion tube 燃烧试管17 pressure sensor 压力传感器4 3-tube furnace可容3个试管的加热炉18 drying tube, oxygen 干燥管,氧5 O2-lance O2输入口19 needle valve for O2-dosing用于O2加入的针形阀4.Sample loading 样品装填The homogenized sample is packed in tin foil, weighed and placed into the carousel of the automatic sample feeder (1). The sample weight is entered into the PC either from an on-line balance via an interface or manually with the keyboard. The sample name and the matrix specific oxygen dosing (O2-Index 1-5) is allocated to the sample weight . Now the analysis can be started.均匀分布的微粒样品包裹在锡箔中,称重之后放入自动样品进样器的旋转式进样盘中(1)。
样品重量输入PC中,既可通过界面的在线天平也可用键盘手动输入。
样品名称和矩阵特殊的加氧量(O2-指数1-5)被分配到样品重量中。
现在分析能开始了。
At the start of an analysis, the Auto-Zero Adjust of the measuring signal is carried out through the detector (9). Thereafter the ball valve (2) opens through a 180° turn of the blind hole ball. The carousel (1) moves up one position and the sample drops into the blind hole of the ball valve (2). The ball valve (2) turns 90°into flushing position and seals the apparatus. The atmospheric nitrogen that had entered is now flushed out and after flushing is completed, the sample drops into the ash finger (6) of the combustion tube (3)through another 90° turn of the ball valve (2).在分析开始时,测量信号的自动调零通过检测器(9)执行。
