土壤有效硅的测定
ICP-AES法测定土壤中的有效硅

ICP-AES法测定土壤中的有效硅摘要:中酸性土壤中的有效硅使用柠檬酸浸提,石灰性土壤中有效硅使用pH4.0的醋酸-醋酸钠缓冲溶液浸提。
过滤后浸提液直接使用电感耦合等离子体发射光谱法测定。
方法检出限低,精密度好,比传统的硅钼蓝比色法流程短,操作简便。
可广泛应用于生产实践中。
关键词:有效硅;电感耦合等离子体发射光谱(ICP-AES);高灵敏度硅是植物体组成的重要营养元素,对作物的生长发育有积极作用,特别是在增强作物的抗逆性和抗病虫害能力方面有明显效果。
硅可促进作物根系生长,增加根量,提高根系的氧化力和呼吸率,增强根系活力[1-2]。
此外硅还能改良盐碱地和酸性土壤,有改善农产品品质的作用。
土壤有效硅是指土壤中可供当季作物吸收利用的硅素,包括土壤溶液中的单硅酸及各种易于转化为单硅酸的成分,是目前广泛应用的衡量土壤供硅能力的指标,所以测定土壤中有效硅含量可及时了解当前土壤硅素肥力的状况,对指导施肥、改良土壤、提高产量、保护环境具有重要意义[3-5]。
林业部标准LY/T 1266-1999规定了土壤中有效硅的测定方法,土壤经醋酸-醋酸钠缓冲溶液或柠檬酸溶液浸提,过滤分取后采用硅钼蓝分光光度法测定其含量。
此方法涉及的试剂繁多,显色过程繁琐,先要形成硅钼黄,用草酸等掩蔽剂去除磷干扰后,再用硫酸亚铁铵等还原剂还原成硅钼蓝[6]。
操作中要严格控制显色温度及两次显色时间,温度太高或太低都会对测定结果造成巨大影响。
再者,硅钼蓝分光光度法所绘制的标准曲线的线性范围太窄,一般不超过10μg/mL,在实际测量样品时,含量有高有低,事前并不知道要分取多少溶液才能使得结果在线性范围内,这样我们往往需要再二次测定,浪费了许多时间的试剂。
因此,我们采用电感耦合等离子发射光谱法(ICP-AES)测定有效硅的含量。
ICP-AES法分析样品具有操作简单,检出限低,线性范围宽,精密度良好,重现性好等优点[7-8],节约了时间和成本;并能对多元素和元素的多个分析线同时测定,快速优化仪器测试条件,消除基体和共存元素的干扰。
电感耦合等离子体发射光谱(ICP-OES)测定土壤中有效硅

电感耦合等离子体发射光谱(ICP-OES)测定土壤中有效硅周大颖;龚小见;钟宏波【摘要】建立了电感耦合等离子体发射光谱(ICP-OES)测定土壤中有效硅含量的方法.研究了ICP-OES工作条件、测定谱线等对有效硅检测结果的影响.结果表明建立的方法检出限低(0.03μg,/mL)、精密度高(0.25%~0.92%)、回收率好(95.9%~104.5%).通过对国家土壤有效态一级标准物质有效硅的测试,测定结果与标准物质证书结果基本一致.该方法灵敏度高、重复性好、准确度高、操作简便,完全适用于土壤中有效硅的测定.%The method of determining effective silicon content in soil was established by ICP-OES.The effects of ICP-OES working conditions and spectrometric lines on the effective silicon detection results were studied.The results showed that the detected limit of this method was low (0.03μg/mL),with the hig her precision of this method (0.25%~0.92%),and the recovery rate of this method was good (95.9%~104.5%).The results of the test and the national soil effective state level were consistent with the standard material certificate.This determination method was high sensitivity,good repeatability,high accuracy and feasible operation,which was suitable for the determination of effective silicon in soil.【期刊名称】《贵州师范大学学报(自然科学版)》【年(卷),期】2018(036)003【总页数】4页(P52-55)【关键词】ICP-OES;土壤;有效硅【作者】周大颖;龚小见;钟宏波【作者单位】贵州师范大学天然药物质量控制研究中心,贵州贵阳 550001;贵州省产品质量监督检验院,贵州贵阳 550016;贵州师范大学天然药物质量控制研究中心,贵州贵阳 550001;贵州省产品质量监督检验院,贵州贵阳 550016【正文语种】中文【中图分类】O657.30 引言硅是植物生长所必需的一种营养元素。
森林土壤有效硅的测定(分光光度法)测量不确定度评估报告

森林土壤有效硅的测定(分光光度法)测量不确定度评估报告摘要:检测土壤中的有效硅元素可有效掌握土壤硅素肥力的情况,对改善土质、科学施肥、提高质量、环保有着重大作用。
有效硅是环境分析的关键的指标之一。
在完全相同的测量条件下,测量多次,每次得到的计数是不同的,评价测量结果的水平如何,用不确定度来说明。
不确定度愈小,检测水平越高;反之,不确定度愈大,检测水平越低。
因此学会不确定度的评定是实际检测工作中很重要的部分。
依据LY/T1266-1999《森林土壤有效硅的测定》,分析在土壤有效硅测定时,其中存在的不确定量,探讨不确定量。
关键词:不确定度;土壤有效硅含量;硅钼蓝比色法1.检测方法依据LY/T 1266-1999《森林土壤有效硅的测定》2.测定原理经柠檬酸缓冲溶液中淋失的硅,在特定的酸性环境下,可与钼试药反应得到硅钼酸,当用草酸为掩蔽物以消除对磷的影响时,硅钼酸又可被用硫酸亚铁铵等还原剂再得到硅钼蓝溶液,在上述规定的范围内,蓝深浅与硅浓度成正比,因此也可进行比色测试。
3.测定过程针对风干后的土样利用2毫米筛处理,然后称取10.00克备用,在塑料瓶中利用0.025mol/L柠檬酸溶液进行混合,溶液量为0.1L,确保混合均匀。
放于预先调节至30摄氏度的恒温箱中,每隔1小时摇动一次,取出后用干滤纸过滤。
取滤液0.005L于0.05L容量瓶中,用水稀释至0.015L左右,依次加入硫酸、钼酸铵溶液,摇匀后放置10分钟。
再依次加入草酸铵。
硫酸亚铁铵溶液,用水定容。
放置20分钟后,用1厘米比色皿在700纳米波长处比色。
4.测量结果的计算(1)测量结果计算公式:(2)被测溶液中SiO2的浓度x由线性回归方程计算得到:y = bx + a计算森林土壤中有效硅所产生的各不确定度量,并按照不确定度传递率,相对的不稳定程度如下:因此,可以明确不确定度各分量。
表1:不确定度各分量5.各不确定度分量的计算5.1称重土壤样品质量引入的不确定度根据电子天平IE014-14校准证书,扩展不确定度U=0.03g(k=2),所以标准不确定度为:。
土壤有效硅的测定

土壤有效硅的测定A 0.025mol •L-1柠檬酸浸提—硅钼蓝比色法1 方法提要土壤中有效硅以0.025 mol ·L -1柠檬酸浸提,浸提出的硅酸在一定的酸度条件下可与钼试剂反应生成硅钼酸,用草酸等掩蔽剂去除磷的干扰后,硅钼酸可被抗坏血酸等还原剂还原成硅钼蓝,在一定浓度范围内,蓝色深浅与硅含量成正比,可进行比色测定。
2 适用范围本方法适用于酸性、中性和微碱性土壤中有效硅的测定。
3 主要仪器设备3.1 分光光度计;3.2恒温往复式或旋转式振荡机,满足180r/min 的振荡频率或达到相同效果。
4 试剂4.1 无水碳酸钠(Na 2CO 3);4.2 柠檬酸溶液 [c (C 6H 8O 7)= 0.025 mol ·L -1]:称取5.25 g 柠檬酸(C 6H 8O 7.H 2O )溶于水中,稀释至1L ;4.3 硫酸溶液[c (21H 2SO 4)=0.6 mol ·L -1]:吸取16.6mL 浓硫酸,缓缓加入到800mL 水中,冷却后稀释至1L ; 4.4 硫酸溶液 [c (21H 2SO 4)=6 mol ·L -1]:量取166mL 浓硫酸,缓缓加入到800mL 水中,冷却后稀释至1L ;4.5 钼酸铵溶液 [ρ((NH 4)6Mo 7O 24·4H 2O)=50g ·L -1]:称取50.00g 钼酸铵溶于水中,稀释至1L ;4.6 草酸溶液 [ρ(H 2C 2O 4·2H 2O )=50g ·L -1]:称取50.00g 草酸溶于水中,稀释至1L ;4.7 抗坏血酸溶液[ρ(C 6H 8O 6)=15g ·L -1]:称取1.50g 抗坏血酸(左旋,C 6H 8O 6),用[c (21H 2SO 4)=6 mol ·L -1]硫酸溶液溶解并稀释至100mL 。
此液需随用随配; 4.8 硅标准储备溶液[ρ(Si )=500μg ·mL -1]:称取经920℃灼烧过的二氧化硅(SiO 2,优级纯)0.5347g ,放入铂坩锅中,另取4g 无水碳酸钠于一干净容器中,将3/4的碳酸钠加入铂坩锅内,以细圆头玻棒(以防玻棒划伤坩锅)小心搅拌均匀,再用剩余的碳酸钠擦洗玻棒并无损移入坩锅中覆盖在混合物表面。
NYT 1121.15-2006 土壤 有效硅 方法验证
1方法依据
本方法依据NY/T 1121.15-2006 土壤有效硅的测定
2仪器和设备
紫外-可见分光光度计;
3分析步骤
详见NY/T 1121.15-2006 土壤有效硅的测定
4试验结果报告
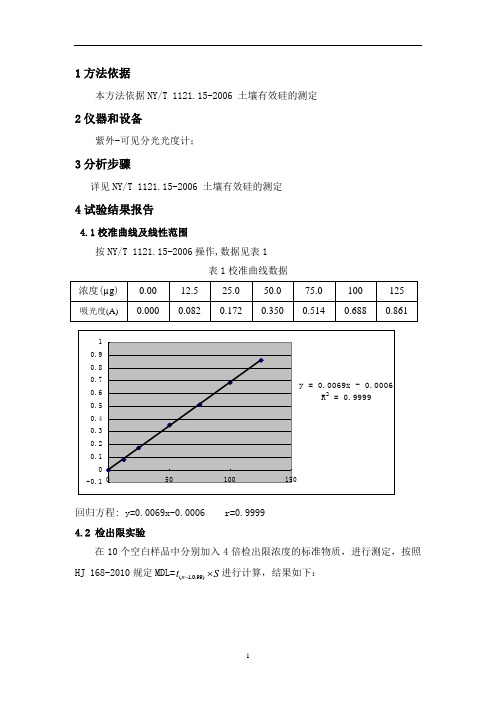
4.1校准曲线及线性范围
按NY/T 1121.15-2006操作,数据见表1
表1校准曲线数据
回归方程: y=0.0069x-0.0006 r=0.9999 4.2 检出限实验
在10个空白样品中分别加入4倍检出限浓度的标准物质,进行测定,按照HJ 168-2010规定MDL=S t n ⨯-)99.0,1(进行计算,结果如下:
表2 方法检出限测定结果(N=10)
计算得出方法检出限为1.00mg/kg
由W(Si,mg/kg) =
m
其中:C—由校准曲线查得显色液中硅的含量,μg;
m—试样质量,g;m=10g;
D —分取倍数,100/5=20。
4.3精密度实验
取2个浓度水平的样品,按照步骤3,分别做6次平行实验,计算出有效硅的浓度平均值,最大相对相差,相对标准偏差,结果见表3
表3 精密度测试数据
4.4 准确度实验
取2个有证标准物质,按照步骤3,平行测定6份样品,计算平均值,相对误差,检测结果见表4
表4 有证标准物质测试
5 结论
5.1检出限
实验室检出限为1.00mg/kg。
5.2精密度
样品1平均值为129mg/kg,最大相对相差为5%;样品2平均值为563mg/kg,最大相对相差为2%;标准中要求平行测定结果的相对相差≤10%。
5.3准确度
有证标准物质GBW07460(ASA-9)、GBW07458(ASA-7)单次测定结果均在标准值范围内。
土壤有效硅测定

土壤有效硅测定土壤有效硅的测定(NY/T1121.15-2006)2019-2-131 本方法用于测定水稻土有效硅,对酸性、中性及微碱性土壤测定结果较为一致。
土壤经酸性提取剂在恒温下提取有效硅。
测定体系中,通过降低酸浓度到0.03M、加入草酸以抑制磷的干扰。
2、提取:称取4.00g 过2mm筛风干土,装入50ml圆底离心管中,加40ml 0.025M柠檬酸提取液,30度下提取5小时(中间间断震荡3-4次),3000转离心15分钟(或过滤,不用玻璃漏斗),上清液倒入塑料瓶中待测(为避免高浓度硅溶液的聚合,常温勿超过两天存储。
长期储存需要添加1ml 40% 氢氧化钠,并在计算时考虑稀释因素)。
3、测定(钼蓝法):取待测液5ml(视含量,20-120ug),于50ml容量瓶中,加水到15ml 左右,加2滴2,4-二硝基酚指示剂,用1N 氢氧化钠和0.3M硫酸调整到微黄,混匀,放置15-20分钟,加0.3M硫酸、5%钼酸铵各5ml,摇匀,放置5分钟,加5%草酸、1.5%Vc各5ml,定容,20分钟后700nm比色。
4、标准曲线:以1000mg SiO2/L(467mgSi/L)标准溶液,按下表配制,标准曲线,各加与待测液等量的提取液,同上测定。
SiO2(ppm)吸取标准1000mg SiO2/L(ml)0 01 0.052 0.103 0.154 0.205 0.255、计算:有效硅含量(mg SiO2/kg)=硅浓度(ppm)*50ml*取用倍数(40/5)/重量g如果加了氢氧化钠,需要乘以(稀释后体积/稀释前体积)6、试剂6.1 0.025M柠檬酸提取液:称取一水柠檬酸(FW210.14)5.25g 溶于1000ml水中(pH约2.36)。
6.2 硝基酚指示剂:2-6-二硝基酚或2-4-二硝基酚溶于水中(饱和)。
6.3 5M硫酸:取25ml浓硫酸,在搅拌情况下加入到75ml水中。
6.4 1N 氢氧化钠: 4g氢氧化钠水溶解,定容1000ml,塑料瓶盛放。
土壤有效硅的测定

ICS 1 3.080.05B11N Y 中华人民共禾口国农业行业标准NY/T1121.1卜2006土壤检测第1 5部分:土壤有效硅的测定Soil TestingPa rt15:Method for determination of soll ava ilable si licon2006—07—10发布2006—10—01实施中华人民共和国农业部发布NY/T 1121 15—2006刖罱NY/T1121《土壤检测》为系列标准,包括以下部分——第1部分:土壤样品的采集、处理和贮存——第2部分:土壤pH的测定——第3部分:土壤机械组成的测定——第4部分:土壤容重的测定——第5部分:石灰性土壤阳离子交换量的测定——第6部分:土壤有机质的测定——第7部分:酸性土壤有效磷的测定——第8部分:土壤有效硼的测定——第9部分:土壤有效钼的测定——第10部分:土壤总汞的测定——第11部分:土壤总砷的测定——第12部分:土壤总铬的测定——第13部分:土壤交换性钙和镁的测定——第14部分:土壤有效硫的测定——第15部分:土壤有效硅的测定——第16部分:土壤水溶性盐总量的测定——第17部分:土壤氯离子含量的测定——第18部分:土壤硫酸根离子含量的测定本部分为NY/T 1121的第15部分。
本部分由中华人民共和国农业部提出并归口。
本部分起草单位:全国农业技术推广服务中心、湖南省土壤肥料工作站、安徽省土壤肥料总站。
本部分主要起草人:辛景树、田有国、任意、黄铁平、张一凡、郑磊。
NY/T 1121.15—2006土壤检测第15部分:土壤有效硅的测定1应用范围本部分适用于各种类型水稻土中二氧化硅含量的测定,对于酸性、中性及微碱性土壤具有较为一致的浸提能力。
2方法提要用柠檬酸作浸提剂,浸出的硅在一定酸度条件下与钼试剂生成硅钼酸,用草酸掩蔽磷的干扰后,硅钼酸可被抗坏血酸还原成硅钼蓝,在一定浓度范围内蓝色深浅与硅浓度成正比,从而可用比色法测定。
土壤有效硅的测定标准曲线

土壤有效硅的测定标准曲线
土壤有效硅是指能够被植物吸收利用的硅元素。
测定土壤有效硅含量的方法有很多种,其中最常用的是酸提-氢氟酸分解法。
为了准
确测定土壤有效硅的含量,需要建立标准曲线。
建立土壤有效硅的测定标准曲线需要以下步骤:
1.准备不同浓度的硅标准溶液,将其分别加入相同质量的土壤中,进行提取和分析。
2.通过分析不同浓度的硅标准溶液所得到的硅含量和其对应土
壤提取液的硅含量,建立标准曲线。
3.使用标准曲线对待测土壤提取液的硅含量进行定量分析,并计算出土壤有效硅含量。
标准曲线的建立可以提高测定土壤有效硅含量的准确性和可靠性,为土壤养分管理和作物生长提供重要参考。
- 1 -。
农业土壤有效硅含量测定中的相关因素研究-农艺学论文-农学论文

农业土壤有效硅含量测定中的相关因素研究-农艺学论文-农学论文——文章均为WORD文档,下载后可直接编辑使用亦可打印——摘要:对农业土壤中的有效硅含量进行测量, 不仅能有效了解当前农业土壤中硅素肥力的实际情况, 还对指导农业土壤改良、施肥有着重要的意义。
结合个人实践工作经验与相关参考文献, 就农业土壤中有效硅的测试结果影响因素展开分析, 以供参考。
关键词:农业土壤; 有效硅含量; 影响因素;Abstract:Measuring the effective silicon content inagricultural soil can not only effectively understand the actual situation of silicon fertility in agricultural soil, but also have important significance for guiding agricultural soil improvement and fertilization. Combining personal work experience and related references, the factors affecting the test results of effective silicon in agricultural soil are analyzed for reference.Keyword:Agricultural soil; Effective silicon content; Influencing factors;对于农作物的生长发育而言, 硅有着至关重要的促进作用, 尤其是在农作物的抗逆性与抗病虫害能力方面, 有着十分显着的效果。
同时, 硅还能最大限度降低土壤中磷的固定, 对土壤中的磷起到活化作用, 有效改善高磷肥的利用效果。
安徽省水稻土有效硅测定方法及影响因素

安徽省水稻土有效硅测定方法及影响因素曹克丽【摘要】[目的]探讨安徽省水稻土有效硅测定方法及其影响因素,为硅肥施用提供借鉴.[方法]采取土壤有效硅测定方法间对比分析法以及土壤有效硅含量与土壤性质间相关分析法.[结果]采取不同方法测定有效硅含量间虽有较大差异,但存在极显著线性正相关关系.供试水稻土有效硅含量存在较大差异,多数水稻土有效硅含量低于临界值.土壤母质和基本性质对有效硅含量有较大影响.[结论]安徽省水稻土有效硅测定以浓度1%柠檬酸法和pH 4.0醋酸-醋酸钠法方法较好.成土母质、土壤pH、黏粒含量是影响有效硅含量的主要因素.【期刊名称】《安徽农业科学》【年(卷),期】2013(000)028【总页数】3页(P11549-11551)【关键词】土壤有效硅;测定方法;水稻土;影响因素【作者】曹克丽【作者单位】湖北省生态工程职业技术学院,湖北武汉430200【正文语种】中文【中图分类】S153.6硅在水稻生长发育中发挥积极作用[1]。
土壤硅素供应状况及硅肥施用在水稻生产中日益受到人们重视,已被列为水稻增产的四大元素之一。
硅可促进水稻根系生长,增加根量,提高根系的氧化力和呼吸率,增强根系活力;硅可提高水稻同化二氧化碳的能力,使水稻增产;硅能增强作物的抗逆性、抗病虫害能力等。
目前,反映土壤硅素供应状况的主要指标——土壤有效硅含量测定选用的提取剂较多,结果也有较大差异。
针对某一地区水稻土,研究其有效硅的测定方法及其影响因素对指导水稻硅肥施用有重要意义。
笔者通过筛选适宜于安徽省水稻土的有效硅测定方法,研究安徽省水稻土有效硅状况及其影响因素,为安徽省水稻土供硅能力评价及水稻硅肥施用提供参考。
1 材料与方法1.1 供试材料采集安徽省不同地区不同母质上发育的水稻土27个样品。
供试土壤基本性质见表1。
同时,采集水稻植株样品供植株硅素分析。
1.2 测定方法土壤有效硅含量[2-5]的测定方法见表2。
水稻植株硅含量的测定采用重量法[4];土壤pH的测定采用酸度计法;土壤有机质的测定采用重铬酸钾外加热法;土壤颗粒组成的测定采用比重计法;土壤有效磷的测定采用Olsen法;土壤速效钾的测定采用1 mol/L中性醋酸铵浸提—火焰光度法[3-4]。
土壤硅的测定

土壤硅的测定咱今儿就来说说土壤硅的测定这档子事儿。
你说这土壤硅啊,就像是土壤这个大“家庭”里的一个重要成员。
那怎么才能知道这个成员在这个家里的分量有多重呢?这就得靠咱们去测定啦!想象一下,土壤就好比是一个大宝藏,而硅就是藏在里面的宝贝。
要找到这个宝贝可不容易呢,得有合适的方法和工具。
一般来说呢,测定土壤硅可以用一些化学方法。
就好像我们找东西,得有个趁手的工具,这些化学方法就是我们的“秘密武器”。
比如说有个方法是先把土壤样本弄碎了,就像把一个大蛋糕切成小块儿,这样才能更好地去研究它里面的成分。
然后通过一些化学反应,让硅现形。
这过程就好像是在玩一个解谜游戏,一点点地揭开硅的神秘面纱。
这测定的过程可得细心点儿,就跟咱包饺子一样,得仔细地擀皮儿、包馅儿,稍有疏忽,这饺子可就包不好啦。
要是不认真对待,那得出的结果能靠谱吗?那肯定不行啊!还有啊,不同的土壤类型,测定硅的方法可能还不太一样呢。
这就好比不同的人有不同的性格,得用不同的方法去对待。
比如黏土和砂土,那能一样吗?肯定不能啊!所以啊,咱得根据具体情况来选择合适的方法。
咱再说说这测定土壤硅有啥用呢?嘿,用处可大啦!就好像你知道了自己身体里有多少营养元素,才能更好地去补充营养,让自己更健康。
知道了土壤里硅的含量,就能更好地去管理土壤,让土壤发挥出更大的作用。
比如要是硅少了,咱就给它补补,让土壤更肥沃,种出来的庄稼不就更好啦?而且啊,这对搞农业的人来说尤其重要。
农民伯伯们辛辛苦苦种地,不就是希望有个好收成嘛。
要是能通过测定土壤硅来让土地更适合种庄稼,那他们得多高兴啊!这就像是给农民伯伯们送了一份大礼。
总之呢,土壤硅的测定可不是一件小事儿,它关系到我们的土地、我们的庄稼、我们的生活。
我们可得认真对待,就像对待我们最喜欢的宝贝一样。
大家说是不是这个理儿呀?所以啊,别小看了这土壤硅的测定,它可是有着大作用呢!。
土壤中全硅的测定实验报告

土壤中全硅的测定实验报告随着科技的发展,现代工业对环境的污染越来越严重。
尤其是近几年,由于全球气候变暖,我国华北地区大面积出现了沙尘暴天气,这给人们带来很多困扰。
为此,我想通过研究沙尘暴形成原因及防治措施,从而改善当前的状况。
土壤中全硅的测定实验报告第一部分:仪器与药品1、实验用的称量瓶、烧杯等玻璃容器要洗净,并且晾干;2、称取5g土样放入250ml 三角瓶内,加入5ml盐酸,盖好瓶塞后摇匀,然后再滴加15ml 盐酸至刚好完全反应,静置片刻待溶液澄清后,用少许蒸馏水洗涤烧杯壁,洗液并入盛有土样的三角瓶内,混合均匀后备用。
3.自来水用小苏打溶液((或生石灰))调成不同浓度的溶液进行消化,直到无白色沉淀为止。
4.将在上述过程中产生的沉淀都倒入滤纸上,以便观察。
5.将滤纸铺平,用吸管向纸上吹气使之润湿,然后把它夹在两个试管中间,用橡皮筋扎紧,做成“空心”的玻璃管。
6.用蒸馏水冲洗干净容量瓶和移液管,装满水,用酒精灯火焰烘烤烧杯外壁,直到水沸腾,趁热转动容量瓶,使水沿玻璃管流下,冷却后读数。
7.用少许蒸馏水将三角瓶内的残留物质洗去,然后按照上述方法处理另一份土样。
8.如果需要,可用少量稀硝酸浸泡烧杯,除去氧化膜。
9.称取0.1g土样放入250ml 三角瓶内,加10ml盐酸,盖好瓶塞后摇匀,然后再滴加15ml 盐酸至刚好完全反应,静置片刻待溶液澄清后,用少许蒸馏水洗涤烧杯壁,洗液并入盛有土样的三角瓶内,混合均匀后备用。
10.将在上述过程中产生的沉淀都倒入滤纸上,以便观察。
11.将滤纸铺平,用吸管向纸上吹气使之润湿,然后把它夹在两个试管中间,用橡皮筋扎紧,做成“空心”的玻璃管。
12.用蒸馏水冲洗干净容量瓶和移液管,装满水,用酒精灯火焰烘烤烧杯外壁,直到水沸腾,趁热转动容量瓶,使水沿玻璃管流下,冷却后读数。
13.用少许蒸馏水将三角瓶内的残留物质洗去,然后按照上述方法处理另一份土样。
14.如果需要,可用少量稀硝酸浸泡烧杯,除去氧化膜。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
土壤有效硅的测定A 0.025mol •L-1柠檬酸浸提—硅钼蓝比色法1 方法提要土壤中有效硅以0.025 mol ·L -1柠檬酸浸提,浸提出的硅酸在一定的酸度条件下可与钼试剂反应生成硅钼酸,用草酸等掩蔽剂去除磷的干扰后,硅钼酸可被抗坏血酸等还原剂还原成硅钼蓝,在一定浓度范围内,蓝色深浅与硅含量成正比,可进行比色测定。
2 适用范围本方法适用于酸性、中性和微碱性土壤中有效硅的测定。
3 主要仪器设备3.1 分光光度计;3.2恒温往复式或旋转式振荡机,满足180r/min 的振荡频率或达到相同效果。
4 试剂4.1 无水碳酸钠(Na 2CO 3);4.2 柠檬酸溶液 [c (C 6H 8O 7)= 0.025 mol ·L -1]:称取5.25 g 柠檬酸(C 6H 8O 7.H 2O )溶于水中,稀释至1L ;4.3 硫酸溶液[c (21H 2SO 4)=0.6 mol ·L -1]:吸取16.6mL 浓硫酸,缓缓加入到800mL 水中,冷却后稀释至1L ; 4.4 硫酸溶液 [c (21H 2SO 4)=6 mol ·L -1]:量取166mL 浓硫酸,缓缓加入到800mL 水中,冷却后稀释至1L ;4.5 钼酸铵溶液 [ρ((NH 4)6Mo 7O 24·4H 2O)=50g ·L -1]:称取50.00g 钼酸铵溶于水中,稀释至1L ;4.6 草酸溶液 [ρ(H 2C 2O 4·2H 2O )=50g ·L -1]:称取50.00g 草酸溶于水中,稀释至1L ;4.7 抗坏血酸溶液[ρ(C 6H 8O 6)=15g ·L -1]:称取1.50g 抗坏血酸(左旋,C 6H 8O 6),用[c (21H 2SO 4)=6 mol ·L -1]硫酸溶液溶解并稀释至100mL 。
此液需随用随配; 4.8 硅标准储备溶液[ρ(Si )=500μg ·mL -1]:称取经920℃灼烧过的二氧化硅(SiO 2,优级纯)0.5347g ,放入铂坩锅中,另取4g 无水碳酸钠于一干净容器中,将3/4的碳酸钠加入铂坩锅内,以细圆头玻棒(以防玻棒划伤坩锅)小心搅拌均匀,再用剩余的碳酸钠擦洗玻棒并无损移入坩锅中覆盖在混合物表面。
在920℃高温电炉中熔融30min ,取出稍冷,熔块用热水溶解,洗入500mL 容量瓶中,定容后立即倒入塑料瓶中存放;4.9 硅(Si )标准溶液[ρ(Si )=25μg ·mL -1]:准确吸取硅标准储备溶液5.00mL 于100mL 容量瓶中,定容后摇匀,于塑料瓶中保存。
5 分析步骤称取过2mm 孔径筛的风干试样5.00g 于200mL 塑料瓶中,加入50.0mL 0.025 mol ·L -1柠檬酸溶液,塞好瓶盖摇匀,在25℃~30℃的条件下,以180r/min 的频率连续振荡2小时,取出后迅速干过滤于100mL 塑料器皿中,弃去最初几毫升滤液后,保留滤液待测定用。
吸取上述滤液1.00mL ~5.00 mL (使含硅在10μg ~125μg 范围内)于50 mL 容量瓶中,用水稀释至20 mL 左右,加入5 mL[c (21H 2SO 4)=0.6 mol ·L -1]硫酸溶液,在30℃~35℃下放置15min,加5mL50g ·L -1钼酸铵溶液,摇匀后放置5min ,再加入5mL 50g ·L -1草酸溶液和5mL 15g ·L -1抗坏血酸溶液,用水定容,摇匀后放置20min ,1.5h 内在分光光度计上700nm 波长处用1cm 光径比色皿比色测定。
同时做空白试验。
以扣除空白后的吸光值查校准曲线或求回归方程得到测定液中硅的质量浓度(ρ)。
校准曲线绘制:在试液测定的同时,分别吸取硅标准溶液0.0、0.5、1.00、2.00、3.00、4.00、5.00mL 于50mL 容量瓶中,用水稀释至20 mL 左右,同样品测试显色、定容。
此标准溶液硅的浓度分别为0.00、0.25、0.50、1.00、1.50、2.00、2.50μg ·mL -1。
摇匀后放置20min ,1.5h 内在分光光度计上,用标准系列溶液的零浓度调节仪器零点进行比色,计算回归方程或绘制工作曲线。
6 结果计算有效硅(Si ),mg ·kg -1=100010m 3⨯⨯⋅⋅D V ρ式中:ρ——查校准曲线或求回归方程而得测定液中硅的质量浓度,μg ·mL -1;V——测定时定容体积,50mL ;D——分取倍数,加入浸提剂体积/浸提液吸取体积,50/(1~5);103和1000——分别将μg 换算成mg 和将g 换算为kg ;m——风干试样质量,g 。
平行结果用算术平均值表示,保留二位小数。
7 精密度平行测定结果允许相对相差≤10%。
不同实验室测定结果允许相对相差≤15%。
8 注释8.1 酸度对硅钼黄和硅钼蓝的生成和稳定时间有很大影响,因此要严格控制酸度。
8.2 不同浸提剂浸出土壤有效硅的差别较大。
对于我国南方水稻土来说,用pH4.0乙酸缓冲液浸提,浸出量多为30 mg ·kg -1~300mg ·kg -1二氧化硅,用0.025mol ·L -1柠檬酸浸提一般可浸提出80 mg ·kg -1~500 mg ·kg -1。
8.3 生成的硅钼黄的稳定时间受温度影响很大,因此从加入钼酸铵溶液到加入草酸溶液之间的时间间距应视温度而定。
为了保证结果重现性好,统一规定:在加入[c (21H 2SO 4)=0.6 mol ·L -1]硫酸溶液后于30℃~35℃保温15min ,加入钼酸铵溶液后,摇匀放置5min 。
B. 乙酸缓冲液浸提-硅钼蓝比色法1 方法提要经pH4.0乙酸-乙酸钠缓冲液浸提出的硅酸,在一定的酸度条件下可与钼试剂反应生成硅钼酸,用草酸等掩蔽剂去除磷的干扰后,硅钼酸可被抗坏血酸等还原剂还原成硅钼蓝,在一定浓度范围内,蓝色深浅与硅含量成正比,可进行比色测定。
2 适用范围本方法适用于水稻土有效硅的测定,其它中性、酸性及微碱性土壤也可参照使用。
3 主要仪器设备3.1 分光光度计;3.2 恒温培养箱(控温在60℃以内);3.3 塑料瓶:200mL 。
4 试剂4.1 pH4.0乙酸-乙酸钠缓冲液:量取49.2mL 冰乙酸,加14.0g 乙酸钠,加水溶解,稀释至1L 。
用1mol ·L -1乙酸及1 mol ·L -1氢氧化钠调至pH4.0;4.2 硫酸溶液[c (21H 2SO 4)=0.6 mol ·L -1]:吸取16.6mL 浓硫酸,缓缓加入到800mL 水中,冷却后稀释至1L ; 4.3 硫酸溶液 [c (21H 2SO 4)=6 mol ·L -1]:量取166mL 浓硫酸,缓缓加入到800mL 水中,冷却后稀释至1L ;4.4 钼酸铵溶液 [ρ((NH 4)6Mo 7O 24·4H 2O)=50g ·L -1]:称取50.00g 钼酸铵溶于水中,稀释至1L ;4.5 草酸溶液 [ρ(H 2C 2O 4·2H 2O )=50g ·L -1]:称取50.00g 草酸溶于水中,稀释至1L ;4.6 抗坏血酸溶液[ρ(C 6H 8O 6)=15g ·L -1]:称取1.50g 抗坏血酸(左旋,C 6H 8O 6),用[c (21H 2SO 4)=6 mol ·L -1]硫酸溶液溶解并稀释至100mL 。
此液需随用随配; 4.7 硅标准储备溶液[ρ(Si )=500μg ·mL -1]:准确称取经920℃灼烧过的二氧化硅(SiO 2,优级纯)0.5347g ,放入铂坩锅中,另取4g 无水碳酸钠于一干净容器中,将3/4的碳酸钠加入铂坩锅内,以细圆头玻棒(以防玻棒划伤坩锅)小心搅拌均匀,再用剩余的碳酸钠擦洗玻棒并无损移入坩锅中覆盖在混合物表面。
在920℃高温电炉中熔融30min ,取出稍冷,熔块用热水溶解,洗入500mL 容量瓶中,定容后立即倒入塑料瓶中存放;4.8 硅(Si )标准溶液[ρ(Si )=25μg ·mL -1]:准确吸取硅标准储备溶液5.00mL 于100mL 容量瓶中,定容后摇匀,于塑料瓶中保存。
5 分析步骤称取通过2mm 孔径筛的风干试样10.00g 于200mL 塑料瓶中,加入100mL 乙酸-乙酸钠缓冲液,塞好瓶塞,摇匀,置于预先调节至40℃的恒温箱中保温平衡5h ,每隔1h 摇动一次。
取出,干过滤于三角瓶中,弃去最初滤液。
取滤液5.00mL (含二氧化硅25μg ~250μg )于50mL 容量瓶中,用水稀释至20mL 左右,加入5 mL[c (21H 2SO 4)=0.6 mol ·L -1]硫酸溶液,在30℃~35℃下放置15min ,加5mL50g ·L -1钼酸铵溶液,摇匀后放置5min ,再加入5mL 50g ·L -1草酸溶液和5mL 15g ·L -1抗坏血酸溶液,加水定容,摇匀后放置20min ,1.5h 内在分光光度计上700nm 波长处用1cm 光径比色皿比色测定。
同时做空白试验。
以扣除空白后的吸光值查校准曲线或求回归方程得到测定液中硅的质量浓度(ρ)。
校准曲线绘制:在试液测定的同时,分别吸取硅标准溶液0.0、0.5、1.00、2.00、3.00、4.00、5.00mL 于50mL 容量瓶中,用水稀释至20mL 左右,同样品测试显色、定容。
此标准溶液硅的浓度分别为0.00、0.25、0.50、1.00、1.50、2.00、2.50μg ·mL -1。
摇匀后放置20min ,1.5h 内在分光光度计上,用标准系列溶液的零浓度调节仪器零点进行比色,计算回归方程或绘制校准曲线。
6 结果计算有效硅(Si ),mg ·kg -1=100010m 3⨯⨯⋅⋅D V ρ式中:ρ——查校准曲线或求回归方程而得测定液中硅的质量浓度,μg ·mL -1;V——测定时定容体积,50mL ;D——分取倍数,加入浸提剂体积/浸提液吸取体积,100/5;103和1000——分别将μg 换算成mg 和将g 换算为kg ;m——风干试样质量,g 。
7 精密度平行测定结果允许相对相差≤10%。
8 注释8.1 酸度对硅钼黄和硅钼蓝的生成和稳定时间有很大影响,因此要严格控制酸度。
8.2 浸提温度和时间对浸出的硅酸量有很大影响,要求浸提温度稳定在40℃±1℃,浸提时间为5h 。
