第四章 红外光谱法
仪器分析3—红外吸收光谱法

傅立叶变换红外光谱仪
样品池
红外光源
摆动的 凹面镜
迈克尔逊 干扰仪
参比池
摆动的 凹面镜
检测器 干涉图谱 计算机 解析 还原
M1 II
同步摆动
I M2
红外谱图
BS
D
仪器组成
第五节 红外光谱法应用
红外光谱法由于操作简单,分析速度 快,样品用量少,不破坏样品,特征性 强等优点,在有机定性分析中应用广泛。 利用红外光谱可对化合物进行鉴定或结 构测定。 但由于吸收较复杂,在定量分析方面 应用受到一定限制。
第四章 红外吸收光谱分析法(IR)
Infrared Absorption Spectrometry
第一节
红外光谱基本知识
1、红外线波长范围: 光学光谱区域:10nm ~1000μm; 其中:10nm ~400nm为紫外光区 400nm ~760nm为可见光区, 760nm ~ 1000μm为红外光区。 为表示方便,红外光不用nm(纳米) 而用微米( μm)表示其波长。
由原理图可见,红外分光光度计也主要 由光源、样品吸收池、单色器、检测器、 记录仪等部件构成。 1、光源:能斯特灯或硅碳棒
红外光谱仪中所用的光源通常是一种惰性固体,用 电加热使之发射高强度的连续红外辐射。 常用的是Nernst灯或硅碳棒。 Nernst灯是用氧化锆、氧化钇和氧化钍烧结而成的 中空棒和实心棒。工作温度约为1700℃,在此高温下导 电并发射红外线。但在室温下是非导体,因此,在工作 之前要预热。它的特点是发射强度高,使用寿命长,稳 定性较好。 硅碳棒是由碳化硅烧结而成,工作温度在1200-1500℃ 左右。
ε>100 非常强峰(vs) 20<ε<100 强 峰(s) 10<ε<20 中强峰(m) 1<ε<10 弱 峰(w)
第四章 红外光谱

电磁波的波长( )、频率( v)、能量(E)之间的关系:
2020/3/20
3
二、红外光谱的表示方法
红外光谱是研究波数在4000-400cm-1范围内不同
波长的红外光通过化合物后被吸收的谱图。谱图以波 长或波数为横坐标,以透过率为纵坐标而形成。
横坐标:波长/λ或波数/cm-1。 纵坐标:吸光度A或透过率T,
N为分子中成键原子的个数。
例1: H O H 为非线状分子,应有3N-6=9-6=3个峰。
2020/3/20
15
例2:O=C=O为线状分子,便有3N-5=9-5= 4个峰。
Why? ①νs O=C=O 不改变分子的偶极矩; ②δs O=C=O 与δw + O=C=O + 简并。
2020/3/20
16
1900~2500 cm-1,主要是:C≡C、C≡N 三键和 C=C=C、C=N=O 等累积双键的伸缩振动吸收峰。
(3) Y=Z双键伸缩振动区(第三峰区) :
1500~1900 cm-1,主要是:C=O、C=N、C=C等双 键存在。
2020/3/20
13
2)指纹区:
<1500 cm-1的低频区,主要是:C-C、C-N、 C-O等单键和各种弯曲振动的吸收峰,其特点是谱带 密集、难以辨认。
2020/3/20
1
4.1 基本原理
红外光谱就是当红外光照射有机物时,用仪器记录 下来的吸收情况(被吸收光的波长及强度等),用来进行 分析的方法。红外线可分为三个区域:
红外光谱法主要讨论有机物对中红区的吸收(振动能 级跃迁)。
2020/3/20
2
红外光谱的基本原理:
用不断改变波长的红外光照射样品,当某一波长的频 率刚好与分子中某一化学键的振动频率相同时,分子就会 吸收红外光,产生吸收峰。用波长(λ)或波长的倒数波 数(cm-1)为横坐标,百分透光率(T%)或吸收度(A) 为纵坐标做图,得到红外吸收光谱图(IR)。分子振动所 需能量对应波数范围在400 cm-1~4000 cm-1。
第四章 傅里叶红外光谱

4
10 ―――波数(cm-1)
―――波长 (µm)
(11)
1 2 )
4.2 润滑油的傅里叶红外光谱分析
4.2.2 红外光谱定量分析原理
分子基团对红Biblioteka 辐射的特征吸收是进行定量分析的基础
样品的吸光性通过分光计进行间接的测量
红外光照射样品后到达分光检测器的光强 强度 之比称为透过率 ,即:
子基团的特征吸收谱带也叫特征峰。吸收谱带极大值的波数位置 称为特征频率。进行基团定性时,是根据基团特征吸收峰来判断 基团的存在与否
(10)
4.2 润滑油的傅里叶红外光谱分析
波数是红外吸收光谱图横坐标常用的物理量之一,单位为cm-1。它 是描述红外线振动特性的物理量。波数与波长的换算关系是:
式中:
(22)
4.3 在用油红外光谱参数的识别
通常表征润滑油硝化的峰位在~1630 cm-1附近;典型值则为20A·cm-1,高值 >40 A·cm-1
图为新油和深度硝化在用油的红外光谱 对比(上谱线为深度硝化在用油,下谱 线为新油),硝化深度的急剧增加,意 味着因高温和燃烧条件恶化而生成了大 量的氮氧化物
(3)
4.1 傅里叶红外光谱仪法
4.1.1 傅里叶红外光谱仪的工作原理 红外光谱仪(FT-IR)主要由红外光源、 吸收池、分光系统、检测 系统等几部分组成 检测时,从光源发出的红外光,经过迈克尔逊干涉仪变成干涉光 (消除杂光),再让干涉光经过样品,到探测器,探测器检测到透 过油样的红外线强度,并将其转换成与油样成分、含量相对应的电 压值,然后利用计算机系统把干涉图进行数字变换,最后得到光谱 图 FT-IR光谱仪的核心光学部件为迈科尔逊干涉仪,干涉仪的使用, 提高了红外光谱仪的灵敏度和准确性
第四章炔烃二烯烃红外光谱
第四章炔烃二烯烃红外光谱(一)炔烃▪分子中具有一个碳碳叁键的开链不饱和烃——炔烃。
▪通式为CnH2n-2,碳碳叁键是炔烃的官能基。
4.1 炔烃的构造异构和命名1.炔烃的构造异构▪从丁炔开始,除碳链异构外,碳碳叁键位置的不同(位置异构)也可引起同分异构现象。
1-丁炔2-丁炔2. 炔烃的命名炔烃的系统命名法规则1)选含有碳碳叁键的最长碳链为主链。
2)从靠近叁键的一端开始编号,使叁键的位次尽可能小。
命名时要标出叁键的位置。
3) 其余取代基按烷烃的系统命名规则来命名。
4) 含有双键的炔烃命名时,一般先命名烯再命名炔,碳链编号以表示双键与叁键位置的两个数字之和取最小的原则。
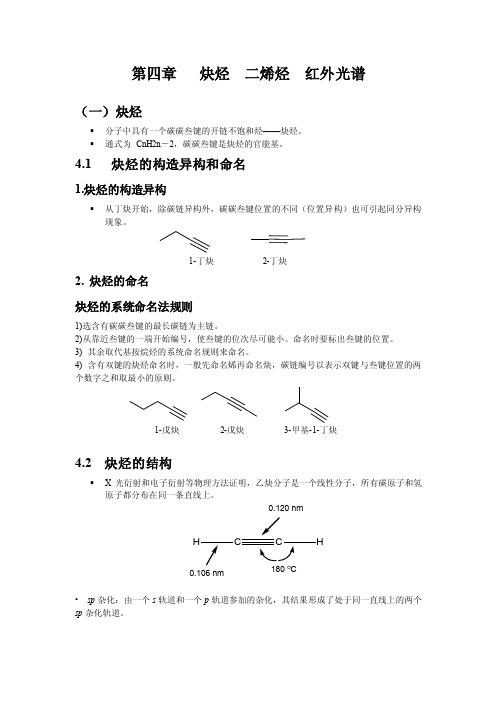
1-戊炔2-戊炔3-甲基-1-丁炔4.2 炔烃的结构▪X光衍射和电子衍射等物理方法证明,乙炔分子是一个线性分子,所有碳原子和氢原子都分布在同一条直线上。
•sp杂化:由一个s轨道和一个p轨道参加的杂化,其结果形成了处于同一直线上的两个sp杂化轨道。
0.120 nm180 o C0.106 nmH乙炔分子中σ键的形成▪乙炔分子中,每个碳原子与另外两个原子形成了一个C sp-H s σ键和一个C sp-C sp σ键,在同一直线上,方向相反,故乙炔分子为线性分子。
乙炔分子中的π键▪每个碳原子上还各有两个未参加杂化的p轨道,互相平行,故这两个p轨道可侧面相互交盖而形成了两个π键,这两个π键并不是孤立分离的,其电子云对称分布在碳碳σ键键轴周围,类似圆筒性状。
参见图4-3。
▪碳碳叁键由一个σ键和两个π键组成。
乙炔键长缩短的原因1)s轨道的电子较p电子接近原子核,故杂化轨道的s成分越多,则在杂化轨道上的电子越接近原子核。
乙炔分子中的C sp-H s σ键,因sp杂化轨道的s成分大(50%),其电子云更靠近原子核。
2)乙炔分子中有两个形成π键,且sp杂化轨道参与了碳碳σ键的组成。
4.3 炔烃的物理性质∙炔烃的物理性质和烷烃、烯烃基本相似。
∙低级的炔烃常温常压下为气体,但沸点比相同碳原子数的烯烃略高。
第四章 二烯烃 炔烃 红外光谱

+
双烯体 亲双烯体
O
O
+
O O O
O O
O
+
O O
CH2
O O
这类反应在合成上可用来合成许多环 状化合物,反应类型属第三类——协同反 应,即新键的生成和旧键的断裂同时发生 异协同进行。
(二) 炔 烃
4.4 命名
若分子中即含叁键,又含双键,则选择含有 叁键,双键的链为主链,以烯、炔两个数字 和的数值最小编号,碳原子数写在烯前,若 烯、炔位次一样,以烯为准。
+
NH3
NaNH2
R
CH
+ NaNH2
液氨
R
CNa
+
NH 3
CH
CH
+ 2 Ag(NH3)2NO3 + 2 Cu(NH3)2Cl
AgC
CAg
+ 2 NH4NO3 + 2 NH3 + 2 NH4NO3 + 2 NH3
CH
CH
CuC
CCu
鉴别1-炔烃和其它炔烃的方法
(二)、加成反应
1、加氢
H2 / Pt H2 / Pt
4.9 红外光谱
一般的红外吸收光谱主要指中红外 范围而言,波数在400-4000 cm-1,谱图 是以波长和波数为横坐标,表示吸收带 的位置,以透射率(T%)为纵坐标,表 示光的吸收强度,整个吸收曲线反映了 一个化合物在不同波长的光谱区域内吸 收能量的分布情况。
一、分子振动、分子结构和红外光谱
分子振动包括键的伸缩振动和键的弯 曲振动。并非所有的分子振动都能吸收 红外光,只有使分子的偶极矩发生变化 的分子振动才具有红外活性,才有相应 的吸收谱带,分子中极性基团很易引起 明显的红外吸收。
红外吸收光谱法

16:12:58
k为化学键的力常数(单位:N·cm-1 ),为双 原子折合质量(单位为g)
m1m2
m1 m2
若原子的质量用原子质量单位(u,1u=1.66×10-24g) 表示,则成键两原子的折合质量应为:
(m1
m1m2 m2 ) 6.02
10 23
16:12:58
❖ 从分子简谐振动方程可知,分子振动频率与化 学键的键力常数、原子质量有关系.
四、紫外吸收光谱与红外吸收光谱的区别
1. 光谱产生的机制不同 紫外:电子光谱; 红外:振-转光谱
2. 研究对象和使用范围不同 紫外:研究不饱和化合物,具有共轭体系; 红外:凡是在振动中伴随有偶极矩变化的化合
物都是红外光谱研究的对象。可研究几乎所有的有 机物。
16:12:58
五、红外光谱法的特点和应用
分子的振动总能量:
Ev
(v
1 )h
2
(v = 0, 1, 2, ···)
式中, v 为振动量子数,ν为分子 振动频率。
16:12:58
在室温时,分子处于基态(v = 0),此时伸 缩振动振幅很小。当有红外辐射照射分子时,若 辐射光子所具有的能量恰好等于分子振动能级差 时,则分子吸收光子能量跃迁至振动激发态,导 致振幅增大。
16:12:58
(二) 吸收谱带的强度
➢ 分子振动时偶极矩是否变化决定了该分子能
否产生红外吸收,而偶极矩变化的大小又决定了 吸收谱带的强弱。
➢ 根据量子理论,红外光谱的强度与分子振动
时偶极矩变化的平方成正比。
➢ 偶极矩的变化与固有偶极矩有关。一般极性
比较强的分子或基团吸收强度都比较大,极性比 较弱的分子或基团吸收强度都比较弱。
红外吸收光谱分析法 红外谱图解析

顺式烯 乙烯基烯 亚乙烯基烯
08:12:21
R1 H R1 H R1 R2
1660cm-1
1660-1630cm-1
中强,尖
总结
ⅰ 分界线1660cm-1 ⅱ 顺强,反弱
ⅲ 四取代(不与O,N等相连)无υ
ⅳ 端烯的强度强
(C=C)峰
ⅴ共轭使υ
下降20-30 cm-1 (C=C)
H C C R R1 C C R2
08:12:21
υ υ
C C
2140-2100cm-1 (弱) 2260-2190 cm-1 (弱)
C C
c)C-H 变形振动(1000-700 cm-1 )
面内变形(=C-H)1400-1420 cm-1 (弱) 面外变形(=C-H) 1000-700 cm-1 (有价值)
R1 H R1 R2 R1 R2 C C R4
O—H,C—O
a)-OH 伸缩振动(>3600 cm-1) b)碳氧伸缩振动(1100 cm-1)
C Cα C Cα′ C C Cα″ β
υ
(C-O)
OH
υ
游 离 仲-OH 醇, 叔-OH 酚 酚-OH 伯-OH
(—OH) 3640cm-1 3630cm-1 3620cm-1 3610cm-1
1050 cm-1 1100 cm-1 1150 cm-1 1200 cm-1
第四章 红外吸收光谱分 析法
infrared absorption spec-troscopy,IR
一、红外谱图解析
analysis of infrared spectrograph
二、未知物结构确定
structure determination of compounds
第四章炔烃二烯烃红外光谱黑体

C=C
H
H
(3) 和水得加成
补充1 (末端炔烃):R-CCH 得:甲基酮 (R-CO-CH3) 补充2 (不对称炔烃): R-CC-R’ 得:混合酮
若:R为一级取代基,R’为二、三级取代基,则C=O 与R’相邻。 (注意空间效应)
为什么发生重排?
CH2=C-OH CH3-C=O
H
H
•乙 醛 得 总 键 能 2 7 4 1 k J / m o l 比 乙 烯 醇 得 总 键 能 2678kJ/mol大,即乙醛比乙烯醇稳定、
CH2=HC-CH2-CCH + Br2 CH2BrCHBrCH2CCH
**为什么炔烃得亲电加成不如烯烃活泼?
•烷基碳正离子(中间体)—正碳原子就是sp2杂化状态,她得正电荷 易分散到烷基上、
•烯基碳正离子(中间体)—sp杂化状态, 正电荷不易分散、所以能 量高,不稳定、形成时需要更高得活化能,不易生成、
• 杂化轨道理论:两个成键轨道(1, 2),两个反键轨道 (1*, 2*)
• 两个成键 轨道组合成了对称分布于碳碳 键键 轴周围得,类似圆筒形状得 电子云、
(5) 总结
•碳碳叁键就是由一个 键和两个 键 组成、
•键能—乙炔得碳碳叁键得键能就是:837 kJ/mol;
乙烯得碳碳双键键能就是:611 kJ/mol;
甲基乙烯基醚
• CH3OH + KOH
CH3O-K+ + H2O
•带负电荷得甲氧基负离子 CH3O-,能供给电子,具有亲近 正电荷(核)得倾向,所以就是亲核试剂、
•反应首先就是由甲氧基负离子攻击乙炔开始、
CHCH + CH3O- CH3O-CH=C-H CH3OH CH3O-CH=CH2 + CH3O-
第四章红外吸收光谱法3、CO的红外吸收光谱在2170cm-1处有一振动
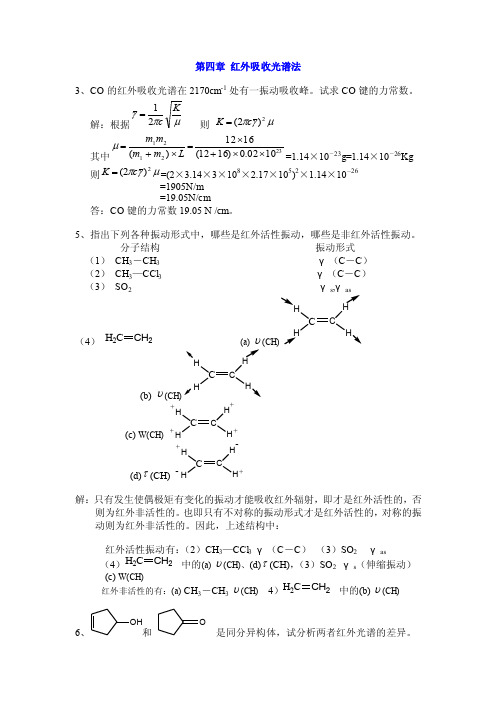
第四章 红外吸收光谱法3、CO 的红外吸收光谱在2170cm -1处有一振动吸收峰。
试求CO 键的力常数。
解:根据μπγKc 21= 则 μγπ2)2(c K = 其中2321211002.0)1612(1612)(⨯⨯+⨯=⨯+=L m m m m μ=1.14×10-23g=1.14×10-26Kg 则μγπ2)2(c K ==(2×3.14×3×108×2.17×105)2×1.14×10-26 =1905N/m=19.05N/cm答:CO 键的力常数19.05 N /cm 。
5、指出下列各种振动形式中,哪些是红外活性振动,哪些是非红外活性振动。
分子结构 振动形式(1) CH 3-CH 3 γ(C -C )(2) CH 3—CCl 3 γ(C -C )(3) SO 2 γs ,γ(4)H 2C CH 2 (a) υ(CH)CC(b) υ(CH)CH C (c) W(CH) C HHC H H ++++(d)τ(CH) C H H C H -++-解:只有发生使偶极矩有变化的振动才能吸收红外辐射,即才是红外活性的,否则为红外非活性的。
也即只有不对称的振动形式才是红外活性的,对称的振动则为红外非活性的。
因此,上述结构中:红外活性振动有:(2)CH 3—CCl 3 γ(C -C ) (3)SO 2 γas(4)H 2C CH 2 中的(a) υ(CH)、(d)τ(CH),(3)SO 2 γs (伸缩振动) (c) W(CH)红外非活性的有:(a) CH 3-CH 3 υ(CH) 4)H 2C CH 2 中的(b) υ(CH)6、OH 和 O是同分异构体,试分析两者红外光谱的差异。
答:由于OH中含有一个-OH 基团,因此在红外光谱中有一强吸收峰在3700~3100cm -1,且此分子中含有一个C=C 双键,因此在1680~1620cm -1也有一较弱的吸收峰。
第四红外吸收光谱分析法-

1.内部因素
(1)电子效应 a.诱导效应:吸电子基团使吸收峰向高频方向移动(兰移)
R-COR C=0 1715cm-1 ; R-COCl C=0 1800cm-1 ; F-COF C=0 1928cm-1 ;
2019/9/10
R-COH C=0 1730cm -1 ; R-COF C=0 1920cm-1 ; R-CONH2 C=0 1920cm-1 ;
b.共轭效应
O H 3CCC3H
O CC3H
O CC3H
O C
1715cm -1 1685cm -1 1685cm -1 1660cm -1
2019/9/10
2019/9/10
苯衍生物的C=C
苯衍生物在 1650 2000 cm-1 出现 C-H和C=C键的面内 变形振动的泛频吸收(强度弱),可用来判断取代基位置。
2000
1600
2019/9/10
(3)C=O (1850 1600 cm-1 ) 碳氧双键的特征峰,强度大,峰尖锐。
饱和醛(酮)1740-1720 cm-1 ;强、尖;不饱和向低波移动; 醛,酮的区分?
共轭 2220 2230 cm-1 仅含C、H、N时:峰较强、尖锐; 有O原子存在时;O越靠近C N,峰越弱;
2019/9/10
3. 双键伸缩振动区( 1900 1200 cm-1 )
(1) RC=CR’ 1620 1680 cm-1 强度弱, R=R’(对称)时,无红外活性。
(2)单核芳烃 的C=C键伸缩振动(1626 1650 cm-1 )
(分子内氢键;分子间氢键):对峰位,峰强产生极明显影 响,使伸缩振动频率向低波数方向移动.
仪器分析 第四章--红外吸收光谱法

章节重点:
分子振动基本形式及自由度计算;
红外吸收的产生2个条件;
各类基团特征红外振动频率;
影响红外吸收峰位变化的因素。
第八章 红外吸收光谱分 析法
第三节 红外分光光度计
1. 仪器类型与结构
2. 制样方法
3. 联用技术
1. 仪器类型与结构
两种类型:色散型 干涉型(傅立叶变换红外光谱仪)
弯曲振动:
1.4 振动自由度
多原子分子振动形式的多少用振动自由度标示。
三维空间中,每个原子都能沿x、y、z三个坐标方向独 立运动,n个原子组成的分子则有3n个独立运动,再除 掉三个坐标轴方向的分子平移及整体分子转动。
非线性分子振动自由度为3n-6,如H2O有3个自由度。 线性分子振动自由度为3n-5,如CO2有4个自由度。
某些键的伸缩力常数:
键类型: 力常数: 峰位:源自-CC15 2062 cm-1
-C=C10 1683 cm-1
-C-C5 1190 cm-1
-C-H5.1 2920 cm-1
化学键键强越强(即键的力常数K越大),原子折合 质量越小,化学键振动频率越大,吸收峰在高波数区。
1.2 非谐振子
实际上双原子分子并非理想的谐振子!随着振动量子 数的增加,上下振动能级间的间隔逐渐减小!
(1)-O-H,37003100 cm-1,确定醇、酚、酸 在非极性溶剂中,浓度较小(稀溶液)时,峰形尖锐 ,强吸收;当浓度较大时,发生缔合作用,峰形较宽。
注意区分: -NH伸缩振动:3500 3300 cm-1 峰型尖锐
(2)饱和碳原子上的-C-H -CH3 2960 cm-1 2870 cm-1 反对称伸缩振动 对称伸缩振动
仪器分析 第4章 红外吸收光谱法

4.2 基本原理
4.2.3 多原子分子的振动类型(P56)
伸缩振动 (υ):键长发生变化 1.简正振动基本形式 变形振动 (δ):键角发生变化
伸缩振动(υ)
对称伸缩振动(υs)
不对称伸缩振动(υas)
变形振动(δ)
面内变形振动(β)
面外变形振动(γ)
亚甲基的各种振动形式
2. 基本振动的理论数(分子振动自由度)
4.4 试样的处理和制备
4.4 试样的处理和制备
4.4.1 红外光谱法对试样的要求 (1)单一组分纯物质,纯度 > 98%; (2)样品中不含游离水; (3)要选择合适的浓度和测试厚度, 使大多数吸收峰透射比处于10%~80%。
4.4 试样的处理和制备
4.4.2 制样方法 1.气体样品的制备 2.液体和溶液样品的制备 3.固体样品的制备
分子振动自由度:多原子分子的基本振动
数目,也就是基频吸收峰的数目。
基频吸收峰:分子吸收一定频率的红外光后,
其振动能级由基态跃迁到第一
激发态时所产生的吸收峰。
2. 基本振动的理论数
线型分子振动自由度 = 3N – 5(如CO2)
非线型分子振动自由度 = 3N – 6(如H2O)
图5.12 CO2分子的简正振 动形式
来指导谱图解析。
基本概念
基团频率区: 在4000~1300cm-1 范围内的吸收峰,有一 共同特点:既每一吸收峰都和一定的官能 团相对应,因此称为基团频率区。
在基团频率区,原则上每个吸收峰都可以找到归属。
基本概念
指纹区: 在1300~400cm-1范围内,虽然有些吸收也对应 着某些官能团,但大量吸收峰仅显示了化合物 的红外特征,犹如人的指纹,故称为指纹区。
分析化学(仪器分析)第四章-仪器分析(IR)

30
第二节 红外吸收基本理论
振动过程中偶极矩发生变化(△≠0) 的分子振动能引起可观测的红外吸收光谱, 称之为红外活性的。 振动过程中偶极矩不发生变化(△=0) 的分子振动不能产生红外吸收光谱,称为非 红外活性的。
31
第二节 红外吸收基本理论
绝大多数化合物在红外光谱图上出现的峰数远 小于理论上计算的振动数,这是由如下原因引起的: (1)没有偶极矩变化的振动,不产生红外吸收; (2)相同频率的振动吸收重叠,即简并; (3)仪器不能区别频率十分接近的振动,或吸收带 很弱,仪器无法检测; (4)有些吸收带落在仪器检测范围之外。
33
第二节 红外吸收基本理论
(二)吸收谱带的强度
红外吸收谱带的强度取决于分子振动时偶极矩 的变化,红外光谱的强度与分子振动时偶极矩变 化的平方成正比。 偶极矩的变化与分子的极性以及分子结构的对 称性,也就是固有偶极矩有关。极性较强的基团 (如C=O,C-X等)吸收强度较大,极性较弱的 基团(如C=C、C-C、N=N等)吸收较弱。分子 的对称性越高,振动中分子偶极矩变化越小,谱 带强度也就越弱。
28
第二节 红外吸收基本理论
在倍频峰中,二倍频峰还比较强。三倍频峰以 上,因跃迁几率很小,一般都很弱,常常不能测到。 除此之外,还有合频峰(1+2,21+2, ),差频峰( 1-2,21-2, )等,这些 峰多数很弱,一般不容易辨认。倍频峰、合频峰和 差频峰统称为泛频峰,泛频峰一般都很弱。
11
第二节 红外吸收基本理论
根据Hooke定律,分子 简谐振动的频率的计算 公式为
12
第二节 红外吸收基本理论
式中k为化学键的力常数,定义为将两原子由 平衡位置伸长单位长度时的恢复力(单位为Ncm -1)单键、双键和三键的力常数分别近似为 5、 1 0和15 Ncm-1;c为光速(2.9981010cm s-1), 为折合质量,单位为g,且 影响分子振动频率的直接原因是原子质量和 化学键的力常数。
第四章 红外光谱分析法
第四章红外光谱分析法§4—1红外光谱简介红外辐射泛指位于可见光和微波段之间的那一部分电磁波谱.对有机化学家最有实际用处的是只限于4000—666厘米-1(2.5-15.0微米)之间的范围.最近,对近红外区14290—4000(0.7一2.5微米)和远红外区700—200厘米-1(14.3—50微米)的兴趣正在增加.在红外光谱分析中,一个十分简单的分子也可以给出一个非常复杂的红外光谱图.有机化学家就是利用这种光谱图的复杂性,将一个未知化合物的光谱图与一个可靠的标准品的光谱图相互比较,两张光谱图中峰对峰的完全一致对于鉴定就是最好的证据.除了光学对映体外的任何两个化合物均不可能给出相同的红外光谱图.虽然,红外光谱图是整个分子的特性,但是不管分子其余部分的结构如何,结果是某一特定的原子基团总是在相同的或者几乎是相同的频率处产生吸收谱带.正是这种特征谱带的不变性使化学家可以,通过简单的观察并参考有关特征基团频率的综合图嵌来获得有用的结构信息.我们将主要依靠这些特征基团频率.由于我们并不单纯依靠红外光谱图进行鉴定,因此,并不需要对红外光谱图进行详细的分析.根据我们的总的计划,在这里将提出为达到下列目的,所必需的理论:即把红外光谱图与其它的光谱数据一起用来确定分子结构.因为大多数大学的和工业的实验室都把红外分光光度计作为有机化学家的一种常备的基本工具,在这一章中将比其它各章较详细地叙述仪器和样品制备.红外光谱法作为实用有机化学家的一种工具,从已经出版书籍的数目可以明显地看到.在这些书中,有的是全部地、有的是部分地讨论了红外光谱法的应用。
.一、红外光的表征近红外(泛频区)0.75-2.5微米;13334-4000波数中红外(基频区) 2.5 -25 微米4000-400 波数远红外(转动区)25-1000微米400-10 波数由于中红外区能最深刻地反映分子内部所进行的各种物理过程以及分子结构方面的各种特性,对于解决分子结构和化学组成各种问题最为有效。
第四章 红外光谱(IR)和拉曼光谱

在十九世纪初就发现了红外线,到1892年有人利用岩盐棱 镜和测热幅射计(电阻温度计)测定了20多种有机化合物的 红外光谱。 1905年科伯伦茨发表了128种有机和无机化合物的红外 光谱,红外光谱与分子结构间的特定联系才被确认。 到1930年前后,随着量子理论的提出和发展,红外光 谱的研究得到了全面深入的开展,并且依据测得的大量物 质的红外光谱。 1947年第一台实用的双光束自动记录的红外分光光度计 问世。这是一台以棱镜作为色散元件的第一代红外分光光 度计。
例:已知羰基C=O的键力常数K=l2×l05dyn/cm,求C=O
解:
=1307
12 12 16 12 16
=1725 (cm-1)
当分子吸收红外光发生跃迁时要满足一定的选律,即振 动能级是量子化的,可能存在的能级要满足下式: E=(V+1/2)h
式中h为普朗克常数,为振动频率,V为振动量子数(0、 1、2……),振动能级不止一种激发态。
4.1.2红外光谱法的特点
(1)红外光谱是依据样品 吸收谱带的位置、强度、形状、 个数,推测分子中某种官能团的存在与否,推测官能团的 邻近基团,确定化合物结构。
(2) 红外光谱不破坏样品,并且对任何样品的存在状态
都适用,如气体、液体、可研细的固体或薄膜似的固体都 可以分析。测定方便,制样简单。
(3)红外光谱特征性高。由于红外光谱信息多,可以对
键 H-F H-Cl H-Br H-I H-O H-O H-S H-N H-C 分子 HF HCl HBr HI H2 O 游离 H2 S NH3 CH3X K(×105dyn/cm) 9.7 4.8 4.1 3.2 7.8 7.12 4.3 6.5 4.7-5.0 键 H-C H-C C-C C=C C≡C C-O C=O C-Cl C≡N 分子 K(×105dyn/cm) CH2=CH2 5.1 CH≡CH 5.9 4.5-5.6 9.5-9.9 15-17 5.0-5.8 12-13 CH3Cl 3.4 16-18
分子光谱法4-第四章红外光谱法2

饱和醛(酮 不饱和向低波移动; 饱和醛 酮)1740-1720 cm-1 ;强、尖;不饱和向低波移动; 醛,酮的区分? 酮的区分?
酸酐的C=O 酸酐的
双吸收峰:1820~1750 cm-1 ,两个羰基振动偶合裂分; 线性酸酐:两吸收峰高度接近,高波数峰稍强; 环形结构:低波数峰强;
羧酸的C=O 羧酸的
0,表示分子是饱和的 表示分子是饱和的, ◇ Ω = 0,表示分子是饱和的,应为链状烃或不 含双键的衍生物; 含双键的衍生物; 1,表示分子中可能有一个双键或者一个 ◇ Ω = 1,表示分子中可能有一个双键或者一个 脂环; 脂环; ◇ Ω = 2, 表示分子中有一个三键或者两个双 键或者两个脂环; 键或者两个脂环; 4,表示分子中可能有一个苯环 表示分子中可能有一个苯环( ◇ Ω = 4,表示分子中可能有一个苯环(可理解 为一个环加三个双键)。 为一个环加三个双键)。
(3)不饱和碳原子上的 )不饱和碳原子上的=C—H(≡ C—H ) (
苯环上的C—H =C—H ≡ C—H 3030 cm-1 3010 ∼ 2260 cm-1 3300 cm-1
3000 cm-1 以上
2.叁键和累积双键伸缩振动区(2500 ∼ 1900 cm-1 ) 叁键和累积双键伸缩振动区( 叁键和累积双键伸缩振动区
§4-4 影响基团频率位移的因素
factors influenced peak shift
化学键的振动频率不仅与其性质有关,还受分子的内部 化学键的振动频率不仅与其性质有关, 结构和外部因素影响。 结构和外部因素影响。相同基团的特征吸收并不总在一个固 定频率上。 定频率上。
一.内部因素
1 电子效应 电子效应(Electric effects) a.诱导效应( Inductive effect ) :吸电子基团使吸收峰向高频方向 . 移动(兰移)
4第四章红外吸收光谱法副本

作业题第四章红外分光光度法第一节概述填空题1、红外光区位于 ______ 光区和________ 光区之间, 波长范围为_______________ ,习惯上又可将其细分为__________ 、 _________ 和 __________ 三个光区,应用较多的是________ 光区。
2、红外谱图纵坐标一般为,横坐标一般为。
简答题:红外分光光度法的特点。
H H H Clci" 'ci D. Cl" X H4、在有机化合物的红外吸收光谱中,出现在4000 1250cm—1频率范围的可用于鉴定官能团,这一段频率范围称为()A.指纹区B.倍频区C.特征区D.合频区5、第二节基本原理1、分子内部的运动方式有三种,即:_____ 、_____ 和 _____,相应于这三种不同的运动形式,分子具有______ 能级、______ 能级和____ 能级。
2、一般多原子分子的振动类型分为 _________ 振动和________ 振动。
3、乙烷的振动自由度是 ____________ 。
4、甲酸的振动自由度是 ____________ 。
判断题:1、对称结构分子,如H2O分子,没有红外活性。
()2、水分子的H— O— H对称伸缩振动不产生吸收峰。
()以上①、②、③、④四种烯的u c=c值为:A. ①为1650cm1;②为1678cm1;③为1657cm1:④ 为1781cm1B. ①为1781cm1;②为1657cm1;③为1650cm1:④ 为1678cm-1C. ①为1650cm1;②为1657cm1;③为1678cm1:④ 为1781cm1D. ①为1781cm1;②为1678cm1;③为1657cm1:④ 为1650cm-16、乙烯分子的振动自由度为:A.20B.13C.12D.6E.157、下列环烯化合物中,u C=c出现最低波数者为:A. B. C.D. E.选择题:1、试比较同一周期内下列情况的伸缩振动(不考虑费米共振与生成氢键)产生的红外吸收峰,频率最小的是()A C-HB N-HC O-HD F-H2、已知下列单键伸缩振动中C-C C-N C-O 键力常数k/(N ?cm1) 4.5 5.8 5.0 以用W-入/ 卩m 66.46 6.85 问C-C, C-N, C-O 键振动能级之差/ E顺序为()A C-C > C-N > C-OB C-N > C-O > C-CC C-C > C-O > C-ND C-O > C-N > C-C3、判断下列各分子的碳碳对称伸缩振动在红外光谱中哪个是非活性的()A. CH3—CH3B. CH3- CCI3C.8、下列合物中u c=c吸收强度最大的化合物为:A.R —CH= CHB.R —CH= CH- R(顺)C.R—CH= CH- R (反)D.R 1—CH= CH— R(顺)ER —CH= CH- COR (反)9、孤立甲基的弯曲振动一般为1380cm1,异丙基中的甲基裂分为1385cm1和1375cm1,叔丁基中的甲基裂分为1395cm1和1370cm1,造成裂分的原因是:A.分子的对称性B. 振动偶合C.费米共振 D. 诱导效应U C=O出现在1870cm1至1540cm之间,它们的u c=。
红外吸收光谱分析法PPT课件

红外光谱的吸收强度
❖ 红外吸收谱带的强度取决于分子振动时偶极矩的变化,而 偶极矩与分子结构的对称性有关。振动的对称性越高,振 动中分子偶极矩变化越小,谱带强度也就越弱。
❖ 极性较强的基团(如C=0,C-X等)振动,吸收强度较大; 极性较弱的基团(如C=C、C-C、N=N等)振动,吸收较 弱。
化学键键强越强(即键的力常数k越大)原子折合质量越小,化学键
的振动频率越大,吸收峰将出现在高波数区。
9c
振动的基本类型
振动类型
伸缩振动 变形振动
对称性伸缩振动 V S 反对称性伸缩振动 V aS
面内变形振动
剪式振动δ S 平面摇摆ρ
面外变形振动
非平面摇摆ω 扭曲振动τ
伸缩振动的k比变形振动k大;因此伸缩振动出现在红外吸收
变长—k 降低—特征频率减小(移向低波数)。
25 c
3)氢键效应(X-H)
形成氢键使电子云密度平均化(缔合态),使体系能量下 降,基团伸缩振动频率降低,其强度增加但峰形变宽。
如羧酸 RCOOH(C=O=1760cm-1 ,O-H=3550cm-1); (RCOOH)2(C=O=1700cm-1 ,O-H=3250-2500cm-1)
HH 690 cm-1
单取代:770-730, 710-690 邻位取代:770-735 间位取代:810-750,725-680 对位取代:860-800
21 c
苯衍生物的红外光谱图
下图为不同的苯环取代类型在2000~ 1667cm-1和900~600cm-1区域 的光谱。
22 c
影响基团频率位移的因素
H-Br H-I H-O H-S H-N H-C
分子 HF HCl
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
k为化学键的力常数,为将两原子由平衡位置伸长单位长度时的恢复力
影响基本振动频率的直接原因是相对原子
质量和化学键的力常数。化学键的力常数k越
大,折合相对原子质量Ar越小,则化学键的 振动频率越高,吸收峰将出现在高波数区; 反之,则出现在低数区。
4.2.4、吸收谱带的强度 红外吸收谱带的强度取决于分子振动时偶极矩
810-750,710-690 830-810 910-840
810,850-900
各主要官能团红外光谱的特征吸收峰频率
❖ 二、常见化合物的特征吸收峰
烷烃类 烯烃类 炔烃类 芳香类 羰基化合物 羟基化合物
1. 烷烃 —CH3
CH2
❖ C-H C-H伸缩振动 < 3000 cm-1 3000 ~2800 cm-1 强吸收峰 ❖ X-H C-H弯曲振动 < 1500 cm-1 ~1460 cm-1 有一强吸收峰 ❖ —CH3: X-H ~1380 cm-1附近有强吸收峰,受取代基影响
4.3 基团频率和特征吸收峰
4000
2500 2000 1500 1300 cm-1 900 600 cm-1
X-H 伸缩振动区
(O、N、 C或S)
叁键和 累积双 键区。
双键 伸缩 振动
C-H
弯曲 振动
单键 伸缩 振动
苯环 取代
官能团区 (基团频率区,特征区)
指纹区
红外光谱图的六个区域
4000-2500cm-1 2500-2000cm-1 2000-1500cm-1 1500-1300cm-1 1300-910cm-1 910cm-1以下
X-H伸缩振动区 三键伸缩振动区 双键伸缩振动区 C-H弯曲振动区 单键伸缩振动区 苯环取代
4000-2500cm-1 X-H伸缩振动(X=O、N、C)
OH伸缩:
3200-3650cm-1
NH伸缩:
3300-3500cm-1
CH伸缩:
3000cm-1
饱和的CH:<3000cm-1
不饱和C的CH:>3000cm-1
不同点 紫外可见吸收光谱
光源
紫外可见光
起源
电子能级跃迁
红外吸收光谱 红外光
振动能级跃迁
研 究 不饱和有机化合物 几乎所有有机物; 范 围 共轭双键、芳香族等 许多无机化合物
特色
反映发色团、助色团 反映各个基团的振
的情况
动及转动特性
4.1 概述
几点认识: 1 ) IR方法是分子吸收光谱方法 2) IR 涉及分子振动和转动能级的跃迁;
炔 C≡C
-C≡N
O﹦C﹦O
(反对称体)
2140(中)
2240(中)
2350(中)
2000-1500cm-1 双键伸缩振动
羰基
芳环
C=C 双 键
~1600(中)
1740(强)
~1500(中)
1640(强)
1500-1300cm-1 C-H弯曲振动
﹣CH3
﹣C﹣CH3 CH3
1460 1380(中)
❖ CC 与其它基团共轭时,吸收峰向低频方向移动
3300cm-1 C≡C-H
伸缩振动
2250~2100 C≡C伸缩振动
4. 芳烃类
❖ C H > 3000 3040~3030cm-1,3~4个多重峰 ❖ C=C 1650~1450 cm-1,2~4个中强吸收峰;
分子振动频率
1 k 2
:振动频率 HZ K:键力常数 N•cm-1
定义:两原子由平衡位置伸长单位长
度时的恢复力
单键 双键 三键
5
10
15
μ:折合质量 g
入射光频率与分子振动频率相等时,分子 将吸收入射光,振动振幅加大,产生吸收 光谱,因此,吸收光谱的频率为
1 k 2
波数 = 1302(k /A)1/2 A为折合相对原子质量
2. 烯烃类
❖ =CH =C-H伸缩振动 3100 cm-1 附近有较强吸收峰
❖ C=C C=C 伸缩振动 1700~1600 cm-1 较弱吸收峰
—— 共轭体系中, C=C 向低波数方向移动,强度增大,对 称性越差,吸收峰越强,完全对称,不出现吸收峰
❖ =CH =C-H弯曲振动 1000~650cm-1 处有强吸收峰 ——鉴定烯烃取代基类型最特征的峰
4.2.1、产生红外吸收的两个条件 1 . 辐射光子具有的能量与发生振动跃迁所需的跃迁能量 相等
V=0,1,2,3…… EL =△E振 即L=△•
2. 辐射与物质之间有耦合作用
△≠0
基频峰
分子吸收红外辐射后,由基态振动能级(=0)跃 迁至第一振动激发态(=1)时,所产生的吸收峰称 为基频峰。
倍频峰
近红外光区
0.75
2.5
中红外光区
2.5
50
远红外光区
50 1000
频率 Hz
4.0*1014
波数 cm-1 13000
1.2*1014
4000
1.2*1014
4000
6.0*1012 6.0*1012 30 * 1011
200 200 10
分析对象
蛋白质和水 定量
几乎所有有机物 纯无机或金
属有机物
一、基团的特征吸收峰——基团频率
➢ 组成分子的基团如:O-H、C=C、C=O等都有自己特定的 红外吸收区域,分子的其它部分对其吸收位置影响较小。
➢ 通常把能代表某基团存在,并有较高强度的吸收峰,称为 特征吸收峰,所在的频率位置称为基团频率。
➢ 基团频率——主要是一些伸缩振动引起的,常用于鉴定 某官能团是否存在。基团不同,基团频率不同。
= 3n-6 非线性分子 = 3n-5 线性分子(原子在一条直线上) • 如:H2O振动自由度 3×3 – 6 = 3三种基本振动形式
水—非线型分子的振动形式: 3n-6=9-6=3 二氧化碳—线型分子的振动形式:3n-5=9-5=4
绝大多数化合物在红外光谱图上出现的峰数远小于理 论上计算的振动数,
较小,可作为有无甲基存在的依据
当两个或三个—CH3连在一个C上时, —CH3 的1380
cm-1 峰会分裂
CH3
异丙基 CH3-CH-
叔丁基 CH3-C-
CH3 两峰高
度相近
两峰高度 一高一矮
CH3
(CH2)n n ≥ 4 CH2 750~720
正庚烷的红外光谱图
C-H C-H伸缩振动 , 3000 ~2800 cm-1 强吸收峰 X-H C-H弯曲振动 ~1460 cm-1 有一强吸收峰 X-H ~1380 cm-1附近有强吸收峰
互作用而形成)——统称泛频 ❖ 振动偶合—相邻的两个基团相互振动偶合使峰数目增多 ❖ 费米共振—当倍频或组合频与某基频峰位相近时,由于相
互作用产生强吸收带或发生峰的分裂,这种倍频峰或组合 频峰与基频峰之间的偶合称为费米共振。
4.2.3、分子振动的频率
m1
m
2
经典力学解释:质量分别为m1和m2的原子,依 靠类似弹簧的化学键连在一起。
定性 定量
定量
4.1.2 红外光谱的表示方法:
横坐标:波数(波长)
纵坐标:透光率
波长与波数之间的关系为: 波数/ cm-1 =104 /( / µm )
(每cm中波的个数)
A
光谱的表 示方式
• 紫外:用A表示吸 收光的程度,波长为 横坐标; 紫外可见 T% 吸收光谱的特征用 λmax和κ来描述
光谱区在红外光区; 3) 广泛应用于几乎所有物质的定性分析
4.1.1红外光区的划分 0.0005nm γ射线 0.01nm
X 射线
10nm
紫外光区
0.75 µm 2.5 µm 25 µm
1000 µm
近红外光区 中红外光区
远红外光区
400nm
可 见
光
区
红外光区微波Fra bibliotek30m 无线电波
光学区
电磁光谱
波长 µm
一、官能团区和指纹区
❖ 紫外可见吸收光谱为了便于解析分为R K B E四个吸收带
❖ 红外吸收光谱为了便于解析划分为两个区域
❖ 4000~1300 区域:是由伸缩振动产生的吸收带,为化学键 和基团的特征吸收峰,吸收峰较稀疏,鉴定基团存在的 主要区域——官能团区
❖ 1300~650区域:吸收光谱较复杂,除单键的伸缩振动外, 还有变形振动。能反映分子结构 的细微变化——指纹区
λ(λ)
• 红外:用T%来表示吸光强度,光的性质用波长或波数表 示;红外吸收光谱的特征用吸收峰位置和κ来描述
4.2 基本原理
红外光谱的产生
• 当一束红外光照射分子时,分子中某个振动频 率与红外光某一频率光相同时(振= 外),分子 就吸收此频率光发生振动能级跃迁,产生红外吸收 光谱。
• 根据红外吸收光谱中吸收峰的位置和形状来推 测未知物结构,进行定性分析和结构分析;根据吸 收峰的强弱与物质含量的关系进行定量分析。
RCH=RCH 反式 990~970
顺式 690
RCH=CH2 990、910两个强峰
1-辛烯红外谱图
3079cm-1 =C-H伸缩振动
~2900 cm-1 C-H伸缩振动
1642cm-1 C=C 伸缩振动
993, 910cm-1 -CH=CH2 弯曲 振动
=C-H伸缩振动 3079cm-1; C-H伸缩振动 ~2900 cm-1 C=C 伸缩振动 1642cm-1 ; -CH=CH2 弯曲振动 993, 910cm-1
2. 简正振动的基本形式 ( 1)伸缩振动
(2)变形振动(又称弯曲振动或变角振动)
伸缩振动 对称伸缩振动
反对称伸缩振动
弯曲振动 剪式振动
