镧系元素
稀土元素 镧系

稀土元素镧系镧系元素是指周期表中镧(La)到镱(Yb)这15个元素,它们统称为镧系元素。
镧系元素是稀土元素中的一类,具有独特的化学和物理性质,广泛应用于各个领域。
下面将对镧系元素进行详细介绍。
一、镧系元素的概述镧系元素是指原子核中电子的填充顺序为4f的元素,它们的外层电子结构为5d1 6s2。
镧系元素的原子序数从57到71,依次为镧、铈、镨、钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱。
这些元素的原子半径逐渐缩小,原子质量逐渐增加。
二、镧系元素的性质1. 化学性质镧系元素具有较强的还原性和氧化性,可以与大多数非金属和金属反应。
其中镧、铈和钇是相对稳定的,而镝、钬和铒则比较活泼。
镧系元素的化合价一般为+3,但也可表现出+2和+4的化合价。
2. 物理性质镧系元素是金属,具有良好的导电性和热导性。
它们的熔点和沸点较高,且在常温下呈固态。
镧系元素的磁性多样,有的呈铁磁性,有的呈反铁磁性,还有的呈顺磁性。
三、镧系元素的应用1. 钢铁冶炼镧系元素可用作钢铁冶炼中的合金元素,能够提高钢的强度、塑性和耐腐蚀性。
其中钕铁硼磁体是应用最广泛的稀土磁体,被广泛应用于电机、传感器、声学设备等领域。
2. 光学材料镧系元素的化合物具有良好的光学性能,可用于制备激光材料、光纤通信材料和荧光材料。
镧系元素的荧光粉被广泛应用于LED照明、荧光屏幕和激光显示器等领域。
3. 催化剂镧系元素的化合物具有良好的催化性能,可用作汽车尾气净化催化剂、石油加工催化剂和化学合成催化剂。
镧系催化剂能够提高反应速率、改善反应选择性和延长催化剂寿命。
4. 核能材料镧系元素的同位素镧-138是一种重要的核能材料,可用于核反应堆的燃料制备。
镧系元素还可用于制备核探测仪器、核医学放射性示踪剂和放射治疗药物。
5. 稀土磷光粉镧系元素的磷光粉广泛应用于荧光显示器、荧光屏幕、LED照明等领域。
镧系元素的磷光粉具有高亮度、长寿命和良好的发光特性。
6. 其他应用镧系元素还可用于制备陶瓷材料、玻璃材料、高温超导材料和磁性材料等。
镧系元素_高等教育-工学

★★★★★第18章镧系元素习题1. 按顺序写出镧系元素的名称、元素符号和价层电子构型。
解:镧La,5d1 6s2;铈Ce,4f15d1 6s2;镨Pr,4f3 6s2;钕Nd,4f4 6s2;钷Pm,4f5 6s2;钐Sm,4f6 6s2;铕Eu,4f7 6s2;钆Gd,4f7 5d1 6s2;铽Tb,4f9 6s2;镝Dy,4f10 6s2;钬Ho,4f11 6s2; 铒Er,4f12 6s2; 铥Tm,4f13 6s2; 镱Yb,4f14 6s2; 镥Lu, 4f14 5d1 6s2。
2. 什么是“镧系收缩”,它的起因和后果如何?解:镧系元素随着原子序数的增加原子半径的减小称为镧系收缩(lanthanide contraction)。
从La到Lu,随着原子序数增大,4f轨道中的电子逐渐增多,因4f电子对6s电子屏蔽较完全(屏蔽常数 = 0.99),原子核对最外层6s电子吸引力的增强较慢,使原子半径缓慢减小。
但镧系元素原子半径收缩的趋势不十分明显,从La到Lu原子序数增大了15,半径收缩只有15 pm,平均1 pm/核电荷。
镧系收缩使第六周期镧系后面的副族元素的半径大致减小了11pm,从而与第五周期同族元素的原子半径几乎相等(详见表10-3),又因为同族元素的价层电子构型相同,因此,他们的性质十分接近,在自然界中常共生在一起而难以分离,如Zr与Hf,Nb与Ta,Mo 与W,Tc与Re等。
3. 镧系元素常见的氧化态为+3。
为什么铈、镨、铽、镝的氧化态常呈现+4,而钐、铕、铥、镱却能呈现+2氧化态?解:镧系元素在形成化合物时,失去最外层的2个s电子, 次外层的1个d电子, 或外数第3层的1个f电子,所需电离能较小,镧系元素的特征氧化数为+3。
众所周知,电子层有一种保持或接近全空、半充满与全充满的倾向。
由于这个原因,铈Ce与铽Tb常呈现+4氧化态: Ce+4 (4f0)、Tb+4 (4f7)。
Pr+4 (4f1)、Dy+4 (4f8) 也可呈现+4氧化态,但没有Ce4+、Tb4+稳定;同理,Eu2+、Yb2+的电子结构分别为半充满的4f7和全充满的4f14,稳定性显然比Sm2+(4f6)、Tm2+(4f13)高。
镧系元素
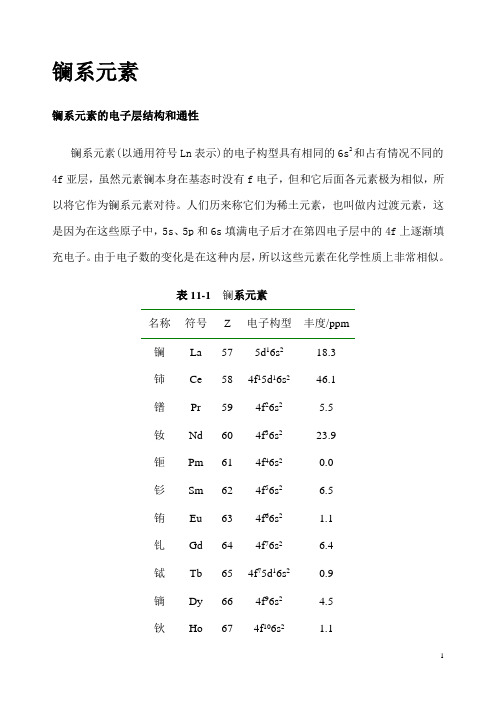
镧系元素镧系元素的电子层结构和通性镧系元素(以通用符号Ln表示)的电子构型具有相同的6s2和占有情况不同的4f亚层,虽然元素镧本身在基态时没有f电子,但和它后面各元素极为相似,所以将它作为镧系元素对待。
人们历来称它们为稀土元素,也叫做内过渡元素,这是因为在这些原子中,5s、5p和6s填满电子后才在第四电子层中的4f上逐渐填充电子。
由于电子数的变化是在这种内层,所以这些元素在化学性质上非常相似。
表11-1 镧系元素名称符号Z 电子构型丰度/ppm镧La 57 5d16s218.3铈Ce 58 4f15d16s246.1镨Pr 59 4f26s2 5.5钕Nd 60 4f36s223.9钷Pm 61 4f46s20.0钐Sm 62 4f56s2 6.5铕Eu 63 4f66s2 1.1钆Gd 64 4f76s2 6.4铽Tb 65 4f75d16s20.9镝Dy 66 4f96s2 4.5钬Ho 67 4f106s2 1.1铒Er 68 4f116s2 2.5铥Tm 69 4f126s20.2镱Yb 70 4f136s2 2.7镥Lu 71 4f145d16s20.8它们性质上的微小差别,主要是由“镧系收缩”引起的。
因为核内每增加一个质子,相应进入4f亚层的电子却太分散,不象定域程度更高的内层电子那样能有效地屏蔽核电荷,所以随着镧系元素原子序数的增加,原子核对最外层电子的引力就不断地增大,这就使得原子体积从镧到镥依次减小。
三价阳离子的收缩是十分规则的,从La3+的106pm收缩到Lu3+的35pm。
图11.1A所示金属半径,虽然总的趋向是减小,但Eu和Yb的半径比其余原子的要大得多。
它们是形成二价阳离子的倾向最大的两个镧系元素。
在固体中,这两种原子可能只将两个电子给予导带,而所形成的2+离子和其余镧系金属的3+离子相比,其半径较大、离子间的结合力较弱。
金属铕(Eu)和镱(Yb),与表中相邻的金属比,显然具有较低的密度,较低的熔点(图11.1B)和较低的升华能。
元素周期表中的镧系与锕系元素

元素周期表中的镧系与锕系元素镧系元素和锕系元素是元素周期表中两个重要的连续元素系列。
它们在化学性质和应用中都具有独特的特点。
下面将对镧系元素和锕系元素进行详细介绍。
一、镧系元素镧系元素是指周期表中镧(La)至镤(Lr)这一系列的元素。
镧系元素具有相似的化学性质和电子结构,这是由于它们都有4f轨道的电子。
镧系元素主要包括镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)和镥(Lu)。
镧系元素具有较强的还原性和催化活性,广泛应用于催化剂、照明材料和电子器件等方面。
以镧系元素为主的合金在航天、国防等领域也有重要应用。
二、锕系元素锕系元素是指周期表中锕(Ac)至铀(U)这一系列的元素。
锕系元素的特点是其核外电子排布在5f轨道上,这使得它们具有较复杂的电子结构和较高的电子自旋磁矩。
锕系元素主要包括锕(Ac)、钍(Th)、镤(Pa)、铀(U)、镅(Np)、钚(Pu)、镎(Am)、锔(Cm)、锫(Bk)、锎(Cf)、锿(Es)、镄(Fm)、钔(Md)、锘(No)和鿃(Lr)。
锕系元素具有重要的核物理性质和广泛的应用价值。
铀是锕系元素中应用最广泛的元素,被广泛应用于核能产业和核武器制造。
锕系元素还可以用于放射性同位素的制备、放射性示踪和医学诊断等领域。
总结:镧系元素和锕系元素在元素周期表中具有重要的位置和作用。
它们的电子结构和化学性质的独特性使得它们在催化、照明、电子器件、核能产业等方面具有广泛的应用价值。
对镧系和锕系元素的深入研究有助于我们更好地理解元素周期表和探索新的材料与技术。
通过对元素周期表中镧系和锕系元素的了解,我们可以更好地认识这些元素的特性和应用,并且在科学研究和工业生产中发挥其独特作用。
希望对您有所帮助!。
镧系元素

原子半径/pm
187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4
Ln3+半径 /pm E q /V
106.1 -2.38
103.4 -2.34
101.3 -2.35
99.5 -2.32
97.9
-2.29
96.4
-2.30
95.0
-1.99
93.8 -2.28
92.3
-2.31
90.8
-2.29
89.4
-2.33
88.1
-2.32
86.9
-2.32
85.8
-2.22
84.8
-2.30
7Hale Waihona Puke 从上图中可以看出,镧系元素的原子半径和
离子半径在总的趋势上都随着原子序数的增加而
缩小的幅度很小,这叫做
2
3 Li
锂
4 Be
铍
5 B 6 C 7 N 8 O 9 F 10 Ne
硼 碳 氮氧 氟 氖
3
11 Na
钠
12 Mg
镁
IIIB
IVB
VB
VIB VIIB
VIII
13 Al 14 Si 15 P 16 S 17 Cl 18 Ar
IB IIB 铝 硅 磷 硫 氯 氩
4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr
整个电子壳层依次收缩的积累造成总的镧系收缩
镧系元素

镧系元素在周期系中,你知道什么是镧系元素?什么是稀土元素吗?它们的电子层结构和性质有什么特点?它们在科学技术和生产中扮演了什么样的角色?“镧系元素”在周期表中从原子序数为57号的镧到原子序数为71号的镥共15种元素,它们的化学性质十分相似,都位于周期表中第ⅢB族,第6周期镧的同一格内,但它们不是同位素。
同位素的原子序数是相同的,只是质量数不同。
而这15种元素,不仅质量数不同,原子序数也不同。
称这15种元素为镧系元素,用Ln表示。
它们组成了第一内过渡系元素。
“稀土元素”镧系元素以及与镧系元素在化学性质上相近的、在镧系元素格子上方的钇和钪,共17种元素总称为稀土元素,用RE表示。
按照稀土元素的电子层结构及物理和化学性质,把钆以前的7个元素:La、Ce、Pr、Nd、Pm、Sm和Eu称为轻稀土元素或铈组稀土元素;钆和钆以后的7个元素:Gd、Tb、Dy、Ho、Er、Tm、Yb、Lu,再加上Sc和Y共10个元素,称为重稀土元素或钇组稀土元素。
“稀土”的名称是18世纪遗留下来的。
由于当时这类矿物相当稀少,提取它们又困难,它们的氧化物又和组成土壤的金属氧化物Al2O3很相似,因此取名“稀土”。
实际上稀土元素既不“稀少”,也不像“土”。
它们在地壳中的含量为0.01534,其中丰度最大的是铈,在地壳中的含量占0.0046,其次是钇、钕、镧等。
铈在地壳中的含量比锡还高,钇比铅高,就是比较少见的铥,其总含量也比人们熟悉的银或汞多,所以稀土元素并不稀少。
这些元素全部是金属,人们有时也叫它们稀土金属。
我国稀土矿藏遍及18个省(区),是世界上储量最多的国家。
内蒙包头的白云鄂博矿是世界上最大的稀土矿。
在我国,具有重要工业意义的稀土矿物有氟碳铈矿Ce(CO3)F,独居石矿RE(PO4),它们是轻稀土的主要来源。
磷钇矿YPO4和褐钇铌矿YNbO4是重稀土的主要来源。
我们从以下几个方面来讨论镧系元素的通性:1、价电子层结构2、氧化态3、原子半径和离子半径4、离子的颜色5、离子的磁性6、标准电极7、金属单质电子层结构这是目前根据原子光谱和电子束共振实验得到的镧系元素原子的电子层结构:根据电子填充的一般规律,由于4f能级的能量介于6s和5d之间,由表Ln-1中可见,从第57号元素镧开始,新增加的电子填充在4f能级上,应该4f能级充满后再填充到5d能级上去。
第十二章镧系元素介绍

溶液中Ln3+的颜色
镧系元素离子为何具有颜色?
4f亚层半充满的镧系元素离子,其颜色主要是由4f 亚层 中的电子跃迁引起的。(f-f 跃迁)
如果金属处于高氧化态而配位体又具有还原性的话,就 能产生配位体到金属的电荷迁移跃迁。
Ce4+离子的橙红色是由电荷迁移跃迁还是由f-f 跃迁所引 起?(电荷迁移跃迁)
镧系元素化学性质的差异
从La3+到Lu3+, 因电子结构单调变化使+3价离子的半径作有 规律的变化,结果导致镧系元素化学性质上的微细差异作有 规律的收缩。 e.g. 镧系元素+3价离子的碱度随着原子序数的递增而依次减 弱,并且同原子的电负性的变化平行。其离子碱度相对强弱 可以用以判断离子水解程度、配位化合物的稳定性和金属离子 形成氢氧化物沉淀的pH大小。
• 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No
12.1 镧系元素的性质
1.引言
镧系元素包括从镧(57)到镥(71)的15个第六周期
的内过渡元素;
锕系元素包括从锕(89)到铹(71)的15个第七周期
的内过渡元素;
(内过渡元素:有电子填充在内层的(n-2)f 能级。但对于镧系和锕系 来讲并不规则,电子也会填入5d或6d能级:这是由于4f和5d, 5f和6d能 级的能量较为接近的原因)
稀土元素
镧系元素的化学性质十分相似而又不完全 相同。包括镧系元素以及与镧系元素在化学性 质上相近的钪(Sc)和钇(Y),共17个元素总称为
从上图中可以看出,镧系元素的原子半径和离子 半径在总的趋势上都随着原子序数的增加而缩小,这 叫做镧系收缩现象. 镧系收缩的结果,使金属原子半 径从La (187.7 pm) 到Lu (173.4 pm)共缩小~15 pm, 平均1 pm/核电荷.
第一节 镧系元素
第一节 镧系元素 第二节 锕系元素
ⅠA
H
ⅡA
元素周期表
ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
0 ⅢA ⅣA ⅤA ⅥA ⅦA
He Ne
Li Be Na Mg K Ca Rb Sr Sc Y Ti V
B
C
N
O S
F
Al Si P
Cl Ar Xe
Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
钆(ga) Gd ga) 镥 Lu
2.镧系收缩 2.镧系收缩
符号 价电子结构 rM(pm) pm)
镧系元素的原子半 径(或离子半径)随原 或离子半径) 子系数的增加而逐渐减 小的现象,称为“ 小的现象,称为“镧系 逐 收缩” 步 收缩”。 减 小
镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥
为什么铕和铥会 出现反常现象。 出现反常现象。
资料卡片
⑴屏蔽效应
所谓屏蔽效应是指, 所谓屏蔽效应是指,由于其它电子对某一电子的排斥作用而抵 消了一部分核电荷,从而引起有效核电荷的降低, 消了一部分核电荷,从而引起有效核电荷的降低,削弱了核电荷对 该电子的吸引,这种作用称为屏蔽作用或屏蔽效应。 该电子的吸引,这种作用称为屏蔽作用或屏蔽效应。
在钪、钇之后, 在钪、钇之后,随着原子序数的增 加,电子相应地填充在3d、4d轨道上构 电子相应地填充在3d、4d轨道上构 3d 成第一、第二过渡系。 成第一、第二过渡系。 到了镧后,原子出现了f 轨道。镧 到了镧后,原子出现了f 轨道。 之后的14种元素4f 镧系) 之后的14种元素4f1-4f14(镧系)称为 14种元素 第一内过渡系。 第一内过渡系。 锕之后的14种元素5f 锕系) 锕之后的14种元素5f1-5f14(锕系) 14种元素 称为第二内过渡系。 称为第二内过渡系。
第十四章 镧系元素 原子核化学

二、衰变常数和半衰期 核衰变都是一级反应。因此一级化学反应的 速率公式也适用于核衰变。 核衰变相对应的速率公式: dN/dt=λN 即 lnN=lnN0-λt 或lnN0/N=λt 即 t1/2=0.693/λ 以上公式中,N0为起使时(t=0)放射性原子 核的数目;N为t时刻尚未衰变的核数目;dN 为t到t + dt时间间隔内衰变的核数;λ为衰变 常数;t1/2为半衰期,即核衰变一半所需的时 间。
四、镧系元素离子和化合物的颜色 不少镧系元素离子具有颜色,由于f-f跃迁引 起的。Ln3+呈现颜色通常与未成对电子数有 关,即Ln3+具有fn和f14-n个电子,因未成对电 子数相同,所以呈现相同或相近颜色。其中 La3+(f0)、Lu3+(f14)为无色,因不能实现f-f跃 迁;Ce3+(f1)、Eu3+(f6)、Gd3+(f7)、Tb3+(f8)等 离子虽可实现f-f跃迁,但吸收峰落在紫外区, Yb3+(f13)吸收峰落在红外区,故也为无色; Ce4+(f0)呈现橙红色是由于电荷迁移引起的。
相似处: 1、镧系特征氧化态为+3,锕系随原子序数增 加+3价稳定 2、锕系许多化合物与镧系化合物类质同晶 3、与镧系收缩相似,锕系元素离子半径也出 现“锕系收缩” 4、锕系元素也能发生f-f跃迁而显色
不同处: 1、锕系氧化态呈现多样性,前面一部分锕系 元素最稳定氧化态有+4、+5、+6,而这些元 素多种氧化态可同时稳定存在,如Pu在水溶 液中+3、+4、+5、+6都可存在。 2、锕系元素离子形成配合物时有较多的共价 性,因而形成配合物的能力比镧系元素强。
六、锕系元素 从原子序数89的锕(Ac)至原子序数103的铹 (Lr),共15种元素,用An表示。价电子构 型有两种类型:5fn7s2和5fn-16d17s2,但锕系 的5f和6d能量差比镧系4f和5d能量差更小, 锕系前半部分元素的原子有保持d电子倾向, 后半部分元素原子电子构型与镧系元素相似。
镧系元素

+II Sm(4f66s2) Sm(4f6)
Eu(4f76s2) Tm(4f136s2) Yb(4f146s2) Eu(4f7) Tm(4f13) Yb(4f14)
从4f电子层结构来看,其接近或保持全空、半满及全 满时的状态较稳定(也存在热力学及动力学因素)。
水溶液的稳定性:
Ce4+(4fo) > Pr4+(4f1) Sm2+(4f6) < Eu2+(4f7)
LnCl3
LnCl3·6H2
O
LnCl标3和准L溶nC解l3焓·6H2O的
镧系元素的单质
1. 镧系金属单质的化学性质
碱金属 Eo = -2.9左右 碱土金属 Eo = -2.3—2.9
Al E o = -1.96
Ln E o = -2.3左右
(1) 活泼性仅次于碱金属和Ca、Sr、Ba而与Mg 类似;
89 Ac 90 Th 91 Pa 92 U 93 Np 94 Pu 95Am 96 Cm 97 Bk 98 Cf 99 Es 100 Fm 101Md 102No 103 Lr
锕 钍 镤 铀镎 钚 镅 锔 锫 锎 锿 镄 钔 锘 铹
镧系元素的发现
镱 1879年 钇 1794年 镱 1878年
镥 1905-1907年 钇土1794年 铒 1843年 钪 1879年
不同点:
铈组
钇组
硫酸盐 碳酸盐 草酸盐
不溶于M2SO4溶液 不溶于CO32-溶液 不溶于C2O42-溶液
溶于M2SO4溶液 溶于CO32-溶液 溶于C2O42-溶液
2. +IV化合物
Ce(4f15d16s2),Pr(4f36s2),Tb(4f96s2),Dy(4f106s2)能形 成+IV氧化态即Ce(4f0),Pr(4f1),Tb(4f7),Dy(4f8) 。
镧系元素.ppt

6铕36铕3EEuu 9镅59镅5AAmm
664钆4钆GGdd 9锔9锔66CCmm
6655铽铽TTbb 9977锫锫BBkk
6969镝锎68镝锎68DCDCyfyf69钬7锿969钬7H锿9EHoEsos160镄8铒1060镄8铒FE0mrFEm1r60铥钔911MT60铥钔9dm1MT1dm70镱锘021NY70镱 锘ob02NY170ob1镥铹3 L1L701u镥铹r3 LLur
原子半径/pm
187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4
Ln3+半径 /pm E q /V
106.1 -2.38
103.4 -2.34
101.3 -2.35
99.5 -2.32
三、氧化态
+III氧化态是所有Ln元素的特征氧化态。
Ce(4f15d16s2),Pr(4f36s2),Tb(4f96s2),Dy(4f106s2) 能形成+IV氧化态即
Ce(4f0),Pr(4f1),Tb(4f7),Dy(4f8) 。
Sm(4f66s2),Eu(4f76s2),Tm(4f136s2),Yb(4f146s2) 能形成+II氧化态即
钫 镭 Ac-Lr 钅卢 钅杜 钅喜 钅波 钅黑 钅麦 Uun Uuu Uub
114 116 118
镧 锕系 系镧锕系系85镧 锕97ALca85镧锕97A5L9铈 钍80caTC59he铈钍80 TC59he9镨镤1 P5P99镨镤1arPP69ar0钕2铀N690U钕2d铀NUd69钷 镎136P9N钷镎13mpPNmp69钚24钐69钚24PS钐PSumum
镧系元素和锕系元素

镧系元素和锕系元素在工业、科研、医疗等领域有着广泛的应用,如用于制造催化剂、荧光材料、核反应堆等。
在自然界中的分布与稳定性
分布
镧系元素和锕系元素主要分布在地球的岩石圈中,其中一些元素也可以在海洋、大气中检测到。
稳定性
在自然界中,镧系元素和锕系元素通常以稳定或较稳定的同位素形式存在,但也有一些放射性同位素 。
REPORT
CATALOG
DATE
ANALYSIS
SUMMARY
镧系元素和锕系元素
目录
CONTENTS
• 镧系元素的概述 • 锕系元素的概述 • 镧系元素与锕系元素的相似性 • 镧系元素与锕系元素的区别 • 镧系元素与锕系元素的未来发展
REPORT
CATALOG
DATE
ANALYSIS
SUMMAR Y
电子排布与性质
电子排布
镧系元素和锕系元素的电子排布具有 相似性,它们的最外层电子数均为8 个,次外层电子数均为18个。
性质
由于电子排布相似,镧系元素和锕系 元素在化学性质上也有很多相似之处, 如氧化态、配位数等。
化学性质与用途
化学性质
镧系元素和锕系元素具有多种氧化态,可以形成多种化合物,如氧化物、硫化物、卤化物等。
非金属元素反应。
在工业与科学研究中的应用差异
镧系元素在工业 中的应用
镧系元素在工业中广泛应用 于制造合金、催化剂、荧光 粉等。例如,镧可以用于制 造高温超导材料,铈可以用 于制造汽车尾气净化催化剂 等。
锕系元素在工业 中的应用
锕系元素在工业中主要用于 核能领域,如制造核燃料和 核反应堆等。例如,铀和钚 是核反应堆中的重要燃料, 镅和锔可用于制造放射性示 踪剂等。
镧系元素总结

镧系元素总结简介镧系元素是指周期表中镧(La)至镥(Lu)元素的集合。
这些元素也被称为稀土元素,由于其在地壳中含量较低且难以提取,因此被称为稀土。
镧系元素具有独特的化学和物理特性,广泛应用于科学研究、工业生产和医学领域。
特性1.原子结构:镧系元素的原子结构特点是外层电子结构为4f n5d16s^2,其中n代表原子序数。
这些元素的电子排布使得它们在化学性质上表现出相似的特点。
2.化学性质:镧系元素具有较强的金属性质,常为淡黄色的金属。
它们高度活泼,能与多种元素形成化合物。
镧系元素在化学反应中往往呈现多个化价态,表现出丰富的化学性质。
3.物理性质:镧系元素具有较高的熔点、沸点和密度。
它们具有良好的导电性和热导性。
镧系元素还具有磁性,在不同的温度下表现出不同的磁性行为。
4.放射性:镧系元素中的几个元素具有放射性。
其中,镧和钆具有稳定的同位素,而其他元素如镤、铕、铽等则具有放射性同位素。
应用领域1.制备材料:镧系元素广泛应用于材料科学领域。
它们在制备高温超导材料、储能材料和催化剂等方面发挥重要作用。
2.光学应用:镧系元素的化合物在光学领域具有广泛的应用。
它们的特殊发光性能使得它们成为荧光粉、荧光标记剂和激光材料的重要组成部分。
3.化学分析:镧系元素在化学分析中具有重要的作用。
它们的化学性质使得它们成为配位化合物和指示剂的理想选择。
4.核医学:镧系元素的放射性同位素被广泛应用于核医学领域。
镧系元素的放射性同位素可用于放射性示踪、放射治疗和核素扫描等。
5.环境保护:镧系元素在环境保护领域具有重要作用。
它们的催化性能使得镧系元素在废气净化和废水处理中起到重要的作用。
镧系元素列表•镧 (La)•铈 (Ce)•镨 (Pr)•钕 (Nd)•钷 (Pm)•铒 (Sm)•铽 (Eu)•镝 (Gd)•钬 (Ho)•铒 (Er)•铥 (Tm)•镱 (Yb)•镥 (Lu)结论镧系元素具有独特的化学和物理特性,广泛应用于科学研究、工业生产和医学领域。
第二十一章 镧系元素

4f 14电子,这种结构比起4f 电子层没有充满的其他状态来
对原子核有较大的屏蔽作用,所以其半径突出地增大。基 于此, Eu和Yb的密度、熔点比它们各自左右相邻的两个金 属都小;它们的性质同Ca、Sr、Ba相近,如都能溶于液氨 形成深蓝色溶液。
c) 镧系收缩的影响
使钇Y3+(88 pm)在离子半径的序列中落在铒Er3+(88.1 pm)
或将镧系金属直接氧化 Ln2O3。 但Ce生成白色CeO2,
Pr生成黑色Pr6O11,Tb生成暗棕色的Tb4O7。CeO2 、
PrO2比Al2O3 、SiO2还要稳定。
Ln2O3难溶于水和碱性介质中,但是易溶于强酸中。 Ln2O3在空气中吸收二氧化碳而形成碱式碳酸盐。
2 氢氧化物
制备 : Ln3+ (aq) + NH3 ·H2O (或 NaOH) → Ln (OH)3↓
4) 镧系元素草酸盐可溶于碱金属草酸盐溶液中,但
溶解度有明显的区别。
6 硝酸盐
Ln(NO)3 · xH2O: 镧系元素硝酸盐以x=6较为常 见。 Ln(NO)3易溶于水,也能溶于有机溶剂,如醇、 酮、醚中。 Ce(NO)4能和NH4NO3形成较稳定的配合物 (NH4)2[Ce(NO3)6],易溶于水,也能溶于有机溶
“稀土”元素并不稀少
17种稀土元素在地壳中占0.0153%,其中丰度最大的是 铈,在地壳中占0.0046%,含量高于锡;其次是钇、钕、镧 等。钇含量高于铅,铥也比我们所熟悉的银或汞多。所以, “稀土”元素并不稀少。
世界上目前已发现的稀土矿物约有250多种,其中含量 较高的有60多种,实际上有开采价值的只有10多种。我国 稀土矿藏遍及十多个省,是世界上储量最多的国家。白云 鄂博矿床距包头 150 公里,它是世界上最大的稀土资源, 目前的稀土产量占全国的 60%。 具有重要工业意义的稀土矿物有磷钇矿(YPO4)、氟碳铈 (Ce(CO3)F)矿、褐钇铌矿(YNbO4)等等。
镧系元素

由于稀土元素半径相近,性质相似, 往往以混合矿物形式存在。
独居石、磷钇矿、氟碳铈镧矿等是 重要的稀土磷酸盐矿物。
我国的稀土储量占世界第一位。
锕系元素都具有放射性 Ac Th 锕 钍 Bk Cf 锫 锎 Pa 镤 Es 锿 U 铀 Fm 镄 Np 镎 Md 钔 Pu Am 钚 镅 No Lr 锘 铹 Cm 锔
Ln2O3 难溶于水,易溶于酸,经过灼烧 仍溶于强酸,与 Al2O3 不同。 Ln 盐类与 NaOH 反应,可以得到 (III ) Ln (OH) 3, 其碱性与碱金属和碱土金属的氢 氧化物相近,且随着原子序数的递增而有规 律减弱。
(2)其它价态化合物
除 + 3 价外,有的镧系元素也有 + 2 和 +4价。 + 4 价氧化物具有较强的氧化性,例如 PrO2 只能存在于固体中,与水作用将还原 成 +3 价。 4 PrO2 + 6 H2O —— 4 Pr (OH) 3 + O2↑
Gd Tb Dy Ho Er Tm Yb Lu 钆 铽 镝 钬 铒 铥 镱 镥 外加 Y 钇和 Sc 钪,称为钇组稀土或重稀土
稀土元素总量在地壳中的丰度为 1.53 × 10–2 %。
其中最多的是Ce,丰度为 6.8 ×10–3 % , 比 Cu 含量多,其次是 Y,Nd,La等,Pm 在地壳中仅以痕量存在。
镧系元素内层 4f 电子受晶体场影响较小, 因此,在计算磁矩时,既要考虑自旋运动的贡献, 又要考虑轨道运动的贡献。 镧系元素是良好的磁性材料。 其中,稀土—钴永磁材料是目前广发应用 的磁性材料。
22―1―2 镧系元素的重要化合物
1 氧化物和氢氧化物
(1) +3 价化合物 +3 价是镧系元素的主要价态。 除 Ce,Pr,Tb 外,镧系金属在空气 中加热均可得到 +3 价碱性氧化物 Ln2O3。
镧系元素-最详细的介绍

4、 硫酸盐 常含结晶水,Ln2(SO4)3·8H2O,溶解度随升 温而降低;加 MI2SO4 可成复,盐,但化 学式与常规的不同:
xLn2(SO4)3·y MI2SO4·zH2O x:y:z = 1:1:2 或 1:1:4 Ln2(SO4)3·8H2O ∆ → Ln2(SO4)3 ∆ → Ln2O2SO4 + 2SO2 + O2 Ln2O2SO4 ∆ →Ln2O3 + SO2 + 0.5O2
3、 卤化物 F-:LnF3 在3M HNO3 中仍沉淀(鉴定方法), 其它卤化物易溶; Ln2O3 + 6NH4Cl 300°C → 2 LnCl3 + 3H2O + 6NH3 Ln3+ 也易水解,所以其结晶水盐加热脱水时需 加条件。 LnCl3 + H2O ≒ LnOCl + 2HCl LnCl3·nH2O 欲脱水要采用1 低温抽真空;2通 HCl 3加NH4Cl一起加热。
三、重要化合物
(一)、+3价 1、氧化物,mp高熔点,偏离子型晶体;从氢氧 化物、各种含氧酸盐灼烧可得,或金属单质灼 烧直接氧化也可得;通式:Ln2O3 Ln2(C2O4)3 -→ >800°C → Ln2O3 最常见的方法 Ln2O3难溶于水或碱;易溶于强酸 2、 Ln(OH)3 碱性近似于碱土,但溶解度很小,Ksp:10-19~ 10-24 ;在NH4Cl存在下加NH3·H2O可沉淀,借 此可与Mg2+等碱土离子分离。 碱性:从La3+ -→ Lu3+ 减小
5、 草酸盐 Ln2(C2O4)3 难溶于水又难溶于酸,以此与 其它金属离子分离开来,对于提炼稀土 有重要的意义。硝酸盐或氯化物中加 6MHNO3和H2C2O4得到。
Ln2(C2O4)3 ∆ → ―→ ―→ ―→ CO,CO2,Ln2O3 Ln2(C2O4) (CO3)2, Ln2 (CO3)3, Ln2O (CO3)2, + CO + CO +CO2
镧系元素-最详细的介绍

慢性影响
长期接触镧系元素可能导致贫血、肝肾损伤等 慢性健康问题。
发育毒性
研究表明,镧系元素可能对胎儿和婴幼儿发育产生不良影响。
安全注意事项和使用规范
佩戴防护用品
在接触镧系元素的过程中,应佩戴化学防护 眼镜、实验服和化学防护手套。
镧系元素包括
镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽 (Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)和镥(Lu)。
特性
01
镧系元素的原子序数逐渐增加,但核外电子排布却只有两 个电子层,即K层和L层。
02
镧系元素具有类似的化学性质和物理性质,因为它们的价 电子构型相同,都是4f^n6s^2。
03
稀土元素矿是工业上提取镧系 元素的主要来源,通过分离和 提纯这些元素,可以用于各种 工业和科技领域。
02 镧系元素的物理和化学性质
物理性质
原子序数
从57(镧)到71(镥),原 子序数逐渐增加。
原子半径
随着原子序数的增加,原子 半径逐渐减小,表现出明显 的"镧系收缩"现象。
电子构型
每个镧系元素的电子构型都 是相同的,即每个元素都有 两个未充满的电子壳层 (n=4和5)。
03
镧系收缩:随着原子序数的增加,镧系元素的原子半径逐渐减 小,这是因为4f电子逐渐向5d电子跃迁,使得原子核的对外层
电子的吸引力逐渐增强。
镧系元素在自然界中的存在
01
镧系元素在地壳中的丰度较低 ,它们主要存在于稀土元素矿 中。
02
自然界中,镧系元素通常与其 他稀土元素共生,以化合物的 形式存在于矿物中。
镧系元素氧化态_概述及解释说明

镧系元素氧化态概述及解释说明1. 引言1.1 概述镧系元素是指周期表中的镧系15个元素,包括镧(La)、铈(Ce)、钕(Pr)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu)以及长寿命的放射性元素锗(Ge)。
这些元素具有独特的物理和化学性质,在多个领域有广泛应用。
1.2 文章结构本文首先介绍了镧系元素氧化态的基本概念,包括定义、特点以及氧化态分类方法。
接着,文章将详细解释说明镧系元素氧化态的形成机制,主要通过原子轨道理论、电子云密度分析和分子轨道理论对其进行解释。
随后,我们将探讨实验方法与技术在研究镧系元素氧化态中的应用,包括X射线衍射分析技术、光谱技术和表面分析技术。
最后,文章总结了已有研究并展望未来的研究方向。
1.3 目的本文旨在全面了解和阐述镧系元素氧化态的基本概念和形成机制,并介绍实验方法与技术在其研究中的应用。
通过对镧系元素氧化态的深入分析,我们将更加全面地认识这些元素的性质及其在材料科学、催化剂设计等领域的应用潜力。
此外,本文还将探讨未来研究方向,促进相关领域的持续发展。
2. 镧系元素氧化态的基本概念2.1 镧系元素的定义与特点镧系元素是指原子序数58至71的一组元素,也称为镧系或稀土元素。
这组元素具有相似的电子结构和化学性质。
它们一般包括铈(Ce)、镧(La)、钕(Nd)、钷(Pr)、钐(Sm)以及其他几个元素。
镧系元素在自然界中广泛存在,并且在地壳中含量较高。
它们具有良好的磁性、光学性能和催化活性,因此在多个领域具有重要应用价值。
此外,镧系元素还可以形成多种氧化态,这些不同氧化态对其物理化学性质产生重要影响。
2.2 氧化态的概念及意义氧化态是指一个原子或离子损失或获得电子后所带电荷的状态。
它可以反映出物质中原子或离子所具有的电荷转移情况以及其与其他物质相互作用的能力。
对于镧系元素而言,不同氧化态代表着其所处的不同电荷状态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
广西大学化学化工学院
无机化学
产生结果: 1、Y成为稀土元素的成员 2、Zr和Hf,Nb和Ta,Mo和W原子半径和离子半 径也较接近,化学性质也相似。 3、ⅧB族中两排铂系元素在性质上极为相似, 也是镧系收缩所带来的影响。
2019/11/21
广西大学化学化工学院
无 机 化 学 22.2.3 镧系元素的氧化态
为4fn6s2。
2019/11/21
但在固态下主要为 4fn-15d16s2, 例外:Eu 4f76s2
Yb 4f146s2
广西大学化学化工学院
无机化学
由于4f 轨道被外层电子有效地屏蔽着, 且由于E4fE5d, 因而在结构为 4fn6s2 的情况下, f 电子要参与反应,必须 先得由4f 轨道跃迁到5d 轨道。这样,由于电子构型不 同,所需激发能不同,元素的化学活泼性就有了差异。
2019/11/21
广西大学化学化工学院
无 机 化 学 22.3.2 镧系元素离子和化合物的磁性
双峰形状是由于镧系离 子的总角动量呈现周期 性变化所致。除Sm3+和 Eu3+外,其他离子的计 算值和实验值都很一致, Sm3+和Eu3+的不一致被 认为是在测定时包含了 较低激发态的贡献。
良好磁性材料,把它们制成稀土合金后可作为
2019/11/21
广西大学化学化工学院
无机化学
2019/11/21
22.2.2 镧系收缩
镧系元素原子半径和离子半径: • 原子半径:
大于相应的第五周期元素; 总趋势是逐渐减小,在Eu 和Yb处有两个峰值 • 离子半径: 半径递减,没有峰值 递减程度比原子半径递减 程度大
广西大学化学化工学院
无机化学
2019/11/21
广西大学化学化工学院
无 机 化 学 22.3 镧系元素离子和化合物
22.3.1 镧系元素离子和化合物的颜色 22.3.2 镧系元素离子和化合物的磁性 22.3.3 镧系元素的发光材料
2019/11/21
广西大学化学化工学院
无 机 化 学 22.3.1 镧系元素离子和化合物的颜色
2019/11/21
广西大学化学化工学院
无 机 化 学 22.4.2 氧化数为+3的化合物
(1) 氧化物
镧系金属在高于456K时,能迅速被空气氧化,生成 Ln2O3型的氧化物。 Ln2O3难溶 于水或碱性介质中,但易溶于强酸中 Ln2O3在水中发生水合作用而形成水合氧化物 Ln2O3从空气在中吸收二氧化碳生成碱式碳酸盐 (2)氢氧化物
材料、稀土原子能材料等一批新型功能材料。这些材料
因为无污染、高性能而被称为“绿色材料”,它们已经
或将要在电子信息、汽车尾气净化、电动汽车以及空间、
海洋、生物技术、生理医疗等领域发挥巨大的作用。
2019/11/21
广西大学化学化工学院
无机化学
稀土有净化环境的功能。汽车尾气净化催化剂 是稀土应用量最大的项目之一。由于稀土元素具 有特殊的电子层结构,可以将吸收到的能量转换 为光的形式发出。利用这一特性制成的稀土荧光 材料可用于计算机显示器及各种显示屏和荧光灯。 以彩电为代表的家电产品广泛应用了稀土的荧光、 抛光、永磁、功能陶瓷、玻璃添加剂等多种功能 材料,带动了稀土开发应用。
64 Gd 180.2
93.8
65 Tb 178.2
92.3 84
66 Dy 177.3
90.8
67 Ho 176.6
89.4
68 Er 175.7
88.1
69 Tm 174.6 94 86.9
70 Yb 194.0 93 85.8
71 2019/11/21 Lu 173.4
84.8
镧系收缩: 镧系元素的原子半径和 离子半径随着原子序数 的增加而逐渐减小的现 象称为镧系收缩,Eu 和Yb出现反常现象,
解释:颜色主要是由4f 电子跃迁引起,即f-f 跃迁所引 起。4f 轨道全空、半充满和全充满或接近这种结构时是 稳定的或比较稳定的,4f 轨道半充满、全充满时4f 电 子不被可见光激发,4f 轨道全空时无电子可激发,所以 La3+(4f0),Gd3+(4f7), Lu3+(4f14)和Ce3+(4f1),Eu3+(4f6), Tb3+(4f8),Yb3+(4f13)皆无色。其它具有fn(n=2, 3, 4, 5, 9,10,ll,12)电子的Ln3+都显示不同的颜色。
另一方面,激发的结果增加了一个成键电子,成键 时可以多释放出一份成键能。对大多数镧系的原子,其 成键能大于激发能,从而导致4f 电子向5d 电子跃迁, 但少数原子,如Eu和Yb,由于4f 轨道处于半满和全满 的稳定状态,要使4f 电子激发必须破坏这种稳定结构, 因而所需激发能较大,激发能高于成键能,电子不容易 跃迁, 使得Eu、Yb两元素在化学反应中往往只以6s2电子 参与反应。
2019/11/21
广西大学化学化工学院
无 机 化 学 22.4 镧系元素的重要化合物和镧系金属
22.4.1 镧系金属单质 22.4.2 氧化数为+3的化合物 22.4.3 氧化数为+4和+2的化合物 22.4.4 配位化合物
2019/11/21
广西大学化学化工学院
无 机 化 学 22.4.1 镧系金属单质
广西大学化学化工学院
无机化学
镧系收缩
镧系收缩90%归因于依次填充的(n-2)f电子, 其屏蔽常数可能略小于1.00(有文献报告为0.98), 对核电荷的屏蔽不够完全,使有效核电荷Z*递增, 核对电子的引力增大使其更靠近核;而10%来源 于相对论性效应,重元素的相对论性收缩较为显 著。
2019/11/21
原子元素 金属原子 离子半径/ pm 序数符号 半径/pm RE2+ RE3+ RE4+
57 La 187.7
106.1
58 Ce 182.4
103.4 92
59 Pr 182.8
101.3 90
60 Nd 182.1
99.5
61 Pm 181.0
97.9
62 Sm 180.2 111 96.4
63 Eu 204.2 109 95.0
在水溶液中主要形成水的配合物,只有和螯合剂才 能形成稳定的配合物。
(2)配位数
Ln3+离子的配位数一般比较大,最高可达12
2019/11/21
广西大学化学化工学院
无机化学
稀土的用途
稀土钢能显著提高钢的耐磨性、耐磨蚀性和韧性;
稀土铝盘条在缩小铝线细度的同时可提高强度和导电率;
将稀土农药喷洒在果树上,即能消灭病虫害,又能提高
+III氧化态是所有Ln元素的特征氧化态。 它们失去三个电子所需的电离势较低,即能形成稳 定的+III氧化态。 有些虽然也有+II或+IV氧化态,但都不稳定。 Ce(4f15d16s2),Pr(4f36s2),Tb(4f96s2),Dy(4f106s2)能形成 +IV氧化态即Ce(4f0),Pr(4f1),Tb(4f7),Dy(4f8) 。 Sm(4f66s2),Eu(4f76s2),Tm(4f136s2),Yb(4f146s2)能形成 +II氧化态即Sm(4f6),Eu(4f7),Tm(4f13),Yb(4f14) 。 接近或保持全空、半满及全满时的状态较稳定
这种跃迁是量子化的,因而都应是线状光谱,强度 不同,综合起来显示红色。
2019/11/21
广西大学化学化工学院
无机化学
红:铕激活的氧化钇基质 蓝:铕激活的硅酸盐基质、
铕激活的磷酸盐基质 铕激活的锆酸盐基质、 铕激活的钡、镁、铝酸盐基质 绿:铽激活的磷酸盐基质、 铽激活的硅酸盐基质 铽激活的铈、镁、铝酸盐基质
2019/11/21
广西大学化学化工学院
无 机 化 学22.2 镧系元素的电子结构和通性
22.2.1 镧系元素的价电子层结构 22.2.2 镧系收缩 22.2.3 镧系元素的氧化态
2019/11/21
广西大学化学化工学院
无 机 化 学22.2.1 镧系元素的价电子层结构
镧系元素气态原子的4f轨道的充填呈现两种构型, 即4fn-15d16s2和4fn6s2,其中 La、Ce、Gd、Lu的 基态处于4fn-15d16s2 时能量较低,而其余元素皆
挂果率;稀土复合肥即能改善土壤结构,又给提高农产
品产量;加入稀土的化妆品能美容,让人更显年轻;稀
土元素还能抑制癌细胞的恶化和扩散。
稀土元素在光、磁、电领域能够产生特殊的能量转
换、传输、存储功能,通过对稀土原料的加工,已形成
稀土永磁材料、稀土发光材料、稀土激光材料、稀土贮
氢材料、稀土光纤材料、稀土磁光存储材料、稀土超导
离子(4fn)
未成对 4f电子数
颜色
La3+(4f0)
0
Ce3+(4f1)
1
Pr3+(4f2)
2
Nd3+(4f3)
3
无 无 绿 淡红
Pm3+(4f4)
4
粉红/淡黄
Sm3+(4f5)
5
黄
Eu3+(4f6)
6
无
Gd3+(4f7)
7
无
2019/11/21
未成对 4f电子数
0 1 2 3
4
5 6 7
离子(4fn)
2019/11/21
广西大学化学化工学院
无机化学
稀土元素在地壳中的丰度大,但比较分散,且性质相近, 分离提纯困难。
奇偶变化
镧系元素在地壳中的丰度 随原子序数的增加而出现奇偶 变化的规律:原子序数为偶数 的元素,其丰度总是比紧靠它 的原子序数为奇数的大。
