大连理工大学1993年物理化学及物理化学实验考研真题
大连理工大学884物理化学及物理化学实验专...考研内部资料

考研专业课系列辅导之大连理工大学884物理化学及物理化学实验强化讲义全国考研专业课教研中心编光华职业教育咨询服务有限公司目录第一部分强化阶段的“一个目标两项任务” (3)第二部分强化课程主讲内容 (4)第一章化学热力学基础 (4)第二章相平衡热力学 (8)第三章相平衡状态图 (10)第四章化学平衡热力学 (17)第五章统计热力学初步 (20)第六章化学动力学基础 (21)第七章界面层的热力学及动力学 (28)第八章电解质溶液 (29)第九章电化学系统的热力学及动力学 (31)第十章胶体分散系统及粗分散系统 (36)第十一章物理化学实验 (38)第三部分历年真题解析 (39)3.1大连理工大学884物理化学及物理化学实验2010年真题解析 (39)3.2大连理工大学884物理化学及物理化学实验2009年真题解析 (39)3.3大连理工大学884物理化学及物理化学实验2008年真题解析 (41)3.4兄弟院校试题练习 (41)第四部分结束语 (83)第一部分强化阶段的“一个目标两项任务”专业课强化阶段学习时间是9月初至11月初,通过该阶段的学习,学员要达到“一目标”完成“两任务”。
“一个目标”是指做专业课真题自我模拟成绩达到最少120分。
得到这个分数,说明学员已经全面掌握了目标学校的考研基础知识点。
“两项任务”是指掌握教材知识点,研究真题并总结思路。
具体如下:强化阶段任务一:在认真学习完考研专业课公用知识点的基础上,扩展并掌握目标院校目标专业的考研知识点,完成强化、巩固过程,并逐步建立清晰的知识框架图,形成学员自有的知识体系,具体步骤如下(1)通识教材针对指定教材,毫无遗漏的将教材的章节知识点、例题及习题,仔细完整的进行一遍自学,并对把握不准的知识点做好标记;(2)阅读讲义在听课前,先自学一遍强化班讲义,在自学过程中,将讲义中涉及到的知识点标记在教材中。
如果同学还没有完成前面两步,我建议你暂时不要听课,先完成以上两个步骤,然后再听课,这样效果甚佳。
大连理工大学考研物理真题及详细答案

大连理工大学考研物理真题及详细答案大连理工大学二00四年硕士生入学考试《物理化学》试题一. 是非题1. 如某溶质的稀溶液随溶质浓度的加大其表面张力变小,则在平衡态下该溶质在界面层中的浓度一定大于在溶液本体中的浓度。
2. 一定温度下,化学反应的一定大于该反应的。
3. 二组分真实液态混合物的总蒸气压与组分B的摩尔分数xB成直线关系。
4. 定温定压下,纯物质A的化学势就是该条件下的摩尔吉布斯函数Gm,A5. A和B 形成的固熔体由A(s)和B(s)两相构成。
6. 水在玻璃毛细管中时正常沸点高于100℃。
7. 对于封闭体系,在定压下没有非体积功时,系统从环境吸收的热量全部用来增加热力学能。
8. 物质B有从化学势大的一相转移到化学势小的一相的趋势9. 对于由A和B两组分组成的均相系统,定温定压下再向该系统加入少量A或B时,A的偏摩尔体积V A增加时,B的偏摩尔体积VB就减少。
10. 在其他条件相同时,电解质对溶胶的聚沉值与反离子的化合价数成反比,即反离子的化合价数越高,其聚沉值越小。
11. 在液相进行的A和B间的非催化反应。
其反应速度不受惰性溶剂存在与否的影响。
12. 光化学反应的光量子效率总是在0—1之间二.选择题1. 浓度为0.005mol kg-1的蔗糖水溶液和0.01 mol kg-1的葡萄糖水溶液,二者沸点:A 0.005 mol kg-1 蔗糖水溶液和0.01 mol kg-1的葡萄糖水溶液的沸点大致相同B 0.01 mol kg-1的葡萄糖水溶液的沸点高于0.005 mol kg-1蔗糖水溶液C 无法比较2. 封闭系统内的状态变化:A 如果系统的 Ssys>0,则该变化过程自发B 变化过程只要对环境放热,则该变化过程自发C 仅从系统的 Ssys,变化过程是否自发无法判断3. 真实液态混合物:A 活度因子f的取值在0—1之间B 活度因子f的取值有时大于1C 活度因子f的大小符合: bB趋近于0时,fB的取值趋近于14 在定压下,NaCl晶体,蔗糖晶体,与它们的饱和混合水溶液平衡共存时,独立组分数C和条件自由度:A C=3, =1B C=3, =2C C=4, =2D C=4, =35 若一种液体在某固体表面能铺展,则下列几种描述正确的是:A S<0, >90°B S >0, >90°C S >0, <90°6 下列三种胶体分散系统中,热力不稳定的系统是:A 大分子溶胶B 胶体电解质C 溶胶7 对于NaSO ,其离子平均活度与平均活度因子,质量摩尔浓度间的关系为:A B CD 以上A,B,C 给出的关系都不对三.推导题(10分)A和B两种吸附质在同一均匀固体表面上竞争(同种吸附中心)吸附,每个吸附分子吸附在一个吸附中心上,如果符合兰缪尔(langmuir)假设,试推导证明:达到吸附平衡时,A的表面覆盖度与A,B在气相平衡分压pA和pB 之间的关系为:=( pA)/(1+ pA+ pB) (其中和分别为A,B在该表面的吸附平衡常数)四.作图题(共15分)在固相金属A,B 与它们生成的化合物间完全不互溶,用热分析法测得A和B双组分系统的步冷曲线的转折温度及停歇温度数据如下: 转折温度/℃停歇温度/℃转折温度/℃停歇温度/℃0 - 6300.20 550 4100.37 460 4100.47 - 4100.50 419 410 0.58 - 4390.70 400 2950.93 - 2951.00 - 321(1) 由以上数据绘制A-B系统熔点-组成图(2) 已知A和B的摩尔质量分别为121.8g mol-1和112.4 g mol-1,由相图求A和B形成化合物的最简分子式(3) 对相图中各相区排号,在下表中列出相图中所有液-固两相区的固相成分:相区(号) 固相成分(4) 当为0.25的A-B双组分系统由700℃逐步降低时,液相l(A+B)中B的含量怎样变化(在一定温度区间或温度点的的大小及变化) 五计算题(要求详细计算过程)1.(10分)以知某物质B在液体和固体状态的饱和蒸汽压p(l)及p(s)与温度的关系式分别为:=- +22.405=- +27.650(1) 计算下述过程的G: B(s,1mol,300kPa,200k) B(l,1mol,300kPa,200k)(2) 判断在200k,300kPa下,物质在液态能否稳定存在?2. (6分)已知在定压下某液相反应A B,k1和标准平衡常数与反应温度T有下列关系:=- +6.0 ,则,该正向反应为______________级反应,其标准摩尔焓变和逆向反应的活化能分别为____________________和_________________________________________3. (18分)某溶液中的反应A+B X+Y,反应开始时,A和B的物质的量相等,反应进行1h时A的转换率为75%,求,当反应分别符合下列假设时,进行到2h的时候反应物A剩余多少(以起始量的百分数表示)未反应(液体总体积随反应的变化可忽略)?A) 对A为1级,对B为0级B) 对A和B均为1级C) 对A和B均为0级D) 对A为0级,对B为1级E) 对A为0级,对B为2级F) 对A为2级,对B为0级4.(14分)已知以下数据(I)298.15k的热力学数据物质/(kg mol-1) /(kg mol-1)HgO(s) 73.22O (g) 205.1H O(g) -285.85 70.08Hg(l) 77.4H (g) 130.7(ii)电池的Pt|H (p )|NaOH(aq)|HgO(s)|Hg(l)的E=0.9265V(1)写出阴、阳两极电极反应和电池反应(2)计算该电池反应的(3)计算HgO(s)的分解反应HgO=Hg(l)+(1/2)O2(g)的(298.15K)(4)计算HgO(s)在25℃的分解压5.(12分)某分子B,其运动形式只有三个可及的能级ε1, ε2, ε3,其基态能级是非简并的。
大连理工大学2005年物理化学及物理化学实验考研真题

注:答题必须注明题号答在答题纸上,否则试卷作废! 请认真看题,祝好运! 一、是非题(每小题 2 分,共 24 分) ,正确的标“√” ,错误的标“×” : 1. 一定温度下化学反应的 r G m 一定大于 r Am 。
-23 -1 -34 (已知 k=1.3810 J•K ,h=6.6310 J•s) -1
பைடு நூலகம்
十、实验题(15 分): 乙酸乙酯皂化反应的反应式为:
3
七(12 分) 、在 80℃下,有机物 B 溶于水中(摩尔分数 xB=0.10)的稀溶液与其气相平衡共存。如溶液可 视为理想稀溶液,求气相中水的分压。已知水的气化焓为 40.7kJ•mol . 八(14 分) 、气体 A 的分解反应 A(g)=Y(g)+Z(g) 已知反应速率与反应物、产物的浓度均无关。若向真空容器内迅速充入气体 A,初始压力达到 100kPa。在 700K 下恒容反应 10 秒,测得压力变为 150kPa,求该反应在此反应条件下的速率系数。 九、 (8 分)在 298.15K,1mol O2(g)放在体积为 V 的容器中,压力为 p,试计算: (1)O2 分子的平动配分函数 qt (2) O2 分子的平动热力学能 U t 。
2.
(
G ) T , p ,nC ( C B ) nB
既是物质 B 的化学势又是物质 B 的偏摩尔量。
3. 用 G 0 判断变化方向,适用于任何系统的任何变化。 4. 稀溶液的凝固点一定比纯溶剂的凝固点低。 5. 因为溶胶在一定条件下能存在很长时间,所以它是势力学稳定系统。 6. 在大气压下,水银在玻璃毛细管中的沸点高于其正常沸点。 7. NaCl 水溶液在表面层的浓度高于其溶液本体浓度。 8. 物质 B 总是从高浓度相自发转移到低浓度相。 9. 在化学反应中,所有反应物分子实现化学反应都经过反应的最低能量途径。 10. 超电势的存在,使原电池的输出电压变小。 11. NaOH 水溶液的摩尔电导率与其浓度有关。 12. 气体在固体表面的吸附只能是单层的。 二、选择题(包括 8 小题,每小题 2 分,共 16 分) ,选择一个正确答案的编号: 1. Na2CO3 与 H2O 可以生成如下几种化合物 Na2CO3· H2O, Na2CO3*7H2O, Na2CO3*10H2O,在标准压 力下与 Na2CO3 水溶液、冰平衡共存的水合物最多能有几种: A. 1 种; B. 2 种; C. 3 种
大连理工-物理化学-化学平衡-例题汇编

平衡时 n/mol 1×(1-)
1
1
n B
=
(1+)
mol
K = 2 [ p(总) / p ]
1
= K /[K p(总) /p] 2
12
=0.854
3-1-4.今有 2 H2(g) +2 CO(g) == CO2(g) + CH4(g) 的反应 (1)若在600℃、101 325 Pa 下,以n(H2):n(CO):n(N2)= 1:5:2 开始进行反应,问反应达平衡时,混合气体的组成; (2)与(1)在同样温度,压力条件下,以n(H2):n(CO):n(N2)= 1:5:2 开始进行反应,问反应达平衡时,混合气体中若不计算 N2部分时,H2(g),CO(g),CO2(g),CH4(g)的体积分数与(1)是 否相同?
已知在600 ℃时 CH4(g) + H2O(g) == CO(g) + 3H2(g) , rGm (1) = 4435 J·mol; CO(g) + H2O(g) == CO2(g) + H2(g) , rGm (2) = 6 632 J·mol (p = 100 kPa)
解:(1)据已知条件求反应 rGm ,再求K 。 rGm = rGm (2)- rGm (1) = - 11607 J·mol K = exp(-rGm /RT)= 4.58 2H2(g) + 2CO(g) == CO2(g) + CH4(g)
2
K = 1 2
即
1
( K ) 2 4.94 103
1
= 4.9×103 = 0.49%
故C6H5CH3的最高产率为0.49%。
3-1-3. 在温度恒定于375 K的抽空容器中,放入Cl2(g) 与 SO2(g)。若它们之间不发生反应时,则分压力分别为47 836 Pa 与44 786 Pa。但因发生反应,故反应达平衡时,系统的总压力 为86100 Pa。
大连理工-物理化学-相平衡热力学-选择填空

(B) α (A) 2 β (A 2 )
9 理想液态混合物的混合性质是( ) (A)mixV=0, mixH=0, mixS>0, mixG<0 (B)mixV<0, mixH<0, mixS<0, mixG=0 (C) mixV>0, mixH>0, mixS=0, mixG=0 (D) mixV>0, mixH>0, mixS<0, mixG>0 9 答:A 10 稀溶液的凝固点Tf与纯溶剂Tf*的凝固点比较,Tf <Tf *的条件 是( ) (A)溶质必须是挥发性的 (B)析出的固相一定是固溶体 (C)析出的固相是纯溶剂 (D)析出的固相是纯溶质 10 答:C
d ln{ p} vap H m dT RT 2
)
用于纯物质
的液气两相平衡,因为 vapHm>0 ,所以随着温度的升 高,液体的饱和蒸气压总是升高的。( ) 4 答:
5 二组分理想液态混合物的总蒸气压大于任一纯组分的蒸气压。 ( ) 5答 6 理想混合气体中任意组分B的逸度就等于其分压力pB。( ) 6答 7 因为溶入了溶质,故溶液的凝固点一定低于纯溶剂的凝固点。 ( ) 7答: 8 溶剂中溶入挥发性溶质,肯定会引起溶液的蒸气压升高。() 8答: 9 理想稀溶液中的溶剂遵从亨利定律,溶质遵从拉乌尔定律() 9答:
3. 液体在其T, p满足克-克方程的条件下进行汽化的过 程,以下各量中不变的是:( ) (A)摩尔热力学能 3 答:C 4. (A)21 J·mol-1·K-1 (B)88 J·K-1 (C)109 J·mol-1·K-1 4 答:B 5 在、两相中都含有A和B两种物质,当达到相平衡 时,下列三种情况正确的是: ( )
大连理工大学884物理化学及物理化学实验专...考研内部资料

考研专业课系列辅导之大连理工大学884物理化学及物理化学实验强化讲义全国考研专业课教研中心编光华职业教育咨询服务有限公司目录第一部分强化阶段的“一个目标两项任务” (3)第二部分强化课程主讲内容 (4)第一章化学热力学基础 (4)第二章相平衡热力学 (8)第三章相平衡状态图 (10)第四章化学平衡热力学 (17)第五章统计热力学初步 (20)第六章化学动力学基础 (21)第七章界面层的热力学及动力学 (28)第八章电解质溶液 (29)第九章电化学系统的热力学及动力学 (31)第十章胶体分散系统及粗分散系统 (36)第十一章物理化学实验 (38)第三部分历年真题解析 (39)3.1大连理工大学884物理化学及物理化学实验2010年真题解析 (39)3.2大连理工大学884物理化学及物理化学实验2009年真题解析 (39)3.3大连理工大学884物理化学及物理化学实验2008年真题解析 (41)3.4兄弟院校试题练习 (41)第四部分结束语 (83)第一部分强化阶段的“一个目标两项任务”专业课强化阶段学习时间是9月初至11月初,通过该阶段的学习,学员要达到“一目标”完成“两任务”。
“一个目标”是指做专业课真题自我模拟成绩达到最少120分。
得到这个分数,说明学员已经全面掌握了目标学校的考研基础知识点。
“两项任务”是指掌握教材知识点,研究真题并总结思路。
具体如下:强化阶段任务一:在认真学习完考研专业课公用知识点的基础上,扩展并掌握目标院校目标专业的考研知识点,完成强化、巩固过程,并逐步建立清晰的知识框架图,形成学员自有的知识体系,具体步骤如下(1)通识教材针对指定教材,毫无遗漏的将教材的章节知识点、例题及习题,仔细完整的进行一遍自学,并对把握不准的知识点做好标记;(2)阅读讲义在听课前,先自学一遍强化班讲义,在自学过程中,将讲义中涉及到的知识点标记在教材中。
如果同学还没有完成前面两步,我建议你暂时不要听课,先完成以上两个步骤,然后再听课,这样效果甚佳。
物理化学实验试题

物理化学实验试题一、实验目的本实验旨在通过一系列典型的物理化学实验,帮助学生掌握物理化学实验的基本方法和技能,加深对物理化学基本理论的理解和认识,提高运用物理化学知识解决实际问题的能力。
二、实验原理本实验主要包括电导率测定、化学反应速率和化学平衡等实验。
通过这些实验,可以帮助学生更好地理解溶液中的离子平衡和反应机理,掌握化学反应速率的测定方法,了解化学平衡的移动和影响因素。
三、实验步骤1、电导率测定实验(1)准备实验器材:电导率计、烧杯、玻璃棒、恒温水浴、浓度已知的电解质溶液。
(2)将电导率计放入恒温水浴中,调整温度至25℃。
(3)将已知浓度的电解质溶液倒入烧杯中,用玻璃棒搅拌均匀。
(4)用玻璃棒蘸取少量电解质溶液,滴入电导率计中,记录电导率值。
(5)重复步骤4,共测定5组数据。
(6)根据测定结果计算电解质溶液的浓度。
2、化学反应速率实验(1)准备实验器材:恒温水浴、滴定管、容量瓶、三角瓶、催化剂、浓度已知的反应物溶液。
(2)将恒温水浴调整至25℃。
(3)在容量瓶中加入催化剂和反应物溶液,摇匀。
(4)将容量瓶放入恒温水浴中,记录滴定管的初始读数。
(5)每隔1分钟记录滴定管的读数一次,共记录5分钟。
(6)根据滴定的体积变化计算反应速率。
3、化学平衡实验(1)准备实验器材:恒温水浴、分光光度计、比色皿、标准溶液、可逆反应的起始物和生成物。
(2)将恒温水浴调整至25℃。
(3)在比色皿中加入标准溶液和可逆反应的起始物,摇匀。
(4)每隔一段时间记录分光光度计的读数一次,共记录5小时。
(5)根据吸光度的变化计算平衡常数。
四、实验结果与讨论1、电导率测定实验结果与讨论:根据实验数据计算电解质溶液的浓度,比较不同浓度电解质溶液的电导率大小,讨论离子浓度对电导率的影响。
2、化学反应速率实验结果与讨论:根据滴定的体积变化计算反应速率,比较不同催化剂对反应速率的影响,讨论温度对反应速率的影响。
3、化学平衡实验结果与讨论:根据吸光度的变化计算平衡常数,比较不同起始物浓度对平衡常数的影响,讨论温度对平衡常数的影响。
大连理工-物理化学-相图-习题

则该系统的独立组分数C为:( 11 答: A
12 已知A,B两液体可组成无最高或最低恒沸点的液态完全互 溶的系统,则将某一组成的溶液蒸馏可以获得:( )。 (A)一个纯组分和一个恒沸混合物 (B) 两个恒沸混合物 (C) 两个 纯组分。 12 答: C
13 已知A和B二组分可组成具有 最低恒沸点的液态完全互溶的 系统,其t-x(y)如图所示。若把 xB=0.4的溶液进行精馏,在塔顶 可以获得:( )。 (A) 纯组分A(l) (B)纯组分B(l) (C)最低恒沸混合物。
是非题 下述各题中的说法是否正确 ? 正确的在题后括号内画“ ” , 错 的画“”。 1.相是指系统处于平衡时,系统中物理性质及化学性质都均匀的 部分。( ) 1 答: 2. 依据相律,纯液体在一定温度下,蒸气压应该是定值。( ) 2 答: 3. 依据相律,恒沸温合物的沸点不随外压的改变而改变。( ) 3 答: 4 双组分相图中恒沸混合物的组成随外压力的不同而不同。( ) 4 答:
10 将固体NH4HCO3(s) 放入真空容器中,恒温到400 K, NH4HCO3 按下式分解并达到平衡: NH4HCO3(s) === NH3(g) + H2O(g) + CO2(g) 系统的组分数C和自由度数f为:( ) (A) C=2,f =2; (B) (C) C=2,f =0; 10 答: C
16 在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统 的沸点( ) (A) 必低于373.2K (B) 必高于373.2K
( C)取决于水与有机物的相对数量 (D)取决于有机物的相对分子质量的大小 16答: A 17 已知A与B可构成固熔体,在组分A中,若加入组分B可使固 熔体的熔点提高,则组分B在此固熔体中的含量必( )组分 B在液相中的含量。 (A)大于 17 答: A (B)小于 (C )等于 (D)不能确定
大连理工考研物化试卷

感谢网友化学丫头,云下,sunshibo_hui第一题是选择(一共6道每题2分)(涉及到不同过程的W与Q的分别比较,毛细管的相关、沉聚相关、水加入表面活性剂后是正吸附还是负吸附!水和盐水在一个钟罩里,问一定时间过后,他们的水平面高度,组成都为AB的两不同真实混合物化学势)第二题是填空(一共9个空每空2分)(组分数,自由度数。
还有就是问几级反应,今年考的一级,一个是计算标准平衡常数,还有就是热机效率的问题,问的是热机效率是冬天大还是夏天大,最后一个是问的稀溶液的沸点,高压锅里的水沸点,这些都是说个大概,要全面复习!!!)第三题是判断(一共10个没空1分)(好多。
不一一写出了,但有一道题是自发反应的的特G!)第四题是热力学和相平衡热力学那章结合着出的(10分)第五题是化学热力学基础那章的(20分很基础。
好像是求1mol水定温298.15K定压101325pa 下先变成了1mol的水蒸汽,然后再定温可逆变成了4.4×10∧-3pa。
问你各过程和总过程的W、Q、U、H、S、G)第六题是范特霍夫方程的应用(很简单,好像是10分)第七题是求电动势和超电势(16分,3个问最后一个问是两种物质谁先析出)第八题是求活度和平均活度因子(6分)第九题是电化学章的,写出电极反应和电池反应,然后好像是求标准平衡常数(15分)第十题是相图,上来就是用到杠杆,问哪几相平衡,他们的质量是多少(16分)实验题(18分)是有关萘的摩尔燃烧焓的测定,然后是皂化反应,然有一个实在记不请了,好像是什么活化能!复习时一定要认真。
书上例题要弄会。
热点与重点说死都要做两遍!对了,今年要求写大题今年第一个是选择题然后填空然后判断具体记不得了反正挺容易我不到十五分钟全部做完大题今年没有计算填空题型全要求写过程有两个电化学一个关于超电势10’ 一个写电池方程算标准平衡常数15‘一个算活度和平均活度因子6‘一个算大家族20’一个是求气相组成10‘一个套范特霍夫方程10’?相图是气液平衡杠杆原理(20‘?)好像没有推导题啊今年看来真是容易实验题18’很囧有一个是关于阀门得旋转方向反正我是蒙的实验题好像是皂化反应得统计热力学没有题(连续两年了好像难道以后不再考了?)胶体有个聚沉值的小题界面层有个正负吸附得小题还有几个有意思的小题一个是关于封闭系统里两个杯子一个是满杯的水一个装半杯盐溶液足够长时间后会怎样呢一个是常压下吸附水常压下加糖水高压锅中水在100度下为什么不沸腾然后还有些大家一起回忆回忆吧题型是:选择6个填空5个判断10个计算题有1热点76页例102学习指导32页例83热点177页例74热点335页例75热点371页例106学习指导369页例12还有绘图题没有要求计算过程,就是回答结果图与热点135页上边的一样实验题是18分涉及2个有一个是氧弹测燃烧热另1个是乙酸乙酯皂化反应实验1问氧弹结束后还需要测量什么2有一个仪器实验书146页上边那个问2个是什么表3问减压阀门还有一个阀门是顺时针还是逆时针旋转4燃烧热的测量公式5乙酸乙酯的反应时为什么要恒温水浴6乙酸乙酯的反应为什么要求反应物初始浓度相同7如何测量反应物的浓度8测量反应活化能的公式绘图是问在三相线上或者下的平很有哪些还有平衡计算填空题 1碳酸氢钠的分解反应问反应的组分数相数自由度2氯化铵分解反应已知平衡分压为66.66KPa 求平衡系数3K与反应物的初始浓度无关问反应是几级4内燃机的效率冬天比夏天高还是低5稀糖水在100°为什么不沸腾水在含二氧化硅的什么东西里在100°为什么不沸腾水在高压锅100°为什么不沸腾对了还得热点还有学习辅导都得是第四版。
大连理工物理化学实验
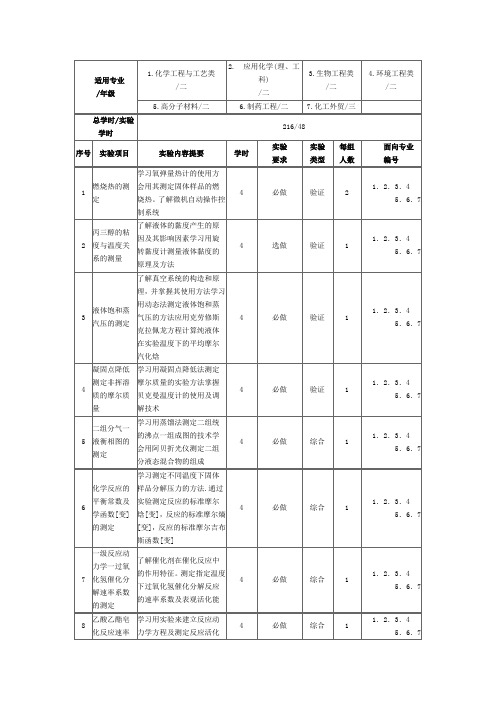
适用专业/年级1.化学工程与工艺类/二2. 应用化学(理、工科)/二3.生物工程类/二4.环境工程类/二5.高分子材料/二6.制药工程/二7.化工外贸/三总学时/实验学时216/48序号实验项目实验内容提要学时实验要求实验类型每组人数面向专业编号1 燃烧热的测定学习氧弹量热计的使用方会用其测定固体样品的燃烧热。
了解微机自动操作控制系统4 必做验证 21.2.3.45.6.72 丙三醇的粘度与温度关系的测量了解液体的黏度产生的原因及其影响因素学习用旋转黏度计测量液体黏度的原理及方法4 选做验证 11.2.3.45.6.73 液体饱和蒸汽压的测定了解真空系统的构造和原理,并掌握其使用方法学习用动态法测定液体饱和蒸气压的方法应用克劳修斯克拉佩龙方程计算纯液体在实验温度下的平均摩尔汽化焓4 必做验证 11.2.3.45.6.74 凝固点降低测定非挥溶质的摩尔质量学习用凝固点降低法测定摩尔质量的实验方法掌握贝克曼温度计的使用及调解技术4 必做验证 11.2.3.45.6.75 二组分气一液衡相图的测定学习用蒸馏法测定二组统的沸点一组成图的技术学会用阿贝折光仪测定二组分液态混合物的组成4 必做综合 11.2.3.45.6.76 化学反应的平衡常数及学函数[变]的测定学习测定不同温度下固体样品分解压力的方法.通过实验测定反应的标准摩尔焓[变],反应的标准摩尔熵[变],反应的标准摩尔吉布斯函数[变]4 必做综合 11.2.3.45.6.77 一级反应动力学一过氧化氢催化分解速率系数的测定了解催化剂在催化反应中的作用特征。
测定指定温度下过氧化氢催化分解反应的速率系数及表观活化能4 必做综合 11.2.3.45.6.78 乙酸乙酯皂化反应速率系数及活化学习用实验来建立反应动力学方程及测定反应活化能的方法。
‘掌握用计算机4 必做综合 11.2.3.45.6.7能的测定采集数据,处理数据的操作方法9 原电池电动势及其温度系数的测定掌握对峙法测定原电池电动势的测定的原理和电位差计的使用方,了解电动势法测定溶液PH值的原理,并测定溶液的PH值。
大连理工大学考研真题物理化学及物理化学实验2003(有答案)

大 连 理 工 大 学二○○三年攻读硕士学位研究生入学考试物理化学及物理化学实验试题一、判断题( )1.绝热过程Q ﹦0,故必是定熵过程。
( )2.某系统从初态Ⅰ经过一个不可逆过程到终态Ⅱ,此过程环境的熵变一定大于该系统由态Ⅰ→态Ⅱ经历可逆过程时环境的熵变。
( )3.H 2(g)和O 2(g)在绝热钢瓶中反应生成水,反应系统的∆H ﹦0, ∆U ﹦0,∆ p ﹦0。
( )4.理想液体混合物与其蒸气达成气、液两相平衡时,气相总压力p 与液相组成x B呈线性关系。
( )5.如果某一化学反应的0r m H ∆>,则该反应的K 随温度升高而增大。
( )6.任何化学反应的半衰期都与反应物的初始浓度有关。
( )7.对同一反应,活化能一定,则反应的起始温度愈低,反应的速率系数对温度的变化愈敏感。
( )8.用能斯特公式算得电池的电动势为正值,表示该电池反应在定温定压下可正向进行。
( )9.可逆过程中,系统的熵不变;不可逆过程中,熵值增大。
( )10.一定量纯气体定温变压时,其转动配分函数不变化。
( )11.胶束溶液是高度分散的均相热力学稳定系统。
( )12.垂直插入水中一支干净的玻璃毛细管,当在管中水上升至平衡液面处加热时,水柱会上升。
( )13.真实液态混合物中组分B 的活度因子值:0<f B <1( )14.一级反应肯定是单分子反应。
( )15.BET 吸附定温式可用于物理吸附。
二、选择题( )1.298.15 K ,已知气相反应2CO (g)﹢O 2(g)→2CO 2(g)的r m G ∆﹦-514.2。
大连理工大学考研物理真题及详细答案

大连理工大学二00四年硕士生入学考试《物理化学》试题一. 是非题1. 如某溶质的稀溶液随溶质浓度的加大其表面张力变小,则在平衡态下该溶质在界面层中的浓度一定大于在溶液本体中的浓度。
2. 一定温度下,化学反应的一定大于该反应的。
3. 二组分真实液态混合物的总蒸气压与组分B的摩尔分数xB成直线关系。
4. 定温定压下,纯物质A的化学势就是该条件下的摩尔吉布斯函数Gm,A5. A和B 形成的固熔体由A(s)和B(s)两相构成。
6. 水在玻璃毛细管中时正常沸点高于100℃。
7. 对于封闭体系,在定压下没有非体积功时,系统从环境吸收的热量全部用来增加热力学能。
8. 物质B有从化学势大的一相转移到化学势小的一相的趋势9. 对于由A和B两组分组成的均相系统,定温定压下再向该系统加入少量A或B时,A的偏摩尔体积V A增加时,B的偏摩尔体积VB就减少。
10. 在其他条件相同时,电解质对溶胶的聚沉值与反离子的化合价数成反比,即反离子的化合价数越高,其聚沉值越小。
11. 在液相进行的A和B间的非催化反应。
其反应速度不受惰性溶剂存在与否的影响。
12. 光化学反应的光量子效率总是在0—1之间二.选择题1. 浓度为0.005mol kg-1的蔗糖水溶液和0.01 mol kg-1的葡萄糖水溶液,二者沸点:A 0.005 mol kg-1 蔗糖水溶液和0.01 mol kg-1的葡萄糖水溶液的沸点大致相同B 0.01 mol kg-1的葡萄糖水溶液的沸点高于0.005 mol kg-1蔗糖水溶液C 无法比较2. 封闭系统内的状态变化:A 如果系统的 Ssys>0,则该变化过程自发B 变化过程只要对环境放热,则该变化过程自发C 仅从系统的 Ssys,变化过程是否自发无法判断3. 真实液态混合物:A 活度因子f的取值在0—1之间B 活度因子f的取值有时大于1C 活度因子f的大小符合: bB趋近于0时,fB的取值趋近于14 在定压下,NaCl晶体,蔗糖晶体,与它们的饱和混合水溶液平衡共存时,独立组分数C和条件自由度:A C=3, =1B C=3, =2C C=4, =2D C=4, =35 若一种液体在某固体表面能铺展,则下列几种描述正确的是:A S<0, >90°B S >0, >90°C S >0, <90°6 下列三种胶体分散系统中,热力不稳定的系统是:A 大分子溶胶B 胶体电解质C 溶胶7 对于NaSO ,其离子平均活度与平均活度因子,质量摩尔浓度间的关系为:A B CD 以上A,B,C 给出的关系都不对三.推导题(10分)A和B两种吸附质在同一均匀固体表面上竞争(同种吸附中心)吸附,每个吸附分子吸附在一个吸附中心上,如果符合兰缪尔(langmuir)假设,试推导证明:达到吸附平衡时,A的表面覆盖度与A,B在气相平衡分压pA和pB之间的关系为:=( pA)/(1+ pA+ pB) (其中和分别为A,B在该表面的吸附平衡常数)四.作图题(共15分)在固相金属A,B 与它们生成的化合物间完全不互溶,用热分析法测得A和B双组分系统的步冷曲线的转折温度及停歇温度数据如下:转折温度/℃停歇温度/℃转折温度/℃停歇温度/℃0 - 6300.20 550 4100.37 460 4100.47 - 4100.50 419 410 0.58 - 4390.70 400 2950.93 - 2951.00 - 321(1) 由以上数据绘制A-B系统熔点-组成图(2) 已知A和B的摩尔质量分别为121.8g mol-1和112.4 g mol-1,由相图求A和B形成化合物的最简分子式(3) 对相图中各相区排号,在下表中列出相图中所有液-固两相区的固相成分:相区(号) 固相成分(4) 当为0.25的A-B双组分系统由700℃逐步降低时,液相l(A+B)中B的含量怎样变化(在一定温度区间或温度点的的大小及变化)五计算题(要求详细计算过程)1.(10分)以知某物质B在液体和固体状态的饱和蒸汽压p(l)及p(s)与温度的关系式分别为:=- +22.405=- +27.650(1) 计算下述过程的 G: B(s,1mol,300kPa,200k) B(l,1mol,300kPa,200k)(2) 判断在200k,300kPa下,物质在液态能否稳定存在?2. (6分)已知在定压下某液相反应A B,k1和标准平衡常数与反应温度T有下列关系:=- +6.0 ,则,该正向反应为______________级反应,其标准摩尔焓变和逆向反应的活化能分别为____________________和_________________________________________3. (18分)某溶液中的反应A+B X+Y,反应开始时,A和B的物质的量相等,反应进行1h时A的转换率为75%,求,当反应分别符合下列假设时,进行到2h的时候反应物A剩余多少(以起始量的百分数表示)未反应(液体总体积随反应的变化可忽略)?A) 对A为1级,对B为0级B) 对A和B均为1级C) 对A和B均为0级D) 对A为0级,对B为1级E) 对A为0级,对B为2级F) 对A为2级,对B为0级4.(14分)已知以下数据(I)298.15k的热力学数据物质/(kg mol-1) /(kg mol-1)HgO(s) 73.22O (g) 205.1H O(g) -285.85 70.08Hg(l) 77.4H (g) 130.7(ii)电池的Pt|H (p )|NaOH(aq)|HgO(s)|Hg(l)的E=0.9265V(1)写出阴、阳两极电极反应和电池反应(2)计算该电池反应的(3)计算HgO(s)的分解反应HgO=Hg(l)+(1/2)O2(g)的(298.15K)(4)计算HgO(s)在25℃的分解压5.(12分)某分子B,其运动形式只有三个可及的能级ε1, ε2, ε3,其基态能级是非简并的。
大工化学各种真题

注:答题必须注明题号答在答题纸上,否则试卷作废!
请认真看题,祝好运!
一、 是非题(每小题2分,共24分),正确的标“√”,错误的标“×”:
1. 一定温度下化学反应的 一定大于 。
2. 既是物质B的化学势又是物质B的偏摩尔量。
3. 用 判断变化方向,适用于任何系统的任何变化。
A. 1种; B. 2种; C. 3种
2. 在一密闭恒温容器内,有大小不同的两个微小汞滴,经过足够长时间后,容器内仍有液体汞存在。则下述叙述正确的是:
A. 有大小不等的两个液滴;B. 有两个大小相等的液滴
C.大液滴消失; D. 小液滴消失
3. 反应CaCO3(s)=CaO(s)+CO2(g)在一定温度下达到平衡,现在不改变温度、CO2分压力及氧化钙的颗粒大小,只增大碳酸钙的分散度,则平衡将:
10. 超电势的存在,使原电池的输出电压变小。
11. NaOH水溶液的摩尔电导率与其浓度有关。
12. 气体在固体表面的吸附只能是单层的。
二、 选择题(包括8小题,每小题2分,共16分),选择一个正确答案的编号:
1. Na2CO3与H2O可以生成如下几种化合物Na2CO3?H2O,? Na2CO3*7H2O, Na2CO3*10H2O,在标准压力下与Na2CO3水溶液、冰平衡共存的水合物最多能有几种:
2 在重力场中,流体的机械能衡算方程的适用条件是
3 流体流动过程中,影响摩擦因子的两个无因次数群是 ,在层流区,摩擦因子与 有关;在完全湍流区,摩擦因子与 有关
六、(17分)图a是A、B两组分的固/液平衡图,回答问题:
图
(1)填表:
大连理工-物理化学-电化学-例题

0.1 2 0.56 0.1 3
2 0.56S m -1 3
mol dm3,其电导率为:
HCl的浓度为 0.1
2 3 (1.70- ×0.56)S m1 = 1.33 S m1 3
Λ
1.33 2 -1 HCl S m mol 0 .1 m 3 3 10 399 10 -4 S m 2 mol -1
11
解:(1)电导池常数K(l / A)=κR=0.14114 Sm1×112.3Ω=15.85m1
K (l / A) 15.82m 1 (2)溶液x的电导率 7.257 10 3 S m 1 R 21.84Ω
3 1 7 . 257 10 S m (3)溶液x的摩尔电导率Λm= 3 3
EMF = E + - E- = E (Cl| Hg2Cl2|Hg)- E (H+|H2|Pt)
= E(Cl| Hg2Cl2|Hg) E(Cl|
E Hg2Cl2|Hg) = MF
= 0.t | H2(p) | H2SO4(b=0.01mol·kg1) | O2(p) | Pt在298K时的EMF=1.229 V,液态水的fHm(298K) = 285.84 kJ·mol1,求该电池的温度系数及273K时的电动 势(设在此温度范围内rH为常数)。
EMF= EMF = E (Cl|Cl2)- E (Cl|AgCl|Ag)
=[1.3583-0.2223] V= 1.136 V
23
12-1-4 298K下,电池: Pt | H2(g , p) | HCl[b(HCl) =0.08 mol·kg1, =0.809)] | Hg2Cl2(s) | Hg(l)
1993 大连理工大学硕士生入学考试物理化学及物理化学实验试题

大连理工大学一九九三年硕士生入学考试物理化学及物理化学实验试题一、是非题(包括5小题,每小题2分,共10分)。
以下各小题你认为正确的用“+”号,错误的用“-”号,填入各小题前的括号内:()1、对于气体,在高于其临界温度的条件下,无论加多大压力都不会使其液化。
()2、(C≠B)既是偏摩尔量,又是化学势。
()3、催化剂的加入,可以改变反应的Δr G m。
()4、弯曲液面产生的附加压力与表面张力成反比。
()5、能量零点选择不同,对分子配分数无影响。
二、填空题(包括7小题,1-5每小题2分,6-7每小题3分,共16分)在以下各小题中画有横线处填入答案:1.热力学第二定律的经典表述之一为_______________________________________,其数学表述式为_____________。
2.胶体分散系统,分散质(或分散相)的颗粒大小介于____nm之间。
3.若炮化学反应的量子效率φ>1,表明_____________________________________。
ngmuir单分子层吸附理论的基本假设为(i)_________________,(ii)_____________,(iii)___________________,(iv)____________。
由此推导出的吸附等温式为θ=________。
5.热电偶的温差电势与热电偶的______无关,而与两个接点的______有关。
6.测定电解质溶液的电导率K与摩尔电导率Λm时,实验中所用的仪器设备有:(i)___________(ii)___________(iii)_____________。
7.贝克曼温度计上的最小刻度是____℃,可以估读到____℃,整个温度计刻度范围是____℃或____℃,它只能用于测______,而不能测_______。
三、计算题(不要求写出运算过程,只需将计算结果填入相应的空白处)(共19分):1、(12分)试计算给定的理想气体反应:A(g)+B(g)=L(g)+M(g)的以下结果:(1) 已知298K时:A(g)+4B(g)=C(g)+2L(g) (i)Δr G iθ=-112.60kJ·mol-12B(g)+E(g)=2L(g) (ii)Δr G iiθ=-456.12kJ·mol-12F(g)+E(g)=2M(g) (iii)Δr G iiiθ=-272.04kJ·mol-1F(g)+2B(g)=C(g) (iv)Δr G ivθ=-51.07kJ·mol-1则给定反应的Δr G ivθ(298K)=_______kJ·mol-1,K pθ(298K)=_____。
大连理工大学1993年硕士生入学考试物理化学及物理化学实验试题

大连理工大学1993年硕士生入学考试物理化学及物理化学实验试题一、是非题(包括5小题,每小题2分,共10分)。
以下各小题你认为正确的用“+”号,错误的用“-”号,填入各小题前的括号内:()1、对于气体,在高于其临界温度的条件下,无论加多大压力都不会使其液化。
()2、(C≠B)既是偏摩尔量,又是化学势。
()3、催化剂的加入,可以改变反应的Δr Gm 。
()4、弯曲液面产生的附加压力与表面张力成反比。
()5、能量零点选择不同,对分子配分数无影响。
二、填空题(包括7小题,1-5每小题2分,6-7每小题3分,共16分)在以下各小题中画有横线处填入答案:1.热力学第二定律的经典表述之一为_______________________________________,其数学表述式为_____________。
2.胶体分散系统,分散质(或分散相)的颗粒大小介于____nm之间。
3.若炮化学反应的量子效率φ>1,表明_____________________________________。
ngmuir单分子层吸附理论的基本假设为(i)_________________,(ii)_____________,(iii)___________________,(iv)____________。
由此推导出的吸附等温式为θ=________。
5.热电偶的温差电势与热电偶的______无关,而与两个接点的______有关。
6.测定电解质溶液的电导率K与摩尔电导率Λm时,实验中所用的仪器设备有:(i)___________(ii)___________(iii)_____________。
7.贝克曼温度计上的最小刻度是____℃,可以估读到____℃,整个温度计刻度范围是____℃或____℃,它只能用于测______,而不能测_______。
三、计算题(不要求写出运算过程,只需将计算结果填入相应的空白处)(共19分):1、(12分)试计算给定的理想气体反应:A(g)+B(g)=L(g)+M(g)的以下结果:(1) 已知298K时:A(g)+4B(g)=C(g)+2L(g) (i)Δr G iθ=-112.60kJ·mol-12B(g)+E(g)=2L(g) (ii)Δr G iiθ=-456.12kJ·mol-12F(g)+E(g)=2M(g) (iii)Δr G iiiθ=-272.04kJ·mol-1F(g)+2B(g)=C(g) (iv)Δr G ivθ=-51.07kJ·mol-1则给定反应的Δr Givθ(298K)=_______kJ·mol-1,Kpθ(298K)=_____。
大连理工大学(已有10试题)

大连理工大学应用数学系数学分析2001——2005(2005有答案)高等代数2000——2005、2007(2005有答案)物理系数学物理方法2000——2005量子力学2000,2002——2005热力学与统计物理2000,2002——2005电动力学2000,2002——2005普通物理2000——2005光学(几何光学与波动光学)2000晶体管原理2000半导体材料2004——2005半导体器件2004——2005半导体物理2001——2002,2004——2005神经科学基础2004——2005生物统计学2004——2005生物物理学2004——2005工程光学2005微电子技术2003——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005模拟电子技术2001——2005工程力学系材料力学1999——2001,2003——2005,2010(2010为回忆版)理论力学1995,1999——2001,2003——2005理论力学(土)2000土力学1999——2005自动控制原理(含现代20%) 1999——2005杆系结构静力学1998,2000弹性力学(不含板壳)1999——2004流体力学1999——2005流体力学(土)2004——2005流体力学基础2002——2005岩石力学1999——2000钢筋混凝土结构1999——2000工程流体力学2001,2004——2005水力学1999——2000,2002,2004——2005机械工程学院机械设计2001——2005(2001——2005有答案)机械原理1999——2000,2003——2005画法几何及机械制图2003——2005控制工程基础2001,2003——2005微机原理及应用(8086)1999——2000微机原理及应用(机)2004——2005微机接口与通讯及程序设计1999——2000模拟电子技术2001——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005过程控制(含计算机控制)2000杆系结构静力学1998,2000微电子技术2003——2005系统工程概论1999——2002晶体管原理2000系统工程概论1999——2005管理基础知识1999——2001,2003——2005(2003——2005有答案)计算机组成原理(软)2005管理学基础2004——2005(2004——2005有答案)管理学2010(回忆版)材料力学1999——2001,2003——2005,2010(2010为回忆版)自动控制原理(含现代20%) 1999——2005材料科学与工程学院材料科学基础2003——2005,2010(2010为回忆版)机械设计2001——2005(2001——2005有答案)模拟电子技术2001——2005微电子技术2003——2005物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)胶凝材料学2001——2005硅酸盐物理化学2001——2002,2005杆系结构静力学1998,2000金属学2000金属热处理原理2000金属材料学2000钢筋混凝土结构1999——2000晶体管原理2000土木水利学院材料力学(土)2000,2003——2005材料力学1999——2001,2003——2005,2010(2010为回忆版)土力学1999——2005结构力学2000——2001,2003——2005水力学1999——2000,2002,2004——2005杆系结构静力学1998,2000理论力学(土)2000弹性力学(不含板壳)1999——2004流体力学1999——2005流体力学(土)2004——2005流体力学基础2002——2005岩石力学1999——2000钢筋混凝土结构1999——2000工程流体力学2001,2004——2005系统工程概论1999——2005工程经济学2004——2005无机化学2003——2005传热学2002,2004——2005工程力学2004——2005工程项目管理2004——2005建筑材料2005工程热力学2001——2002,2004——2005热工基础(含工程热力学和传热学)2003化工学院无机化学2003——2005物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)有机化学及实验2001,2003——2005高分子化学及物理2002——2005化工原理及化工原理实验2001——2005材料力学1999——2001,2003——2005,2010(2010为回忆版)工程流体力学2001,2004——2005硅酸盐物理化学2001——2002,2005热力学基础2005天然药物化学2005药剂学2005生物化学及生物化学实验1999——2005船舶工程学院船舶动力装置2002——2005船舶设计原理2001——2005水声学原理2002——2005船舶静力学2001——2005杆系结构静力学1998,2000电子与信息工程学院模拟电子技术2001——2005信号与系统(含随机信号20%)1999——2005 自动控制原理(含现代20%) 1999——2005工程光学2005通信原理2004——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005离散数学与计算机组成原理2005离散数学与数据库原理2004——2005数据结构与计算机组成原理2004——2005计算机组成原理与计算机体系结构2004——2005 计算机组成原理与数字逻辑2000计算机组成原理(软)2005编译方法1999——2000操作系统1999——2001高等代数2000——2005过程控制(含计算机控制)2000微电子技术2003——2005微机接口与通讯及程序设计1999——2000系统工程概论1999——2005晶体管原理2000能源与动力学院汽车理论2000——2005机械原理1999——2000,2003——2005自动控制原理(含现代20%) 1999——2005化工原理及化工原理实验2001——2005普通物理2000高等代数2000——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005运筹学基础及应用2004——2005计算机信息管理1999——2001,2004——2005 微电子技术2003——2005杆系结构静力学1998,2000系统工程概论1999——2005晶体管原理2000信息管理与信息系统2010(回忆版)管理学院计算机信息管理1999——2001,2004——2005 运筹学基础及应用2004——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005公共经济学基础2004——2005,2010(2010为回忆版)过程控制(含计算机控制)2000微电子技术2003——2005系统工程概论1999——2002政治学原理2004——2005行政管理学2004——2005,2010(2010为回忆版)经济学基础2001——2005(2001——2005有答案)运筹学基础及应用2004——2005公共管理学2005社会保障学2004——2005管理学2010(回忆版)信息管理与信息系统2010(回忆版)人文社会科学学院经济学基础2001——2005(2001——2005有答案)管理基础知识1999——2001,2003——2005(2003——2005有答案)管理学基础2004——2005(2004——2005有答案)管理学2010(回忆版)系统工程概论1999——2002现代科学技术基础知识1999——2000,2004——2005思想政治教育学2004——2005马克思主义哲学原理2004——2005马克思主义哲学2001——2002西方哲学史2005哲学概论2004——2005科学技术史(含命题作文)2004——2005科学史、技术史、命题作文2001——2003政治学原理2004——2005行政管理学2004——2005,2010(2010为回忆版)传播学2004——2005新闻传播实务2004——2005民法学2004——2005法理学与商法总论2004——2005政治学2004——2005中外教育史2004——2005教育学2005中国近现代史2004——2005世界近现代史2004——2005电气工程及应用电子技术系电路理论2002——2005自动控制原理(含现代20%) 1999——2005过程控制(含计算机控制)2000微电子技术2003——2005系统工程概论1999——2005晶体管原理2000外国语学院二外德语2002,2004二外俄语2002——2004二外法语2004——2005二外日语2002——2004专业基础英语2003英汉翻译2003,2005英汉翻译与写作2004英语水平测试2004——2005二外英语2002——2005日语水平测试2004——2005翻译与写作(日)2004——2005专业基础日语2002——2003外国语言学与应用语言学(日语)专业综合能力测试2002——2003体育教学部运动生物力学2005人体测量与评价2004——2005生物学基础2005体质学2004——2005建筑艺术学院建筑设计(8小时)2000,2004——2005建筑设计原理1999——2000,2003建筑设计理论综合2004——2005城市建设史2002——2003中国与外国建筑史2000建筑构造与建筑结构1999——2000城市规划历史与理论2004——2005城市规划原理2003城市设计2002规划设计(8小时)2004-2005素描(8小时)2005泥塑(8小时)2005色彩(4小时)2005软件学院离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005离散数学与计算机组成原理2005离散数学与数据库原理2004——2005数据结构与计算机组成原理2004——2005计算机组成原理与计算机体系结构2004——2005计算机组成原理与数字逻辑2000计算机组成原理(软)2005编译方法1999——2000操作系统1999——2001环境与生命学院物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)化工原理及化工原理实验2001——2005硅酸盐物理化学2001——2002,2005基因工程原理2004——2005微生物学2004——2005细胞生物学2005环境化学2004——2005环境工程原理2004——2005,2010(2010为回忆版)分子遗传学2004——2005环境微生物2002经济系经济学基础2001——2005(2001——2005有答案)公共经济学基础2004——2005,2010(2010为回忆版)高科技研究院数学分析2001——2005(2005有答案)高等代数2000——2005数学物理方法2000——2005量子力学2000,2002——2005热力学与统计物理2000,2002——2005电动力学2000,2002——2005物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)硅酸盐物理化学2001——2002,2005微电子技术2003——2005。
参考资料真题汇总

参考资料真题汇总试题编号:586考试⽇期:2003年1 ⽉19⽇下午⼤连理⼯⼤学⼆○○三年硕⼠⽣⼊学考试《化⼯原理及实验》试题注:试题必须注明题号答在答题纸上,否则试卷作废⼀填空(45分)1 流体流动的两种基本类型为,判断流体流动类型的⽆因次数群(特征数)2 在重⼒场中,流体的机械能衡算⽅程的适⽤条件是3 流体流动过程中,影响摩擦因⼦的两个⽆因次数群是,在层流区,摩擦因⼦与有关;在完全湍流区,摩擦因⼦与有关4 ⼀般来说,随着流量的增⼤,离⼼泵的压头将,轴功率将5 离⼼泵流量调节⽅法有两种,⼀种是,另⼀种是改变离⼼泵的6 流化床中流体流速应该控制在范围内7 傅⽴叶定律表明,导热传热通量与成正⽐,其⽐例系数⼀般称为8 对填料塔⽓膜控制的逆流吸收过程,如其它操作条件不变,将⽓液流量同⽐例减少,则⽓体出塔组成将液体出塔组成将9 温度升⾼时,⽓相分⼦扩散系数将液相分⼦扩散系数将10 多级萃取的优点是缺点是11 间歇精馏塔只有段,当回流⽐恒定条件下操作时,随操作时间的增加,塔顶产品组成塔顶温度12 某精馏塔塔顶上升蒸汽组成为y,温度为T,经全凝器冷凝到泡点温度t,部分回流⼊塔,其组成为x,则y x,T t13 精馏塔设计时,若进料组成为,塔顶塔底产品组成为, 和进料热状态参数q,及回流⽐R 均不变,只增⼤进料量F,则所需要的塔径所需要的理论板数14 将不饱和空⽓在间壁式换热器中进⾏加热,使温度由升⾼到,则其湿球温度露点温度相对湿度φ⼆(20分) 如图所⽰,采⽤离⼼泵将20℃,45 的⽔从⽔池送⾄⾼位槽中,已知吸⼊管路的总长度(包括局部阻⼒的当量长度,下同)为50m,出⼝阀半开时排出管线的总长度为270m,吸⼊管线和排出管线的尺⼨均为Φ108×4。
管内流体流动的摩擦因⼦为0.024,其他数据如图所⽰,试求:1. 泵⼊⼝处真空表的读数是多少2 管路中泵的压头,有效功率及轴功率(泵的效率可取为70%)3 若该泵的特性曲线可以表⽰为H=50.15-0.01 (压头H的单位为m,流量Q的单位为)试求泵全开时(此时泵排除管包括局部阻⼒当量长度为100m)的流量和压头4 定性分析出⼝阀由半开到全开时出⼝压⼒表和⼊⼝真空表的变化情况,并图⽰泵的⼯作点的变化三(30分)拟⽤⼀板框过滤机在恒压下过滤某悬浮液,要求在1.5⼩时内得到2 滤液,已知过滤常数K=5×,过滤介质阻⼒可以忽略不计,试求:1 若⽤尺⼨为900×900×30mm的板框,则需要滤框和滤板各多少2 过滤终了时,⽤0.4 洗涤⽔进⾏洗涤,洗涤⽔的黏度与滤液黏度相同,洗涤压⼒差与过滤终了的压⼒差相同,则洗涤时间为多少3 过滤辅助时间为0.5⼩时,则该过滤机的⽣产能⼒为多少四(19分)有⼀单程列管换热器,传热⾯积为40 (按外表⾯积)共有Φ25×2.5的传热管86根,现⽤该换热器以循环⽔冷却流量为28000kg/h的⽯油产品,⽯油⾛管程,两流体逆流换热,实际测得⽯油产品的进出⼝温度分别为90℃和50℃,冷却⽔的进出⼝温度分别为25℃和40℃,已知⽯油产品的⽐热容为=2.8kJ/h,⽔的有关物性分别为密度ρ=995 ,⽐热=4.17kJ/kg℃黏度µ=0.80× PaS 导热系数λ=0.618W/m℃试求1 冷却⽔的⽤量2 该换热器的总传热系数3 管程和壳程的传热膜系数(⼜称表⾯传热系数),可忽略两侧的污垢热阻与管壁热阻4* 由于污垢积累,⽯油产品的出⼝温度升⾼,为使⽯油产品的温度仍为50℃,需增加冷却⽔的流量使冷却⽔的出⼝温度为35℃,⽯油产品温度达到50℃,估算两侧的污垢热阻之和为多少(各物理性质数据可视为不变,忽略管壁热阻)五(19分) 在塔径为0.6m的常压填料塔中,以洗油为吸收剂逆流吸收煤⽓中的苯蒸汽,已知进塔的混合⽓量为916 (标准状态),其中含苯3%(摩尔百分⽐),要求苯的回收率为98%,进塔洗油中不含苯,其⽤量是最⼩溶剂⽤量的1.5倍,已知操作条件下的平衡关系为=0.15x ⽓相总体积传质系数=162 试求1 洗油⽤量(kmol/h)2 出塔洗油中苯的摩尔分率3 完成分离任务所需要的填料⾼度4 每⼩时回收的苯多少千克5* 若填料层⾼度⽆限⾼时,出塔⽓液相组成各为多少?六(19分)拟⽤连续精馏塔分离苯甲苯混合物,塔顶设全凝器,塔底设再沸器,在常压下操作已知进料流量为1000kmol/h含苯0.4(摩尔分率,下同),要求塔顶馏出液中含苯为0.95,苯回收率不低于90%,泡点回流,回流⽐是最⼩回流⽐的2倍。
大连理工-物理化学-化学平衡-例题

的饱和蒸气压力为16586.9 Pa,求反应 CH3OH(g)==HCHO(g)+H2(g),在298 K时K 。(p =100 kPa) 解: CH3OH(g) G1 CH3OH(g) G2 CH3OH(l) G3 CH3OH(l) p p* p* rGm (2) p 298 K rGm (1) K HCHO(g)+H2(g) p
求K 实为求 rGm (1) ,故 rGm (1) =G1+G2+G3+ rGm (2) G3 0
O
G2=0
G1= pp*Vdp =RTln(p* / p ) 则 rGm (1)= RT ln(p*/p )+ rGm (2) 而 rGm (2)= fGm (HCHO, g , 298 K)- fGm (CH3OH, l, 298 K) =53.4 kJ·mol1 rGm (1)= RTln(p* / p )+ rGm (2)=(53.4-4.45) kJ·mol1 =48.9 kJ·mol1 lnK =- rGm (2 )/ (RT) =-19.74 则 K =2.68×109
3 1 1 1
则
K = 8.2×1010
3-1-7. 水在298 K时的标准摩尔生成吉布斯函数为-237.14 kJ·mol1,又知水在298 K时的蒸气压力为3370 Pa, 则反应 H2(g)+1/2O2(g)==H2O(g) 的K (298 K)为多少?(p =100 kPa) 解: H2(g)+1/2O2 (g) G1 G2 rGm H2O(g, p ) G4 H2O(g, p *) G3=0 H2O(l, p *)
=4.45×103J · mol1 25℃时CH3OH(g)的f Gm =(-166.23+4.45) kJ·mol1
大连理工大学物化考研真题

大连理工大学物化考研真题第一章是非题以下各题的表达是否正确?正确的在题后括号内画“?‖,错误的画―?‖ 1 在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变, CO2的热力学能和焓也不变。
?2 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
〔?〕3 稳定态单质的?fHm?(800K)=0 。
(? )4 dU=nCv,mdT公式对一定量的理想气体的任何pVT过程都适用。
(? )5 系统处于热力学平衡态时,其所有的宏观性质都不随时间而变。
〔? 〕6 假设系统的所有宏观性质均不随时间而变,那么该系统一定处于平衡态。
〔? 〕7 隔离系统的热力学能是守恒的。
〔? 〕 8隔离系统的熵是守恒的。
〔? 〕9 一定量理想气体的熵只是温度的函数。
〔? 〕 10 绝热过程都是定熵过程。
〔? 〕11 一个系统从始态到终态,只有进行可逆过程才有熵变。
〔? 〕12 系统从同一始态出发,经绝热不可逆过程到达的终态,假设经绝热可逆过程,那么一定达不到此终态。
〔? 〕13 热力学第二定律的克劳修斯说法是:热从低温物体传到高温物体是不可能的。
? 14 系统经历一个不可逆循环过程,其熵变> 0。
〔? 〕15 系统由状态1经定温、定压过程变化到状态2,非体积功W’?G和?G 0,那么其相反的过程即绝热不可逆压缩过程中?S 0 (B) ?U0 (C) =0 (D)无法判断 11 1mol理想气体〔1〕经定温自由膨胀使体积增加1倍;〔2〕经定温可逆膨胀使体积增加1倍;〔3〕经绝热自由膨胀使体积增加1倍;〔4〕经绝热可逆膨胀使体积增加1倍。
在以下结论中何者正确?〔D 〕(A)?S1= ?S2= ?S3= ?S4 (B)?S1= ?S2, ?S3= ?S4=0 (C)?S1= ?S4, ?S2= ?S3(D)?S1= ?S2= ?S3, ?S4=012 373.15K和p?下,水的摩尔汽化焓为40.7kJ?mol-1,1mol水的体积为18.8cm3,1mol水蒸气的体积为30 200cm3,1mol水蒸发为水蒸气的? U为〔C 〕。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大连理工大学一九九三年硕士生入学考试物理化学及物理化学实验试题
一、是非题(包括5小题,每小题2分,共10分)。
以下各小题你认为正确的用“+”号,错误的用“-”号,填入各小题前的括号内:
()1、对于气体,在高于其临界温度的条件下,无论加多大压力都不会使其液化。
()2、(C≠B)既是偏摩尔量,又是化学势。
()3、催化剂的加入,可以改变反应的Δr G m 。
()4、弯曲液面产生的附加压力与表面张力成反比。
()5、能量零点选择不同,对分子配分数无影响。
二、填空题(包括7小题,1-5每小题2分,6-7每小题3分,共16分)在以下各小题中画有横线处填入答案:
1.热力学第二定律的经典表述之一为________________________
_______________,其数学表述式为_____________。
2.胶体分散系统,分散质(或分散相)的颗粒大小介于____nm 之间。
3.若炮化学反应的量子效率φ>1,表明_______________________
______________。
ngmuir 单分子层吸附理论的基本假设为(i )_________________,(ii )
_____________,(iii)___________________,(iv )____________。
由此推导出的吸附等温式为θ=________。
5.热电偶的温差电势与热电偶的______无关,而与两个接点的______有关。
6.测定电解质溶液的电导率K 与摩尔电导率Λm 时,实验中所用的仪器设备有:(i )____
_______(ii )___________(iii)_____________。
7.贝克曼温度计上的最小刻度是____℃,可以估读到____℃,整个温度计刻度范围是
____℃或____℃,它只能用于测______,而不能测_______。
三、计算题(不要求写出运算过程,只需将计算结果填入相应的空白处)(共19分):1、(12分)试计算给定的理想气体反应:A(g)+B(g)=L(g)+M(g)的以下结果:(1)已知298K 时:
A(g)+4B(g)=C(g)+2L(g)(i)Δr G i θ
=-112.60kJ·mol
-1
2B(g)+E(g)=2L(g)(ii)
Δr G ii θ=-456.12kJ·mol
-1
2F(g)+E(g)=2M(g)(iii)Δr G iii θ
=-272.04kJ·mol -1
F(g)+2B(g)=C(g)(iv)Δr G iv θ
=-51.07kJ·mol
-1
则给定反应的Δr G iv θ
(298K)=_______kJ·mol -1,K p θ
(298K)=_____。
(2)对定反应,又查得得以下数据:
气体
Δf H B
θ
(298K)/kJ·mol -1
C p,m.,B /J·mol -1
·
K
-1
A -393.544.4
B 029.1L -241.837.9M
-110.5
35.6
则给定反应的Δr H m θ
(298K)=______kJ·mol -1
,
Δr H m θ
(498K)=_____kJ·mol -1
,K p θ
(498K)=______。
(3)试判断,当A(g)、B(g)、L(g)、M(g)混合物中各物质的摩尔分数分别为0.3,0.4,0.2,0.6时,在100kPa 及498K 时,给定反应的方向是向______(填入“左”或“右”)(注,P θ
=100kPa)。
2、(7分)电池:
Pt,H 2(p θ
=100kPa)|HCl(m=0.1mol·kg -1
,=0.796||
KCl(m=0.1mol·kg -1
,
=0.769),Hg 2Cl 2|Hg,Pt
测得25℃时的电动势E=0.398V,假定m=0.1mol·kg -1的KCl 和HCl 两个溶液中的相同,并且
m=0.1mol-kg -1的KCl 溶液中
=。
1.写出该电池的电极反应和电池反应为:
(-)极:___________________________(+)极:___________________________电池反应:___________________________
2.计算25℃时,KCl 浓度为m=0.1mol·kg -1时甘汞电极的电极势φ(甘汞)=____V 。
3.计算该电池中1molH 2发生反应时Δr G m =_____kJ·mol -1。
四、读图题(10分)
下图为A 及B 二组分液态部分互溶系统的相图(t A *,t B *分别为100kPa 下A 及B 的沸点):
1、(8分)设由4molB 和6molA 组成的一系统,从20℃到120℃均处于相平衡状态,试根据上图填写下表:
注:填表时用统一符号――平衡相的聚集态(即气、液、固)分别用g、l、s 表示(对两相区再加角性1、2,例g 1,g 2…);平衡相的相组成分别用y B g
、x B l
、x B s
表示,平衡相的物量分别用n g
、n l
、n s
表示(对两相区再加角注1、2,例y B,1g 、y B,2g …,n 1g 、n 2g …)并填上等于的数值。
系统温度/
℃平衡相数
平衡相的聚集态
平衡相的组成(估
读)
平衡相的物量n
406080120
2、(2分)分别计算图中各相区(i)、(ii)、(iii)、(iv)及t B *所在相区的条件自由度f ’=?,填在以下空白处:f ’(i)=_____,f ’(ii)=_____,f ’(iii)=_____,f ’(iv)=__
___,=____。
五、运算题(按规范化要求写出运算过程,即写出所用公式,代入数值和单位,求出运算结果)(共29分):
1、(18分)平行反应:
总反应对A 及B 均为一级,对P 及Q 均为零级,已知:
(1)若A 和B 的初始浓度分别为C A,O =0.100mol·dm -3,C B,O =0.200mol·dom -3
,计算500K 时经过30min,A 的转化率为多少?此时P 和Q 的浓度各为多少?(2)分别计算活化能E 1及E 2。
(3)试用有关公式分析,改变温度时,能否改变比值C p /C Q ?要提高主产物的收率是采取降温措施还是升温措施?
(4)在同一座标上作主、副反应的lgK A(1及2)~图,并利用该图分析提高反应温度,可否使k A,2>k A,1。
2、(6分)已知液体Na(l)的饱和蒸汽压与温度的关系为:
(1)计算1155K 时Na(l)的饱和蒸汽压P*Na(l,1155K)=?
(2)计算下述过程的ΔH 、ΔS 、ΔG[设Na(g)可视为理想气体]。
Na[1mol·l,1155,P*Na(l,1155K)]─→Na[1mol·g,1155K,P*Na =10132.5Pa](注:该题标准压力按P θ
=101325Pa 计算)
3、(5分)已知25℃时,苯蒸气和液态苯的标准生成热(Δf H B θ
)分别为82。
93kJ·mol -1
和48.66kJ·mol -1
,苯在101325Pa 下的沸点是80.1℃。
若25℃时甲烷溶在苯中,平衡浓度x(CH 4)=0.0043时,则与其平衡的气相中,CH 4的分压力为245kPa。
试计算:(1)25℃,当x(CH 4)=0.01时的甲烷苯溶液的蒸气总压P;(2)与上述溶液成平衡的气相组成y(CH 4)。
注:以下六、七两题统考生只作六题,不作七题;单考生可在六、七两题中任选一题,若两题均作,律作废(六题包括1、2两小题)。
六、推导及证明题(共16分):
1、(9分)反应的机理为:
k3。
其中B为活性中间物,假定k
2?
(1)试按上述机理导出:该反应的速率方程为。
与各基无反应活化能的关系。
(2)根据活化能定义,推导表观活化能E
a
=R
2、(7分)试用统计热力学方法推导单原子理想气体恒容摩尔热容C
V,m
已知,内能U与配分函数q的关系为:
七、分析推理题(16分)
某反应:A+B→C
在一定温度下,实验测得如下动力学数据:
实验反应物初始浓度反应时经左栏所列时间后
编号
间t/min
A 的浓度为CA/mol·dm
-3
C A,O /mol·dm
-3
C B,O /mol·dm
-3
10.100.1016000.0520.20.28000.1030.400.304000.204
0.80
0.50
200
0.40
1.分析和综合表中实验数据你可发现哪些问题或得到什么结论?
2.由(1)的分析结果,初步确定该反应的速率方程形式;
3.对你所初步确定的速率方程是否正确再用表中数据作进一步和论证;
4.该反应的速率方程除在(2)中所确定的形式外,可还还存在其它形式?请再用表中数据作
论证。
