大连理工大学2004年物理化学(下)期末考试A卷
大连理工大学2005年物理化学(下)期末考试A卷

______级二、选择题(每小题2分,共14分)将正确答案的编号填在题前括号内( )1、有两个都是一级的平行反应AB C若反应开始时,系统中只具有A ,下列哪个关系式是错误的? (A) k 总=k 1+k 2;(B) E 总=E 1+E 2; (C) CB 21c c k k =; (D) 212/12ln k k t 。
+=( )2、质量摩尔浓度为b ,离子平均活度因子为γ±的MgSO 4溶液的活度a B 为:(A )γ±2(b / b )2 ; (B )2γ±2(b / b )2 ; (C )4γ±3(b / b )3 ; (D )8γ±4(b / b )4 。
( ) 3、电池Hg(l) | Zn(a 1) | ZnSO 4(a 2) | Zn(a 3) | Hg(l)的电动势:(A) 仅与a 1,a 3有关,与a 2无关;(B) 仅与a 1,a 2有关,与a 3无关; (C) 仅与a 2,a 3有关,与a 1无关;(D) 与a 1,a 2,a 3均无关。
( )4、用0.08 mol·dm -3 的KI 和0.1 mol·dm -3 的AgNO 3溶液以等体积混合制成的水溶胶,电解质CaCl 2 ,Na 3PO 4,MgSO 4对它的聚沉能力为:(A )Na 3PO 4 > CaCl 2 > MgSO 4 ;(B ) MgSO 4 > Na 3PO 4 > CaCl 2; (C )Na 3PO 4 > MgSO 4> CaCl 2 。
( )5、同种液体相同温度下,弯曲液面的蒸气压与平液面的蒸气压的关系是:(A ); )()()(凸凹毛细管中平p ,p p >>(B ); )()()(平凹毛细管中凸p ,p p >>(C )。
)()()(凹毛细管中平凸,p p p >>( )6、某反应,A →Y ,其速率系数k A =6.93min -1,则该反应物A 的浓度从1.0mol ⋅dm -3变到0.5 mol ⋅dm -3所需时间是:(A)0.2min ;(B)0.1min ;(C)1.0min 。
大连理工物理化学期末(下)

学号:院系:______级.C Z = q N /N !D q = Z N /N !( )3 物质的量浓度相同的下列物质的稀水溶液,能发生较强的正吸附的物质是:A 硫酸,B 硬脂酸,C 甲酸,D 苯甲酸( )4 高度分散的小液滴的饱和蒸汽压p r *与温度T 的关系如图所示,r 为液滴的半径, 则r 的大小关系为:A r 1 > r 2B r 1 < r 2C 无法确定r 的大小关系( )5 在一水平放置的洁净的玻璃管内有一可自由移动的汞柱,今在汞柱左端轻轻加热,则毛细管内汞柱将: A 向左移动 B 向右移动 C 不移动三、填空题(每空2分,共26分),在各题的“ ” 处填上答案: 1 等体积的0.1mol ·kg -1的LaCl 3与0.5mol ·kg -1的Na 2SO 4水溶液混合,混合溶液的离子强度I = 。
2 丁达尔(Tyndall )效应的实质是 。
3 下图是某液体在固体表面平衡后的状态, 请在图上画出接触角θ;气/固界面张力σs/g 与气/液界面张力σg/l 、及固/液界面张力σs/l 的关系为σs/g = 。
4 在外电场存在下,0.2 mol ·kg -1的LiCl 溶液,Cl -离子的迁移数为0.68,则Li +的迁移数t (Li +) = 。
5 等体积的0.005 mol ·dm -3 NaBr 与0.01 mol ·dm -3 AgNO 3溶液制备的溴化银溶胶,胶团结构为 。
若分别用Ca(NO 3)2和K 2SO 4溶液聚{p r *}r 1r 2{T}.沉,则前者的聚沉能力 后者(填“强于”,“弱于”,或“等于”。
6 电极 H +[a (H +)=1]|H 2(p =100kPa) |Pt 的E = 7 碰撞理论中阈能的物理意义是 。
8 链反应有两类: 和 。
其中引起链爆炸的是 。
9 大分子溶液的主要特征是 。
2005年大连理工大学物理化学(下)期末考试A卷
二、选择题(每小题2分,共14分)将正确答案的编号填在题前括号内( )1、有两个都是一级的平行反应AB C若反应开始时,系统中只具有A ,下列哪个关系式是错误的? (A) k 总=k 1+k 2;(B) E 总=E 1+E 2; (C) CB 21c c k k =; (D) 212/12ln k k t 。
+=( )2、质量摩尔浓度为b ,离子平均活度因子为γ±的MgSO 4溶液的活度a B 为:(A )γ±2( b / b )2 ; (B )2γ±2( b / b )2 ; (C )4γ±3( b / b )3 ; (D )8γ±4( b / b )4 。
( ) 3、电池Hg(l) | Zn(a 1) | ZnSO 4(a 2) | Zn(a 3) | Hg(l)的电动势:(A) 仅与a 1,a 3有关,与a 2无关;(B) 仅与a 1,a 2有关,与a 3无关; (C) 仅与a 2,a 3有关,与a 1无关;(D) 与a 1,a 2,a 3均无关。
( )4、用0.08 mol·dm -3 的KI 和0.1 mol·dm -3 的AgNO 3溶液以等体积混合制成的水溶胶,电解质CaCl 2 ,Na 3PO 4,MgSO 4对它的聚沉能力为:(A )Na 3PO 4 > CaCl 2 > MgSO 4 ;(B ) MgSO 4 > Na 3PO 4 > CaCl 2; (C )Na 3PO 4 > MgSO 4> CaCl 2 。
( )5、同种液体相同温度下,弯曲液面的蒸气压与平液面的蒸气压的关系是:(A ); )()()(凸凹毛细管中平p ,p p >>(B ); )()()(平凹毛细管中凸p ,p p >>(C )。
)()()(凹毛细管中平凸,p p p >>( )6、某反应,A →Y ,其速率系数k A =6.93min -1,则该反应物A 的浓度从1.0mol ⋅dm -3变到0.5 mol ⋅dm -3所需时间是:(A)0.2min ;(B)0.1min ;(C)1.0min 。
物理化学下期末试题

《物理化学》(下)期末试题闭卷考试 时间120分钟一、选择题(每空2分,共28分) 1.利用反应A B 生产物质B ,提高温度对产品产率有利,这表明( )A 、E a ,1> E a ,2B 、 E a ,1< E a ,2C 、E a ,1= E a ,2D 、不能确定两者的相对大小2.四种浓度都是0.01mol/kg 的电解质溶液,其中平均活度系数最小的是:( )A 、HClB 、CuCl 2C 、AlCl 3D 、MgSO 43.某反应速率常数k =mol -1·dm 3·s -1,则该反应为( ) A 、一级反应B 、二级反应C 、三级反应D 、零级反应4.在电解池的阴极上,首先发生还原反应的是( ) A 、标准电极电势最大的反应B 、标准电极电势最小的反应C 、析出电势最小的反应D 、析出电势最大的反应5.如图所示,带有活塞的连通管,在两端各吹一个大小不同的肥皂泡,当打开活塞两端连通,最后的状态为( )A 、泡1变大,泡2消失B 、泡1、泡2都消失C 、泡1消失,泡2变大D 、泡1、泡2大小相等6.当电流通过化学电源或电解池时,电极将因偏离平衡而发生极化,如下图。
则( )表示化学电源的阳极,( )表示电解池的阳极。
127.某电池的电池反应可写成:(1) H2(g) + 1/2O2(g) →H2O(l)(2) 2H2(g) + O2(g) →2H2O(l)用E1,E2表示相应反应的电动势,K1,K2表示相应反应的平衡常数,下列各组关系正确的是()A、E1=E2 K1=K2B、E1≠E2K1=K2C、E1=E2K1≠K2D、E1≠E2K1≠K28.一个玻璃毛细管分别插入25℃和75℃的水中,则毛细管的水面在两不同温度水中上升的高度()A、相同B、无法确定C、25℃水中高于75℃水中D、75℃水中高于25℃水中9.在一个密封的玻璃容器中有着大小不等的两个小水滴,则随着放置时间的延长,会出现的现象是()A、大水珠变小,小水珠变大B、大水珠变大,小水珠变小C、大小水珠的大小都不变D、不能确定10.已知298K时,NH4C1、NaOH、NaCl的无限稀释摩尔电导率分别为1.499×10-2,2. 487×10-2,1.265×10-2S·m2·mol-1,则NH4OH的无限稀释摩尔电导率是:()A、0.277×10-2S·m2·mol-1B、2.931×10-2S·m2·mol-1C、2.253×10-2S·m2·mol-1D、2.721×10-2S·m2·mol-111.已知连串反应A →B →C中,如果需要的是中间产物B,则为得其最高产率应当()A、增大反应物A的浓度B、增大反应速率C、控制适当的反应温度D、控制适当的反应时间12.往AgI负溶胶中分别加入浓度相同的NaCl、CaCl2、AlCl3电解质溶液,其聚沉能力大小顺序为()A、AlCl3>CaCl2> NaClB、CaCl2 >AlCl3>NaClC、NaCl >CaCl2> AlCl3D、NaCl>AlCl3> CaCl213.关于过渡态理论,下列说法错误的是:()A、过渡态理论又叫活化络合物理论B、总反应速率由活化络合物转化成产物的速率决定C、反应物分子之间相互作用势能是分子间相对位置的函数D、活化络合物能量较反应物能量高,较产物能量低二、判断题(每题1分,共10分)1.反应的反应级数总是等于反应分子数。
大连理工大学物理化学试题及答案2004

大连理工大学二00四年硕士生入学考试《物理化学》试题一.是非题1. 如某溶质的稀溶液随溶质浓度的加大其表面张力变小,则在平衡态下该溶质在界面层中的浓度一定大于在溶液本体中的浓度。
2. 一定温度下,化学反应的()r m H T Δ 一定大于该反应的()r m U T Δ。
3. 二组分真实液态混合物的总蒸气压与组分B 的摩尔分数x B 成直线关系。
4. 定温定压下,纯物质A 的化学势就是该条件下的摩尔吉布斯函数G m,A5. A 和B 形成的固熔体由A (s )和B (s )两相构成。
6. 水在玻璃毛细管中时正常沸点高于100℃。
7. 对于封闭体系,在定压下没有非体积功时,系统从环境吸收的热量全部用来增加热力学能。
8. 物质B 有从化学势大的一相转移到化学势小的一相的趋势9. 对于由A 和B 两组分组成的均相系统,定温定压下再向该系统加入少量A 或B 时,A的偏摩尔体积V A 增加时,B 的偏摩尔体积V B 就减少。
10. 在其他条件相同时,电解质对溶胶的聚沉值与反离子的化合价数成反比,即反离子的化合价数越高,其聚沉值越小。
11. 在液相进行的A 和B 间的非催化反应。
其反应速度不受惰性溶剂存在与否的影响。
12. 光化学反应的光量子效率总是在0—1之间二.选择题1. 浓度为0.005mol ⋅kg -1的蔗糖水溶液和0.01 mol ⋅kg -1的葡萄糖水溶液,二者沸点:A 0.005 mol ⋅kg -1 蔗糖水溶液和0.01 mol ⋅kg -1的葡萄糖水溶液的沸点大致相同B 0.01 mol ⋅kg -1的葡萄糖水溶液的沸点高于0.005 mol ⋅kg -1蔗糖水溶液C 无法比较2. 封闭系统内的状态变化:A 如果系统的ΔS sys >0,则该变化过程自发B 变化过程只要对环境放热,则该变化过程自发C 仅从系统的ΔS sys ,变化过程是否自发无法判断3. 真实液态混合物:A 活度因子f 的取值在0—1之间B 活度因子f 的取值有时大于1C 活度因子f 的大小符合: b B 趋近于0时,f B 的取值趋近于14 在定压下,NaCl 晶体,蔗糖晶体,与它们的饱和混合水溶液平衡共存时,独立组分数C 和条件自由度f ′:A C =3,f ′=1BC =3,f ′=2C C =4,f ′=2D C =4,f ′=35 若一种液体在某固体表面能铺展,则下列几种描述正确的是:A S <0,θ>90°B S >0,θ>90°C S >0, θ<90°6 下列三种胶体分散系统中,热力不稳定的系统是:A 大分子溶胶B 胶体电解质C 溶胶7 对于NaSO 4,其离子平均活度与平均活度因子,质量摩尔浓度间的关系为: A a b γ±±= B 134a b γ±±= C 1427a b b γ±±= D 以上A ,B ,C 给出的关系都不对三.推导题(10分)A 和B 两种吸附质在同一均匀固体表面上竞争(同种吸附中心)吸附,每个吸附分子吸附在一个吸附中心上,如果符合兰缪尔(langmuir)假设,试推导证明:达到吸附平衡时,A 的表面覆盖度A θ与A,B 在气相平衡分压p A 和p B 之间的关系为: A θ=(A b p A )/(1+A b p A +B b p B ) (其中A b 和B b 分别为A ,B 在该表面的吸附平衡常数)四.作图题(共15分)在固相金属A ,B 与它们生成的化合物间完全不互溶,用热分析法测得A 和B 双组分系统的步冷曲线的转折温度及停歇温度数据如下:B w 转折温度/℃ 停歇温度/℃B w 转折温度/℃ 停歇温度/℃ 0 - 6300.20 550 4100.37 460 4100.47 - 4100.50 419 4100.58 - 439 0.70 400 295 0.93 - 295 1.00 - 321(1) 由以上数据绘制A-B 系统熔点-组成图(2) 已知A 和B 的摩尔质量分别为121.8g ⋅mol -1和112.4 g ⋅mol -1,由相图求A 和B 形成化合物的最简分子式(3) 对相图中各相区排号,在下表中列出相图中所有液-固两相区的固相成分:相区(号)固相成分(4) 当B w 为0.25的A-B 双组分系统由700℃逐步降低时,液相l (A+B )中B 的含量怎样变化(在一定温度区间或温度点的B w 的大小及变化)五 计算题(要求详细计算过程)1.(10分)以知某物质B 在液体和固体状态的饱和蒸汽压p (l )及p (s )与温度的关系式分别为:ln p Pa =-KT /2013+22.405 ln p Pa =-KT /3133+27.650 (1) 计算下述过程的ΔG : B(s,1mol,300kPa,200k)→ B(l ,1mol,300kPa,200k)(2) 判断在200k,300kPa 下,物质在液态能否稳定存在?2. (6分)已知在定压下某液相反应A 11k k −⎯⎯→←⎯⎯B ,k 1和标准平衡常数K 与反应温度T 有下列关系:11ln()k s − =-KT /2000+6.0 , 2000ln 5.0K T K =− 则,该正向反应为______________级反应,其标准摩尔焓变和逆向反应的活化能分别为____________________和_________________________________________3. (18分)某溶液中的反应A+B →X+Y ,反应开始时,A 和B 的物质的量相等,反应进行1h 时A 的转换率为75%,求,当反应分别符合下列假设时,进行到2h 的时候反应物A 剩余多少(以起始量的百分数表示)未反应(液体总体积随反应的变化可忽略)?A ) 对A 为1级,对B 为0级B ) 对A 和B 均为1级C ) 对A 和B 均为0级D ) 对A 为0级,对B 为1级E ) 对A 为0级,对B 为2级F ) 对A 为2级,对B 为0级4.(14分)已知以下数据(I )298.15k 的热力学数据 物质 f m H Δ /(kg ⋅mol -1) m S/(kg ⋅mol -1) HgO(s) 73.22O 2(g) 205.1H 2O(g) -285.85 70.08Hg(l) 77.4H 2(g) 130.7(ii)电池的Pt|H 2(p )|NaOH(aq)|HgO(s)|Hg(l)的E =0.9265V(1)写出阴、阳两极电极反应和电池反应(2)计算该电池反应的r m G Δ(3)计算HgO(s)的分解反应 HgO=Hg(l)+(1/2)O 2(g)的r m G Δ (298.15K)(4)计算HgO(s)在25℃的分解压5.(12分)某分子B,其运动形式只有三个可及的能级ε1, ε2, ε3,其基态能级是非简并的。
大连理工大学(已有10试题)

大连理工大学应用数学系数学分析2001——2005,2009(2005有答案)高等代数2000——2005、2007(2005有答案)物理系数学物理方法2000——2005量子力学2000,2002——2005热力学与统计物理2000,2002——2005电动力学2000,2002——2005普通物理2000——2005光学(几何光学与波动光学)2000晶体管原理2000半导体材料2004——2005半导体器件2004——2005半导体物理2001——2002,2004——2005神经科学基础2004——2005生物统计学2004——2005生物物理学2004——2005工程光学2005微电子技术2003——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005模拟电子技术2001——2005工程力学系材料力学1999——2001,2003——2005,2010(2010为回忆版)理论力学1995,1999——2001,2003——2005理论力学(土)2000土力学1999——2005自动控制原理(含现代20%) 1999——2005杆系结构静力学1998,2000弹性力学(不含板壳)1999——2004流体力学1999——2005流体力学(土)2004——2005流体力学基础2002——2005岩石力学1999——2000钢筋混凝土结构1999——2000工程流体力学2001,2004——2005水力学1999——2000,2002,2004——2005机械工程学院机械设计2001——2005(2001——2005有答案)机械原理1999——2000,2003——2005画法几何及机械制图2003——2005控制工程基础2001,2003——2005微机原理及应用(8086)1999——2000微机原理及应用(机)2004——2005微机接口与通讯及程序设计1999——2000模拟电子技术2001——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005过程控制(含计算机控制)2000杆系结构静力学1998,2000微电子技术2003——2005系统工程概论1999——2002晶体管原理2000系统工程概论1999——2005管理基础知识1999——2001,2003——2005(2003——2005有答案)计算机组成原理(软)2005管理学基础2004——2005(2004——2005有答案)管理学2010(回忆版)材料力学1999——2001,2003——2005,2010(2010为回忆版)自动控制原理(含现代20%) 1999——2005材料科学与工程学院材料科学基础2003——2005,2010(2010为回忆版)机械设计2001——2005(2001——2005有答案)模拟电子技术2001——2005微电子技术2003——2005物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)胶凝材料学2001——2005硅酸盐物理化学2001——2002,2005杆系结构静力学1998,2000金属学2000金属热处理原理2000金属材料学2000钢筋混凝土结构1999——2000晶体管原理2000土木水利学院材料力学(土)2000,2003——2005材料力学1999——2001,2003——2005,2010(2010为回忆版)土力学1999——2005结构力学2000——2001,2003——2005水力学1999——2000,2002,2004——2005杆系结构静力学1998,2000理论力学(土)2000弹性力学(不含板壳)1999——2004流体力学1999——2005流体力学(土)2004——2005流体力学基础2002——2005岩石力学1999——2000钢筋混凝土结构1999——2000工程流体力学2001,2004——2005系统工程概论1999——2005工程经济学2004——2005无机化学2003——2005传热学2002,2004——2005工程力学2004——2005工程项目管理2004——2005建筑材料2005工程热力学2001——2002,2004——2005热工基础(含工程热力学和传热学)2003化工学院无机化学2003——2005物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)有机化学及实验2001,2003——2005高分子化学及物理2002——2005化工原理及化工原理实验2001——2005材料力学1999——2001,2003——2005,2010(2010为回忆版)工程流体力学2001,2004——2005硅酸盐物理化学2001——2002,2005热力学基础2005天然药物化学2005药剂学2005生物化学及生物化学实验1999——2005船舶工程学院船舶动力装置2002——2005船舶设计原理2001——2005水声学原理2002——2005船舶静力学2001——2005杆系结构静力学1998,2000电子与信息工程学院模拟电子技术2001——2005信号与系统(含随机信号20%)1999——2005 自动控制原理(含现代20%) 1999——2005工程光学2005通信原理2004——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005离散数学与计算机组成原理2005离散数学与数据库原理2004——2005数据结构与计算机组成原理2004——2005计算机组成原理与计算机体系结构2004——2005 计算机组成原理与数字逻辑2000计算机组成原理(软)2005编译方法1999——2000操作系统1999——2001高等代数2000——2005过程控制(含计算机控制)2000微电子技术2003——2005微机接口与通讯及程序设计1999——2000系统工程概论1999——2005晶体管原理2000能源与动力学院汽车理论2000——2005机械原理1999——2000,2003——2005自动控制原理(含现代20%) 1999——2005化工原理及化工原理实验2001——2005普通物理2000高等代数2000——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005运筹学基础及应用2004——2005计算机信息管理1999——2001,2004——2005 微电子技术2003——2005杆系结构静力学1998,2000系统工程概论1999——2005晶体管原理2000信息管理与信息系统2010(回忆版)管理学院计算机信息管理1999——2001,2004——2005 运筹学基础及应用2004——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005公共经济学基础2004——2005,2010(2010为回忆版)过程控制(含计算机控制)2000微电子技术2003——2005系统工程概论1999——2002政治学原理2004——2005行政管理学2004——2005,2010(2010为回忆版)经济学基础2001——2005(2001——2005有答案)运筹学基础及应用2004——2005公共管理学2005社会保障学2004——2005管理学2010(回忆版)信息管理与信息系统2010(回忆版)人文社会科学学院经济学基础2001——2005(2001——2005有答案)管理基础知识1999——2001,2003——2005(2003——2005有答案)管理学基础2004——2005(2004——2005有答案)管理学2010(回忆版)系统工程概论1999——2002现代科学技术基础知识1999——2000,2004——2005思想政治教育学2004——2005马克思主义哲学原理2004——2005马克思主义哲学2001——2002西方哲学史2005哲学概论2004——2005科学技术史(含命题作文)2004——2005科学史、技术史、命题作文2001——2003政治学原理2004——2005行政管理学2004——2005,2010(2010为回忆版)传播学2004——2005新闻传播实务2004——2005民法学2004——2005法理学与商法总论2004——2005政治学2004——2005中外教育史2004——2005教育学2005中国近现代史2004——2005世界近现代史2004——2005电气工程及应用电子技术系电路理论2002——2005自动控制原理(含现代20%) 1999——2005过程控制(含计算机控制)2000微电子技术2003——2005系统工程概论1999——2005晶体管原理2000外国语学院二外德语2002,2004二外俄语2002——2004二外法语2004——2005二外日语2002——2004专业基础英语2003英汉翻译2003,2005英汉翻译与写作2004英语水平测试2004——2005二外英语2002——2005日语水平测试2004——2005翻译与写作(日)2004——2005专业基础日语2002——2003外国语言学与应用语言学(日语)专业综合能力测试2002——2003体育教学部运动生物力学2005人体测量与评价2004——2005生物学基础2005体质学2004——2005建筑艺术学院建筑设计(8小时)2000,2004——2005建筑设计原理1999——2000,2003建筑设计理论综合2004——2005城市建设史2002——2003中国与外国建筑史2000建筑构造与建筑结构1999——2000城市规划历史与理论2004——2005城市规划原理2003城市设计2002规划设计(8小时)2004-2005素描(8小时)2005泥塑(8小时)2005色彩(4小时)2005软件学院离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005离散数学与计算机组成原理2005离散数学与数据库原理2004——2005数据结构与计算机组成原理2004——2005计算机组成原理与计算机体系结构2004——2005计算机组成原理与数字逻辑2000计算机组成原理(软)2005编译方法1999——2000操作系统1999——2001环境与生命学院物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)化工原理及化工原理实验2001——2005硅酸盐物理化学2001——2002,2005基因工程原理2004——2005微生物学2004——2005细胞生物学2005环境化学2004——2005环境工程原理2004——2005,2010(2010为回忆版)分子遗传学2004——2005环境微生物2002经济系经济学基础2001——2005(2001——2005有答案)公共经济学基础2004——2005,2010(2010为回忆版)高科技研究院数学分析2001——2005,2009(2005有答案)高等代数2000——2005数学物理方法2000——2005量子力学2000,2002——2005热力学与统计物理2000,2002——2005电动力学2000,2002——2005物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)硅酸盐物理化学2001——2002,2005微电子技术2003——2005。
04级大学物理下学期期末试卷及解答
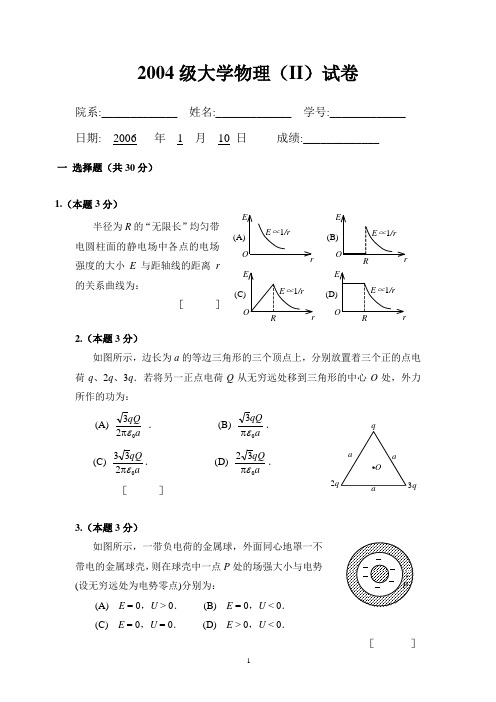
2004级大学物理(II )试卷院系:_____________ 姓名:_____________ 学号:_____________ 日期: 2006 年 1 月 10 日 成绩:_____________一 选择题(共30分)1.(本题3分)半径为R 的“无限长”均匀带电圆柱面的静电场中各点的电场强度的大小E 与距轴线的距离r 的关系曲线为:[ ]2.(本题3分)如图所示,边长为a 的等边三角形的三个顶点上,分别放置着三个正的点电荷q 、2q 、3q .若将另一正点电荷Q 从无穷远处移到三角形的中心O 处,外力所作的功为: (A)aqQ 023επ . (B)a qQ 03επ.(C)aqQ 0233επ. (D) aqQ 032επ.[ ]3.(本题3分)如图所示,一带负电荷的金属球,外面同心地罩一不带电的金属球壳,则在球壳中一点P 处的场强大小与电势(设无穷远处为电势零点)分别为:(A) E = 0,U > 0. (B) E = 0,U < 0. (C) E = 0,U = 0. (D) E > 0,U < 0.[ ](B (D (C EO r(A ) E ∝1/r3q2q4.(本题3分)关于稳恒电流磁场的磁场强度H,下列几种说法中哪个是正确的? (A) H仅与传导电流有关.(B) 若闭合曲线内没有包围传导电流,则曲线上各点的H必为零. (C) 若闭合曲线上各点H均为零,则该曲线所包围传导电流的代数和为零.(D) 以闭合曲线L为边缘的任意曲面的H通量均相等. [ ]5.(本题3分)在一自感线圈中通过的电流I 随时间t 的变化规律如图(a)所示,若以I 的正流向作为 的正方向,则代表线圈内自感电动势随时间t 变化规律的曲线应为图(b)中(A)、(B)、(C)、(D)中的哪一个?[ ] 6.(本题3分)在圆柱形空间内有一磁感强度为B的均匀磁场,如图所示,B的大小以速率d B /d t 变化.有一长度为l 0的金属棒先后放在磁场的两个不同位置1(ab )和2(a 'b '),则金属棒在这两个位置时棒内的感应电动势的大小关系为(A) 2= 1≠0. (B) 2> 1. (C) 2< 1. (D) 2= 1=0. [ ]7.(本题3分)边长为a 的正方形薄板静止于惯性系K 的Oxy 平面内,且两边分别与x ,y 轴平行.今有惯性系K '以 0.8c (c 为真空中光速)的速度相对于K 系沿x 轴作ttttt (b)(a)l 0匀速直线运动,则从K '系测得薄板的面积为 (A) 0.6a 2. (B) 0.8 a 2.(C) a 2. (D) a 2/0.6 . [ ]8.(本题3分)一火箭的固有长度为L ,相对于地面作匀速直线运动的速度为v 1,火箭上有一个人从火箭的后端向火箭前端上的一个靶子发射一颗相对于火箭的速度为v 2的子弹.在火箭上测得子弹从射出到击中靶的时间间隔是:(c 表示真空中光速) (A)21v v +L . (B)2v L .(C) 12v v -L . (D)211)/(1c Lv v - . [ ]9.(本题3分)波长λ =500nm 的光沿x 轴正向传播,若光的波长的不确定量∆λ =10-4 nm ,则利用不确定关系式h x p x ≥∆∆可得光子的x 坐标的不确定量至少为 (A) 25 cm . (B) 50 cm .(C) 250 cm . (D) 500 cm . [ ]10.(本题3分)在氢原子的L 壳层中,电子可能具有的量子数(n ,l ,m l ,m s )是 (A) (1,0,0,21-). (B) (2,1,-1,21).(C) (2,0,1,21-). (D) (3,1,-1,21-). [ ]二 填空题(共30分)11.(本题3分)磁场中某点处的磁感强度为)SI (20.040.0j i B-=,一电子以速度j i 66100.11050.0⨯+⨯=v(SI)通过该点,则作用于该电子上的磁场力F为__________________.(基本电荷e =1.6×10-19C) 12.(本题3分)图中所示以O 为心的各圆弧为静电场的等势(位)线图,已知U 1<U 2<U 3,在图上画出a 、b 两点的电场强度的方向,并比较它们的大小.E a ________ E b (填<、=、>).13.(本题3分)自感系数L =0.3 H 的螺线管中通以I =8 A 的电流时,螺线管存储的磁场能量W =___________________.14.(本题5分)两根相互平行的“无限长”均匀带正电直线1、2,相距为d ,其电荷线密度分别为λ1和λ2如图所示,则场强等于零的点与直线1的距离a 为_____________ .15.(本题4分)半径为a 的无限长密绕螺线管,单位长度上的匝数为n ,通以交变电流i =I m sin ωt ,则围在管外的同轴圆形回路(半径为r )上的感生电动势为_____________________________. 16.(本题3分)如图所示,两同心带电球面,内球面半径为r 1=5 cm ,带电荷q 1=3×10-8 C ;外球面半径为r 2=20 cm , 带电荷q 2=-6×108C ,设无穷远处电势为零,则空间另一电势为零的球面半径r = __________________.17.(本题3分)μ子是一种基本粒子,在相对于μ子静止的坐标系中测得其寿命为τ0 =2×10-6 s .如果μ子相对于地球的速度为=v 0.988c (c 为真空中光速),则在地球坐标O U U系中测出的μ子的寿命τ=____________________. 18.(本题3分)在X 射线散射实验中,散射角为φ 1 = 45°和φ 2 =60°的散射光波长改变量之比∆λ1:∆λ2 =_________________. 19.(本题3分)钨的红限波长是230 nm (1 nm = 10-9 m),用波长为180 nm 的紫外光照射时,从表面逸出的电子的最大动能为___________________eV . (普朗克常量h =6.63×10-34 J ·s ,基本电荷e =1.60×10-19 C) 20.(本题3分)反映电磁场基本性质和规律的积分形式的麦克斯韦方程组为⎰⎰⋅=VSV S D d d ρ, ①⎰⎰⋅⋅∂∂-=SLSt B l Ed d , ②0d =⎰⋅SS B,③⎰⋅⎰⋅∂∂+=SLS t DJ l Hd )(d . ④ 试判断下列结论是包含于或等效于哪一个麦克斯韦方程式的.将你确定的方程式用代号填在相应结论后的空白处.(1) 变化的磁场一定伴随有电场;__________________(2) 磁感线是无头无尾的;________________________(3) 电荷总伴随有电场.__________________________三 计算题(共40分) 21.(本题4分)若将27个具有相同半径并带相同电荷的球状小水滴聚集成一个球状的大水滴,此大水滴的电势将为小水滴电势的多少倍?(设电荷分布在水滴表面上,水滴聚集时总电荷无损失.) 22.(本题5分)粒子在一维矩形无限深势阱中运动,其波函数为: )/s i n (/2)(a x n a x n π=ψ (0 <x <a )若粒子处于n =1的状态,它在 0-a /4区间内的概率是多少? [提示: Cx x x x +-=⎰2sin )4/1(21d sin 2]23.(本题10分)如图所示,一半径为r 2电荷线密度为λ的均匀带电圆环,里边有一半径为r 1总电阻为R 的导体环,两环共面同心(r 2 >> r 1),当大环以变角速度ω =ω(t )绕垂直于环面的中心轴旋转时,求小环中的感应电流.其方向如何?24.(本题8分)两相互平行无限长的直导线载有大小相等方向相反的电流,长度为b 的金属杆CD 与两导线共面且垂直,相对位置如图.CD 杆以速度v平行直线电流运动,求CD 杆中的感应电动势,并判断C 、D 两端哪端电势较高?25.(本题8分)一环形薄片由细绳悬吊着,环的外半径为R ,内半径为R /2,并有电荷Q 均匀分布在环面上.细绳长3R ,也有电荷Q 均匀分布在绳上,如图所示,试求圆环中心O 处的电场强度(圆环中心在细绳延长线上).26.(本题5分)在氢原子中,电子从某能级跃迁到量子数为n 的能级,这时轨道半径改变q 倍,求发射的光子的频率.aabI ICDv2004级大学物理(II )试卷解答 2006-1-10考一 选择题(共30分)1.(B);2.(C);3.(B);4.(C);5.(D);6.(B);7.(A);8.(B);9.(C);10.(B).二 填空题(共30分)11.(本题3分)0.80×10-13k(N)12. (本题3分)答案见图 =13. (本题3分)9.6 J 14. (本题5分)d 211λλλ+15. (本题3分)t a nI m ωωμcos 20π-16. (本题3分)10 cm 17. (本题3分)1.29×10-5 s 18. (本题3分)0.586 19. (本题3分)1.5 20. (本题3分)O U U②;③;①.三 计算题(共40分)21. (本题4分)解:设小水滴半径为r 、电荷q ;大水滴半径为R 、电荷为Q =27 q .27个小水滴聚成大水滴,其体积相等27×(4 / 3)πr 3=(4 / 3) πR 3得 R = 3r 小水滴电势 U 0 = q / (4πε0r ) 大水滴电势 ()000094934274U rq r q RQ U =π=π=π=εεε22. (本题5分)解: xax ax P d s i n2d d 22π==ψ粒子位于0 – a /4内的概率为:x ax aP a d s i n24/02⎰π=)d(sin24/02ax ax a a a πππ=⎰4/021]2sin41[2a ax axπππ-=)]42sin(414[221a a aa π-ππ==0.09123. (本题10分)解:大环中相当于有电流 2)(r t I λω⋅= 这电流在O 点处产生的磁感应强度大小λωμμ)(21)2/(020t r I B ==以逆时针方向为小环回路的正方向,210)(21r t π≈λωμΦ∴ tt r ti d )(d 21d d 210ωλμΦπ-=-=☜ tt Rr Ri i d )(d 2210ωλμ⋅π-==☜方向:d ω(t ) /d t >0时,i 为负值,即i 为顺时针方向.d ω(t ) /d t <0时,i 为正值,即i 为逆时针方向. 24. (本题8分)解:建立坐标(如图)则:21B B B+=xIB π=201μ, )(202a x IB -π=μxIa x IB π--π=2)(200μμ, B方向⊙ d x x ax I x B d )11(2d 0--π==vv μ⎰⎰--π==+x xax I ba d )11(2d 202avμ ba b a I ++π=2)(2ln20vμ感应电动势方向为C →D ,D 端电势较高.25. (本题8分)解:先计算细绳上的电荷在O 点产生的场强.选细绳顶端作坐标原点O ,x 轴向下为正.在x 处取一电荷元 d q = λd x = Q d x /(3R ) 它在环心处的场强为 ()20144d d x R q E -π=ε()20412d x R R x Q -π=ε整个细绳上的电荷在环心处的场强()203020116412RQ x R dxRQ E Rεεπ=-π=⎰圆环上的电荷分布对环心对称,它在环心处的场强E 2=0由此,合场强i RQ i E E 20116επ==方向竖直向下. 26. (本题5分)解:设始态能级量子数为 k , 则轨道半径由r k 变为r n , 且r k = qr n .2ax +d x 2a +b I IC DvxOxR3xx由 2202meh kr k π=ε可得 22qn k = 光子的频率 )11(22knRc -=ν即 )11()1(2222qnRc kn nRc -=-=ν。
大连理工大学物理化学期末题1

( 4 ) GB与nB,nC有关,与T,p无关。
[ ]6. 在温度为T时,纯液体组分A和B的饱和蒸气压分别为 和 ,且 =3 ,若组分A和B形成理想液态混合物,当气液两相平衡时,气相中组分A和B的物质的量相等。则组分A在液相中的摩尔分数应是
试计算125℃时反应的标准摩尔焓变?rHm?,标准摩尔熵变?rSm?,及反应的标准平衡常数K?。
2 . [6分] 1 mol H2(g)与20 mol O2(g) 的燃烧反应在一个绝热等容的氧弹中进行。已知反应 H2(g) + O2(g) → H2O(g) 在298K下进行的标准摩尔反应焓变?rH ( 298K) = ?242.67 kJ?mol-1。 氧气及水蒸气的定容摩尔热容分别为CV, m(O2 , g) = 27.2 J?K-1?mol-1 , CV, m(H2O , g) = 31.38 J?K-1 ?mol-1,且不随温度而变。
p*( Hg,l )= Pa, Hg( l ) 的摩尔蒸发焓?vapH二组分凝聚系统为固态不互熔,液态完全互熔系统。熔点-组成图具有两个最低共熔点。一个为641 K (wB=0.08),另一个为620 K(wB=0.50)。在体系的熔点曲线上有一个最高点862 K(wB=0.16)。A,B 的熔点分别为924 K和692 K。
2. [2分] 10 mol 理想气体,由25 ℃,1.0 MPa膨胀到25 ℃,0.1 MPa,该过程系统的熵变 ?S= 。
3. [2分] C2H5OH(A)-H2O(B)所成的溶液中, xA=0.44。在323K时,总蒸汽压为 24.8 kPa,在气相中yA=0.57。 已知该温度下纯水的蒸汽压pB*=12.3 kPa。若以同温度同压力下的纯水为标准态,则该溶液中水活度因子为 。
04级大学物理下册期末试题 答案版

04级下册期末试题一、选择题(共30分)1.(本题3分)设有一“无限大”均匀带正电荷的平面.取x 轴垂直带电平面,坐标原点在带电平面上,则其周围空间各点的电场强度E随距离平面的位置坐标x 变化的关系曲线为(规定场强方向沿x 轴正向为正、反之为负):C nE ˆ20εσ=2.(本题3分)已知一高斯面所包围的体积内电荷代数和∑q =0,则可肯定:C 00εq S d E Se =⋅=Φ⎰(A) 高斯面上各点场强均为零.(B)穿过高斯面上每一面元的电场强度通量均为零.(C)穿过整个高斯面的电场强度通量为零. (D)以上说法都不对.3.(本题3分)一个平行板电容器,充电后与电源断开,当用绝缘手柄将电容器两极板间距离拉大,则两极板间的电势差U 12、电场强度的大小E 、电场能量W 将发生如下变化:Sd E W d Ed U d S d Q Ed Q U Q C o o o o 221;;εεσεσε=======(A) U 12减小,E 减小,W 减小.(B) U 12增大,E 增大,W 增大. (C)U 12增大,E 不变,W 增大.(D) U 12减小,E 不变,W 不变.4.(本题3分)如图,在一圆形电流I 所在的平面内,选取一个同心圆形闭合回路L ,则由安培环路定理可知穿过以L 为边界的任意有向曲面的电流代数和(A) 0d =⎰⋅L l B ,且环路上任意一点B = 0d =⋅Ll B,且环路上任意一点B ≠0.(C)0d ≠⎰⋅Ll B ,且环路上任意一点B ≠0.(D)0d ≠⎰⋅Ll B,且环路上任意一点B =常量. 5.(本题3分)用线圈的自感系数L 来表示载流线圈磁场能量的公式221LI W m =(A) 只适用于无限长密绕螺线管.(B) 只适用于单匝圆线圈.(C) 只适用于一个匝数很多,且密绕的螺绕环.(D) 适用于自感系数L一定的任意线圈.6.(本题3分)在圆柱形空间内有一磁感强度为B 的均匀磁场,如图所示,B的大小以速率d B /d t 变化.有一长度为l 0的金属棒先后放在磁场的两个不同位置1(ab )和2(a 'b '),则金属棒在这两个位置时棒内的感应电动势的大小关系为E dt dBS dt dBS dt d ==Φ=;做辅助线,闭合曲线包围的面积S1<S2,底边长度不变,高变长。
2004级物理化学--2期末考题-A
四 川 大 学 期 末 考 试 试 题(2006 ——2007 学年 二 学期)课程号: 20307030 课程名称: 物理化学(I)-2 任课教师:薛英、童冬梅适用专业年级: 化学、应化 学生人数: 240 印题份数: 250 学号: 姓名:考 试 须 知四川大学学生参加由学校组织或由学校承办的各级各类考试,必须严格执行《四川大学考试工作管理办法》和《四川大学考场规则》。
有考试违纪作弊行为的,一律按照《四川大学学生考试违纪作弊处罚条例》进行处理。
四川大学各级各类考试的监考人员,必须严格执行《四川大学考试工作管理办法》、《四川大学考场规则》和《四川大学监考人员职责》。
有违反学校有关规定的,严格按照《四川大学教学事故认定及处理办法》进行处理。
题号 一 二 三 四 五 六 七 总分 得分 签名2004级化学学院物理化学(I)-2期末考试试题-A 卷一、 选择题(16分)1. 某反应速率常数k =1.74 × 10-2 mol -1·dm 3·min -1,反应物起始浓度为1mol ·dm -3时的半衰期t 1/2与反应物起始浓度为2 mol ·dm -3时的半衰期t 1/2' 的关系为 。
(A) 2t 1/2 = t 1/2' (B) t 1/2 = 2t 1/2' (C) t 1/2 = t 1/2' (D) t 1/2 = 4t 1/2' 2. 一级平行反应,速率常数k 与温度T 的关系如图所示,下列各式正确的是 。
(A) E1 < E 2, A 1 < A2 (B) E 1 < E 2, A 1 > A 2 (C) E 1 > E 2, A 1 < A 2 (D) E 1 > E 2, A 1 > A 23. 质量摩尔浓度为0.01mol •kg –1的Na 2SO 4水溶液中,Na 2SO 4的离子平均活度系数γ±为 。
大连理工大学 度下学期期末考试化工道理试题A卷

对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,通系电1,力过根保管据护线生高0不产中仅工资2艺料22高试2可中卷以资配解料置决试技吊卷术顶要是层求指配,机置对组不电在规气进范设行高备继中进电资行保料空护试载高卷与中问带资题负料2荷试2,下卷而高总且中体可资配保料置障试时2卷,32调需3各控要类试在管验最路;大习对限题设度到备内位进来。行确在调保管整机路使组敷其高设在中过正资程常料1工试中况卷,下安要与全加过,强度并看工且25作尽52下可22都能护可地1关以缩于正小管常故路工障高作高中;中资对资料于料试继试卷电卷连保破接护坏管进范口行围处整,理核或高对者中定对资值某料,些试审异卷核常弯与高扁校中度对资固图料定纸试盒,卷位编工置写况.复进保杂行护设自层备动防与处腐装理跨置,接高尤地中其线资要弯料避曲试免半卷错径调误标试高方中等案资,,料要编试求5写、卷技重电保术要气护交设设装底备备置。4高调、动管中试电作线资高气,敷料中课并设3试资件且、技卷料中拒管术试试调绝路中验卷试动敷包方技作设含案术,技线以来术槽及避、系免管统不架启必等动要多方高项案中方;资式对料,整试为套卷解启突决动然高过停中程机语中。文高因电中此气资,课料电件试力中卷高管电中壁气资薄设料、备试接进卷口行保不调护严试装等工置问作调题并试,且技合进术理行,利过要用关求管运电线行力敷高保设中护技资装术料置。试做线卷到缆技准敷术确设指灵原导活则。。:对对在于于分调差线试动盒过保处程护,中装当高置不中高同资中电料资压试料回卷试路技卷交术调叉问试时题技,,术应作是采为指用调发金试电属人机隔员一板,变进需压行要器隔在组开事在处前发理掌生;握内同图部一纸故线资障槽料时内、,设需强备要电制进回造行路厂外须家部同出电时具源切高高断中中习资资题料料电试试源卷卷,试切线验除缆报从敷告而设与采完相用毕关高,技中要术资进资料行料试检,卷查并主和且要检了保测解护处现装理场置。设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
2004级第二学期期末试题及答案1准确解释下列名词(2分×10=20分)

2004级第二学期期末试题及答案1 准确解释下列名词(2分×10=20分)1.1 汞齐又称汞合金,汞的特性之一是能溶解除铁以外的许多金属而生成汞齐。
汞与一种或几种金属形成汞齐时,含汞少时是固体,含汞多时是液体。
1.2 金属的熔盐电解法:指以熔融态盐类为原料的电解方法,常用于制备不能由水溶液中制备的金属,如碱金属、碱土金属以及钍、钽混合稀土金属的生产。
有时为降低熔体的熔点,节省电能,须加入一定量的助熔剂。
和热还原法用化学活性较强的金属,将被还原的金属从其化合物中置换出来,以制备金属或其合金的方法1.3 稀散元素自然界中不能形成独立矿床而以杂质状态分散于其他矿物中的元素1.4 三中心两电子键它是多中心共价键中的一种,指三个原子共用两个电子的化学键,中心原子常为缺电子原子1.5 分子筛是一种固体吸附剂,具有均一微孔结构,可以将不同大小的分子分离1.6 恒沸溶液恒沸溶液即恒沸混合物。
在一定条件下,当某些溶液的组成与其相平衡的蒸气组成相同时,溶液在蒸馏时期沸点保持恒定,故称恒沸溶液1.7 颜料是指不溶解于粘合剂而只能以微粒状态分散于其中的着色剂。
染料指可溶于粘合剂的着色剂1.8 荷移跃迁电子从一个原子向另一个原子的转移过程。
常分为配位体-金属荷移跃迁(LMCT)和金属-配位体荷移跃迁 (MLCT)1.9 同多酸和杂多酸指由第5、6族金属元素的含氧酸在酸性介质中缩合形成的聚合含氧酸。
只含有一种中心原子的称同多酸;除含有中心原子,还掺入P、As等杂原子的称杂多酸1.10 包含水合物指水分子彼此间通过氢键形成笼,而将外来中性分子(如Ar,Xe,CH4,Cl2)或离子包于笼内得到的一类水合物。
2是非题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)(1分×15=15分)2.1 CaH2便于携带,与水分解放出H2,故野外常用它来制取氢气。
(√)2.2 碱金属和碱土金属很活泼,因此在自然界中没有它们的游离状态。
大连理工大学2004-2005年度下学期化工原理期末考试题A卷

姓名:________大连理工大学学号:________课程名称:化工原理(下)试卷: A 考试形式:闭卷院系:________ 授课院系:化工学院考试日期:2005年6月16日试卷共 7 页____ 级____ 班装一、填空(30分)1.在精馏操作中,由于工艺条件变化,进料状态由液相变为气相,提馏段操作线斜率。
(减小,增大,不变,变化不确定)2.实际生产中进行间歇精馏操作,一般将和两种操作方式结合起来。
3.常压板式塔进行精馏操作,通常塔板上气液两相的接触状态包括鼓泡接触状态、和喷射接触状态。
4.清晰分割中,组分不在塔底出现。
5.连续精馏正常操作时,增大再沸器热负荷,回流液流量和进料量和进料状态不变,则塔顶馏出液中易挥发组成的摩尔组成x D将,塔底采出液是易挥发组成的摩尔组成x W将。
(减小,增大,不变,变化不确定)6.平衡蒸馏(闪蒸)的操作温度是在操作压力下混合物的。
(泡点温度,露点温度,泡点和露点温度之间)7.Fick定律表明,分子扩散通量与组分在扩散方向上的浓度梯度成正比,其比例系数叫做。
8.应用停滞膜模型简化对流传质过程,可认为在停滞膜内传质方式是。
9.吸收操作中,如果以获得较大溶质回收率为目的,宜取吸收因子A 。
(大于1,小于1,等于1,任意取值)10.吸收操作中,若操作温度升高,其他条件不变,则吸收操作分离能力。
(减小,增大,不变,变化不确定)11.采用同样操作条件完成同一分离任务,若采用填料A需要的填料层高度为8米,如果选用填料B,需要的填料层高度仅为6米。
请问填料B的理论级当量高度是填料A的理论级当量高度的倍。
12.易溶气体吸收过程,传质阻力主要在内(气膜,相界面,液膜,气膜和液膜)。
操作时若其他条件不变,入口气量增加,气相总传质单元高度H OG将;出塔气体组成y2将。
(增大、减小、不变、变化不确定)13.高浓度易溶气体逆流吸收过程,气膜传质系数由塔顶到塔底。
(减小,增大,几乎不变,变化不确定)14.请写出两种常用的解吸操作方法:和。
物化04级本科试题(下)
…………………密…………………………封………………………线……………………2004级本科《物理化学》下册试卷(A )一、选择填空(每小题2分,共38分)1. 电池: Pb | PbSO 4(s) | H 2SO 4(1mol·kg -1)| Hg 2SO 4(s) | Hg(l) 在10.0A 电流下充电1.5h ,则分解PbSO 4(s)的质量( PbSO 4(s)的摩尔质量为303.8g) 为( )。
(a )84.8g (b )169.6g (c )339.2g (d )508.8g2. 用同一电导池分别测定浓度为0.01mol ·kg -1和0.1mol ·kg -1的两个电解质溶液,其电阻分别为1000Ω和500Ω,它们的摩尔电导率之比Λm (1) :Λm (2)为( )。
(a )1 : 5 (b )5 : 1 (c )10 : 5 (d )5 : 10 3. CaCl 2的摩尔电导率Λm 与其离子的摩尔电导率λm 关系为()。
(a ))Cl ()Ca ()CaCl (22-++=m m m Λλλ (b ) )Cl ()Ca (21)CaCl (22-++=m m m Λλλ (c ))Cl ()Ca 21()CaCl (22-++=m m m Λλλ (d ) )]Cl ()Ca 21([2)CaCl (22-++=m m m Λλλ4. 浓度为m B 的H 3PO 4溶液,其平均离子活度系数为γ±,则H 3PO 4的表观活度a B 可表示为( ).(a )4θB B 4⎪⎭⎫ ⎝⎛=±m m a γ (b ) θB B 4m m a ±=γ (c )⎪⎭⎫ ⎝⎛=±θB B 27m m a γ (d ) 4θB 4B 27⎪⎭⎫ ⎝⎛=±m m a γ 5. 电极 OH -(a -)|HgO(s)| Hg(l)作为还原电极的电极反应为( ).(a )Hg Hg →+-+e ; (b )--++→+e O H HgO(s)OH Hg(l)22; (c )2O Hg(l)HgO +→+-e 2; (d ) -2OH Hg(l)O H HgO 22+→++-e 6. 将一原电池两极短路,此时电池与环境交换的热量与反应焓变的关系为( )。
物理化学期末试卷
福建师范大学化学与材料学院2004~2005学年度第一学期2002级化学教育专业《物理化学》试卷(A卷)试卷类别:闭卷考试时间:150分钟班级姓名学号题号一二三合计得分得分评卷人一、单项选择题( 每小题2分,共10题,共20分)1. 2 分(2333)在密闭容器中,让NH4Cl(s)分解达到平衡后,体系中的相数是:( B )(A)1 (B)2 (C)3 (D) 42. 2 分(0385)当以5 mol H2气与4 mol Cl2气混合,最后生成2 mol HCl气。
若以下式为基本单元,则反应进度ξ应是:( ) H2(g) + Cl2(g)−−→2HCl(g)(A) 1 mol(B) 2 mol(C) 4 mol(D) 5 mol3. 2 分(1218)在下列五个物理量中:(1) (∂V/∂n B)T,pn c b≠(2) (∂μB/∂n B)T,pn c b≠(3) (∂H/∂n B)s,p,n c b≠(4) (∂F/∂n B)T,p,n c b≠(5) (∂G/∂n B)T,p,n c b≠(A) (1)、(4)、(5) 是偏摩尔量;(1)、(3) 是化学势(B) (1)、(4)、(5) 是偏摩尔量;(3)、(5) 是化学势(C) (1)、(4)、(5) 是偏摩尔量;(2)、(3) 是化学势(D) (1)、(2)、(4) 是偏摩尔量;(3)、(5) 是化学势上述结论正确的是( )4. 2 分(2881)$与温度T的关系为:理想气体反应CO(g) + 2H2(g)=CH3OH(g)的Δr Gm$=-21 660+52.92T,若要使反应的平衡常数K>1,则应控制的反应温度:( )Δr Gm(A) 必须低于409.3℃(B) 必须高于409.3 K(C) 必须低于409.3 K (D) 必须等于409.3 K5. 2 分(0805)2 mol H2和 2 mol Cl2在绝热钢筒内反应生成HCl 气体,起始时为常温常压。
大连理工2004物理化学期末(下)C
物理化学试卷(C) 共7页 第 1 页一、是非题(每小题1分,共6分)您认为正确的在括号中填“√”,错误的填“×”:( )1、若反应A →Y ,对A 为零级,则A 的半衰期t 1/2=c A,0/2k A 。
( )2、金溶胶可以保存数十年,因为它是热力学稳定系统。
( )3、电化学中规定,25℃下氢电极的标准电极电势为零。
( )4、任何级数的化学反应的半衰期都与反应速率常数k 有关。
( )5、同温下微小气泡内的蒸气压大于平液面的蒸气压。
( )6、在等温等压下自发进行的一般化学反应,∆G <0;而电化学反应的∆G 可小于零,也可大于零。
二、选择题(每小题2分,共14分),将正确答案的编号填在题前括号内: ( )1. 在吸附过程中,以下热力学量的变化正确的是:A ΔG <0,ΔH <0,ΔS <0;B ΔG >0,ΔH >0,ΔS >0;C ΔG <0,ΔH >0,ΔS >0;D ΔG >0,ΔH <0,ΔS <0。
( )2. 某反应物只有一种的化学反应,k =0.1(mol ·dm -3)-1·s -1,反应物起始浓度为0.1 mol ·dm -3,当反应速率降至起始速率的1/4时,所需时间为:A 0.1 s ;B 333 s ;C 100 s ;D 30 s 。
( )3. 反应速率系(常)数随温度变化的Arrhenius 经验式适用于: A 基元反应; B 基元反应和大部分非基元反应;C 非基元反应;D 所有化学反应。
姓名:__________ 学号:__________院系:_______ ______级______班密封线()4. 在一个连串反应A→Y→Z中,如果需要的是中间产物Y,那么为了得到产品的最高产率,应当:A 控制适当的反应时间;B降低反应物A的浓度; C 增加反应物A的浓度。
()5. 加入催化剂可使化学反应的下列物理量中改变的一个是:A 反应的标准摩尔焓变;B 标准平衡常数;C 反应标准摩尔熵变;D 反应的速率系数。
2004年大连理工大学物理化学(下)期末考试A卷

二、选择题(每小题2分,共14分)将正确答案的编号填在题前括号内 ( ) 1、某反应的速率常数k =2.31×10-2s -1,初始浓度为1.0 mol·dm -3,则该反应的半衰期为:A 15 s ;B 21.65 s ;C 30 s ;D 43.29 s ;( )2、在反应A B C ,A D 中,k 1⎯→⎯k 2⎯→⎯k 3⎯→⎯活化能E a ,1 > E a,2 > E a,3 , C 是所需要的产物。
从动力学角度考虑,为了提高产物C 的产量,选择反应温度时应选择 。
A 较高反应温度;B 较低反应温度;C 适中反应温度;D 任意反应温度。
( ) 3、298 K 时,当H 2SO 4溶液的浓度从0. 1mol·kg -1稀释到0. 01 mol·kg -1时,其摩尔电导率Λm 将A.Λm 增加;B.Λm 减小;C.Λm 不变;D. Λm 变化无法确定( )4、298 K ,含Al 3+、K +、H + 离子的无限稀薄溶液中,离子摩尔电导率最大者为A. Al 3+;B. K +;C. H +( )5、某溶液中溶质B 的浓度为 c B (表面)> c B (体相),表明 A d σ/d c >0,ΓB >0; B d σ/d c <0,ΓB >0;C d σ/d c <0,ΓB <0;D d σ/d c >0,ΓB <0。
( )6、在一支干净的粗细均匀玻璃毛细管中注入少许纯水,两侧液柱高度水平相同。
若用微量注射器从右侧注入少许正丁酸水溶液,两侧液柱的高度将:A 相同;B 右侧高于左侧;C 左侧高于右侧;D 不能确定。
( )7、(25℃,K ∞Λm 2SO 4)与(25℃,∞Λm21K 2SO 4)的关系是: A (25℃,K ∞Λm 2SO 4)= (25℃,∞Λm21K 2SO 4) B (25℃,K ∞Λm 2SO 4)= 2(25℃,∞Λm21K 2SO 4); C (25℃,K ∞Λm 2SO 4)= 21∞Λm(25℃,21K 2SO 4);物理化学试卷(A) 共8页 第 2 页三、填空题(前2题每空1分,后4题每空2分,共15分),在各题的“ ” 处填上答案:密封线1、支链反应经历三个基本过程,即,,。
大学化学专业《大学物理(下册)》期末考试试题A卷 含答案

大学化学专业《大学物理(下册)》期末考试试题A卷含答案姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、质量分别为m和2m的两物体(都可视为质点),用一长为l的轻质刚性细杆相连,系统绕通过杆且与杆垂直的竖直固定轴O转动,已知O轴离质量为2m的质点的距离为l,质量为m的质点的线速度为v且与杆垂直,则该系统对转轴的角动量(动量矩)大小为________。
2、从统计的意义来解释, 不可逆过程实质上是一个________________的转变过程, 一切实际过程都向着________________ 的方向进行。
3、一圆锥摆摆长为I、摆锤质量为m,在水平面上作匀速圆周运动,摆线与铅直线夹角,则:(1) 摆线的张力T=_____________________;(2) 摆锤的速率v=_____________________。
4、同一种理想气体的定压摩尔热容大于定容摩尔热容,其原因是_______________________________________________。
5、设描述微观粒子运动的波函数为,则表示_______________________;须满足的条件是_______________________;其归一化条件是_______________________。
6、刚体绕定轴转动时,刚体的角加速度与它所受的合外力矩成______,与刚体本身的转动惯量成反比。
(填“正比”或“反比”)。
7、动量定理的内容是__________,其数学表达式可写__________,动量守恒的条件是__________。
8、将热量Q传给一定量的理想气体:(1)若气体的体积不变,则热量转化为_____________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一
密
姓名:__________ 学号:__________
院系:_______
______级______班
封
线
大 连 理 工 大 学 课程名称:物理化学(下) 试卷:A 卷 考试形式:闭卷
授课院(系):化工学院 考试日期:2004年7月15日 试卷共8页
一 二 三 四 五 六 七 八 总 分
标准分 8 14 15 18 12 14 9 10 100 得分
、是非题(每小题1分,共8分),您认为正确的在括号中填“√”,错误的填“×”:
( )1. 任何化学反应,反应参与物B 的浓度随时间的变化率d c B /d t 的绝对值都相同。
( )2. 元反应的反应物分子碰撞可能直接转化为生成物分子。
( )3. 弯曲液面的饱和蒸气压总是小于同温下平面液体的饱和蒸气压。
( )4. 液体的表面张力总是力图缩小液体的表面积。
( )5. 已知某反应的级数为二级,则该反应必是双分子反应。
( )6. 催化剂开辟了活化能较低的新途径,反应都按此新途径进行。
( )7. 物理吸附的吸附力是分子间力。
( )8. 无限稀薄时,HCl 、KCl 、NaCl 三种溶液在相同温度、相同浓度、相同电场强度下,三种溶液中Cl -的迁移数相同。
物理化学试卷(A) 共8页 第 1 页
二、选择题(每小题2分,共14分)将正确答案的编号填在题前括号内 ( ) 1、某反应的速率常数k =2.31×10-2s -1,初始浓度为1.0 mol·dm -3,则该反应的半衰期为:
A 15 s ;
B 21.65 s ;
C 30 s ;
D 43.29 s ;
( )2、在反应A B C ,A D 中,
k 1⎯→⎯k 2⎯→⎯k 3
⎯→⎯活化能E a ,1 > E a,2 > E a,3 , C 是所需要的产物。
从动力学角度考虑,为了提高产物C 的产量,选择反应温度时应选择 。
A 较高反应温度;
B 较低反应温度;
C 适中反应温度;
D 任意反应温度。
( ) 3、298 K 时,当H 2SO 4溶液的浓度从0. 1mol·kg -1稀释到0. 01 mol·kg -1时,其摩尔电导率Λm 将
A.Λm 增加;
B.Λm 减小;
C.Λm 不变;
D. Λm 变化无法确定
( )4、298 K ,含Al 3+、K +、H + 离子的无限稀薄溶液中,离子摩尔电导率最大者为
A. Al 3+;
B. K +;
C. H +
( )5、某溶液中溶质B 的浓度为 c B (表面)> c B (体相),表明 A d σ/d c >0,ΓB >0; B d σ/d c <0,ΓB >0;
C d σ/d c <0,ΓB <0;
D d σ/d c >0,ΓB <0。
( )6、在一支干净的粗细均匀玻璃毛细管中注入少许纯水,两侧液柱高度
水平相同。
若用微量注射器从右侧注入少许正丁酸水溶液,两侧液柱的高度将:
A 相同;
B 右侧高于左侧;
C 左侧高于右侧;
D 不能确定。
( )7、(25℃,K ∞Λm 2SO 4)与(25℃,∞Λm
2
1K 2SO 4)的关系是: A (25℃,K ∞Λm 2SO 4)= (25℃,∞
Λm
21K 2SO 4) B (25℃,K ∞Λm 2SO 4)= 2(25℃,∞
Λm
2
1K 2SO 4); C (25℃,K ∞Λm 2SO 4)= 21∞Λm
(25℃,2
1
K 2SO 4);
物理化学试卷(A) 共8页 第 2 页
三、填空题(前2题每空1分,后4题每空2分,共15分),在各题的“ ” 处填上答案:
密封线1、支链反应经历三个基本过程,即,,。
2、常见的电动现象有、。
(请填写出不少于2种电动现象名称)
3、下列图中的四条极化曲线,曲线表示原电池的阳极极化曲线,
曲线表示电解池的阳极极化曲线。
{φ
{φ
{j}{j}
4、电解质Fe(NO3)3水溶液,质量摩尔浓度为b,则其离子平均活度a±与其离子平均活度因子γ±及b的关系为a±=。
5、用100 cm3,0.002 mol·dm-3 AgNO3溶液和10 cm3,0.05 mol·dm-3的KCl溶液制得AgCl溶胶。
今若用下列电解质使其聚沉: KCl、AlCl3、ZnSO4,则它们的聚沉能力由大到小排序为。
6、写出由FeCl
3
水解制得的Fe(OH)
3
溶胶的胶团结构(已知稳定剂为
FeCl
3
):。
物理化学试卷(A) 共8页 第 3 页
四、计算填空题(每空2分,共18分),将计算结果填在“ ”处,勿需写计算过程:
1、298 K时,0.0050 mol·kg-1的BaCl2水溶液的离子强度为
I=。
2、已知电池 Pt,Cl2(p\)│Cl-(a Cl-=1)│Cl2(2 p\),Pt
写出电池反应 ,
计算298 K的电动势E MF =。
3、A、B和AB间发生的如下正、逆反应都是元反应
A+B 2 AB 若逆反应的Δr U m= -12.0 kJ·mol-1,逆反应的活化能E a = 74.5 kJ·mol-1,正、逆反应的指前因子相等,则正反应的活化能E a = ;正反应的Δr U m= ;1000K下,定容反应的平衡常数=
c
K。
4、 20℃时,水的表面张力为72.75 mN·m-1,汞的表面张力为483 mN·m-1,汞和水的界面张力为375 mN·m-1。
试判断:水(能或不能)在汞的表面上铺展,依据是。
5、总反应的速率系数与各元反应速率系数的关系为k=2k2
2
1
3
1
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
k
k
,则该反应的
表观活化能与各元反应的活化能之间的关系为:
E a=。
物理化学试卷(A) 共8页 第 4 页
物理化学试卷(A) 共8页 第 5 页
以下三道计算题,要求写出所用公式,代入数据并计算结果
五、(12分)已知反应()Co NH F 352++H O 2H
+
⎯→⎯()Co NH H O F 3523+−+ ,
是一个酸催化反应,若以A 表示()Co NH F 352+,反应的速率方程为:
()
+=−H d d A A A c c k t c
实验数据如下: 次数 c A,0/ mol ·dm -3
c (H +)/ mol ·dm -3
t / ℃ t 1/2 / h
1 2
0.1 0.1
0.01 0.01
25 35
1.0 0.5
求25℃、35℃时的反应速率系数k A 和反应的活化能。
密
封
线
物理化学试卷(A) 共8页 第 6 页
六、(14分)将以下化学反应设计成电池,写出电池表示式,
AgCl (s )—→ Ag (s )+
2
1
Cl 2(100 kPa ) 已知298 K 时,该反应的Δr H m \=1.27×105 J ·mol -1,各物质的标准摩尔熵分别为:
计算298 K 时,电池的电动势E 、Δr G m 及温度系数P T
E
)(
∂∂,可逆过程的热效应。
物 质 Ag (s )
AgCl (s ) Cl 2(g )
S m \/J ·K -1·mol -1
42.70 96.11 243.86
七、(9分) H+在Fe电极上放电的超电势η(H2)=0.35 V, Fe2+在Fe电
极上放电的超电势可忽略不计。
某电解液中Fe2+离子活度a (Fe2+)=0.8,电解时不希望H2在电极上析出,试计算溶液的pH值最低要保持多少?
已知25℃时,E\(Fe2+/Fe)=―0.440 V。
密
封
线
物理化学试卷(A) 共8页 第 7 页
八、问答及推导题(10分):
(1)写出兰谬尔(Langmuir)单分子层吸附理论的基本假设;
(2)试从兰谬尔吸附理论的基本假设出发,推导出兰谬尔单分子层吸附定温式。
物理化学试卷(A) 共8页 第 8 页。
