大学无机化学热力学定律全解共49页文档
大专无机化学知识点总结

大专无机化学知识点总结无机化学是化学学科的一个重要分支,对于大专阶段的学习来说,掌握好无机化学的知识点至关重要。
以下是对大专无机化学中一些重要知识点的总结。
一、化学热力学基础1、热力学第一定律能量守恒定律在热力学中的体现,即能量可以在不同形式之间转化,但总量保持不变。
对于一个封闭系统,热力学能的变化等于吸收的热与所做的功之和。
2、焓变在恒压条件下,反应的热效应等于焓变(ΔH)。
焓变可以通过反应物和生成物的标准生成焓计算得出。
3、熵变用来描述系统混乱度的热力学函数。
熵值越大,系统的混乱度越高。
对于一个自发的过程,总熵变通常是增加的。
4、自由能变自由能变(ΔG)是判断一个反应能否自发进行的重要依据。
当ΔG < 0 时,反应自发进行;当ΔG = 0 时,反应达到平衡;当ΔG > 0 时,反应不能自发进行。
二、化学反应速率1、反应速率的表示通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示反应速率。
2、浓度对反应速率的影响反应速率与反应物浓度的幂次方成正比,这一关系可以用质量作用定律来描述。
3、温度对反应速率的影响温度升高,反应速率加快。
这是因为温度升高,分子的运动速率加快,有效碰撞的几率增加。
4、催化剂对反应速率的影响催化剂能够改变反应的途径,降低反应的活化能,从而加快反应速率。
三、化学平衡1、化学平衡的特征正逆反应速率相等,各物质的浓度不再发生变化。
2、平衡常数对于一个特定的化学反应,在一定温度下,其平衡常数是一个定值。
平衡常数的大小可以反映反应进行的程度。
3、影响化学平衡的因素浓度、温度、压力等因素的改变会导致化学平衡的移动。
遵循勒夏特列原理,即如果改变影响平衡的一个条件,平衡就会向着能够减弱这种改变的方向移动。
四、酸碱平衡1、酸碱质子理论能给出质子的物质是酸,能接受质子的物质是碱。
酸和碱之间存在着相互依存的关系,称为共轭酸碱对。
2、酸碱的强度用酸或碱的解离常数来衡量其强度。
解离常数越大,酸或碱的强度越强。
无机化学_第1章化学热力学基础

2020年8月23日 3时38分
引言
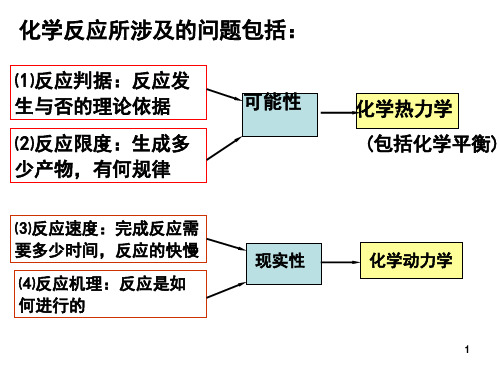
(1) 反应是否能自发进行(反应的方向)?通过理论计 算来解决问题而不是靠实验。
(2) 如果反应能自发进行,它可以进行到何种程度(反 应的限度)?整个反应过程中的能量变化是多少?
(3)反应的速率大小(反应是否有实际意义)? (4)了解物质的结构和性能之间的关系。
2020年8月23日 3时38分
如:在一封闭系统中
始态
过程中
U1
与环境交换热和功
q +W
终态 U2
根据能量守恒定律: U2 = U1 +(q + W) 或:△U = U2 - U1 = q + W
上式说明:系统从始态到终态的变化过程,其 热力学能的改变(△U )等于系统吸收的热量和 得到的功。
2020年8月23日 3时38分
规定: 1、系统吸热 q >0 ,系统放热 q <0。 2、系统对环境做功 W < 0 , 环境对系统做功 W > 0。 3、热和功不是状态函数,因此其数值大
小与变化途径有关 4、热和功的单位:J 或 kJ
2020年8月23日 3时38分
1-1-5 热力学能
1、热力学能──系统中一切形式能量的总和, 用U表示。
我们把状态发生变化的经过称为过程。完成 这个过程的具体步骤称为途径。又分为:
恒温过程:过程中体系的温度保持不变。 恒压过程:过程中体系的压力保持不变。 恒容过程:过程中体系的容积保持不变。 绝热过程:过程中体系与环境热交换为零。
2020年8月23日 3时38分
1-1-4 热和功
热量──系统和环境之间存在温差时所发生的能 量交换。 如:反应热、溶解热等
绪论 第一章 化学热力学基础 第二章 化学反应速率和化学平衡 第三章 滴定分析法概述、误差与数据处理 第四章 酸碱平衡 第五章 酸碱滴定法 第六章 氧化还原反应及电化学 第七章 氧化还原滴定法
第3章 化学热力学(无机化学)

(3) 整个反应过程中的能量变化是多少?放热还是吸热?
(4) 反应的速率大小(反应是否有实际意义)? 本章要解决前三个问题,其余的留待下一章解决。
二、热力学常用术语
1、体系和环境
被研究的物质称为体系。也就是说为了研究的需要把周围 的物质和空间隔离开来的被研究的对象。 而体系以外的与体系有密切关系的周围部分称为环境。
3
过程和途径
在一定的环境下,体系状态发生变化的经过称为过程,
而把完成这个过程的具体步骤称为途径。
n(H2)=1 mol T = 100 K p = 100 kPa 等温过程 n(H2)=1mol T = 100 K p = 300 kPa
1
2
定压过程 n(H2)=1 mol T = 200 K p = 100 kPa
变。
3
反应进度概念
表示化学反应进行程度的物理量
符号 ξ,单位为 mol 对于任意一个反应 νA A+νB B = νG G+νH H Δξ = ΔnB/νB
对于指定的化学计量方程,当ΔnB等于νB时,反应进
度为 1,表示各物质按计量方程进行的完全反应
4
Qp 和QV 的关系
生成物 I T1 p2 V1 n2 (II)恒容过程
第三节 热效应,焓 一、热效应:在等温条件下(反应发生后,使产物的温度恢复到反应 物的起始温度),化学反应放出或吸收的热量称为化学反应的“~”。 根据: △U = q+w ,如果体系只做体积功则有: △U = q-p ×△V 恒容热效应(qV) :因为△V = 0 恒压热效应(qp) -焓(H): 恒压:体系的压力不变,且等于外压, △U = qp-p ×△V (U2-U1)= qp-p ×(V2-V1) 整理一下得: 我们定义: qp =(U2+PV2) - (U1+PV1) U+PV=H 所以qV = △U
化学热力学初步(无机化学)
功和热的特点: ① 二者都是能量传递的形式;单位都用J或KJ ② 不是状态函数,二者都与体系进行的过程密切相关。
环境 热
Q﹥
注意:功和热的正、负号表示能
量传递的方向,是由体系的观点 体
Q﹤
系
出发的;
w﹥
w﹤
功 18
3.3 热力学第一定律及反应热
一、研究基础
1. 热功当量 即: 1 cal = 4.1840 J
有时把封闭体系和体系影响 所及的环境一起作为孤立体 系来考虑。
8
二、热力学状态及其状态函数
用宏观可测性质(物理量,热力学变量)来描述体系的热 力学状态。当体系的一切性质都具有一定数值且不随时间 而变时,体系就处于某一状态。(变量即状态函数)
1. 状态函数可分为两类:
容量性质(又称广度性质):即热力学体系中那些与体系中 物质的数量成正比的性质。 特点:具有加合性。 如V、m、n(摩尔数)、内能U、焓H、自由能G等
rH = H2 - H1 = H产 – H反
H只取决于系统的始态和终态,与实现变化的途径无关。 H有具体物理意义。其值是可以测定和计算的。
意义:
△H =Qp
1. 当反应在恒温恒压下进行,且 ∆H > 0 体系吸热
不做非体积功时,体系的焓变在 ∆H < 0 体系放热
数值上等于恒压反应热。
2. 把一个与过程有关的量Qp和一个与过程无关的量H
∆U > 0 吸热, ∆U < 0 放热 26
恒压反应热Qp的测定
原理 如图所示的保温杯式量热计可用于
测定中和热、溶解热等溶液反应的热 效应。(大气压下测定)
Q放 = Q吸 Qp = Q溶液+ Q杯
设:c 为溶液的比热;V 为反应后溶液的 总体积;为溶液的密度;C 叫做量热 计常数,又设溶液温度升为 t °C,
无机化学 课件 PPT 第三章 化学热力学基础

第一节 热力学基本概念
7. 可逆过程
可逆过程是热力学中一个重要的概念,指在系统状态变化的全 过程中,不仅系统内部任何瞬间都无限接近平衡态,而且系统与环 境间也无限接近平衡。例如,系统与环境间在无限小的温度差下发 生的热交换过程,即T(环)=T±dT(dT为具有正值的无限小量);又如 在无限小的压力差下发生的体积变化过程,即p(环)=p±dp(dp为具 有正值的无限小量)。上述在一系列无限接近平衡条件下进行的过程, 在热力学中称为可逆过程。可逆过程是一种理想化的过程。这种过 程实际上是不可能的,因为每个过程的发生都要引起状态的改变, 而状态的改变一定会破坏平衡。
第一节 热力学基本概念
三、 状态与状态函数
在热力学中,系统所处的状态是由系统的物理性质和化学 性质确定的。状态是系统所有性质的总体表现。换言之,系统 所有的性质确定后,状态就完全确定。反之,系统状态确定后, 它的所有性质均有确定值,与系统到达该状态前的经历无关。 鉴于状态与性质之间的这种单值对应关系,所以系统的热力学 性质又称作状态函数。
第一节 热力学基本概念
2. 定压过程
状态变化的过程中,p(系)=p(环)=常 数的过程称为定压过程。若系统的始态压 力p1及终态压力p2与环境压力相等,即 p1=p2=p(环)=常数时,称为等压过程。
第一节 热力学基本概念
3. 定外压过程
当系统状态改变时,环境 压力恒定,即p(环)=常数,而 系统的始态压力p1不等于环境 压力p(环),但终态压力p2等于 p(环)的过程,称为定外压过程。 定压过程与定外压过程是两个 不同的概念。
第2章无机化学热力学

计算CaF3的△Hfθ,说明其热力学稳定性。(注:利用卡普 斯钦斯基经验公式计算晶格能理论值) 已知:D(F2)=158 kJ·mol-1, ΔatHθm (K , s) =178 kJ·mol-1, Ea(F,g)=-328 kJ·mol-1, I1(Ca,s)=590 kJ·mol-1, I2(Ca,s)=1145 kJ·mol-1, I3(Ca,s)=4912 kJ·mol-1, r(F)=133pm, 假设:r(Ca3+)≈r(Sc3+)=81pm
△fHm / kJmol-1 35
-396 0
△fGm ≈△rHm =(-396)- 2×35 =-466 kJmol-1
即使能生成CrCl,也会按上式发生歧化反应。 ∴CrCl是不稳定的。
第16页,本讲稿共47页
2、 指导无机化合物的合成
应用晶格能和玻恩-哈伯热化学循环,可以预计合 成未知无机化合物的可能性。
数据表明:
晶格能并不严格地随半径而变化
第20页,本讲稿共47页
26
69 89 112
结论:在离子晶格中有明显的共价键能的贡献, 共价成分越 多,玻恩-哈伯热化学循环计算所得的晶格能的实验值与理 论计算值之差大得也就越多。 ∴将二者进行比较,就可以作出化合物键合性质的判断。
典型的离子晶体,二者之间的差不超过50 kJmol-1
△atHm
1/2 D
Cr(s) + 1/2 Cl2(g)
L =(△atHm +I)Cr+(1/2 D+Ea)Cl-△fHm Cr+的半径估计约为100 pm, rCl-=181 pm, 根据晶格能的 理论计算公式
L= 1.079×105×2×1/281=768 kJmol-1 代入相应的热力学数据: △fHm (CrCl)= (△atHm +I)Cr+(1/2 D+Ea)Cl-L
无机化学第二章

(1) N 2 (g) + 3H 2 (g)
2NH 3 (g)
∆n(N 2 ) ∆n(H 2 ) ∆n(NH 3 ) ∆ξ1 = = = v1 (N 2 ) v1 (H 2 ) v1 (NH 3 ) −2 mol −6 mol 4 mol = = = = 2 mol −1 −3 2 1 3 NH 3 (g) (2) N 2 (g) + H 2 (g) 2 2 ∆n(N 2 ) ∆n(H 2 ) ∆n(NH 3 ) ∆ξ 2 = = = v2 (N 2 ) v2 (H 2 ) v2 (NH 3 ) −2 mol −6 mol 4 mol = = = =4 mol −1/2 −3/2 1
第二章 化学热力学基础
第一节 第二节 第三节 第四节 第五节 热力学第一定律 热化学 热化学第二定律 化学反应的摩尔吉布斯自由能变 热力学在生物化学中的应用
热力学是研究热与其他形式的能量之间转化 规律的一门科学。热力学的基础是热力学第一定 律和热力学第二定律。 利用热力学定律、原理和方法研究化学反应 以及伴随这些化学反应而发生的物理变化过程就 形成了化学热力学。 化学热力学主要研究和解决的问题有: (1)化学反应及与化学反应密切相关的物理 过程中的能量变化; (2)判断化学反应进行的方向和限度。
引入反应进度的优点是,用任一种反应物或 产物表示反应进行的程度,所得值都是相同的。 应用反应进度时,必须指明化学反应方程式。
例题
例 2-1 10 mol N2 和 20 mol H2 在合成塔混合后, 经多次循环反应生成了 4 mol NH3。试分别以如下两 个反应方程式为基础,计算反应进度变。 (1) N 2 (g) + 3H 2 (g) 2NH 3 (g)
根据系统与环境之间物质和能量的交换情况 的不同,把系统分为三类: (1)敞开系统:系统与环境之间既有能量交 换,又有物质交换。 (2)封闭系统:系统与环境之间只有能量交 换,没有物质交换。 (3)隔离系统:系统与环境之间既没有能量 交换,也没有物质交换。
无机化学之化学热力学基础

第15页/共131页
途径 (path) 体系由同一始态变到同一终态可以经由不同的方
式,这种不同的方式称为途径。 途径也可以说是体系由始态到终态所经历的过程
总和。
途径1 终态
始态
途径2
第16页/共131页
3.1.4 热和功
• 状态函数的特点
1)状态函数是状态的单值函数。 2)条件变化时,状态也将变化,但状态函数的变化值只
取决于始态和终态,而与状态变化的具体途径无关。
例:当系统由始态变到终 态时,系统的状态函
系统压力从 3pº变为 pº
数压力 P 和体积V 的
变化量与途径无关。
始 态
终 态
中间态
3)当状态变化时,状态函数一定改变,但状态变化时,
从而使系统在每一步膨胀过程中都无限接近于平衡态,经 过无穷多次膨胀后(也就是小颗粒被取完时)而达到终态, 这种过程称为准静态过程。
当然,完成此过程需要无限长的时间。此时体系对外做 的总膨胀功为同一始、终态条件下不同膨胀途径中的最大 功,其数值为:
W3 =
V2 V1
p外dV
nRT ln V2 V1
第13页/共131页
几种常见的热力学过程
• 恒压过程(isobar process)
如果体系在状态变化过程中,且压力始终恒定, 则此变化过程称为恒压过程;
等压变化:只强调始态与终态的压力相同,且等 于环境压力,而对过程中的压力不作任何要求。
• 恒温过程(isothermal process)
如果体系的状态变化是在温度恒定的条件下进行 的,此变化称为恒温过程。
例如,要描述一理想气体所处的状态,只需知道 T、p、V 就够用,因为根据理想气体的状态方程 pV = nRT,此理想气体的物质的量 (n) 也就确定了。
大学无机化学第3章 化学热力学初步

定,殊途同归变化等,周而复始变化零。” 状态函数变化值 终态值 始态值
( 1 )一个体系的某个状态函数的值改变,该 体系的状态就改变了。 例: 状态1 状态2 p = 101.325 kPa 320 kPa 物理量 = 纯数 量纲 状态的变化——过程(process)
(2)殊途同变化等 例:始态 T1 298K → 350K T2 终态 ↓ ↑ 520K → 410K ( → 途经1 , →途经2 ) 途经1 和途经2: △T = T2 - T1 =350K – 298K = 52K 状态函数的变化只取决于始态和终态,而与 途经无关。
(3)周而复始变化零 始态、终态 T1 、T2 298K ← 350K
二、功(work)
当体系发生变化时,在体系与环境间除热以外
的其它各种形式的能量传递,都称为功。
与热一样,功是与过程相联系的量,所以功也不
是体系的状态函数。单位:J。 体积功 功 其它功:电功、机械功……
功=力×位移=f×Δl =
f l s P外 V s
P外·ΔV : 体积功。(在化学热力学中 只考虑体积功) •符号W,由于功的传递具有方向性, 所以规定: (1) 体系对环境作功为正值: W>0 体积功=P·ΔV (2) 环境对体系作功为负值: W<0
1-2
体系和环境
一、定义 体系:被划分为研究对象的那部分物质或空间 称为体系(system) 。 环境:体系以外的并且与体系有关系的其他部 分物质或空间称为环境(surrounding) 。
二、体系的分类
敞开体系:体系与环境之间既有物质交换,
又有能量交换。如,开口的热水杯。 封闭体系:体系与环境之间没有物质交换, 只有能量交换。如,带盖的热水杯。 孤立体系:体系与环境之间既没有物质交换, 也没有能量交换。如,带塞的暖水瓶。
无机化学化学热力学初步

的热容,指内容物升高 1 K 所需要的热 量;
C :量热计常数,整个量热计升高 1 K 所需要的热量。
无机化学化学热力学初步
保温杯式量热计29
反应热的测量
❖ 2)等容反应热 Qv——弹式量 热计(测定燃烧热)
Q放= Q吸 Qv = Q水+ Q弹
4 10 5 Pa 4 dm3 15
途径 B:分两步膨胀
无机化学化学热力学初步
4 10 5 Pa 4 dm3 16
2 ) 再反抗外压 p2 = 1 10 5 Pa , 膨胀到 16 dm3
W2 = - p外 V = - 1 10 5 ( 16 - 8 ) 10-3 = - 800 (J)
= - 0.5 8.314 373
= - 1.55 kJ ·mol – 1
∵ Qp = Qv + nRT ∴ Qv = Qp – nRT
= - 241.9 – (-1.55)
= - 240.35 kJ ·mol – 1
无机化学化学热力学初步
34
2.3 化学反应的热效应
二、反应进度概念
❖ 煤炭燃烧中的重要反应: C + O2 —— CO2
31
R = 8.314 J K-1 mol-1 = 8.314 Pam3 K-1 mol-1 = 8.314 kPadm3 K-1 mol-1
无机化学化学热力学初步
32
例 2: 在 101.3 kPa 条 件 下 , 373 K 时 , 反 应 2H2(g)+O2(g)=2H2O(g)的等压反应热是 -483.7kJ·mol– 1,求生成1mol H2O(g)时的等压 反应热QP及等容反应热QV 。
无机化学-化学热力学基础

无机化学
Ch2 化学热力学
热力学第一定律 热化学 热力学第二定律 化学反应的摩尔吉布斯自由 能变 热力学在生物化学中的应用8 39热化学. .
. .
. .
. .
.
9 / 39
热化学
热化学 研究化学反应所吸收或放出热量 热力学第一定律在化学反应中的应用 反应热 Wf = 0 当产物温度与反应物温度相同时化学反应 吸收或放出的热 (化学反应热效应) 封闭系统
无机化学
Ch2 化学热力学
热力学第一定律 热化学 热力学第二定律 化学反应的摩尔吉布斯自由 能变 热力学在生物化学中的应用
. . . . . . . .
. . . . . . . . .
. .
. .
. .
. .
.
3 / 39
热力学第一定律
系统 研究对象 环境 系统以外与系统密切相关的周围部分
无机化学
Ch2 化学热力学
热力学第一定律 热化学 热力学第二定律 化学反应的摩尔吉布斯自由 能变 热力学在生物化学中的应用
系统 能量交换 物质交换 √ √ 敞开 √ 封闭 × 孤立 × × 人?宇宙?系统+环境?
▶ ▶ ▶
无机化学
Ch2 化学热力学
热力学第一定律 热化学 热力学第二定律 化学反应的摩尔吉布斯自由 能变 热力学在生物化学中的应用
能量变化 反应方向 反应程度 (Ch3 化学平衡)
化学动力学 反应速率 反应机理 (Ch4)
. . .
. .
.
. . . . . . . .
