免疫胶体金标记手册
胶体金标记技术

胶体金标记技术胶体金标记技术是以胶体金作为示踪标志物或显色剂,应用于抗原抗体反应的一种新型免疫标记技术。
由于它不存在内源酶干扰及放射性同位素污染等问题,且利用不同颗粒大小的胶体金还可以作双重甚至多重标记,使定位更加精确。
因此已成为继荧光素、酶、同位素及乳胶标记技术之后的一种新型标记技术。
现已广泛应用于电镜、流式细胞仪、免疫印迹、蛋白染色、体外诊断试剂的制造等领域。
用胶体金作为特殊标记物的研究始于60年代初,1962年Feldberr等报道了用胶体金标记细胞进行电子显微镜的研究。
1971年,Taylor又将胶体金引入电镜免疫标记技术中。
近年来的研究表明,胶体金也可作为体外免疫加层试验的指示物。
由于胶体金作为标记物具有很多优点,因此自其问世以来,在国内外的许多研究领域中得到了迅速的发展。
近年来,它更多的被应用于免疫学和细胞学相关分子水平的检测中。
尤其随着人们物质生活的改善,有关人类健康的问题在现实生活中已显得非常突出。
从90年代至今的多篇报道都是关于动物体或人体相关抗体和病原体检测的。
制备方法在溶液中金颗粒呈圆形,边缘平整,界线十分清楚。
金颗粒表面带有大量负电荷,由于静电的排斥力,使其在水中保持稳定状态,形成稳定的胶体,所以称其为胶体金。
胶体金的制作方法有白磷还原法,抗坏血酸还原法,柠檬酸三钠还原法和鞣酸—柠檬酸三钠还原法。
通过改变反应体系中氯金酸与还原剂的比例(即增加或减少还原剂的量)可得到所需不同直径的金颗粒。
但前两种方法制备得到的金颗粒直径大小不均一,所以目前常用后两种方法,以柠檬酸三钠还原法为例,有两种方法。
1.Frens标准方法:1)取0.01%HAuCl4溶液50mL,加热煮沸,随即快速加入1%柠檬酸三钠溶液0.5mL。
2)约过25s沸腾的溶液变为淡蓝色,大约再过70s,蓝色突然转变为亮红色,3)继续煮沸约5分钟后结束反应。
4)冷却后用0.1M K2CO3溶液调至所需PH值。
5)此后再延长反应时间或另加入额外的柠檬酸三钠都不影响实验结果。
胶体金金标检验法

胶体金(金标)检验法胶体金是一种常用的标记技术,有其独特的优点。
近年已在各种生物学研究中广泛使用。
免疫胶体金技术的基本原理是:氯金酸(HAuCl4)在还原剂作用下,可聚合成一定大小的金颗粒,形成带负电的疏水胶溶液。
由于静电作用而成为稳定的胶体状态,故称胶体金。
胶体金标记,实质上是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。
免疫金标记技术(Immunogold labelling techique) 主要利用了金颗粒具有高电子密度的特性,在金标蛋白结合处,在显微镜下可见黑褐色颗粒,当这些标记物在相应的配体处大量聚集时,肉眼可见紫色斑点,因而用于定性或半定量的快速免疫检测方法中。
为什么霍乱可以用胶体金(金标)检验法进行快速筛查?霍乱弧菌快速检测卡是利用单克隆抗体胶体金标记技术和膜层析技术研制而成,用于定性检测样本中可能存在的霍乱弧菌的特异性抗原A及O139血清型。
首先按常规方法制备并筛选出效价高的抗O1群A 抗原和抗O139抗原的单抗细胞株。
然后采用枸缘酸钠还原法制备胶体金颗粒,选择玻璃纤维吸附最适浓度的金标抗体。
按常规方法免疫家兔,制备霍乱弧菌的多克隆抗体。
根据检测对象(疑似病人粪便)的特殊性,研制了特异的稀释液。
一方面可裂解细菌,释放抗原,提高检测敏感性,另一方面可起到防止污染的作用。
经二年多的反复试制,我公司完成的霍乱弧菌O1群(O139)快速检测试纸,其对霍乱弧菌最低敏感性10分钟内106菌/ml阳性,达到临床最低检出量的要求,符合卫生部《霍乱防治手册》要求,且对高浓度的菌液109 菌/ml无前置反应;用萃取液、正常人粪便标本及其它大肠中寄生菌进行的特异性鉴定表明,该试纸条特异性为100%金特敏? 霍乱快速检测卡的特点是什么?最低检出量:不低于105cfu/ml适合临床需要。
快速出结果:稀释直接裂解细菌,10分钟观察结果满足疾病控制要求。
便利使用:独立包装,“插”式设计,操作简捷,避免二次污染。
免疫胶体金层析法

4
negative
HCG 阴性标本
MAX
尿中无HCG与金标记的鼠抗人HCG单抗结合形成免疫复合物 随层析作用向上移动,至检测线与鼠抗人HCG抗体不结合而不显色
在检测线未结合的金标记鼠抗人HCG单抗(IgG)随着尿液上行,到达质控
线与羊抗鼠IgG(二抗)结合而显色,作为质控对照。Fra bibliotek精选ppt
5
试纸条失效
失效
MAX
金标鼠抗人IgG单抗随层析作用向上移动,到达质控线,无羊抗鼠IgG( 二抗)或破坏失效,不结合而 不显色,作为质控对照。
精选ppt
6
大便隐血
MAX
精选ppt
7
注意事项
• 1. 将试条有标志线的下端浸入尿液标本中, 深度不可超过标志线(若超过,可能会出 现假阳性)
• 2. 约3秒后取出,平放,5分钟内观察结果 (时间不能小于5分钟):两条红线为(+),提 示尿中含HCG。一条红线为(一),表示不含 HCG。(时间过短,可能有假阴性)
免疫胶体金层析法
——金标记免疫法测HCG
精选ppt
1
原理
• 采用胶体金标记抗体,以硝酸纤维 素膜为载体,使抗原抗体反应和洗 涤在同一渗滤膜上,反应后根据在 膜上的颜色判断结果。
• 以硝酸纤维素膜为载体,利用微孔 膜毛细管作用,使膜一端的液体慢 慢向另一端渗移,犹如层析
精选ppt
2
← HCG分子 ← 鼠抗人HCG单抗 ← 胶体金颗粒 ←胶体金标记鼠抗人HCG单抗
精选ppt
8
方法学评价
• 该法为定性检测尿中HCG,不能确定其浓度 • 因为该法是用单抗来测定HCG,特异性较高, 黄
疸、蛋白、血细胞和浑浊度对结果观察都无影 响。、 • 晨尿中一般含有最高的HCG值,检出率较高。 • 检测时间:HCG一般在受精卵着床后几天才出现 在尿液中,而且要达到一定的量才能被检出,因 此,对于平时月经正常的妇女需在月经推迟后才 可能在尿中检出,二月经周期长或排卵异常的妇 女有可能在停经40-44天才能检出 • 尿液稀释:如果喝水过多使尿液稀释可能会导致 假阴性结果。
免疫胶体金标记手册

免疫胶体金标记手册浙江大学电子显微镜室浙江大学生物技术研究所胶体金免疫标记技术培训班技术资料胡东维洪健徐颖浙江大学2001年10月一、胶体金的制备根据不同的制备方法,可以制备出直径1-500nm的胶体金粒子,但做为免疫标记探针,其直径应在3-30nm范围内。
在氯化金(HAuCl4)水溶液中加入还原剂使之还原并聚积形成胶体金粒子。
使用不同种类、不同剂量的还原剂,可以控制所产生的粒子大小。
即粒子大小取决于反应溶液中最初还原试剂和还原核的数量。
还原剂浓度越高,核浓度也越高,氯化金的还原也就从更多的还原中心开始,因此产生的胶体金粒子数量越多,但体积也越小。
粒子直径每增加一倍,数量减少为原来的1/8。
以柠檬酸钠和单宁酸做还原剂,能够制备大小相对一致、直径3~16nm的胶体金。
因此一般胶体金探针均使用该方法进行。
但该方法制备的胶体金粒子直径范围较窄,而且残留的多聚单宁酸残基往往干扰某些蛋白与金粒子的结合。
此时在溶液中添加0.1~0.2%的H2O2能够去除这些残基。
双标记或制备5-10 nm的胶体金时建议使用该方法。
利用柠檬酸为还原剂,可以制备12~150 nm直径的胶体金。
但制备大体积的胶体金时,胶体金粒子的误差也同时增加。
因此做单标记时,建议使用该方法制备12-16 nm直径的胶体金。
除了上述方法外,也可以用磷作为还原剂来制备5 nm的胶体金,它避免了单宁酸残基的问题,但所形成的金粒子体积变化较大。
磷易燃且有毒,制备的残液需进一步处理,故该方法已经很少使用。
氯化金极易吸湿,故一般均以小剂量密封保存(0.5g或1g),因此在配制氯化金溶液时一次配完,暂时不用的可以用1.5 ml试管分装为1 ml保存(-20℃)。
注意各种玻璃器皿一定要洗净并用双蒸水多次冲洗,有条件时可硅化处理(1%双氯硅烷/氯仿浸泡1小时,烘干)。
配制各种试剂时均使用双蒸水,随后再用0.22 m微孔滤膜过滤后使用。
三角瓶可反复多次使用,不用时应密封保存,以防污染。
胶体金免疫色谱试验测定法

胶体金免疫色谱试验测定法
胶体金免疫色谱试验(Gold Immunochromatography Assay,简称GIA)是一种常用于检测生物样本中特定分子(如蛋白质、荷尔蒙、抗体等)的定性或定量分析方法。
一般的胶体金免疫色谱试验包括以下步骤:
1. 样品处理:将待检生物样品(如血液、尿液、唾液等)进行预处理,通常包括离心、稀释或某些特殊样品的处理方法。
2. 准备试纸条:将试纸条浸泡于样品中,使试纸条上的涂层带上样品中的目标分子。
3. 上样:将预处理后的样品滴入试纸条上的样品进样孔,让样品与试纸条上的特异抗体结合。
4. 试纸条扩散:待样品进入样品孔后,样品中的目标分子会与试纸条上固定的抗体结合,形成抗原-抗体复合物。
复合物会随着样品的扩散而向试纸条上移动。
5. 可视化结果:在试纸条上存在着特定检测线。
当复合物通过检测线时,会发生阳性反应,即出现颜色改变。
通过检测线的出现与否,可以判断样品中是否存在目标分子。
胶体金免疫色谱试验的优点包括操作简便、快速、便携、结果可视化等,因此被广泛应用于临床诊断、食品安全、环境监测等领域。
17.2-金免疫标记技术

一 洗 净 双 手
四
立 即 加 1 2 滴 缓 冲 液
操作
二 用 采 血 针 采 指 尖 血
样三 孔将 1 滴 指 尖 血 滴 入 加
??结果
步骤5:15分钟读 取结果
??结果
讨论分析
胶体金标记技术 (Immunogold labeling technique)
是以胶体金作为示 踪标记物,应用于 抗原抗体反应的一 种新型免疫标记技 术。
讨论分析
制备高质量胶体金的注意事项
(1)玻璃器皿必须彻底清洗,最好是经过硅化处理的玻璃 器皿,或用第一次配制的胶体金稳定的玻璃器皿,再用双 馏水冲洗后使用。否则影响生物大分子与金颗粒结合和活 化后金颗粒的稳定性,不能获得预期大小的金颗粒。 (2)试剂配制必须保持严格的纯净,所有试剂都必须使用 双馏水或三馏水并去离子后配制,或者在临用前将配好的 试剂经超滤或微孔滤膜(0.45µ m)过滤,以除去其中 的聚合物和其它可能混入的杂质。
讨论分析
2.鞣酸—枸橼酸钠还原法 A液:1%HAuCl4水溶液1ml加入79ml双馏水中混匀。 B液:1%枸橼酸三钠4ml,1%鞣酸0.7ml,0.1Mol/L K2CO3液0.2ml,混合,加入双馏水至20ml。
将A液、B液分别加热至60℃,在电磁搅拌下迅速将 B液加入A液中,溶液变蓝,继续加热搅拌至溶液变 成亮红色。此法制得的金颗粒的直径为5nm。如需 要制备其它直径的金颗粒,则按表15-1所列的数字 调整鞣酸及K2CO3的用量
讨论分析
示踪剂:以胶体金为指示剂,本 身形成免疫分析过程后的颜色标记
符号显示结果
自带质控对照
快速:全部检测过程 仅需 3-20分钟。
简便、经济实用
可单份检测,稳定性好
免疫电镜胶体金标记法-1

免疫电镜胶体金标记法-1金标法是Faulk和Taylor(1971)提出的,并首先用于免疫电镜。
它是利用胶体金在碱性环境中带有负电的性质,使其与抗体相吸附,从而将抗体标记。
当用金标记的抗体与抗原反应时,在光镜水平胶金液呈现鲜艳的樱红色,不需加外进行染色。
在电镜水平,金颗粒具有很高的电子密度,清晰可辨。
因此,免疫电镜胶体金标记法近年来被成功地应用于生物学的各个方面,并取得了要喜的进展,解决了一些过去未能解决的问题,80年代以来似有取代免疫电镜 PAP技术的趋势。
胶体金标记抗体技术在电镜水平应用有许多优点:首先,手续不如PAP法烦琐,不需用H2O2等损伤微细结构的处理步骤,对微细结构的影响较少。
其次,金颗粒具有很高的电子密度,在电镜下金颗粒清晰可辨,易于与其他免疫产物相区别。
因此,金标法还可以和PAP法相结合进行双重或多重染色的超微结构定位。
另外,利用不同直径的金颗粒标记不同的抗体,是研究突触小泡内神经递质共存的有力工具。
由于抗原抗体反应部位结合金颗粒数量的多少可进行粗略的免疫细胞化学定量研究。
金标抗体还可加入培养液中,对培养细胞内抗原进行标记定位。
曾有报告用金标记法于细胞内骨架的研究获满意的效果。
由于金具有强烈的继发电子的能力,因此,不仅可以用于透射电镜的超薄切片观察,也可以用于扫描电镜对细胞表面的抗原、受体进行标记定位观察。
金标液无毒性,对人体无损伤。
胶体金及胶体金标记物的制备见第五章第3节。
在原位分子杂交技术在电镜水平的应用中,胶体金的标记术被科技工作者认为是当前最理想的标记物。
一、电镜水平的免疫金染色法应用于电镜水平的免疫法,可分为包埋前染色和包埋后染色,由于包埋前染色对细胞膜的穿透性差,一般只用于细胞表面的抗原标记,如需穿透细胞膜,则需辅以冻融法或加入Triton X-100、皂素等活性剂,后者会加重细胞超微结构的破坏,因此,现较普遍采用包埋后染色,现分别介绍如下:1、包埋后染色(1)超薄切片厚50~70nm左右,载于200~300网孔的镍网上。
胶体金金标检验法

胶体金(金标)检验法胶体金是一种常用的标记技术,有其独特的优点。
近年已在各种生物学研究中广泛使用。
免疫胶体金技术的基本原理是:氯金酸(HAuCl4)在还原剂作用下,可聚合成一定大小的金颗粒,形成带负电的疏水胶溶液。
由于静电作用而成为稳定的胶体状态,故称胶体金。
胶体金标记,实质上是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。
免疫金标记技术(Immunogold labelling techique) 主要利用了金颗粒具有高电子密度的特性,在金标蛋白结合处,在显微镜下可见黑褐色颗粒,当这些标记物在相应的配体处大量聚集时,肉眼可见紫色斑点,因而用于定性或半定量的快速免疫检测方法中。
为什么霍乱可以用胶体金(金标)检验法进行快速筛查?霍乱弧菌快速检测卡是利用单克隆抗体胶体金标记技术和膜层析技术研制而成,用于定性检测样本中可能存在的霍乱弧菌的特异性抗原A及O139血清型。
首先按常规方法制备并筛选出效价高的抗O1群A 抗原和抗O139抗原的单抗细胞株。
然后采用枸缘酸钠还原法制备胶体金颗粒,选择玻璃纤维吸附最适浓度的金标抗体。
按常规方法免疫家兔,制备霍乱弧菌的多克隆抗体。
根据检测对象(疑似病人粪便)的特殊性,研制了特异的稀释液。
一方面可裂解细菌,释放抗原,提高检测敏感性,另一方面可起到防止污染的作用。
经二年多的反复试制,我公司完成的霍乱弧菌O1群(O139)快速检测试纸,其对霍乱弧菌最低敏感性10分钟内106菌/ml阳性,达到临床最低检出量的要求,符合卫生部《霍乱防治手册》要求,且对高浓度的菌液109 菌/ml无前置反应;用萃取液、正常人粪便标本及其它大肠中寄生菌进行的特异性鉴定表明,该试纸条特异性为100%金特敏? 霍乱快速检测卡的特点是什么?最低检出量:不低于105cfu/ml适合临床需要。
快速出结果:稀释直接裂解细菌,10分钟观察结果满足疾病控制要求。
便利使用:独立包装,“插”式设计,操作简捷,避免二次污染。
人类免疫缺陷病毒标准操作规程(胶体金法)
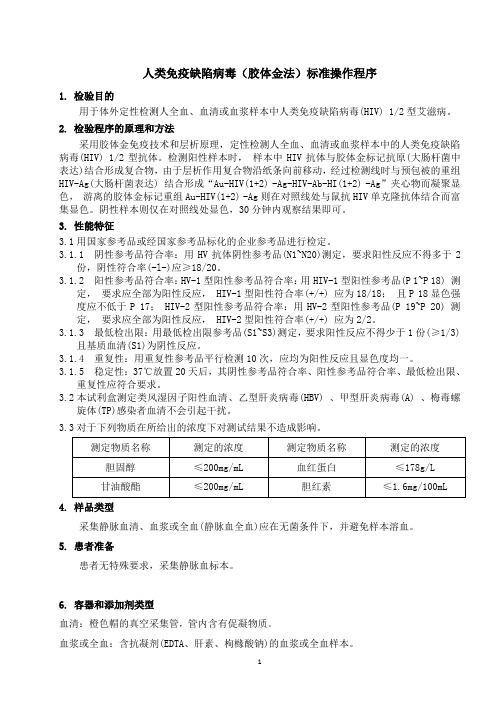
人类免疫缺陷病毒(胶体金法)标准操作程序1.检验目的用于体外定性检测人全血、血清或血浆样本中人类免疫缺陷病毒(HIV) 1/2型艾滋病。
2.检验程序的原理和方法采用胶体金免疫技术和层析原理,定性检测人全血、血清或血浆样本中的人类免疫缺陷病毒(HIV) 1/2型抗体。
检测阳性样本时,样本中HIV抗体与胶体金标记抗原(大肠杆菌中表达)结合形成复合物,由于层析作用复合物沿纸条向前移动,经过检测线时与预包被的重组HIV-Ag(大肠杆菌表达) 结合形成“Au-HIV(1+2) -Ag-HIV-Ab-HI(1+2) -Ag”夹心物而凝聚显色,游离的胶体金标记重组Au-HIV(1+2) -Ag则在对照线处与鼠抗HIV单克隆抗体结合而富集显色。
阴性样本则仅在对照线处显色,30分钟内观察结果即可。
3.性能特征3.1用国家参考品或经国家参考品标化的企业参考品进行检定。
3.1.1阴性参考品符合率:用HV抗体阴性参考品(N1~N20)测定,要求阳性反应不得多于2份,阴性符合率(-l-)应≥18/20。
3.1.2阳性参考品符合率:HV-1型阳性参考品符合率:用HIV-1型阳性参考品(P 1~P 18) 测定,要求应全部为阳性反应, HIV-1型阳性符合率(+/+) 应为18/18;且P 18显色强度应不低于P 17; HIV-2型阳性参考品符合率:用HV-2型阳性参考品(P 19~P 20) 测定,要求应全部为阳性反应, HIV-2型阳性符合率(+/+) 应为2/2。
3.1.3最低检出限:用最低检出限参考品(S1~S3)测定,要求阳性反应不得少于1份(≥1/3)且基质血清(S1)为阴性反应。
3.1.4重复性:用重复性参考品平行检测10次,应均为阳性反应且显色度均一。
3.1.5稳定性:37℃放置20天后,其阴性参考品符合率、阳性参考品符合率、最低检出限、重复性应符合要求。
3.2本试利盒测定类风湿因子阳性血清、乙型肝炎病毒(HBV) 、甲型肝炎病毒(A) 、梅毒螺旋体(TP)感染者血清不会引起干扰。
胶体金技术资料

免疫胶体金技术(Immune colloidal gold technique) (一)原理免疫胶体金技术是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术。
胶体金是由氯金酸(HAuCl4)在还原剂如白磷、抗坏血酸、枸橼酸钠、鞣酸等作用下,聚合成为特定大小的金颗粒,并由于静电作用成为一种稳定的胶体状态,称为胶体金。
胶体金在弱碱环境下带负电荷,可与蛋白质分子的正电荷基团形成牢固的结合,由于这种结合是静电结合,所以不影响蛋白质的生物特性。
胶体金除了与蛋白质结合以外,还可以与许多其它生物大分子结合,如SPA、PHA、ConA 等。
根据胶体金的一些物理性状,如高电子密度、颗粒大小、形状及颜色反应,加上结合物的免疫和生物学特性,因而使胶体金广泛地应用于免疫学、组织学、病理学和细胞生物学等领域。
(二)胶体金的制备根据不同的还原剂可以制备大小不同的胶体金颗粒。
常用来制备胶体金颗粒的方法如下。
1.枸橼酸三钠还原法(1)10nm胶体金粒的制备:取0.01%HAuCl4水溶液100ml,加入1%枸橼酸三钠水溶液3 ml,加热煮沸30min,冷却至4℃,溶液呈红色。
(2)15nm胶体金颗粒的制备:取0.01%HAuCl4水溶液100ml,加入1%枸橼酸三钠水溶液2ml,加热煮沸15min~30min,直至颜色变红。
冷却后加入0.1Mol/L K2CO30.5ml,混匀即可。
(3)15nm、18nm~20nm、30nm或50nm胶体金颗粒的制备:取0.01%HAuCl4水溶液100 ml,加热煮沸。
根据需要迅速加入1%枸橼酸三钠水溶液4ml、2.5ml、1ml或0.75ml,继续煮沸约5min,出现橙红色。
这样制成的胶体金颗粒则分别为15nm、18~20nm、30nm和5 0nm。
2.鞣酸—枸橼酸钠还原法A液:1%HAuCl4水溶液1ml加入79ml双馏水中混匀。
B液:1%枸橼酸三钠4ml,1%鞣酸0.7ml,0.1Mol/L K2CO3液0.2ml,混合,加入双馏水至20ml。
简化免疫胶体金标记技术

包埋后免疫胶体金标记技术1.试剂固定液:0.1M二钾砷酸鈉缓冲液pH7.4(4%多聚甲醛+0.1%戊二醛+4%蔗糖)洗涤液:0.1M二钾砷酸鈉缓冲液pH7.4(4%蔗糖)醛基灭活液:0.1M二钾砷酸鈉缓冲液pH7.4(4%蔗糖+0.1M甘氨酸)脱水剂:甲醇(ddH2O稀释成30%,50%,70%,80%,90%,95%)包埋剂:K4M (2.7g交联剂A+17.3单体B+0.1g引发剂C)标记封闭液:0.01M磷酸盐缓冲液pH7.4(1%BSA+0.05%TritonX-100+0.05%Tween 20) 标记洗涤液:0.01M磷酸盐缓冲液pH7.4抗体稀释液:0.01M磷酸盐缓冲液pH7.4(1%BSA+0.05%Tween 20)染色液:醋酸铀(3-4g醋酸双氧铀+100ml50%甲醇);柠檬酸铅pH12(1.33g硝酸铅+1.76g柠檬酸鈉+30mlddH2O)2. 主要仪器:镍网(喷有方华膜和碳膜)、镊子、Parafilm、自制小环、冰箱(4℃至-35℃)、紫外聚合箱、培养皿、透射电镜、离子溅射仪、超薄切片机、恒温箱(28℃)0.2二钾砷酸鈉缓冲液母液pH7.4:0.4M 二钾砷酸鈉(21.4g二钾砷酸鈉/250mlddH2O)0.2M盐酸(4.5ml/250mlddH2O)50ml二钾砷酸鈉(0.4M)中加入8ml左右0.2M盐酸,调节pH至pH7.2-7.4,加入ddH2O 至终体积为100ml,即为0.2二甲砷酸鈉缓冲液母液pH7.42.5%戊二醛母液pH7.4:25%戊二醛10ml +0.2M二钾砷酸鈉缓冲液50ml,加入ddH2O至终体积为100ml,pH无需再调,现配现用4%多聚甲醛pH7.4:a.16%多聚甲醛25ml+0.2M二钾砷酸鈉缓冲液50ml,加入ddH2O至终体积为100ml,pH无需再调,现配现用b. 2g多聚甲醛粉末+40ml ddH2O,70℃加热至粉末完全溶解,加入1.07g二钾砷酸鈉,用0.2M盐酸调至pH7.4,加入ddH2O至终体积为50ml,现配现用0. 1M磷酸盐缓冲液pH7.4:NaH2PO4∙H2O1.8g+23.25gNa2HPO4∙7H2O+NaCl 5.0g.加入ddH2O至终体积为1000mlK4M:2.7g交联剂A+17..3单体B至离心管中,充入氮气以使其充分混合,在加入0.1g引发剂C,继续充入氮气至其完全溶解,配置好的K4M包埋剂-20℃保存3%醋酸铀:3-4g醋酸双氧铀至100ml浓度为50%的甲醇中,静置过夜,过滤后4℃避光保存1%柠檬酸铅:1.33g硝酸铅+1.76g柠檬酸鈉至30mlddH2O中,剧烈混匀,加入8ml1MNaOH至溶液变得澄清,加入ddH2O至终体积为50ml,最终pH12左右3. 步骤及方法3.1 取材与固定对于培养与分离的细胞,随用随取,取材时越快越好,动物组织取材的最理想的方法是经过组织灌流固定后再用锋利的刀片将其切成1mm3以下大小的组织块,投入到固定液中继续固定。
胶体金标记技术

胶体金免疫分析技术随着免疫分析日益广泛应用于以临床为主以及非临床领域的诊断工业,免疫分析正在向两个方向发展:一类为全自动化的免疫分析;另一类为以硝酸纤维膜为载体的快速免疫分析。
前者需要价格昂贵的全自动仪器及与仪器严格配套的各种试剂盒,目前只能在医疗及检测中心应用,虽也能较快速给出结果,但仍需一定时间,不适合远离医疗及检测中心的地区,更不能用于“患者床旁检验”和普查的需要,在酶免疫分析的基础上,主要以硝酸纤维素膜为载体的快速诊断方法迅速和广泛地发展起来。
这类方法目前在文献及市场上的命名还很不统一。
它实际上属于快速斑点免疫结合分析,主要有以下两种方法:斑点免疫渗滤分析DIFA 和斑点免疫层析分析DICA。
本篇主要介绍以金作为标志物的胶体金免疫分析技术。
金标记免疫分析技术也称免疫胶体金技术,是于1971年建立的一种信号显示技术。
此技术最初用于免疫电镜检查,由胶体金颗粒标记抗原或抗体,与组织或细胞中相应的抗体或抗原相结合,在电子显微镜的检查时可起特异的示踪作用。
此后,此技术与银染技术相结合建立的免疫金银染色法,使抗原抗体特异反应信号可在光学显微镜下观察。
近10多年来,利用硝酸纤维素膜(NC)等为固相载体,以胶体金标记的抗原或抗体与特异配体的反应在膜上进行,建立了快速的金标记免疫渗滤技术和金标记免疫层析技术,并在传染病、心血管病、风湿病、自身免疫病的免疫学检测中广泛应用。
胶体金是指金微小粒子(0-100nm)分散在另一种物质中所形成的体系,通常指金以微小粒子分散在溶液中所形成的金溶胶,用此金溶胶标记蛋白质(抗原、抗体或SPA、SPG),胶体金颗粒具有高电子密度的特性,故在金标蛋白的抗原抗体结合处,显微镜下可见黑褐色颗粒;当这些标记物在相应的标记处大量聚集时,可在载体膜上呈现红色或粉红色斑点,从而用于抗原或抗体物质的半定量或定性。
与ELISA不同之处便是反应时间大大缩短,仅需要数分钟就完成了ELISA 需数小时才能显示的结果。
免疫胶体金技术..

胶体金标记技术的相关定义
免疫胶体金技术 是以胶体金作为示踪标志物应用于抗原抗 体的一种新型的免疫标记技术。 胶体金标记 实质上是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。
To the boiling solution, add 1.5 mL of a 1% solution of trisodium citrate dihydrate, Na3C6H5O7.2H2O
Stop heating when a deep red color is obtained.
Synthesis and properties of different particle size
免疫胶体金技术的特点
优点: 检测方法简单而快速,数分钟即可得出结果; 不需仪器设备,操作人员不需特殊训练; 试剂稳定,适用于单份测定; 无污染。 GICA的特点是单一试剂,一步操作。小型实验室即有条件开发生产。 干燥包装的试剂可在室温保存一年以上。
成为目前“病人身边检验”(point-of-care testing,POCT)中广为应用的方法。
Adjust the gold colloid to the proper pH
常用几种蛋白质标记时胶体金所用的pH值
Determined the minimum amount of protein
(1)光电比色法:制备一系列不同浓度的等体积蛋白质溶液(1ml),分别加入5ml胶体金中,迅速混匀,然后,各加入1ml 10% NaCl溶液,摇匀,静置5min后测各管。根据胶体金颗粒的大小,OD在520~580nm之间测定,以OD值为纵坐标,蛋白质用量为横坐标作一曲线,取曲线最先与横轴相接近的那一点处的蛋白质用量为最适稳定量。图5.2中10nm的胶体金溶液中蛋白质的最适稳定量为45μg/ml。
胶体金标记

配方宜简不宜繁
配伍原则
缓冲体系
BSA
糖封闭金垫 3.流动封闭NC膜
干燥保护剂
表面活性剂 高分子聚合物 酪蛋白
Company Logo
蛋白的半胱氨酸 可以通过硫基与 胶体金表面形成 配位键,这种作 用力非常强,出 现了pH越高, 特异性越好的现 象。 (硫柳汞)
Company Logo
正电荷:利于结合 调节pH目的:带有合适的正负电荷 负电荷:防止交联死金
最适蛋白量
盐离子破坏稳定性
NaCl滴定法
封闭剂
不适用
Company Logo
1.pH<pI,正电 荷 2.pH=pI,不带 电 3.pH>pI,负电 荷
Company Logo
结合的三种作用力
电荷引力
疏水作用力
配价结合
胶体金表面一圈 负电层,蛋白质 在标记环境下一 些基团是带正电 荷的,两者之间 通过电荷引力结 合。 (低pH和高pH 的体现)
这种力在免疫反 应中的作用最大 最强,对于维系 复合物起到主要 作用,而胶体金 与蛋白稳定吸附 也很依赖疏水作 用力。 (表活)
胶体金表面一圈负电层蛋白质在标记环境下一些基团是带正电荷的两者之间通过电荷引力结低ph和高ph的体现蛋白的半胱氨酸可以通过硫基与胶体金表面形成配位键这种作用力非常强出现了ph越高特异性越好的现电荷引力疏水作用力配价结合调节ph目的
胶体金标记
巫泳瑤 2017.04.23
Contents
检测模式
最适pH 最适蛋白量与封闭 离心纯化 复溶
Company Logo
检测模式
1.竞争法
双抗体夹心法
2.夹心法
双抗原夹心法
3.间接法和捕获法
免疫金标记检测方法标准操作程序

免疫金标记检测方法标准操作程序【目的】保证免疫金标技术检验准确性【本SOP适用范围】免疫金标技术【该SOP变动程序】本标准操作程序的变动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、科主任。
【原理】氯化金分子在还原剂作用下聚合形成金颗粒,颗粒与颗粒之间因静电作用而相互排斥,使其保持一个比较稳定的胶体状态,故称作胶体金。
利用胶体金颗粒的高电子密度及其表面能结合生物大分子(如抗体、SPA、植物血凝素和刀豆蛋白A等)以及具有一定颜色等特性,可用光镜和电镜对细胞内抗原进行定位、定性的研究。
【方法学分类】1. 班点金免疫渗滤试验固相膜免疫测定中液体在微孔膜中穿过流出呈穿流形式,为斑点金免疫渗滤试验(dot immunogold filtration assay,DIGFA),亦有称免疫金溶胶斑点法、滴金免疫测定法等。
试验单位为三层反应盒,第一层为过滤器(滤纸层),第二层为反应膜(NC膜或MC膜)上点加有特异性抗原或抗体,第三层为吸水垫料,有称此渗滤装置为滴金反应板。
以双抗体夹心法测dsDNA为例:试验中将标本加在反应盒上,血清(标本)透过过滤层进入反应层,反应层上点有“一”字形抗IgG(或某种人血清蛋白作为试验阳性对照)及“.”形被测物相应抗体,血清中抗原与反应层中抗体结合,其余无关蛋白等滤出膜片,加入金标记抗体试剂,反应膜上“一”字形及“.”形均显红色为试验阳性,仅“一”形显红色为试验阴性(试剂盒状态良好),“一”不显色提示试剂盒质量不合格,需另取反应盒重做试验。
试剂盒基本试剂成分有滴金反应板、金标记试剂及洗涤液。
2. 斑点金免疫层析试验固相膜免疫测定中液体通过毛细管作用在膜上向前移行呈横流形式,为斑点金免疫层析试验(dotimmunogoldchromatographyassay,DIGCA)。
试验单位为一滤膜条,自上而下分有多个层次。
如单克隆双抗体法测HCG,滤膜条各区域分别为:吸水滤纸—固定有金标二抗的MC膜—固定有抗β-HCG抗体的MC膜—金标记抗。
免疫金标记技术(研究生讲义)

DIGFA与GICA的比较
DIGFA (穿透滤过型) GICA (横向流动型)
硝酸纤维素 膜的种类 试剂形式
操作步骤 观察时间
圆片膜
窄长型膜
渗滤装置及2瓶液体 单一试剂条(板) 试剂(液相形式 ) (固相形式 )
3
1
操作结束(约3min)即 操作结束后
刻观察
等待3-20min
35
IFA 穿流(FLOW THROUGH)
金免疫层析试验
( goldimmunochromatographic assay,GICA )
20
斑点金免疫渗滤试验 (dot immunogold filtration assay,DIGFA)
操作示意图 加标本 免疫金 洗涤液
盖 微孔膜 吸水垫料 底
装置分解图
21
技术类型:夹心法、间接法
双抗体夹心法
温度、稳定剂
8
呈色性
不同大小的胶体金呈现不同的颜色 小颗粒--橙黄色 中等颗粒—酒红色 较大颗粒—深红色 大颗粒—紫色
9
胶体性质
稳定性:稳定地、均匀地、呈单一分散状态悬浮
于液体中
10
胶体金 1 % 柠 檬 酸 三 胶体金特性 粒 径 钠 加 入 量 呈色 (nm) (ml)*
16
2.00
橙色
λmax 518nm
免疫金标记技术 (Immunogold labelling techique)
1
免疫技术
试剂 Ag Ab
标本 Ab Ag
2
放射性核素 荧光素 酶
化学发光剂 胶体金
标记免疫技术
试剂 Ag*
标本 Ab
Ab*
Ag
标记物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大学电子显微镜室大学生物技术研究所胶体金免疫标记技术培训班技术资料胡东维洪健徐颖大学2001年10月一、胶体金的制备根据不同的制备方法,可以制备出直径1-500nm的胶体金粒子,但做为免疫标记探针,其直径应在3-30nm围。
在氯化金(HAuCl4)水溶液中加入还原剂使之还原并聚积形成胶体金粒子。
使用不同种类、不同剂量的还原剂,可以控制所产生的粒子大小。
即粒子大小取决于反应溶液中最初还原试剂和还原核的数量。
还原剂浓度越高,核浓度也越高,氯化金的还原也就从更多的还原中心开始,因此产生的胶体金粒子数量越多,但体积也越小。
粒子直径每增加一倍,数量减少为原来的1/8。
以柠檬酸钠和单宁酸做还原剂,能够制备大小相对一致、直径3~16nm的胶体金。
因此一般胶体金探针均使用该方法进行。
但该方法制备的胶体金粒子直径围较窄,而且残留的多聚单宁酸残基往往干扰某些蛋白与金粒子的结合。
此时在溶液中添加0.1~0.2%的H2O2能够去除这些残基。
双标记或制备5-10 nm的胶体金时建议使用该方法。
利用柠檬酸为还原剂,可以制备12~150 nm直径的胶体金。
但制备大体积的胶体金时,胶体金粒子的误差也同时增加。
因此做单标记时,建议使用该方法制备12-16 nm直径的胶体金。
除了上述方法外,也可以用磷作为还原剂来制备5 nm的胶体金,它避免了单宁酸残基的问题,但所形成的金粒子体积变化较大。
磷易燃且有毒,制备的残液需进一步处理,故该方法已经很少使用。
氯化金极易吸湿,故一般均以小剂量密封保存(0.5g或1g),因此在配制氯化金溶液时一次配完,暂时不用的可以用1.5 ml试管分装为1 ml保存(-20℃)。
注意各种玻璃器皿一定要洗净并用双蒸水多次冲洗,有条件时可硅化处理(1%双氯硅烷/氯仿浸泡1小时,烘干)。
配制各种试剂时均使用双蒸水,随后再用0.22 m微孔滤膜过滤后使用。
三角瓶可反复多次使用,不用时应密封保存,以防污染。
制备好的胶体金保存寿命较长,可4℃保存6个月以上或室温下保存1-2个月。
当出现明显悬浮物或沉淀后表示已不可再用。
但无论无何,在保存较长时间后应进行镜检,如出现大量胶体金粒子凝集,说明已经过期。
1、单宁酸/柠檬酸钠法制备3~16 nm胶体金(1)取一250 ml三角瓶,加入79 ml双蒸水和1 ml 1%氯化金,预热至60~70℃。
(2)取一50 ml烧杯,加入4 ml 1%柠檬酸钠,然后根据所制备金粒子体积大小加入不同用量的单宁酸及等量的25 mM K2CO3。
预热至60~70℃。
K2CO3的作用是保持溶液的中性pH。
因此如果单宁酸的量少于0.5 ml时,对pH的影响不大,K2CO3可以省略。
(3)将上两种溶液迅速混合并充分混匀,加热至沸并保温10分钟。
自然冷却。
柠檬酸钠(ml)单宁酸( l)胶体金(nm)4 5000 34 2000 44 500 64 120 84 70 104 10 162、白磷还原法制备5 nm胶体金(1)取250 ml三角瓶一个,加79 ml双蒸水,1 ml 1%氯化金,并用0.25 M K2CO3将溶液调至中性(pH7.0)。
(2)取0.2 ml饱和磷/乙醚溶液加到1.5 ml试管中,再加0.8 ml乙醚,混匀。
取0.7 ml加入溶液(1)中(磷有毒且易燃,操作请带手套,多余的磷溶液用CuSO4进行中和)。
(3)室温下轻轻摇匀15 min,然后加热沸腾并保持5 min,自然冷却。
3、柠檬酸三钠法制备12-30 nm胶体金(Frens, 1973)(1)取250 ml三角瓶一个,加100 ml双蒸水及1 ml 1%氯化金,加热沸腾;(2)取不同量的1%柠檬酸钠加入上述溶液中。
混匀,再保持沸腾30 min,溶液颜色首先变黑,再逐渐变红,粒子体积较小时,溶液呈桔红色,而粒子体积较大时,则颜色偏向紫色。
柠檬酸钠(ml) 胶体金(nm)5 124 163 242.8 30注意:(1)由于使用试剂质量及其它方面可能存在的误差,以及制备过程中的其它问题,胶体金粒子的大小及一致性与理论值可能有偏差,因此,在制备完成后必须进行镜检。
如出现粒子体积偏差太大,粒子凝聚,粒子边缘不清晰等问题,须重新制备。
(2)胶体金溶液最好保存在4℃冰箱中;也可保存在室温下,一般可保存1-2个月。
但决不可保存在0℃以下,否则金粒子发生凝聚。
二、蛋白-金复合体的制备一般认为胶体金粒子表面为一层AuCl2,因此,粒子表面带有负电荷,这种负电荷粒子之间相互排斥,形成稳定悬浮的胶体金溶液。
金颗粒表面可以包被一层生物大分子(如蛋白)来稳定和保护这些粒子,以免受外来电解质的影响而相互凝聚在一起。
胶体金粒子对蛋白的吸附作用取决于pH值,这是因蛋白的净电荷取决于溶液的pH值,在pH=pI时为中性。
由于在pH=pI时蛋白溶解度最小,因此这时它水化程度最小,最溶液吸附到疏水的金粒子表面。
但在实际的胶体金探针制备中,一般胶体金调整为pH=PI+0.5,这样蛋白带正电,有利于结合更稳定。
胶体金探针所用蛋白必须要经过前处理,其目的在于(1)去除高浓度的盐分,高浓度的盐分往往干扰蛋白与胶体金的吸附结合,或导致胶体金粒子的凝聚,这一步往往采用低浓度缓冲液中进行。
(2)使蛋白分子尽量分散为单体,冻干蛋白或高浓度蛋白溶液中蛋白分子往往凝聚为多聚体大分子,可同时与多个胶体金粒子结合,影响标记的灵敏度和定量分析。
(3)使蛋白具有适当的分子量。
蛋白分子量过小(30 kD),形成的蛋白复合体往往是不稳定,可短时间失活。
而分子量过大时,被认为影响探针的灵敏度,特别是已知蛋白的结构与活性中心的情况下,去除对活性武影响的结构部分是提高标记灵敏度,延长探针寿命(防止凝集)的有效办法。
把分子量过小的蛋白与其它蛋白(如BSA,牛血清蛋白等)结合后,能制备出稳定性更佳的探针。
当蛋白前处理完成后,接着要确定胶体金与蛋白结合的最佳pH值。
对于理化性质不确定的蛋白这一步尤为重要。
过量的蛋白与不同pH值得胶体金结合后,只有某一特定pH 值能够形成结合最稳定的探针。
在高浓度电解质(如NaCl)作用下不会凝聚。
不同蛋白的适宜pH围的宽窄大不相同。
一般选择最小适宜pH值为最佳pH值。
但有些探针的实际情况并不完全如此,最稳定发探针并不完全代表活性最好。
这要靠实验验证。
在确定最佳pH值后,最后要确定最小蛋白量,即能够形成稳定探针的蛋白的最小量。
如果在制备探针时加入太多的蛋白,不仅造成浪费,而且更为严重的是容易造成探针凝聚,并严重影响标记活性。
因为探针溶液中的游离蛋白容易抢先与标记位点结合,起到“封闭”(Blocking)作用,而胶体金探针标记不上。
在标记位点希少、被标记物含量较少的情况下要特别注意。
这里需要特别指出的是,使用不同直径的胶体金与同一蛋白结合时,除了蛋白量完全不同外,往往最佳pH也有一定变化。
因此,在探针制备每一环节应随时监测探针对分布情况、负染结合及活性。
1、抗血清的前处理一般抗血清中IgG的含量为10-25%,而绝大部分为其它蛋白。
用抗血清直接制备探针其标记活性与特异性均不理想。
因此需去除其中多数杂蛋白。
但处理环节不宜太繁,在实验室设备与经验缺乏的情况下更是如此,否则会导致IgG活性的大幅降低。
如果你的实验室在蛋白纯化方面有很强的技术支持,高度纯化后效果会更好。
大量工作表明,只用硫酸铵沉淀就可以得到足够纯度及高活性的IgG蛋白。
其基本步骤如下:(1)取抗血清0.2 ml;(2)加生理盐水(0.85%NaCl)0.3 ml,混匀;(3)逐滴加入饱和(NH4)2SO4 0.5 ml,充分振荡混匀,4℃静置1 h;(4)10000 rpm/min离心20 min,弃上清;(5)加0.5 ml生理盐水重悬浮,混匀;(6)逐滴加0.25 ml饱和(NH4)2SO4,充分振荡混匀,4℃静置1 h;(7)10000 rpm/min离心20 min,弃上清;(8)重复5~8步骤一次;(9)加生理盐水0.5 ml重悬浮,混匀;(10)生理盐水中透析12~24 h;(11)在0.2 M pH 9.0硼酸缓冲液透析12~24 h;(12)分装,即将使用时4℃保存,备用-20℃保存。
为最大限度保持抗体活性,整个过程应在4℃下进行。
对于冻干抗血清或长时间保存的血清,将生理盐水透析改为3 M KCNS透析,促使聚合的多聚体解聚。
如果抗血清效价较低时,不宜准备胶体金探针。
2、亲和纯化抗体的处理亲和纯化抗体多是一些商品化的通用抗体,即二抗。
一般为羊抗兔、羊抗鼠或羊抗人的抗体。
这些抗体一般有两个问题,一是IgG分子往往聚集为多聚体分子,二是往往含有较多的盐分。
因此前处理的目的在于脱盐和解聚。
其基本步骤如下:(1)将亲和纯化抗体用生理盐水稀释为0.5-1 mg/ml浓度(2)在3 M KCNS(硫氰酸钾)溶液中透析12 h(3)在2 mMol pH 9.0的硼酸缓冲液中透析12 h(更换透析液数次)(4)分装备用其它蛋白可参考此方法进行。
但注意后一种透析液的pH值应与交联时pH值一致。
在实际运用中,一般省略去3M KCNS透析这一步,特别是当蛋白分子量较小,且为非糖蛋白时。
我们建议在制备通用探针(如二抗IgG,Protein A,Protein G,Streptavidin)等时,严格使用该方法,而制备直接标记探针时,也可以忽略处理步骤。
3、IgG Fab片段的制备一般来说体积较小的探针具有相对较高的标记活性。
主要原因在于胶体金颗粒较小时有利于在标记溶液中的扩散运动;在胶体金直径一定时,蛋白分子量越小,金表面吸附的蛋白分子越多,活性位点也越密集,也容易于靶位点结合。
IgG分子量为150 kD左右,由4个亚基组成,即两条重链(H)和两条轻链(L)。
用水解酶(木瓜蛋白酶)水解后可得到两种片段,即Fab和Fc。
其中Fab是具有抗原识别活性的部分,回收后制备探针。
Fc能够与Protein A和Protein G特异性结合。
但这种分离只能在有条件的实验室进行。
其基本过程如下:(1)用PBS(pH 7.0,含10 mM EDTA,20 mM盐酸半胱氨酸)溶解纯化的IgG(2)加固化木瓜蛋白酶(3)37℃处理5h(4)离心,去除固化木瓜蛋白酶(沉淀)(5)过Protein G柱(6)纯化的Fab片段按前文方法做进一步处理注:Fab与胶体金结合的pH值为6.54、蛋白与胶体金结合最佳pH测定(例纤维素酶,pI未知)(1)取若干个1.5ml试管,分别加入1 ml 10 nm胶体金;(2)用25 mM K2CO3将pH分别调为3,4,5,6,7,8,9,10;(3)取一96孔培养板,按pH从低到高分别将上述胶体金分别取100 μl加入孔中,重复三次;(4)每孔分别加入3 μl浓度为1 mg/ml的纤维素酶,混合,室温下放置10-15 min;(5)每孔分别加入20 μl浓度为10%NaCl溶液,混合,室温下放置10 min;(6)观察胶体金颜色变化,记录保持红色的最低pH(X);(7)重复(1)-(5)步,pH梯度为X-0.6;X-0.3;X;X+0.3;X+0.6;X+1。
